Règlement sur les aliments et drogues (C.R.C., ch. 870)
Texte complet :
- HTMLTexte complet : Règlement sur les aliments et drogues (Boutons d’accessibilité disponibles) |
- XMLTexte complet : Règlement sur les aliments et drogues [4950 KB] |
- PDFTexte complet : Règlement sur les aliments et drogues [13030 KB]
Règlement à jour 2024-11-26; dernière modification 2024-06-17 Versions antérieures
Règlement sur les aliments et drogues
C.R.C., ch. 870
LOI SUR LES ALIMENTS ET DROGUES
Règlement concernant les aliments et drogues
PARTIE AAdministration
Dispositions générales
A.01.001 Le présent règlement peut être cité sous le titre : Règlement sur les aliments et drogues.
A.01.002 Lorsqu’il y a lieu, les dispositions du présent règlement établissent les normes de composition, de concentration, d’activité, de pureté, de qualité ou autre propriété de la substance alimentaire ou de la drogue, auxquelles elles se rapportent.
A.01.003 [Abrogé, DORS/94-289, art. 1]
Interprétation
A.01.010 Dans le présent règlement,
- centimètre cube
centimètre cube ou son abréviation cc. sont censées interchangeables avec le mot millilitre et son abréviation ml.; (cubic centimetre)
- conjoint de fait
conjoint de fait S’entend au sens de l’article 2 du Code criminel; (common-law partner)
- Directeur
Directeur[Abrogée, DORS/2018-69, art. 1]
- drogue sur ordonnance
drogue sur ordonnance Drogue figurant sur la Liste des drogues sur ordonnance, avec ses modifications successives, ou faisant partie d’une catégorie de drogues figurant sur cette liste; (prescription drug)
- emballage de sécurité
emballage de sécurité désigne un emballage doté d’un dispositif de sûreté qui offre au consommateur une assurance raisonnable que l’emballage n’a pas été ouvert avant l’achat; (security package)
- espace principal
espace principal S’entend au sens du Règlement sur l’emballage et l’étiquetage des produits de consommation; (principal display panel)
- étiquette extérieure
étiquette extérieure désigne l’étiquette sur l’extérieur d’un emballage d’aliment ou de drogue, ou y apposée; (outer label)
- étiquette intérieure
étiquette intérieure désigne l’étiquette sur le récipient immédiat d’un aliment ou d’une drogue, ou y apposée; (inner label)
- fabricant
fabricant[Abrogée, DORS/97-12, art. 1]
- fabricant
fabricant ou distributeur Toute personne, y compris une association ou une société de personnes, qui, sous son propre nom ou sous une marque de commerce, un dessin-marque, un logo, un nom commercial ou un autre nom, dessin ou marque soumis à son contrôle, vend un aliment ou une drogue; (manufacturer ou distributor)
- Liste des drogues sur ordonnance
Liste des drogues sur ordonnance Liste établie par le ministre en vertu de l’article 29.1 de la Loi; (Prescription Drug List)
- Loi
Loi Sauf pour l’application des parties G et J, la Loi sur les aliments et drogues; (Act)
- méthode acceptable
méthode acceptable Méthode d’analyse ou d’examen désignée par le ministre comme étant acceptable aux fins de l’application de la Loi et du présent règlement; (acceptable method)
- méthode officielle
méthode officielle signifie une méthode d’analyse ou d’examen désignée comme telle par le ministre pour usage dans l’application de la Loi et du présent règlement; (official method)
- numéro de lot
numéro de lot désigne toute combinaison de lettres, de chiffres ou de lettres et de chiffres au moyen de laquelle tout aliment ou une drogue peut être retracé au cours de la fabrication et identifié au cours de la distribution. (Lot number)
- DORS/84-300, art. 1(F)
- DORS/85-141, art. 1
- DORS/89-455, art. 1
- DORS/97-12, art. 1
- DORS/2000-353, art. 1
- DORS/2001-272, art. 5
- DORS/2003-135, art. 1
- DORS/2013-122, art. 1
- DORS/2018-69, art. 1 et 27
- DORS/2022-197, art. 1
A.01.011 Le ministre doit, sur demande, fournir des exemplaires des méthodes officielles.
- DORS/2018-69, art. 27
A.01.012 Le ministre doit, sur demande, indiquer si une méthode est acceptable ou non, lorsqu’on la lui présente en vue d’une décision.
- DORS/2018-69, art. 27
A.01.013 Dans le présent règlement, la mention propre ou usuelle d’un aliment, d’une drogue ou d’une vitamine sous un de ses noms, renvoie à tous ses noms.
A.01.014 Quand, suivant le présent règlement, un numéro de lot doit paraître sur tout article, récipient, emballage ou étiquette, ce numéro doit être précédé de l’une des désignations suivantes :
a) « Numéro du Lot »;
b) « Lot no »;
c) « Lot »; ou
d) « (L) ».
A.01.015 (1) Sous réserve du paragraphe (2), toute mention, tout renseignement ou toute déclaration dont le présent règlement exige l’indication sur l’étiquette d’une drogue doit être soit en anglais soit en français, en plus de toute autre langue.
(2) Lorsqu’en vertu du sous-alinéa C.01.004(1)c)(iii), un mode d’emploi doit figurer sur les étiquettes intérieure et extérieure d’une drogue, ce mode d’emploi doit être en anglais et en français si cette drogue est disponible à la vente sans ordonnance à un point de vente libre-service.
- DORS/85-140, art. 1
A.01.016 Tout renseignement qui, aux termes du présent règlement, doit figurer sur l’étiquette d’un aliment ou d’une drogue autre qu’une drogue pour usage humain sous forme posologique doit :
a) être clairement présenté et placé bien en vue;
b) être facile à apercevoir, pour l’acheteur ou le consommateur, dans les conditions ordinaires d’achat et d’usage.
- DORS/2014-158, art. 1
- DORS/2022-143, art. 1(F)
A.01.017 Toute étiquette d’une drogue pour usage humain sous forme posologique remplit les conditions suivantes :
a) les renseignements qui, aux termes du présent règlement, doivent y figurer sont :
(i) placés bien en vue,
(ii) faciles à apercevoir, pour l’acheteur ou le consommateur, dans les conditions ordinaires d’achat et d’usage,
(iii) formulés en langage clair;
b) son format, notamment la façon dont le texte et tout élément graphique sont présentés, ne doit pas nuire à la compréhension des renseignements visés à l’alinéa a).
- DORS/2014-158, art. 2
Analystes; inspecteurs
A.01.020 et A.01.021 [Abrogés, DORS/81-935, art. 1]
A.01.022 Les devoirs et fonctions des inspecteurs s’exercent au titre des aliments et drogues visés par la Loi et le présent règlement.
A.01.023 Les attributions d’un inspecteur s’étendent à tout le Canada.
A.01.024 Le certificat visé au paragraphe 22(2) de la Loi doit :
a) établir que la personne qui y est nommée est un inspecteur pour les fins de la Loi; et
b) être signé par
(i) le ministre et la personne nommée au certificat, dans le cas d’un inspecteur du ministère.
(ii) [Abrogé, DORS/2000-184, art. 60]
- DORS/80-500, art. 1
- DORS/92-626, art. 1
- DORS/95-548, art. 5
- DORS/2000-184, art. 60
- DORS/2018-69, art. 27
A.01.025 Lorsque les règlements d’exécution de la Loi sur la radiodiffusion les y autorisent, les inspecteurs doivent agir en qualité de représentants du Conseil de la radiodiffusion et des télécommunications canadiennes aux fins d’appliquer les règlements édictés par le Conseil de la radiodiffusion et des télécommunications canadiennes, relativement à la publicité de tout article qui tombe sous le coup de la Loi sur les aliments et drogues, ou relativement à toute recommandation quant à la prévention, au traitement ou à la guérison d’une maladie ou affection.
A.01.026 Un inspecteur peut, pour l’application de la Loi ou du présent règlement, prendre des photographies
a) de tout article visé au paragraphe 23(2) de la Loi;
b) de tout lieu où il a des motifs raisonnables de croire qu’un article visé à l’alinéa a) y est fabriqué, préparé, conservé, empaqueté ou emmagasiné; et
c) de toute chose lorsqu’il a des motifs raisonnables de croire, qu’elle sert ou peut servir à la fabrication, la préparation, la conservation, l’empaquetage ou l’emmagasinage d’un article visé à l’alinéa a).
- DORS/90-814, art. 1
Importations
A.01.040 Sous réserve de l’article A.01.044, il est interdit d’importer pour la vente des aliments ou des drogues dont la vente au Canada enfreindrait la Loi ou le présent règlement.
- DORS/92-626, art. 2(F)
A.01.041 L’inspecteur peut examiner et prélever des échantillons de tout aliment ou drogue destinés à être importés au Canada.
A.01.042 L’inspecteur peut référer à un analyste, pour examen, les échantillons des aliments ou drogues examinés ou prélevés en vertu de l’article A.01.041.
- DORS/2017-18, art. 1(A)
A.01.043 L’inspecteur qui estime, après examen d’un échantillon de l’aliment ou de la drogue ou réception du rapport de l’analyste, que la vente de l’aliment ou de la drogue au Canada serait contraire à la Loi ou au présent règlement en avise par écrit le percepteur des douanes ainsi que l’importateur.
- DORS/84-300, art. 2(A)
- DORS/2017-18, art. 2
A.01.044 (1) Quiconque cherche à importer pour la vente un aliment ou une drogue dont la vente enfreindrait la Loi ou le présent règlement peut, dans les cas où un nouvel étiquetage ou une modification rendrait cette vente au Canada conforme à la Loi et au présent règlement, importer cet aliment ou cette drogue pour la vente aux conditions suivantes :
a) l’importateur avise l’inspecteur de l’importation proposée;
b) les aliments ou les drogues font l’objet d’un nouvel étiquetage ou d’une modification propre à rendre légale leur vente au Canada.
(2) Il est interdit de vendre un aliment ou une drogue importé au Canada en vertu du paragraphe (1), à moins qu’il n’ait fait l’objet d’un nouvel étiquetage ou d’une modification dans les trois mois suivant la date de l’importation ou dans le délai plus long fixé :
a) par le ministre, s’il s’agit d’une drogue;
b) par le ministre ou le président de l’Agence canadienne d’inspection des aliments, s’il s’agit d’un aliment.
- DORS/92-626, art. 3
- DORS/95-548, art. 5
- DORS/2000-184, art. 61
- DORS/2000-317, art. 18
- DORS/2018-69, art. 27
Exportation
A.01.045 Le certificat visé à l’article 37 de la Loi doit revêtir la forme prévue à l’appendice III et être délivré et signé par l’exportateur.
- DORS/80-318, art. 1
- DORS/90-814, art. 2
A.01.046 L’exportateur qui délivre le certificat visé à l’alinéa 37(1)c) de la Loi à l’égard d’une drogue en conserve une copie pendant cinq ans après la date à laquelle cette drogue est exportée.
A.01.047 (1) Pour l’application de l’alinéa 37(1)d) de la Loi, la drogue qui, aux termes de l’alinéa A.01.048a), doit être manufacturée, emballée-étiquetée, analysée, distribuée ou vendue en gros conformément à une licence d’établissement doit l’être par le titulaire de cette licence qui s’est acquitté du prix à payer relativement à celle-ci conformément à l’Arrêté sur les prix à payer à l’égard des drogues et instruments médicaux.
(2) Les termes du présent article s’entendent au sens du paragraphe C.01A.001(1).
A.01.048 Pour l’application du paragraphe 37(1.2) de la Loi, les dispositions ci-après s’appliquent concernant les drogues :
a) les dispositions du titre 1A de la partie C;
b) les dispositions du titre 2 de la partie C, à l’exception de l’article C.02.003.2 et des alinéas C.02.009(5)b), C.02.016(3)b) et C.02.018(3)c);
c) les articles C.03.001 à C.03.013;
d) les dispositions du titre 4 de la partie C, à l’exception des dispositions suivantes :
(i) les articles C.04.003, C.04.019, C.04.020, C.04.054, C.04.055, C.04.080, C.04.082 à C.04.085 et C.04.091,
(ii) les articles C.04.101 et C.04.102, l’alinéa C.04.117c), les articles C.04.118 à C.04.120, C.04.126 et C.04.127, l’alinéa C.04.128a) et les articles C.04.137, C.04.138, C.04.146, C.04.147, C.04.169, C.04.170, C.04.187 et C.04.190,
(iii) les articles C.04.218 à C.04.220 et C.04.239 à C.04.241,
(iv) les articles C.04.555, C.04.556, C.04.561, C.04.562, C.04.567, C.04.568, C.04.573, C.04.574, C.04.578, C.04.580, C.04.581, C.04.588, C.04.589, C.04.593, C.04.595 et C.04.596,
(v) les articles C.04.601, C.04.602, C.04.650 à C.04.656, C.04.676, C.04.677 et C.04.680 à C.04.683.
Transbordements
A.01.049 Pour l’application de l’alinéa 38c) de la Loi, toute drogue doit être en douane.
Échantillons
A.01.050 L’inspecteur qui prélève un échantillon d’un article en vertu de l’alinéa 23(2)i) de la Loi avise le propriétaire de l’article ou la personne de qui il a obtenu l’échantillon de son intention de soumettre tout ou partie de l’échantillon à un analyste pour analyse ou examen, et :
a) lorsque, de l’avis de l’inspecteur, la division de la quantité obtenue ne nuirait pas à l’examen ou à l’analyse, il doit
(i) diviser la quantité prélevée en trois parties,
(ii) identifier les trois parties comme la partie du propriétaire, l’échantillon et le double de l’échantillon, et si une partie seulement porte l’étiquette, cette partie doit constituer l’échantillon,
(iii) sceller chaque partie de manière qu’elle ne puisse être ouverte sans briser le sceau, et
(iv) remettre la partie identifiée comme la partie du propriétaire, au propriétaire ou à la personne chez qui l’échantillon a été prélevé et envoyer l’échantillon ainsi que le double à un analyste pour l’examen ou analyse; ou
b) lorsque, de l’avis de l’inspecteur, la division de la quantité prélevée nuirait à l’analyse ou à l’examen, il doit
(i) identifier la quantité entière de l’échantillon,
(ii) sceller l’échantillon de manière qu’il ne puisse être ouvert sans briser le sceau, et
(iii) envoyer l`échantillon à un analyste pour analyse ou examen.
- DORS/90-814, art. 3
- DORS/2021-46, art. 1
A.01.051 Lorsque le propriétaire ou la personne chez qui l’échantillon est prélevé s’oppose à la méthode suivie par un inspecteur en vertu de l’article A.01.050 au moment où l’échantillon est prélevé, l’inspecteur doit suivre les deux méthodes énoncées dans ledit article si le propriétaire ou la personne chez qui l’échantillon a été prélevé lui fournit une quantité suffisante de l’objet en cause.
Honoraires d’analyse
A.01.060 Les honoraires d’analyse de tout échantillon, autrement qu’aux fins de la présente Loi ou pour le compte d’un autre ministère du gouvernement du Canada aux fins de poursuites judiciaires, sont de 15 $.
Étiquetage des contenants d’aliments et de drogues sous pression
A.01.060.1 Les définitions qui suivent s’appliquent aux articles A.01.061 et A.01.062.
- espace principal
espace principal[Abrogée, DORS/2000-353, art. 2]
- projection de la flamme
projection de la flamme Détermination de la longueur du jet enflammé du contenu sous pression expulsé d’un contenant aérosol lorsque celui-ci est soumis à un essai selon la méthode officielle DO-30, intitulée Détermination de la projection de la flamme, en date du 15 octobre 1981. (flame projection)
- retour de flamme
retour de flamme Partie de la projection de la flamme qui va du point d’inflammation jusqu’au contenant aérosol lorsque celui-ci est soumis à un essai selon la méthode officielle DO-30, intitulée Détermination de la projection de la flamme, en date du 15 octobre 1981. (flashback)
- DORS/92-15, art. 1
- DORS/2000-353, art. 2
- DORS/2001-272, art. 6
A.01.061 (1) Sous réserve de l’article A.01.063, l’étiquette intérieure et l’étiquette extérieure d’un aliment ou d’une drogue emballés dans un contenant métallique non réutilisable, conçu pour permettre de libérer le contenu sous pression au moyen d’une valve actionnée à la main et faisant partie intégrante du contenant, doivent porter dans leur espace principal, conformément aux articles 15 à 18 du Règlement sur les produits chimiques et contenants destinés aux consommateurs, dans sa version en vigueur le 30 septembre 2001 :
a) le signal de danger figurant à la colonne II de l’article 10 de l’annexe II de ce règlement et le mot indicateur « ATTENTION / CAUTION »;
b) la mention de danger principale suivante : « CE CONTENANT PEUT EXPLOSER S’IL EST CHAUFFÉ. / CONTAINER MAY EXPLODE IF HEATED. ».
(2) Sous réserve de l’article A.01.063, l’étiquette intérieure et l’étiquette extérieure d’un aliment ou d’une drogue visés au paragraphe (1) doivent porter dans un espace quelconque, selon les dimensions prévues à l’alinéa 19(1)b) du Règlement sur les produits chimiques et contenants destinés aux consommateurs, dans sa version en vigueur le 30 septembre 2001, la mention de danger additionnelle suivante :
« Contenu sous pression. Ne pas mettre dans l’eau chaude ni près des radiateurs, poêles ou autres sources de chaleur. Ne pas percer le contenant, ni le jeter au feu, ni le conserver à des températures dépassant 50 °C.
Contents under pressure. Do not place in hot water or near radiators, stoves or other sources of heat. Do not puncture or incinerate container or store at temperatures over 50°C. »
(3) Les exigences des paragraphes (1) et (2) ne s’appliquent pas à l’égard d’une drogue ou d’un aliment si le ministre conclut que la conception du contenant, les matériaux utilisés pour la fabrication de ce dernier ou la présence d’un dispositif de sécurité éliminent le danger éventuel que présente le contenant.
- DORS/81-616, art. 1
- DORS/85-1023, art. 1
- DORS/92-15, art. 2
- DORS/2001-272, art. 7
- DORS/2018-69, art. 2
A.01.062 (1) Sous réserve de l’article A.01.063, l’étiquette intérieure et l’étiquette extérieure d’un aliment ou d’une drogue qui est emballé dans un contenant visé au paragraphe A.01.061(1) et qui présente une projection de la flamme d’une longueur visée à la colonne I de l’un des articles 1 à 3 du tableau du présent paragraphe ou un retour de flamme indiqué à la colonne I de l’article 4 de ce tableau, déterminés selon la méthode officielle DO-30, intitulée Détermination de la projection de la flamme, en date du 15 octobre 1981, doivent porter dans leur espace principal, conformément aux articles 15 à 18 du Règlement sur les produits chimiques et contenants destinés aux consommateurs, dans sa version en vigueur le 30 septembre 2001 :
a) le signal de danger correspondant qui figure à la colonne II;
b) dans les deux langues officielles, le mot indicateur correspondant qui est précisé à la colonne III;
c) dans les deux langues officielles, la mention de danger principale correspondante qui est prévue à la colonne IV.
CE GRAPHIQUE N’EST PAS EXPOSÉ, VOIR DORS/81-616, ART. 2; DORS/92-15, ART. 3
(2) En plus des exigences énoncées au paragraphe (1), l’étiquette intérieure et l’étiquette extérieure d’un aliment ou d’une drogue visés à ce paragraphe doivent porter dans un espace quelconque, selon les dimensions prévues à l’alinéa 19(1)b) du Règlement sur les produits chimiques et contenants destinés aux consommateurs, dans sa version en vigueur le 30 septembre 2001, la mention de danger additionnelle suivante :
« Ne pas utiliser en présence d’une flamme nue ou d’étincelles.
Do not use in presence of open flame or spark. »
- DORS/81-616, art. 2
- DORS/82-429, art. 1
- DORS/85-1023, art. 2
- DORS/92-15, art. 3
- DORS/2001-272, art. 8
A.01.063 (1) Lorsque le contenu net étiqueté d’un contenant d’un aliment ou d’une drogue visés aux paragraphes A.01.061(1) ou A.01.062(1) ne dépasse pas 60 millilitres ou 60 grammes, l’étiquette intérieure peut ne porter que les renseignements exigés à l’alinéa A.01.061(1)a) ou aux alinéas A.01.062(1)a) et b), selon le cas.
(2) Lorsque le contenu net étiqueté d’un contenant d’un aliment ou d’une drogue visés aux paragraphes A.01.061(1) ou A.01.062(1) est supérieur à 60 millilitres ou 60 grammes mais ne dépasse pas 120 millilitres ou 120 grammes, l’étiquette intérieure peut ne porter que les renseignements exigés aux paragraphes A.01.061(1) ou A.01.062(1), selon le cas.
(3) Lorsque la quantité nette figurant sur l’étiquette d’un contenant d’un aliment ou d’une drogue visés aux paragraphes A.01.061(1) ou A.01.062(1) est inférieure à 30 mL ou à 30 g, le signal de danger doit être d’une taille telle qu’il peut être circonscrit par un cercle ayant un diamètre d’au moins 6 mm.
(4) Lorsqu’un contenant d’un aliment ou d’une drogue décrit aux paragraphes (1) ou (2) est vendu dans un emballage, l’étiquette extérieure peut ne porter que les renseignements exigés au paragraphe A.01.061(2) et, s’il y a lieu, au paragraphe A.01.062(2).
- DORS/81-616, art. 2
- DORS/92-15, art. 4
A.01.064 [Abrogé, DORS/93-243, art. 2]
Emballage de sécurité
A.01.065 (1) Pour l’application du présent article, drogue pour usage humain s’entend d’une drogue destinée à la consommation humaine, qu’elle soit sous forme de :
a) rince-bouche;
b) drogue pour usage par inhalation, ingestion ou insertion;
c) drogue pour usage ophtalmique.
(2) Sous réserve du paragraphe (3), il est interdit de vendre ou d’importer une drogue pour usage humain qui est emballée et qui est offerte à un point de vente libre-service accessible au public, à moins qu’elle ne soit contenue dans un emballage de sécurité.
(3) Le paragraphe (2) ne s’applique pas aux pastilles.
(4) Sous réserve du paragraphe (5), une mention ou une illustration qui attire l’attention sur le dispositif de sûreté de l’emballage visé au paragraphe (2) doit figurer :
a) d’une part, sur l’étiquette intérieure de l’emballage;
b) d’autre part, sur l’étiquette extérieure de l’emballage si le dispositif fait partie de l’emballage extérieur.
(5) Le paragraphe (4) ne s’applique pas dans le cas où le dispositif est évident et fait partie intégrante du récipient immédiat de la drogue.
- DORS/85-141, art. 2
- DORS/88-323, art. 1
- DORS/92-664, art. 1
Exemptions
Application
A.01.066 Les articles A.01.067 et A.01.068 ne s’appliquent pas aux drogues suivantes :
a) toute drogue qui est inscrite aux annexes I, II, III, IV ou V de la Loi réglementant certaines drogues et autres substances;
b) toute drogue sur ordonnance.
- DORS/2007-288, art. 1
- DORS/2013-122, art. 2
Publicité
A.01.067 Est exemptée de l’application du paragraphe 3(1) de la Loi toute drogue dont la publicité est faite, auprès du grand public, à titre de mesure préventive — mais non à titre de traitement ou de moyen de guérison — d’une maladie, d’un désordre ou d’un état physique anormal énuméré à l’annexe A.1 de la Loi.
- DORS/2007-288, art. 1
- DORS/2021-46, art. 10
Vente
A.01.068 Est exemptée de l’application du paragraphe 3(2) de la Loi, en ce qui concerne sa vente par une personne, à titre de mesure préventive — mais non à titre de traitement ou de moyen de guérison — d’une maladie, d’un désordre ou d’un état physique anormal énuméré à l’annexe A.1 de la Loi, toute drogue qui est représentée par une étiquette ou dont la publicité auprès du grand public est faite par la personne en cause.
- DORS/2007-288, art. 1
- DORS/2021-46, art. 10
PARTIE BAliments
TITRE 1
Dispositions générales
B.01.001 (1) Dans la présente partie,
- acides gras monoinsaturés
acides gras monoinsaturés, graisses monoinsaturées, gras monoinsaturés, lipides monoinsaturés ou monoinsaturés Acides gras cis-monoinsaturés; (monounsaturated fatty acids, monounsaturated fat, monounsaturates or monounsaturated)
- acides gras polyinsaturés
acides gras polyinsaturés, graisses polyinsaturées, gras polyinsaturés, lipides polyinsaturés ou polyinsaturés Acides gras polyinsaturés à interruption cis-méthylénique; (polyunsaturated fatty acids, polyunsaturated fat, polyunsaturates or polyunsaturated)
- acides gras polyinsaturés oméga-3
acides gras polyinsaturés oméga-3, graisses polyinsaturées oméga-3, gras polyinsaturés oméga-3, lipides polyinsaturés oméga-3, polyinsaturés oméga-3 ou oméga-3 Selon le cas :
a) acide 9-cis, 12-cis, 15-cis octadécatriénoïque ou acide α-linolénique;
b) acide 8-cis, 11-cis, 14-cis, 17-cis éicosatétraénoïque;
c) acide 5-cis, 8-cis, 11-cis, 14-cis, 17-cis éicosapentaénoïque ou AEP;
d) acide 7-cis, 10-cis, 13-cis, 16-cis, 19-cis docosapentaénoïque;
e) acide 4-cis, 7-cis, 10-cis, 13-cis, 16-cis, 19-cis docosahexaénoïque ou ADH; (omega-3 polyunsaturated fatty acids, omega-3 polyunsaturated fat, omega-3 polyunsaturates, omega-3 polyunsaturated or omega-3)
- acides gras polyinsaturés oméga-6
acides gras polyinsaturés oméga-6, graisses polyinsaturées oméga-6, gras polyinsaturés oméga-6, lipides polyinsaturés oméga-6, polyinsaturés oméga-6 ou oméga-6 Selon le cas :
a) acide 9-cis, 12-cis octadécadiénoïque ou acide linoléique;
b) acide 6-cis, 9-cis, 12-cis octadécatriénoïque;
c) acide 8-cis, 11-cis, 14-cis éicosatriénoïque ou acide di-homo-γ-linolénique;
d) acide 5-cis, 8-cis, 11-cis, 14-cis éicosatétraénoïque ou acide arachidonique;
e) acide 7-cis, 10-cis, 13-cis, 16-cis docosatétraénoïque;
f) acide 4-cis, 7-cis, 10-cis, 13-cis, 16-cis docosapentaénoïque; (omega-6 polyunsaturated fatty acids, omega-6 polyunsaturated fat, omega-6 polyunsaturates, omega-6 polyunsaturated or omega-6)
- acides gras saturés
acides gras saturés, graisses saturées, gras saturés, lipides saturés ou saturés Acides gras ne contenant aucune liaison double; (saturated fatty acids, saturated fat, saturatesorsaturated)
- acides gras trans
acides gras trans, graisses trans, gras trans, lipides trans ou trans Acides gras insaturés qui contiennent une ou plusieurs liaisons doubles isolées ou non conjuguées de configuration trans; (trans fatty acids, trans fatortrans )
- additif alimentaire
additif alimentaire s’entend de toute substance dont l’emploi est tel ou peut vraisemblablement être tel que cette substance ou ses sous-produits sont intégrés à un aliment ou en modifient les caractéristiques, à l’exclusion de ce qui suit :
a) toute substance nutritive qui est employée, reconnue ou vendue couramment comme substance alimentaire ou comme ingrédient d’un aliment,
b) vitamines, minéraux nutritifs et acides aminés, autres que ceux qui sont énumérés aux tableaux du Titre 16,
b.1) ingrédients supplémentaires,
c) épices, assaisonnements, préparations aromatisantes, essences, oléorésines et extraits naturels,
d) produits chimiques agricoles autres que ceux visés aux tableaux du titre 16,
e) matériaux d’emballage des aliments ou toute substance qui entre dans leur composition, et
f) produits pharmaceutiques recommandés pour les animaux dont la chair peut être consommée par l’homme; (food additive)
- agent édulcorant
agent édulcorant Vise notamment tout aliment qui fait l’objet d’une norme énoncée dans le titre 18, mais non les additifs alimentaires visés aux tableaux du titre 16; (sweetening agent)
- agent gélatinisant
agent gélatinisant désigne la gélatine, l’agar-agar et la carragénine; (gelling agent)
- aliment non normalisé
aliment non normalisé désigne tout aliment pour lequel la présente partie ne prescrit pas de norme; (unstandardized food)
- aliment supplémenté
aliment supplémenté Produit préemballé qui appartient à une catégorie d’aliments figurant à la colonne 1 de la Liste des catégories autorisées d’aliments supplémentés et auquel a été ajouté un ingrédient supplémentaire, à l’exclusion des aliments suivants :
a) les aliments à usage diététique spécial au sens de l’article B.24.001 qui sont visés à l’un ou l’autre des alinéas B.24.003(1)f) à f.2) et h) à j), même s’ils sont également des aliments sans gluten visés à l’alinéa B.24.003(1)g);
b) les aliments étiquetés ou annoncés comme pouvant être consommés par :
(i) des bébés au sens de l’article B.25.001,
(ii) des enfants âgés d’au moins un an mais de moins de quatre ans,
(iii) des femmes enceintes ou qui allaitent;
c) les aliments ci-après qui figurent à la colonne I du tableau de l’article D.03.002 :
(i) ceux qui figurent à l’un des articles 1, 2.1, 2.2, 4, 5, 7, 8, 9.1, 10 à 13, 15, 17 à 19, 21 à 25 et 27,
(ii) la glace préemballée;
d) les aliments qui n’ont pas été transformés ou qui l’ont minimalement été;
e) les boissons dont la teneur en alcool est de plus de 0,5 %; (supplemented food)
- allongeur de produit de viande
allongeur de produit de viande désigne un aliment qui est source de protéines et qui est présenté comme devant servir à augmenter le volume de produits de viande; (meat product extender)
- allongeur de produit de volaille
allongeur de produit de volaille désigne un aliment qui est source de protéines et qui est présenté comme devant servir à augmenter le volume de produits de volaille; (poultry product extender)
- apport nutritionnel recommandé pondéré
apport nutritionnel recommandé pondéré Relativement à une vitamine ou à un minéral nutritif figurant à la colonne I du tableau II du titre 1 de la partie D ou à la colonne I du tableau II du titre 2 de cette partie, la quantité indiquée dans la colonne III; (weighted recommended nutrient intake)
- apport quotidien recommandé
apport quotidien recommandé[Abrogée, DORS/2016-305, art. 1]
- à proximité
à proximité À l’égard d’un renseignement figurant sur une étiquette ou un écriteau, qui est situé immédiatement à côté de celui-ci, sans texte imprimé ou écrit ni signe graphique intercalé; (close proximity)
- autorisation de mise en marché
autorisation de mise en marché Autorisation de mise en marché délivrée par le ministre en vertu du paragraphe 30.3(1) de la Loi; (marketing authorization)
- boeuf attendri mécaniquement
boeuf attendri mécaniquement Boeuf coupé solide non cuit conditionné de l’une des façons suivantes :
a) sa surface est affaiblie du fait qu’elle est perforée par des lames, des aiguilles ou tout autre instrument similaire;
b) une marinade ou toute autre solution attendrissante y est injectée; (mechanically tenderized beef)
- colorant alimentaire
colorant alimentaire Tout colorant visé à l’article 2 de l’Autorisation de mise en marché d’additifs alimentaires comme colorants. (food colour)
- constituant
constituant désigne une unité alimentaire alliée, en tant qu’élément alimentaire individuel, à une ou plusieurs autres unités alimentaires pour former un ingrédient; (component)
- date limite de conservation
date limite de conservation désigne la date où la durée de conservation d’un produit préemballé prend fin; (durable life date)
- document sur les noms usuels d’ingrédients et de constituants
document sur les noms usuels d’ingrédients et de constituants Le document intitulé Noms usuels d’ingrédients et de constituants, préparé par l’Agence canadienne d’inspection des aliments et publié sur son site Web, avec ses modifications successives; (Common Names for Ingredients and Components Document)
- durée de conservation
durée de conservation désigne la période, commençant le jour de l’emballage pour la vente au détail, pendant laquelle un produit préemballé qui est en stockage dans des conditions qui conviennent audit produit, retiendra, sans détérioration appréciable, la nature saine, le caractère agréable au goût et la valeur nutritive que possède ordinairement ce produit, ainsi que toute autre qualité revendiquée par le fabricant; (durable life)
- édulcorant
édulcorant Tout édulcorant visé à l’article 2 de l’Autorisation de mise en marché d’additifs alimentaires comme édulcorants; (sweetener)
- emballage décoratif
emballage décoratif désigne un emballage sur lequel ne figure, sauf sur le dessous, aucune indication promotionnelle ou publicitaire autre qu’une marque de commerce ou un nom usuel et qui, à cause d’un dessin figurant sur sa surface ou à cause de sa forme ou de son apparence, semble être décoratif et est vendu à titre d’objet décoratif en plus d’être vendu comme emballage du produit; (ornamental container)
- entièrement hydrogénée
entièrement hydrogénée se dit d’une graisse ou d’une huile qui est hydrogénée et dont l’indice d’iode est d’au plus 4; (fully hydrogenated)
- espace principal
espace principal Malgré la définition de ce terme à l’article A.01.010, vise :
a) dans le cas d’une étiquette apposée sur un aliment de consommation préemballé, au sens de l’article 1 du Règlement sur la salubrité des aliments au Canada, l’espace principal visé à l’un des alinéas a) à c) de la définition de ce terme à cet article;
b) dans le cas d’une étiquette apposée sur un produit préemballé autre qu’un aliment de consommation préemballé visé par le Règlement sur la salubrité des aliments au Canada, la portion de l’étiquette apposée sur tout ou partie de la face ou de la surface de l’emballage qui est exposée ou visible dans les conditions normales ou habituelles de vente ou d’utilisation, et dans les cas où l’emballage ne possède pas une telle face ou surface, la portion de l’étiquette apposée sur toute partie de l’emballage, à l’exclusion du dessous de l’emballage, le cas échéant;
c) dans le cas d’une étiquette apposée sur un aliment qui n’est pas un produit préemballé, la portion de l’étiquette apposée sur tout ou partie de la face ou de la surface de l’aliment qui est exposée ou visible dans les conditions normales ou habituelles de vente ou d’utilisation. (principal display panel)
- identifiant des aliments supplémentés avec mise en garde
identifiant des aliments supplémentés avec mise en garde S’entend de l’identifiant que porte l’espace principal d’un aliment supplémenté en application du paragraphe B.29.021(1); (supplemented food caution identifier)
- ingrédient
ingrédient désigne une unité alimentaire alliée, en tant qu’élément alimentaire, à une ou plusieurs autres unités alimentaires pour former une denrée alimentaire intégrale vendue comme produit préemballé; (ingredient)
- ingrédient à base de sucres
ingrédient à base de sucres À l’égard d’un produit préemballé :
a) l’ingrédient qui est un monosaccharide ou un disaccharide, ou une combinaison de ceux-ci;
b) l’ingrédient qui est un agent édulcorant autre que ceux visés à l’alinéa a);
c) tout autre ingrédient qui contient un ou plusieurs sucres et qui est ajouté au produit comme substitut fonctionnel d’un agent édulcorant; (sugars-based ingredient)
- ingrédient supplémentaire
ingrédient supplémentaire S’entend d’un élément nutritif, notamment d’une vitamine, d’un minéral nutritif ou d’un acide aminé, ou de toute autre substance qui figure à la colonne 1 de la Liste des ingrédients supplémentaires autorisés et qui est ajouté à titre d’ingrédient à un aliment conformément aux conditions d’utilisation applicables prévues aux colonnes 2 à 5; (supplemental ingredient)
- Liste de contaminants et d’autres substances adultérantes dans les aliments
Liste de contaminants et d’autres substances adultérantes dans les aliments La Liste de contaminants et d’autres substances adultérantes dans les aliments, publiée par le ministère de la Santé sur son site Web, avec ses modifications successives; (List of Contaminants and Other Adulterating Substances in Foods)
- Liste des catégories autorisées d’aliments supplémentés
Liste des catégories autorisées d’aliments supplémentés Le document intitulé Liste des catégories autorisées d’aliments supplémentés, publié par le gouvernement du Canada sur son site Web, avec ses modifications successives; (List of Permitted Supplemented Food Categories)
- Liste des ingrédients supplémentaires autorisés
Liste des ingrédients supplémentaires autorisés Le document intitulé Liste des ingrédients supplémentaires autorisés, publié par le gouvernement du Canada sur son site Web, avec ses modifications successives; (List of Permitted Supplemental Ingredients)
- liste des mises en garde
liste des mises en garde Liste qui figure sur l’étiquette d’un aliment supplémenté conformément au paragraphe B.29.020(1); (list of cautionary statements)
- nom usuel
nom usuel, en ce qui a trait à un aliment, désigne
a) le nom de l’aliment imprimé en caractères gras mais non italiques dans une disposition du présent règlement,
b) le nom prescrit par un autre règlement, ou
c) si le nom de l’aliment n’est pas ainsi imprimé ou prescrit, le nom sous lequel l’aliment est généralement connu ou un nom qui n’est pas générique et qui le décrit; (common name)
- norme de référence
norme de référence[Abrogée, DORS/2016-305, art. 1]
- oeuf à jaune substitué
oeuf à jaune substitué désigne un aliment qui
a) ne contient pas de jaune d’oeuf mais qui contient de l’albumen d’oeuf liquide, en poudre ou congelé ou un mélange de ces trois formes,
b) est destiné à servir de substitut à l’oeuf entier, et
c) est conforme aux exigences de l’article B.22.032; (yolk-replaced egg)
- parties par million
parties par million[Abrogée, DORS/2010-94, art. 1]
- parties par million
parties par million ou p.p.m. S’entend de parties par million en poids, à moins d’indication contraire; (parts per million or p.p.m.)
- plat principal
plat principal plat composé selon le Tableau des quantités de référence qui ne requiert pas l’ajout d’ingrédients lors de sa préparation, à l’exception de l’eau, et qui contient des aliments d’au moins deux catégories parmi les suivantes :
a) les produits laitiers ainsi que leurs substituts, autres que le beurre, la crème, la crème sure, la crème glacée, le lait glacé, le sorbet laitier et leurs substituts;
b) les produits de viande, les produits de volaille et les produits d’animaux marins et d’animaux d’eau douce visés au titre 21 ainsi que leurs substituts, dont les oeufs, le tofu, les légumineuses, les fruits à écale, les graines, les beurres de fruits à écale ou de graines et les tartinades de légumineuses;
c) les fruits et les légumes, autres que les pickles, les cornichons, les achards (relish), les olives et les garnitures;
d) les pains, les céréales à déjeuner, le riz et autres grains et les pâtes alimentaires; (main dish)
- point
point Unité de mesure de la force du corps des caractères connu comme point PostScript et qui équivaut à 0,3527777778 mm; (point)
- pour cent
pour cent ou % Pourcentage en poids, à moins d’indication contraire; (per cent or %)
- préparation aromatisante
préparation aromatisante s’applique à tout aliment qui fait l’objet d’une norme du titre 10; (flavouring preparation)
- principale surface exposée
principale surface exposée s’agissant d’un produit préemballé :
a) si son emballage a une surface exposée ou visible dans les conditions habituelles de vente ou d’utilisation, la totalité de cette surface, à l’exclusion du dessus, le cas échéant;
b) si son emballage est muni d’un couvercle qui constitue sa partie exposée ou visible dans les conditions habituelles de vente ou d’utilisation, la totalité de la surface supérieure du couvercle;
c) si son emballage n’a pas de surface en particulier qui soit exposée ou visible dans les conditions habituelles de vente ou d’utilisation, 40 % de la surface totale de l’emballage, à l’exclusion du dessus et du dessous, le cas échéant, s’il est possible que cette proportion de la surface soit exposée ou visible dans ces conditions;
d) si son emballage est un sac dont les surfaces sont d’égales dimensions, la surface totale de l’une d’elles;
e) si son emballage est un sac dont les surfaces sont de dimensions différentes, la surface totale de l’une de ses plus grandes surfaces;
f) malgré les alinéas a) à e), si son emballage n’a pas de surface exposée ou visible dans les conditions habituelles de vente ou d’utilisation sur laquelle une étiquette peut être apposée, la surface totale de l’un des côtés de l’étiquette mobile attachée à l’emballage;
g) malgré les alinéas a) à e), si l’emballage contient du vin exposé pour la vente, toute partie de la surface de l’emballage, à l’exclusion du dessus et du dessous, qui peut être vue sans qu’il soit nécessaire de tourner l’emballage;
h) si son emballage est une enveloppe ou une bande si étroite par rapport à la dimension de l’aliment qu’elle contient qu’il n’est pas raisonnable de considérer que l’emballage a une surface exposée ou visible dans les conditions habituelles de vente ou d’utilisation, la surface totale de l’un des côtés de l’étiquette mobile attachée à l’emballage; (principal display surface)
- produit chimique agricole
produit chimique agricole Toute substance utilisée ou présentée comme étant utilisable dans un aliment, ou sur sa surface, pendant sa production, son entreposage ou son transport et dont l’utilisation donne lieu, ou dont on peut raisonnablement s’attendre à ce qu’elle donne lieu, à un résidu ou à un composant ou dérivé de la substance dans l’aliment ou sur sa surface, y compris tout produit antiparasitaire au sens du paragraphe 2(1) de la Loi sur les produits antiparasitaires, régulateur de croissance des végétaux, fertilisant ou tout adjuvant ou véhicule utilisé avec la substance. Sont toutefois exclus les produits suivants :
a) les additifs alimentaires visés aux tableaux de l’article B.16.100 et utilisés conformément à ces tableaux;
b) les substances nutritives utilisées, reconnues ou couramment vendues comme aliments ou comme ingrédients d’un aliment;
c) les vitamines, minéraux nutritifs et acides aminés;
c.1) les ingrédients supplémentaires;
d) les assaisonnements, épices, extraits naturels, huiles essentielles, oléorésines et préparations aromatisantes;
e) les matériaux d’emballage des aliments ou toute substance qui entre dans leur composition;
f) les drogues recommandées pour administration aux animaux pouvant être consommés comme aliments; (agricultural chemical)
- produit de poisson
produit de poisson désigne du poisson ou du poisson préparé; (fish product)
- produit de viande
produit de viande désigne de la viande, des sous-produits de viande, de la viande préparée ou des sous-produits de viande préparée; (meat product)
- produit de viande avec allongeur
produit de viande avec allongeur désigne un produit de viande auquel un allongeur de produit de viande a été ajouté; (extended meat product)
- produit de volaille
produit de volaille désigne de la viande de volaille, de la viande de volaille préparée, des sous-produits de viande de volaille ou des sous-produits de viande de volaille préparée; (poultry product)
- produit de volaille avec allongeur
produit de volaille avec allongeur désigne un produit de volaille auquel un allongeur de produit de volaille a été ajouté; (extended poultry product)
- produit préemballé
produit préemballé désigne un aliment contenu dans un emballage de manière à être normalement vendu, utilisé ou acheté par une personne; (prepackaged product)
- produit préemballé à portion individuelle
produit préemballé à portion individuelle Produit préemballé dont la quantité nette de l’aliment contenu dans l’emballage correspond à la portion indiquée pour cet aliment, tel qu’il est prévu à l’alinéa B.01.002A(1)b); (single-serving prepackaged product)
- produit préemballé à portions multiples
produit préemballé à portions multiples Produit préemballé autre qu’un produit préemballé à portion individuelle; (multiple-serving prepackaged product)
- quantité de référence
quantité de référence S’agissant d’un aliment figurant à la colonne 1 du Tableau des quantités de référence, la quantité de cet aliment indiquée dans la colonne 2; (reference amount)
- ration quotidienne raisonnable
ration quotidienne raisonnable, appliquée à un aliment énuméré à un poste de la colonne I de l’annexe K, désigne la quantité de cet aliment indiquée dans la colonne II de ladite annexe; (reasonable daily intake)
- repas préemballé
repas préemballé Choix préemballé d’aliments destiné à une seule personne, qui ne requiert aucune autre préparation que le réchauffage et qui contient au moins les portions suivantes, selon la description qui en est donnée dans la publication intitulée Guide alimentaire canadien pour manger sainement, autorisée par le ministre de la Santé nationale et du Bien-être social et publiée en 1992 par le ministère des Approvisionnements et Services :
a) une portion de viande, poisson, volaille, légumineuses, noix, graines, oeufs ou lait ou produits du lait autres que le beurre, la crème, la crème sure, la crème glacée, le lait glacé et le sorbet laitier;
b) une portion de légumes, fruits ou produits céréaliers; (prepackaged meal)
- Répertoire des modèles de TVN
Répertoire des modèles de TVN Le document intitulé Étiquetage nutritionnel — Répertoire des modèles de tableaux de la valeur nutritive, publié par le gouvernement du Canada sur son site Web, avec ses modifications successives; (Directory of NFT Formats)
- Répertoire des spécifications des symboles nutritionnels
Répertoire des spécifications des symboles nutritionnels le document intitulé Étiquetage nutritionnel — Répertoire des spécifications des symboles nutritionnels, publié par le gouvernement du Canada sur son site Web, avec ses modifications successives; (Directory of Nutrition Symbol Specifications)
- simili-produit de viande
simili-produit de viande désigne un aliment qui ne contient aucun produit de viande, produit de volaille ni produit de poisson mais qui a l’apparence d’un produit de viande; (simulated meat product)
- simili-produit de volaille
simili-produit de volaille désigne un aliment qui ne contient aucun produit de volaille, produit de viande ni produit de poisson mais qui a l’apparence d’un produit de volaille; (simulated poultry product)
- substitut de repas
substitut de repas Préparation alimentaire qui, à elle seule, peut remplacer au moins un repas quotidien; (meal replacement)
- substitut fonctionnel d’un agent édulcorant
substitut fonctionnel d’un agent édulcorant À l’égard d’un produit préemballé, l’aliment — autre que l’édulcorant ou l’agent édulcorant, notamment les sucres — qui remplace un agent édulcorant et qui possède une ou plusieurs des fonctions de ce dernier en termes notamment de pouvoir édulcorant, épaississant, texturant ou caramélisant; (functional substitute for a sweetening agent)
- sucres
sucres désigne tous les monosaccharides et les disaccharides; (sugars)
- supplément nutritif
supplément nutritif Aliment vendu ou présenté comme supplément à un régime alimentaire dont l’apport en énergie et en éléments nutritifs essentiels peut ne pas être suffisant. Est exclu de la présente définition le fortifiant pour lait humain; (nutritional supplement)
- surface exposée disponible
surface exposée disponible Relativement à un produit préemballé, les surfaces suivantes :
a) le dessous de tout emballage décoratif ou la totalité de la surface des deux côtés d’une étiquette mobile attachée à l’emballage décoratif, la plus grande surface étant à retenir;
b) la totalité de la surface des deux côtés de toute étiquette mobile attachée à un emballage sur lequel aucune étiquette ne peut être apposée ou sur lequel les renseignements ne peuvent être indiqués lisiblement et de façon que l’acheteur ou le consommateur puisse les voir aisément dans les conditions habituelles d’achat;
c) la totalité de la surface de tout autre emballage, à l’exclusion de son dessous si son contenu fuit ou est endommagé lorsque l’emballage est retourné.
Sont toutefois exclus :
d) toute surface de l’emballage sur lequel aucune étiquette ne peut être apposée ou sur lequel les renseignements ne peuvent être indiqués lisiblement et de façon que l’acheteur ou le consommateur puisse les voir aisément dans les conditions habituelles d’achat;
e) toute partie d’un emballage, autre que l’emballage d’un aliment destiné à être consommé par une personne en une seule fois, qui est conçue pour être détruite lors de l’ouverture de celui-ci;
f) tout espace occupé par le code universel des produits; (available display surface)
- surtitrage
surtitrage Quantité d’une vitamine ou d’un minéral nutritif ajoutée à un aliment, dans les limites des bonnes pratiques industrielles, en sus de la quantité déclarée sur l’étiquette, afin d’assurer le maintien de cette dernière pendant toute la durée de conservation; (overage)
- symbole nutritionnel
symbole nutritionnel symbole que porte l’espace principal d’un produit préemballé en application du paragraphe B.01.350(1); (nutrition symbol)
- tableau de la valeur nutritive
tableau de la valeur nutritive Tableau que porte l’étiquette d’un produit préemballé conformément au paragraphe B.01.401(1); (nutrition facts table)
- Tableau des mentions et des allégations autorisées concernant la teneur nutritive
Tableau des mentions et des allégations autorisées concernant la teneur nutritive le document intitulé Étiquetage nutritionnel — Tableau des mentions et des allégations autorisées concernant la teneur nutritive, publié par le gouvernement du Canada sur son site Web, avec ses modifications successives; (Table of Permitted Nutrient Content Statements and Claims)
- Tableau des quantités de référence
Tableau des quantités de référence Le document intitulé Étiquetage nutritionnel — Tableau des quantités de référence pour aliments, publié par le gouvernement du Canada sur son site Web, avec ses modifications successives; (Table of Reference Amounts)
- tableau des renseignements sur les aliments supplémentés
tableau des renseignements sur les aliments supplémentés Tableau que porte l’étiquette d’un aliment supplémenté conformément au paragraphe B.29.002(1); (supplemented food facts table)
- Tableau des valeurs quotidiennes
Tableau des valeurs quotidiennes Le document intitulé Étiquetage nutritionnel — Tableau des valeurs quotidiennes, publié par le gouvernement du Canada sur son site Web, avec ses modifications successives; (Table of Daily Values)
- valeur énergétique
valeur énergétique s’entend, dans le cas d’un aliment, de la quantité d’énergie que peut recevoir une personne lorsqu’elle ingère l’aliment et que les constituants chimiques de cet aliment, dont les protéines, les matières grasses, les glucides et l’alcool, sont métabolisés; (energy value)
- valeur quotidienne
valeur quotidienne S’agissant d’un élément nutritif, la quantité applicable visée au paragraphe B.01.001.1(2). (daily value)
(2) Les termes ci-après sont définis comme il suit pour l’application de la Loi.
- additif alimentaire
additif alimentaire S’entend au sens du paragraphe (1). (food additive)
- produit chimique agricole
produit chimique agricole S’entend au sens du paragraphe (1). (agricultural chemical)
(3) Les définitions qui suivent s’appliquent au présent titre.
- fortifiant pour lait humain
fortifiant pour lait humain S’entend au sens de l’article B.25.001. (human milk fortifier)
- succédané de lait humain
succédané de lait humain S’entend au sens de l’article B.25.001. (human milk substitute)
(4) Pour l’application des définitions de aliment supplémenté et ingrédient supplémentaire, au paragraphe (1), l’ingrédient supplémentaire d’un aliment supplémenté qui est utilisé comme ingrédient dans la fabrication d’un autre aliment supplémenté est réputé également avoir été ajouté à cet autre aliment supplémenté à titre d’ingrédient supplémentaire et ne pas être un constituant d’un ingrédient de cet autre aliment supplémenté, s’il y est contenu conformément aux conditions d’utilisation applicables prévues aux colonnes 2 à 5 de la Liste des ingrédients supplémentaires autorisés.
- DORS/78-403, art. 1(F)
- DORS/79-23, art. 1
- DORS/81-83, art. 1
- DORS/81-617, art. 1
- DORS/88-336, art. 1
- DORS/88-559, art. 1
- DORS/89-175, art. 1
- DORS/91-124, art. 1
- DORS/91-527, art. 1
- DORS/93-276, art. 1
- DORS/95-474, art. 1
- DORS/98-580, art. 1(F)
- DORS/2000-353, art. 3
- DORS/2003-11, art. 1
- err.(A), Vol. 137, no 5
- DORS/2005-98, art. 1
- DORS/2008-181, art. 1
- DORS/2008-182, art. 1
- DORS/2010-94, art. 1
- DORS/2011-278, art. 1
- 2014, ch. 20, art. 366(A)
- DORS/2014-99, art. 1
- DORS/2016-74, art. 1
- DORS/2016-305, art. 1
- DORS/2018-108, art. 393
- DORS/2021-57, art. 1
- DORS/2022-143, art. 2
- DORS/2022-168, art. 1
- DORS/2022-169, art. 1
B.01.001.1 (1) Pour l’application du paragraphe (2), le terme lipides qui est utilisé dans le Tableau des valeurs quotidiennes s’entend de tous les acides gras exprimés sous forme de triglycérides.
(2) La valeur quotidienne d’un élément nutritif contenu dans un aliment est :
a) s’agissant d’un élément nutritif mentionné à la colonne 1 de la partie 1 du Tableau des valeurs quotidiennes, la quantité qui figure :
(i) à la colonne 2, dans le cas d’un aliment destiné exclusivement aux enfants âgés d’au moins un an mais de moins de quatre ans,
(ii) à la colonne 3, dans le cas d’un aliment destiné aux enfants âgés d’au moins un an mais de moins de quatre ans ou aux enfants âgés d’au moins quatre ans et aux adultes;
b) s’agissant d’une vitamine ou d’un minéral nutritif mentionné à la colonne 1 de la partie 2 du Tableau des valeurs quotidiennes, la quantité de cette vitamine ou de ce minéral nutritif qui figure :
(i) à la colonne 2, dans le cas d’un aliment destiné exclusivement aux bébés âgés d’au moins six mois mais de moins d’un an,
(ii) à la colonne 3, dans le cas d’un aliment destiné aux bébés âgés d’au moins six mois mais de moins d’un an ou aux enfants âgés d’au moins un an mais de moins de quatre ans,
(iii) à la colonne 4, dans les autres cas.
(3) Le paragraphe (2) ne s’applique pas si l’aliment est :
a) soit un fortifiant pour lait humain;
b) soit un succédané de lait humain destiné exclusivement aux bébés âgés de moins de six mois.
- DORS/2003-11, art. 2
- DORS/2016-305, art. 2
- DORS/2021-57, art. 2
B.01.002 Dans la présente partie, la présence du symbole [N] entre le numéro d’une disposition et le nom de l’aliment visé indique que la disposition prescrit la norme de composition, de concentration, d’activité, de pureté, de qualité ou de toute autre propriété à observer pour cet aliment; l’absence de ce symbole indique qu’aucune norme n’est prescrite à l’égard de l’aliment visé.
- DORS/79-752, art. 1
B.01.002A (1) Pour l’application de la présente partie, la portion indiquée d’un aliment est :
a) établie en fonction de l’aliment tel qu’il est vendu;
b) dans l’un ou l’autre des cas ci-après, la quantité nette de l’aliment dans l’emballage lorsque :
(i) cette quantité peut être raisonnablement consommée par une personne en une seule fois,
(ii) l’emballage contient moins de 200 % de la quantité de référence de l’aliment;
c) dans les autres cas, la quantité établie selon les critères énoncés à la colonne 3A du Tableau des quantités de référence pour cet aliment.
(2) La portion indiquée d’un aliment est exprimée de la façon suivante :
a) dans le cas d’un produit préemballé à portion individuelle auquel l’alinéa (1)b) s’applique, par emballage et selon les unités suivantes :
(i) en grammes, lorsque la quantité nette de l’aliment est mentionnée en poids ou en nombre sur l’étiquette,
(ii) en millilitres, lorsque la quantité nette de l’aliment est mentionnée en volume sur l’étiquette;
b) dans le cas d’un produit préemballé à portions multiples auquel l’alinéa (1)c) s’applique, selon les unités ci-après indiquées à la colonne 3B du Tableau des quantités de référence et de la manière dont elles y sont présentées :
(i) la mesure domestique applicable au produit,
(ii) la mesure métrique applicable au produit.
- DORS/88-559, art. 2
- DORS/2003-11, art. 3
- DORS/2016-305, art. 3
B.01.003 (1) Doivent porter une étiquette lorsqu’ils sont offerts en vente les aliments suivants :
a) tous les produits préemballés sauf
(i) les confiseries préemballées, appelées couramment bonbons d’une bouchée, qui sont vendues individuellement, et
(ii) les fruits ou légumes frais préemballés qui sont emballés dans une enveloppe ou bande ayant moins de 1/2 pouce de largeur;
b) les viandes et sous-produits de la viande cuits à la broche, rôtis ou grillés sur les lieux de la vente au détail;
c) les volailles, viandes de volaille ou sous-produits de la viande de volaille cuits à la broche, rôtis ou grillés sur les lieux de la vente au détail;
d) la viande de cheval ou ses sous-produits;
e) toute substance ou tout mélange de substances à utiliser comme additif alimentaire ou préparation d’additif alimentaire; et
f) la farine et la farine de blé complet traitées aux rayons gamma provenant d’une source de cobalt 60.
(2) [Abrogé, DORS/79-23, art. 2]
- DORS/79-23, art. 2
B.01.004 (1) L’étiquette visée à l’article B.01.003 doit être apposée en tout ou en partie
a) dans le cas d’un produit préemballé, sur l’emballage dans lequel le produit est vendu; et
b) dans le cas d’un aliment qui n’est pas un produit préemballé, sur l’aliment même.
(2) L’étiquette doit être apposée de manière que l’emballage du produit préemballé ou de l’aliment, selon le cas, porte l’étiquette au moment de la vente.
- DORS/84-300, art. 3
B.01.005 (1) Sous réserve des paragraphes (2) à (5), les renseignements qui doivent figurer sur l’étiquette ne peuvent figurer sur la portion de l’étiquette qui est apposée sur le dessous de l’emballage ou du produit alimentaire, le cas échéant.
(2) Les renseignements dont l’indication sur l’étiquette est prescrite peuvent figurer sur la portion de l’étiquette apposée sur le dessous d’un emballage ou d’un produit alimentaire, le cas échéant, si lesdits renseignements figurent aussi sur les portions de l’étiquette qui ne sont pas apposées sur le dessous de l’emballage ou du produit alimentaire.
(3) Malgré le paragraphe (2), lorsque l’emballage d’un produit préemballé est un emballage décoratif et que l’étiquette est apposée sur le dessous de l’emballage, les renseignements dont l’indication est prescrite peuvent figurer sur l’étiquette apposée sur le dessous de l’emballage.
(4) Malgré le paragraphe (2), les renseignements exigés par le sous-alinéa B.01.007(1.1)b)(i) et les alinéas B.24.103g), B.24.202d), B.24.304h), B.25.020(1)h) et B.25.057(1)f) et (2)f) peuvent figurer sur la partie de l’étiquette qui est apposée sur le dessous de l’emballage s’il est indiqué ailleurs sur l’étiquette à quel endroit figurent ces renseignements.
(4.1) Malgré le paragraphe (2), les renseignements exigés par l’alinéa B.27.005a) peuvent figurer sur la partie de l’étiquette qui est apposée sur le dessous de l’emballage.
(5) Malgré le paragraphe (2), peuvent figurer sur la portion de l’étiquette qui est apposée sur le dessous de l’emballage ou du produit alimentaire le tableau de la valeur nutritive, le tableau des renseignements sur les aliments supplémentés et la liste des mises en garde, si la surface exposée disponible comprend le dessous.
- DORS/79-529, art. 1
- DORS/92-626, art. 4
- DORS/2003-11, art. 4
- DORS/2021-57, art. 3
- DORS/2022-143, art. 3
- DORS/2022-169, art. 2
B.01.006 (1) Le nom usuel de l’aliment doit figurer sur l’espace principal.
(2) Par dérogation au paragraphe (1), le nom usuel des fruits ou légumes frais qui sont préemballés de manière à être visibles et reconnaissables dans leur emballage n’a pas à être indiqué sur l’étiquette.
- DORS/79-23, art. 3
- DORS/92-626, art. 5
B.01.006.1 Sauf disposition contraire du présent règlement ou du Règlement sur la salubrité des aliments au Canada, si un produit préemballé est susceptible d’être confondu avec un autre aliment, une mention précisant la nature véritable du produit préemballé doit figurer sur l’espace principal, afin qu’il soit possible de le distinguer de l’autre aliment. La mention peut porter sur ce qui suit :
a) le type d’agent d’emballage liquide utilisé, notamment la saumure, l’huile végétale ou le sirop;
b) le genre ou la forme du produit préemballé, notamment ferme, extra ferme, entier, tranché ou en dés;
c) la condition du produit préemballé, notamment séché, concentré, reconstitué, gazéifié ou fumé, auquel cas la mention fait partie du nom usuel.
B.01.007 (1) Dans le présent article, date d’emballage désigne :
a) soit la date à laquelle l’aliment est emballé pour la première fois dans l’emballage dans lequel il sera offert en vente aux consommateurs;
b) soit la date à laquelle le produit préemballé est pesé par le détaillant dans l’emballage dans lequel il sera offert en vente aux consommateurs pour la première fois.
(1.1) L’étiquette doit comporter les renseignements suivants :
a) le nom et l’adresse du principal établissement de la personne par qui ou pour qui l’aliment a été fabriqué ou produit;
b) dans le cas où le produit préemballé a une durée de conservation de 90 jours ou moins et est emballé ailleurs que sur les lieux de vente au détail où il sera vendu :
(i) la date limite de conservation,
(ii) le mode d’entreposage du produit préemballé, s’il requiert des conditions d’entreposage différentes des conditions ambiantes normales;
c) dans le cas où le produit préemballé a une durée de conservation de 90 jours ou moins et est emballé sur les lieux de vente au détail où il sera vendu :
(i) la date d’emballage,
(ii) la durée de conservation de l’aliment, sauf si elle est affichée près de l’aliment.
(1.2) La date d’emballage visée à l’alinéa (1.1)c) doit répondre aux exigences des paragraphes (4) et (5) sauf en ce qui concerne les expressions « best before » et « meilleur avant » qui doivent être remplacées par celles de « packaged on » et « empaqueté le ».
(2) L’alinéa (1.1)a) ne s’applique pas aux fruits ou légumes frais qui sont sur les lieux de vente au détail, sont préemballés de façon à être visibles et identifiables dans l’emballage.
(3) Les alinéas (1.1)b) et c) ne s’appliquent pas :
a) aux produits préemballés qui sont des fruits ou légumes frais préemballés;
b) aux portions individuelles préemballées d’aliments qui sont servies avec des repas ou des casse-croûte par un restaurant ou une autre entreprise commerciale;
c) aux portions individuelles préemballées d’aliments qui sont préparées dans un dépôt de vivres et vendues au moyen de distributeurs automatiques ou d’une cantine mobile;
d) aux beignets préemballés.
(4) La date limite de conservation doit être indiquée de la manière suivante :
a) les mots « meilleur avant » et « best before » doivent être regroupés avec la date limite de conservation à moins que cette date ne soit clairement expliquée ailleurs sur l’étiquette;
b) lorsqu’il est nécessaire, pour des raisons de clarté, d’indiquer l’année de la date limite de conservation, l’année doit être indiquée en premier et doit comprendre au moins les deux derniers chiffres;
c) le mois doit figurer en toutes lettres après l’année, si l’année est indiquée, et peut être abrégé comme le paragraphe (5); et
d) le jour du mois doit être indiqué après le mois et en chiffres.
(5) Le mois de la date limite de conservation, lorsqu’il est abrégé, doit être abrégé de la manière suivante, et une seule abréviation doit être utilisée pour la langue anglaise et la langue française :
- JApour JANVIER
- FEpour FÉVRIER
- MRpour MARS
- ALpour AVRIL
- MApour MAI
- JNpour JUIN
- JLpour JUILLET
- AUpour AOÛT
- SEpour SEPTEMBRE
- OCpour OCTOBRE
- NOpour NOVEMBRE
- DEpour DÉCEMBRE
(6) Sauf indication contraire du présent règlement, nul ne doit utiliser, pour marquer une date limite de conservation sur l’étiquette d’un produit préemballé, une autre méthode que la méthode indiquée dans le présent article.
(7) L’alinéa (1.1)b) ne s’applique pas à la levure fraîche préemballée si
a) la date à laquelle il est prévu que le produit perd son efficacité est indiquée sur l’étiquette de la manière et selon la forme prescrites pour la date limite de conservation en vertu des paragraphes (4) et (5); et
b) les termes « best before » et « meilleur avant » sont remplacés par les termes « use by » et « employez avant ».
- DORS/79-23, art. 4
- DORS/79-529, art. 2
- DORS/88-291, art. 1
- DORS/92-626, art. 6
B.01.008 (1) Les renseignements suivants doivent être groupés ensemble, sur n’importe quelle partie de l’étiquette :
a) les renseignements exigés par le présent règlement, autres que :
(i) ceux qui doivent figurer sur l’espace principal, dans le tableau de la valeur nutritive ou dans le tableau des renseignements sur les aliments supplémentés,
(ii) ceux exigés par le paragraphe B.01.005(4), les articles B.01.007, B.01.301, B.01.305, B.01.311, B.01.503, B.01.513 et B.01.601, les alinéas B.24.103g), B.24.202d), B.24.304h), B.25.020(1)e), f) et h), B.25.057(1)f) et (2)f) et B.27.005a) et les articles B.29.020 et B.29.026,
(iii) les mentions devant figurer sur l’étiquette d’un aliment supplémenté conformément à la colonne 5 de la Liste des ingrédients supplémentaires autorisés;
b) lorsqu’un produit préemballé se compose de plus d’un ingrédient, une liste de tous les ingrédients, y compris, sous réserve de l’article B.01.009, les constituants, le cas échéant.
(2) L’alinéa (1)b) ne s’applique pas
a) aux produits préemballés, sauf les noix assorties, dont l’emballage se fait sur les lieux de vente au détail à partir du produit en vrac;
b) aux portions individuelles préemballées d’aliment, destinées uniquement à être servies par un restaurant ou une autre entreprise commerciale avec les repas ou casse-croûte;
c) aux portions individuelles préemballées d’aliment, préparées dans un dépôt de vivres et vendues au moyen de distributeurs automatiques ou d’une cantine mobile;
d) aux viandes et sous-produits de la viande préemballés, cuits à la broche, rôtis ou grillés sur les lieux de la vente au détail;
e) aux volailles, viandes de volaille, ou sous-produits de la viande de volaille cuits à la broche, rôtis ou grillés sur les lieux de la vente au détail;
f) au bourbon et aux produits préemballés régis par les normes de composition énoncées au titre 2;
g) aux produits préemballés régis par les normes de composition du titre 19.
(3) Malgré l’alinéa (1)b), les éléments ci-après n’ont pas à être indiqués sur l’étiquette d’un produit préemballé :
a) les composés d’enduits de cire et leurs constituants utilisés comme ingrédients ou constituants des fruits ou légumes frais préemballés;
b) les boyaux de saucisse utilisés comme ingrédients ou constituants des saucisses préemballées;
c) l’hydrogène utilisé pour l’hydrogénation, comme ingrédient ou constituant des produits préemballés;
d) les constituants des ingrédients d’un sandwich fait avec du pain;
e) l’eau ajoutée utilisée comme ingrédient qui a été éliminée pendant la fabrication des produits préemballés.
(4) à (10) [Abrogés, DORS/2016-305, art. 4]
- DORS/79-23, art. 5
- DORS/88-559, art. 3
- DORS/92-626, art. 7
- DORS/93-145, art. 1
- DORS/2003-11, art. 5
- DORS/2011-28, art. 1
- DORS/2016-305, art. 4
- DORS/2021-57, art. 4
- DORS/2022-143, art. 5
- DORS/2022-169, art. 3
B.01.008.1 (1) Les renseignements qui, aux termes des articles B.01.008.2 à B.01.010.4, B.01.014 et B.29.020, figurent sur l’étiquette d’un produit préemballé sont indiqués en caractères :
a) monochromes et équivalent visuellement à de l’imprimerie noire en aplat de 100 % sur un fond blanc ou de couleur de teinte neutre et uniforme d’au plus 5 %;
b) normalisés, sans empattement, non décoratifs et inscrits de manière à ce qu’ils ne se touchent pas ni ne touchent à aucun élément de démarcation prévu au paragraphe B.01.008.2(2);
c) de chasse normale ou étroite sans qu’elle soit réduite pour qu’ils prennent moins d’espace sur le plan horizontal, et, si un tableau de la valeur nutritive ou un tableau des renseignements sur les aliments supplémentés figure sur l’étiquette, les caractères sont d’une chasse égale à celle qui est exigée pour les caractères des éléments nutritifs figurant dans le tableau de la valeur nutritive ou à celle qui est exigée pour les caractères des ingrédients supplémentaires figurant dans le tableau des renseignements sur les aliments supplémentés, selon le cas;
d) ordinaires, sauf disposition contraire prévue à ces articles;
e) d’une même hauteur, soit d’au moins 1,1 mm, avec un interligne identique d’au moins 2,5 mm, sauf disposition contraire prévue au présent article ou à ces articles.
(2) Malgré l’alinéa (1)a), la liste des ingrédients figurant sur l’étiquette des produits préemballés ci-après n’a pas à être sur un fond blanc ou de couleur de teinte neutre et uniforme d’au plus 5 % :
a) tout produit préemballé qui est destiné uniquement à être utilisé comme ingrédient dans la fabrication d’autres produits préemballés destinés à être vendus au consommateur au niveau du commerce de détail ou comme ingrédient dans la préparation d’aliments par une entreprise commerciale ou industrielle ou une institution;
b) tout produit préemballé à portions multiples prêt à servir destiné uniquement à être servi par une entreprise commerciale ou industrielle ou une institution.
(3) Sauf disposition contraire prévue au paragraphe (4) et aux articles B.01.008.2 à B.01.010.4, si un tableau de la valeur nutritive ou un tableau des renseignements sur les aliments supplémentés figure sur l’étiquette d’un produit préemballé et que les éléments nutritifs qui figurent dans le tableau de la valeur nutritive — ou les ingrédients supplémentaires qui figurent dans le tableau des renseignements sur les aliments supplémentés — sont présentés en caractères d’au moins 8 points, les renseignements visés au paragraphe (1) sont indiqués en caractères qui remplissent les exigences suivantes :
a) ils sont d’une même hauteur que ceux utilisés pour présenter les éléments nutritifs dans le tableau de la valeur nutritive ou les ingrédients supplémentaires dans le tableau des renseignements sur les aliments supplémentés, selon le cas;
b) ils sont d’une hauteur d’au moins 1,4 mm, avec un interligne identique d’au moins 3,2 mm.
(4) Le titre utilisé pour présenter la liste des ingrédients, la mention des sources d’allergènes alimentaires ou de gluten et des sulfites ajoutés au sens du paragraphe B.01.010.1(1), l’énoncé visé au paragraphe B.01.010.4(1) ou la liste des mises en garde peut être en caractères d’une hauteur plus grande que celle des caractères utilisés pour indiquer les renseignements contenus dans l’une ou l’autre de ces listes, dans la mention ou dans l’énoncé, selon le cas.
(5) Si plus d’un des titres visés au paragraphe (4) figure sur l’étiquette, les caractères de chacun de ces titres doivent être de la même hauteur.
(6) Pour l’application du présent article, la hauteur d’un caractère désigne la hauteur de la lettre minuscule « x ».
- DORS/2016-305, art. 5
- DORS/2022-168, art. 2
- DORS/2022-169, art. 4
B.01.008.2 (1) La liste des ingrédients est indiquée par un titre qui, à la fois :
a) est formé de la mention :
(i) « Ingrédients », « Ingrédients : » ou « Ingrédients : », pour ce qui est de la version française de la liste,
(ii) « Ingredients », « Ingredients: » ou « Ingredients : » pour ce qui est de la version anglaise de la liste;
b) figure en caractères gras;
c) figure sans qu’aucun texte imprimé ou écrit, ni aucun autre signe graphique ne soit intercalé entre le titre et le premier ingrédient mentionné à la liste.
(2) La liste des ingrédients est présentée de l’une des manières ci-après, ou des deux, de façon à ce qu’elle se démarque nettement sur l’étiquette :
a) elle est encadrée par une bordure ou délimitée par une ou plusieurs lignes continues tracées immédiatement au-dessus, au-dessous ou aux extrémités de la liste, qui sont de la même couleur que celle des caractères utilisés pour indiquer les renseignements visés au paragraphe B.01.008.1(1);
b) il y a un contraste entre la couleur de fond de la liste et la couleur de fond de la partie adjacente de l’étiquette, exception faite de la partie où figurent l’un ou l’autre des renseignements suivants :
(i) la mention des sources d’allergènes alimentaires ou de gluten et des sulfites ajoutés au sens du paragraphe B.01.010.1(1),
(ii) l’énoncé visé au paragraphe B.01.010.4(1),
(iii) toute mention visée au paragraphe B.01.014(1),
(iv) le tableau de la valeur nutritive,
(v) le tableau des renseignements sur les aliments supplémentés,
(vi) la liste des mises en garde.
(3) Les ingrédients figurent dans la liste des ingrédients :
a) dans l’ordre décroissant de leurs proportions respectives, en poids, dans le produit préemballé avant qu’ils ne soient combinés pour former celui-ci;
b) en lettres minuscules, sauf dans les cas ci-après où des lettres majuscules sont utilisées :
(i) la première lettre de chacun des ingrédients ou, s’il s’agit d’un additif alimentaire ou d’un ingrédient supplémentaire indiqué — en tout ou en partie — par son acronyme, la totalité de l’acronyme,
(ii) le descripteur alphabétique utilisé dans le nom usuel d’un additif alimentaire, d’une vitamine, d’un ingrédient supplémentaire ou d’un microorganisme;
c) séparés entre eux par une puce ou une virgule.
(4) Malgré l’alinéa (3)a), les ingrédients ci-après peuvent figurer dans n’importe quel ordre à la fin de la liste des ingrédients :
a) épices, fines herbes et autres assaisonnements, sauf le sel ajouté séparément, lorsque le poids total de ces autres assaisonnements ne dépasse pas deux pour cent du poids total des ingrédients utilisés pour fabriquer le produit préemballé, à l’exception de l’eau ajoutée utilisée comme ingrédient qui a été éliminée pendant la fabrication;
b) substances aromatisantes naturelles et substances aromatisantes artificielles;
c) substances qui rehaussent le goût;
d) additifs alimentaires, sauf les ingrédients de préparation d’additifs alimentaires ou les mélanges de substances devant être utilisés comme additifs alimentaires;
e) vitamines;
f) sels ou dérivés de vitamines;
g) minéraux nutritifs;
h) sels de minéraux nutritifs;
i) ingrédients supplémentaires.
(5) Les constituants d’un ingrédient figurent dans la liste des ingrédients :
a) entre parenthèses, immédiatement après l’ingrédient sauf si une source d’allergène alimentaire ou de gluten est indiquée immédiatement après l’ingrédient, auquel cas les constituants de l’ingrédient figurent plutôt immédiatement après cette source;
b) dans l’ordre décroissant de leurs proportions respectives, en poids, dans l’ingrédient avant qu’ils ne soient combinés pour former celui-ci;
c) en lettres minuscules, sauf dans les cas ci-après où des lettres majuscules sont utilisées :
(i) s’il s’agit d’un additif alimentaire ou d’un ingrédient supplémentaire indiqué — en tout ou en partie — par son acronyme, la totalité de l’acronyme,
(ii) le descripteur alphabétique utilisé dans le nom usuel d’un additif alimentaire, d’une vitamine, d’un ingrédient supplémentaire ou d’un microorganisme;
d) séparés entre eux par une virgule.
(6) Malgré l’alinéa B.01.008(1)b) et les alinéas (5)a) et b) et sous réserve de l’article B.01.009, dans les cas où le présent règlement exige l’indication d’un ou de plusieurs constituants d’un ingrédient dans la liste des ingrédients, le nom de cet ingrédient n’a pas à être inclus dans la liste si tous ses constituants y sont désignés par leur nom usuel et y figurent conformément au paragraphe (3) comme s’ils étaient des ingrédients.
(7) Dans le cas où une source d’allergène alimentaire ou de gluten figure à la liste des ingrédients, la source figure :
a) immédiatement à la suite de l’ingrédient ou du constituant dont elle indique la source, conformément aux paragraphes B.01.010.1(8) et (10);
b) en lettres minuscules uniquement;
c) séparée par une virgule de toute autre source d’allergène alimentaire ou de gluten figurant pour un même ingrédient ou constituant.
(8) Lorsque les versions française et anglaise de la liste des ingrédients figurent sur l’étiquette, elles sont présentées sur un espace continu de la surface exposée disponible, mais n’ont pas à être présentées sur le même.
(9) Lorsque les versions anglaise et française de la liste des ingrédients sont présentées sur un même espace continu de l’étiquette, celle des versions qui suit l’autre ne doit pas débuter sur la même ligne que celle où se termine cette autre version, sauf s’il s’agit d’un produit préemballé dont la surface exposée disponible est de moins de 100 cm2.
B.01.008.3 (1) Lorsqu’un produit préemballé contient un ou plusieurs ingrédients à base de sucres, ces ingrédients doivent, malgré l’ordre de présentation prévu à l’alinéa B.01.008.2(3)a), être regroupés dans la liste des ingrédients, entre parenthèses, immédiatement après la mention :
a) « Sucres » pour ce qui est de la version française de la liste;
b) « Sugars » pour ce qui est de la version anglaise de la liste.
(2) La mention « Sucres » visée au paragraphe (1) figure dans la liste des ingrédients :
a) dans l’ordre décroissant de la proportion, en poids, de tous les ingrédients à base de sucres dans le produit préemballé avant qu’ils ne soient combinés pour former celui-ci;
b) séparée des autres ingrédients par une puce ou une virgule.
(3) Chaque ingrédient à base de sucres indiqué immédiatement après la mention « Sucres » figure :
a) malgré l’alinéa B.01.008.2(3)b), uniquement en lettres minuscules;
b) dans le cas où plus d’un de ces ingrédients sont indiqués :
(i) dans l’ordre décroissant de sa proportion, en poids, dans le produit préemballé, conformément au paragraphe B.01.008.2(3),
(ii) séparé par une virgule.
(4) Les paragraphes (1) à (3) ne s’appliquent pas aux produits préemballés suivants :
a) les agents édulcorants;
b) les jus de fruit ou de légume ou les boissons de légumes qui ne contiennent aucun agent édulcorant, ou les mélanges de ces jus ou boissons, y compris :
(i) ceux auxquels de la purée de fruit ou de légume, ou de fruits et de légumes, a été ajoutée,
(ii) ceux reconstitués,
(iii) les concentrés de ces jus ou boissons à diluer et à consommer sous forme de jus ou de boisson;
c) les purées de fruit ou de légume qui ne contiennent aucun agent édulcorant y compris les mélanges de ces purées;
d) les produits préemballés qui contiennent seulement un ingrédient à base de sucres dont le nom usuel contient le mot « sucre »;
e) les préparations pour régime liquide, les fortifiants pour lait humain et les succédanés de lait humain;
f) les produits préemballés qui contiennent moins de 0,5 g de sucres par portion indiquée.
- DORS/2016-305, art. 5
- DORS/2021-57, art. 5
- DORS/2022-143, art. 7
- DORS/2022-197, art. 4
B.01.009 (1) Les constituants des ingrédients ou groupes d’ingrédients énumérés dans le tableau du présent paragraphe n’ont pas à être indiqués sur l’étiquette d’un produit.
TABLEAU
Article Ingrédient 1 beurre 2 margarine 3 shortening 4 saindoux 5 saindoux de panne 6 monoglycérides 7 diglycérides 8 riz 9 amidons ou amidons modifiés 10 pains régis par les normes de composition énoncées aux articles B.13.021 à B.13.029 11 farine 12 farine de soya 13 farine Graham 14 farine de blé entier 15 levure artificielle (poudre à pâte) 16 laits régis par les normes de composition énoncées aux articles B.08.003 à B.08.027 17 base de gomme à mâcher 18 agents édulcorants régis par les normes de composition énoncées aux articles B.18.001 à B.18.018 19 cacao, cacao faible en gras 20 sel 21 vinaigres régis par les normes de composition énoncées aux articles B.19.003 à B.19.007 22 bourbon et boissons alcooliques régies par les normes de composition énoncées aux articles B.02.001 à B.02.134 23 fromage faisant l’objet d’une norme prévue au titre 8 et qui, dans un produit préemballé, constitue au total moins de 10 pour cent de celui-ci 24 confitures, marmelades et gelées régies par les normes de composition énoncées aux articles B.11.201 à B.11.241, lorsque la quantité totale de ces ingrédients constitue moins de 5 pour cent du produit préemballé 25 olives, marinades, achards (relish) et raifort, lorsque la quantité totale de ces ingrédients constitue moins de 10 pour cent du produit préemballé 26 graisse ou huile végétale ou animale visées par une norme prévue au titre 9 et graisse ou huile végétale ou animale modifiées, interestérifiées ou entièrement hydrogénées dont la quantité totale équivaut à moins de 15 pour cent du produit préemballé 27 viande, poisson, viande de volaille, sous-produit de viande ou de viande de volaille, préparé ou conservé, lorsque la quantité totale de ces ingrédients constitue moins de 10 pour cent d’un produit préemballé qui est un aliment non normalisé 28 pâte alimentaire qui ne contient aucun oeuf sous quelque forme que ce soit, ni aucune farine autre que de la farine de blé 29 culture bactérienne 30 protéine végétale hydrolysée 31 eau gazéifiée 32 lactosérum (petit-lait), poudre de lactosérum (petit-lait), lactosérum (petit-lait) concentré, beurre de lactosérum (petit-lait) et huile de beurre de lactosérum (petit-lait) 33 culture de moisissures 34 eau chlorée et eau fluorée 35 gélatine 36 chapelure de blé grillée utilisée dans ou comme liant, agent de remplissage ou d’enrobage dans ou sur un produit alimentaire (2) Sous réserve du paragraphe (3), lorsqu’une préparation ou un mélange figurant au tableau du présent paragraphe est ajouté à un aliment, les ingrédients et les constituants de la préparation ou du mélange n’ont pas à être indiqués sur l’étiquette de l’aliment.
TABLEAU
Article Préparation ou mélange 1 préparation de colorants alimentaires 2 préparation aromatisante 3 préparation aromatisante artificielle 4 mélange d’épices ou de fines herbes 5 mélange d’assaisonnements, autre que celui visé à l’article 4, et le sel ajouté séparément, lorsque le poids total de ces assaisonnements ne dépasse pas 2 % du poids total des ingrédients utilisés pour fabriquer le produit préemballé, à l’exception de l’eau ajoutée utilisée comme ingrédient qui a été éliminée pendant la fabrication 6 préparation vitaminée 7 préparation minérale 8 préparation d’additif alimentaire 9 préparation de présure 10 préparation de rehausseur de saveur 11 préparation de levure pressée, sèche, active ou instantanée (3) Les ingrédients ou les constituants suivants d’une préparation ou d’un mélange figurant au tableau du paragraphe (2) qui a été ajouté à un aliment doivent figurer sous leur nom usuel dans la liste des ingrédients de l’aliment, comme s’ils étaient des ingrédients de celui-ci :
a) sel;
b) acide glutamique ou ses sels;
c) protéine végétale hydrolysée;
d) aspartame;
e) chlorure de potassium;
f) les ingrédients ou les constituants qui remplissent une fonction dans l’aliment ou qui ont un effet sur celui-ci;
g) les ingrédients supplémentaires.
(4) Malgré les paragraphes (1) et (2), les constituants suivants, lorsqu’ils sont contenus dans un des ingrédients énumérés au tableau de ces paragraphes, doivent figurer dans la liste des ingrédients :
a) l’huile d’arachide;
b) l’huile d’arachide entièrement hydrogénée;
c) l’huile d’arachide modifiée.
(5) [Abrogé, DORS/2011-28, art. 2]
- DORS/78-728, art. 1
- DORS/79-23, art. 6
- DORS/79-662, art. 1
- DORS/88-559, art. 4
- DORS/92-626, art. 8
- DORS/93-145, art. 2
- DORS/93-465, art. 1
- DORS/95-548, art. 5(F)
- DORS/97-263, art. 1
- DORS/2000-417, art. 1
- DORS/2010-143, art. 39(A)
- DORS/2011-28, art. 2
- DORS/2022-143, art. 8
- DORS/2022-168, art. 4
- DORS/2022-169, art. 6
B.01.010 (1) Au présent article, nom usuel s’entend du nom indiqué dans le document sur les noms usuels d’ingrédients et de constituants.
(2) Un ingrédient ou constituant doit figurer dans la liste des ingrédients sous son nom usuel.
(3) Aux fins du paragraphe (2),
a) l’ingrédient ou le constituant mentionné dans le document sur les noms usuels d’ingrédients et de constituants doit figurer dans la liste d’ingrédients sous le nom usuel indiqué dans ce document;
b) l’ingrédient ou le constituant mentionné dans le document sur les noms usuels d’ingrédients et de constituants peut figurer dans la liste d’ingrédients sous le nom usuel indiqué dans ce document.
(4) Malgré le paragraphe (2) et le paragraphe B.01.008.2(5), lorsqu’un aliment contient des ingrédients de la même catégorie, ceux-ci peuvent être indiqués par un nom de catégorie si :
a) ils sont formés de plus d’un constituant et ne sont pas énumérés au tableau du paragraphe B.01.009(1); et
b) leurs constituants sont indiqués
(i) immédiatement après le nom de catégorie des ingrédients dont ils sont des constituants de manière à indiquer qu’ils sont des constituants de ces ingrédients, et
(ii) par ordre décroissant de leur proportion collective, en poids, dans ces ingrédients.
- DORS/79-23, art. 7 et 8(F)
- DORS/79-529, art. 3
- DORS/80-632, art. 1
- DORS/84-300, art. 4(A) et 5(F)
- DORS/91-124, art. 2
- DORS/92-626, art. 9
- DORS/92-725, art. 1
- DORS/93-243, art. 2(F)
- DORS/93-465, art. 2
- DORS/95-548, art. 5(F)
- DORS/97-516, art. 1
- DORS/98-458, art. 1 et 7(F) DORS/2005-98, art. 7
- DORS/2007-302, art. 4(F)
- DORS/2011-28, art. 3
- DORS/2016-305, art. 6
- DORS/2021-46, art. 3(A)
- DORS/2022-143, art. 9
B.01.010.1 (1) Les définitions ci-après s’appliquent au présent article et aux articles B.01.010.2 à B.01.010.4.
- allergène alimentaire
allergène alimentaire Toute protéine provenant d’un des aliments ci-après, ou toute protéine modifiée –– y compris toute fraction protéique — qui est dérivée d’un tel aliment :
a) amandes, noix du Brésil, noix de cajou, noisettes, noix de macadamia, pacanes, pignons, pistaches ou noix;
b) arachides;
c) graines de sésame;
d) blé ou triticale;
e) oeufs;
f) lait;
g) soja;
h) crustacés;
i) mollusques;
j) poissons;
k) graines de moutarde. (food allergen)
- gluten
gluten
a) Toute protéine de gluten provenant des grains d’une des céréales ci-après ou des grains d’une lignée hybride issue d’au moins une de ces céréales :
(i) orge,
(ii) avoine,
(iii) seigle,
(iv) triticale,
(v) blé;
b) toute protéine de gluten modifiée — y compris toute fraction protéique de gluten — qui est dérivée des grains d’une des céréales mentionnées à l’alinéa a) ou des grains d’une lignée hybride qui est visée à cet alinéa. (gluten)
- hauteur
hauteur En ce qui a trait aux caractères, la hauteur de la lettre minuscule « x ». (height)
- mention des sources d’allergènes alimentaires ou de gluten et des sulfites ajoutés
mention des sources d’allergènes alimentaires ou de gluten et des sulfites ajoutés Toute mention figurant sur l’étiquette d’un produit préemballé qui indique les sources d’allergènes alimentaires ou de gluten présentes dans le produit et les sulfites qui y sont ajoutés et présents dans une quantité totale égale ou supérieure à 10 p.p.m. (food allergen source, gluten source and added sulphites statement)
(2) Dans le cas où un allergène alimentaire ou du gluten est présent dans un produit préemballé, la source de l’allergène alimentaire ou de gluten, selon le cas, figure sur l’étiquette du produit :
a) soit dans la liste des ingrédients;
b) soit sous la mention des sources d’allergènes alimentaires ou de gluten et des sulfites ajoutés.
(3) Le paragraphe (2) ne s’applique pas à l’allergène alimentaire ou au gluten présent dans un produit préemballé par suite de contamination croisée.
(4) Le paragraphe (2) ne s’applique pas à l’allergène alimentaire ou au gluten présent dans un produit préemballé visé à l’un des alinéas B.01.008(2)a) à e), sauf si l’étiquette d’un tel produit porte une liste des ingrédients.
(5) [Abrogé, DORS/2019-98, art. 1]
(6) La source de l’allergène alimentaire devant figurer en application du paragraphe (2) est indiquée :
a) s’agissant d’un allergène alimentaire provenant d’un aliment mentionné à l’un des alinéas a), b) et e) de la définition de allergène alimentaire, au paragraphe (1), ou dérivé d’un tel aliment, par le nom de l’aliment tel qu’il est indiqué à l’alinéa applicable, écrit au singulier ou au pluriel;
b) s’agissant d’un allergène alimentaire provenant de l’aliment mentionné à l’alinéa c) de la même définition ou dérivé d’un tel aliment, par le nom « sésame », « graine de sésame » ou « graines de sésame »;
c) s’agissant d’un allergène alimentaire provenant d’un aliment mentionné à l’un des alinéas d) et f) de la même définition ou dérivé d’un tel aliment, par le nom de l’aliment tel qu’il est indiqué à l’alinéa applicable;
d) s’agissant d’un allergène alimentaire provenant de l’aliment mentionné à l’alinéa g) de la même définition ou dérivé d’un tel aliment, par le nom « soja » ou « soya »;
e) s’agissant d’un allergène alimentaire provenant d’un aliment mentionné à l’un des alinéas h) à j) de la même définition ou dérivé d’un tel aliment, par le nom usuel de l’aliment indiqué dans le document sur les noms usuels d’ingrédients et de constituants;
f) s’agissant d’un allergène alimentaire provenant de l’aliment mentionné à l’alinéa k) de la même définition ou dérivé d’un tel aliment, par le nom « moutarde », « graine de moutarde » ou « graines de moutarde ».
(7) La source de gluten devant figurer en application du paragraphe (2) est indiquée :
a) s’agissant du gluten provenant de grains d’une céréale mentionnée à l’un des sous-alinéas a)(i) à (v) de la définition de gluten, au paragraphe (1), ou dérivé de tels grains, par le nom de la céréale tel qu’il est indiqué au sous-alinéa applicable;
b) s’agissant du gluten provenant de grains d’une lignée hybride issue d’une ou de plusieurs céréales mentionnées aux sous-alinéas a)(i) à (v) de la même définition, ou dérivé de tels grains, par le nom de la ou des céréales tel qu’il est indiqué aux sous-alinéas applicables.
(8) Pour l’application de l’alinéa (2)a), la source de l’allergène alimentaire ou de gluten figure dans la liste des ingrédients entre parenthèses :
a) immédiatement à la suite de l’ingrédient qui figure dans la liste des ingrédients si l’allergène alimentaire ou le gluten :
(i) est cet ingrédient,
(ii) est présent dans cet ingrédient mais n’en est pas un constituant ni n’est présent dans un de ses constituants,
(iii) est un constituant de cet ingrédient, ou est présent dans un tel constituant, et le constituant ne figure pas dans la liste des ingrédients;
b) immédiatement à la suite du constituant qui figure dans la liste des ingrédients si l’allergène alimentaire ou le gluten est ce constituant ou s’il est présent dans celui-ci.
(9) Malgré le paragraphe (2), la source de l’allergène alimentaire ou de gluten figure sur l’étiquette du produit sous la mention des sources d’allergènes alimentaires ou de gluten et des sulfites ajoutés si l’allergène alimentaire ou le gluten est, selon le cas :
a) un ingrédient qui ne figure pas dans la liste des ingrédients, ou est présent dans un tel ingrédient mais n’en n’est pas un constituant ni n’est présent dans un de ses constituants;
b) un constituant ou est présent dans un constituant et ni le constituant ni l’ingrédient dans lequel il est présent ne figurent dans la liste des ingrédients.
(10) Malgré le paragraphe (8), la source de l’allergène alimentaire ou du gluten n’a pas à figurer entre parenthèses immédiatement à la suite de l’ingrédient ou du constituant, selon le cas, si elle figure à l’un ou l’autre des endroits suivants :
a) dans la liste des ingrédients :
(i) soit comme partie du nom usuel de l’ingrédient ou du constituant,
(ii) soit entre parenthèses, immédiatement à la suite d’un autre ingrédient ou constituant, conformément au paragraphe (8);
b) sous la mention des sources d’allergènes alimentaires ou de gluten et des sulfites ajoutés.
(11) Il est entendu que le paragraphe (8) est sans effet sur la façon dont les ingrédients ou constituants peuvent être indiqués dans la liste des ingrédients en vertu de l’alinéa B.01.010(3)b).
- DORS/2011-28, art. 4
- DORS/2016-305, art. 7 et 72
- DORS/2019-98, art. 1
- DORS/2021-46, art. 4(A)
- DORS/2022-143, art. 10
- DORS/2022-168, art. 5
B.01.010.2 (1) Au présent article et à l’article B.01.010.3, sulfites s’entend des additifs alimentaires mentionnés dans le document sur les noms usuels d’ingrédients et de constituants qui sont présents dans un produit préemballé.
(2) Il est entendu que la définition de sulfites au paragraphe (1) ne vise que les sulfites dont la présence dans le produit préemballé est le résultat de leur ajout à celui-ci.
(3) Si des sulfites sont présents dans un produit préemballé en une quantité totale égale ou supérieure à 10 parties par million et qu’aucun n’a à être indiqué dans la liste des ingrédients en application des articles B.01.008 ou B.01.009, ils figurent sur l’étiquette du produit :
a) soit dans la liste des ingrédients;
b) soit sous la mention des sources d’allergènes alimentaires ou de gluten et des sulfites ajoutés, auquel cas les exigences du paragraphe B.01.010.3(1) doivent être respectées.
(4) Le paragraphe (3) ne s’applique pas aux sulfites présents dans les produits préemballés visés aux alinéas B.01.008(2)a) à e), sauf si l’étiquette de ces produits porte une liste des ingrédients.
(5) [Abrogé, DORS/2019-98, art. 2]
(6) Les sulfites devant figurer sur l’étiquette du produit en application du paragraphe (3) sont indiqués :
a) s’ils figurent dans la liste des ingrédients :
(i) soit par l’un des noms usuels « agents de sulfitage » ou « sulfites »,
(ii) soit individuellement, par celui des noms d’additifs alimentaires indiqué dans le document sur les noms usuels d’ingrédients et de constituants, sauf lorsqu’il s’agit d’un des noms « dithionite de sodium », « anhydride sulfureux » ou « acide sulfureux », auquel cas ce nom doit être suivi, entre parenthèses, par l’un des noms usuels « agents de sulfitage » ou « sulfites »;
b) s’ils figurent sous la mention des sources d’allergènes alimentaires ou de gluten et des sulfites ajoutés, par l’un des noms usuels « agents de sulfitage » ou « sulfites ».
(7) Les sulfites figurant dans la liste des ingrédients en application de l’alinéa (6)a) sont indiqués :
a) s’ils sont des constituants d’un ingrédient figurant dans la liste des ingrédients, soit entre parenthèses immédiatement à la suite de l’ingrédient, soit à la fin de la liste des ingrédients où ils peuvent figurer dans n’importe quel ordre avec les autres ingrédients indiqués à la fin de la liste des ingrédients aux termes du paragraphe B.01.008.2(4);
b) dans les autres cas, à la fin de la liste des ingrédients où ils peuvent figurer dans n’importe quel ordre avec les autres ingrédients indiqués à la fin de la liste des ingrédients aux termes du paragraphe B.01.008.2(4).
(8) Si des sulfites sont présents dans un produit préemballé en une quantité totale égale ou supérieure à 10 parties par million et qu’un ou plusieurs d’entre eux, d’une part, doivent figurer dans la liste des ingrédients en application des articles B.01.008 ou B.01.009 et, d’autre part, y sont désignés individuellement par celui des noms « dithionite de sodium », « anhydride sulfureux » ou « acide sulfureux » qui s’applique, ce nom doit être suivi, entre parenthèses, de l’un des noms usuels « agents de sulfitage » ou « sulfites ».
(9) Si la quantité totale de sulfites présents dans le produit préemballé est égale ou supérieure à 10 parties par million, les sulfites qui doivent figurer dans la liste des ingrédients en application des articles B.01.008 ou B.01.009 peuvent en plus figurer sur l’étiquette du produit sous la mention des sources d’allergènes alimentaires ou de gluten et des sulfites ajoutés, auquel cas les exigences du paragraphe B.01.010.3(1) doivent être respectées.
(10) Malgré le sous-alinéa (6)a)(ii) et le paragraphe (8), si des sulfites sont désignés individuellement dans la liste des ingrédients par l’un des noms « dithionite de sodium », « anhydride sulfureux » ou « acide sulfureux », ce nom n’a pas à être suivi, entre parenthèses, de l’un des noms usuels « agents de sulfitage » ou « sulfites » si, selon le cas :
a) dans la liste des ingrédients :
(i) la mention « sulfite » figure dans le nom usuel d’un autre sulfite,
(ii) l’un des noms usuels « agents de sulfitage » ou « sulfites » figure entre parenthèses à la suite d’un autre sulfite;
b) sous la mention des sources d’allergènes alimentaires ou de gluten et des sulfites ajoutés, l’un des noms usuels « agents de sulfitage » ou « sulfites » figure sur l’étiquette du produit.
- DORS/2011-28, art. 4
- DORS/2016-305, art. 8 et 72
- DORS/2019-98, art. 2
- DORS/2022-143, art. 11
- DORS/2022-168, art. 6
B.01.010.3 (1) La mention des sources d’allergènes alimentaires ou de gluten et des sulfites ajoutés satisfait aux exigences suivantes :
a) elle débute par un titre conforme aux précisions suivantes :
(i) il est formé des mots suivants :
(A) s’agissant de la version française de cette mention, « Contient », « Contient : » ou « Contient : »,
(B) s’agissant de la version anglaise de cette même mention, « Contains », « Contains: » ou « Contains : »,
(ii) il est en caractères gras,
(iii) il figure sans qu’aucun texte imprimé ou écrit ni aucun signe graphique ne soit intercalé entre lui et le reste de la mention,
(iv) si elle est précédée d’une mention visée au paragraphe B.01.014(1) et si elle débute sur la ligne où se termine cette mention, il est présenté en caractères d’une hauteur plus grande d’au moins 0,2 mm que celle des caractères utilisés dans cette autre mention;
a.1) elle suit immédiatement, pour chaque version linguistique, toute mention visée au paragraphe B.01.014(1) qui figure dans la même langue ou, à défaut, la liste des ingrédients qui figure dans la même langue, et, dans les deux cas, sans qu’aucun texte imprimé ou écrit ni aucun signe graphique ne soit intercalé;
a.2) elle est présentée sur le même espace continu que la mention ou la liste qui la précède immédiatement et de la même manière que la liste des ingrédients, conformément au paragraphe B.01.008.2(2);
b) elle inclut tous les renseignements ci-après, que l’un ou plusieurs d’entre eux figurent ou non dans la liste des ingrédients :
(i) la source de chacun des allergènes alimentaires présents dans le produit préemballé,
(ii) chacune des sources de gluten présent dans le produit,
(iii) l’un des noms usuels « agents de sulfitage » ou « sulfites », si la quantité totale de sulfites présents dans le produit est égale ou supérieure à 10 parties par million;
c) elle indique les renseignements en caractères ordinaires ou gras, en lettres minuscules, sauf pour la première lettre de chacun des renseignements qui est majuscule, chacun des renseignements étant séparé des autres par une puce ou une virgule.
(2) Malgré l’alinéa (1)b), les renseignements ci-après n’ont à figurer qu’une seule fois sous la mention applicable :
a) une même source d’allergène alimentaire;
b) une même source de gluten;
c) l’un des noms usuels « agents de sulfitage » ou « sulfites ».
(3) Lorsque les versions anglaise et française de la mention sont présentées sur un même espace continu de l’étiquette, celle des versions qui suit l’autre ne doit pas débuter sur la même ligne que celle où se termine cette autre version, sauf s’il s’agit d’un produit préemballé dont la surface exposée disponible est de moins de 100 cm2.
- DORS/2011-28, art. 4
- DORS/2016-305, art. 9
- DORS/2022-168, art. 7
B.01.010.4 (1) Si l’étiquette du produit préemballé porte un énoncé visant à signaler au consommateur la présence possible, dans le produit, d’une source d’allergène alimentaire ou de gluten en raison d’un risque de contamination croisée, l’énoncé doit satisfaire aux exigences suivantes :
a) il suit immédiatement :
(i) la mention des sources d’allergènes alimentaires ou de gluten et des sulfites ajoutés, le cas échéant,
(ii) toute mention visée au paragraphe B.01.014(1), si l’étiquette ne contient pas de mention des sources d’allergènes alimentaires ou de gluten et des sulfites ajoutés,
(iii) la liste des ingrédients, si l’étiquette ne contient aucune des mentions visées au sous-alinéa (ii);
b) il est présenté en français et en anglais, si la mention ou la liste qui le précède immédiatement figure dans les deux langues;
c) il est présenté sur le même espace continu que la mention ou la liste qui le précède immédiatement, et de la même manière que la liste des ingrédients, conformément au paragraphe B.01.008.2(2);
d) il figure sans qu’aucun texte imprimé ou écrit ni aucun signe graphique ne soit intercalé entre lui et la mention ou la liste qui le précède immédiatement, à l’exception d’une ligne continue pouvant figurer avant lui s’il débute sur une ligne distincte de celle où se termine la mention ou la liste;
e) il est en caractères gras, s’il débute sur la ligne où se termine la mention ou la liste qui le précède immédiatement et s’il ne débute pas par un titre;
f) s’il débute par un titre, celui-ci figure en caractères gras si l’énoncé débute sur la ligne où se termine la mention ou la liste qui le précède immédiatement;
g) s’il est précédé d’une mention visée au paragraphe B.01.014(1) et s’il débute sur la ligne où se termine cette mention, son titre ou, à défaut, l’énoncé lui-même est en caractères d’une hauteur plus grande d’au moins 0,2 mm que celle des caractères utilisés dans cette mention.
(2) Lorsque les versions française et anglaise de l’énoncé sont présentées sur un même espace continu de l’étiquette, celle des versions qui suit l’autre ne peut débuter sur la ligne où se termine cette autre version, sauf s’il s’agit d’un produit préemballé dont la surface exposée disponible est de moins de 100 cm2.
- DORS/2016-305, art. 10
- DORS/2022-168, art. 8
B.01.011 (1) Lorsqu’il est reconnu comme une pratique industrielle acceptable pour un fabricant
a) de ne pas inclure dans un produit préemballé un aliment qui est normalement un ingrédient ou constituant de son produit préemballé, ou
b) de remplacer en tout ou en partie un aliment qui est normalement un ingrédient ou constituant de son produit préemballé par un autre aliment,
la liste des ingrédients, pour la période de 12 mois à partir du moment où l’étiquette est apposée sur le produit préemballé, peut indiquer comme ingrédients ou constituants les aliments qui peuvent être omis et les aliments utilisables comme aliments de substitution
c) si tous les aliments utilisables comme ingrédients ou constituants pendant toute la période de 12 mois sont compris dans la liste d’ingrédients;
d) s’il est clairement énoncé dans la liste d’ingrédients que l’aliment indiqué comme ingrédient ou constituant peut être omis du produit préemballé ou qu’un autre aliment peut être substitué à l’aliment figurant comme ingrédient ou constituant; et
e) si les aliments qui peuvent être omis ou remplacés sont groupés avec la même catégorie d’aliments utilisés comme ingrédients ou constituants, et si les aliments compris dans chacun de ces groupes sont énumérés dans l’ordre décroissant de leurs proportions respectives, en poids, dans lesquelles ils seront probablement utilisés au cours de la période de 12 mois.
(2) Lorsqu’il est reconnu comme une pratique industrielle acceptable pour un fabricant de varier les proportions des ingrédients ou constituants dans un produit préemballé, la liste d’ingrédients, pour la période de 12 mois à compter du moment où l’étiquette est apposée sur le produit préemballé, peut indiquer les ingrédients ou constituants dans les mêmes proportions pendant toute la période de 12 mois
a) s’il est clairement énoncé dans la liste d’ingrédients que les proportions indiquées sont susceptibles de modification; et
b) si les ingrédients ou constituants sont indiqués dans l’ordre décroissant de leurs proportions respectives, en poids, dans lesquelles ils seront probablement utilisés au cours de la période de 12 mois.
B.01.012 (1) Dans le présent article,
- aliment spécial
aliment spécial Aliment — autre qu’un fortifiant pour lait humain ou un aliment supplémenté — qui est :
a) soit un aliment ayant un caractère religieux particulier et utilisé pour les cérémonies religieuses;
b) soit un aliment importé dont, à la fois :
(i) l’usage n’est pas largement répandu chez la population du Canada en général,
(ii) il n’existe aucun succédané facilement accessible, qui soit fabriqué, transformé, produit ou emballé au Canada et qui soit généralement reconnu comme un succédané valable; (specialty food)
- collectivité locale
collectivité locale désigne une cité, un territoire d’un gouvernement métropolitain, une ville, un village, une municipalité ou tout autre territoire d’un gouvernement local mais ne comprend pas une collectivité locale située dans un district bilingue établi sous le régime de la Loi sur les langues officielles; (local government unit)
- langue maternelle
langue maternelle désigne la première langue qu’ont apprise dans leur enfance des personnes vivant dans une région du Canada et qu’elles comprennent encore, tel qu’il a été établi par le dernier recensement décennal qui a précédé la date à laquelle l’aliment visé au paragraphe (3) est vendu au consommateur; (mother tongue)
- langues officielles
langues officielles désigne la langue française et la langue anglaise; (official languages)
- produit alimentaire d’essai
produit alimentaire d’essai désigne un aliment qui, avant la date de l’avis d’intention concernant cet aliment et dont il est question au paragraphe (5), n’était pas vendu au Canada et qui diffère considérablement de tout autre aliment vendu au Canada par sa composition, sa fonction, son état ou la forme de son emballage, et comprend un aliment visé à l’article B.01.054; (test market food)
- produit alimentaire local
produit alimentaire local désigne un aliment qui est fabriqué, transformé, produit ou emballé dans une collectivité locale et vendu seulement
a) dans la collectivité locale où il est fabriqué, transformé, produit ou emballé,
b) dans une ou plusieurs collectivités locales situées dans le voisinage immédiat de la collectivité où il est fabriqué, transformé, produit ou emballé, ou
c) dans la collectivité locale où il est fabriqué, transformé, produit ou emballé et dans une ou plusieurs collectivités locales situées dans le voisinage immédiat de ladite collectivité. (local food)
(2) Sous réserve des paragraphes (9), (10) et (11), tous les renseignements devant être indiqués sur l’étiquette d’un aliment en vertu du présent règlement doivent l’être dans les deux langues officielles.
(3) Sous réserve des paragraphes (4) à (6), un produit alimentaire local ou un produit alimentaire d’essai est exempté de l’application des dispositions du paragraphe (2)
a) s’il est vendu dans une collectivité locale où l’une des langues officielles est la langue maternelle de moins de 10 pour cent de la population résidente de la collectivité locale; et
b) si les renseignements devant figurer sur l’étiquette d’un aliment aux termes du présent règlement sont indiqués dans la langue officielle qui est la langue maternelle d’au moins 10 pour cent de la population résidente de la collectivité locale.
(4) Lorsqu’une des langues officielles est la langue maternelle de moins de 10 pour cent de la population résidente de la collectivité locale et que l’autre langue officielle est la langue maternelle de moins de 10 pour cent de la population résidente de la même collectivité locale, le paragraphe (3) ne s’applique pas.
(5) Le paragraphe (3) ne s’applique pas à un produit alimentaire d’essai, sauf si la personne qui a l’intention de sonder le marché du produit a déposé, auprès du président de l’Agence canadienne d’inspection des aliments, six semaines avant de sonder le marché, un avis d’intention établi en une forme que celui-ci juge acceptable.
(6) Aux fins de l’application du paragraphe (3), un produit alimentaire d’essai cesse d’en être un à la fin d’une période de 12 mois après la date à laquelle il a été pour la première fois offert en vente à titre de produit d’essai, mais un produit alimentaire d’essai acheté pour la revente par une autre personne que celle qui a déposé l’avis d’intention dont il est question au paragraphe (5), avant la fin de ladite période demeure un produit d’essai aux fins du paragraphe (3) jusqu’à ce qu’il soit vendu à un consommateur.
(7) Un produit alimentaire spécial est exempté de l’application du paragraphe (2) si les renseignements devant figurer sur son étiquette selon ce règlement sont indiqués dans l’une des langues officielles.
(8) Lorsque l’étiquette d’un produit préemballé comporte une ou plusieurs surfaces qui sont de même dimension et de même importance que l’espace principal, les renseignements devant figurer dans l’espace principal, aux termes du présent règlement peuvent y figurer dans une langue officielle seulement s’ils figurent dans l’autre langue officielle sur l’une des autres surfaces.
(9) Le paragraphe (2) ne s’applique pas au nom et au principal établissement de la personne par ou pour qui l’aliment a été fabriqué, transformé, produit ou emballé pour la revente si ces renseignements sont indiqués dans l’une des langues officielles.
(10) Le paragraphe (2) ne s’applique pas aux noms usuels suivants si un de ceux-ci est indiqué de la manière suivante sur l’espace principal :
- Scotch Whisky
- Irish Whisky
- Highland Whisky
- Dry Gin
- Bourbon
- Tennessee Whisky
- Tequila
- Mezcal
- Rye Whisky
- Crème de Menthe
- Crème de Cacao
- Crème de Cassis
- Crème de Banane
- Triple Sec
- Anisette
- Crème de Noyau
- Brandy
- Sake or Saki
- Advocaat or Advokaat
- Kirsch
- Slivovitz
- Ouzo
- Cherry Brandy Liqueur
- Kummel
- Akvavit
- Aquavit
- Armagnac
- Marc
- Grappa
- Calvados
- Poire William
- Crème de Bleuets
- Curaçao Orange
- Liqueur de Fraise
- Mandarinette
- Prunelle de Bourgogne
- Chartreuse
- Pastis
- Fior d’Alpe
- Strega
- Campari
- Americano
- Apricot Brandy Liqueur
- Peach Brandy Liqueur
- Sloe Gin
- Manhattan
- Martini
(11) Le paragraphe (2) ne s’applique pas à l’étiquette d’un contenant d’expédition destiné à une entreprise commerciale ou industrielle ou une institution si :
a) le contenant d’expédition et son contenu ne sont pas revendus comme produit préemballé individuel à un consommateur au niveau du commerce de détail; et
b) tous les renseignements devant être indiqués sur l’étiquette d’un aliment en vertu du présent règlement le sont dans l’une des langues officielles.
- DORS/79-23, art. 9
- DORS/79-529, art. 4
- DORS/84-300, art. 6
- DORS/93-603, art. 1
- DORS/95-548, art. 5
- DORS/2000-184, art. 62
- DORS/2016-305, art. 11
- DORS/2021-57, art. 6
- DORS/2022-169, art. 7
B.01.013 (1) Sauf disposition contraire de la Loi ou du présent règlement, il est interdit de faire mention, directement ou indirectement, de la Loi ou du présent règlement sur l’étiquette ou dans l’annonce d’un aliment.
(2) Par dérogation au paragraphe (1), l’étiquette ou l’annonce d’un aliment peut contenir une mention indiquant que l’aliment est « conforme à la norme établie dans le Règlement sur les aliments et drogues pour (nom usuel de l’aliment visé) », si l’aliment satisfait à la norme applicable établie par le présent règlement et si le fabricant de l’aliment le prouve à l’aide des résultats d’essais effectués avant l’inscription de la mention ou le justifie par toute autre preuve existant avant cette inscription.
- DORS/92-626, art. 10
- DORS/95-548, art. 5(F)
B.01.014 (1) L’étiquette d’un aliment qui contient de l’aspartame porte une mention à l’intention des personnes atteintes de la phénylcétonurie indiquant que l’aliment contient de la phénylalanine ou une mention indiquant que l’aspartame contient de la phénylalanine.
(2) Toute mention satisfait aux exigences suivantes :
a) elle est en caractères gras;
b) elle suit immédiatement, pour chaque version linguistique, la liste des ingrédients qui figure dans la même langue, sur la même ligne que le dernier ingrédient ou sur la suivante, sans qu’aucun texte écrit ou imprimé ni aucun signe graphique ne soit intercalé;
c) elle est présentée sur le même espace continu que la liste des ingrédients et de la même manière que cette liste, conformément au paragraphe B.01.008.2(2).
- DORS/81-617, art. 2
- DORS/88-559, art. 5
- DORS/2003-11, art. 6
- DORS/2016-305, art. 75(F)
- DORS/2018-108, art. 400
- DORS/2022-168, art. 9
B.01.015 [Abrogé, DORS/2022-168, art. 9]
B.01.016 [Abrogé, DORS/2022-168, art. 9]
B.01.017 [Abrogé, DORS/2022-168, art. 9]
B.01.018 L’étiquette d’un aliment qui contient du polydextrose en indique la teneur, exprimée en grammes, par portion indiquée.
- DORS/93-276, art. 2
- DORS/94-779, art. 1
- DORS/97-512, art. 1
- DORS/2003-11, art. 10
- DORS/2016-305, art. 75(F)
B.01.019 [Abrogé, DORS/2022-168, art. 10]
B.01.020 [Abrogé, DORS/2022-168, art. 10]
B.01.021 (1) À moins qu’elle ne porte un tableau de la valeur nutritive ou un tableau des renseignements sur les aliments supplémentés, l’étiquette d’un aliment qui contient de l’érythritol doit porter une mention indiquant la teneur en érythritol de l’aliment, exprimée en grammes, par portion indiquée.
(2) La mention indiquant la teneur en érythritol et celle indiquant la teneur en tout autre polyalcool et en polydextrose doivent être regroupées.
- DORS/2004-261, art. 1
- DORS/2016-305, art. 75(F)
- DORS/2022-169, art. 8
B.01.022 [Abrogé, DORS/2022-168, art. 11]
B.01.023 L’étiquette d’un aliment qui est un édulcorant de table contenant de l’aspartame, du sucralose, de l’acésulfame-potassium ou du néotame comprend une mention sur le pouvoir édulcorant d’une portion exprimée en fonction de la quantité de sucre requise pour produire un degré d’édulcoration équivalent.
- DORS/2007-176, art. 4
- DORS/2016-305, art. 75(F)
- DORS/2018-108, art. 400
- DORS/2022-168, art. 11
B.01.033 (1) À l’exception d’une préparation pour régime liquide, d’un fortifiant pour lait humain et d’un succédané de lait humain, il est interdit de vendre un aliment représenté de quelque manière que ce soit comme contenant du collagène, de la gélatine ou de la caséine, totalement ou partiellement hydrolysés, à moins que son étiquette ne porte sur l’espace principal, en caractères de même dimension que le nom usuel, la mention :
« ATTENTION À NE PAS UTILISER COMME SOURCE UNIQUE D’ALIMENTATION ».
(2) On entend par préparation pour régime liquide un aliment visé aux articles B.24.101 à B.24.103.
- DORS/78-65, art. 1
- DORS/2021-57, art. 7
B.01.034 [Abrogé, DORS/88-559, art. 7]
B.01.035 (1) Sous réserve du paragraphe (8), dans le cas d’un aliment irradié visé à la colonne 1 du tableau du titre 26 qui est un produit préemballé offert en vente, l’espace principal de l’étiquette apposée sur l’emballage doit porter le symbole prévu au paragraphe (5).
(2) Dans le cas d’un aliment irradié visé à la colonne 1 du tableau du titre 26, autre qu’un produit préemballé, qui est offert pour la vente, un écriteau portant le symbole prévu au paragraphe (5) doit être placé à côté de l’aliment.
(3) Le symbole devant, selon les paragraphes (1) ou (2), figurer sur l’espace principal de l’étiquette ou sur un écriteau doit être accompagné de l’une des mentions suivantes ou d’une mention ayant le même sens :
a) « traité par radiation »;
b) « traité par irradiation »;
c) « irradié ».
(4) Il est interdit de vendre un aliment visé à la colonne 1 du tableau du titre 26 qui a été irradié de la façon prévue au paragraphe B.26.003(2) à moins que les exigences des paragraphes (1) à (3) ne soient respectées.
(5) Pour l’application des paragraphes (1) à (3), le symbole désignant l’aliment irradié doit :
a) avoir un diamètre extérieur :
(i) dans le cas visé au paragraphe (1), égal ou supérieur à la hauteur des données numériques de la déclaration de quantité nette visée à l’alinéa 229(1)a) et les paragraphes 229(2) et (3) du Règlement sur la salubrité des aliments au Canada,
(ii) dans le cas visé au paragraphe (2), d’au moins 5 cm;
b) revêtir la forme suivante :

(6) Nonobstant le paragraphe B.01.009(1), tout aliment visé à la colonne 1 du tableau du titre 26 qui sert d’ingrédient ou de constituant dans un produit préemballé et qui a été irradié doit, s’il représente 10 pour cent ou plus de ce produit, figurer dans la liste des ingrédients avec la mention « irradié ».
(7) L’étiquette apposée sur le contenant d’expédition de tout aliment visé à la colonne 1 du tableau du titre 26 et irradié selon la dose absorbée maximale prévue à la colonne 5 de ce tableau doit porter la mention exigée par le paragraphe (3) ainsi que la mention « Ne pas irradier de nouveau. ».
(8) Dans le cas où le contenant d’expédition constitue l’emballage du produit préemballé, l’étiquette qui y est apposée doit porter les mentions visées au paragraphe (7); le symbole prévu au paragraphe (5) n’est pas obligatoire.
(9) Toute annonce concernant un aliment irradié visé à la colonne 1 du tableau du titre 26 doit indiquer que cet aliment a été irradié.
(10) Les mentions visées aux paragraphes (3) et (6) à (8) doivent figurer dans les deux langues officielles, conformément au paragraphe B.01.012(2).
- DORS/89-172, art. 1
- DORS/2017-16, art. 1
- DORS/2018-108, art. 400
B.01.037 [Abrogé, DORS/88-559, art. 8]
B.01.040 [Abrogé, DORS/88-559, art. 9]
B.01.042 Lorsque la présente partie prescrit une norme pour un aliment,
a) l’aliment ne doit renfermer que les ingrédients nommés dans la norme pour cet aliment;
b) chacun des ingrédients doit être incorporé dans les limites de quantités, s’il en est, fixées pour tel ingrédient; et
c) l’ingrédient, si la norme comprend un ingrédient qui peut s’utiliser comme additif alimentaire à une fin particulière, doit être un additif alimentaire nommé à l’un des tableaux de l’article B.16.100 comme additif alimentaire utilisable dans cet aliment et à cette fin particulière.
B.01.043 Sous réserve de l’article B.25.062, lorsque la présente partie ne prévoit pas de norme pour un aliment :
a) l’aliment ne doit renfermer aucun additif alimentaire autre que les additifs alimentaires nommés à l’un des tableaux de l’article B.16.100, comme additifs utilisables dans ledit aliment aux fins précisées audit tableau; et
b) chacun desdits additifs alimentaires doit être incorporé dans l’aliment en quantité telle qu’il reste dans les limites, s’il en est, fixées pour cet aliment et pour cet additif alimentaire audit tableau.
- DORS/87-640, art. 1
B.01.044 Lorsque la limite de tolérance d’un additif alimentaire à tout tableau de l’article B.16.100 est fixée par les mots « Bonnes pratiques industrielles », la quantité d’additif alimentaire, ajoutée à l’aliment en cours de fabrication et de conditionnement, ne doit pas dépasser la quantité requise pour arriver aux fins pour lesquelles l’additif est autorisé pour ledit aliment.
B.01.045 Un additif alimentaire doit,
a) lorsque des spécifications sont énoncées pour cet additif dans la présente partie, répondre à ces spécifications;
b) lorsqu’aucune spécification n’est prévue pour cet additif dans la présente partie, mais que l’une des publications ci-après en prévoit, satisfaire à ces spécifications :
(i) la publication de la United States Pharmacopeial Convention, Rockville, MD, États-Unis, intitulée Food Chemicals Codex, dixième édition, publiée en 2016, ou toute édition subséquente — y compris leurs suppléments —, avec leurs modifications successives,
(ii) la publication de l’Organisation des Nations Unies pour l’alimentation et l’agriculture, préparée par le Comité mixte FAO/OMS d’experts des additifs alimentaires, et intitulée Répertoire des normes pour les additifs alimentaires, publiée sur le site Web de l’organisation, avec ses modifications successives;
c) dans le cas d’un colorant alimentaire pour lequel aucune spécification n’est prévue aux termes des alinéas a) ou b), renfermer au plus :
(i) trois parties par million d’arsenic,
(ii) dix parties par million de plomb.
d) [Abrogé, DORS/2010-142, art. 1]
e) [Abrogé, DORS/97-512, art. 2]
f) [Abrogé, DORS/2016-305, art. 12]
g) [Abrogé, DORS/97-512, art. 2]
- DORS/82-383, art. 1
- DORS/91-527, art. 3
- DORS/92-93, art. 1
- DORS/92-551, art. 1
- DORS/93-276, art. 3
- DORS/94-625, art. 4
- DORS/94-779, art. 2
- DORS/95-172, art. 2
- DORS/97-512, art. 2
- DORS/2010-142, art. 1
- DORS/2016-305, art. 12
B.01.046 [Abrogé, DORS/2016-74, art. 2]
B.01.047 [Abrogé, DORS/2016-74, art. 2]
B.01.047.1 (1) Les définitions qui suivent s’appliquent au présent article.
- ESB
ESB Encéphalopathie spongiforme bovine. (BSE)
- matériel à risque spécifié
matériel à risque spécifié S’entend de ce qui suit :
a) le crâne, la cervelle, les ganglions trigéminés, les yeux, les amygdales, la moelle épinière et les ganglions de la racine dorsale des boeufs âgés de 30 mois ou plus;
b) l’iléon distal des boeufs de tous âges. (specified risk material)
(2) Il est interdit de vendre ou d’importer pour la vente tout aliment qui contient du matériel à risque spécifié.
(3) Le paragraphe (2) ne s’applique pas à l’égard de l’aliment qui provient d’un pays désigné comme exempt d’ESB en conformité avec l’article 7 du Règlement sur la santé des animaux.
(4) Le paragraphe (2) ne s’applique pas à l’égard de l’aliment emballé pour la vente ou importé pour la vente avant l’entrée en vigueur du présent paragraphe.
- DORS/2003-265, art. 1
B.01.048 (1) Il est interdit de vendre :
a) des animaux qui sont destinés à être consommés comme aliments et auxquels a été administré un produit contenant une drogue mentionnée au paragraphe (2);
b) des aliments qui proviennent d’un animal auquel a été administré un produit contenant une drogue mentionnée au paragraphe (2);
c) des aliments qui proviennent d’un animal s’ils contiennent des résidus d’une drogue mentionnée au paragraphe (2).
(2) Les drogues visées au paragraphe (1) sont :
a) le chloramphénicol, ses sels et ses dérivés;
b) un composé de 5-nitrofurane;
c) le clenbutérol, ses sels et ses dérivés;
d) un composé de 5-nitro-imidazole;
e) le diéthylstilbestrol et d’autres composés de stilbène.
- DORS/85-685, art. 1
- DORS/87-626, art. 1
- DORS/94-568, art. 1
- DORS/97-510, art. 1
- DORS/2003-292, art. 1
- DORS/2016-74, art. 3
B.01.049 Il est interdit d’employer sur l’étiquette ou l’emballage, dans la réclame ou pour la vente d’un produit alimentaire qui ne répond pas aux prescriptions du « kashruth » qui s’y applique, le mot « kascher » une lettre de l’alphabet hébreu ou tout autre mot, expression, illustration, signe, symbole, marque, véhicule ou autre représentation indiquant ou risquant de donner l’impression que ce produit est « kascher ».
- DORS/84-300, art. 8
B.01.050 Il est interdit d’employer sur l’étiquette ou l’emballage, dans la réclame ou pour la vente d’un produit alimentaire le mot « halal », une lettre de l’alphabet arabe ou tout autre mot, expression, illustration, signe, symbole, marque, véhicule ou autre représentation indiquant ou risquant de donner l’impression que ce produit est « halal », à moins d’indiquer sur l’étiquette ou l’emballage, dans la réclame ou dans le cadre de la vente, le nom de l’organisme ou de la personne qui a certifié que ce produit est « halal ».
- DORS/2014-76, art. 1
B.01.053 Il est interdit de vendre un produit présenté comme déjeuner prêt à manger ou déjeuner instantané, ou sous toute autre appellation semblable, à moins qu’il n’y ait dans chaque portion indiquée :
a) au moins 4,0 mg de fer;
b) de la vitamine A, de la thiamine, de la riboflavine, de la niacine ou de la niacinamide et de la vitamine C;
c) une bonne source alimentaire de protéines; et
d) si le produit est consommé de la façon indiquée, au moins 300 calories.
- DORS/2003-11, art. 13
- DORS/2016-305, art. 75(F)
B.01.054 (1) Afin de recueillir des renseignements à l’appui d’une modification au présent règlement, le ministre peut délivrer au fabricant ou au distributeur d’un aliment, lorsque l’aliment ou l’emballage, l’étiquetage ou l’annonce de celui-ci ne sont pas conformes aux exigences du présent règlement, une lettre d’autorisation de mise en marché temporaire permettant la vente, l’emballage, l’étiquetage ou l’annonce de l’aliment décrit dans la lettre pour une période déterminée, dans une région désignée, en quantité définie et de la manière précisée dans la lettre si
a) le fabricant ou le distributeur lui a fourni les renseignements suivants :
(i) la raison pour laquelle une autorisation de mise en marché temporaire de l’aliment est requise,
(ii) une description de l’aliment, y compris un échantillon et un projet d’étiquette,
(iii) une description de toute modification proposée aux exigences du présent règlement,
(iv) des données suffisantes à prouver que la consommation de l’aliment ne sera pas nuisible à la santé de l’acheteur ni à celle du consommateur,
(v) la quantité proposée d’aliment à vendre,
(vi) la période projetée qui est requise pour une telle vente,
(vii) la région proposée qui est désignée pour une telle vente, et
(viii) toutes les autres données que le ministre pourrait lui demander; et
b) le fabricant ou le distributeur de l’aliment a consenti
(i) à décrire l’aliment sur une étiquette ou dans une réclame d’une manière qui ne soit ni fausse, ni trompeuse, ni mensongère,
(ii) à se servir sur l’étiquette ou dans toute annonce des marques ou déclarations que le ministre pourrait exiger,
(iii) à faire part au ministre, sur demande, des résultats de la mise en marché temporaire, et
(iv) à retirer le produit du marché, sur demande, si de l’avis du ministre, il est de l’intérêt public de le faire.
(2) Le ministre doit, dans toute lettre d’autorisation de mise en marché temporaire délivrée conformément au paragraphe (1), préciser
a) le nom usuel et une description de l’aliment qui doit être vendu;
b) le nom et l’adresse du fabricant ou du distributeur de l’aliment;
c) la raison pour laquelle la mise en marché temporaire de l’aliment est autorisée;
d) la quantité de l’aliment dont la vente est autorisée;
d.1) le genre d’emballage, d’étiquetage ou d’annonce autorisé à l’égard de l’aliment lorsque la lettre a pour objet d’autoriser une modification aux exigences du règlement traitant de l’emballage, de l’étiquetage ou de l’annonce;
e) la période où l’aliment peut être vendu; et
f) la région désignée dans laquelle l’aliment peut être vendu.
- DORS/81-566, art. 1
- DORS/85-275, art. 1
- DORS/2018-69, art. 27
B.01.055 (1) Le fabricant ou le distributeur mentionné dans une lettre d’autorisation de mise en marché temporaire délivrée conformément au paragraphe B.01.054(1) peut, aux fins visées dans la lettre, vendre, emballer, étiqueter ou annoncer l’aliment pour la période déterminée, dans la région désignée, en quantité définie et de la manière autorisée dans la lettre.
(2) L’aliment ou l’emballage, l’étiquetage ou l’annonce d’un aliment à l’égard desquels une lettre d’autorisation de mise en marché temporaire a été délivrée en application du paragraphe B.01.054(1) sont soustraits à l’application des dispositions du présent règlement prises en vertu de l’alinéa 30(1)b) de la Loi auxquelles ils ne sont pas conformes, s’ils respectent les modalités de la lettre d’autorisation.
- DORS/81-566, art. 1
- DORS/85-275, art. 2
- DORS/90-814, art. 4
B.01.056 [Abrogé, DORS/2016-74, art. 4]
B.01.060 à B.01.066 [Abrogés, DORS/88-559, art. 10]
B.01.070 [N]. Des noix mélangées ou un mélange de noix doivent être un mélange de noix qui comporte un pourcentage, en poids, d’au moins cinq pour cent de chaque type de noix.
B.01.071 Pour tout produit préemballé qui est un mélange de noix, le pourcentage et le nom usuel du type de noix prédominant en poids doivent figurer sur l’espace principal de l’emballage, à proximité du nom usuel du produit.
- DORS/88-336, art. 3
- DORS/92-626, art. 11
B.01.072 Par dérogation à toute autre disposition de la partie B, peut être qualifié de « fumé » tout produit alimentaire qui a été exposé à la chaleur en présence d’une solution de fumée liquide vaporisée et tirée du bois dur, de la sciure de bois dur ou des épis de maïs.
- DORS/92-626, art. 11
B.01.080 (1) Dans le présent article, congelés s’entend d’un produit conservé à la température de congélation et n’inclut pas une congélation de surface qui aurait pu se produire durant la manutention et le transport.
(2) Lorsque de la viande ou un de ses sous-produits, de la volaille ou un de ses sous-produits, du poisson ou de la chair de tout autre animal marin ou d’eau douce qui a été congelé est décongelé avant la vente, la mention « produit décongelé » doit figurer
a) sur l’espace principal de l’étiquette, à proximité du nom usuel du produit, et en lettres au moins aussi lisibles et en évidence que celles du nom usuel;
b) n’importe où sur l’espace principal de l’étiquette en lettres d’au moins 1/4 de pouce (6,4 millimètres) de hauteur; ou
c) sur un écriteau placé tout près du produit alimentaire, en lettres que tout acheteur éventuel peut voir et lire facilement.
(3) Lorsqu’une partie d’un produit alimentaire mentionné au paragraphe (2) a été congelée et décongelée avant la vente, la mention « Provenance : parties fraîches et congelées » ou « Provenance : parties de (d’) (nom du produit) fraîches et congelées » doit figurer à l’endroit précisé et comme il est indiqué à l’alinéa (2)a), b) ou c).
- DORS/88-336, art. 3
- DORS/2022-143, art. 13(A)
B.01.090 (1) Est interdite la mise en vente au détail de toute viande coupée solide ou de toute viande de volaille coupée solide à laquelle ont été ajoutés des sels de phosphate ou de l’eau, à moins que la viande ne soit contenue dans un emballage et ne porte une étiquette.
(2) L’étiquette visée au paragraphe (1) doit inclure une mention de la teneur minimale en protéines de la viande, incorporée au nom usuel du produit sur l’espace principal de l’emballage, en caractères aussi lisibles et visibles que tous les autres caractères figurant dans le même espace et de dimension au moins égale à la moitié de la taille des lettres utilisées pour le nom usuel du produit, sans être d’une hauteur inférieure à 1,6 mm.
- DORS/94-262, art. 1
B.01.091 L’étiquette de toute pièce de viande ou de toute pièce de viande de volaille à laquelle ont été ajoutés des sels de phosphate ou de l’eau, qui est non traitée par salaison et qui est préemballée chez le détaillant, indique les ingrédients de cet aliment conformément aux paragraphes B.01.008.2(1) à (5) et (7).
- DORS/94-262, art. 1
- DORS/2003-11, art. 14
- DORS/2016-305, art. 13
B.01.092 Les articles B.01.090 et B.01.091 ne s’appliquent pas au bacon de flanc, au bacon Wiltshire, aux bajoues de porc, ni au porc et au boeuf salés.
- DORS/94-262, art. 1
B.01.100 (1) Le nom usuel d’un simili-produit de viande ou d’un simili-produit de volaille est formé du nom usuel du produit de viande ou de volaille dont l’apparence est imitée, auquel s’ajoute le préfixe « simili ».
(2) Le préfixe « simili » mentionné au paragraphe (1) doit figurer en caractères au moins aussi gros et aussi en évidence que ceux du reste du nom usuel du simili-produit.
(3) Lorsqu’un simili-produit de viande ou un simili-produit de volaille n’est pas un produit préemballé, doivent être indiqués, en caractères lisibles, sur une inscription placée bien en évidence sur le produit ou à proximité, le nom usuel du produit et les autres renseignements qui, aux termes du présent article, doivent figurer sur l’étiquette d’un simili-produit de viande ou d’un simili-produit de volaille.
(4) La mention
a) « sans teneur en viande », dans le cas d’un simili-produit de viande, et
b) « sans teneur en volaille », dans le cas d’un simili-produit de volaille,
doit figurer sur l’espace principal de l’étiquette d’un simili-produit de viande ou d’un simili-produit de volaille à proximité du nom usuel et en caractères au moins aussi gros et aussi visibles que ceux du reste du nom usuel.
(5) à (7) [Abrogés, DORS/88-559, art. 11]
- DORS/88-336, art. 3
- DORS/88-559, art. 11
B.01.101 (1) Aux fins du présent article et de l’article B.01.102, source de protéines s’entend de tout aliment à teneur en protéines, à l’exclusion des produits suivants : épices, assaisonnements, parfums ou arômes, parfums ou arômes artificiels, exhausteurs de goût (substances qui rehaussent le goût), additifs alimentaires et produits analogues qui ne contiennent que de petites quantités de protéines.
(2) Le nom usuel d’un allongeur de produit de viande est formé du mot « allongeur » suivi de « au », « à la » ou « aux », selon le cas, du nom usuel de l’aliment qui est contenu dans l’allongeur de produit de viande et qui est source de protéines et
a) de l’expression « pour viande »; ou
b) du nom usuel du produit de viande dont le volume est augmenté.
(3) Le nom usuel d’un allongeur de produit de volaille est formé du mot « allongeur » suivi de « au », « à la » ou « aux », selon le cas, du nom usuel de l’aliment qui est contenu dans l’allongeur de produit de volaille et qui est source de protéines et
a) de l’expression « pour volaille »; ou
b) du nom usuel du produit de volaille dont le volume est augmenté.
(4) Les aliments qui sont sources de protéines dans l’allongeur de produits de viande ou dans l’allongeur de produits de volaille doivent figurer dans le nom usuel de cet allongeur, où ils sont désignés par leur nom usuel,
a) dans l’ordre décroissant de leurs proportions, en poids, dans l’allongeur;
b) en caractères au moins aussi gros et aussi en évidence que ceux du reste du nom usuel de l’allongeur de produits de viande ou de volaille.
(5) et (6) [Abrogés, DORS/88-559, art. 12]
- DORS/88-559, art. 12
- DORS/2022-143, art. 14
B.01.102 (1) Le nom usuel d’un produit de viande avec allongeur ou d’un produit de volaille avec allongeur est formé du nom usuel du produit de viande ou de volaille dont le volume est augmenté, auquel s’ajoute le nom usuel de chacun des aliments qui sont sources de protéines dans le produit de viande avec allongeur ou dans le produit de volaille avec allongeur.
(2) Par dérogation au paragraphe (1),
a) les mots « viande », « produit de viande », « volaille », « viande de volaille » ou « sous-produit de viande de volaille », selon le cas, peuvent être employés dans le nom usuel d’un produit de viande avec allongeur ou d’un produit de volaille avec allongeur comme étant le nom usuel de l’aliment incorporé qui est une source de protéines dérivée d’un produit de viande ou d’un produit de volaille; et
b) lorsque, suivant une pratique industrielle reconnue, le fabricant n’inclut pas dans l’allongeur de produit de viande ou dans l’allongeur de produit de volaille une source quelconque de protéines qui est dérivée d’une plante et qui est généralement un ingrédient de cet allongeur de produit de viande ou de cet allongeur de produit de volaille, ou qu’il remplace en tout ou en partie, dans l’allongeur de produit de viande ou dans l’allongeur de produit de volaille, une source de protéines qui est généralement un ingrédient de ce produit par une source quelconque de protéines dérivée d’une plante, le terme « plante » peut être employé dans le nom usuel d’un produit de viande avec allongeur ou d’un produit de volaille avec allongeur comme étant le nom usuel de l’aliment incorporé qui est une source de protéines dérivée d’une plante.
(3) Les aliments qui sont sources de protéines dans un produit de viande avec allongeur ou dans un produit de volaille avec allongeur doivent figurer dans le nom usuel de ce produit, où ils sont désignés par leur nom usuel, à la fois :
a) dans l’ordre décroissant de leurs proportions respectives, en poids, du produit de viande avec allongeur ou de volaille avec allongeur;
b) en caractères au moins aussi gros et aussi en évidence que ceux du reste du nom usuel de ce produit.
(4) Lorsqu’un produit de viande avec allongeur ou un produit de volaille avec allongeur n’est pas un produit préemballé, doivent être indiqués, en caractères lisibles, sur une inscription placée bien en évidence sur le produit ou à proximité, le nom usuel du produit et les autres renseignements qui, aux termes du présent article, doivent figurer sur l’étiquette d’un produit de viande avec allongeur ou d’un produit de volaille avec allongeur.
(5) à (7) [Abrogés, DORS/88-559, art. 13]
- DORS/84-300, art. 9
- DORS/88-559, art. 13
- DORS/2022-143, art. 15
B.01.103 (1) [Abrogé, DORS/2022-143, art. 16]
(2) à (4) [Abrogés, DORS/88-559, art. 14]
- DORS/88-559, art. 14
- DORS/2022-143, art. 16
B.01.300 [Abrogé, DORS/2003-11, art. 15]
B.01.301 (1) Est interdite, sur l’étiquette ou dans l’annonce d’un aliment, ailleurs que dans le tableau de la valeur nutritive ou dans le tableau des renseignements sur les aliments supplémentés, le cas échéant, toute indication de la valeur énergétique de l’aliment ou de sa teneur en un élément nutritif ou un ingrédient supplémentaire, à moins qu’elle ne soit exprimée de la façon ci-après, par portion indiquée :
a) dans le cas de la valeur énergétique, en Calories;
b) dans le cas d’une vitamine mentionnée au paragraphe D.01.002(1) qui n’est pas l’une des vitamines ci-après, selon l’unité applicable indiquée au paragraphe D.01.003(1) :
(i) la bêta-carotène qui est une forme de vitamine A ou le rétinol, y compris ses dérivés, qui est une forme de vitamine A, ou les deux, si un de ceux-ci est un ingrédient supplémentaire,
(ii) la niacine qui est un ingrédient supplémentaire;
b.01) dans le cas des vitamines ci-après, selon l’unité applicable prévue à la colonne 3 de la Liste des ingrédients supplémentaires autorisés :
(i) la bêta-carotène qui est une forme de vitamine A ou le rétinol, y compris ses dérivés, qui est une forme de vitamine A, ou les deux, si un de ceux-ci est un ingrédient supplémentaire,
(ii) la niacine qui est un ingrédient supplémentaire;
b.1) dans le cas des minéraux nutritifs ci-après, selon l’unité suivante :
(i) s’agissant du sodium, du potassium, du calcium, du phosphore, du magnésium, du fer, du zinc, du chlore, du cuivre et du manganèse, en milligrammes,
(ii) s’agissant de l’iode, du chrome, du sélénium et du molybdène, en microgrammes;
c) dans le cas du cholestérol, en milligrammes;
d) dans le cas de la teneur en ions minéraux de l’eau ou de la glace préemballées, en parties par million;
d.1) dans le cas d’un ingrédient supplémentaire autre qu’une vitamine ou un minéral nutritif visés au présent paragraphe, selon l’unité applicable prévue à la colonne 3 de la Liste des ingrédients supplémentaires autorisés;
e) dans les autres cas, en grammes.
(1.1) Malgré le paragraphe D.01.003(1) et pour l’application du présent article, la teneur en unités métriques des vitamines visées à l’alinéa (1)b.01) est déterminée en fonction de leur teneur en l’aliment supplémenté, et, le cas échéant, conformément à la colonne 5 de la Liste des ingrédients supplémentaires autorisés.
(2) Malgré le paragraphe (1), est permise, sur l’étiquette ou dans l’annonce d’un aliment, ailleurs que dans le tableau de la valeur nutritive ou dans le tableau des renseignements sur les aliments supplémentés, le cas échéant, toute indication du pourcentage de la valeur quotidienne d’un élément nutritif contenu dans l’aliment, si les conditions suivantes sont réunies :
a) dans le cas d’un aliment autre qu’un aliment supplémenté, l’élément nutritif figure à la colonne 1 des tableaux des articles B.01.401 ou B.01.402 et le pourcentage de la valeur quotidienne de l’élément nutritif doit ou peut être déclaré dans le tableau de la valeur nutritive;
b) dans le cas d’un aliment supplémenté, l’élément nutritif figure à la colonne 1 des tableaux des articles B.29.002 ou B.29.003, ou est visé à la colonne 2 de l’article 18 du tableau de l’article B.29.002, et le pourcentage de la valeur quotidienne de l’élément nutritif doit ou peut être déclaré dans le tableau des renseignements sur les aliments supplémentés;
c) le pourcentage de la valeur quotidienne de l’élément nutritif est déclaré par portion indiquée.
(3) Toute indication visée aux paragraphes (1) ou (2) paraissant sur l’étiquette d’un aliment figure :
a) soit en français et en anglais;
b) soit dans l’une de ces langues, si, conformément aux paragraphes B.01.012(3) ou (7), les renseignements devant être indiqués sur l’étiquette de l’aliment aux termes du présent règlement peuvent l’être uniquement dans la langue en cause et qu’ils y figurent dans celle-ci.
- DORS/88-559, art. 15
- DORS/2003-11, art. 16
- DORS/2016-305, art. 14 et 75(F)
- DORS/2022-169, art. 9
B.01.302 Si l’étiquette d’un produit préemballé à portions multiples indique le nombre de portions que contient le produit, ou celui qui sera obtenu si l’aliment est préparé selon les instructions fournies dans ou sur l’emballage, ce renseignement doit être déclaré sur le fondement de la portion indiquée figurant dans le tableau de la valeur nutritive ou dans le tableau des renseignements sur les aliments supplémentés du produit, selon le cas.
- DORS/2016-305, art. 15
- DORS/2018-108, art. 394
- DORS/2022-169, art. 10
B.01.303 et B.01.304 [Abrogés, DORS/2003-11, art. 17]
B.01.305 (1) Est interdite, sur l’étiquette ou dans l’annonce d’un aliment, toute déclaration, expresse ou implicite, relativement aux protéines, à moins que l’aliment réponde aux critères mentionnés à la colonne 2 de l’article 8 du Tableau des mentions et des allégations autorisées concernant la teneur nutritive en regard du sujet « source de protéines » visé à la colonne 1.
(2) Est interdite, sur l’étiquette ou dans l’annonce d’un aliment autre qu’un aliment supplémenté toute déclaration, expresse ou implicite, relativement aux acides aminés, à moins que :
a) l’aliment réponde aux critères mentionnés à la colonne 2 de l’article 8 du Tableau des mentions et des allégations autorisées concernant la teneur nutritive en regard du sujet « source de protéines » visé à la colonne 1;
b) sa teneur en histidine, en isoleucine, en leucine, en lysine, en méthionine, en phénylalanine, en thréonine, en tryptophane et en valine soit exprimée en grammes par portion indiquée sur l’étiquette ou dans l’annonce.
(3) Les paragraphes (1) et (2) ne s’appliquent pas :
a) à une préparation pour régime liquide, à un fortifiant pour lait humain, à un succédané de lait humain ou à un aliment présenté comme contenant un succédané de lait humain;
b) à un aliment présenté comme étant destiné à un régime sans gluten, à teneur réduite en protéines, à faible teneur en (nom de l’acide aminé) ou sans (nom de l’acide aminé);
c) au mot « protéines » utilisé dans le nom usuel d’un ingrédient dans la liste d’ingrédients;
d) à la déclaration des acides aminés dans la liste d’ingrédients;
e) aux noms usuels mentionnés dans le document sur les noms usuels d’ingrédients et de constituants lorsqu’ils figurent dans la liste d’ingrédients aux termes de l’alinéa B.01.010(3)a);
f) au nom usuel d’une préparation contenant un seul acide aminé qui peut être vendue comme aliment;
g) à toute mention visée au paragraphe B.01.014(1);
h) à toute mention ou allégation figurant à la colonne 4 de l’article 7 du Tableau des mentions et des allégations autorisées concernant la teneur nutritive en regard du sujet « faible teneur en protéines » visé à la colonne 1;
i) à la déclaration de la teneur en protéines dans le tableau de la valeur nutritive ou dans le tableau des renseignements sur les aliments supplémentés, selon le cas;
j) à une mention de la teneur en protéines d’un aliment tel que l’exigent l’alinéa B.24.103c), le sous-alinéa B.24.202a)(ii), les alinéas B.24.304b) ou B.25.057(1)a) ou les sous-alinéas B.25.057(2)c)(i) ou d)(i);
k) à la déclaration selon laquelle un aliment n’est pas une source de protéines.
(4) Toute déclaration visée aux paragraphes (1) ou (2) paraissant sur l’étiquette d’un aliment figure :
a) soit en français et en anglais;
b) soit dans l’une de ces langues, si, conformément aux paragraphes B.01.012(3) ou (7), les renseignements devant être indiqués sur l’étiquette de l’aliment aux termes du présent règlement peuvent l’être uniquement dans la langue en cause et qu’ils y figurent dans celle-ci.
- DORS/88-559, art. 15
- DORS/90-830, art. 3(F)
- DORS/2003-11, art. 18
- DORS/2016-305, art. 75(F)
- DORS/2021-57, art. 8
- DORS/2022-143, art. 17
- DORS/2022-168, art. 12
- DORS/2022-168, art. 52
- DORS/2022-169, art. 11
B.01.306 à B.01.310 [Abrogés, DORS/2003-11, art. 19]
B.01.311 (1) Sous réserve des paragraphes (2) et (3), est interdite, sur l’étiquette ou dans l’annonce d’un aliment, toute déclaration, expresse ou implicite, concernant l’action ou les effets de la valeur énergétique de l’aliment ou de tout élément nutritif contenu dans l’aliment.
(2) Toute mention ou allégation figurant à la colonne 1 du tableau suivant l’article B.01.603 est permise sur l’étiquette ou dans l’annonce d’un aliment.
(3) Sous réserve de l’article B.01.312, est permise, sur l’étiquette ou dans l’annonce d’un aliment, toute mention ou allégation indiquant que la valeur énergétique de l’aliment ou un de ses éléments nutritifs est généralement reconnu comme aidant à entretenir les fonctions de l’organisme nécessaires au maintien de la santé et à la croissance et au développement normaux.
(4) Si une mention ou une allégation visée au paragraphe (3) porte sur un élément nutritif qui ne figure pas à la colonne 1 des tableaux des articles B.01.401 et B.01.402 — ou, selon le cas, qui ne figure pas à la colonne 1 des tableaux des articles B.29.002 et B.29.003 et qui n’est pas visé à la colonne 2 de l’article 18 du tableau de l’article B.29.002 — la teneur de l’aliment en cet élément est indiquée sur l’étiquette, exprimée en grammes par portion indiquée.
(5) Toute mention ou allégation visée aux paragraphes (2) ou (3) paraissant sur l’étiquette d’un aliment figure :
a) soit en français et en anglais;
b) soit dans l’une de ces langues, si, conformément aux paragraphes B.01.012(3) ou (7), les renseignements devant être indiqués sur l’étiquette de l’aliment aux termes du présent règlement peuvent l’être uniquement dans la langue en cause et qu’ils y figurent dans celle-ci.
- DORS/88-559, art. 15
- DORS/2003-11, art. 20
- DORS/2016-305, art. 75(F)
- DORS/2022-169, art. 12
B.01.312 (1) Si une mention ou une allégation visée au paragraphe B.01.311(3) est faite sur l’étiquette ou dans l’annonce d’un aliment qui n’est pas un produit préemballé ou dans l’annonce d’un produit préemballé faite par une personne autre que le fabricant du produit ou une personne agissant sous ses ordres, l’étiquette ou l’annonce indique les renseignements ci-après qui font l’objet de la mention ou de l’allégation, par portion indiquée :
a) la valeur énergétique;
b) la teneur en l’élément nutritif.
(1.1) Le paragraphe (1) ne s’applique pas si la mention ou l’allégation est faite sur l’étiquette ou dans l’annonce d’un légume frais, d’un fruit frais ou d’un mélange quelconque de légumes frais ou de fruits frais sans ingrédient ajouté, d’une orange à laquelle un colorant alimentaire a été ajouté et d’un légume frais ou d’un fruit frais enrobé d’huile minérale, de paraffine, de vaseline ou de tout autre enduit protecteur.
(2) Si une mention ou une allégation est faite dans l’annonce d’un aliment, autre qu’une annonce radiophonique ou télévisée, les renseignements visés au paragraphe (1), à la fois :
a) précèdent ou suivent, sans qu’aucun texte imprimé ou écrit ni aucun signe graphique ne soit intercalé, la mention ou l’allégation ne paraissant qu’une seule fois ou, si la mention ou l’allégation est répétée, celle qui est la plus en évidence;
b) figurent en caractères d’une taille qui est au moins égale et aussi bien en vue que ceux de la mention ou de l’allégation ne paraissant qu’une seule fois ou, si la mention ou l’allégation est répétée, que ceux de celle qui est la plus en évidence.
(3) Si une mention ou une allégation est faite dans une annonce radiophonique ou dans la composante audio d’une annonce télévisée, les renseignements visés au paragraphe (1) précèdent ou suivent immédiatement la mention ou l’allégation.
(4) Si une mention ou une allégation est faite dans une annonce télévisée, les renseignements visés au paragraphe (1) sont communiqués, selon le cas :
a) en mode audio, si la mention ou l’allégation fait partie uniquement de la composante audio de l’annonce ou, à la fois des composantes audio et visuelle de celle-ci;
b) en mode audio ou en mode visuel, si la mention ou l’allégation fait partie uniquement de la composante visuelle de l’annonce.
(5) Les renseignements visés au paragraphe (1) qui sont communiqués en mode visuel dans une annonce télévisée, à la fois :
a) paraissent en même temps et pendant au moins la même durée que la mention ou l’allégation;
b) précèdent ou suivent, sans qu’aucun texte imprimé ou écrit ni aucun signe graphique ne soit intercalé, la mention ou l’allégation ne paraissant qu’une seule fois ou, si la mention ou l’allégation est répétée, celle qui est la plus en évidence;
c) figurent en caractères d’une taille qui est au moins égale et aussi bien en vue que ceux de la mention ou de l’allégation ne paraissant qu’une seule fois ou, si la mention ou l’allégation est répétée, que ceux de celle qui est la plus en évidence.
- DORS/2003-11, art. 20
- DORS/2016-305, art. 16 et 75(F)
Symboles nutritionnels
Renseignements obligatoires
B.01.350 (1) Sauf disposition contraire du présent article, l’espace principal d’un produit préemballé porte un symbole figurant à l’annexe K.1 si les conditions ci-après sont réunies :
a) le produit, tel qu’il est vendu, contient un élément nutritif visé à la colonne 1 du tableau du présent article;
b) la teneur en cet élément nutritif, calculée en pourcentage de la valeur quotidienne, est égale ou supérieure au seuil applicable visé aux colonnes 2 à 7 de ce tableau.
(2) Pour l’application du paragraphe (1), le pourcentage de la valeur quotidienne de l’élément nutritif est calculé sur la base de sa teneur, en poids, par portion indiquée ou par quantité de référence, selon la plus élevée de ces quantités.
(3) Malgré le paragraphe (2), dans le cas d’un produit préemballé dont la préparation requiert la reconstitution avec de l’eau ou un autre liquide ou l’ajout d’un autre ingrédient et dont la quantité de référence applicable se réfère uniquement à l’aliment dans sa forme préparée, le pourcentage de la valeur quotidienne de l’élément nutritif est calculé sur la base de sa teneur, en poids, par portion indiquée.
(4) Le seuil visé aux colonnes 2 à 7 du tableau du présent article applicable au produit préemballé visé au paragraphe (3) est établi en fonction de sa portion indiquée et non de sa quantité de référence.
(5) Le paragraphe (1) ne s’applique pas :
a) au contenant d’expédition, sauf si ce dernier et son contenu sont vendus comme produit préemballé individuel à un consommateur au niveau du commerce de détail;
b) au produit préemballé dont la surface exposée disponible est de moins de 15 cm2;
c) à la portion individuelle préemballée d’un aliment destinée uniquement à être servie avec des repas ou des casse-croûte par un restaurant ou une autre entreprise commerciale;
d) au produit préemballé à portions multiples, prêt à servir et destiné uniquement à être servi par une entreprise commerciale ou industrielle ou par une institution;
e) au produit préemballé qui est destiné uniquement à être utilisé comme ingrédient dans la fabrication d’un autre produit préemballé destiné à être vendu au consommateur au niveau du commerce de détail ou comme ingrédient dans la préparation d’aliments par une entreprise commerciale ou industrielle ou par une institution;
f) au lait, au lait partiellement écrémé, au lait écrémé, au lait de chèvre, au lait de chèvre partiellement écrémé, au lait de chèvre écrémé, au lait (indication de l’arôme), au lait partiellement écrémé (indication de l’arôme), au lait écrémé (indication de l’arôme) ou à la crème, vendus dans un contenant réutilisable en verre;
g) à l’agent édulcorant, y compris le sucre d’érable et le sirop d’érable;
h) au sel de table, au sel d’usage domestique général, au sel de céleri, au sel d’ail et au sel d’oignon et tout autre sel d’assaisonnement si « sel » fait partie du nom usuel de l’aliment;
i) à toute graisse ou huile visée au titre 9, à toute graisse ou huile de poisson ou d’autres animaux marins, au beurre, au ghee et à la margarine et autres succédanés de beurre similaires;
j) à la ration individuelle destinée aux militaires en opération ou en exercice.
(6) Le paragraphe (1) ne s’applique pas, à l’égard d’un élément nutritif, aux produits préemballés ci-après, si les seuls ingrédients qui contiennent l’élément nutritif sont, dans le cas des gras saturés ou du sodium, ceux visés au paragraphe (7) ou, dans le cas des sucres, ceux visés au paragraphe (8) :
a) les fruits ou les légumes — entiers ou coupés — notamment congelés, en conserve, déshydratés ou séchés;
b) le lait obtenu de tout animal, sous forme liquide ou en poudre;
c) les œufs entiers, notamment les œufs liquides, congelés ou desséchés ou le mélange d’œuf;
d) les fruits à écale, les graines ou le beurre de fruits à écale ou de graines dont la teneur totale en gras est de moins de 30 % de gras saturés;
e) l’huile végétale ou l’huile marine dont la teneur totale en gras est de moins de 30 % de gras saturés;
f) les produits d’animaux marins et d’animaux d’eau douce visés au titre 21 dont la teneur totale en gras est de moins de 30 % de gras saturés;
g) toute combinaison des aliments visés aux alinéas a) à f).
(7) Pour l’application du paragraphe (6), en ce qui concerne les gras saturés et le sodium, les ingrédients sont les ingrédients ci-après auxquels aucun gras saturé ni sodium n’a été ajouté :
a) les fruits ou les légumes — entiers ou coupés — notamment congelés, en conserve, déshydratés ou séchés;
b) le lait obtenu de tout animal, sous forme liquide ou en poudre;
c) les œufs entiers, notamment les œufs liquides, congelés ou desséchés ou le mélange d’œuf;
d) les fruits à écale, les graines ou le beurre de fruits à écale ou de graines dont la teneur totale en gras est de moins de 30 % de gras saturés;
e) l’huile végétale ou l’huile marine dont la teneur totale en gras est de moins de 30 % de gras saturés;
f) les produits d’animaux marins et d’animaux d’eau douce visés au titre 21 dont la teneur totale en gras est de moins de 30 % de gras saturés.
(8) Pour l’application du paragraphe (6), en ce qui concerne les sucres, les ingrédients sont les ingrédients ci-après auxquels aucun sucre n’a été ajouté :
a) les ingrédients visés aux alinéas (7)a), b) et d);
b) les produits laitiers, sauf ceux visés à l’alinéa (7)b);
c) les grains;
d) les légumineuses.
(9) Le paragraphe (1) ne s’applique pas, à l’égard des gras saturés et des sucres, aux produits préemballés lorsqu’il s’agit de fromage ou de yogourt — notamment le yogourt à boire — faits de produits laitiers, de kéfir ou de babeurre, sauf si :
a) dans le cas de gras saturés, le produit contient un ingrédient, à l’exception des ingrédients ci-après, qui contient des gras saturés :
(i) les substances laitières,
(ii) les substances laitières modifiées,
(iii) les fruits à écale ou les graines dont la teneur totale en gras est de moins de 30 % de gras saturés,
(iv) l’huile végétale ou l’huile marine dont la teneur totale en gras est de moins de 30 % de gras saturés,
(v) les produits d’animaux marins et d’animaux d’eau douce visés au titre 21 dont la teneur totale en gras est de moins de 30 % de gras saturés;
b) dans le cas de sucres, il contient un ingrédient, à l’exception des ingrédients ci-après, qui contient des sucres ou l’un de ces ingrédients auquel des sucres ont été ajoutés :
(i) les fruits ou les légumes — entiers ou coupés — notamment congelés, en conserve, déshydratés ou séchés,
(ii) les produits laitiers,
(iii) les grains,
(iv) les légumineuses,
(v) les fruits à écale ou les graines.
(10) Pour l’application des alinéas (6)a) et (7)a) les fruits ne comprennent pas la noix de coco.
(11) Le paragraphe (1) ne s’applique pas, à l’égard du sodium, aux produits préemballés, s’il s’agit de fromage faits de produits laitiers.
(12) Pour l’application des paragraphes (9) et (11), les produits préemballés sont les suivants :
a) ceux dont la quantité de référence est de 30 g ou 30 mL ou moins et dont le pourcentage de la valeur quotidienne pour le calcium, par portion indiquée ou par quantité de référence, selon la plus élevée de ces quantités, est de 10% ou plus;
b) ceux dont la quantité de référence est supérieure à 30 g ou 30 mL et dont le pourcentage de la valeur quotidienne pour le calcium, par portion indiquée ou par quantité de référence, selon la plus élevée de ces quantités, est de 15% ou plus.
(13) Le paragraphe (1) ne s’applique pas aux produits préemballés ci-après sauf s’ils sont tenus de porter sur leur étiquette un tableau de la valeur nutritive :
a) la boisson dont la teneur en alcool est supérieure à 0,5 %;
b) la viande, le sous-produit de viande, la viande de volaille ou le sous-produit de viande de volaille crus, composés d’un seul ingrédient et non hachés;
c) le produit d’animaux marins ou d’animaux d’eau douce cru et composé d’un seul ingrédient;
d) le produit vendu uniquement dans l’établissement de détail où il est préparé et transformé à partir de ses ingrédients, y compris un pré-mélange si un ingrédient autre que de l’eau y est ajouté lors de la préparation et de la transformation du produit;
e) le produit vendu uniquement dans un éventaire routier, une exposition d’artisanat, un marché aux puces, une foire, un marché d’agriculteurs ou une érablière par l’individu qui l’a transformé et préparé;
f) la portion individuelle qui est vendue pour consommation immédiate et qui n’a fait l’objet d’aucun procédé pour en prolonger la durée de conservation, y compris l’utilisation d’un emballage spécial;
g) le produit vendu uniquement dans l’établissement de détail où il est emballé, si l’étiquette du produit est un autocollant et que la surface exposée disponible du produit est de moins de 200 cm2;
h) le produit dont la surface exposée disponible est de moins de 100 cm2.
(13.01) Le paragraphe (1) ne s’applique pas à un produit préemballé lorsqu’il s’agit de viande, d’un sous-produit de viande, de viande de volaille ou d’un sous-produit de viande de volaille crus, composés d’un seul ingrédient et hachés, sauf s’il répond aux critères mentionnés aux alinéas B.01.401(3)a), b) ou e).
(13.1) Sous réserve du paragraphe (13.2), le paragraphe (1) ne s’applique pas aux aliments supplémentés dont la surface exposée disponible est de moins de 100 cm2 sauf s’ils sont visés à l’alinéa B.29.018(2)b).
(13.2) Le paragraphe (1) ne s’applique pas aux aliments supplémentés dont la surface exposée disponible est de moins de 100 cm2, même s’ils sont visés à l’alinéa B.29.018(2)b), s’ils portent un identifiant des aliments supplémentés avec mise en garde.
(14) Lorsqu’en raison de l’application de l’une des dispositions prévues aux paragraphes (5) à (13.2) le paragraphe (1) ne s’applique pas à un produit préemballé ou à un produit préemballé à l’égard d’un élément nutritif en particulier, cette disposition l’emporte sur toute autre disposition contraire aux paragraphes (5) à (13.2).
(15) Malgré toute autre disposition du présent article, l’étiquette des produits préemballés ci-après ne peut porter de symbole visé au paragraphe (1) :
a) le produit préemballé destiné exclusivement aux bébés âgés d’au moins six mois mais de moins d’un an;
b) le fortifiant pour lait humain;
c) le succédané de lait humain ou l’aliment présenté comme contenant un succédané de lait humain;
d) la préparation pour régime liquide, au sens de l’article B.24.001;
e) le substitut de repas;
f) le supplément nutritif;
g) l’aliment présenté comme étant destiné aux régimes à teneur réduite en protéines;
h) l’aliment présenté comme étant destiné aux régimes à faible teneur en (nom de l’acide aminé);
i) l’aliment présenté comme étant conçu pour un régime à très faible teneur en énergie, au sens de l’article B.24.001.
TABLEAU
Seuils exigeant un symbole nutritionnel
Colonne 1 Colonne 2 Colonne 3 Colonne 4 Colonne 5 Colonne 6 Colonne 7 Élément nutritif Seuil pour produit préemballé autre que celui mentionné aux colonnes 5 à 7 Seuil pour produit préemballé destiné exclusivement aux enfants âgés d’au moins un an mais de moins de quatre ans Article À l’exception du produit mentionné à la colonne 4, produit préemballé dont la quantité de référence est supérieure à 30 g ou 30 mL Produit préemballé dont la quantité de référence est de 30 g ou 30 mL ou moins Plat principal préemballé dont la quantité de référence est de 200 g ou plus À l’exception du produit mentionné à la colonne 7, produit préemballé dont la quantité de référence est supérieure à 30 g ou 30 mL Produit préemballé dont la quantité de référence est de 30 g ou 30 mL ou moins Plat principal préemballé dont la quantité de référence est de 170 g ou plus 1 Gras saturés 15 % de la valeur quotidienne de la somme des acides gras saturés et des acides gras trans visée à la colonne 3 de la partie 1 du Tableau des valeurs quotidiennes 10 % de la valeur quotidienne de la somme des acides gras saturés et des acides gras trans visée à la colonne 3 de la partie 1 du Tableau des valeurs quotidiennes 30 % de la valeur quotidienne de la somme des acides gras saturés et des acides gras trans visée à la colonne 3 de la partie 1 du Tableau des valeurs quotidiennes 15 % de la valeur quotidienne de la somme des acides gras saturés et des acides gras trans visée à la colonne 2 de la partie 1 du Tableau des valeurs quotidiennes 10 % de la valeur quotidienne de la somme des acides gras saturés et des acides gras trans visée à la colonne 2 de la partie 1 du Tableau des valeurs quotidiennes 30 % de la valeur quotidienne de la somme des acides gras saturés et des acides gras trans visée à la colonne 2 de la partie 1 du Tableau des valeurs quotidiennes 2 Sucres 15 % de la valeur quotidienne de sucres visée à la colonne 3 de la partie 1 du Tableau des valeurs quotidiennes 10 % de la valeur quotidienne de sucres visée à la colonne 3 de la partie 1 du Tableau des valeurs quotidiennes 30 % de la valeur quotidienne de sucres visée à la colonne 3 de la partie 1 du Tableau des valeurs quotidiennes 15 % de la valeur quotidienne de sucres visée à la colonne 2 de la partie 1 du Tableau des valeurs quotidiennes 10 % de la valeur quotidienne de sucres visée à la colonne 2 de la partie 1 du Tableau des valeurs quotidiennes 30 % de la valeur quotidienne de sucres visée à la colonne 2 de la partie 1 du Tableau des valeurs quotidiennes 3 Sodium 15 % de la valeur quotidienne de sodium visée à la colonne 3 de la partie 1 du Tableau des valeurs quotidiennes 10 % de la valeur quotidienne de sodium visée à la colonne 3 de la partie 1 du Tableau des valeurs quotidiennes 30 % de la valeur quotidienne de sodium visée à la colonne 3 de la partie 1 du Tableau des valeurs quotidiennes 15 % de la valeur quotidienne de sodium visée à la colonne 2 de la partie 1 du Tableau des valeurs quotidiennes 10 % de la valeur quotidienne de sodium visée à la colonne 2 de la partie 1 du Tableau des valeurs quotidiennes 30 % de la valeur quotidienne de sodium visée à la colonne 2 de la partie 1 du Tableau des valeurs quotidiennes
Présentation du symbole nutritionnel
B.01.351 (1) Le symbole nutritionnel est présenté en noir et blanc et conformément au symbole applicable figurant à l’annexe K.1.
(2) Sous réserve du paragraphe (3), le symbole nutritionnel est présenté selon l’un des modèles suivants :
a) le modèle horizontal unilingue, où figurent deux versions distinctes du symbole, l’une en français (FH) et l’autre en anglais (AH);
b) le modèle horizontal bilingue (HB), où figure le symbole dans les deux langues officielles.
(3) Si la principale surface exposée est de 450 cm2 ou moins et que la largeur du symbole nutritionnel qui serait applicable selon l’un ou l’autre des modèles horizontaux est supérieure à celle de l’espace principal, le symbole est présenté selon l’un des modèles suivants :
a) le modèle vertical unilingue, où figurent deux versions distinctes du symbole, l’une en français (FV) et l’autre en anglais (AV);
b) le modèle vertical bilingue (VB), où figure le symbole dans les deux langues officielles.
(4) Si, conformément aux paragraphes B.01.012(3) ou (7), les renseignements devant être indiqués aux termes du présent règlement sur l’étiquette d’un produit préemballé peuvent l’être uniquement en français ou uniquement en anglais et qu’ils y figurent dans la langue en cause, le symbole nutritionnel peut être présenté dans l’espace principal du produit dans cette langue sur tout espace continu de la surface exposée disponible.
(5) Lorsque le symbole nutritionnel est présenté selon le modèle bilingue, l’ordre de présentation des langues indiqué dans le symbole applicable figurant à l’annexe K.1 peut être inversé.
B.01.352 (1) La version du symbole nutritionnel que doit porter le produit préemballé dont la principale surface exposée se situe dans la plage prévue à la colonne 1 du tableau du présent article et qui contient un élément nutritif visé à la colonne 2 de ce tableau en une teneur égale ou supérieure au seuil applicable visé au paragraphe B.01.350(1) est celle visée aux colonnes 3 ou 5 du même tableau ou, le cas échéant, aux colonnes 4 ou 6 du même tableau.
(2) Malgré le paragraphe (1), le produit préemballé dont la principale surface exposée est supérieure à 250 cm2 peut porter la version applicable du symbole nutritionnel visée à l’article 4 des tableaux 1 ou 3 du Répertoire des spécifications des symboles nutritionnels, dans la colonne 2, si le produit est vendu uniquement dans l’établissement de détail où il est emballé et si l’étiquette est un autocollant.
(3) Le symbole nutritionnel doit être présenté conformément aux spécifications applicables prévues dans le Répertoire des spécifications des symboles nutritionnels.
(4) Malgré le paragraphe (3), le symbole nutritionnel peut être de dimensions plus grandes que celles indiquées à la colonne 3 du tableau applicable du Répertoire des spécifications des symboles nutritionnels s’il est agrandi proportionnellement sur les plans vertical et horizontal.
TABLEAU
Symboles nutritionnels et modèles
Colonne 1 Colonne 2 Colonne 3 Colonne 4 Colonne 5 Colonne 6 Article Plage de la principale surface exposée Élément nutritif égal ou supérieur au seuil prévu au paragraphe B.01.350(1) Symbole nutritionnel du modèle horizontal unilingue Symbole nutritionnel du modèle vertical unilingue Symbole nutritionnel du modèle horizontal bilingue Symbole nutritionnel du modèle vertical bilingue 1 > 30 cm2 Gras saturés (Gras sat.), sucres et sodium 1(FH) et 1(AH) 1(FV) et 1(AV) 1(HB) 1(VB) Gras saturés (Gras sat.) et sucres 2(FH) et 2(AH) 2(FV) et 2(AV) 2(HB) 2(VB) Sucres et sodium 3(FH) et 3(AH) 3(FV) et 3(AV) 3(HB) 3(VB) Gras saturés (Gras sat.) et sodium 4(FH) et 4(AH) 4(FV) et 4(AV) 4(HB) 4(VB) Gras saturés (Gras sat.) 5(FH) et 5(AH) 5(FV) et 5(AV) 5(HB) 5(VB) Sucres 6(FH) et 6(AH) 6(FV) et 6(AV) 6(HB) 6(VB) Sodium 7(FH) et 7(AH) 7(FV) et 7(AV) 7(HB) 7(VB) 2 ≤ 30 cm2 Gras saturés (Gras sat.), sucres et sodium 1(FH) et 1(AH) 1(FV) et 1(AV) 1(HB) 1(VB) Gras saturés (Gras sat.) et sucres 8(FH) et 8(AH) 8(FV) et 8(AV) 8(HB) 8(VB) Sucres et sodium 9(FH) et 9(AH) 9(FV) et 9(AV) 9(HB) 9(VB) Gras saturés (Gras sat.) et sodium 10(FH) et 10(AH) 10(FV) et 10(AV) 10(HB) 10(VB) Gras saturés (Gras sat.) 11(FH) et 11(AH) 11(FV) et 11(AV) 11(HB) 11(VB) Sucres 12(FH) et 12(AH) 12(FV) et 12(AV) 12(HB) 12(VB) Sodium 13(FH) et 13(AH) 13(FV) et 13(AV) 13(HB) 13(VB)
B.01.353 (1) Sous réserve du paragraphe (2), dans le cas d’un produit préemballé contenant un assortiment d’aliments dont au moins un requiert un symbole nutritionnel, les symboles nutritionnels sont présentés de façon à indiquer clairement les éléments nutritifs applicables contenus dans chaque aliment.
(2) Dans le cas d’un produit préemballé contenant des ingrédients destinés à être alliés ou des aliments destinés à être consommés ensemble, le symbole nutritionnel présente les éléments nutritifs contenus dans le produit dans son ensemble.
B.01.354 Les caractères et les autres éléments du symbole nutritionnel sont présentés de manière à ce qu’ils ne se touchent pas.
Emplacement du symbole nutritionnel
B.01.355 (1) Le symbole nutritionnel est présenté :
a) dans le cas d’un produit préemballé dont l’espace principal est moins haut que large, dans la moitié droite de l’espace principal;
b) dans le cas de tout autre produit préemballé, dans la moitié supérieure de l’espace principal.
(2) Le symbole nutritionnel est entouré d’un espace de dégagement qui satisfait aux exigences suivantes :
a) il a une largeur égale ou supérieure à celle prévue à la colonne 4 du tableau applicable du Répertoire des spécifications des symboles nutritionnels;
b) il ne contient aucun texte ni aucun autre signe graphique.
(3) Si un produit préemballé est de forme cylindrique, le bord extérieur de l’espace de dégagement est présenté à une distance qui représente au moins 10 % de la largeur de la principale surface exposée de l’emballage, à partir du bord des côtés gauche ou droit de cette surface.
(4) Dans le cas où il est impossible de se conformer à la fois aux règles prévues à l’alinéa (1)a) et au paragraphe (3), le symbole nutritionnel peut être présenté en partie dans la moitié gauche de l’espace principal dans la mesure où cela est nécessaire pour permettre l’application de ce paragraphe.
B.01.356 Le symbole nutritionnel est orienté dans le même sens que la plupart des autres renseignements figurant dans l’espace principal, sauf si l’espace principal figure sur le plan vertical et que la plupart des autres renseignements ne figurent pas parallèlement à la base de l’emballage, auquel cas il est orienté de manière à ce que les mots qui y figurent soient parallèles à la base.
Visibilité de la déclaration concernant la santé
B.01.357 (1) Lorsqu’un symbole nutritionnel et une déclaration concernant la santé paraissent dans l’espace principal d’un produit préemballé et que la déclaration est liée à un élément nutritif visé par le symbole nutritionnel, la déclaration satisfait aux exigences suivantes :
a) la hauteur des lettres majuscules qui y paraissent ne dépasse pas celle des lettres majuscules, sauf tout accent, paraissant dans le symbole nutritionnel, à l’exception des lettres des mots « Santé Canada » et « Health Canada »;
b) la hauteur de la hampe ascendante la plus élevée des lettres minuscules qui y paraissent ne dépasse pas celle de la hampe ascendante la plus élevée des lettres minuscules paraissant dans le symbole nutritionnel, à l’exception des lettres des mots « Santé Canada » et « Health Canada ».
(2) Lorsqu’un symbole nutritionnel et une déclaration concernant la santé paraissent dans l’espace principal d’un produit préemballé et que la déclaration n’est pas liée à un élément nutritif visé par le symbole nutritionnel, la déclaration satisfait aux exigences suivantes :
a) la hauteur des lettres majuscules qui y paraissent ne dépasse pas le double de celle des lettres majuscules, sauf tout accent, paraissant dans le symbole nutritionnel, à l’exception des lettres des mots « Santé Canada » et « Health Canada »;
b) la hauteur de la hampe ascendante la plus élevée des lettres minuscules qui y paraissent ne dépasse pas le double de celle de la hampe ascendante la plus élevée des lettres minuscules paraissant dans le symbole nutritionnel, à l’exception des lettres des mots « Santé Canada » et « Health Canada ».
(3) Au présent article, déclaration concernant la santé s’entend, selon le cas :
a) de toute indication visée aux paragraphes B.01.301(1) ou (2);
b) de toute mention ou allégation visée aux paragraphes B.01.311(2) ou (3);
c) de toute déclaration visée à l’un des articles B.01.503 à B.01.513;
d) de toute mention ou allégation visée au paragraphe B.01.601(1);
e) de tout autre mention, logo, symbole, sceau d’approbation ou marque concernant la santé, sauf les suivants :
(i) la marque ou le nom d’un produit préemballé,
(ii) toute mention ou allégation visée à l’un des articles D.01.004 à D.01.007 et D.02.002 à D.02.005.
Interdictions — Ressemblance au symbole nutritionnel
B.01.358 (1) Il est interdit, relativement à un produit préemballé :
a) de l’étiqueter en utilisant une déclaration, y compris un mot, une expression, une illustration, un signe, une marque, un symbole ou un dessin, qui est susceptible d’être confondue avec un symbole nutritionnel;
b) d’en faire la publicité ou de le vendre s’il porte sur son étiquette toute déclaration visée à l’alinéa a).
(2) Pour l’application du paragraphe (1), la déclaration ne comprend pas l’identifiant des aliments supplémentés avec mise en garde.
Interprétation
B.01.400 (1) Pour l’application des articles B.01.401 à B.01.603, lipides s’entend de tous les acides gras exprimés sous forme de triglycérides.
(2) Pour l’application des articles B.01.401 à B.01.603, la teneur en vitamines est déterminée conformément à l’article D.01.003.
- DORS/2003-11, art. 20
- DORS/2016-305, art. 17
Étiquetage nutritionnel
Renseignements principaux
B.01.401 (1) Sauf disposition contraire du présent article et des articles B.01.402 à B.01.406 et B.01.467 à B.01.469, l’étiquette de tout produit préemballé porte un tableau de la valeur nutritive indiquant exclusivement les renseignements visés à la colonne 1 du tableau du présent article, exprimés au moyen de la nomenclature indiquée dans la colonne 2, de l’unité indiquée dans la colonne 3 et des règles d’écriture indiquées dans la colonne 4.
(1.1) Pour l’application du paragraphe (1), la portion indiquée qui est exprimée en unité métrique dans le tableau de la valeur nutritive d’un produit préemballé sert de fondement pour établir les renseignements relatifs à la valeur énergétique et aux éléments nutritifs qui figurent au tableau de la valeur nutritive du produit.
(1.2) Le pourcentage de la valeur quotidienne d’un minéral nutritif qui, aux termes du paragraphe (1), figure dans le tableau de la valeur nutritive d’un produit préemballé est établi sur la base de la teneur, en poids, du minéral nutritif dans le produit, par portion indiquée, une fois la teneur arrondie selon les règles d’écriture applicables prévues à la colonne 4 du tableau du présent article.
(2) Le paragraphe (1) ne s’applique pas à un produit préemballé dans les cas suivants :
a) tous les renseignements visés à la colonne 1 du tableau du présent article, autres que l’article 1 (« portion indiquée »), peuvent être exprimés par « 0 » au tableau de la valeur nutritive conformément au présent article;
b) le produit est, selon le cas :
(i) une boisson dont la teneur en alcool est de plus de 0,5 %,
(ii) [Abrogé, DORS/2016-305, art. 18]
(iii) de la viande, un sous-produit de viande, de la viande de volaille ou un sous-produit de viande de volaille, cru et composé d’un seul ingrédient,
(iv) un produit d’animaux marins ou d’animaux d’eau douce cru et composé d’un seul ingrédient,
(v) un produit vendu uniquement dans l’établissement de détail où il est préparé et transformé à partir de ses ingrédients, y compris un pré-mélange si un ingrédient autre que de l’eau est ajouté au pré-mélange lors de la préparation et de la transformation du produit,
(vi) un produit vendu uniquement dans un éventaire routier, une exposition d’artisanat, un marché aux puces, une foire, un marché d’agriculteurs ou une érablière par l’individu qui l’a transformé et préparé,
(vii) une portion individuelle qui est vendue pour consommation immédiate et qui n’a fait l’objet d’aucun procédé pour en prolonger la durée de conservation, notamment l’utilisation d’un emballage spécial,
(viii) un produit vendu uniquement dans l’établissement de détail où il est emballé, si l’étiquette du produit est un autocollant et que la surface exposée disponible du produit est de moins de 200 cm2;
c) le produit est, selon le cas :
(i) un légume frais, un fruit frais ou un mélange quelconque de légumes frais ou de fruits frais sans ingrédient ajouté, une orange à laquelle un colorant alimentaire a été ajouté et un légume frais ou un fruit frais enrobé d’huile minérale, de paraffine, de vaseline ou de tout autre enduit protecteur,
(ii) une portion individuelle préemballée d’un aliment, destinée uniquement à être servie par un restaurant ou une autre entreprise commerciale avec les repas ou casse-croûte,
(iii) du lait, du lait partiellement écrémé, du lait écrémé, du lait de chèvre, du lait de chèvre partiellement écrémé, du lait de chèvre écrémé, du lait (indication de l’arôme), du lait partiellement écrémé (indication de l’arôme), du lait écrémé (indication de l’arôme) ou de la crème, vendu dans un contenant réutilisable en verre.
(3) Malgré les alinéas (2)a) et b), le paragraphe (1) s’applique dans les cas suivants :
a) le produit contient une vitamine ou un minéral nutritif ajoutés;
b) une vitamine ou un minéral nutritif est déclaré comme constituant d’un ingrédient du produit, sauf si l’ingrédient est de la farine;
c) [Abrogé, DORS/2022-168, art. 14]
d) le produit est de la viande, un sous-produit de viande, de la viande de volaille ou un sous-produit de viande de volaille hachés;
e) l’étiquette du produit ou encore l’annonce faite par le fabricant du produit ou sous ses ordres comporte, selon le cas :
(i) une mention de la valeur énergétique, d’un élément nutritif figurant à la colonne 1 du tableau du présent article ou à la colonne 1 du tableau de l’article B.01.402 ou une mention d’un composant de l’élément nutritif, autre qu’un renseignement prévu au titre 12 ou qu’une mention du nom usuel de l’ingrédient dans la liste des ingrédients du produit,
(ii) une déclaration indiquant expressément ou implicitement que le produit a des propriétés particulières liées à la nutrition ou à la santé, notamment une mention ou une allégation figurant à la colonne 4 du Tableau des mentions et des allégations autorisées concernant la teneur nutritive, à la colonne 1 du tableau suivant l’article B.01.603 ou aux articles B.01.311, D.01.006 ou D.02.004,
(iii) un nom, une mention, un logo, un symbole, un sceau d’approbation ou toute autre marque concernant la santé,
(iv) les expressions « valeur nutritive », « valeurs nutritives » ou « nutrition facts ».
(4) Le paragraphe (1) ne s’applique pas à la préparation pour régime liquide, au fortifiant pour lait humain, au succédané de lait humain, à l’aliment présenté comme contenant un succédané de lait humain, au substitut de repas, au supplément nutritif, à l’aliment présenté comme étant conçu pour un régime à très faible teneur en énergie ou à l’aliment supplémenté.
(5) L’étiquette ou l’annonce d’une préparation pour régime liquide, d’un fortifiant pour lait humain, d’un succédané de lait humain, d’un aliment présenté comme contenant un succédané de lait humain, d’un substitut de repas, d’un supplément nutritif, d’un aliment présenté comme étant conçu pour un régime à très faible teneur en énergie ou d’un aliment supplémenté ne peut comporter un tableau de la valeur nutritive ou les expressions « valeur nutritive », « valeurs nutritives » ou « nutrition facts ».
(6) Si au moins six des renseignements relatifs à la valeur énergétique et aux éléments nutritifs visés à la colonne 1 des articles 2 à 5 et 7 à 15 du tableau du présent article peuvent être exprimés, conformément au présent article, par « 0 » au tableau de la valeur nutritive d’un produit préemballé, autre qu’un produit destiné exclusivement aux bébés âgés d’au moins six mois mais de moins d’un an, le tableau peut ne contenir que les renseignements suivants :
a) la portion indiquée;
b) la valeur énergétique;
c) la teneur en lipides;
d) la teneur en glucides;
e) la teneur en protéines;
f) la teneur en tout élément nutritif qui fait l’objet d’une déclaration visée au sous-alinéa (3)e)(ii);
g) la teneur en un polyalcool, en une vitamine ou en un minéral nutritif ajoutés au produit, à l’exclusion de l’iodure ajouté à du sel de table ou à du sel d’usage domestique général et du fluorure ajouté à de l’eau ou à de la glace préemballées;
h) la teneur en une vitamine ou en un minéral nutritif déclaré comme constituant d’un ingrédient du produit, à l’exclusion de la farine;
i) la teneur en tout élément nutritif visé à la colonne 1 des articles 4, 5, 7, 8, 10, 11 et 13 à 15 du tableau du présent article qui ne peut être exprimée par « 0 » au tableau de la valeur nutritive;
j) la mention « Source négligeable de (désignation de tout élément nutritif omis conformément au présent paragraphe) » ou, si le produit remplit les conditions du paragraphe B.01.455(3), la mention « Source négligeable d’autres éléments nutritifs ».
(6.1) Le tableau de la valeur nutritive d’un produit préemballé à portion individuelle autre qu’un repas préemballé peut ne contenir que les renseignements suivants :
a) la portion indiquée;
b) la valeur énergétique;
c) la teneur en lipides;
d) la teneur en glucides;
e) la teneur en protéines;
f) la teneur en tout élément nutritif qui fait l’objet d’une déclaration visée au sous-alinéa (3)e)(ii);
g) la teneur en un polyalcool, en une vitamine ou en un minéral nutritif ajoutés au produit, à l’exclusion de l’iodure ajouté à du sel de table ou à du sel d’usage domestique général et du fluorure ajouté à de l’eau ou à de la glace préemballées;
h) la teneur en tout élément nutritif visé à la colonne 1 des articles 4 et 5 du tableau du présent article et la somme des acides gras saturés et des acides gras trans si l’une de ces teneurs ou cette somme ne peut être exprimée par « 0 » au tableau de la valeur nutritive;
i) la teneur en tout élément nutritif visé à la colonne 1 des articles 8 et 11 du tableau du présent article qui ne peut être exprimée par « 0 » au tableau de la valeur nutritive;
j) l’énoncé interprétatif du % de la valeur quotidienne.
(7) Le paragraphe (1) ne s’applique pas aux produits préemballés suivants :
a) tout produit destiné uniquement à être utilisé comme ingrédient dans la fabrication d’autres produits préemballés destinés à être vendus au consommateur au niveau du commerce de détail ou comme ingrédient dans la préparation d’aliments par une entreprise commerciale ou industrielle ou une institution;
b) tout produit à portion multiple prêt à servir destiné uniquement à être servi par une entreprise commerciale ou industrielle ou une institution.
(8) Le tableau de la valeur nutritive figurant sur l’étiquette d’un produit préemballé, s’il correspond à l’une des figures 6.5(B), 6.6(B), 6.5.1(B), 6.6.1(B), 7.3(B), 7.4(B), 7.3.1(B), 7.4.1(B), 17.2(F) et (A), 17.2.1(F) et (A), 24.1(F) et (A) à 24.6(F) et (A), 25.1(B) à 25.6(B), 26.1(B) à 26.4(B), 32.1(F) et (A) ou 32.2(F) et (A) du Répertoire des modèles de TVN, n’a pas à indiquer l’énoncé interprétatif du % de la valeur quotidienne visé à l’article 16 du tableau du présent article.
TABLEAU
Renseignements principaux
Article Colonne 1 Colonne 2 Colonne 3 Colonne 4 Renseignements Nomenclature Unité Règles d’écriture 1 Portion indiquée « Portion (portion indiquée) », « pour (portion indiquée) » ou « par (portion indiquée) » La portion est exprimée :
a) s’agissant d’un produit préemballé à portion individuelle :
(i) par emballage,
(ii) en grammes ou en millilitres tel qu’il est prévu aux sous-alinéas B.01.002A(2)a)(i) et (ii);
b) s’agissant d’un produit préemballé à portions multiples, selon les unités ci-après indiquées à la colonne 3B du Tableau des quantités de référence :
(i) la mesure domestique applicable au produit,
(ii) la mesure métrique applicable au produit.
(1) La portion exprimée en unité métrique est arrondie :
a) lorsqu’elle est inférieure à 10 g ou 10 mL : au plus proche multiple de 0,1 g ou 0,1 mL;
b) lorsqu’elle est égale ou supérieure à 10 g ou 10 mL : au plus proche multiple de 1 g ou 1 mL.
(2) La portion exprimée en fraction est représentée par un numérateur et un dénominateur séparés d’une barre.
(3) La portion comprend le terme « assortis » lorsque le tableau de la valeur nutritive du produit préemballé qui contient un assortiment d’aliments indique les renseignements qui correspondent à une valeur composée.
2 Valeur énergétique « Calories » ou « Calories totales » La valeur est exprimée en Calories par portion indiquée. La valeur est arrondie :
a) lorsqu’elle est inférieure à 5 Calories :
(i) si le produit répond aux critères mentionnés à la colonne 2 de l’article 1 du Tableau des mentions et des allégations autorisées concernant la teneur nutritive en regard du sujet « sans énergie » visé à la colonne 1 : à 0 Calorie,
(ii) dans les autres cas : au plus proche multiple de 1 Calorie;
b) lorsqu’elle est égale ou supérieure à 5 Calories sans dépasser 50 Calories : au plus proche multiple de 5 Calories;
c) lorsqu’elle est supérieure à 50 Calories : au plus proche multiple de 10 Calories.
3 Teneur en lipides « Lipides » ou « Total des lipides » La teneur est exprimée :
a) en grammes par portion indiquée;
b) en pourcentage de la valeur quotidienne par portion indiquée.
(1) La teneur est arrondie :
a) lorsqu’elle est inférieure à 0,5 g :
(i) si le produit répond aux critères mentionnés à la colonne 2 de l’article 11 du Tableau des mentions et des allégations autorisées concernant la teneur nutritive en regard du sujet « sans lipides » visé à la colonne 1 et si les teneurs en acides gras saturés et en acides gras trans sont exprimées par « 0 g » au tableau de la valeur nutritive, ou sont omises de ce tableau conformément au paragraphe B.01.401(6), et qu’aucun autre acide gras n’est exprimé par une valeur supérieure à 0 g : à 0 g,
(ii) dans les autres cas : au plus proche multiple de 0,1 g;
b) lorsqu’elle est égale ou supérieure à 0,5 g sans dépasser 5 g : au plus proche multiple de 0,5 g;
c) lorsqu’elle est supérieure à 5 g : au plus proche multiple de 1 g.
(2) Le pourcentage est arrondi :
a) lorsque la teneur déclarée est « 0 g » : à 0 %;
b) dans les autres cas : au plus proche multiple de 1 %.
4 Teneur en acides gras saturés « Acides gras saturés », « Lipides saturés » ou « saturés » La teneur est exprimée en grammes par portion indiquée. La teneur est arrondie :
a) lorsqu’elle est inférieure à 0,5 g :
(i) si le produit répond aux critères mentionnés à la colonne 2 de l’article 18 du Tableau des mentions et des allégations autorisées concernant la teneur nutritive en regard du sujet « sans acides gras saturés » visé à la colonne 1 : à 0 g,
(ii) dans les autres cas : au plus proche multiple de 0,1 g;
b) lorsqu’elle est égale ou supérieure à 0,5 g sans dépasser 5 g : au plus proche multiple de 0,5 g;
c) lorsqu’elle est supérieure à 5 g : au plus proche multiple de 1 g.
5 Teneur en acides gras trans « Acides gras trans », « Lipides trans » ou « trans » La teneur est exprimée en grammes par portion indiquée. La teneur est arrondie :
a) lorsqu’elle est inférieure à 0,5 g :
(i) si le produit répond aux critères mentionnés à la colonne 2 de l’article 22 du Tableau des mentions et des allégations autorisées concernant la teneur nutritive en regard du sujet « sans acides gras trans » visé à la colonne 1 : à 0 g,
(ii) dans les autres cas : au plus proche multiple de 0,1 g;
b) lorsqu’elle est égale ou supérieure à 0,5 g sans dépasser 5 g : au plus proche multiple de 0,5 g;
c) lorsqu’elle est supérieure à 5 g : au plus proche multiple de 1 g.
6 Somme des acides gras saturés et des acides gras trans « Acides gras saturés + acides gras trans », « Lipides saturés + lipides trans » ou « saturés + trans » La somme est exprimée en pourcentage de la valeur quotidienne par portion indiquée. Le pourcentage est arrondi :
a) lorsque les teneurs en acides gras saturés et en acides gras trans déclarées sont « 0 g » : à 0 %;
b) dans les autres cas : au plus proche multiple de 1 %.
7 Teneur en cholestérol « Cholestérol » La teneur :
a) est exprimée en milligrammes par portion indiquée;
b) peut aussi être exprimée en pourcentage de la valeur quotidienne par portion indiquée.
(1) La teneur est arrondie :
a) si le produit répond aux critères mentionnés à la colonne 2 de l’article 27 du Tableau des mentions et des allégations autorisées concernant la teneur nutritive en regard du sujet « sans cholestérol » visé à la colonne 1 : à 0 mg;
b) dans les autres cas : au plus proche multiple de 5 mg.
(2) Le pourcentage est arrondi :
a) lorsque la teneur déclarée est « 0 mg » : à 0 %;
b) dans les autres cas : au plus proche multiple de 1 %.
8 Teneur en sodium « Sodium » La teneur est exprimée :
a) en milligrammes par portion indiquée;
b) en pourcentage de la valeur quotidienne par portion indiquée.
(1) La teneur est arrondie :
a) lorsqu’elle est inférieure à 5 mg :
(i) si le produit répond aux critères mentionnés à la colonne 2 de l’article 31 du Tableau des mentions et des allégations autorisées concernant la teneur nutritive en regard du sujet « sans sodium ou sans sel » visé à la colonne 1 : à 0 mg,
(ii) dans les autres cas : au plus proche multiple de 1 mg;
b) lorsqu’elle est égale ou supérieure à 5 mg sans dépasser 140 mg : au plus proche multiple de 5 mg;
c) lorsqu’elle est supérieure à 140 mg : au plus proche multiple de 10 mg.
(2) Le pourcentage est arrondi :
a) lorsque la teneur déclarée est « 0 mg » : à 0 %;
b) dans les autres cas : au plus proche multiple de 1 %.
9 Teneur en glucides « Glucides » ou « Total des glucides » La teneur est exprimée en grammes par portion indiquée. La teneur est arrondie :
a) lorsqu’elle est inférieure à 0,5 g : à 0 g;
b) lorsqu’elle est égale ou supérieure à 0,5 g : au plus proche multiple de 1 g.
10 Teneur en fibres « Fibres » ou « Fibres alimentaires » La teneur est exprimée :
a) en grammes par portion indiquée;
b) en pourcentage de la valeur quotidienne par portion indiquée.
(1) La teneur est arrondie :
a) lorsqu’elle est inférieure à 0,5 g : à 0 g;
b) lorsqu’elle est égale ou supérieure à 0,5 g : au plus proche multiple de 1 g.
(2) Le pourcentage est arrondi :
a) lorsque la teneur déclarée est « 0 g » : à 0 %;
b) dans les autres cas : au plus proche multiple de 1 %.
11 Teneur en sucres « Sucres » La teneur est exprimée :
a) en grammes par portion indiquée;
b) en pourcentage de la valeur quotidienne par portion indiquée.
(1) La teneur est arrondie :
a) lorsqu’elle est inférieure à 0,5 g : à 0 g;
b) lorsqu’elle est égale ou supérieure à 0,5 g : au plus proche multiple de 1 g.
(2) Le pourcentage est arrondi :
a) lorsque la teneur déclarée est « 0 g » : à 0 %;
b) dans les autres cas : au plus proche multiple de 1 %.
12 Teneur en protéines « Protéines » La teneur est exprimée en grammes par portion indiquée. La teneur est arrondie :
a) lorsqu’elle est inférieure à 0,5 g : au plus proche multiple de 0,1 g;
b) lorsqu’elle est égale ou supérieure à 0,5 g : au plus proche multiple de 1 g.
13 Teneur en potassium « Potassium » La teneur est exprimée :
a) en milligrammes par portion indiquée;
b) en pourcentage de la valeur quotidienne par portion indiquée.
(1) La teneur est arrondie :
a) lorsqu’elle est inférieure à 5 mg : à 0 mg;
b) lorsqu’elle est égale ou supérieure à 5 mg mais moins de 50 mg : au plus proche multiple de 10 mg;
c) lorsqu’elle est égale ou supérieure à 50 mg mais moins de 250 mg : au plus proche multiple de 25 mg;
d) lorsqu’elle est égale ou supérieure à 250 mg : au plus proche multiple de 50 mg.
(2) Le pourcentage est arrondi :
a) lorsque la teneur déclarée est « 0 mg » : à 0 %;
b) dans les autres cas : au plus proche multiple de 1 %.
14 Teneur en calcium « Calcium » La teneur est exprimée :
a) en milligrammes par portion indiquée;
b) en pourcentage de la valeur quotidienne par portion indiquée.
(1) La teneur est arrondie :
a) lorsqu’elle est inférieure à 5 mg : à 0 mg;
b) lorsqu’elle est égale ou supérieure à 5 mg mais moins de 50 mg : au plus proche multiple de 10 mg;
c) lorsqu’elle est égale ou supérieure à 50 mg mais moins de 250 mg : au plus proche multiple de 25 mg;
d) lorsqu’elle est égale ou supérieure à 250 mg : au plus proche multiple de 50 mg.
(2) Le pourcentage est arrondi :
a) lorsque la teneur déclarée est « 0 mg » : à 0 %;
b) dans les autres cas : au plus proche multiple de 1 %.
15 Teneur en fer « Fer » La teneur est exprimée :
a) en milligrammes par portion indiquée;
b) en pourcentage de la valeur quotidienne par portion indiquée.
(1) La teneur est arrondie :
a) lorsqu’elle est inférieure à 0,05 mg : à 0 mg;
b) lorsqu’elle est égale ou supérieure à 0,05 mg mais moins de 0,5 mg : au plus proche multiple de 0,1 mg;
c) lorsqu’elle est égale ou supérieure à 0,5 mg mais moins de 2,5 mg : au plus proche multiple de 0,25 mg;
d) lorsqu’elle est égale ou supérieure à 2,5 mg : au plus proche multiple de 0,5 mg.
(2) Le pourcentage est arrondi :
a) lorsque la teneur déclarée est « 0 mg » : à 0 %;
b) dans les autres cas : au plus proche multiple de 1 %.
16 Énoncé interprétatif du % de la valeur quotidienne « *5 % ou moins c’est peu, 15 % ou plus c’est beaucoup » [non-applicable] Le sous-titre « % valeur quotidienne » ou « % VQ » est suivi d’un astérisque qui signale l’énoncé interprétatif du % de la valeur quotidienne figurant au tableau de la valeur nutritive.
- DORS/2003-11, art. 20
- DORS/2007-176, art. 5
- DORS/2016-305, art. 18, 73 et 75(F)
- DORS/2021-57, art. 9
- DORS/2022-143, art. 18(A)
- DORS/2022-168, art. 14
- DORS/2022-168, art. 52
- DORS/2022-169, art. 15
Renseignements complémentaires
B.01.402 (1) Le tableau de la valeur nutritive peut également indiquer les renseignements visés à la colonne 1 du tableau du présent article.
(2) Les renseignements visés à la colonne 1 du tableau du présent article qui sont présentés dans le tableau de la valeur nutritive sont exprimés au moyen de la nomenclature indiquée dans la colonne 2, de l’unité indiquée dans la colonne 3 et des règles d’écriture indiquées dans la colonne 4.
(2.1) Pour l’application du paragraphe (2), la portion indiquée qui est exprimée en unité métrique dans le tableau de la valeur nutritive d’un produit préemballé sert de fondement pour établir les renseignements relatifs à la valeur énergétique et aux éléments nutritifs qui figurent au tableau de la valeur nutritive du produit.
(2.2) Le pourcentage de la valeur quotidienne d’une vitamine ou d’un minéral nutritif qui, aux termes du paragraphe (2), figure dans le tableau de la valeur nutritive d’un produit préemballé est établi sur la base de la teneur en poids de la vitamine ou du minéral nutritif dans le produit, par portion indiquée, une fois la teneur arrondie selon les règles d’écriture applicables prévues à la colonne 4 du tableau du présent article.
(3) Le tableau de la valeur nutritive indique la teneur en acides gras polyinsaturés oméga-6, en polyinsaturés oméga-3 et en monoinsaturés dans l’un ou l’autre des cas suivants :
a) la teneur en un de ces groupes d’acides gras ou la teneur en acides gras polyinsaturés est indiquée dans le tableau ou sur l’étiquette du produit préemballé ou encore dans l’annonce d’un tel produit faite par le fabricant du produit ou sous ses ordres;
b) la teneur en un acide gras est indiquée sur l’étiquette du produit préemballé ou encore dans l’annonce d’un tel produit faite par le fabricant du produit ou sous ses ordres.
(4) Lorsqu’une déclaration expresse ou implicite incluant des renseignements visés à la colonne 1 du tableau du présent article est faite sur l’étiquette du produit préemballé ou encore dans l’annonce d’un tel produit faite par le fabricant du produit ou sous ses ordres, ces renseignements sont aussi mentionnés dans le tableau de la valeur nutritive.
(5) [Abrogé, DORS/2016-305, art. 19]
(6) Le tableau de la valeur nutritive du produit préemballé indique la teneur en un polyalcool, en une vitamine ou en un minéral nutritif ajoutés au produit préemballé, à l’exclusion de l’iodure ajouté à du sel de table ou d’usage domestique général et du fluorure ajouté à de l’eau ou à de la glace préemballées.
(7) Le tableau de la valeur nutritive de tout produit préemballé dont un ingrédient, autre que de la farine, contient une vitamine ou un minéral nutritif déclaré comme constituant de cet ingrédient en indique la teneur.
(8) [Abrogé, DORS/2018-108, art. 395]
(9) Si les renseignements visés à la colonne 1 du tableau du présent article paraissent dans le tableau de la valeur nutritive, ils figurent :
a) soit en français et en anglais;
b) soit dans l’une de ces langues, si, conformément aux paragraphes B.01.012(3) ou (7), les renseignements devant être indiqués sur l’étiquette du produit aux termes du présent règlement peuvent l’être uniquement dans la langue en cause et qu’ils y figurent dans celle-ci.
TABLEAU
Renseignements complémentaires
Article Colonne 1 Colonne 2 Colonne 3 Colonne 4 Renseignements Nomenclature Unité Règles d’écriture 1 Portions par emballage « Portions par contenant », « (nombre d’unités) par contenant », « Portions par emballage », « (nombre d’unités) par emballage », « portions par (type d’emballage) » ou « (nombre d’unités) par (type d’emballage) » La quantité est exprimée en nombre de portions. (1) La quantité est arrondie :
a) lorsqu’elle est inférieure à 2, au plus proche multiple de 1;
b) lorsqu’elle est égale ou supérieure à 2 sans dépasser 5 : au plus proche multiple de 0,5;
c) lorsqu’elle est supérieure à 5 : au plus proche multiple de 1.
(2) Si la quantité est arrondie, elle est précédée du mot « environ ».
(3) Si le poids du produit varie, la quantité peut être déclarée « variable ».
2 Valeur énergétique « kilojoules » ou « kJ » La valeur est exprimée en kilojoules par portion indiquée. La valeur est arrondie au plus proche multiple de 10 kilojoules. 3 et 4 [Abrogés, DORS/2016-305, art. 19] 5 Teneur en acides gras polyinsaturés « Acides gras polyinsaturés », « Lipides polyinsaturés » ou « polyinsaturés » La teneur est exprimée en grammes par portion indiquée. La teneur est arrondie :
a) lorsqu’elle est inférieure à 1 g : au plus proche multiple de 0,1 g;
b) lorsqu’elle est égale ou supérieure à 1 g sans dépasser 5 g : au plus proche multiple de 0,5 g;
c) lorsqu’elle est supérieure à 5 g : au plus proche multiple de 1 g.
6 Teneur en acides gras polyinsaturés oméga-6 (1) Si le tableau de la valeur nutritive indique la teneur en acides gras polyinsaturés : « oméga-6 », « Acides gras polyinsaturés oméga-6 », « Lipides polyinsaturés oméga-6 » ou « polyinsaturés oméga-6 »
(2) Dans les autres cas : « Acides gras polyinsaturés oméga-6 », « Lipides polyinsaturés oméga-6 » ou « polyinsaturés oméga-6 »
La teneur est exprimée en grammes par portion indiquée. La teneur est arrondie :
a) lorsqu’elle est inférieure à 1 g : au plus proche multiple de 0,1 g;
b) lorsqu’elle est égale ou supérieure à 1 g sans dépasser 5 g : au plus proche multiple de 0,5 g;
c) lorsqu’elle est supérieure à 5 g : au plus proche multiple de 1 g.
7 Teneur en acides gras polyinsaturés oméga-3 (1) Si le tableau de la valeur nutritive indique la teneur en acides gras polyinsaturés : « oméga-3 », « Acides gras polyinsaturés oméga-3 », « Lipides polyinsaturés oméga-3 » ou « polyinsaturés oméga-3 »
(2) Dans les autres cas : « Acides gras polyinsaturés oméga-3 », « Lipides polyinsaturés oméga-3 » ou « polyinsaturés oméga-3 »
La teneur est exprimée en grammes par portion indiquée. La teneur est arrondie :
a) lorsqu’elle est inférieure à 1 g : au plus proche multiple de 0,1 g;
b) lorsqu’elle est égale ou supérieure à 1 g sans dépasser 5 g : au plus proche multiple de 0,5 g;
c) lorsqu’elle est supérieure à 5 g : au plus proche multiple de 1 g.
8 Teneur en acides gras monoinsaturés « Acides gras monoinsaturés », « Lipides monoinsaturés » ou « monoinsaturés » La teneur est exprimée en grammes par portion indiquée. La teneur est arrondie :
a) lorsqu’elle est inférieure à 1 g : au plus proche multiple de 0,1 g;
b) lorsqu’elle est égale ou supérieure à 1 g, sans dépasser 5 g : au plus proche multiple de 0,5 g;
c) lorsqu’elle est supérieure à 5 g : au plus proche multiple de 1 g.
9 [Abrogé, DORS/2016-305, art. 19] 10 Teneur en fibres solubles « Fibres solubles » La teneur est exprimée en grammes par portion indiquée. La teneur est arrondie :
a) lorsqu’elle est inférieure à 0,5 g : à 0 g;
b) lorsqu’elle est égale ou supérieure à 0,5 g : au plus proche multiple de 1 g.
11 Teneur en fibres insolubles « Fibres insolubles » La teneur est exprimée en grammes par portion indiquée. La teneur est arrondie :
a) lorsqu’elle est inférieure à 0,5 g : à 0 g;
b) lorsqu’elle est égale ou supérieure à 0,5 g : au plus proche multiple de 1 g.
12 Teneur en polyalcools (1) Si l’aliment ne contient qu’un polyalcool : « Polyalcool », « Polyol » ou « (Nom du polyalcool) »;
(2) Dans les autres cas : « Polyalcools » ou « Polyols »
La teneur est exprimée en grammes par portion indiquée. La teneur est arrondie :
a) lorsqu’elle est inférieure à 0,5 g : à 0 g;
b) lorsqu’elle est égale ou supérieure à 0,5 g : au plus proche multiple de 1 g.
13 Teneur en amidon « Amidon » La teneur est exprimée en grammes par portion indiquée. La teneur est arrondie :
a) lorsqu’elle est inférieure à 0,5 g : à 0 g;
b) lorsqu’elle est égale ou supérieure à 0,5 g : au plus proche multiple de 1 g.
14 Teneur en vitamine A « Vitamine A » ou « Vit A » La teneur est exprimée :
a) en microgrammes par portion indiquée;
b) en pourcentage de la valeur quotidienne par portion indiquée.
(1) La teneur est arrondie :
a) lorsqu’elle est inférieure à 5 µg : à 0 µg;
b) lorsqu’elle est égale ou supérieure à 5 µg mais moins de 50 µg : au plus proche multiple de 10 µg;
c) lorsqu’elle est égale ou supérieure à 50 µg mais moins de 250 µg : au plus proche multiple de 50 µg;
d) lorsqu’elle est égale ou supérieure à 250 µg : au plus proche multiple de 100 µg.
(2) Le pourcentage est arrondi :
a) lorsque la teneur déclarée est « 0 µg » : à 0 %;
b) dans les autres cas : au plus proche multiple de 1 %.
15 Teneur en vitamine C « Vitamine C » ou « Vit C » La teneur est exprimée :
a) en milligrammes par portion indiquée;
b) en pourcentage de la valeur quotidienne par portion indiquée.
(1) La teneur est arrondie :
a) lorsqu’elle est inférieure à 0,1 mg : à 0 mg;
b) lorsqu’elle est égale ou supérieure à 0,1 mg mais moins de 1 mg : au plus proche multiple de 0,2 mg;
c) lorsqu’elle est égale ou supérieure à 1 mg mais moins de 5 mg : au plus proche multiple de 0,5 mg;
d) lorsqu’elle est égale ou supérieure à 5 mg : au plus proche multiple de 1 mg.
(2) Le pourcentage est arrondi :
a) lorsque la teneur déclarée est « 0 mg » : à 0 %;
b) dans les autres cas : au plus proche multiple de 1 %.
16 Teneur en vitamine D « Vitamine D » ou « Vit D » La teneur est exprimée :
a) en microgrammes par portion indiquée;
b) en pourcentage de la valeur quotidienne par portion indiquée.
(1) La teneur est arrondie :
a) lorsqu’elle est inférieure à 0,1 µg : à 0 µg;
b) lorsqu’elle est égale ou supérieure à 0,1 µg mais moins de 1 µg : au plus proche multiple de 0,2 µg;
c) lorsqu’elle est égale ou supérieure à 1 µg mais moins de 5 µg : au plus proche multiple de 0,5 µg;
d) lorsqu’elle est égale ou supérieure à 5 µg : au plus proche multiple de 1 µg.
(2) Le pourcentage est arrondi :
a) lorsque la teneur déclarée est « 0 µg » : à 0 %;
b) dans les autres cas : au plus proche multiple de 1 %.
17 Teneur en vitamine E « Vitamine E » ou « Vit E » La teneur est exprimée :
a) en milligrammes par portion indiquée;
b) en pourcentage de la valeur quotidienne par portion indiquée.
(1) La teneur est arrondie :
a) lorsqu’elle est inférieure à 0,05 mg : à 0 mg;
b) lorsqu’elle est égale ou supérieure à 0,05 mg mais moins de 0,5 mg : au plus proche multiple de 0,1 mg;
c) lorsqu’elle est égale ou supérieure à 0,5 mg mais moins de 2,5 mg : au plus proche multiple de 0,25 mg;
d) lorsqu’elle est égale ou supérieure à 2,5 mg : au plus proche multiple de 0,5 mg.
(2) Le pourcentage est arrondi :
a) lorsque la teneur déclarée est « 0 mg » : à 0 %;
b) dans les autres cas : au plus proche multiple de 1 %.
18 Teneur en vitamine K « Vitamine K » ou « Vit K » La teneur est exprimée :
a) en microgrammes par portion indiquée;
b) en pourcentage de la valeur quotidienne par portion indiquée.
(1) La teneur est arrondie :
a) lorsqu’elle est inférieure à 0,05 µg : à 0 µg;
b) lorsqu’elle est égale ou supérieure à 0,05 µg mais moins de 0,5 µg : au plus proche multiple de 0,1 µg;
c) lorsqu’elle est égale ou supérieure à 0,5 µg mais moins de 2,5 µg : au plus proche multiple de 0,25 µg;
d) lorsqu’elle est égale ou supérieure à 2,5 µg : au plus proche multiple de 0,5 µg.
(2) Le pourcentage est arrondi :
a) lorsque la teneur déclarée est « 0 µg » : à 0 %;
b) dans les autres cas : au plus proche multiple de 1 %.
19 Teneur en thiamine « Thiamine », « Thiamine (vitamine B1) » ou « Thiamine (vit B1) » La teneur est exprimée :
a) en milligrammes par portion indiquée;
b) en pourcentage de la valeur quotidienne par portion indiquée.
(1) La teneur est arrondie :
a) lorsqu’elle est inférieure à 0,005 mg : à 0 mg;
b) lorsqu’elle est égale ou supérieure à 0,005 mg mais moins de 0,05 mg : au plus proche multiple de 0,01 mg;
c) lorsqu’elle est égale ou supérieure à 0,05 mg mais moins de 0,25 mg : au plus proche multiple de 0,025 mg;
d) lorsqu’elle est égale ou supérieure à 0,25 mg : au plus proche multiple de 0,05 mg.
(2) Le pourcentage est arrondi :
a) lorsque la teneur déclarée est « 0 mg » : à 0 %;
b) dans les autres cas : au plus proche multiple de 1 %.
20 Teneur en riboflavine « Riboflavine », « Riboflavine (vitamine B2) » ou « Riboflavine (vit B2) » La teneur est exprimée :
a) en milligrammes par portion indiquée;
b) en pourcentage de la valeur quotidienne par portion indiquée.
(1) La teneur est arrondie :
a) lorsqu’elle est inférieure à 0,005 mg : à 0 mg;
b) lorsqu’elle est égale ou supérieure à 0,005 mg mais moins de 0,05 mg : au plus proche multiple de 0,01 mg;
c) lorsqu’elle est égale ou supérieure à 0,05 mg mais moins de 0,25 mg : au plus proche multiple de 0,025 mg;
d) lorsqu’elle est égale ou supérieure à 0,25 mg : au plus proche multiple de 0,05 mg.
(2) Le pourcentage est arrondi :
a) lorsque la teneur déclarée est « 0 mg » : à 0 %;
b) dans les autres cas : au plus proche multiple de 1 %.
21 Teneur en niacine « Niacine » La teneur est exprimée :
a) en milligrammes par portion indiquée;
b) en pourcentage de la valeur quotidienne par portion indiquée.
(1) La teneur est arrondie :
a) lorsqu’elle est inférieure à 0,05 mg : à 0 mg;
b) lorsqu’elle est égale ou supérieure à 0,05 mg mais moins de 0,5 mg : au plus proche multiple de 0,1 mg;
c) lorsqu’elle est égale ou supérieure à 0,5 mg mais moins de 2,5 mg : au plus proche multiple de 0,25 mg;
d) lorsqu’elle est égale ou supérieure à 2,5 mg : au plus proche multiple de 0,5 mg.
(2) Le pourcentage est arrondi :
a) lorsque la teneur déclarée est « 0 mg » : à 0 %;
b) dans les autres cas : au plus proche multiple de 1 %.
22 Teneur en vitamine B6 « Vitamine B6 » ou « Vit B6 » La teneur est exprimée :
a) en milligrammes par portion indiquée;
b) en pourcentage de la valeur quotidienne par portion indiquée.
(1) La teneur est arrondie :
a) lorsqu’elle est inférieure à 0,005 mg : à 0 mg;
b) lorsqu’elle est égale ou supérieure à 0,005 mg mais moins de 0,05 mg : au plus proche multiple de 0,01 mg;
c) lorsqu’elle est égale ou supérieure à 0,05 mg mais moins de 0,25 mg : au plus proche multiple de 0,025 mg;
d) lorsqu’elle est égale ou supérieure à 0,25 mg : au plus proche multiple de 0,05 mg.
(2) Le pourcentage est arrondi :
a) lorsque la teneur déclarée est « 0 mg » : à 0 %;
b) dans les autres cas : au plus proche multiple de 1 %.
23 Teneur en folate « Folate » La teneur est exprimée :
a) en microgrammes d’équivalents de folate alimentaire (ÉFA) par portion indiquée;
b) en pourcentage de la valeur quotidienne par portion indiquée.
(1) La teneur est arrondie :
a) lorsqu’elle est inférieure à 1 µg ÉFA : à 0 µg ÉFA;
b) lorsqu’elle est égale ou supérieure à 1 µg ÉFA mais moins de 10 µg ÉFA : au plus proche multiple de 2 µg ÉFA;
c) lorsqu’elle est égale ou supérieure à 10 µg ÉFA mais moins de 50 µg ÉFA : au plus proche multiple de 5 µg ÉFA;
d) lorsqu’elle est égale ou supérieure à 50 µg ÉFA : au plus proche multiple de 10 µg ÉFA.
(2) Le pourcentage est arrondi :
a) lorsque la teneur déclarée est « 0 µg ÉFA » : à 0 %;
b) dans les autres cas : au plus proche multiple de 1 %.
24 Teneur en vitamine B12 « Vitamine B12 » ou « Vit B12 » La teneur est exprimée :
a) en microgrammes par portion indiquée;
b) en pourcentage de la valeur quotidienne par portion indiquée.
(1) La teneur est arrondie :
a) lorsqu’elle est inférieure à 0,005 µg : à 0 µg;
b) lorsqu’elle est égale ou supérieure à 0,005 µg mais moins de 0,05 µg : au plus proche multiple de 0,01 µg;
c) lorsqu’elle est égale ou supérieure à 0,05 µg mais moins de 0,25 µg : au plus proche multiple de 0,025 µg;
d) lorsqu’elle est égale ou supérieure à 0,25 µg : au plus proche multiple de 0,05 µg.
(2) Le pourcentage est arrondi :
a) lorsque la teneur déclarée est « 0 µg » : à 0 %;
b) dans les autres cas : au plus proche multiple de 1 %.
25 Teneur en biotine « Biotine » La teneur est exprimée :
a) en microgrammes par portion indiquée;
b) en pourcentage de la valeur quotidienne par portion indiquée.
(1) La teneur est arrondie :
a) lorsqu’elle est inférieure à 0,05 µg : à 0 µg;
b) lorsqu’elle est égale ou supérieure à 0,05 µg mais moins de 0,5 µg : au plus proche multiple de 0,1 µg;
c) lorsqu’elle est égale ou supérieure à 0,5 µg mais moins de 2,5 µg : au plus proche multiple de 0,25 µg;
d) lorsqu’elle est égale ou supérieure à 2,5 µg : au plus proche multiple de 0,5 µg.
(2) Le pourcentage est arrondi :
a) lorsque la teneur déclarée est « 0 µg » : à 0 %;
b) dans les autres cas : au plus proche multiple de 1 %.
26 Teneur en acide pantothénique « Acide pantothénique » ou « Pantothénate » La teneur est exprimée :
a) en milligrammes par portion indiquée;
b) en pourcentage de la valeur quotidienne par portion indiquée.
(1) La teneur est arrondie :
a) lorsqu’elle est inférieure à 0,01 mg : à 0 mg;
b) lorsqu’elle est égale ou supérieure à 0,01 mg mais moins de 0,1 mg : au plus proche multiple de 0,02 mg;
c) lorsqu’elle est égale ou supérieure à 0,1 mg mais moins de 0,5 mg : au plus proche multiple de 0,05 mg;
d) lorsqu’elle est égale ou supérieure à 0,5 mg : au plus proche multiple de 0,1 mg.
(2) Le pourcentage est arrondi :
a) lorsque la teneur déclarée est « 0 mg » : à 0 %;
b) dans les autres cas : au plus proche multiple de 1 %.
27 Teneur en choline « Choline » La teneur est exprimée :
a) en milligrammes par portion indiquée;
b) en pourcentage de la valeur quotidienne par portion indiquée.
(1) La teneur est arrondie :
a) lorsqu’elle est inférieure à 1 mg : à 0 mg;
b) lorsqu’elle est égale ou supérieure à 1 mg mais moins de 10 mg : au plus proche multiple de 2 mg;
c) lorsqu’elle est égale ou supérieure à 10 mg mais moins de 50 mg : au plus proche multiple de 5 mg;
d) lorsqu’elle est égale ou supérieure à 50 mg : au plus proche multiple de 10 mg.
(2) Le pourcentage est arrondi :
a) lorsque la teneur déclarée est « 0 mg » : à 0 %;
b) dans les autres cas : au plus proche multiple de 1 %.
28 Teneur en phosphore « Phosphore » La teneur est exprimée :
a) en milligrammes par portion indiquée;
b) en pourcentage de la valeur quotidienne par portion indiquée.
(1) La teneur est arrondie :
a) lorsqu’elle est inférieure à 5 mg : à 0 mg;
b) lorsqu’elle est égale ou supérieure à 5 mg mais moins de 50 mg : au plus proche multiple de 10 mg;
c) lorsqu’elle est égale ou supérieure à 50 mg mais moins de 250 mg : au plus proche multiple de 25 mg;
d) lorsqu’elle est égale ou supérieure à 250 mg : au plus proche multiple de 50 mg.
(2) Le pourcentage est arrondi :
a) lorsque la teneur déclarée est « 0 mg » : à 0 %;
b) dans les autres cas : au plus proche multiple de 1 %.
29 Teneur en iode « Iodure » ou « Iode » La teneur est exprimée :
a) en microgrammes par portion indiquée;
b) en pourcentage de la valeur quotidienne par portion indiquée.
(1) La teneur est arrondie :
a) lorsqu’elle est inférieure à 1 µg : à 0 µg;
b) lorsqu’elle est égale ou supérieure à 1 µg mais moins de 10 µg : au plus proche multiple de 2 µg;
c) lorsqu’elle est égale ou supérieure à 10 µg mais moins de 50 µg : au plus proche multiple de 5 µg;
d) lorsqu’elle est égale ou supérieure à 50 µg : au plus proche multiple de 10 µg.
(2) Le pourcentage est arrondi :
a) lorsque la teneur déclarée est « 0 µg » : à 0 %;
b) dans les autres cas : au plus proche multiple de 1 %.
30 Teneur en magnésium « Magnésium » La teneur est exprimée :
a) en milligrammes par portion indiquée;
b) en pourcentage de la valeur quotidienne par portion indiquée.
(1) La teneur est arrondie :
a) lorsqu’elle est inférieure à 1 mg : à 0 mg;
b) lorsqu’elle est égale ou supérieure à 1 mg mais moins de 10 mg : au plus proche multiple de 2 mg;
c) lorsqu’elle est égale ou supérieure à 10 mg mais moins de 50 mg : au plus proche multiple de 5 mg;
d) lorsqu’elle est égale ou supérieure à 50 mg : au plus proche multiple de 10 mg.
(2) Le pourcentage est arrondi :
a) lorsque la teneur déclarée est « 0 mg » : à 0 %;
b) dans les autres cas : au plus proche multiple de 1 %.
31 Teneur en zinc « Zinc » La teneur est exprimée :
a) en milligrammes par portion indiquée;
b) en pourcentage de la valeur quotidienne par portion indiquée.
(1) La teneur est arrondie :
a) lorsqu’elle est inférieure à 0,05 mg : à 0 mg;
b) lorsqu’elle est égale ou supérieure à 0,05 mg mais moins de 0,5 mg : au plus proche multiple de 0,1 mg;
c) lorsqu’elle est égale ou supérieure à 0,5 mg mais moins de 2,5 mg : au plus proche multiple de 0,25 mg;
d) lorsqu’elle est égale ou supérieure à 2,5 mg : au plus proche multiple de 0,5 mg.
(2) Le pourcentage est arrondi :
a) lorsque la teneur déclarée est « 0 mg » : à 0 %;
b) dans les autres cas : au plus proche multiple de 1 %.
32 Teneur en sélénium « Sélénium » La teneur est exprimée :
a) en microgrammes par portion indiquée;
b) en pourcentage de la valeur quotidienne par portion indiquée.
(1) La teneur est arrondie :
a) lorsqu’elle est inférieure à 0,1 µg : à 0 µg;
b) lorsqu’elle est égale ou supérieure à 0,1 µg mais moins de 1 µg : au plus proche multiple de 0,2 µg;
c) lorsqu’elle est égale ou supérieure à 1 µg mais moins de 5 µg : au plus proche multiple de 0,5 µg;
d) lorsqu’elle est égale ou supérieure à 5 µg : au plus proche multiple de 1 µg.
(2) Le pourcentage est arrondi :
a) lorsque la teneur, déclarée est « 0 µg » : à 0 %;
b) dans les autres cas : au plus proche multiple de 1 %.
33 Teneur en cuivre « Cuivre » La teneur est exprimée :
a) en milligrammes par portion indiquée;
b) en pourcentage de la valeur quotidienne par portion indiquée.
(1) La teneur est arrondie :
a) lorsqu’elle est inférieure à 0,0015 mg : à 0 mg;
b) lorsqu’elle est égale ou supérieure à 0,0015 mg mais moins de 0,025 mg : au plus proche multiple de 0,002 mg;
c) lorsqu’elle est égale ou supérieure à 0,025 mg mais moins de 0,05 mg : au plus proche multiple de 0,005 mg;
d) lorsqu’elle est égale ou supérieure à 0,05 mg : au plus proche multiple de 0,01 mg.
(2) Le pourcentage est arrondi :
a) lorsque la teneur déclarée est « 0 mg » : à 0 %;
b) dans les autres cas : au plus proche multiple de 1 %.
34 Teneur en manganèse « Manganèse » La teneur est exprimée :
a) en milligrammes par portion indiquée;
b) en pourcentage de la valeur quotidienne par portion indiquée.
(1) La teneur est arrondie :
a) lorsqu’elle est inférieure à 0,005 mg : à 0 mg;
b) lorsqu’elle est égale ou supérieure à 0,005 mg mais moins de 0,05 mg : au plus proche multiple de 0,01 mg;
c) lorsqu’elle est égale ou supérieure à 0,05 mg mais moins de 0,25 mg : au plus proche multiple de 0,025 mg;
d) lorsqu’elle est égale ou supérieure à 0,25 mg : au plus proche multiple de 0,05 mg.
(2) Le pourcentage est arrondi :
a) lorsque la teneur déclarée est « 0 mg » : à 0 %;
b) dans les autres cas : au plus proche multiple de 1 %.
35 Teneur en chrome « Chrome » La teneur est exprimée :
a) en microgrammes par portion indiquée;
b) en pourcentage de la valeur quotidienne par portion indiquée.
(1) La teneur est arrondie :
a) lorsqu’elle est inférieure à 0,05 µg : à 0 µg;
b) lorsqu’elle est égale ou supérieure à 0,05 µg mais moins de 0,5 µg : au plus proche multiple de 0,1 µg;
c) lorsqu’elle est égale ou supérieure à 0,5 µg mais moins de 2,5 µg : au plus proche multiple de 0,25 µg;
d) lorsqu’elle est égale ou supérieure à 2,5 µg : au plus proche multiple de 0,5 µg.
(2) Le pourcentage est arrondi :
a) lorsque la teneur déclarée est « 0 µg » : à 0 %;
b) dans les autres cas : au plus proche multiple de 1 %.
36 Teneur en molybdène « Molybdène » La teneur est exprimée :
a) en microgrammes par portion indiquée;
b) en pourcentage de la valeur quotidienne par portion indiquée.
(1) La teneur est arrondie :
a) lorsqu’elle est inférieure à 0,05 µg : à 0 µg;
b) lorsqu’elle est égale ou supérieure à 0,05 µg mais moins de 0,5 µg : au plus proche multiple de 0,1 µg;
c) lorsqu’elle est égale ou supérieure à 0,5 µg mais moins de 2,5 µg : au plus proche multiple de 0,25 µg;
d) lorsqu’elle est égale ou supérieure à 2,5 µg : au plus proche multiple de 0,5 µg.
(2) Le pourcentage est arrondi :
a) lorsque la teneur déclarée est « 0 µg » : à 0 %;
b) dans les autres cas : au plus proche multiple de 1 %.
37 Teneur en chlorure « Chlorure » La teneur est exprimée :
a) en milligrammes par portion indiquée;
b) en pourcentage de la valeur quotidienne par portion indiquée.
(1) La teneur est arrondie :
a) lorsqu’elle est inférieure à 5 mg : à 0 mg;
b) lorsqu’elle est égale ou supérieure à 5 mg mais moins de 50 mg : au plus proche multiple de 10 mg;
c) lorsqu’elle est égale ou supérieure à 50 mg mais moins de 250 mg : au plus proche multiple de 25 mg;
d) lorsqu’elle est égale ou supérieure à 250 mg : au plus proche multiple de 50 mg.
(2) Le pourcentage est arrondi :
a) lorsque la teneur déclarée est « 0 mg » : à 0 %;
b) dans les autres cas : au plus proche multiple de 1 %.
- DORS/2003-11, art. 20
- err., Vol. 137, no 5
- DORS/2005-98, art. 2(F)
- DORS/2016-305, art. 19 et 75(F)
- DORS/2018-108, art. 395
Aliments pour bébés âgés d’au moins six mois mais de moins d’un an
- DORS/2016-305, art. 20
B.01.403 (1) Le présent article s’applique à tout produit préemballé destiné exclusivement aux bébés âgés d’au moins six mois mais de moins d’un an.
(2) Le tableau de la valeur nutritive du produit préemballé ne peut indiquer le pourcentage de la valeur quotidienne des lipides, des fibres, des sucres, du cholestérol, du sodium ou de la somme des acides gras saturés et des acides gras trans.
(3) Les teneurs en acides gras saturés, en acides gras trans et en cholestérol peuvent être omises du tableau de la valeur nutritive.
(4) Malgré le paragraphe (3), le tableau de la valeur nutritive qui indique la teneur en cholestérol doit également indiquer la teneur en acides gras saturés et la teneur en acides gras trans.
(5) Si au moins cinq des renseignements relatifs à la valeur énergétique et aux éléments nutritifs visés à la colonne 1 des articles 2, 3 et 8 à 15 du tableau de l’article B.01.401 peuvent être exprimés, conformément à cet article, par « 0 » au tableau de la valeur nutritive du produit préemballé, le tableau peut ne contenir que les renseignements suivants :
a) la portion indiquée;
b) la valeur énergétique;
c) la teneur en lipides;
d) la teneur en glucides;
e) la teneur en protéines;
f) la teneur en tout élément nutritif qui fait l’objet d’une des déclarations visées au sous-alinéa B.01.401(3)e)(ii);
g) la teneur en un polyalcool, en une vitamine ou en un minéral nutritif ajoutés au produit, à l’exclusion du fluorure ajouté à de l’eau ou à de la glace préemballées;
h) la teneur en une vitamine ou en un minéral nutritif déclaré comme constituant d’un ingrédient du produit, à l’exclusion de la farine;
i) la teneur en tout élément nutritif visé à la colonne 1 des articles 8, 10, 11 et 13 à 15 du tableau de l’article B.01.401 qui ne peut être exprimée par « 0 » au tableau de la valeur nutritive;
j) sauf dans le cas mentionné à l’alinéa k), la mention « Source négligeable de (désignation de tout élément nutritif omis conformément au présent paragraphe) »; la mention peut toutefois être omise en ce qui concerne les acides gras saturés, les acides gras trans et le cholestérol;
k) si le produit remplit les conditions du paragraphe B.01.462(3), la mention « Source négligeable d’autres éléments nutritifs » ou la mention visée à l’alinéa j).
- DORS/2003-11, art. 20
- DORS/2016-305, art. 21 et 75(F)
Aliments utilisés dans la fabrication d’autres aliments
B.01.404 (1) Sous réserve de l’article B.29.004, le présent article s’applique à tout produit préemballé qui est destiné uniquement à être utilisé comme ingrédient dans la fabrication d’autres produits préemballés destinés à être vendus au consommateur au niveau du commerce de détail ou comme ingrédient dans la préparation d’aliments par une entreprise commerciale ou industrielle ou par une institution.
(2) Il est interdit de vendre le produit préemballé à moins que des renseignements nutritionnels écrits concernant le produit l’accompagnent lors de sa livraison à l’acheteur.
(3) Les renseignements nutritionnels :
a) comprennent ceux que le tableau de la valeur nutritive indiquerait, n’eût été le paragraphe B.01.401(7), aux termes des articles B.01.401 et B.01.402;
b) peuvent comprendre ceux que le tableau de la valeur nutritive peut indiquer aux termes de l’article B.01.402;
c) sont présentés conformément aux articles B.01.401 et B.01.402, sous réserve des modifications suivantes :
(i) les renseignements concernant les vitamines mentionnées au paragraphe D.01.002(1) sont exprimés au moyen de l’unité applicable indiquée au paragraphe D.01.003(1) et ceux concernant les minéraux nutritifs figurant aux alinéas D.02.001(1)a) à j), l) à n) et p) sont exprimés en milligrammes pour le sodium, le potassium, le calcium, le phosphore, le magnésium, le fer, le zinc, le chlore, le cuivre et le manganèse et en microgrammes pour l’iode, le chrome, le sélénium et le molybdène,
(A) par gramme ou 100 grammes de l’aliment, dans le cas où la quantité nette de l’aliment est mentionnée en poids ou en nombre sur l’étiquette,
(B) par millilitre ou 100 millilitres de l’aliment, dans le cas où la quantité nette de l’aliment est mentionnée en volume sur l’étiquette,
(ii) les renseignements concernant les autres éléments nutritifs ainsi que la valeur énergétique, figurant à la colonne 1 des tableaux des articles B.01.401 ou B.01.402 sont exprimés au moyen d’une unité visée à la colonne 3 :
(A) par gramme ou 100 grammes de l’aliment, dans le cas où la quantité nette de l’aliment est mentionnée en poids ou en nombre sur l’étiquette,
(B) par millilitre ou 100 millilitres de l’aliment, dans le cas où la quantité nette de l’aliment est mentionnée en volume sur l’étiquette,
(iii) le pourcentage de la valeur quotidienne et les renseignements concernant la portion indiquée peuvent être omis,
(iv) les renseignements nutritionnels sont indiqués avec un degré de précision qui correspond à la précision des méthodes analytiques utilisées pour produire ces renseignements.
- DORS/2003-11, art. 20
- DORS/2016-305, art. 22, 73 et 75(F)
- DORS/2022-169, art. 16
Aliments pour entreprise ou institution
B.01.405 (1) Le présent article s’applique à tout produit préemballé à portions multiples — autre qu’un aliment supplémenté — prêt à servir et destiné uniquement à être servi par une entreprise commerciale ou industrielle ou par une institution.
(2) Il est interdit de vendre le produit préemballé à moins que des renseignements nutritionnels écrits concernant le produit l’accompagnent lors de sa livraison à l’acheteur.
(3) Les renseignements nutritionnels :
a) comprennent ceux que le tableau de la valeur nutritive indiquerait, n’eût été le paragraphe B.01.401(7), aux termes des articles B.01.401 et B.01.402;
b) peuvent comprendre ceux que le tableau de la valeur nutritive peut indiquer en vertu de l’article B.01.402;
c) sont présentés conformément aux articles B.01.401 et B.01.402.
- DORS/2003-11, art. 20
- DORS/2016-305, art. 23
- DORS/2022-169, art. 17
Objet des renseignements
B.01.406 (1) Sous réserve des paragraphes (2) à (8), le tableau de la valeur nutritive indique les renseignements uniquement en fonction du produit préemballé tel qu’il est vendu.
(2) Le tableau de la valeur nutritive de tout produit préemballé qui comprend des ingrédients ou des aliments emballés séparément et destinés à être consommés ensemble indique les renseignements en fonction soit de chaque ingrédient ou aliment, soit du produit dans son ensemble.
(3) Le tableau de la valeur nutritive de tout produit préemballé qui contient un assortiment d’aliments du même type et dont la portion typique ne comprend qu’un de ces aliments indique les renseignements en fonction :
a) de chaque aliment dans le produit, lorsque les renseignements nutritionnels figurant à la colonne 1 du tableau de l’article B.01.401 sont différents pour chaque aliment;
b) d’un aliment dans le produit, lorsque les renseignements nutritionnels figurant à la colonne 1 du tableau de l’article B.01.401 sont les mêmes pour chaque aliment.
(4) Le tableau de la valeur nutritive de tout produit préemballé qui contient un assortiment d’aliments du même type et dont la portion typique comprend plus d’un de ces aliments indique les renseignements qui correspondent soit à la valeur de chaque aliment, soit à une valeur composée.
(5) Le tableau de la valeur nutritive de tout produit préemballé contenant un aliment à préparer selon des instructions fournies dans ou sur l’emballage, ou qui est normalement combiné avec d’autres ingrédients ou aliments ou cuit avant d’être consommé, peut également indiquer les renseignements en fonction de l’aliment une fois préparé, auquel cas :
a) le tableau indique les renseignements ci-après en fonction de l’aliment préparé :
(i) sauf dans le cas visé au sous-alinéa (ii), la quantité de l’aliment exprimée en l’unité visée à la colonne 3 du sous-alinéa 1b)(i) du tableau de l’article B.01.401, soit « environ (la portion indiquée) » ou « environ (la portion indiquée) préparé », et, s’il y a lieu, au moyen des règles d’écriture indiquées dans la colonne 4 des paragraphes 1(1) et (2),
(ii) si l’aliment est normalement combiné avec un autre aliment, la quantité de l’autre aliment exprimée en l’unité visée à la colonne 3 du sous-alinéa 1b)(i) du tableau de l’article B.01.401,
(iii) la valeur énergétique exprimée au moyen de la nomenclature indiquée dans la colonne 2 de l’article 2 du tableau de l’article B.01.401, de l’unité indiquée dans la colonne 3 et des règles d’écriture indiquées dans la colonne 4,
(iv) les renseignements visés à la colonne 1 des articles 3, 6 à 8, 11 et 13 à 15 du tableau de l’article B.01.401 et à la colonne 1 des articles 14 à 37 du tableau de l’article B.01.402 et qui sont indiqués en pourcentage de la valeur quotidienne dans le tableau de la valeur nutritive en fonction de l’aliment tel qu’il est vendu, exprimés au moyen de la nomenclature indiquée dans la colonne 2, en pourcentage de la valeur quotidienne par portion indiquée et au moyen des règles d’écriture indiquées dans la colonne 4;
(v) [Abrogé, DORS/2016-305, art. 24]
b) le tableau peut également indiquer les renseignements ci-après en fonction des ingrédients ajoutés ou de l’autre aliment, s’ils sont déclarés dans le tableau de la valeur nutritive de l’aliment tel qu’il est vendu :
(i) les renseignements visés à la colonne 1 des articles 3 à 5 et 7 à 12 du tableau de l’article B.01.401, exprimés au moyen de la nomenclature indiquée dans la colonne 2, en milligrammes pour ceux visés à la colonne 1 des articles 7 et 8 et en grammes pour ceux visés à la colonne 1 des articles 3 à 5 et 9 à 12 et au moyen des règles d’écriture indiquées dans la colonne 4,
(ii) les renseignements visés à la colonne 1 des articles 5 à 8 et 10 à 13 du tableau de l’article B.01.402, exprimés au moyen de la nomenclature indiquée dans la colonne 2, en grammes et au moyen des règles d’écriture indiquées dans la colonne 4,
(iii) les renseignements visés à la colonne 1 de l’article 2 du tableau de l’article B.01.401, exprimés au moyen de la nomenclature indiquée dans la colonne 2, de l’unité indiquée dans la colonne 3, par portion indiquée de l’aliment préparé, et au moyen des règles d’écriture indiquées dans la colonne 4.
(6) Le paragraphe (5) ne s’applique pas aux produits préemballés destinés exclusivement aux bébés âgés d’au moins six mois mais de moins d’un an.
(7) Sous réserve du paragraphe (8), le tableau de la valeur nutritive peut aussi indiquer les renseignements en fonction d’autres quantités de l’aliment qui correspondent à différents usages ou unités de mesure de l’aliment, auquel cas :
a) le tableau indique les renseignements ci-après pour chacune des autres quantités de l’aliment :
(i) la quantité exprimée selon une mesure domestique et une mesure métrique et au moyen des règles d’écriture indiquées dans la colonne 4 du tableau de l’article B.01.401, aux paragraphes 1(1) et (2),
(ii) la valeur énergétique, exprimée au moyen de la nomenclature indiquée dans la colonne 2 de l’article 2 du tableau de l’article B.01.401, de l’unité indiquée dans la colonne 3 et des règles d’écriture indiquées dans la colonne 4,
(iii) les renseignements visés à la colonne 1 des articles 3, 6 à 8, 11 et 13 à 15 du tableau de l’article B.01.401 et à la colonne 1 des articles 14 à 37 du tableau de l’article B.01.402 et qui sont indiqués en pourcentage de la valeur quotidienne dans le tableau de la valeur nutritive à l’égard de la première quantité d’aliment pour laquelle des renseignements sont déclarés, exprimés au moyen de la nomenclature indiquée dans la colonne 2, en pourcentage de la valeur quotidienne par portion indiquée et au moyen des règles d’écriture indiquées dans la colonne 4;
(iv) [Abrogé, DORS/2016-305, art. 24]
b) [Abrogé, DORS/2016-305, art. 24]
c) si le tableau est présenté selon l’une des versions du modèle composé prévu aux articles B.01.459 ou B.01.464, il indique également les renseignements ci-après pour chacune des autres quantités de l’aliment, s’ils sont déclarés dans le tableau de la valeur nutritive à l’égard de la première quantité d’aliment pour laquelle des renseignements sont déclarés :
(i) [Abrogé, DORS/2016-305, art. 24]
(ii) les renseignements visés à la colonne 1 des articles 3 à 5 et 7 à 12 du tableau de l’article B.01.401, exprimés au moyen de la nomenclature indiquée dans la colonne 2, en milligrammes pour ceux visés à la colonne 1 des articles 7 et 8 et en grammes pour ceux visés à la colonne 1 des articles 3 à 5 et 9 à 12, et au moyen des règles d’écriture indiquées dans la colonne 4,
(iii) les renseignements visés à la colonne 1 des articles 5 à 8 et 10 à 13 du tableau de l’article B.01.402, exprimés au moyen de la nomenclature indiquée dans la colonne 2, en grammes et au moyen des règles d’écriture indiquées dans la colonne 4.
(8) Le tableau de la valeur nutritive d’un produit préemballé destiné exclusivement aux bébés âgés d’au moins six mois mais de moins d’un an qui indique des renseignements conformément au paragraphe (7) indique les renseignements visés aux alinéas (7)a) et c).
- DORS/2003-11, art. 20
- DORS/2016-305, art. 24
[
Présentation du tableau de la valeur nutritive
B.01.450 (1) Sous réserve des paragraphes (2) à (6), le tableau de la valeur nutritive est présenté selon le modèle de la figure applicable du Répertoire des modèles de TVN, compte tenu notamment de l’ordre de présentation, des dimensions, des espacements et de l’emploi des majuscules, des minuscules et des caractères gras.
(2) Les caractères et les filets du tableau de la valeur nutritive sont monochromes et équivalent visuellement à de l’imprimerie noire en aplat de 100 % sur un fond blanc ou de couleur de teinte neutre et uniforme d’au plus 5 %.
(3) Les caractères dans le tableau de la valeur nutritive :
a) sont normalisés, sans empattement, non décoratifs et inscrits de manière à ce qu’ils ne se touchent pas et ne touchent pas les filets;
b) peuvent être de dimensions plus grandes que ceux indiqués dans la figure applicable du Répertoire des modèles de TVN si tous les caractères sont agrandis de façon uniforme.
(3.1) La taille des caractères qui est indiquée entre parenthèses pour une version prévue à un tableau des articles B.01.454 à B.01.459 et B.01.461 à B.01.464 représente la taille minimale des caractères à utiliser, dans le tableau de la valeur nutritive, pour indiquer les éléments nutritifs figurant aux tableaux des articles B.01.401 et B.01.402 conformément à cette version.
(4) Un filet de un ou deux points visé à la figure applicable du Répertoire des modèles de TVN peut avoir une force de corps plus grande dans le tableau de la valeur nutritive.
(5) Le tableau de la valeur nutritive indique les renseignements conformément aux articles B.01.400 à B.01.403 et B.01.406.
(6) L’ordre de la langue indiqué dans la figure applicable du Répertoire des modèles de TVN peut être inversé lorsque le tableau de la valeur nutritive est composé d’un tableau en français et en anglais.
- DORS/2003-11, art. 20
- DORS/2016-305, art. 25 et 74
Emplacement du tableau de la valeur nutritive
B.01.451 (1) Sous réserve du paragraphe (2), le tableau de la valeur nutritive est présenté sur l’étiquette du produit préemballé :
a) dans un tableau en français et un tableau en anglais sur le même espace continu de la surface exposée disponible;
b) dans un tableau en français et en anglais sur tout espace continu de la surface exposée disponible;
c) dans un tableau en français sur tout espace continu de la surface exposée disponible et un tableau en anglais sur tout autre espace continu de cette surface de même grandeur et de même importance que le premier espace.
(2) Si, conformément aux paragraphes B.01.012(3) ou (7), les renseignements devant être indiqués sur l’étiquette d’un produit préemballé aux termes du présent règlement peuvent l’être uniquement en français ou uniquement en anglais et qu’ils y figurent dans la langue en cause, le tableau de la valeur nutritive du produit peut être présenté sur l’étiquette du produit uniquement dans cette langue sur tout espace continu de la surface exposée disponible.
- DORS/2003-11, art. 20
Orientation du tableau de la valeur nutritive
B.01.452 (1) Sous réserve du paragraphe (2), le tableau de la valeur nutritive est orienté dans le même sens que les autres renseignements figurant sur l’étiquette du produit préemballé.
(2) Dans le cas où une version du tableau de la valeur nutritive ne peut être orientée dans le même sens que les autres renseignements figurant sur l’étiquette du produit préemballé, elle est orientée dans un autre sens s’il y a suffisamment d’espace et si le contenu ne fuit pas ou n’est pas endommagé lorsque l’emballage est retourné.
(3) Le paragraphe (1) ne s’applique pas au tableau de la valeur nutritive présenté sur le dessus ou le dessous du produit préemballé.
- DORS/2003-11, art. 20
Application
B.01.453 (1) Les articles B.01.454 à B.01.460 s’appliquent aux produits préemballés autres que ceux destinés exclusivement aux bébés âgés d’au moins six mois mais de moins d’un an.
(2) Les articles B.01.461 à B.01.465 s’appliquent aux produits préemballés destinés exclusivement aux bébés âgés d’au moins six mois mais de moins d’un an.
- DORS/2003-11, art. 20
- DORS/2016-305, art. 26
Modèles standard et horizontal
B.01.454 (1) Le présent article s’applique à tout produit préemballé à moins que l’un des articles B.01.455 à B.01.459 s’y applique.
(2) Sous réserve du paragraphe (3), le tableau de la valeur nutritive du produit préemballé est présenté selon l’une des versions figurant à la colonne 1 du tableau du présent article, si la condition prévue à la colonne 2 est remplie.
(3) Si le tableau de la valeur nutritive ne peut être présenté conformément au présent règlement sur 15 % ou moins de la surface exposée disponible du produit préemballé selon l’une ou l’autre des versions figurant à la colonne 1 du tableau du présent article, il est présenté de l’une des façons suivantes :
a) selon le modèle standard bilingue prévu aux figures 3.5(B), 3.6(B) ou 3.7(B) du Répertoire des modèles de TVN;
b) selon le modèle horizontal bilingue prévu aux figures 4.3(B), 4.4(B) ou 4.5(B) du Répertoire des modèles de TVN;
c) selon le modèle linéaire prévu aux figures 16.1(F) et (A) ou 16.2(F) et (A) du Répertoire des modèles de TVN;
d) selon l’une des versions figurant à la colonne 1 du tableau du présent article, même si le tableau de la valeur nutritive devrait être présenté sur plus de 15 % de la surface exposée disponible;
e) d’une façon prévue à l’article B.01.466.
(4) Pour l’application du présent article, afin d’établir si une version du tableau de la valeur nutritive ne peut être présentée conformément au présent règlement sur 15 % ou moins de la surface exposée disponible du produit préemballé, il n’est tenu compte, dans le tableau, que des renseignements exigés par le présent règlement.
(5) Malgré les paragraphes (2) et (3), si le produit préemballé, dont l’étiquette est un autocollant et dont la surface exposée disponible est de 200 cm2 ou plus, est vendu uniquement dans l’établissement de détail où il est emballé, le tableau de la valeur nutritive est présenté selon l’une des versions figurant à la colonne 1 des articles 1 à 3 des parties 1 à 3 du tableau du présent article, sans égard à toute condition prévue à la colonne 2.
(6) Malgré les paragraphes (2) et (3), si le tableau de la valeur nutritive du produit préemballé est placé sur une étiquette mobile attachée à un emballage décoratif ou sur une étiquette mobile attachée à un emballage sur lequel aucune étiquette ne peut être apposée ou sur lequel les renseignements ne peuvent être indiqués lisiblement et de façon que l’acheteur ou le consommateur puisse les voir aisément dans les conditions habituelles d’achat, il est présenté selon l’une des versions prévues aux alinéas (3)a), b) et c) ou selon l’une des versions figurant à la colonne 1 du tableau du présent article, sans égard à toute condition prévue à la colonne 2.
TABLEAU
PARTIE 1
Modèle standard
Article Colonne 1 Colonne 2 Figure du Répertoire des modèles de TVN (version) Condition d’utilisation 1 1.1(F) et (A) (éléments nutritifs figurant en caractères d’au moins 8 points) 2 1.2(F) et (A) La version de l’article 1 ne peut être présentée conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères d’au moins 7 points) 3 1.3(F) et (A) Les versions des articles 1 et 2 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères étroits d’au moins 7 points) 4 1.4(F) et (A) Les versions des articles 1 à 3 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères étroits d’au moins 7 points) 5 1.5(F) et (A) Les versions des articles 1 à 4 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères étroits d’au moins 6 points) 6 1.6(F) et (A) Les versions des articles 1 à 5 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères étroits d’au moins 6 points) PARTIE 2
Modèle standard étroit
Article Colonne 1 Colonne 2 Figure du Répertoire des modèles de TVN (version) Condition d’utilisation 1 2.1(F) et (A) (éléments nutritifs figurant en caractères d’au moins 8 points) 2 2.2(F) et (A) La version de l’article 1 ne peut être présentée conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères d’au moins 7 points) 3 2.3(F) et (A) Les versions des articles 1 et 2 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères étroits d’au moins 7 points) 4 2.4(F) et (A) Les versions des articles 1 à 3 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères étroits d’au moins 6 points) PARTIE 3
Modèle standard bilingue
Article Colonne 1 Colonne 2 Figure du Répertoire des modèles de TVN (version) Condition d’utilisation 1 3.1(B) (éléments nutritifs figurant en caractères d’au moins 8 points) 2 3.2(B) La version de l’article 1 ne peut être présentée conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères d’au moins 7 points) 3 3.3(B) Les versions des articles 1 et 2 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères étroits d’au moins 7 points) 4 3.4(B) Les versions des articles 1 à 3 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères étroits d’au moins 6 points) PARTIE 4
Modèle horizontal bilingue
Article Colonne 1 Colonne 2 Figure du Répertoire des modèles de TVN (version) Condition d’utilisation 1 4.1(B) Les versions des parties 1 à 3 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères étroits d’au moins 7 points) 2 4.2(B) Les versions des parties 1 à 3 et de l’article 1 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères étroits d’au moins 6 points)
- DORS/2003-11, art. 20
- DORS/2016-305, art. 27 et 74
Modèles simplifiés
B.01.455 (1) Le présent article s’applique à tout produit préemballé qui remplit la condition du paragraphe B.01.401(6) et dont le tableau de la valeur nutritive ne contient que les renseignements visés aux alinéas B.01.401(6)a) à j).
(2) Sous réserve du paragraphe (3), le tableau de la valeur nutritive du produit préemballé est présenté selon l’une des versions figurant à la colonne 1 du tableau du présent article, si la condition prévue à la colonne 2 est remplie.
(3) Si le tableau de la valeur nutritive qui ne contient que les renseignements visés aux alinéas B.01.401(6)a) à j) ne peut être présenté conformément au présent règlement sur 15 % ou moins de la surface exposée disponible du produit préemballé selon l’une des versions figurant à la colonne 1 du tableau du présent article, il est présenté de l’une des façons suivantes :
a) selon le modèle standard simplifié bilingue prévu aux figures 6.5(B) ou 6.6(B) du Répertoire des modèles de TVN;
b) selon le modèle horizontal simplifié bilingue prévu aux figures 7.3(B) ou 7.4(B) du Répertoire des modèles de TVN;
c) selon le modèle linéaire simplifié prévu aux figures 17.1(F) et (A) ou 17.2(F) et (A) du Répertoire des modèles de TVN;
d) selon l’une des versions figurant à la colonne 1 du tableau du présent article, même si le tableau de la valeur nutritive devrait être présenté sur plus de 15 % de la surface exposée disponible;
e) d’une façon prévue à l’article B.01.466.
(4) Malgré les paragraphes (2) et (3), si le produit préemballé, dont l’étiquette est un autocollant et dont la surface exposée disponible est de 200 cm2 ou plus, est vendu uniquement dans l’établissement de détail où il est emballé, le tableau de la valeur nutritive est présenté selon l’une des versions figurant à la colonne 1 des articles 1 à 3 des parties 1 et 2 du tableau du présent article, sans égard à toute condition prévue à la colonne 2.
(5) Malgré les paragraphes (2) et (3), si le tableau de la valeur nutritive du produit préemballé est placé sur une étiquette mobile attachée à un emballage décoratif ou sur une étiquette mobile attachée à un emballage sur lequel aucune étiquette ne peut être apposée ou sur lequel les renseignements ne peuvent être indiqués lisiblement et de façon que l’acheteur ou le consommateur puisse les voir aisément dans les conditions habituelles d’achat, il est présenté selon l’une des versions prévues aux alinéas (3)a), b) et c) ou selon l’une des versions figurant à la colonne 1 du tableau du présent article, sans égard à toute condition prévue à la colonne 2.
TABLEAU
PARTIE 1
Modèle standard simplifié
Colonne 1 Colonne 2 Article Figure du Répertoire des modèles de TVN (version) Condition d’utilisation 1 5.1(F) et (A) (éléments nutritifs figurant en caractères d’au moins 8 points) 2 5.2(F) et (A) La version de l’article 1 ne peut être présentée conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères d’au moins 7 points) 3 5.3(F) et (A) Les versions des articles 1 et 2 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères étroits d’au moins 7 points) 4 5.4(F) et (A) Les versions des articles 1 à 3 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères étroits d’au moins 7 points) 5 5.5(F) et (A) Les versions des articles 1 à 4 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères étroits d’au moins 6 points) 6 5.6(F) et (A) Les versions des articles 1 à 5 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères étroits d’au moins 6 points) PARTIE 2
Modèle standard simplifié bilingue
Colonne 1 Colonne 2 Article Figure du Répertoire des modèles de TVN (version) Condition d’utilisation 1 6.1(B) (éléments nutritifs figurant en caractères d’au moins 8 points) 2 6.2(B) La version de l’article 1 ne peut être présentée conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères d’au moins 7 points) 3 6.3(B) Les versions des articles 1 et 2 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères étroits d’au moins 7 points) 4 6.4(B) Les versions des articles 1 à 3 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères étroits d’au moins 6 points) PARTIE 3
Modèle horizontal simplifié bilingue
Colonne 1 Colonne 2 Article Figure du Répertoire des modèles de TVN (version) Condition d’utilisation 1 7.1(B) Les versions des parties 1 et 2 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères étroits d’au moins 7 points) 2 7.2(B) Les versions des parties 1 et 2 et de l’article 1 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères étroits d’au moins 6 points)
- DORS/2003-11, art. 20
- DORS/2016-305, art. 28 et 74
Modèles simplifiés — produits préemballés à portion individuelle
B.01.455.1 (1) Le présent article s’applique à tout produit préemballé à portion individuelle autre qu’un repas préemballé dont le tableau de la valeur nutritive ne contient que les renseignements visés aux alinéas B.01.401(6.1)a) à j).
(2) Sous réserve du paragraphe (3), le tableau de la valeur nutritive du produit préemballé à portion individuelle est présenté selon l’une des versions figurant à la colonne 1 du tableau du présent article, si la condition prévue à la colonne 2 est remplie.
(3) Si le tableau de la valeur nutritive qui ne contient que les renseignements visés aux alinéas B.01.401(6.1)a) à j) ne peut être présenté conformément au présent règlement sur 15 % ou moins de la surface exposée disponible du produit préemballé à portion individuelle selon l’une des versions figurant à la colonne 1 du tableau du présent article, il est présenté de l’une des façons suivantes :
a) selon le modèle standard simplifié bilingue prévu aux figures 6.5.1(B) ou 6.6.1(B) du Répertoire des modèles de TVN;
b) selon le modèle horizontal simplifié bilingue prévu aux figures 7.3.1(B) ou 7.4.1(B) du Répertoire des modèles de TVN;
c) selon le modèle linéaire simplifié prévu aux figures 17.1.1(F) et (A) ou 17.2.1(F) et (A) du Répertoire des modèles de TVN;
d) selon l’une des versions figurant à la colonne 1 du tableau du présent article, même si le tableau de la valeur nutritive devrait être présenté sur plus de 15 % de la surface exposée disponible;
e) d’une façon prévue à l’article B.01.466.
(4) Malgré les paragraphes (2) et (3), si le produit préemballé à portion individuelle, dont l’étiquette est un autocollant et dont la surface exposée disponible est de 200 cm2 ou plus, est vendu uniquement dans l’établissement de détail où il est emballé, le tableau de la valeur nutritive est présenté selon l’une des versions figurant à la colonne 1 des articles 1 à 3 de la partie 1 du tableau du présent article, sans égard à toute condition prévue à la colonne 2.
(5) Malgré les paragraphes (2) et (3), si le tableau de la valeur nutritive du produit préemballé à portion individuelle est placé sur une étiquette mobile attachée à un emballage décoratif ou sur une étiquette mobile attachée à un emballage sur lequel aucune étiquette ne peut être apposée ou sur lequel les renseignements ne peuvent être indiqués lisiblement et de façon que l’acheteur ou le consommateur puisse les voir aisément dans les conditions habituelles d’achat, il est présenté selon l’une des versions prévues aux alinéas (3)a), b) et c) ou selon l’une des versions figurant à la colonne 1 du tableau du présent article, sans égard à toute condition prévue à la colonne 2.
TABLEAU
PARTIE 1
Modèle standard simplifié bilingue — produits préemballés à portion individuelle
Article Colonne 1 Colonne 2 Figure du Répertoire des modèles de TVN (version) Condition d’utilisation 1 6.1.1(B) (éléments nutritifs figurant en caractères d’au moins 8 points) 2 6.2.1(B) La version de l’article 1 ne peut être présentée conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères d’au moins 7 points) 3 6.3.1(B) Les versions des articles 1 et 2 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères étroits d’au moins 7 points) 4 6.4.1(B) Les versions des articles 1 à 3 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères étroits d’au moins 6 points) PARTIE 2
Modèle horizontal simplifié bilingue — produits préemballés à portion individuelle
Article Colonne 1 Colonne 2 Figure du Répertoire des modèles de TVN (version) Condition d’utilisation 1 7.1.1(B) Les versions de la partie 1 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères étroits d’au moins 7 points) 2 7.2.1(B) Les versions de la partie 1 et de l’article 1 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères étroits d’au moins 6 points)
- DORS/2016-305, art. 29
Modèle double — aliments à préparer
B.01.456 (1) Sous réserve du paragraphe (2), le tableau de la valeur nutritive de tout produit préemballé qui indique les renseignements visés au paragraphe B.01.406(5) est présenté selon l’une des versions figurant à la colonne 1 du tableau du présent article, si la condition prévue à la colonne 2 est remplie.
(2) Si le tableau de la valeur nutritive ne peut être présenté conformément au présent règlement sur 15 % ou moins de la surface exposée disponible du produit préemballé selon l’une des versions figurant à la colonne 1 du tableau du présent article, il est présenté :
a) soit selon le modèle double bilingue prévu aux figures 9.5(B) ou 9.6(B) du Répertoire des modèles de TVN;
b) soit selon l’une des versions figurant à la colonne 1 du tableau du présent article, même si le tableau de la valeur nutritive devrait être présenté sur plus de 15 % de la surface exposée disponible.
(3) Pour l’application du présent article, afin d’établir si une version du tableau de la valeur nutritive ne peut être présentée conformément au présent règlement sur 15 % ou moins de la surface exposée disponible du produit préemballé, il n’est tenu compte, dans le tableau, que des renseignements exigés par le présent règlement ainsi que des renseignements visés au paragraphe B.01.406(5).
(4) Malgré les paragraphes (1) et (2), si le tableau de la valeur nutritive du produit préemballé est placé sur une étiquette mobile attachée à un emballage décoratif ou sur une étiquette mobile attachée à un emballage sur lequel aucune étiquette ne peut être apposée ou sur lequel les renseignements ne peuvent être indiqués lisiblement et de façon que l’acheteur ou le consommateur puisse les voir aisément dans les conditions habituelles d’achat, il est présenté selon l’une des versions prévues à l’alinéa (2)a) ou selon l’une des versions figurant à la colonne 1 du tableau du présent article, sans égard à toute condition prévue à la colonne 2.
TABLEAU
PARTIE 1
Modèle double — aliments à préparer
Article Colonne 1 Colonne 2 Figure du Répertoire des modèles de TVN (version) Condition d’utilisation 1 8.1(F) et (A) (éléments nutritifs figurant en caractères d’au moins 8 points) 2 8.2(F) et (A) La version de l’article 1 ne peut être présentée conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères d’au moins 7 points) 3 8.3(F) et (A) Les versions des articles 1 et 2 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères étroits d’au moins 7 points) 4 8.4(F) et (A) Les versions des articles 1 à 3 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères étroits d’au moins 7 points) 5 8.5(F) et (A) Les versions des articles 1 à 4 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères étroits d’au moins 6 points) 6 8.6(F) et (A) Les versions des articles 1 à 5 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères étroits d’au moins 6 points) PARTIE 2
Modèle double bilingue — aliments à préparer
Article Colonne 1 Colonne 2 Figure du Répertoire des modèles de TVN (version) Condition d’utilisation 1 9.1(B) (éléments nutritifs figurant en caractères d’au moins 8 points) 2 9.2(B) La version de l’article 1 ne peut être présentée conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères d’au moins 7 points) 3 9.3(B) Les versions des articles 1 et 2 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères étroits d’au moins 7 points) 4 9.4(B) Les versions des articles 1 à 3 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères étroits d’au moins 6 points)
- DORS/2003-11, art. 20
- DORS/2016-305, art. 30 et 74
Modèle composé — différents types d’aliments
B.01.457 (1) Sous réserve du paragraphe (2), le tableau de la valeur nutritive de tout produit préemballé qui indique des renseignements distincts en fonction de chaque ingrédient ou aliment, tel qu’il est prévu au paragraphe B.01.406(2), à l’alinéa B.01.406(3)a) ou au paragraphe B.01.406(4), est présenté selon l’une des versions figurant à la colonne 1 du tableau du présent article, si la condition prévue à la colonne 2 est remplie.
(2) Si le tableau de la valeur nutritive ne peut être présenté conformément au présent règlement sur 15 % ou moins de la surface exposée disponible du produit préemballé selon l’une des versions figurant à la colonne 1 du tableau du présent article, il est présenté :
a) dans le cas de tout produit visé aux paragraphes B.01.406(2) ou (4) :
(i) soit selon le modèle composé bilingue prévu aux figures 11.5(B) ou 11.6(B) du Répertoire des modèles de TVN,
(ii) soit selon l’une des versions figurant à la colonne 1 du tableau du présent article, même si le tableau de la valeur nutritive devrait être présenté sur plus de 15 % de la surface exposée disponible;
b) dans le cas de tout produit visé à l’alinéa B.01.406(3)a) :
(i) soit selon le modèle composé bilingue prévu aux figures 11.5(B) ou 11.6(B) du Répertoire des modèles de TVN,
(ii) soit selon l’une des versions figurant à la colonne 1 du tableau du présent article, même si le tableau de la valeur nutritive devrait être présenté sur plus de 15 % de la surface exposée disponible,
(iii) soit d’une façon prévue à l’article B.01.466.
(3) Pour l’application du présent article, afin d’établir si une version du tableau de la valeur nutritive ne peut être présentée conformément au présent règlement sur 15 % ou moins de la surface exposée disponible du produit préemballé, il n’est tenu compte, dans le tableau, que des renseignements exigés par le présent règlement pour chaque ingrédient ou aliment pour lequel des renseignements distincts y sont indiqués.
(4) Malgré les paragraphes (1) et (2), si le tableau de la valeur nutritive du produit préemballé est placé sur une étiquette mobile attachée à un emballage décoratif ou sur une étiquette mobile attachée à un emballage sur lequel aucune étiquette ne peut être apposée ou sur lequel les renseignements ne peuvent être indiqués lisiblement et de façon que l’acheteur ou le consommateur puisse les voir aisément dans les conditions habituelles d’achat, il est présenté selon l’une des versions prévues au sous-alinéa (2)a)(i) ou selon l’une des versions figurant à la colonne 1 du tableau du présent article, sans égard à toute condition prévue à la colonne 2.
TABLEAU
PARTIE 1
Modèle composé — différents types d’aliments
Article Colonne 1 Colonne 2 Figure du Répertoire des modèles de TVN (version) Condition d’utilisation 1 10.1(F) et (A) (éléments nutritifs figurant en caractères d’au moins 8 points) 2 10.2(F) et (A) La version de l’article 1 ne peut être présentée conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères d’au moins 7 points) 3 10.3(F) et (A) Les versions des articles 1 et 2 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères étroits d’au moins 7 points) 4 10.4(F) et (A) Les versions des articles 1 à 3 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères étroits d’au moins 7 points) 5 10.5(F) et (A) Les versions des articles 1 à 4 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères étroits d’au moins 6 points) 6 10.6(F) et (A) Les versions des articles 1 à 5 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères étroits d’au moins 6 points) PARTIE 2
Modèle composé bilingue — différents types d’aliments
Article Colonne 1 Colonne 2 Figure du Répertoire des modèles de TVN (version) Condition d’utilisation 1 11.1(B) (éléments nutritifs figurant en caractères d’au moins 8 points) 2 11.2(B) La version de l’article 1 ne peut être présentée conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères d’au moins de 7 points) 3 11.3(B) Les versions des articles 1 et 2 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères étroits d’au moins 7 points) 4 11.4(B) Les versions des articles 1 à 3 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères étroits d’au moins 6 points)
- DORS/2003-11, art. 20
- DORS/2016-305, art. 31 et 74
Modèle double — différentes quantités d’aliments
B.01.458 (1) Sous réserve du paragraphe (2), le tableau de la valeur nutritive de tout produit préemballé qui indique des renseignements distincts en fonction de différentes quantités de l’aliment, tel qu’il est prévu à l’alinéa B.01.406(7)a), sans indiquer les renseignements visés au sous-alinéa B.01.406(7)c), est présenté selon l’une des versions figurant à la colonne 1 du tableau du présent article, si la condition prévue à la colonne 2 est remplie.
(2) Si le tableau de la valeur nutritive ne peut être présenté conformément au présent règlement sur 15 % ou moins de la surface exposée disponible du produit préemballé selon l’une des versions figurant à la colonne 1 du tableau du présent article, il est présenté :
a) soit selon le modèle double bilingue prévu aux figures 13.5(B) ou 13.6(B) du Répertoire des modèles de TVN;
b) soit selon l’une des versions figurant à la colonne 1 du tableau du présent article, même si le tableau de la valeur nutritive devrait être présenté sur plus de 15 % de la surface exposée disponible.
(3) Pour l’application du présent article, afin d’établir si une version du tableau de la valeur nutritive ne peut être présentée conformément au présent règlement sur 15 % ou moins de la surface exposée disponible du produit préemballé, il n’est tenu compte, dans le tableau, que des renseignements exigés par le présent règlement pour chaque quantité d’aliment pour laquelle des renseignements distincts y sont indiqués.
(4) Malgré les paragraphes (1) et (2), si le tableau de la valeur nutritive du produit préemballé est placé sur une étiquette mobile attachée à un emballage décoratif ou sur une étiquette mobile attachée à un emballage sur lequel aucune étiquette ne peut être apposée ou sur lequel les renseignements ne peuvent être indiqués lisiblement et de façon que l’acheteur ou le consommateur puisse les voir aisément dans les conditions habituelles d’achat, il est présenté selon l’une des versions prévues à l’alinéa (2)a) ou selon l’une des versions figurant à la colonne 1 du tableau du présent article, sans égard à toute condition prévue à la colonne 2.
TABLEAU
PARTIE 1
Modèle double — différentes quantités d’aliments
Article Colonne 1 Colonne 2 Figure du Répertoire des modèles de TVN (version) Condition d’utilisation 1 12.1(F) et (A) (éléments nutritifs figurant en caractères d’au moins 8 points) 2 12.2(F) et (A) La version de l’article 1 ne peut être présentée conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères d’au moins 7 points) 3 12.3(F) et (A) Les versions des articles 1 et 2 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères étroits d’au moins 7 points) 4 12.4(F) et (A) Les versions des articles 1 à 3 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères étroits d’au moins 7 points) 5 12.5(F) et (A) Les versions des articles 1 à 4 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères étroits d’au moins 6 points) 6 12.6(F) et (A) Les versions des articles 1 à 5 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères étroits d’au moins 6 points) PARTIE 2
Modèle double bilingue — différentes quantités d’aliments
Article Colonne 1 Colonne 2 Figure du Répertoire des modèles de TVN (version) Condition d’utilisation 1 13.1(B) (éléments nutritifs figurant en caractères d’au moins 8 points) 2 13.2(B) La version de l’article 1 ne peut être présentée conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères d’au moins 7 points) 3 13.3(B) Les versions des articles 1 et 2 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères étroits d’au moins 7 points) 4 13.4(B) Les versions des articles 1 à 3 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères étroits d’au moins 6 points)
- DORS/2003-11, art. 20
- DORS/2016-305, art. 32 et 74
Modèle composé — différentes quantités d’aliments
B.01.459 (1) Sous réserve du paragraphe (2), le tableau de la valeur nutritive de tout produit préemballé qui indique des renseignements distincts en fonction de différentes quantités de l’aliment, tel qu’il est prévu aux alinéas B.01.406(7)a) et c), est présenté selon l’une des versions figurant à la colonne 1 du tableau du présent article, si la condition prévue à la colonne 2 est remplie.
(2) Si le tableau de la valeur nutritive ne peut être présenté conformément au présent règlement sur 15 % ou moins de la surface exposée disponible du produit préemballé selon l’une des versions figurant à la colonne 1 du tableau du présent article, il est présenté :
a) soit selon le modèle composé bilingue prévu aux figures 15.5(B) ou 15.6(B) du Répertoire des modèles de TVN;
b) soit selon l’une des versions figurant à la colonne 1 du tableau du présent article, même si le tableau de la valeur nutritive devrait être présenté sur plus de 15 % de la surface exposée disponible.
(3) Pour l’application du présent article, afin d’établir si une version du tableau de la valeur nutritive ne peut être présentée conformément au présent règlement sur 15 % ou moins de la surface exposée disponible du produit préemballé, il n’est tenu compte, dans le tableau, que des renseignements exigés par le présent règlement pour chaque quantité d’aliment pour laquelle des renseignements distincts y sont indiqués.
(4) Malgré les paragraphes (1) et (2), si le tableau de la valeur nutritive du produit préemballé est placé sur une étiquette mobile attachée à un emballage décoratif ou sur une étiquette mobile attachée à un emballage sur lequel aucune étiquette ne peut être apposée ou sur lequel les renseignements ne peuvent être indiqués lisiblement et de façon que l’acheteur ou le consommateur puisse les voir aisément dans les conditions habituelles d’achat, il est présenté selon l’une des versions prévues à l’alinéa (2)a) ou selon l’une des versions figurant à la colonne 1 du tableau du présent article, sans égard à toute condition prévue à la colonne 2.
TABLEAU
PARTIE 1
Modèle composé — différentes quantités d’aliments
Article Colonne 1 Colonne 2 Figure du Répertoire des modèles de TVN (version) Condition d’utilisation 1 14.1(F) et (A) (éléments nutritifs figurant en caractères d’au moins 8 points) 2 14.2(F) et (A) La version de l’article 1 ne peut être présentée conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères d’au moins 7 points) 3 14.3(F) et (A) Les versions des articles 1 et 2 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères étroits d’au moins 7 points) 4 14.4(F) et (A) Les versions des articles 1 à 3 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères étroits d’au moins 7 points) 5 14.5(F) et (A) Les versions des articles 1 à 4 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères étroits d’au moins 6 points) 6 14.6(F) et (A) Les versions des articles 1 à 5 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères étroits d’au moins 6 points) PARTIE 2
Modèle composé bilingue — différentes quantités d’aliments
Article Colonne 1 Colonne 2 Figure du Répertoire des modèles de TVN (version) Condition d’utilisation 1 15.1(B) (éléments nutritifs figurant en caractères d’au moins 8 points) 2 15.2(B) La version de l’article 1 ne peut être présentée conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères d’au moins 7 points) 3 15.3(B) Les versions des articles 1 et 2 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères étroits d’au moins 7 points) 4 15.4(B) Les versions des articles 1 à 3 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères étroits d’au moins 6 points)
- DORS/2003-11, art. 20
- DORS/2016-305, art. 33 et 74
Présentation des renseignements complémentaires
B.01.460 (1) Les renseignements visés à la colonne 1 du tableau de l’article B.01.402 qui sont indiqués dans la version du tableau de la valeur nutritive se composant d’un tableau en anglais et d’un tableau en français ou d’un tableau en anglais ou en français sont présentés :
a) selon l’ordre, les retraits et les notes complémentaires indiqués aux figures 18.1(F) et (A) du Répertoire des modèles de TVN;
b) quant aux autres caractéristiques de présentation, selon le modèle prévu à la figure applicable du Répertoire des modèles de TVN.
(2) Les renseignements visés à la colonne 1 du tableau de l’article B.01.402 indiqués dans la version du tableau de la valeur nutritive se composant d’un tableau en anglais et en français sont présentés :
a) selon l’ordre, les retraits et les notes complémentaires indiqués à la figure 19.1(B) du Répertoire des modèles de TVN;
b) quant aux autres caractéristiques de présentation, selon le modèle prévu à la figure applicable du Répertoire des modèles de TVN.
(3) Malgré l’alinéa (1)a), les retraits indiqués aux figures 18.1(F) et (A) du Répertoire des modèles de TVN ne s’appliquent pas si les renseignements visés à la colonne 1 du tableau de l’article B.01.402 sont présentés selon le modèle linéaire visé à l’alinéa B.01.454(3)c) ou le modèle linéaire simplifié visé à l’alinéa B.01.455(3)c).
- DORS/2003-11, art. 20
- DORS/2016-305, art. 74
Modèles standard et horizontal — bébés âgés d’au moins six mois mais de moins d’un an
- DORS/2003-11, art. 20
- err.(A), Vol. 137, no 5
- DORS/2016-305, art. 34
B.01.461 (1) Le présent article s’applique à tout produit préemballé destiné exclusivement aux bébés âgés d’au moins six mois mais de moins d’un an, sauf si l’un des articles B.01.462, B.01.463 et B.01.464 s’y applique.
(2) Sous réserve du paragraphe (3), le tableau de la valeur nutritive du produit préemballé est présenté selon l’une des versions figurant à la colonne 1 du tableau du présent article, si la condition prévue à la colonne 2 est remplie.
(3) Si le tableau de la valeur nutritive ne peut être présenté conformément au présent règlement sur 15 % ou moins de la surface exposée disponible du produit préemballé selon l’une des versions figurant à la colonne 1 du tableau du présent article, il est présenté de l’une des façons suivantes :
a) selon le modèle standard bilingue prévu aux figures 22.5(B), 22.6(B) ou 22.7(B) du Répertoire des modèles de TVN;
b) selon le modèle horizontal bilingue prévu aux figures 23.3(B) ou 23.4(B) du Répertoire des modèles de TVN;
c) selon le modèle linéaire prévu aux figures 31.1(F) et (A) ou 31.2(F) et (A) du Répertoire des modèles de TVN;
d) selon l’une des versions figurant à la colonne 1 du tableau du présent article, même si le tableau de la valeur nutritive devrait être présenté sur plus de 15 % de la surface exposée disponible;
e) d’une façon prévue à l’article B.01.466.
(4) Pour l’application du présent article, afin d’établir si une version du tableau de la valeur nutritive ne peut être présentée conformément au présent règlement sur 15 % ou moins de la surface exposée disponible du produit préemballé, il n’est tenu compte, dans le tableau, que des renseignements exigés par le présent règlement.
TABLEAU
PARTIE 1
Modèle standard — bébés âgés d’au moins six mois mais de moins d’un an
Article Colonne 1 Colonne 2 Figure du Répertoire des modèles de TVN (version) Condition d’utilisation 1 20.1(F) et (A) (éléments nutritifs figurant en caractères d’au moins 8 points) 2 20.2(F) et (A) La version de l’article 1 ne peut être présentée conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères d’au moins 7 points) 3 20.3(F) et (A) Les versions des articles 1 et 2 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères étroits d’au moins 7 points) 4 20.4(F) et (A) Les versions des articles 1 à 3 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères étroits d’au moins 7 points) 5 20.5(F) et (A) Les versions des articles 1 à 4 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères étroits d’au moins 6 points) 6 20.6(F) et (A) Les versions des articles 1 à 5 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères étroits d’au moins 6 points) PARTIE 2
Modèle standard étroit — bébés âgés d’au moins six mois mais de moins d’un an
Article Colonne 1 Colonne 2 Figure du Répertoire des modèles de TVN (version) Condition d’utilisation 1 21.1(F) et (A) (éléments nutritifs figurant en caractères d’au moins 8 points) 2 21.2(F) et (A) La version de l’article 1 ne peut être présentée conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères d’au moins 7 points) 3 21.3(F) et (A) Les versions des articles 1 et 2 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères étroits d’au moins 7 points) 4 21.4(F) et (A) Les versions des articles 1 à 3 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères étroits d’au moins 6 points) PARTIE 3
Modèle standard bilingue — bébés âgés d’au moins six mois mais de moins d’un an
Article Colonne 1 Colonne 2 Figure du Répertoire des modèles de TVN (version) Condition d’utilisation 1 22.1(B) (éléments nutritifs figurant en caractères d’au moins 8 points) 2 22.2(B) La version de l’article 1 ne peut être présentée conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères d’au moins 7 points) 3 22.3(B) Les versions des articles 1 et 2 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères étroits d’au moins 7 points) 4 22.4(B) Les versions des articles 1 à 3 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères étroits d’au moins 6 points) PARTIE 4
Modèle horizontal bilingue — bébés âgés d’au moins six mois mais de moins d’un an
Article Colonne 1 Colonne 2 Figure du Répertoire des modèles de TVN (version) Condition d’utilisation 1 23.1(B) Les versions des parties 1 à 3 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères étroits d’au moins 7 points) 2 23.2(B) Les versions des parties 1 à 3 et de l’article 1 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères étroits d’au moins 6 points)
- DORS/2003-11, art. 20
- DORS/2016-305, art. 35 et 74
Modèles simplifiés — bébés âgés d’au moins six mois mais de moins d’un an
- DORS/2016-305, art. 36
B.01.462 (1) Le présent article s’applique à tout produit préemballé destiné exclusivement aux bébés âgés d’au moins six mois mais de moins d’un an qui remplit la condition du paragraphe B.01.403(5) et dont le tableau de la valeur nutritive ne contient que les renseignements visés aux alinéas B.01.403(5)a) à k).
(2) Sous réserve du paragraphe (3), le tableau de la valeur nutritive du produit préemballé est présenté selon l’une des versions figurant à la colonne 1 du tableau du présent article, si la condition prévue à la colonne 2 est remplie.
(3) Si le tableau de la valeur nutritive qui ne contient que les renseignements visés aux alinéas B.01.403(5)a) à k) ne peut être présenté conformément au présent règlement sur 15 % ou moins de la surface exposée disponible du produit préemballé selon l’une des versions figurant à la colonne 1 du tableau du présent article, il est présenté de l’une ou l’autre des façons suivantes :
a) selon le modèle standard simplifié bilingue prévu aux figures 25.5(B) ou 25.6(B) du Répertoire des modèles de TVN;
b) selon le modèle horizontal simplifié bilingue prévu aux figures 26.3(B) ou 26.4(B) du Répertoire des modèles de TVN;
c) selon le modèle linéaire simplifié prévu aux figures 32.1(F) et (A) ou 32.2(F) et (A) du Répertoire des modèles de TVN;
d) selon l’une des versions figurant à la colonne 1 du tableau du présent article, même si le tableau de la valeur nutritive devrait être présenté sur plus de 15 % de la surface exposée disponible;
e) d’une façon prévue à l’article B.01.466.
TABLEAU
PARTIE 1
Modèle standard simplifié — bébés âgés d’au moins six mois mais de moins d’un an
Article Colonne 1 Colonne 2 Figure du Répertoire des modèles de TVN (version) Condition d’utilisation 1 24.1(F) et (A) (éléments nutritifs figurant en caractères d’au moins 8 points) 2 24.2(F) et (A) La version de l’article 1 ne peut être présentée conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères d’au moins 7 points) 3 24.3(F) et (A) Les versions des articles 1 et 2 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères étroits d’au moins 7 points) 4 24.4(F) et (A) Les versions des articles 1 à 3 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères étroits d’au moins 7 points) 5 24.5(F) et (A) Les versions des articles 1 à 4 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères étroits d’au moins 6 points) 6 24.6(F) et (A) Les versions des articles 1 à 5 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères étroits d’au moins 6 points) PARTIE 2
Modèle standard simplifié bilingue — bébés âgés d’au moins six mois mais de moins d’un an
Article Colonne 1 Colonne 2 Figure du Répertoire des modèles de TVN (version) Condition d’utilisation 1 25.1(B) (éléments nutritifs figurant en caractères d’au moins 8 points) 2 25.2(B) La version de l’article 1 ne peut être présentée conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères d’au moins 7 points) 3 25.3(B) Les versions des articles 1 et 2 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères étroits d’au moins 7 points) 4 25.4(B) Les versions des articles 1 à 3 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères étroits d’au moins 6 points) PARTIE 3
Modèle horizontal simplifié bilingue — bébés âgés d’au moins six mois mais de moins d’un an
Article Colonne 1 Colonne 2 Figure du Répertoire des modèles de TVN (version) Condition d’utilisation 1 26.1(B) Les versions des parties 1 et 2 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères étroits d’au moins 7 points) 2 26.2(B) Les versions des parties 1 et 2 et de l’article 1 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères étroits d’au moins 6 points)
- DORS/2003-11, art. 20
- DORS/2016-305, art. 37 et 74
Modèle composé — différents types d’aliments — bébés âgés d’au moins six mois mais de moins d’un an
- DORS/2016-305, art. 38
B.01.463 (1) Sous réserve du paragraphe (2), le tableau de la valeur nutritive de tout produit préemballé destiné exclusivement aux bébés âgés d’au moins six mois mais de moins d’un an qui indique des renseignements distincts en fonction de chaque ingrédient ou aliment, tel qu’il est prévu au paragraphe B.01.406(2), à l’alinéa B.01.406(3)a) ou au paragraphe B.01.406(4), est présenté selon l’une des versions figurant à la colonne 1 du tableau du présent article, si la condition prévue à la colonne 2 est remplie.
(2) Si le tableau de la valeur nutritive ne peut être présenté conformément au présent règlement sur 15 % ou moins de la surface exposée disponible du produit préemballé selon l’une des versions figurant à la colonne 1 du tableau du présent article, il est présenté :
a) dans le cas de tout produit visé aux paragraphes B.01.406(2) ou (4) :
(i) soit selon le modèle composé bilingue prévu aux figures 28.5(B) ou 28.6(B) du Répertoire des modèles de TVN,
(ii) soit selon l’une des versions figurant à la colonne 1 du tableau du présent article, même si le tableau de la valeur nutritive devrait être présenté sur plus de 15 % de la surface exposée disponible;
b) dans le cas de tout produit visé à l’alinéa B.01.406(3)a) :
(i) soit selon le modèle composé bilingue prévu aux figures 28.5(B) ou 28.6(B) du Répertoire des modèles de TVN,
(ii) soit selon l’une des versions figurant à la colonne 1 du tableau du présent article, même si le tableau de la valeur nutritive devrait être présenté sur plus de 15 % de la surface exposée disponible;
(iii) soit d’une façon prévue à l’article B.01.466.
(3) Pour l’application du présent article, afin d’établir si une version du tableau de la valeur nutritive ne peut être présentée conformément au présent règlement sur 15 % ou moins de la surface exposée disponible du produit préemballé, il n’est tenu compte, dans le tableau, que des renseignements exigés par le présent règlement pour chaque ingrédient ou aliment pour lequel des renseignements distincts y sont indiqués.
TABLEAU
PARTIE 1
Modèle composé — différents types d’aliments — bébés âgés d’au moins six mois mais de moins d’un an
Article Colonne 1 Colonne 2 Figure du Répertoire des modèles de TVN (version) Condition d’utilisation 1 27.1(F) et (A) (éléments nutritifs figurant en caractères d’au moins 8 points) 2 27.2(F) et (A) La version de l’article 1 ne peut être présentée conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères d’au moins 7 points) 3 27.3(F) et (A) Les versions des articles 1 et 2 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères étroits d’au moins 7 points) 4 27.4(F) et (A) Les versions des articles 1 à 3 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères étroits d’au moins 7 points) 5 27.5(F) et (A) Les versions des articles 1 à 4 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères étroits d’au moins 6 points) 6 27.6(F) et (A) Les versions des articles 1 à 5 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères étroits d’au moins 6 points) PARTIE 2
Modèle composé bilingue — différents types d’aliments — bébés âgés d’au moins six mois mais de moins d’un an
Article Colonne 1 Colonne 2 Figure du Répertoire des modèles de TVN (version) Condition d’utilisation 1 28.1(B) (éléments nutritifs figurant en caractères d’au moins 8 points) 2 28.2(B) La version de l’article 1 ne peut être présentée conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères d’au moins 7 points) 3 28.3(B) Les versions des articles 1 et 2 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères étroits d’au moins 7 points) 4 28.4(B) Les versions des articles 1 à 3 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères étroits d’au moins 6 points)
- DORS/2003-11, art. 20
- DORS/2016-305, art. 39 et 74
Modèle composé — différentes quantités d’aliments — bébés âgés d’au moins six mois mais de moins d’un an
- DORS/2016-305, art. 40
B.01.464 (1) Sous réserve du paragraphe (2), le tableau de la valeur nutritive de tout produit préemballé destiné exclusivement aux bébés âgés d’au moins six mois mais de moins d’un an qui indique les renseignements distincts en fonction de différentes quantités de l’aliment, tel qu’il est prévu au paragraphe B.01.406(8), est présenté selon l’une des versions figurant à la colonne 1 du tableau du présent article, si la condition prévue à la colonne 2 est remplie.
(2) Si le tableau de la valeur nutritive ne peut être présenté conformément au présent règlement sur 15 % ou moins de la surface exposée disponible du produit préemballé selon l’une des versions figurant à la colonne 1 du tableau du présent article, il est présenté :
a) soit selon le modèle composé bilingue prévu aux figures 30.5(B) ou 30.6(B) du Répertoire des modèles de TVN;
b) soit selon l’une des versions figurant à la colonne 1 du tableau du présent article, même si le tableau de la valeur nutritive devrait être présenté sur plus de 15 % de la surface exposée disponible.
(3) Pour l’application du présent article, afin d’établir si une version du tableau de la valeur nutritive ne peut être présentée conformément au présent règlement sur 15 % ou moins de la surface exposée disponible du produit préemballé, il n’est tenu compte, dans le tableau, que des renseignements exigés par le présent règlement pour chaque quantité d’aliment pour laquelle des renseignements distincts y sont indiqués.
TABLEAU
PARTIE 1
Modèle composé — différentes quantités d’aliments — bébés âgés d’au moins six mois mais de moins d’un an
Article Colonne 1 Colonne 2 Figure du Répertoire des modèles de TVN (version) Condition d’utilisation 1 29.1(F) et (A) (éléments nutritifs figurant en caractères d’au moins 8 points) 2 29.2(F) et (A) La version de l’article 1 ne peut être présentée conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères d’au moins 7 points) 3 29.3(F) et (A) Les versions des articles 1 et 2 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères étroits d’au moins 7 points) 4 29.4(F) et (A) Les versions des articles 1 à 3 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères étroits d’au moins 7 points) 5 29.5(F) et (A) Les versions des articles 1 à 4 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères étroits d’au moins 6 points) 6 29.6(F) et (A) Les versions des articles 1 à 5 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères étroits d’au moins 6 points) PARTIE 2
Modèle composé bilingue — différentes quantités d’aliments — bébés âgés d’au moins six mois mais de moins d’un an
Article Colonne 1 Colonne 2 Figure du Répertoire des modèles de TVN (version) Condition d’utilisation 1 30.1(B) (éléments nutritifs figurant en caractères d’au moins 8 points) 2 30.2(B) La version de l’article 1 ne peut être présentée conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères d’au moins 7 points) 3 30.3(B) Les versions des articles 1 et 2 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères étroits d’au moins 7 points) 4 30.4(B) Les versions des articles 1 à 3 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. (éléments nutritifs figurant en caractères étroits d’au moins 6 points)
- DORS/2003-11, art. 20
- DORS/2016-305, art. 41 et 74
Présentation des renseignements complémentaires — bébés âgés d’au moins six mois mais de moins d’un an
- DORS/2016-305, art. 42
B.01.465 (1) Le présent article s’applique à tout produit préemballé destiné exclusivement aux bébés âgés d’au moins six mois mais de moins d’un an.
(2) Les renseignements visés à la colonne 1 du tableau de l’article B.01.402 qui sont indiqués dans une version du tableau de la valeur nutritive se composant d’un tableau en anglais et d’un tableau en français ou d’un tableau en anglais ou en français, sont présentés :
a) selon l’ordre de présentation, les retraits et les notes complémentaires indiqués aux figures 33.1(F) et (A) du Répertoire des modèles de TVN;
b) quant aux autres caractéristiques de présentation, selon le modèle prévu à la figure applicable du Répertoire des modèles de TVN.
(3) Les renseignements visés à la colonne 1 du tableau de l’article B.01.402 qui sont indiqués dans une version du tableau de la valeur nutritive se composant d’un tableau en anglais et en français sont présentés :
a) selon l’ordre de présentation, les retraits et les notes complémentaires indiqués à la figure 34.1(B) du Répertoire des modèles de TVN;
b) quant aux autres caractéristiques de présentation, selon le modèle prévu à la figure applicable du Répertoire des modèles de TVN.
(4) Malgré l’alinéa (2)a), les retraits indiqués aux figures 33.1(F) et (A) du Répertoire des modèles de TVN ne s’appliquent pas si les renseignements visés à la colonne 1 du tableau de l’article B.01.402 sont présentés selon le modèle linéaire visé à l’alinéa B.01.461(3)c) ou le modèle linéaire simplifié visé à l’alinéa B.01.462(3)c).
- DORS/2003-11, art. 20
- DORS/2016-305, art. 43 et 74
Autres modes de présentation
B.01.466 (1) Malgré l’article A.01.016, le tableau de la valeur nutritive d’un produit préemballé qui répond aux critères mentionnés aux paragraphes B.01.454(3) ou B.01.455(3), à l’alinéa B.01.457(2)b), aux paragraphes B.01.461(3) ou B.01.462(3) ou à l’alinéa B.01.463(2)b) peut être placé sur, selon le cas :
a) une étiquette mobile attachée à l’emballage;
b) une notice d’accompagnement;
c) le verso d’une étiquette;
d) une étiquette dépliante;
e) un manchon, une surenveloppe ou un collier.
(2) Si le tableau de la valeur nutritive est placé conformément aux alinéas (1)b) ou c), le recto de l’étiquette en indique l’endroit en caractères d’au moins 8 points.
(3) Si le tableau de la valeur nutritive est placé conformément au paragraphe (1), il est présenté :
a) dans le cas de tout produit visé au paragraphe B.01.454(3), selon l’une des versions prévues aux alinéas B.01.454(3)a), b) et c) ou selon l’une des versions figurant à la colonne 1 du tableau de l’article B.01.454;
b) dans le cas de tout produit visé au paragraphe B.01.455(3), selon l’une des versions prévues aux alinéas B.01.455(3)a), b) et c) ou selon l’une des versions figurant à la colonne 1 du tableau de l’article B.01.455;
c) dans le cas de tout produit visé à l’alinéa B.01.457(2)b), selon l’une des versions prévues au sous-alinéa B.01.457(2)b)(i) ou selon l’une des versions figurant à la colonne 1 du tableau de l’article B.01.457;
d) dans le cas de tout produit visé au paragraphe B.01.461(3), selon l’une des versions prévues aux alinéas B.01.461(3)a), b) et c) ou selon l’une des versions figurant à la colonne 1 du tableau de l’article B.01.461;
e) dans le cas de tout produit visé au paragraphe B.01.462(3), selon l’une des versions prévues aux alinéas B.01.462(3)a), b) et c) ou selon l’une des versions figurant à la colonne 1 du tableau de l’article B.01.462;
f) dans le cas de tout produit visé à l’alinéa B.01.463(2)b), selon l’une des versions prévues au sous-alinéa B.01.463(2)b)(i) ou selon l’une des versions figurant à la colonne 1 du tableau de l’article B.01.463.
- DORS/2003-11, art. 20
- DORS/2018-69, art. 3(F)
Petits emballages
B.01.467 (1) Malgré l’article A.01.016 et sous réserve du paragraphe (2), l’étiquette de tout produit préemballé dont la surface exposée disponible est de moins de 100 cm2 peut ne pas porter le tableau de la valeur nutritive si son recto comporte des indications sur la manière dont l’acheteur ou le consommateur peut obtenir les renseignements qui devraient figurer dans le tableau.
(2) Le paragraphe (1) ne s’applique pas :
a) aux produits préemballés visés aux alinéas B.01.401(3)a), b) ou e);
b) aux produits préemballés contenus dans un emballage sur lequel aucune étiquette ne peut être apposée ou sur lequel les renseignements ne peuvent être indiqués lisiblement et de façon que l’acheteur ou le consommateur puisse les voir aisément dans les conditions habituelles d’achat.
(2.1) Toutefois, le paragraphe (1) s’applique au produit préemballé visé au sous-alinéa B.01.401(3)e)(ii) et qui répond aux critères mentionnés à l’article 37 du Tableau des mentions et des allégations autorisées concernant la teneur nutritive, dans la colonne 2, relatifs au sujet « Sans sucres » figurant à la colonne 1, si les conditions ci-après sont réunies :
a) les produits préemballés ne contiennent pas de vitamines ni de minéraux nutritifs ajoutés;
b) la valeur énergétique exprimée en Calories par portion indiquée et la teneur en polyalcools exprimée en grammes par portion indiquée figurent immédiatement après celui des éléments ci-après qui figure en dernier sur l’étiquette :
(i) la liste des ingrédients,
(ii) la mention des sources d’allergènes alimentaires ou de gluten et des sulfites ajoutés, au sens du paragraphe B.01.010.1(1),
(iii) l’énoncé visé au paragraphe B.01.010.4(1),
(iv) toute mention visée au paragraphe B.01.014(1);
c) toute mention ou allégation figurant à l’article 37 du tableau, dans la colonne 4, en regard du sujet « Sans sucres » visé à la colonne 1 et figurant sur l’étiquette, à la fois :
(i) est lisible sur l’espace principal,
(ii) est en minuscules, à l’exception de la première lettre de chaque mot de la mention ou de l’allégation qui peut être majuscule,
(iii) est en caractères de dimensions au moins égales et aussi bien en vue que les caractères utilisés dans la portion numérique de la déclaration de la quantité nette, comme l’exigent l’alinéa 229(1)a) et les paragraphes 229(2) et (3) du Règlement sur la salubrité des aliments au Canada,
(iv) est d’une couleur faisant contraste avec le fond de l’étiquette.
(3) Les indications visées au paragraphe (1) répondent aux critères suivants :
a) elles sont présentées en caractères d’au moins 8 points;
b) elles comportent une adresse postale ou un numéro de téléphone sans frais;
c) elles figurent :
(i) soit en français et en anglais,
(ii) soit dans l’une de ces langues, si, conformément aux paragraphes B.01.012(3) ou (7), les renseignements devant être indiqués sur l’étiquette du produit aux termes du présent règlement peuvent l’être uniquement dans la langue en cause et qu’ils y figurent dans celle-ci.
(4) Le fabricant du produit préemballé fournit les renseignements visés au paragraphe (1) à l’acheteur ou au consommateur sur demande :
a) sans frais;
b) de la façon suivante :
(i) soit dans la langue officielle dans laquelle les renseignements sont demandés ou, à la demande de l’acheteur ou du consommateur, dans les deux langues officielles,
(ii) soit dans l’une de ces langues, si, conformément aux paragraphes B.01.012(3) ou (7), les renseignements devant être indiqués sur l’étiquette du produit aux termes du présent règlement peuvent l’être uniquement dans la langue en cause et qu’ils y figurent dans celle-ci;
c) sous forme d’un tableau de la valeur nutritive qui est présenté, à la fois :
(i) selon un modèle — autre qu’un modèle horizontal — qui est prévu à l’un des articles B.01.454 à B.01.459 et B.01.461 à B.01.464 et qui, autrement, figurerait sur l’étiquette du produit conformément au présent règlement,
(ii) selon l’une des versions de ce modèle figurant à la colonne 1 de l’article 1 de toute partie du tableau de l’article applicable visé au sous-alinéa (i).
(5) Dans le présent article, langues officielles s’entend du français et de l’anglais.
- DORS/2003-11, art. 20
- DORS/2016-305, art. 44
- DORS/2018-108, art. 400
- DORS/2022-168, art. 15
B.01.468 (1) Sous réserve du paragraphe (2), si un produit préemballé a une surface exposée disponible de moins de 100 cm2 et porte un tableau de la valeur nutritive sur son étiquette, ce tableau peut ne contenir que les seuls renseignements suivants :
a) la portion indiquée;
b) la valeur énergétique et, sous réserve du paragraphe (2), la teneur en tout élément nutritif visé à la colonne 1 des articles 2 à 15 du tableau de l’article B.01.401 qui ne peut être exprimée par « 0 » au tableau de la valeur nutritive selon les règles d’écriture indiquées dans la colonne 4;
c) la teneur en un polyalcool, en une vitamine ou en un minéral nutritif ajoutés au produit.
(2) Lorsqu’une déclaration expresse ou implicite incluant des renseignements visés à la colonne 1 des tableaux des articles B.01.401 ou B.01.402 est faite sur l’étiquette du produit préemballé ou encore dans l’annonce d’un tel produit faite par le fabricant du produit ou sous ses ordres, ces renseignements sont aussi mentionnés dans le tableau de la valeur nutritive.
- DORS/2016-305, art. 45
B.01.469 Malgré le paragraphe B.01.401(1), l’étiquette d’un produit préemballé dont la surface exposée disponible est de moins de 15 cm2 peut ne pas porter de tableau de la valeur nutritive.
- DORS/2016-305, art. 45
[
Allégations relatives à la teneur nutritive
Définitions
B.01.500 (1) Les définitions qui suivent s’appliquent au présent article et au Tableau des mentions et des allégations autorisées concernant la teneur nutritive.
- aliment de référence du même groupe alimentaire
aliment de référence du même groupe alimentaire Aliment qui peut être substitué, dans l’alimentation, à l’aliment auquel il est comparé et qui appartient, selon le cas :
a) au même groupe alimentaire que l’aliment auquel il est comparé, tel que le fromage comme aliment de référence pour le lait, ou le poulet comme aliment de référence pour le tofu;
b) à la catégorie des autres aliments, si l’aliment auquel il est comparé appartient aussi à cette catégorie, tel que les bretzels comme aliment de référence pour les croustilles;
c) à la catégorie des aliments composés, si l’aliment auquel il est comparé appartient aussi à cette catégorie, tel que la pizza comme aliment de référence pour la lasagne. (reference food of the same food group)
- aliment de référence similaire
aliment de référence similaire Aliment du même type que l’aliment auquel il est comparé et qui n’a pas été transformé, formulé, reformulé ou autrement modifié de manière à augmenter ou à diminuer la valeur énergétique ou la teneur en l’élément nutritif qui fait l’objet de la comparaison, tel que le lait entier comme aliment de référence similaire pour le lait partiellement écrémé, ou les biscuits aux brisures de chocolat ordinaires comme aliment de référence similaire pour les biscuits aux brisures de chocolat à teneur réduite en matières grasses. (similar reference food)
- aliments composés
aliments composés Catégorie comprenant les aliments qui contiennent, comme ingrédients, des aliments appartenant à plus d’un groupe alimentaire ou appartenant à un ou plusieurs groupes alimentaires et mélangés avec des aliments provenant de la catégorie des autres aliments, tels que la pizza ou la lasagne. (combination foods)
- autres aliments
autres aliments Catégorie comprenant les aliments qui n’appartiennent à aucun des groupes alimentaires, notamment :
a) les aliments contenant surtout des matières grasses, tels que le beurre, la margarine, l’huile ou le saindoux;
b) les aliments contenant surtout des sucres, tels que les confitures, le miel, le sirop ou les confiseries;
c) les grignotines, telles que les croustilles ou les bretzels;
d) les boissons, telles que l’eau, le thé, le café ou les boissons gazeuses;
e) les fines herbes, épices et condiments, tels que les marinades, la moutarde ou le ketchup. (other foods)
- groupe alimentaire
groupe alimentaire L’une des catégories d’aliments suivantes :
a) les produits du lait et leurs substituts dont les boissons végétales enrichies;
b) la viande, la volaille et le poisson ainsi que leurs substituts, dont les légumineuses, les oeufs, le tofu et le beurre d’arachide;
c) le pain et les produits céréaliers;
d) les légumes et les fruits. (food group)
(2) L’aliment de référence similaire visé à la colonne 3 de l’article 45 du Tableau des mentions et des allégations autorisées concernant la teneur nutritive en regard du sujet « léger (énergie ou lipides) » figurant à la colonne 1 a une valeur nutritionnelle représentative d’aliments du même type qui n’ont pas été transformés, formulés, reformulés ou autrement modifiés de manière à augmenter la valeur énergétique ou la teneur en lipides.
- DORS/2003-11, art. 20
- DORS/2007-302, art. 4(F)
- DORS/2022-168, art. 52
Langues
B.01.501 Les déclarations prévues aux articles B.01.503 à B.01.513 faites sur l’étiquette d’un aliment figurent :
a) soit en français et en anglais;
b) soit dans l’une de ces langues, si, conformément aux paragraphes B.01.012(3) ou (7), les renseignements devant être indiqués sur l’étiquette de l’aliment aux termes du présent règlement peuvent l’être uniquement dans la langue en cause et qu’ils y figurent dans celle-ci.
- DORS/2003-11, art. 20
Mentions ou allégations
B.01.502 (1) Est interdite, sur l’étiquette ou dans l’annonce d’un aliment, toute déclaration, expresse ou implicite, caractérisant la valeur énergétique de l’aliment ou sa teneur en un élément nutritif.
(2) Le paragraphe (1) ne s’applique pas :
a) aux déclarations visées par le présent règlement, y compris celles sous forme de symbole nutritionnel;
b) à la déclaration prévue à l’article 273 du Règlement sur la salubrité des aliments au Canada;
c) aux déclarations prévues à la colonne 1 du tableau 2 du volume 7 du document intitulé Normes d’identité canadiennes, préparé par l’Agence canadienne d’inspection des aliments et publié sur son site Web, avec ses modifications successives;
d) aux déclarations caractérisant la teneur en lactose d’un aliment;
e) aux déclarations caractérisant l’adjonction de sel dans un aliment, autres que les mentions ou les allégations figurant à la colonne 4 du Tableau des mentions et des allégations autorisées concernant la teneur nutritive;
f) aux déclarations caractérisant l’adjonction de sucres dans un aliment, autres que les mentions ou les allégations figurant à la colonne 4 du Tableau des mentions et des allégations autorisées concernant la teneur nutritive;
g) aux déclarations caractérisant la teneur en amidon d’un aliment destiné exclusivement aux bébés âgés d’au moins six mois mais de moins d’un an;
h) aux déclarations « (nom de l’aliment) dégraissé », « (nom de l’aliment) déminéralisé », « (nom du sirop) à forte/haute teneur en (nom du monosaccharide ou du disaccharide) » et « (nom du sirop) à teneur élevée en (nom du monosaccharide ou du disaccharide) »;
i) aux déclarations caractérisant la teneur en un acide gras d’une huile végétale qui font partie du nom usuel de celle-ci;
j) aux déclarations caractérisant la teneur en alcool d’une boisson;
k) à la déclaration « légèrement salé » faite à l’égard du poisson;
l) à la déclaration anglaise « lean » faite à l’égard d’un repas préemballé présenté comme étant conçu pour un régime amaigrissant ou un régime de maintien du poids.
B.01.503 (1) Est permise, sur l’étiquette ou dans l’annonce d’un aliment, toute mention ou toute allégation figurant à la colonne 4 du Tableau des mentions et des allégations autorisées concernant la teneur nutritive en regard de l’un des sujets figurant à la colonne 1, si les conditions suivantes sont réunies :
a) l’aliment répond aux critères mentionnés à la colonne 2;
b) s’il y a lieu, l’étiquette ou l’annonce de l’aliment répond aux critères mentionnés à la colonne 3 conformément aux articles B.01.504 à B.01.506;
c) s’il s’agit d’un aliment qui n’est pas un produit préemballé ou d’un produit préemballé pour lequel une annonce est faite par une personne autre que le fabricant du produit ou une personne agissant sous ses ordres, l’étiquette ou l’annonce indique, par portion indiquée et, le cas échéant, conformément aux articles B.01.505 ou B.01.506 :
(i) soit la valeur énergétique, si l’objet de la mention ou de l’allégation est la valeur énergétique,
(ii) soit la teneur en l’élément nutritif en cause, si l’objet de la mention ou de l’allégation est un élément nutritif.
(1.1) Malgré le paragraphe (1), est interdite, dans l’espace principal du produit préemballé, toute mention ou toute allégation figurant dans la colonne 4 du Tableau des mentions et des allégations autorisées concernant la teneur nutritive liée à un élément nutritif visé par le symbole nutritionnel figurant dans cet espace, sauf si la mention ou l’allégation est faite à l’égard de l’un des sujets ci-après figurant dans la colonne 1 :
a) « teneur réduite en acides gras saturés » visé à l’article 20;
b) « teneur réduite en sodium ou en sel » visé à l’article 33;
c) « teneur réduite en sucres » visé à l’article 38.
(2) Malgré le paragraphe (1), est interdite, sur l’étiquette ou dans l’annonce d’un aliment destiné exclusivement aux enfants âgés de moins de quatre ans, toute mention ou toute allégation figurant dans la colonne 4 du Tableau des mentions et des allégations autorisées concernant la teneur nutritive, sauf si la mention ou l’allégation est faite à l’égard de l’un des sujets ci-après figurant dans la colonne 1 :
a) « source de protéines » visé à l’article 8;
b) « excellente source de protéines » visé à l’article 9;
c) « plus de protéines » visé à l’article 10;
d) « non additionné de sel ou de sodium » visé à l’article 35;
e) « non additionné de sucres » visé à l’article 40.
(2.01) Malgré les paragraphes (1) et (2), est interdite, sur l’étiquette ou dans l’annonce d’un fortifiant pour lait humain, toute mention ou toute allégation figurant à la colonne 4 du Tableau des mentions et des allégations autorisées concernant la teneur nutritive.
(2.1) Les renseignements requis par l’alinéa (1)c) n’ont pas à être indiqués sur l’étiquette ou dans l’annonce d’un légume frais, d’un fruit frais ou d’un mélange quelconque de légumes frais ou de fruits frais sans ingrédient ajouté, d’une orange à laquelle un colorant alimentaire a été ajouté et d’un légume frais ou d’un fruit frais enrobé d’huile minérale, de paraffine, de vaseline ou de tout autre enduit protecteur lorsqu’une mention ou une allégation figurant à la colonne 4 du Tableau des mentions et des allégations autorisées concernant la teneur nutritive est faite sur l’étiquette ou dans l’annonce.
(3) Lorsqu’une mention ou une allégation figurant à la colonne 4 du Tableau des mentions et des allégations autorisées concernant la teneur nutritive est faite sur l’étiquette ou dans l’annonce d’un aliment, tous les mots, chiffres, signes ou symboles constituant cette mention ou allégation ont la même taille et figurent aussi bien en vue les uns que les autres.
(4) Dans la version anglaise des mentions ou des allégations, le terme « fibre » peut aussi s’orthographier « fiber ».
- DORS/2003-11, art. 20
- DORS/2016-305, art. 46 et 75(F)
- DORS/2021-57, art. 10
- DORS/2022-168, art. 17
- DORS/2022-168, art. 52
B.01.504 Lorsqu’une mention ou une allégation figurant à la colonne 4 du Tableau des mentions et des allégations autorisées concernant la teneur nutritive est faite sur l’étiquette d’un aliment, les renseignements requis en vertu des critères mentionnés à la colonne 3, à la fois :
a) précèdent ou suivent, sans qu’aucun texte imprimé ou écrit ni aucun signe graphique ne soit intercalé :
(i) soit la mention ou l’allégation ne paraissant qu’une seule fois,
(ii) soit, si la mention ou l’allégation est répétée, celle qui est la plus en évidence sur l’espace principal ou, à défaut, celle qui est la plus en évidence ailleurs sur l’étiquette;
b) figurent en caractères d’une taille qui est au moins égale et aussi bien en vue que :
(i) ceux de la mention ou de l’allégation ne paraissant qu’une seule fois,
(ii) si la mention ou l’allégation est répétée, ceux de celle qui est la plus en évidence sur l’espace principal ou, à défaut, ceux de celle qui est la plus en évidence ailleurs sur l’étiquette.
- DORS/2003-11, art. 20
- DORS/2022-168, art. 52
B.01.505 Si une mention ou une allégation figurant à la colonne 4 du Tableau des mentions et des allégations autorisées concernant la teneur nutritive est faite dans l’annonce d’un aliment autre qu’une annonce radiophonique ou télévisée, les renseignements requis en vertu des critères mentionnés à la colonne 3 et, le cas échéant, les renseignements requis par l’alinéa B.01.503(1)c), à la fois :
a) précèdent ou suivent, sans qu’aucun texte imprimé ou écrit ni aucun signe graphique ne soit intercalé, la mention ou l’allégation ne paraissant qu’une seule fois ou, si la mention ou l’allégation est répétée, celle qui est la plus en évidence;
b) figurent en caractères d’une taille qui est au moins égale et aussi bien en vue que ceux de la mention ou de l’allégation ne paraissant qu’une seule fois ou, si la mention ou l’allégation est répétée, que ceux de celle qui est la plus en évidence.
- DORS/2003-11, art. 20
- DORS/2022-168, art. 52
B.01.506 (1) Si une mention ou une allégation figurant à la colonne 4 du Tableau des mentions et des allégations autorisées concernant la teneur nutritive est faite dans une annonce radiophonique ou télévisée, les renseignements requis en vertu des critères mentionnés à la colonne 3 et, le cas échéant, les renseignements requis par l’alinéa B.01.503(1)c) figurent dans l’annonce, à l’exception des renseignements requis en vertu des critères mentionnés à l’alinéa a) de la colonne 3, à l’égard des sujets ci-après figurant à la colonne 1, qui peuvent être mentionnés sur l’étiquette de l’aliment :
a) « énergie réduite » visé à l’article 3;
b) « teneur réduite en lipides » visé à l’article 13;
c) « teneur réduite en acides gras saturés » visé à l’article 20;
d) « teneur réduite en acides gras trans » visé à l’article 23;
e) « teneur réduite en cholestérol » visé à l’article 29;
f) « teneur réduite en sodium ou en sel » visé à l’article 33;
g) « légèrement salé » visé à l’article 36;
h) « teneur réduite en sucres » visé à l’article 38;
i) « léger (énergie ou lipides) » visé à l’article 45.
(2) Malgré le paragraphe (1), si la mention ou l’allégation est faite dans une annonce radiophonique ou télévisée par une personne autre que le fabricant de l’aliment ou une personne agissant sous ses ordres, les renseignements requis en vertu des critères mentionnés à l’alinéa a) de la colonne 3 du Tableau des mentions et des allégations autorisées concernant la teneur nutritive à l’égard des sujets visés aux alinéas (1)a) à i) sont mentionnés dans l’annonce.
(3) Si les renseignements requis en vertu des critères mentionnés à la colonne 3 du Tableau des mentions et des allégations autorisées concernant la teneur nutritive et les renseignements requis par l’alinéa B.01.503(1)c) sont mentionnés dans une annonce radiophonique ou dans la composante audio d’une annonce télévisée, ils précèdent ou suivent immédiatement la mention ou l’allégation.
(4) Dans le cas d’une annonce télévisée, les renseignements requis en vertu des critères mentionnés à la colonne 3 du Tableau des mentions et des allégations autorisées concernant la teneur nutritive et, le cas échéant, les renseignements requis par l’alinéa B.01.503(1)c) sont communiqués, selon le cas :
a) en mode audio, si la mention ou l’allégation fait partie uniquement de la composante audio de l’annonce ou à la fois des composantes audio et visuelle de celle-ci;
b) en mode audio ou en mode visuel, si la mention ou l’allégation fait partie uniquement de la composante visuelle de l’annonce.
(5) Les renseignements requis en vertu des critères mentionnés à la colonne 3 du Tableau des mentions et des allégations autorisées concernant la teneur nutritive et les renseignements requis par l’alinéa B.01.503(1)c) qui sont communiqués en mode visuel dans une annonce télévisée, à la fois :
a) paraissent en même temps et pendant au moins la même durée que la mention ou l’allégation;
b) précèdent ou suivent, sans qu’aucun texte imprimé ou écrit ni aucun signe graphique ne soit intercalé, la mention ou l’allégation ne paraissant qu’une seule fois ou, si la mention ou l’allégation est répétée, celle qui est la plus en évidence;
c) figurent en caractères d’une taille au moins égale et aussi bien en vue que ceux de la mention ou de l’allégation ne paraissant qu’une seule fois ou, si la mention ou l’allégation est répétée, que ceux de celle qui est la plus en évidence.
- DORS/2003-11, art. 20
- DORS/2022-168, art. 52
B.01.507 Est permise, sur l’étiquette ou dans l’annonce d’un aliment, toute déclaration, expresse ou implicite, selon laquelle l’aliment est conçu pour un régime à teneur réduite en énergie si une mention ou une allégation figurant à la colonne 4 du Tableau des mentions et des allégations autorisées concernant la teneur nutritive en regard de l’un des sujets ci-après figurant à la colonne 1 est faite sur l’étiquette ou dans l’annonce conformément à l’article B.01.503 :
a) « sans énergie » visé à l’article 1;
b) « peu d’énergie » visé à l’article 2;
c) « énergie réduite » visé à l’article 3;
d) « moins d’énergie » visé à l’article 4;
e) « sans sucres » visé à l’article 37.
- DORS/2003-11, art. 20
- DORS/2022-168, art. 52
B.01.508 (1) Est permise, sur l’étiquette ou dans l’annonce d’un aliment, toute déclaration, expresse ou implicite, selon laquelle l’aliment est conçu pour un régime à teneur réduite en sodium si une mention ou une allégation figurant à la colonne 4 du Tableau des mentions et des allégations autorisées concernant la teneur nutritive en regard de l’un des sujets ci-après figurant à la colonne 1 est faite sur l’étiquette ou dans l’annonce conformément à l’article B.01.503 :
a) « sans sodium ou sans sel » visé à l’article 31;
b) « faible teneur en sodium ou en sel » visé à l’article 32;
c) « teneur réduite en sodium ou en sel » visé à l’article 33;
d) « moins de sodium ou de sel » visé à l’article 34.
(2) Malgré le paragraphe (1), est interdite, dans l’espace principal d’un produit préemballé, toute déclaration, expresse ou implicite, selon laquelle le produit est conçu pour un régime à teneur réduite en sodium si un symbole nutritionnel à l’égard du sodium paraît dans cet espace.
- DORS/2003-11, art. 20
- DORS/2022-168, art. 18
- DORS/2022-168, art. 52
B.01.509 (1) Est permise, sur l’étiquette ou dans l’annonce d’un aliment, la mention ou l’allégation « non sucré » si les conditions ci-après sont réunies :
a) l’aliment répond aux critères mentionnés à l’article 40 du Tableau des mentions et des allégations autorisées concernant la teneur nutritive relatifs, dans la colonne 2, au sujet « Non additionné de sucres » figurant dans la colonne 1;
b) il ne contient aucun des édulcorants mentionnés à l’article 2 de l’Autorisation de mise en marché d’additifs alimentaires comme édulcorants.
(2) Malgré le paragraphe (1), est interdite, dans l’espace principal d’un produit préemballé, la mention ou l’allégation selon laquelle le produit est « non sucré » si un symbole nutritionnel à l’égard des sucres paraît dans cet espace.
- DORS/2003-11, art. 20
- DORS/2022-168, art. 19
B.01.510 Toute mention ou toute allégation figurant à la colonne 4 du Tableau des mentions et des allégations autorisées concernant la teneur nutritive en regard des sujets ci-après figurant à la colonne 1, faite sur l’étiquette ou dans l’annonce de céréales à déjeuner avec du lait, est accompagnée d’une indication que la mention ou l’allégation est faite à l’égard de 30 g de céréales à déjeuner combinées avec 125 mL de lait :
a) « source de protéines » visé à l’article 8;
b) « excellente source de protéines » visé à l’article 9;
c) « plus de protéines » visé à l’article 10.
- DORS/2003-11, art. 20
- DORS/2022-168, art. 52
B.01.511 (1) Sous réserve des paragraphes (2) à (4), il est entendu que toute mention ou toute allégation figurant à la colonne 4 du Tableau des mentions et des allégations autorisées concernant la teneur nutritive, faite sur l’étiquette ou dans l’annonce d’un aliment, ne peut être entrecoupée d’autres mots, chiffres, signes ou symboles, mais peut en être précédée ou suivie.
(2) Les mots « très », « ultra » et « extra », et tout autre mot, chiffre, signe ou symbole modifiant la nature de la mention ou de l’allégation, ne peuvent précéder ou suivre celle-ci.
(3) Toute mention ou toute allégation faite sur l’étiquette ou dans l’annonce d’un aliment qui n’a pas été transformé, formulé, reformulé ou autrement modifié afin de répondre aux critères mentionnés à la colonne 2 du Tableau des mentions et des allégations autorisées concernant la teneur nutritive ne peut être accompagnée de la marque de l’aliment.
(4) Tout mot, chiffre, signe ou symbole qui précède ou suit la mention ou l’allégation visée au paragraphe (3) fait en sorte que la mention ou l’allégation caractérise tous les aliments du même type que l’aliment en cause et non seulement celui-ci en particulier.
- DORS/2003-11, art. 20
- DORS/2022-168, art. 52
B.01.512 Si un aliment répond aux critères mentionnés à la colonne 2 du Tableau des mentions et des allégations autorisées concernant la teneur nutritive en regard de plusieurs sujets figurant à la colonne 1, la répétition de l’élément commun, dans les mentions ou les allégations figurant à la colonne 4 faites sur l’étiquette ou dans l’annonce de l’aliment, n’est pas nécessaire et les éléments dissemblables peuvent être unis au moyen d’une conjonction ou d’un signe de ponctuation, selon le cas.
- DORS/2003-11, art. 20
- DORS/2022-168, art. 52
Caractéristique organoleptique
B.01.513 (1) Est interdite, sur l’étiquette ou dans l’annonce d’un aliment, la mention ou l’allégation « léger » ou « light », de même que toute mention ou toute allégation ayant la même consonance que celle-ci, à l’égard d’une caractéristique organoleptique de l’aliment, à moins que les conditions suivantes soient réunies :
a) si la mention ou l’allégation « léger » ou « light » est faite sur l’étiquette d’un aliment, la caractéristique organoleptique, à la fois :
(i) précède ou suit, sans qu’aucun texte imprimé ou écrit ni aucun signe graphique ne soit intercalé :
(A) la mention ou l’allégation ne paraissant qu’une seule fois,
(B) si la mention ou l’allégation est répétée, celle qui est la plus en évidence sur l’espace principal ou, à défaut, celle qui est la plus en évidence ailleurs sur l’étiquette,
(ii) figure en caractères d’une taille qui est au moins égale et aussi bien en vue que :
(A) ceux de la mention ou de l’allégation ne paraissant qu’une seule fois,
(B) si la mention ou l’allégation est répétée, ceux de celle qui est la plus en évidence sur l’espace principal ou, à défaut, ceux de celle qui est la plus en évidence ailleurs sur l’étiquette;
b) si la mention ou l’allégation « léger » ou « light » est faite dans l’annonce d’un aliment autre qu’une annonce radiophonique ou télévisée, la caractéristique organoleptique, à la fois :
(i) précède ou suit, sans qu’aucun texte imprimé ou écrit ni aucun signe graphique ne soit intercalé, la mention ou l’allégation ne paraissant qu’une seule fois ou, si une telle mention ou allégation est répétée, celle qui est la plus en évidence,
(ii) figure en caractères d’une taille qui est au moins égale et aussi bien en vue que ceux de la mention ou de l’allégation ne paraissant qu’une seule fois ou, si la mention ou l’allégation est répétée, que ceux de celle qui est la plus en évidence;
c) si la mention ou l’allégation « léger » ou « light » est faite dans une annonce radiophonique ou dans la composante audio d’une annonce télévisée, la caractéristique organoleptique précède ou suit immédiatement la mention ou l’allégation;
d) si la mention ou l’allégation « léger » ou « light » est faite dans la composante visuelle d’une annonce télévisée, la caractéristique organoleptique, à la fois :
(i) paraît en même temps et pendant la même durée que la mention ou l’allégation,
(ii) précède ou suit, sans qu’aucun texte imprimé ou écrit ni aucun signe graphique ne soit intercalé, la mention ou l’allégation ne paraissant qu’une seule fois ou, si la mention ou l’allégation est répétée, celle qui est la plus en évidence,
(iii) figure en caractères d’une taille au moins égale et aussi bien en vue que ceux de la mention ou de l’allégation ne paraissant qu’une seule fois ou, si la mention ou l’allégation est répétée, que ceux de celle qui est la plus en évidence.
(2) Le paragraphe (1) ne s’applique pas à la mention ou à l’allégation « léger » ou « light » faite à l’égard du rhum.
- DORS/2003-11, art. 20
- err.(F), Vol. 137, no 5
- DORS/2007-176, art. 6
- DORS/2016-305, art. 75(F)
- DORS/2018-108, art. 397
- DORS/2022-168, art. 20
[
Allégations relatives à la santé
Langues
B.01.600 Toute mention ou allégation mentionnée à la colonne 1 du tableau suivant l’article B.01.603 faite sur l’étiquette d’un aliment figure :
a) soit en français et en anglais;
b) soit dans l’une de ces langues, si, conformément aux paragraphes B.01.012(3) ou (7), les renseignements devant être indiqués sur l’étiquette de l’aliment aux termes du présent règlement peuvent l’être uniquement dans la langue en cause et qu’ils y figurent dans celle-ci.
- DORS/2003-11, art. 20
Mentions ou allégations
B.01.601 (1) L’aliment dont l’étiquette ou l’annonce comporte une mention ou allégation figurant à la colonne 1 du tableau suivant l’article B.01.603 est exempté de l’application des dispositions de la Loi et de ses règlements relatives aux drogues et des paragraphes 3(1) et (2) de la Loi, si les conditions suivantes sont réunies :
a) il répond aux critères applicables mentionnés à la colonne 2;
b) son étiquette ou annonce répond aux critères applicables mentionnés à la colonne 3;
c) il n’est :
(i) ni destiné exclusivement aux enfants âgés de moins de quatre ans,
(ii) ni un aliment présenté comme étant conçu pour un régime à très faible teneur en énergie.
(2) Le paragraphe (1) ne s’applique pas à l’aliment qui satisfait à la définition de drogue, à l’article 2 de la Loi, pour une raison autre que la présence, sur son étiquette ou annonce, d’une mention ou allégation visée à ce paragraphe.
(3) Le paragraphe (1) s’applique même si le terme « lipides » est substitué au terme « graisses » dans la version française de la mention ou de l’allégation.
- DORS/2003-11, art. 20
- DORS/2022-168, art. 21
B.01.602 (1) Les renseignements requis en vertu des critères mentionnés à la colonne 3 du tableau suivant l’article B.01.603 qui figurent dans l’annonce d’un aliment qui n’est pas un produit préemballé ou dans l’annonce d’un produit préemballé faite par une personne autre que le fabricant du produit ou une personne agissant sous ses ordres répondent aux critères suivants :
a) dans le cas d’une annonce autre qu’une annonce radiophonique ou télévisée :
(i) d’une part, ils précèdent ou suivent, sans qu’aucun texte imprimé ou écrit ni aucun signe graphique ne soit intercalé, la mention ou allégation figurant à la colonne 1 ne paraissant qu’une seule fois ou, si la mention ou l’allégation est répétée, celle qui est la plus en évidence,
(ii) d’autre part, ils figurent en caractères d’une taille qui est au moins égale et aussi bien en vue que ceux de la mention ou de l’allégation ne paraissant qu’une seule fois ou, si la mention ou l’allégation est répétée, que ceux de celle qui est la plus en évidence;
b) dans le cas d’une annonce radiophonique ou de la composante audio d’une annonce télévisée, ils précèdent ou suivent immédiatement la mention ou l’allégation figurant à la colonne 1;
c) dans le cas d’une annonce télévisée, ils sont communiqués :
(i) en mode audio, si la mention ou l’allégation figurant à la colonne 1 fait partie uniquement de la composante audio de l’annonce ou, à la fois, des composantes audio et visuelle de celle-ci,
(ii) en mode audio ou en mode visuel, si la mention ou l’allégation figurant à la colonne 1 fait partie uniquement de la composante visuelle de l’annonce.
(2) Les renseignements qui sont communiqués en mode visuel dans une annonce télévisée conformément au sous-alinéa (1)c)(ii), à la fois :
a) paraissent en même temps et pendant au moins la même durée que la mention ou l’allégation;
b) précèdent ou suivent, sans qu’aucun texte imprimé ou écrit ni aucun signe graphique ne soit intercalé, la mention ou allégation ne paraissant qu’une seule fois ou, si la mention ou l’allégation est répétée, celle qui est la plus en évidence;
c) figurent en caractères d’une taille au moins égale et aussi bien en vue que ceux de la mention ou allégation ne paraissant qu’une seule fois ou, si la mention ou l’allégation est répétée, que ceux de celle qui est la plus en évidence.
- DORS/2003-11, art. 20
B.01.603 (1) Il est entendu que toute mention ou allégation figurant à la colonne 1 du tableau suivant le présent article, faite sur l’étiquette ou dans l’annonce d’un aliment, ne peut être entrecoupée d’autres mots, chiffres, signes ou symboles, mais peut en être précédée ou suivie.
(2) Si un aliment répond aux critères mentionnés à la colonne 2 du tableau suivant le présent article en regard de plusieurs articles de ce tableau, la répétition de l’élément commun, dans les mentions ou les allégations figurant à la colonne 1 faites sur l’étiquette ou dans l’annonce de l’aliment, n’est pas nécessaire et les éléments dissemblables peuvent être unis au moyen d’une conjonction ou d’un signe de ponctuation, selon le cas.
TABLEAU
Article Colonne 1 Colonne 2 Colonne 3 Mention ou allégation Critères — aliments Critères — étiquette ou annonce 1 (1) « Une alimentation saine comprenant des aliments à teneur élevée en potassium et pauvres en sodium peut réduire le risque d’hypertension, facteur de risque d’accident cérébrovasculaire et de maladie du coeur. (Nom de l’aliment) ne contient pas de sodium. »
(2) « Une alimentation saine comprenant des aliments à teneur élevée en potassium et pauvres en sodium peut réduire le risque d’hypertension, facteur de risque d’accident cérébrovasculaire et de maladie du coeur. (Nom de l’aliment) est pauvre en sodium. »
(3) « Une alimentation saine comprenant des aliments à teneur élevée en potassium et pauvres en sodium peut réduire le risque d’hypertension, facteur de risque d’accident cérébrovasculaire et de maladie du coeur. (Nom de l’aliment) est une bonne source de potassium et ne contient pas de sodium. »
(4) « Une alimentation saine comprenant des aliments à teneur élevée en potassium et pauvres en sodium peut réduire le risque d’hypertension, facteur de risque d’accident cérébrovasculaire et de maladie du coeur. (Nom de l’aliment) est une bonne source de potassium et est pauvre en sodium. »
(5) « Une alimentation saine comprenant des aliments à teneur élevée en potassium et pauvres en sodium peut réduire le risque d’hypertension, facteur de risque d’accident cérébrovasculaire et de maladie du coeur. (Nom de l’aliment) est une source élevée de potassium et ne contient pas de sodium. »
(6) « Une alimentation saine comprenant des aliments à teneur élevée en potassium et pauvres en sodium peut réduire le risque d’hypertension, facteur de risque d’accident cérébrovasculaire et de maladie du coeur. (Nom de l’aliment) a une teneur élevée en potassium et est pauvre en sodium. »
L’aliment :
a) autre qu’un légume ou un fruit, ne répond pas aux critères mentionnés à la colonne 2 de l’article 2 du Tableau des mentions et des allégations autorisées concernant la teneur nutritive en regard du sujet « peu d’énergie » visé à la colonne 1;
b) contient au moins 10 % de l’apport nutritionnel recommandé pondéré d’une vitamine ou d’un minéral nutritif, selon le cas :
(i) par quantité de référence et portion indiquée,
(ii) par portion indiquée, si l’aliment est un repas préemballé;
c) répond aux critères mentionnés à la colonne 2 de l’article 19 du Tableau des mentions et des allégations autorisées concernant la teneur nutritive en regard du sujet « faible teneur en acides gras saturés » visé à la colonne 1;
d) contient au plus 0,5 % d’alcool;
e) dont l’étiquette ou l’annonce comporte les mentions ou allégations (1), (3) ou (5) figurant à la colonne 1 du présent article, répond aux critères mentionnés à la colonne 2 de l’article 31 du Tableau des mentions et des allégations autorisées concernant la teneur nutritive en regard du sujet « sans sodium ou sans sel » visé à la colonne 1;
f) dont l’étiquette ou l’annonce comporte les mentions ou allégations (2), (4) ou (6) figurant à la colonne 1 du présent article, répond aux critères mentionnés à la colonne 2 de l’article 32 du Tableau des mentions et des allégations autorisées concernant la teneur nutritive en regard du sujet « faible teneur en sodium ou en sel » visé à la colonne 1;
g) dont l’étiquette ou l’annonce comporte les mentions ou allégations (3), (4), (5) ou (6) figurant à la colonne 1 du présent article, contient 350 mg ou plus de potassium, selon le cas :
(i) par quantité de référence et portion indiquée,
(ii) par portion indiquée, si l’aliment est un repas préemballé.
Si la mention ou l’allégation est faite sur l’étiquette ou dans l’annonce d’un aliment qui n’est pas un produit préemballé ou dans l’annonce d’un produit préemballé faite par une personne autre que le fabricant du produit ou une personne agissant sous ses ordres, l’étiquette ou l’annonce indique la teneur en sodium et en potassium par portion indiquée et, le cas échéant, conformément à l’article B.01.602. Toutefois, cette exigence ne s’applique pas si la mention ou l’allégation est faite sur l’étiquette ou dans l’annonce d’un légume frais, d’un fruit frais ou d’un mélange quelconque de légumes frais ou de fruits frais sans ingrédient ajouté, d’une orange à laquelle un colorant alimentaire a été ajouté et d’un légume frais ou d’un fruit frais enrobé d’huile minérale, de paraffine, de vaseline ou de tout enduit protecteur. 2 (1) « Une alimentation saine comprenant une quantité adéquate de calcium et de vitamine D et une activité physique régulière favorisent la formation d’os solides et peuvent réduire le risque d’ostéoporose. (Nom de l’aliment) est une bonne source de calcium. »
(2) « Une alimentation saine comprenant une quantité adéquate de calcium et de vitamine D et une activité physique régulière favorisent la formation d’os solides et peuvent réduire le risque d’ostéoporose. (Nom de l’aliment) est une source élevée de calcium. »
(3) « Une alimentation saine comprenant une quantité adéquate de calcium et de vitamine D et une activité physique régulière favorisent la formation d’os solides et peuvent réduire le risque d’ostéoporose. (Nom de l’aliment) est une excellente source de calcium. »
(4) « Une alimentation saine comprenant une quantité adéquate de calcium et de vitamine D et une activité physique régulière favorisent la formation d’os solides et peuvent réduire le risque d’ostéoporose. (Nom de l’aliment) est une source très élevée de calcium. »
(5) « Une alimentation saine comprenant une quantité adéquate de calcium et de vitamine D et une activité physique régulière favorisent la formation d’os solides et peuvent réduire le risque d’ostéoporose. (Nom de l’aliment) est une excellente source de calcium et de vitamine D. »
(6) « Une alimentation saine comprenant une quantité adéquate de calcium et de vitamine D et une activité physique régulière favorisent la formation d’os solides et peuvent réduire le risque d’ostéoporose. (Nom de l’aliment) est une source très élevée de calcium et de vitamine D. »
L’aliment :
a) autre qu’un légume ou un fruit, ne répond pas aux critères mentionnés à la colonne 2 de l’article 2 du Tableau des mentions et des allégations autorisées concernant la teneur nutritive en regard du sujet « peu d’énergie » visé à la colonne 1;
b) ne contient pas plus de phosphore, à l’exclusion de celui qui est fourni par le phytate, que de calcium;
c) contient au plus 0,5 % d’alcool;
d) dont l’étiquette ou l’annonce comporte les mentions ou allégations (1) ou (2) figurant à la colonne 1 du présent article, contient, selon le cas :
(i) 200 mg ou plus de calcium par quantité de référence et par portion indiquée,
(ii) 300 mg ou plus de calcium par portion indiquée, si l’aliment est un repas préemballé;
e) dont l’étiquette ou l’annonce comporte les mentions ou allégations (3), (4), (5) ou (6) figurant à la colonne 1 du présent article, contient, selon le cas :
(i) 275 mg ou plus de calcium par quantité de référence et par portion indiquée,
(ii) 400 mg ou plus de calcium par portion indiquée, si l’aliment est un repas préemballé;
f) dont l’étiquette ou l’annonce comporte les mentions ou allégations (5) ou (6) figurant à la colonne 1 du présent article, contient 1,25 µg ou plus de vitamine D, selon le cas :
(i) par quantité de référence et portion indiquée,
(ii) par portion indiquée, si l’aliment est un repas préemballé.
(1) Si la mention ou l’allégation figure sur l’étiquette d’un produit préemballé ou encore dans l’annonce d’un tel produit faite par le fabricant du produit ou sous ses ordres, la teneur en vitamine D et en phosphore est indiquée, selon le cas :
a) dans le tableau de la valeur nutritive conformément au paragraphe B.01.402(2);
b) dans le tableau des renseignements sur les aliments supplémentés conformément au paragraphe B.29.002(1), en ce qui a trait à la nomenclature visée à la colonne 2, à l’unité visée à la colonne 3 et aux règles d’écriture visées à la colonne 4 du tableau de l’article B.29.002, ou au paragraphe B.29.003(3), ou aux deux, selon le cas.
(2) Si la mention ou l’allégation est faite sur l’étiquette ou dans l’annonce d’un aliment qui n’est pas un produit préemballé ou dans l’annonce d’un produit préemballé faite par une personne autre que le fabricant du produit ou une personne agissant sous ses ordres, l’étiquette ou l’annonce indique la teneur en vitamine D, en calcium et en phosphore par portion indiquée et, le cas échéant, conformément à l’article B.01.602. Toutefois, cette exigence ne s’applique pas si la mention ou l’allégation est faite sur l’étiquette ou dans l’annonce d’un légume frais, d’un fruit frais ou d’un mélange quelconque de légumes frais ou de fruits frais sans ingrédient ajouté, d’une orange à laquelle un colorant alimentaire a été ajouté et d’un légume frais ou d’un fruit frais enrobé d’huile minérale, de paraffine, de vaseline ou de tout enduit protecteur.
3 (1) « Une alimentation saine pauvre en graisses saturées et en graisses trans peut réduire le risque de maladie du coeur. (Nom de l’aliment) ne contient pas de graisses saturées ni de graisses trans. »
(2) « Une alimentation saine pauvre en graisses saturées et en graisses trans peut réduire le risque de maladie du coeur. (Nom de l’aliment) est pauvre en graisses saturées et en graisses trans. »
L’aliment :
a) autre qu’un légume ou un fruit, ne répond pas aux critères mentionnés à la colonne 2 de l’article 2 du Tableau des mentions et des allégations autorisées concernant la teneur nutritive en regard du sujet « peu d’énergie » visé à la colonne 1;
b) contient au moins 10 % de l’apport nutritionnel recommandé pondéré d’une vitamine ou d’un minéral nutritif, selon le cas :
(i) par quantité de référence et portion indiquée,
(ii) par portion indiquée, si l’aliment est un repas préemballé;
c) contient au plus 100 mg de cholestérol par portion de 100 g de l’aliment;
d) contient au plus 0,5 % d’alcool;
e) s’il est une graisse ou une huile, répond à l’un ou l’autre des critères suivants :
(i) ceux mentionnés à la colonne 2 de l’article 25 du Tableau des mentions et des allégations autorisées concernant la teneur nutritive en regard du sujet « source d’acides gras polyinsaturés oméga-3 » visé à la colonne 1,
(ii) ceux mentionnés à la colonne 2 de l’article 26 du Tableau des mentions et des allégations autorisées concernant la teneur nutritive en regard du sujet « source d’acides gras polyinsaturés oméga-6 » visé à la colonne 1,
(iii) ceux prévus aux sous-alinéas (i) et (ii);
f) contient, selon le cas :
(i) au plus 480 mg de sodium par quantité de référence, par portion indiquée et, si la quantité de référence est d’au plus 30 g ou 30 mL, par 50 g,
(ii) au plus 960 mg de sodium par portion indiquée, si l’aliment est un repas préemballé;
g) dont l’étiquette ou l’annonce comporte la mention ou l’allégation (1) figurant à la colonne 1 du présent article, répond aux critères mentionnés à la colonne 2 de l’article 18 du Tableau des mentions et des allégations autorisées concernant la teneur nutritive en regard du sujet « sans acides gras saturés » visé à la colonne 1;
h) dont l’étiquette ou l’annonce comporte la mention ou l’allégation (2) figurant à la colonne 1 du présent article, répond aux critères mentionnés à la colonne 2 de l’article 19 du Tableau des mentions et des allégations autorisées concernant la teneur nutritive en regard du sujet « faible teneur en acides gras saturés » visé à la colonne 1.
Si la mention ou l’allégation est faite sur l’étiquette ou dans l’annonce d’un aliment qui n’est pas un produit préemballé ou dans l’annonce d’un produit préemballé faite par une personne autre que le fabricant du produit ou une personne agissant sous ses ordres, l’étiquette ou l’annonce indique la teneur en acides gras saturés et en acides gras trans par portion indiquée et, le cas échéant, conformément à l’article B.01.602. Toutefois, cette exigence ne s’applique pas si la mention ou l’allégation est faite sur l’étiquette ou dans l’annonce d’un légume frais, d’un fruit frais ou d’un mélange quelconque de légumes frais ou de fruits frais sans ingrédient ajouté, d’une orange à laquelle un colorant alimentaire a été ajouté et d’un légume frais ou d’un fruit frais enrobé d’huile minérale, de paraffine, de vaseline ou de tout enduit protecteur. 4 « Une alimentation saine comportant une grande variété de légumes et de fruits peut aider à réduire le risque de certains types de cancer. »
L’aliment :
a) est un des légumes, fruits ou jus ci-après et ne peut contenir que les additifs alimentaires visés à l’article 2 d’une autorisation de mise en marché, des agents édulcorants, du sel, des fines herbes, des épices, des assaisonnements et de l’eau :
(i) un légume frais, congelé, en conserve ou déshydraté,
(ii) un fruit frais, congelé, en conserve ou sec,
(iii) un jus de légume ou de fruit,
(iv) une combinaison des aliments mentionnés aux sous-alinéas (i) à (iii);
b) n’est pas :
(i) une pomme de terre, une igname, du manioc, une banane plantain, du maïs, un champignon, une légumineuse mature ou leur jus,
(ii) un légume ou un fruit utilisé comme condiment, garniture ou aromatisant, notamment une cerise au marasquin, un fruit glacé ou confit ou de l’oignon en flocons,
(iii) une confiture ou une tartinade de type confiture, une marmelade, une conserve de fruit ou une gelée,
(iv) une olive;
(v) un légume ou fruit en poudre;
c) contient au plus 0,5 % d’alcool.
4.1 « Une alimentation saine comportant une grande variété de légumes et de fruits peut aider à réduire le risque de maladie du coeur. »
L’aliment :
a) est l’un des légumes ou fruits ci-après et ne peut contenir que les additifs alimentaires visés à l’article 2 d’une autorisation de mise en marché, du sel, des fines herbes, des épices, des assaisonnements ou de l’eau :
(i) un légume frais, congelé, en conserve ou déshydraté,
(ii) un fruit frais, congelé, en conserve ou sec,
(iii) un jus de légumes ou une boisson aux légumes,
(iv) une combinaison quelconque des aliments mentionnés aux sous-alinéas (i) à (iii);
b) n’est pas ou ne contient pas l’un des aliments suivants :
(i) une pomme de terre, une igname, du manioc, une banane plantain, une légumineuse mature ou leur jus,
(ii) un légume ou un fruit utilisé comme condiment, garniture ou aromatisant, notamment une cerise au marasquin, un fruit glacé ou confit ou de l’oignon en flocons,
(iii) une confiture ou une tartinade de type confiture, une marmelade, une conserve de fruit ou une gelée,
(iv) une olive,
(v) un jus de fruits ou une boisson aux fruits,
(vi) un légume ou fruit en poudre,
(vii) une graine d’un fruit connu comme un drupe, notamment une amande, une noix de cajou et de la noix de coco;
c) contient au plus 0,5 % d’alcool;
d) contient moins de 15 % de la valeur quotidienne de sodium par quantité de référence, par portion indiquée et, si la quantité de référence est d’au plus 30 g ou 30 ml, par 50 g.
5 (1) « Ne cause pas la carie dentaire. »
(2) « Ne favorise pas la carie dentaire. »
(3) « Ne favorise pas les caries dentaires. »
(4) « Non cariogène. »
L’aliment est une gomme à mâcher, un bonbon dur ou un rafraîchisseur d’haleine qui répond à l’un ou l’autre des critères suivants :
a) il ne contient, au total, pas plus de 0,25 % d’amidon, de dextrines, de monosaccharides, de disaccharides, d’oligosaccharides ou d’autres glucides fermentescibles;
b) il contient plus de 0,25 % de glucides fermentescibles et il ne réduit pas le pH de la plaque à moins de 5,7 par fermentation bactérienne pendant 30 minutes après avoir été consommé, le pH étant mesuré selon le test « indwelling plaque pH » décrit dans « Identification of Low Caries Risk Dietary Components », Monographs in Oral Science, T.N. Imfeld, Volume 11, 1983.
Si la mention ou l’allégation figure sur l’étiquette d’un produit préemballé ou encore dans l’annonce d’un tel produit faite par le fabricant du produit ou sous ses ordres, la teneur en polyalcools, s’il y en a, est indiquée, selon le cas :
a) dans le tableau de la valeur nutritive conformément au paragraphe B.01.402(2);
b) dans le tableau des renseignements sur les aliments supplémentés conformément au paragraphe B.29.003(3).
- DORS/2003-11, art. 20
- err.(F), Vol. 137, no 5
- DORS/2010-142, art. 2
- DORS/2016-305, art. 47, 48 et 75(F)
- DORS/2022-168, art. 52
- DORS/2022-169, art. 18
TITRE 2Boissons alcooliques
B.02.001 L’expression boissons alcooliques vise notamment les aliments mentionnés dans le présent titre.
- DORS/93-145, art. 3(F)
B.02.002 Les définitions qui suivent s’appliquent au présent titre.
- âge
âge Période durant laquelle une boisson alcoolique est conservée dans les conditions d’emmagasinage nécessaires pour développer sa saveur et son bouquet caractéristiques. (age)
- agent édulcorant
agent édulcorant Le glucose-fructose, le sirop de fructose ou tout aliment qui fait l’objet d’une norme énoncée au titre 18, ou une combinaison de ces produits. (sweetening agent)
- alcool
alcool Alcool éthylique. (alcohol)
- alcool absolu
alcool absolu Alcool à 100 pour cent. (absolute alcohol)
- esprit de grain
esprit de grain Distillat alcoolique obtenu à partir d’un moût de céréales ou de produits de céréales saccharifié par la diastase du malt ou par d’autres enzymes et fermenté au moyen de levure ou d’un mélange de levure et d’autres micro-organismes, et dont les substances naturellement présentes, autres que l’alcool et l’eau, ont été complètement ou presque complètement éliminées. (grain spirit)
- esprit de malt
esprit de malt Distillat alcoolique obtenu, par distillation à l’alambic chauffé à feu nu, à partir d’un moût de céréales ou de produits de céréales saccharifié par la diastase du malt et fermenté au moyen de levure ou d’un mélange de levure et d’autres micro-organismes. (malt spirit)
- esprit de mélasse
esprit de mélasse Distillat alcoolique obtenu à partir de la canne à sucre ou de produits de la canne à sucre fermentés au moyen de levure ou d’un mélange de levure et d’autres micro-organismes, et dont les substances naturellement présentes, autres que l’alcool et l’eau, ont été complètement ou presque complètement éliminées. (molasses spirit)
- petit fût
petit fût Barrique ou baril de bois d’une capacité ne dépassant pas 700 L. (small wood)
- substance aromatique
substance aromatique À l’égard d’un spiritueux, tout autre spiritueux ou vin, domestique ou importé, qui est ajouté comme substance aromatique en vertu de la Loi sur l’accise. (flavouring)
- DORS/84-300, art. 10
- DORS/93-145, art. 4
B.02.003 Lorsqu’une boisson alcoolique a une teneur en alcool de 1,1 pour cent ou plus par volume, la teneur en alcool est indiquée dans l’espace principal en pourcentage, lequel :
a) est soit suivi de la mention « alcool en volume » ou de l’abréviation « alc./vol. » ou « alc/vol »;
b) est soit inséré entre les abréviations « alc. » ou « alc » et « vol. » ou « vol ».
- DORS/88-418, art. 1
- DORS/93-145, art. 5(F)
- DORS/2014-9, art. 1
B.02.004 (1) Il est interdit de vendre de l’alcool purifié aromatisé dans un contenant dont la capacité est d’au plus 1 000 mL, à moins que le contenant ne contienne 25,6 mL ou moins d’alcool.
(2) Le paragraphe (1) ne s’applique pas à l’égard de l’alcool purifié aromatisé vendu dans un contenant de verre dont la capacité est d’au moins 750 mL.
(3) Pour l’application du présent article, alcool purifié aromatisé s’entend d’une boisson alcoolique :
a) qui est obtenue à partir d’une base d’alcool qui a été purifiée en cours de fabrication par un processus autre que la distillation et dont la plupart des substances naturellement présentes, autres que l’alcool et l’eau, ont été éliminées;
b) à laquelle a été ajouté, en cours de fabrication, toute substance ou tout mélange de substances qui lui donne un arôme.
Whisky
B.02.010 [N]. Le whisky ou whiskey, à l’exclusion du whisky de malt, du whisky écossais, du whisky irlandais, du whisky canadien, du whisky Highland, du bourbon ou whisky bourbon et du whisky Tennessee :
a) doit être un distillat alcoolique potable ou un mélange de distillats alcooliques potables obtenu à partir d’un moût de céréales ou de produits de céréales saccharifié par la diastase du malt ou par d’autres enzymes et fermenté au moyen de levure ou d’un mélange de levure et d’autres micro-organismes;
b) peut contenir du caramel et des substances aromatiques.
- DORS/93-145, art. 6
- DORS/93-603, art. 2
B.02.011 et B.02.012 [Abrogés, DORS/93-145, art. 7]
B.02.013 [N]. Le whisky de malt:
a) doit être un distillat alcoolique potable ou un mélange de distillats alcooliques potables obtenu par la distillation d’un moût de grain malté qui a été fermenté au moyen de levure ou d’un mélange de levure et d’autres micro-organismes;
b) doit posséder l’arôme, le goût et les caractéristiques communément attribués au whisky de malt;
c) peut contenir du caramel et des substances aromatiques.
- DORS/93-145, art. 8
B.02.014 et B.02.015 [Abrogés, DORS/93-145, art. 9]
B.02.016 [N]. Le whisky écossais doit être du whisky qui a été distillé en Écosse comme whisky écossais pour la consommation domestique, conformément aux lois du Royaume-Uni.
B.02.017 Est interdit tout mélange ou toute modification de whisky écossais importé en vrac aux fins d’embouteillage et de vente au Canada comme whisky écossais, sauf
a) le mélange avec d’autre whisky écossais;
b) l’addition d’eau distillée ou autrement purifiée pour porter le whisky au degré alcoolique requis; ou
c) l’addition de caramel.
B.02.018 [N]. Le whisky irlandais doit être du whisky distillé en Irlande du Nord ou dans la République d’Irlande pour la consommation domestique, conformément aux lois de l’Irlande du Nord ou de la République d’Irlande.
B.02.019 Est interdit tout mélange ou toute modification de whisky irlandais importé en vrac aux fins d’embouteillage et de vente au Canada comme whisky irlandais, sauf
a) le mélange avec d’autre whisky irlandais;
b) l’addition d’eau distillée ou autrement purifiée pour porter le whisky au degré alcoolique requis; ou
c) l’addition de caramel.
B.02.020 [N]. (1) Le whisky canadien:
a) doit :
(i) être un distillat alcoolique potable ou un mélange de distillats alcooliques potables obtenu à partir d’un moût de céréales ou de produits de céréales saccharifié par la diastase du malt ou par d’autres enzymes et fermenté au moyen de levure ou d’un mélange de levure et d’autres micro-organismes,
(ii) être vieilli en petit fût durant au moins trois ans,
(iii) posséder l’arôme, le goût et les caractéristiques communément attribués au whisky canadien,
(iv) être fabriqué conformément aux exigences de la Loi sur l’accise et de ses règlements d’application,
(v) être trempé, distillé et vieilli au Canada,
(vi) contenir au moins 40 pour cent d’alcool en volume;
b) peut contenir du caramel et des substances aromatiques.
(2) Sous réserve du paragraphe (3), il est interdit de faire une allégation concernant l’âge du whisky canadien, sauf pour la période durant laquelle le whisky a été conservé en petit fût.
(3) Dans le cas du whisky canadien vieilli en petit fût durant au moins trois ans, toute période ne dépassant pas six mois durant laquelle le whisky canadien a été conservé dans d’autres récipients peut être comptée dans l’âge allégué du whisky.
- DORS/93-145, art. 10
- DORS/2000-51, art. 1
B.02.021 [N]. Le whisky Highland:
a) doit être une boisson alcoolique potable mélangée au Canada à partir :
(i) d’une part, d’au moins 25 pour cent de whisky de malt calculé en alcool absolu distillé au Canada ou en Écosse,
(ii) d’autre part, de whisky;
b) s’il contient au moins 51 pour cent de whisky de malt distillé en Écosse, peut être étiqueté et annoncé comme contenant de ce whisky.
- DORS/93-145, art. 10
B.02.022 (1) Sous réserve du paragraphe (2), il est interdit d’étiqueter, d’emballer, de vendre ou d’annoncer un aliment en tant que bourbon, ou d’une manière qui peut laisser croire qu’il s’agit de bourbon, à moins que cet aliment ne soit du whisky fabriqué aux États-Unis en tant que bourbon conformément aux lois de ce pays applicables au bourbon préparé pour consommation à l’intérieur du pays.
(2) Il est permis de modifier du bourbon importé pour être embouteillé et vendu au Canada en tant que bourbon, en y ajoutant de l’eau distillée ou autrement purifiée pour ramener le bourbon au degré alcoolique requis.
- DORS/89-59, art. 2
- DORS/93-145, art. 11(F)
B.02.022.1 (1) Sous réserve du paragraphe (2), il est interdit d’étiqueter, d’emballer ou de vendre un aliment — ou d’en faire la publicité — en tant que whisky Tennessee ou de manière qu’il puisse être confondu avec le whisky Tennessee, à moins que cet aliment ne soit du bourbon ou whisky bourbon pur produit dans l’État du Tennessee et fabriqué aux États-Unis en tant que whisky Tennessee conformément aux lois de ce pays applicables au whisky Tennessee préparé pour consommation à l’intérieur du pays.
(2) Il est permis de modifier du whisky Tennessee importé pour être embouteillé et vendu au Canada en tant que whisky Tennessee, en y ajoutant de l’eau distillée ou autrement purifiée pour ramener le whisky au degré alcoolique voulu.
- DORS/93-603, art. 3
B.02.023 (1) Sous réserve des articles B.02.022 et B.02.022.1, il est interdit de vendre pour consommation au Canada du whisky qui n’a pas été vieilli en petit fût durant au moins trois ans.
(2) Le paragraphe (1) ne s’applique pas aux substances aromatiques contenues dans le whisky; toutefois, il est interdit de vendre pour consommation au Canada du whisky contenant des substances aromatiques, autres que du vin, qui n’ont pas été vieillies en petit fût durant au moins deux ans.
- DORS/93-145, art. 12
- DORS/93-603, art. 4
Rhum
B.02.030 [N]. Le rhum:
a) doit être un distillat alcoolique potable ou un mélange de distillats alcooliques potables obtenu à partir de la canne à sucre ou des produits de la canne à sucre fermentés au moyen de levure ou d’un mélange de levure et d’autres micro-organismes;
b) peut contenir :
(i) du caramel,
(ii) des fruits et d’autres substances végétales,
(iii) des substances aromatiques et des préparations aromatisantes;
c) s’il est importé en vrac aux fins d’embouteillage et de vente au Canada comme du rhum importé, peut être seulement :
(i) modifié par adjonction d’eau distillée ou autrement purifiée pour ramener le rhum au degré alcoolique indiqué sur l’étiquette apposée sur le contenant,
(ii) modifié par adjonction de caramel,
(iii) mélangé avec un autre rhum importé ou, s’il s’agit d’un rhum vendu comme du rhum antillais, avec un autre rhum.
- DORS/93-145, art. 13
- DORS/2012-292, art. 1
B.02.031 (1) Il est interdit de vendre pour consommation au Canada du rhum qui n’a pas été vieilli en petit fût durant au moins un an.
(2) Le paragraphe (1) ne s’applique pas aux substances aromatiques contenues dans le rhum; toutefois, il est interdit de vendre pour consommation au Canada du rhum contenant des substances aromatiques, autres que du vin, qui n’ont pas été vieillies en petit fût durant au moins un an.
- DORS/84-657, art. 1
- DORS/93-145, art. 13
B.02.032 [Abrogé, DORS/93-145, art. 14]
B.02.033 [Abrogé, DORS/2012-292, art. 2]
B.02.034 [Abrogé, DORS/2012-292, art. 2]
Gin
B.02.040 [N]. Le genièvre Hollands, genièvre, gin type hollandais ou gros gin:
a) doit être une boisson alcoolique potable obtenue :
(i) soit par la redistillation de l’esprit de malt avec ou sur des baies de genièvre ou par le mélange des produits de plus d’une telle redistillation,
(ii) soit par la redistillation d’un mélange d’esprit de malt et d’au plus quatre fois le même volume d’esprit de grain en alcool absolu avec ou sur des baies de genièvre, ou par le mélange des produits de plus d’une telle redistillation,
(iii) soit par le mélange d’esprit de malt redistillé avec ou sur des baies de genièvre et d’au plus quatre fois le même volume d’esprit de grain ou d’esprit de mélasse en alcool absolu, ou par une combinaison de plus d’un tel mélange;
b) peut contenir :
(i) d’autres substances végétales aromatiques ajoutées pendant la redistillation,
(ii) du caramel;
c) ne peut contenir plus de deux pour cent d’agent édulcorant;
d) peut être étiqueté ou annoncé comme étant distillé lorsque l’un des sous-alinéas a)(i) ou (ii) est respecté;
e) doit être désigné comme genièvre mélangé sur l’espace principal de l’étiquette et dans la publicité lorsque le sous-alinéa a)(iii) est respecté.
- DORS/93-145, art. 15
B.02.041 [N]. Le gin, à l’exclusion du genièvre Hollands, genièvre, gin type hollandais ou gros gin :
a) doit être une boisson alcoolique potable obtenue :
(i) soit par la redistillation d’alcool dérivé de matières premières alimentaires avec ou sur des baies de genièvre, ou par le mélange des produits de plus d’une telle redistillation,
(ii) soit par le mélange d’alcool dérivé de matières premières alimentaires redistillé avec ou sur des baies de genièvre et d’alcool dérivé de matières premières alimentaires, ou par une combinaison de plus d’un tel mélange;
b) peut contenir :
(i) d’autres substances végétales aromatiques ajoutées pendant la redistillation,
(ii) un agent édulcorant,
(iii) des préparations aromatisantes pour assurer un profil aromatique uniforme;
c) peut être étiqueté et annoncé comme Dry Gin ou London Dry Gin lorsqu’aucun agent édulcorant n’y a été ajouté.
- DORS/93-145, art. 15
B.02.042 [Abrogé, DORS/93-145, art. 15]
B.02.043 Est interdite toute déclaration sur l’âge du genièvre, mais dans le cas du genièvre qui a été conservé dans des récipients appropriés, l’étiquette peut porter une déclaration à cet effet.
Eau-de-vie
B.02.050 [N]. L’eau-de-vie de vin (brandy), à l’exclusion de l’armagnac, du brandy canadien, du brandy de fruits, du brandy de fruits secs, du brandy de lies, du cognac, de la grappa et du marc :
a) doit être un distillat alcoolique potable ou un mélange de distillats alcooliques potables obtenu par la distillation du vin;
b) peut contenir :
(i) du caramel,
(ii) des fruits et d’autres substances végétales,
(iii) des substances aromatiques et des préparations aromatisantes.
- DORS/84-300, art. 12
- DORS/93-145, art. 16
B.02.051 [N]. L’armagnac doit être de l’eau-de-vie de vin (brandy) fabriquée dans la région d’Armagnac, en France, conformément aux lois de la République française pour la consommation en France.
- DORS/93-145, art. 16
B.02.052 [N]. Le brandy canadien :
a) doit être un distillat alcoolique potable ou un mélange de distillats alcooliques potables obtenu par la distillation de vin qui a été fermenté au Canada;
b) peut contenir :
(i) du caramel,
(ii) des fruits et d’autres substances végétales,
(iii) des substances aromatiques et des préparations aromatisantes.
- DORS/93-145, art. 16
B.02.053 [N]. Le cognac doit être de l’eau-de-vie de vin (brandy) fabriquée dans la région de Cognac, en France, conformément aux lois de la République française pour la consommation en France.
- DORS/93-145, art. 16
B.02.054 [N]. Le brandy de fruits secs :
a) doit être un distillat alcoolique potable ou un mélange de distillats alcooliques potables obtenu à partir de fruits secs et sains;
b) peut contenir :
(i) du caramel,
(ii) des fruits et d’autres substances végétales,
(iii) des substances aromatiques et des préparations aromatisantes.
- DORS/93-145, art. 16
B.02.055 [N]. Le brandy de fruits :
a) doit être un distillat alcoolique potable ou un mélange de distillats alcooliques potables obtenu par la distillation :
(i) soit du vin de fruit ou d’un mélange de vins de fruit,
(ii) soit d’un moût fermenté, ou d’un mélange, de fruits mûrs et sains autres que des raisins;
b) peut contenir :
(i) du caramel,
(ii) des fruits et d’autres substances végétales,
(iii) des substances aromatiques et des préparations aromatisantes;
c) peut être désigné sur l’étiquette comme « brandy de (désignation du fruit) » lorsque la totalité des fruits ou du vin de fruit qui ont servi à la fabrication du brandy proviennent du fruit désigné.
- DORS/93-145, art. 16
B.02.056 [N]. La grappa :
a) doit être un distillat alcoolique potable ou un mélange de distillats alcooliques potables obtenu par la distillation du marc provenant de raisins mûrs et sains après extraction du jus ou du vin;
b) peut contenir :
(i) du caramel,
(ii) des fruits et d’autres substances végétales,
(iii) des substances aromatiques et des préparations aromatisantes.
- DORS/93-145, art. 16
B.02.057 [N]. Le brandy de lies :
a) doit être un distillat alcoolique potable ou un mélange de distillats alcooliques potables obtenu par la distillation des lies de vin ou du vin de fruit;
b) peut contenir :
(i) du caramel,
(ii) des fruits et d’autres substances végétales,
(iii) des substances aromatiques et des préparations aromatisantes;
c) peut être désigné sur l’étiquette comme « brandy de lies de (désignation du fruit) » lorsque la totalité des lies qui ont servi à la fabrication du brandy proviennent du fruit désigné.
- DORS/93-145, art. 16
B.02.058 [N]. Le marc :
a) doit être un distillat alcoolique potable ou un mélange de distillats alcooliques potables obtenu par la distillation de la peau et de la pulpe de fruits mûrs et sains après extraction du jus de fruit, du vin ou du vin de fruit;
b) peut contenir :
(i) du caramel,
(ii) des fruits et d’autres substances végétales,
(iii) des substances aromatiques et des préparations aromatisantes;
c) peut être désigné sur l’étiquette comme « marc de (désignation du fruit) » lorsque la totalité de la peau et de la pulpe qui ont servi à la fabrication du brandy proviennent du fruit désigné.
- DORS/93-145, art. 16
B.02.059 Il est interdit de mélanger ou de modifier toute eau-de-vie de vin (brandy) importée en vrac pour être embouteillée et vendue au Canada comme eau-de-vie de vin (brandy) importée, autrement que :
a) par mélange avec d’autres eaux-de-vie de vin (brandy) importées;
b) par addition de caramel;
c) par addition d’eau distillée ou autrement purifiée en vue de porter l’eau-de-vie de vin (brandy) au degré alcoolique requis.
- DORS/93-145, art. 16
B.02.060 Lorsqu’une eau-de-vie de vin (brandy) est entièrement distillée dans un pays autre que le Canada, le pays d’origine doit être inscrit sur l’étiquette.
- DORS/84-300, art. 13(F)
- DORS/93-145, art. 16
B.02.061 (1) Il est interdit de vendre de l’eau-de-vie de vin (brandy) qui n’a pas été vieillie dans des récipients de bois durant au moins un an ou vieillie en petit fût durant au moins six mois.
(2) Le paragraphe (1) ne s’applique pas aux substances aromatiques contenues dans l’eau-de-vie de vin (brandy); toutefois, il est interdit de vendre de l’eau-de-vie de vin (brandy) contenant des substances aromatiques, autres que du vin, qui n’ont pas été vieillies dans des récipients de bois durant au moins un an ou vieillies en petit fût durant au moins six mois.
(3) Les paragraphes (1) et (2) ne s’appliquent pas à l’eau-de-vie de vin (brandy) qui satisfait aux normes applicables prévues aux articles B.02.051 à B.02.058.
(4) Il est interdit de faire toute allégation concernant l’âge de l’eau-de-vie de vin (brandy), sauf pour la période durant laquelle celle-ci a été conservée dans des récipients de bois ou conservée en petit fût.
- DORS/93-145, art. 16
Liqueurs et cordiaux spiritueux
B.02.070 [N]. La liqueur ou le cordial spiritueux:
a) doit être un produit obtenu par le mélange ou la distillation d’alcool dérivé de matières premières alimentaires avec ou sur des fruits, des fleurs, des feuilles ou d’autres substances végétales ou leurs jus, ou avec des extraits obtenus par infusion, percolation ou macération de ces substances végétales;
b) doit être additionné, au cours de la fabrication, d’un agent édulcorant en quantité d’au moins 2,5 pour cent du produit fini;
c) doit contenir au moins 23 pour cent d’alcool absolu en volume;
d) peut contenir :
(i) des préparations aromatisantes naturelles et artificielles,
(ii) des colorants.
- DORS/93-145, art. 16
Vodka
B.02.080 [N]. (1) La vodka doit être un distillat alcoolique potable obtenu à partir de pommes de terre, de grains de céréales ou de toute autre matière d’origine agricole fermentés au moyen de levure ou d’un mélange de levure et d’autres micro-organismes.
(2) Le distillat doit être traité avec du charbon de bois ou d’autres moyens, de manière à ce que la vodka soit exempte de caractère, d’arôme ou de goût distinctifs.
(3) La vodka produite, en tout ou en partie, à partir de matière d’origine agricole autre que des pommes de terre ou des grains de céréales doit porter, à proximité du nom usuel, la mention « produite à partir de » suivie du nom de toute matière d’origine agricole utilisée.
- DORS/93-145, art. 16
- DORS/2019-217, art. 1
Tequila
B.02.090 (1) Sous réserve du paragraphe (2), il est interdit d’étiqueter, d’emballer ou de vendre un aliment — ou d’en faire la publicité — en tant que Tequila ou de manière qu’il puisse être confondu avec la tequila, à moins que cet aliment ne soit de la tequila fabriquée au Mexique en tant que tequila conformément aux lois de ce pays applicables à la tequila préparée pour consommation à l’intérieur du pays.
(2) Il est permis de modifier de la tequila importée pour être embouteillée et vendue au Canada en tant que tequila, en y ajoutant de l’eau distillée ou autrement purifiée pour ramener la tequila au degré alcoolique voulu.
- DORS/93-603, art. 5
Mezcal
B.02.091 (1) Sous réserve du paragraphe (2), il est interdit d’étiqueter, d’emballer ou de vendre un aliment — ou d’en faire la publicité — en tant que Mezcal ou de manière qu’il puisse être confondu avec le mezcal, à moins que cet aliment ne soit du mezcal fabriqué au Mexique en tant que mezcal conformément aux lois de ce pays applicables au mezcal préparé pour consommation à l’intérieur du pays.
(2) Il est permis de modifier du mezcal importé pour être embouteillé et vendu au Canada en tant que mezcal, en y ajoutant de l’eau distillée ou autrement purifiée pour ramener le mezcal au degré alcoolique voulu.
- DORS/93-603, art. 6
Vin
B.02.100 [N]. Le vin
a) doit être une boisson alcoolique produite par la fermentation alcoolique complète ou partielle de raisins frais, de moût de raisin, de produits dérivés uniquement de raisins frais ou d’un mélange de plusieurs de ces ingrédients;
b) peut être additionné, en cours de fabrication,
(i) de levure,
(ii) de jus de raisin concentré,
(iii) de dextrose, de fructose, de glucose, de solides du glucose, de sucre, de sucre inverti ou d’une solution aqueuse de l’une ou l’autre de ces substances,
(iv) de nourriture pour les levures, en conformité avec le tableau XIV de l’article B.16.100,
(v) de sulfate de calcium en quantité telle que la teneur en sulfates solubles de vin fini ne dépasse pas 0,2 pour cent en poids par volume, calculée en sulfate de potassium,
(vi) de carbonate de calcium en quantité telle que la teneur en acide tartrique du vin fini ne soit pas inférieure à 0,15 pour cent en poids par volume,
(vii) d’anhydride sulfureux, y compris ses sels, en quantité telle que sa teneur dans le vin fini ne dépasse pas
(A) 70 parties par million à l’état libre, ou
(B) 350 parties par million à l’état combiné, calculé en anhydride sulfureux,
(viii) de l’une ou plusieurs des substances suivantes :
(A) acide citrique, acide fumarique, acide lactique, acide malique, acide tartrique, bicarbonate de potassium, carbonate de potassium et citrate de potassium, selon les limites de tolérance conformes aux bonnes pratiques industrielles,
(B) acide métatartrique, selon une limite de tolérance de 0,01 pour cent,
(C) tartrate acide de potassium, selon une limite de tolérance de 0,42 pour cent,
(ix) d’amylase et de pectinase, selon les limites de tolérance conformes aux bonnes pratiques industrielles,
(x) d’acide ascorbique ou de ses sels ou d’acide érythorbique ou de ses sels, selon les limites de tolérance conformes aux bonnes pratiques industrielles,
(xi) d’agent antimousse, en conformité avec le tableau VIII de l’article B.16.100,
(xii) de l’un ou plusieurs des agents de collage suivants :
(A) albumine, argile, bioxyde de silicium, blanc d’œuf, caséine, charbon activé, colle de poisson, polyvinylpolypyrrolidone et terre de diatomées,
(B) agar-agar, ferrocyanure de potassium, gélatine et gomme arabique, selon les limites de tolérance conformes aux bonnes pratiques industrielles,
(C) acide tannique, selon une limite de tolérance de 200 parties par million,
(D) polyvinylpyrrolidone, en une quantité ne dépassant pas 2 parties par million dans le produit fini,
(xiii) de caramel, selon une limite de tolérance conforme aux bonnes pratiques industrielles,
(xiv) d’eau-de-vie de vin (brandy), d’eau-de-vie de fruits, ou d’alcool obtenu par fermentation alcoolique de substances alimentaires puis par distillation jusqu’à production d’alcool titrant au moins 94 pour cent en volume,
(xv) de l’une ou plusieurs des substances suivantes :
(A) anhydride carbonique et ozone, selon les limites de tolérance conformes aux bonnes pratiques industrielles,
(B) oxygène,
(xvi) d’acide sorbique ou de ses sels, n’excédant pas 500 parties par million, calculé en acide sorbique,
(xvii) de bactéries malolactiques des genres Lactobacillus, Leuconostoc et Pediococcus,
(xviii) de sulfate de cuivre en quantité telle que la teneur en cuivre du produit fini ne dépasse pas 0,0001 pour cent,
(xix) d’azote,
(xx) de rognures et de particules de chêne;
c) peut, avant la dernière filtration, être traité avec
(i) une résine fortement acide échangeuse de cations sous forme d’ions sodium, ou
(ii) une résine faiblement basique échangeuse d’anions sous forme d’ions hydroxyl.
- DORS/78-402, art. 1
- DORS/81-565, art. 1
- DORS/84-300, art. 14(F) et 15(A)
- DORS/2006-91, art. 1
- DORS/2008-142, art. 1(F)
- DORS/2010-143, art. 39(A)
- DORS/2016-74, art. 5(A)
B.02.101 Est interdite la vente de vin qui contient plus de 0,24 pour cent en poids par volume d’acidité volatile, calculée en acide acétique selon la méthode officielle FO-2, Détermination d’acidité volatile dans le vin, le cidre et le cidre champagne, 15 octobre 1981.
- DORS/82-768, art. 2
- DORS/2006-91, art. 2
B.02.102 [N]. L’eau-de-vie de fruits doit être un distillat alcoolique obtenu du vin, du vin de fruits, de la pulpe de raisins ou de la pulpe de fruits.
B.02.103 [N]. Le vin de fruits, ou vin de (désignation du fruit) doit être un produit de la fermentation alcoolique du jus de fruits mûrs et sains autres que le raisin, et doit être conforme, en tous points, aux exigences de la norme du vin prescrite à l’article B.02.100.
B.02.104 [N]. Le vermouth doit être du vin auquel ont été ajoutés des amers, des aromates ou autres substances végétales ou une préparation aromatisante et ne peut contenir plus de 20 pour cent d’alcool absolu en volume.
- DORS/93-145, art. 17(F)
B.02.105 [N]. Le vin aromatisé, le cocktail au vin ou le vin apéritif est du vin additionné d’herbes, d’épices, d’autres substances végétales, de jus de fruits ou de préparations aromatisantes, et renferme au plus 20 pour cent d’alcool absolu en volume.
B.02.105A [N]. Le vin aromatisé (désignation de fruit), le cocktail au vin (désignation du fruit) ou le vin apéritif (désignation du fruit) est du vin de fruits, un mélange de vins de fruits ou un mélange de vins de fruits et de vin additionné d’herbes, d’épices, d’autres substances végétales, de jus de fruits ou de préparations aromatisantes, et renferme au plus 20 pour cent d’alcool absolu en volume.
B.02.106 [N]. Le vin de miel:
a) est le produit de la fermentation alcoolique d’une solution aqueuse du miel;
b) peut, au cours de sa fabrication, être additionné d’une ou de plusieurs des substances suivantes :
(i) levure,
(ii) nourriture pour les levures,
(iii) anhydride sulfureux, y compris ses sels, en quantité telle que la teneur dans le vin fini ne dépasse pas
(A) 70 parties par million à l’état libre, ou
(B) 350 parties par million à l’état combiné, calculé en anhydride sulfureux,
(iv) acide tartrique ou citrique,
(v) tartrate acide de potassium,
(vi) arômes naturels, d’origine botanique,
(vii) eau-de-vie de fruits, ou alcool obtenu par fermentation alcoolique de substances alimentaires puis par distillation jusqu’à production d’alcool titrant au moins 94 pour cent en volume,
(viii) caramel,
(ix) gaz carbonique,
(x) n’importe lequel des agents de collage suivants : charbon activé, argile ou acide tannique;
(xi) acide sorbique, ainsi que ses sels — calculés en acide sorbique —, en quantité telle que la teneur dans le vin fini ne dépasse pas 500 parties par million.
- DORS/96-241, art. 1
- DORS/2010-94, art. 9(A)
B.02.107 [N]. Le vin de mai doit être du vin auquel a été ajoutée une préparation aromatisante artificielle d’aspérule odorante.
B.02.108 Le pays d’origine doit être clairement indiqué sur l’espace principal de l’étiquette d’un vin.
- DORS/84-300, art. 16(A)
Cidre
B.02.120 [N]. Le cidre
a) doit
(i) être le produit de la fermentation alcoolique du jus de pomme, et
(ii) renfermer au moins 2,5 pour cent et au plus 13,0 pour cent d’alcool absolu en volume; et
b) peut, en cours de fabrication, être additionné
(i) de levure,
(ii) de jus de pomme concentré,
(iii) de sucre, de dextrose, de sucre inverti, de glucose, de solides de glucose ou de solutions aqueuses de n’importe lequel de ces sucres,
(iv) de nourriture pour les levures,
(v) d’acide sulfureux, y compris ses sels, en quantité telle que leur concentration dans le cidre fini ne dépasse pas
(A) 70 parties par million à l’état libre, ou
(B) 350 parties par million à l’état combiné, calculée en anhydride sulfureux,
(vi) d’acide tartrique et de tartrate de potassium,
(vii) d’acide citrique,
(viii) d’acide lactique,
(ix) de pectinase et amylase,
(x) d’acide ascorbique ou érythorbique ou leurs sels,
(xi) de n’importe lequel des agents de clarification suivants :
(A) le charbon activé,
(B) l’argile,
(C) la terre d’infusoires,
(D) la gélatine,
(E) l’albumine,
(F) le chlorure de sodium,
(G) le gel de silice,
(H) la caséine,
(I) l’acide tannique en concentration ne dépassant pas 200 parties par million, ou
(J) la polyvinylpyrrolidone en concentration ne dépassant pas deux parties par million dans le produit fini,
(xii) de caramel,
(xiii) d’eau-de-vie de vin (brandy), d’eau-de-vie de fruits ou d’alcool obtenu par fermentation alcoolique de substances alimentaires puis par distillation jusqu’à production d’alcool tirant au moins 94 pour cent en volume,
(xiv) d’anhydride carbonique,
(xv) d’oxygène,
(xvi) d’ozone, ou
(xvii) d’acide sorbique ou de ses sels, en quantité d’au plus 500 parties par million, calculé en acide sorbique.
- DORS/81-565, art. 2
- DORS/84-300, art. 17(A)
B.02.122 [N]. Le cidre champagne doit être du cidre imprégné de gaz carbonique sous pression, en effectuant
a) le dernier stade de la fermentation en vase clos, ou
b) une fermentation secondaire en vase clos avec ou sans l’addition de sucre, de dextrose, de sucre inverti, de glucose, de solides de glucose ou de solutions aqueuses de n’importe lequel de ces sucres,
et il doit contenir au moins sept pour cent d’alcool absolu en volume.
- DORS/84-300, art. 18
B.02.123 Est interdite la vente de cidre ou de cidre champagne qui possède une acidité volatile de plus de 0,2 pour cent en poids par volume, calculée en acide acétique selon la méthode officielle FO-2, Détermination d’acidité volatile dans le vin, le cidre et le cidre champagne, 15 octobre 1981.
- DORS/82-768, art. 3
Bière
B.02.130 [N]. (1) La bière
a) doit être le produit de la fermentation alcoolique, au moyen de levure ou d’un mélange de levures et d’autres micro-organismes, d’une infusion de malt d’orge ou de malt de blé et de houblon ou d’extrait de houblon dans de l’eau potable;
b) doit contenir au plus quatre pour cent de sucre résiduel;
c) peut, au cours de sa fabrication, être additionnée d’un ou de plusieurs des ingrédients suivants :
(i) grains de céréales,
(ii) miel, sirop d’érable, fruit, jus de fruit ou toute autre source de glucides,
(iii) herbes et épices,
(iv) sel,
(v) préparations aromatisantes,
(vi) extrait de houblon pré-isomérisé,
(vii) extrait de houblon isomérisé réduit,
(viii) additifs alimentaires visés par une autorisation de mise en marché et figurant aux Listes des additifs alimentaires autorisés publiées sur le site Web de Santé Canada.
(2) Le nom de toute préparation aromatisante ajoutée à une bière fait partie du nom usuel de cette dernière.
- DORS/88-418, art. 2
- DORS/92-92, art. 1
- DORS/96-483, art. 1
- DORS/2006-91, art. 3
- DORS/2019-98, art. 3
B.02.131 [Abrogé, DORS/2019-98, art. 4]
B.02.132 Les noms à employer pour désigner la bière dans la publicité qui s’y rapporte ou sur l’étiquette sont les noms usuels, avec ou sans qualificatif, selon le cas, indiqués à la colonne II du tableau du présent article, suivant la teneur en alcool par volume mentionnée à la colonne I.
TABLEAU
| Colonne I | Colonne II | |
|---|---|---|
| Article | Teneur en alcool par volume | Nom usuel |
| 1 | de 1,1 à 2,5 | bière extra-légère |
| 2 | de 2,6 à 4,0 | bière légère |
| 3 | de 4,1 à 5,5 | bière |
| 4 | de 5,6 à 8,5 | bière forte |
| 5 | 8,6 et plus | bière extra-forte |
- DORS/88-418, art. 2
- DORS/2019-98, art. 5
B.02.133 [N]. Dans le présent titre, extrait de houblon désigne un extrait de cones de houblon obtenu par extraction
a) à l’hexane, au méthanol ou au chlorure de méthylène de telle façon que l’extrait de houblon contienne au plus 2,2 pour cent du solvant employé; ou
b) au dioxyde de carbone ou à l’alcool éthylique, en quantité conforme aux bonnes pratiques industrielles.
- DORS/86-89, art. 1
- DORS/88-418, art. 3
B.02.134 [N]. (1) Dans le présent titre, extrait de houblon pré-isomérisé désigne un extrait de houblon obtenu :
a) par utilisation d’un des dissolvants suivants :
(i) l’hexane,
(ii) le dioxyde de carbone,
(iii) l’éthanol;
b) par isolation subséquente des acides alpha et leur conversion en acides alpha isomérisés par utilisation d’un alcali dilué et application de chaleur.
(2) Aux fins de l’alinéa (1)b), la quantité de résidus d’hexane dans l’extrait de houblon pré-isomérisé ne doit pas dépasser 1,5 partie par million pour chaque un pour cent d’acide iso-alpha contenu dans l’extrait.
- DORS/88-418, art. 4
B.02.135 [N]. Dans le présent titre, extrait de houblon isomérisé réduit s’entend :
a) des tétrahydroisohumulones obtenues du houblon :
(i) soit par isomérisation et réduction des humulones (acides alpha) au moyen d’hydrogène et d’un catalyseur,
(ii) soit par réduction des lupulones (acides bêta) au moyen d’hydrogène et d’un catalyseur, suivie d’une oxydation et d’une isomérisation;
b) des hexahydroisohumulones obtenues du houblon par réduction des tétrahydroisohumulones au moyen du borohydrure de sodium;
c) des dihydroisohumulones obtenues du houblon par réduction des acides isoalpha au moyen du borohydrure de sodium.
- DORS/96-483, art. 2
- DORS/2000-352, art. 1
TITRE 3Poudre à pâte
B.03.001 Au présent Titre, substance à réaction acide désigne l’une ou n’importe quelle association des substances suivantes :
a) l’acide lactique ou ses sels;
b) l’acide tartrique ou ses sels;
c) les sels acides de l’acide phosphorique; et
d) les composés acides de l’aluminium.
B.03.002 [N]. La levure artificielle ou poudre à pâte est une combinaison de bicarbonate de sodium ou de potassium, d’une substance à réaction acide, d’amidon ou autre substance neutre; elle peut contenir un agent anti-agglomérant et doit dégager une quantité de gaz carbonique représentant au moins 10 pour cent de son poids, déterminée selon la méthode officielle FO-3, Détermination de gaz carbonique dégagé par la poudre à pâte, 15 octobre 1981.
- DORS/82-768, art. 4
- DORS/92-626, art. 12
TITRE 4Produits du cacao et produits de chocolat
B.04.001 Les définitions qui suivent s’appliquent au présent titre.
- ingrédient édulcorant
ingrédient édulcorant Un agent édulcorant ou une combinaison d’agents édulcorants, à l’exception du sucre à glacer. (sweetening ingredient)
- ingrédient laitier
ingrédient laitier Un des produits suivants ou toute combinaison de ceux-ci :
a) les produits suivants faisant l’objet d’une norme établie dans la présente partie :
(i) lait ou lait entier,
(ii) lait écrémé,
(iii) lait partiellement écrémé ou en partie écrémé,
(iv) lait stérilisé,
(v) lait condensé ou lait condensé sucré,
(vi) lait évaporé,
(vii) lait écrémé évaporé ou écrémé concentré,
(viii) lait évaporé partiellement écrémé ou lait concentré partiellement écrémé,
(ix) poudre de lait, poudre de lait entier, lait entier desséché ou lait entier en poudre,
(x) lait écrémé en poudre, poudre de lait écrémé ou lait écrémé desséché,
(xi) lait écrémé additionné de solides du lait,
(xii) lait partiellement écrémé additionné de solides du lait ou lait en partie écrémé additionné de solides du lait,
(xiii) lait malté, lait malté en poudre ou poudre de lait malté,
(xiv) beurre,
(xv) crème;
b) les produits suivants ne faisant pas l’objet d’une norme établie dans la présente partie :
(i) lait ou lait entier reconstitué,
(ii) lait écrémé reconstitué,
(iii) lait partiellement écrémé reconstitué,
(iv) lait partiellement écrémé en poudre,
(v) babeurre,
(vi) huile de beurre,
(vii) crème reconstituée. (milk ingredient)
- produit de chocolat
produit de chocolat Produit dérivé d’un ou de plusieurs produits du cacao, y compris le chocolat, le chocolat mi-amer, le chocolat mi-sucré, le chocolat noir, le chocolat sucré, le chocolat au lait et le chocolat blanc. (chocolate product)
- produit du cacao
produit du cacao Produit dérivé des fèves de cacao, y compris les fèves de cacao décortiquées, la liqueur de cacao, la pâte de cacao, le chocolat non sucré, le chocolat amer, la liqueur de chocolat, le cacao, le cacao faible en gras, la poudre de cacao et la poudre de cacao faible en gras. (cocoa product)
- DORS/97-263, art. 2
B.04.002 [N]. Les fèves de cacao sont les graines de Theobroma cacao L. ou d’une espèce très proche.
- DORS/97-263, art. 2
B.04.003 [N]. Les fèves de cacao décortiquées sont le produit préparé par décorticage des fèves de cacao nettoyées. Leur teneur en écale résiduelle ne peut excéder 1,75 pour cent en masse — exempte d’alcali lorsque celui-ci a été utilisé pour le traitement des fèves décortiquées ou des fèves de cacao dont elles proviennent —, déterminée conformément à la méthode prévue dans la publication de l’Association of Official Analytical Chemists, de Washington, intitulée Official Methods of Analysis of the Association of Official Analytical Chemists, 12e éd. (1975), aux articles 13.010 à 13.014 sous la rubrique « Shell in Cacao Nibs — Official Final Action ».
- DORS/97-263, art. 2
B.04.004 [N]. La liqueur de cacao, la pâte de cacao, le chocolat non sucré, le chocolat amer ou la liqueur de chocolat :
a) est le produit obtenu par la désagrégation mécanique de la fève de cacao décortiquée, avec ou sans extraction ou addition de l’un de ses constituants;
b) contient au moins 50 pour cent de beurre de cacao.
- DORS/97-263, art. 2
B.04.005 (1) Les produits du cacao peuvent être traités au moyen de l’un ou plusieurs des rajusteurs du pH ou agents alcalinisants suivants :
a) hydroxydes d’ammonium, carbonates d’ammonium, bicarbonates d’ammonium, hydroxydes de sodium, carbonates de sodium, bicarbonates de sodium, hydroxydes de potassium, carbonates de potassium et bicarbonates de potassium;
b) carbonates de magnésium ou hydroxydes de magnésium;
c) carbonates de calcium.
(2) La quantité de tout rajusteur du pH mentionné aux alinéas (1)a) à c) ne peut dépasser les limites de tolérance prévues à la colonne III du tableau X de l’article B.16.100.
(3) La valeur neutralisante de l’ensemble des rajusteurs du pH visés aux alinéas (1)a) à c), calculée d’après la masse respective de chacun, ne peut dépasser la valeur neutralisante de cinq parties, en masse, de carbonate anhydre de potassium par 100 parties, en masse, de produit du cacao, sans matières grasses.
(4) Les produits du cacao peuvent être traités au moyen de l’un ou plusieurs des rajusteurs du pH ou agents neutralisants suivants, ajoutés tels quels ou en solution aqueuse :
a) acide phosphorique;
b) acide citrique;
c) acide tartrique.
(5) La valeur neutralisante de l’ensemble des rajusteurs du pH visés au paragraphe (4), calculée d’après la masse respective de chacun, ne peut dépasser les limites de tolérance applicables prévues à la colonne III du tableau X de l’article B.16.100.
(6) Pour l’application du paragraphe (5) :
a) la quantité totale d’acide phosphorique, en masse, ne peut dépasser 0,5 partie, exprimée en P2O5, par 100 parties, en masse, du produit du cacao, calculée sans matières grasses;
b) la quantité totale, en masse, d’acide citrique et d’acide tartrique, seuls ou en association, ne peut dépasser 1,0 partie par 100 parties, en masse, du produit du cacao, calculée sans matières grasses.
- DORS/97-263, art. 2
- DORS/2012-43, art. 1
B.04.006 [N]. Le chocolat, le chocolat mi-amer, le chocolat mi-sucré ou le chocolat noir :
a) est constitué d’un ou de plusieurs des éléments suivants, en combinaison avec un ingrédient édulcorant :
(i) liqueur de cacao,
(ii) liqueur de cacao et beurre de cacao,
(iii) beurre de cacao et poudre de cacao;
b) contient au moins 35 pour cent de solides du cacao totaux dont :
(i) au moins 18 pour cent sont du beurre de cacao,
(ii) au moins 14 pour cent sont des solides du cacao dégraissés;
c) peut contenir :
(i) moins de 5 pour cent de solides du lait totaux provenant d’ingrédients laitiers,
(ii) des épices,
(iii) des préparations aromatisantes pour équilibrer la saveur, sauf celles qui imitent la saveur du chocolat ou du lait,
(iv) du sel,
(v) les agents émulsifiants suivants, en quantité n’excédant pas, pour chacun de ces agents, les limites de tolérance prévues à la colonne III du tableau IV de l’article B.16.100 et, pour toute combinaison de ces agents, 1,5 pour cent en masse du produit de chocolat :
(A) monoglycérides et mono- et diglycérides,
(B) lécithine et lécithine hydroxylée,
(C) sels d’ammonium de glycérides phosphorylés,
(D) esters polyglycériques d’acides gras d’huile de ricin transestérifiée,
(E) monostéarate de sorbitan.
- DORS/79-664, art. 2
- DORS/97-263, art. 2
B.04.007 [N]. Le chocolat sucré :
a) est constitué d’un ou de plusieurs des éléments suivants, en combinaison avec un ingrédient édulcorant :
(i) liqueur de cacao,
(ii) liqueur de cacao et beurre de cacao,
(iii) beurre de cacao et poudre de cacao;
b) contient au moins 30 pour cent de solides du cacao totaux dont :
(i) 18 pour cent sont du beurre de cacao,
(ii) 12 pour cent sont des solides du cacao dégraissés;
c) peut contenir :
(i) moins de 12 pour cent de solides du lait totaux provenant d’ingrédients laitiers,
(ii) des épices,
(iii) des préparations aromatisantes pour équilibrer la saveur, sauf celles qui imitent la saveur du chocolat ou du lait,
(iv) du sel,
(v) les agents émulsifiants suivants, en quantité n’excédant pas, pour chacun de ces agents, les limites de tolérance prévues à la colonne III du tableau IV de l’article B.16.100 et, pour toute combinaison de ces agents, 1,5 pour cent en masse du produit de chocolat :
(A) monoglycérides et mono- et diglycérides,
(B) lécithine et lécithine hydroxylée,
(C) sels d’ammonium de glycérides phosphorylés,
(D) esters polyglycériques d’acides gras d’huile de ricin transestérifiée,
(E) monostéarate de sorbitan.
- DORS/97-263, art. 2
B.04.008 [N]. Le chocolat au lait :
a) est constitué d’un ou de plusieurs des éléments suivants, en combinaison avec un ingrédient édulcorant :
(i) liqueur de cacao,
(ii) liqueur de cacao et beurre de cacao,
(iii) beurre de cacao et poudre de cacao;
b) contient au moins :
(i) 25 pour cent de solides du cacao totaux dont :
(A) au moins 15 pour cent sont du beurre de cacao,
(B) au moins 2,5 pour cent sont des solides du cacao dégraissés,
(ii) 12 pour cent de solides du lait totaux provenant d’ingrédients laitiers,
(iii) 3,39 pour cent de matières grasses du lait;
c) peut contenir :
(i) moins de 5 pour cent de petit-lait ou de produits du petit-lait,
(ii) des épices,
(iii) des préparations aromatisantes pour équilibrer la saveur, sauf celles qui imitent la saveur du chocolat ou du lait,
(iv) du sel,
(v) les agents émulsifiants suivants, en quantité n’excédant pas, pour chacun de ces agents, les limites de tolérance prévues à la colonne III du tableau IV de l’article B.16.100 et, pour toute combinaison de ces agents, 1,5 pour cent en masse du produit de chocolat :
(A) monoglycérides et mono- et diglycérides,
(B) lécithine et lécithine hydroxylée,
(C) sels d’ammonium de glycérides phosphorylés,
(D) esters polyglycériques d’acides gras d’huile de ricin transestérifiée,
(E) monostéarate de sorbitan.
- DORS/97-263, art. 2
B.04.009 [N]. Le chocolat blanc :
a) est constitué des éléments suivants :
(i) au moins 20 pour cent de beurre de cacao,
(ii) au moins 14 pour cent de solides du lait totaux provenant d’ingrédients laitiers,
(iii) au moins 3,5 pour cent de matières grasses du lait;
b) peut contenir :
(i) moins de 5 pour cent de petit-lait ou de produits du petit-lait,
(ii) des épices,
(iii) des préparations aromatisantes pour équilibrer la saveur, sauf celles qui imitent la saveur du chocolat ou du lait,
(iv) du sel,
(v) les agents émulsifiants suivants, en quantité n’excédant pas, pour chacun de ces agents, les limites de tolérance prévues à la colonne III du tableau IV de l’article B.16.100 et, pour toute combinaison de ces agents, 1,5 pour cent en masse du produit de chocolat :
(A) monoglycérides et mono- et diglycérides,
(B) lécithine et lécithine hydroxylée,
(C) sels d’ammonium de glycérides phosphorylés,
(D) esters polyglycériques d’acides gras d’huile de ricin transestérifiée,
(E) monostéarate de sorbitan.
- DORS/97-263, art. 2
B.04.010 [N]. Le cacao ou la poudre de cacao :
a) est le produit :
(i) qui est obtenu par pulvérisation de ce qui reste de la liqueur de cacao qui a été partiellement dégraissée par moyen mécanique,
(ii) dont la teneur en beurre de cacao est d’au moins 10 pour cent;
b) peut contenir :
(i) des épices,
(ii) des préparations aromatisantes pour équilibrer la saveur, sauf celles qui imitent la saveur du chocolat ou du lait,
(iii) du sel,
(iv) les agents émulsifiants suivants, en quantité n’excédant pas, pour chacun de ces agents, les limites de tolérance prévues à la colonne III du tableau IV de l’article B.16.100 et, pour toute combinaison de ces agents, 1,5 pour cent en masse du produit du cacao :
(A) monoglycérides et mono- et diglycérides,
(B) lécithine et lécithine hydroxylée,
(C) sels d’ammonium de glycérides phosphorylés.
- DORS/82-768, art. 5
- DORS/97-263, art. 2
B.04.011 [N]. Le cacao faible en gras ou la poudre de cacao faible en gras :
a) est le produit :
(i) qui est obtenu par pulvérisation de ce qui reste de la liqueur de cacao qui a été partiellement dégraissée par moyen mécanique,
(ii) dont la teneur en beurre de cacao est de moins de 10 pour cent;
b) peut contenir :
(i) des épices,
(ii) des préparations aromatisantes pour équilibrer la saveur, sauf celles qui imitent la saveur du chocolat ou du lait,
(iii) du sel,
(iv) les agents émulsifiants suivants, en quantité n’excédant pas, pour chacun de ces agents, les limites de tolérance prévues à la colonne III du tableau IV de l’article B.16.100 et, pour toute combinaison de ces agents, 1,5 pour cent en masse du produit du cacao :
(A) monoglycérides et mono- et diglycérides,
(B) lécithine et lécithine hydroxylée,
(C) sels d’ammonium de glycérides phosphorylés.
- DORS/82-768, art. 6
- DORS/97-263, art. 2
B.04.012 Il est interdit de vendre des produits du cacao ou des produits de chocolat, à moins qu’ils ne soient exempts de bactéries du genre Salmonella d’après les résultats de l’analyse selon la méthode officielle MFO-11, Examen microbiologique du cacao et du chocolat, du 30 novembre 1981.
- DORS/97-263, art. 2
TITRE 5Café
B.05.001 [N]. Le café vert, café brut ou café non torréfié doit être la graine de Coffea arabica L., de C. liberia Hiern ou de C. robusta Chev., presque complètement débarrassée de son spermoderme.
B.05.002 [N]. Le café torréfié ou café doit être du café vert torréfié, doit renfermer au moins 10 pour cent de matière grasse et peut renfermer au plus six pour cent de cendres totales.
B.05.003 [N]. Le (indication du type de café) décaféiné :
a) est le café de ce type duquel a été extraite de la caféine et qui, par suite d’une telle extraction, contient au plus :
(i) 0,1 pour cent de caféine, s’il s’agit de café brut décaféiné ou de café décaféiné,
(ii) 0,3 pour cent de caféine, s’il s’agit de café instantané décaféiné;
b) peut avoir été décaféiné au moyen des solvants d’extraction mentionnés au tableau XV du titre 16.
- DORS/90-443, art. 1
TITRE 6
Colorants pour aliments
B.06.001 Dans le présent Titre,
- colorant synthétique
colorant synthétique Colorant alimentaire organique, autre que le caramel, qui est produit par synthèse chimique et qui n’a pas son équivalent dans la nature. (synthetic colour)
- diluant
diluant désigne une substance, autre qu’un colorant synthétique, qui est présente dans une préparation colorante ou un mélange colorant; (diluent)
- mélange
mélange désigne un mélange de deux colorants synthétiques ou plus, ou un mélange d’un ou de plusieurs colorants synthétiques avec un ou plusieurs diluants; (mixture)
- méthode officielle FO-7
méthode officielle FO-7[Abrogée, DORS/2016-305, art. 49]
- méthode officielle FO-8
méthode officielle FO-8[Abrogée, DORS/2016-305, art. 49]
- méthode officielle FO-9
méthode officielle FO-9[Abrogée, DORS/2016-305, art. 49]
- méthode officielle FO-10
méthode officielle FO-10[Abrogée, DORS/2016-305, art. 49]
- méthode officielle FO-11
méthode officielle FO-11[Abrogée, DORS/2016-305, art. 49]
- méthode officielle FO-12
méthode officielle FO-12[Abrogée, DORS/2016-305, art. 49]
- méthode officielle FO-13
méthode officielle FO-13[Abrogée, DORS/2016-305, art. 49]
- méthode officielle FO-14
méthode officielle FO-14[Abrogée, DORS/2016-305, art. 49]
- méthode officielle FO-15
méthode officielle FO-15[Abrogée, DORS/2016-305, art. 49]
- pigment
pigment désigne le pigment principal et tout pigment associé, isomère ou accessoire, présents dans un colorant synthétique; (dye)
- préparation
préparation désigne une préparation faite d’un ou de plusieurs colorants synthétiques, qui renferme moins de trois pour cent de pigment et est vendue pour usage domestique. (preparation)
- DORS/80-500, art. 2
- DORS/84-440, art. 1
- DORS/2016-305, art. 49
B.06.002 Il est interdit de vendre un aliment, à l’exclusion d’un colorant synthétique, d’un mélange, d’une préparation ou d’une préparation aromatisante, qui est destiné à la consommation selon le mode d’emploi figurant sur l’étiquette et qui renferme
a) plus de 300 parties par million d’amaranthe, d’érythrosine, d’indigotine, de jaune soleil FCF, de rouge allura, de tartrazine ou d’un mélange de ces colorants, à moins qu’une limite de tolérance plus élevée soit indiquée dans la colonne III de l’article 3 du tableau III de l’article B.16.100;
b) plus de 100 parties par million de vert solide FCF, de bleu brillant FCF, ou d’un mélange de ces colorants;
c) plus de 300 parties par million d’un mélange des colorants synthétiques visés aux alinéas a) et b) dans les limites qui y sont prévues; ou
d) plus de 150 parties par million de ponceau SX.
- DORS/80-500, art. 2
- DORS/84-440, art. 2
- DORS/86-178, art. 1(F)
- DORS/2007-75, art. 1
B.06.003 [Abrogé, DORS/2016-305, art. 50]
B.06.004 [Abrogé, DORS/2016-305, art. 50]
B.06.005 [Abrogé, DORS/2016-305, art. 50]
B.06.006 [Abrogé, DORS/2016-305, art. 50]
B.06.007 Il est interdit de vendre une préparation pour aliments sans respecter les conditions suivantes :
a) les mots « préparation colorante pour aliments » doivent figurer dans l’espace principal de l’étiquette; et
b) s’il s’agit d’une préparation liquide, la capacité maximale du contenant doit être d’au plus 60 millilitres et le liquide ne doit pouvoir être versé que goutte à goutte.
- DORS/80-500, art. 2
B.06.008 [Abrogé, DORS/2016-305, art. 51]
B.06.009 à B.06.013 [Abrogés, DORS/80-500, art. 2]
B.06.021 [Abrogé, DORS/2016-305, art. 52]
B.06.022 [Abrogé, DORS/2016-305, art. 52]
B.06.023 [Abrogé, DORS/2016-305, art. 52]
B.06.024 [Abrogé, DORS/2016-305, art. 52]
B.06.025 [Abrogé, DORS/2016-305, art. 52]
B.06.031 [Abrogé, DORS/2016-305, art. 52]
B.06.032 [Abrogé, DORS/2016-305, art. 52]
B.06.033 [Abrogé, DORS/2016-305, art. 52]
B.06.041 [Abrogé, DORS/2016-305, art. 53]
B.06.042 [Abrogé, DORS/2016-305, art. 53]
B.06.043 [N]. Le ponceau SX doit être le sel disodique de l’acide 2-(5-sulfo-2,4-xylylazo)-1-naphtol-4-sulfonique; il doit renfermer au moins 85 % de pigment et peut renfermer au plus :
a) 0,2 % de matière insoluble dans l’eau;
b) 0,2 % d’extraits d’éther réunis;
c) 1,0 % de pigments accessoires;
d) 0,5 % de composés intermédiaires;
e) trois parties par million d’arsenic;
f) dix parties par million de plomb.
- DORS/82-768, art. 9
- DORS/84-440, art. 3
- DORS/2016-305, art. 54
B.06.044 [Abrogé, DORS/2016-305, art. 54]
B.06.045 [Abrogé, DORS/2016-305, art. 54]
B.06.046 [Abrogé, DORS/2016-305, art. 54]
B.06.049 [Abrogé, DORS/2016-305, art. 54]
B.06.050 [Abrogé, DORS/2016-305, art. 54]
B.06.051 [Abrogé, DORS/2016-305, art. 54]
B.06.053 [N]. Le rouge citrin no 2 doit être le 1-(2,5-diméthoxyphénylazo)-2-naphtol; il doit renfermer au moins 98 % de pigment et peut renfermer au plus :
a) 0,5 % de matières volatiles (à 100 °C);
b) 0,3 % de cendres sulfatées;
c) 0,3 % de matière soluble dans l’eau;
d) 0,5 % de matière insoluble dans le tétrachlorure de carbone;
e) 0,05 % de composés intermédiaires non combinés;
f) 2,0 % de pigments accessoires;
g) une partie par million d’arsenic;
h) dix parties par million de plomb.
- DORS/82-768, art. 12
- DORS/84-440, art. 3
- DORS/2016-305, art. 55
B.06.061 La laque de tout colorant synthétique soluble dans l’eau qui est visé à l’article 2 de l’Autorisation de mise en marché d’additifs alimentaires comme colorants doit être le sel de calcium ou d’aluminium du colorant en cause, absorbé sur alumine.
- DORS/82-1071, art. 3
- DORS/84-300, art. 20
- DORS/87-640, art. 2
- DORS/2016-305, art. 56
B.06.062 [Abrogé, DORS/82-768, art. 13]
TITRE 7Épices, condiments et assaisonnements
B.07.001 [N]. Le myrte-piment, pimenta, piment de la Jamaïque, piment des Anglais ou toute-épice, entier ou moulu, doit être la baie complète et non mûrie du Pimenta dioica (L) Merr. et doit renfermer
a) au plus
(i) 25 pour cent de cellulose,
(ii) 5,5 pour cent de cendres totales,
(iii) 0,4 pour cent de cendres insolubles dans l’acide chlorhydrique, et
(iv) 12 pour cent d’humidité; et
b) au moins 2,5 millilitres d’huile volatile par 100 grammes d’épice.
- DORS/79-659, art. 1
B.07.002 [N]. L’anis ou la graine d’anis, entier ou moulu, doit être le fruit desséché du Pimpinella anisum L. et doit renfermer
a) au plus
(i) neuf pour cent de cendres totales,
(ii) un pour cent de cendres insolubles dans l’acide chlorhydrique, et
(iii) 10 pour cent d’humidité; et
b) au moins deux millilitres d’huile volatile par 100 grammes d’épice.
- DORS/79-659, art. 1
B.07.003 [N]. Le basilic ou le basilic odorant, entier ou moulu, doit être la feuille desséchée de l’Ocimum basilicum L. et doit renfermer
a) au plus
(i) 15 pour cent de cendres totales,
(ii) deux pour cent de cendres insolubles dans l’acide chlorhydrique, et
(iii) neuf pour cent d’humidité; et
b) au moins 0,2 millilitre d’huile volatile par 100 grammes d’épice.
- DORS/79-659, art. 1
B.07.004 [N]. Les feuilles de laurier, entières ou moulues, doivent être les feuilles desséchées du Laurus nobilis L. et doivent renfermer
a) au plus
(i) 4,5 pour cent de cendres totales,
(ii) 0,5 pour cent de cendres insolubles dans l’acide chlorhydrique, et
(iii) sept pour cent d’humidité; et
b) au moins un millilitre d’huile volatile par 100 grammes d’épice.
- DORS/79-659, art. 1
B.07.005 [N]. Le carvi ou la graine de carvi, entier ou moulu, doit être le fruit desséché du carvi, Carum carvi L. et doit renfermer
a) au plus
(i) huit pour cent de cendres totales,
(ii) un pour cent de cendres insolubles dans l’acide chlorhydrique, et
(iii) 11,5 pour cent d’humidité; et
b) au moins deux millilitres d’huile volatile par 100 grammes d’épice.
- DORS/79-659, art. 1
B.07.006 [N]. La cardamome ou la graine de cardamome, décolorée ou verte, entière ou moulue, doit être le fruit mûr et desséché de l’Elettaria cardamomum Maton et doit renfermer
a) au plus
(i) huit pour cent de cendres totales,
(ii) trois pour cent de cendres insolubles dans l’acide chlorhydrique, et
(iii) 13 pour cent d’humidité; et
b) au moins trois millilitres d’huile volatile par 100 grammes d’épice.
- DORS/79-659, art. 1
B.07.007 [N]. Le poivre de cayenne ou le cayenne, entier ou moulu,
a) est le fruit mûr et desséché du Capsicum frutescens L., du Capsicum baccatum L. ou d’autres espèces de Capsicum portant de petits fruits et doit renfermer au plus
(i) 1,5 pour cent d’amidon,
(ii) 28 pour cent de cellulose,
(iii) 10 pour cent de cendres totales,
(iv) 1,5 pour cent de cendres insolubles dans l’acide chlorhydrique, et
(v) 10 pour cent d’humidité; et
b) peut renfermer au plus deux pour cent de bioxyde de silicium en tant qu’agent anti-agglomérant.
- DORS/79-659, art. 1
- DORS/84-17, art. 2
B.07.008 [N]. Le sel de céleri
a) doit être un mélange
(i) de graines de céleri moulu ou de céleri déshydraté moulu, et
(ii) de sel en une quantité n’excédant pas 75 pour cent; et
b) peut renfermer au plus 0,5 pour cent de bioxyde de silicium comme agent anti-agglomérant.
- DORS/79-659, art. 1
B.07.009 [N]. La graine de céleri, entière ou moulue, doit être la graine mûre et desséchée de l’Apium graveolens L. et doit renfermer
a) au plus
(i) 12 pour cent de cendres totales,
(ii) deux pour cent de cendres insolubles dans l’acide chlorhydrique, et
(iii) 10 pour cent d’humidité; et
b) au moins 1,5 millilitre d’huile volatile par 100 grammes d’épice.
- DORS/79-659, art. 1
B.07.010 [N]. Le poivre de céleri
a) doit être un mélange
(i) de graines de céleri moulu ou de céleri déshydraté moulu, et
(ii) de poivre noir moulu en une quantité n’excédant pas 70 pour cent; et
b) peut renfermer au plus 0,5 pour cent de bioxyde de silicium comme agent anti-agglomérant.
- DORS/79-659, art. 1
B.07.011 [N]. La cannelle ou la cannelle bâtarde (ou fausse cannelle), entière ou moulue, doit être l’écorce desséchée des arbres du genre Cinnamomum des espèces C. burmanni Blume, C. loureirii Nees ou C. Cassia Blume et doit renfermer
a) au plus
(i) six pour cent de cendres totales,
(ii) deux pour cent de cendres insolubles dans l’acide chlorhydrique, et
(iii) 13 pour cent d’humidité; et
b) au moins 1,2 millilitre d’huile volatile par 100 grammes d’épice.
- DORS/79-659, art. 1
B.07.012 [N]. La cannelle de Ceylan, entière ou moulue, doit être la cannelle obtenue exclusivement du Cinnamomum zeylanicum Nees.
- DORS/79-659, art. 1
B.07.013 [N]. Le clou de girofle, entier ou moulu, doit être le bouton clos et desséché de la fleur de l’Eugenia caryophyllus (Spreng) et doit renfermer
a) au plus
(i) cinq pour cent de tiges de clou de girofle,
(ii) six pour cent de cendres totales,
(iii) 0,5 pour cent de cendres insolubles dans l’acide chlorhydrique,
(iv) 10 pour cent de cellulose, et
(v) huit pour cent d’humidité; et
b) au moins 13 millilitres d’huile volatile par 100 grammes d’épice.
- DORS/79-659, art. 1
B.07.014 [N]. La coriandre ou la graine de coriandre, entière ou moulue, doit être la graine desséchée du Coriandrum sativum L. et doit renfermer
a) au plus
(i) sept pour cent de cendres totales,
(ii) un pour cent de cendres insolubles dans l’acide chlorhydrique, et
(iii) neuf pour cent d’humidité; et
b) au moins 0,3 millilitre d’huile volatile par 100 grammes d’épice.
- DORS/79-659, art. 1
B.07.015 [N]. Le cumin ou la graine de cumin, entier ou moulu, doit être la graine desséchée du Cuminum cyminum L. et doit renfermer
a) au plus
(i) 9,5 pour cent de cendres totales,
(ii) 1,5 pour cent de cendres insolubles dans l’acide chlorhydrique, et
(iii) neuf pour cent d’humidité; et
b) au moins 2,5 millilitres d’huile volatile par 100 grammes d’épice.
- DORS/79-659, art. 1
B.07.016 [N]. La poudre de cari doit être un mélange
a) de curcuma avec des épices et des condiments; et
b) de sel en une quantité n’excédant pas cinq pour cent.
- DORS/79-659, art 1
B.07.017 [N]. La graine d’aneth, entière ou moulue, doit être la graine desséchée de l’Anethum graveolens L., ou de l’Anethum sowa D.C. et doit renfermer
a) au plus
(i) 10 pour cent de cendres totales,
(ii) deux pour cent de cendres insolubles dans l’acide chlorhydrique, et
(iii) neuf pour cent d’humidité; et
b) au moins deux millilitres d’huile volatile par 100 grammes d’épice.
- DORS/79-659, art. 1
B.07.018 [N]. Le fenouil ou la graine de fenouil, entier ou moulu, doit être la graine mûre et desséchée du Foeniculum vulgare Mill. et doit renfermer
a) au plus
(i) 10 pour cent de cendres totales,
(ii) un pour cent de cendres insolubles dans l’acide chlorhydrique, et
(iii) 10 pour cent d’humidité; et
b) au moins un millilitre d’huile volatile par 100 grammes d’épice.
- DORS/79-659, art. 1
B.07.019 [N]. Le fenugrec, entier ou moulu, doit être la graine mûre et desséchée du Trigonella foenumgraecum L. et doit renfermer au plus
a) cinq pour cent de cendres totales;
b) un pour cent de cendres insolubles dans l’acide chlorhydrique; et
c) 10 pour cent d’humidité.
- DORS/79-659, art. 1
B.07.020 [N]. Le sel d’ail
a) doit être un mélange
(i) d’ail déshydraté en poudre, et
(ii) de sel en une quantité n’excédant pas 75 pour cent; et
b) peut renfermer les agents anti-agglomérants suivants pour une quantité totale n’excédant pas deux pour cent :
silicate double d’aluminium et de calcium, phosphate tricalcique, silicate de calcium, stéarate de calcium, carbonate de magnésium, silicate de magnésium, stéarate de magnésium, bioxyde de silicium, en une quantité n’excédant pas un pour cent et silicate double de sodium et d’aluminium.
- DORS/79-659, art. 1
B.07.021 [N]. Le gingembre, entier ou moulu, doit être le rhizome lavé et desséché ou décortiqué du Zingiber officinale Roscoe et doit renfermer
a) au plus
(i) sept pour cent de cendres totales,
(ii) un pour cent de cendres insolubles dans l’acide chlorhydrique, et
(iii) 12,5 pour cent d’humidité; et
b) au moins 1,5 millilitre d’huile volatile par 100 grammes d’épice.
- DORS/79-659, art. 1
B.07.022 [N]. Le macis, entier ou moulu, doit être l’arille desséchée du Myristica fragrans Houttyn et doit renfermer
a) au plus
(i) 3,5 pour cent de cendres totales,
(ii) 0,5 pour cent de cendres insolubles dans l’acide chlorhydrique, et
(iii) huit pour cent d’humidité; et
b) au moins 11 millilitres d’huile volatile par 100 grammes d’épice,
la somme des extraits non volatils qui pourraient en être extraits au moyen
c) d’éther éthylique, doit constituer de 20 pour cent à 35 pour cent du produit; et
d) d’éther éthylique, après extraction préliminaire avec l’éther de pétrole, doit représenter au plus cinq pour cent du produit.
- DORS/79-659, art. 1
B.07.023 [N]. La marjolaine, entière ou moulue, doit être la feuille desséchée, avec ou sans une faible proportion des fleurs de la plante de la Marjorana hortensis Moench et doit renfermer
a) au plus
(i) 10 pour cent des tiges et de matières étrangères d’origine végétale,
(ii) 13,5 pour cent de cendres totales,
(iii) 4,5 pour cent de cendres insolubles dans l’acide chlorhydrique, et
(iv) 10 pour cent d’humidité; et
b) au moins 0,7 millilitre d’huile volatile par 100 grammes d’épice.
- DORS/79-659, art. 1
B.07.024 [N]. La graine de moutarde doit être la graine du Sinapis alba, du Brassica hirta Moench, du Brassica juncea (L) Cosson ou du Brassica nigra et doit renfermer
a) au plus
(i) sept pour cent de cendres totales,
(ii) un pour cent de cendres insolubles dans l’acide chlorhydrique, et
(iii) 11 pour cent d’humidité; et
b) au moins 25 pour cent d’extrait d’éther non volatil.
- DORS/79-659, art. 1
B.07.025 [N]. La moutarde, farine de moutarde ou moutarde moulue doit être la poudre qui provient de la graine de moutarde
a) de laquelle
(i) a été enlevée une majeure partie de la balle, et
(ii) peut avoir été enlevée une partie de l’huile fixe; et
b) qui renferme au plus
(i) 1,5 pour cent d’amidon, et
(ii) huit pour cent de cendres totales, sur la matière dégraissée.
- DORS/79-659, art. 1
- DORS/2010-142, art. 3(F)
B.07.026 [N]. La muscade, entière ou moulue, doit être la graine desséchée du Myristica fragrans Houttyn, peut, avant la mouture, porter une mince couche de chaux et doit renfermer
a) au plus
(i) trois pour cent de cendres totales,
(ii) 0,5 pour cent de cendres insolubles dans l’acide chlorhydrique, et
(iii) huit pour cent d’humidité; et
b) au moins
(i) 25 pour cent d’extrait d’éther non volatil, et
(ii) 6,5 millilitres d’huile volatile par 100 grammes d’épice.
- DORS/79-659, art. 1
B.07.027 [N]. Le sel d’oignon
a) doit être un mélange
(i) d’oignons déshydratés en poudre, et
(ii) de sel en une quantité n’excédant pas 75 pour cent; et
b) peut renfermer les agents anti-agglomérants suivants pour une quantité totale n’excédant pas deux pour cent :
silicate double d’aluminium et de calcium, phosphate tricalcique, silicate de calcium, stéarate de calcium, carbonate de magnésium, silicate de magnésium, stéarate de magnésium, bioxyde de silicium en une quantité n’excédant pas un pour cent et silicate double de sodium et d’aluminium.
- DORS/79-659, art. 1
B.07.028 [N]. L’origan, entier ou moulu, doit être la feuille desséchée de l’Origanum vulgar L. ou de l’Origanum Spp. et doit renfermer
a) au plus
(i) 10 pour cent de cendres totales,
(ii) deux pour cent de cendres insolubles dans l’acide chlorhydrique, et
(iii) 10 pour cent d’humidité; et
b) au moins 2,5 millilitres d’huile volatile par 100 grammes d’épice.
- DORS/79-659, art. 1
B.07.029 [N]. Le paprika est le fruit mûr desséché et moulu du Capsicum annuum L. et
a) doit renfermer au plus
(i) 23 pour cent de cellulose,
(ii) 8,5 pour cent de cendres totales,
(iii) un pour cent de cendres insolubles dans l’acide chlorhydrique, et
(iv) 12 pour cent d’humidité; et
b) peut renfermer au plus deux pour cent de bioxyde de silicium en tant qu’agent anti-agglomérant.
- DORS/79-659, art. 1
- DORS/84-17, art. 3
B.07.030 [N]. Le poivre noir ou le poivre en grain, entier ou moulu, doit être la baie non mûrie et desséchée du Piper nigrum L. et doit renfermer
a) au plus
(i) sept pour cent de cendres totales,
(ii) un pour cent de cendres insolubles dans l’acide chlorhydrique, et
(iii) 12 pour cent d’humidité;
b) au moins
(i) six pour cent d’extrait de chlorure de méthylène non volatil,
(ii) 30 pour cent d’amidon de poivre, et
(iii) 2,0 millilitres d’huile volatile par 100 grammes d’épice; et
c) une fois moulu, les diverses parties de la baie dans leurs proportions normales.
- DORS/79-659, art. 1
B.07.031 [N]. Le poivre blanc, entier ou moulu, doit être la baie mûre et desséchée du Piper nigrum L. débarrassée de son enveloppe extérieure et dont l’enveloppe intérieure peut être enlevée, il doit renfermer
a) au plus
(i) cinq pour cent de cellulose,
(ii) 2,5 pour cent de cendres totales,
(iii) 0,3 pour cent de cendres insolubles dans l’acide chlorhydrique, et
(iv) 15 pour cent d’humidité; et
b) au moins
(i) six pour cent d’extrait de chlorure de méthylène non volatil,
(ii) 52 pour cent d’amidon de poivre, et
(iii) un millilitre d’huile volatile par 100 grammes d’épice.
- DORS/79-659, art. 1
B.07.032 [N]. La graine de pavot doit être la graine desséchée du Papaver somniferum L. et doit renfermer
a) au plus
(i) sept pour cent de cendres totales, et
(ii) un pour cent de cendres insolubles dans l’acide chlorhydrique; et
b) au moins 40 pour cent d’extrait d’éther non volatil.
- DORS/79-659, art. 1
B.07.033 [N]. Le romarin, entier ou moulu, doit être la feuille desséchée du Rosemarinus officinalis L. et doit renfermer
a) au plus
(i) 7,5 pour cent de cendres totales,
(ii) un pour cent de cendres insolubles dans l’acide chlorhydrique, et
(iii) neuf pour cent d’humidité; et
b) au moins 1,2 millilitre d’huile volatile par 100 grammes d’épice.
- DORS/78-637, art. 1
- DORS/79-659, art. 1
B.07.034 [N]. La sauge, entière ou moulue, doit être la feuille desséchée du Salvia officinalis L., du Salvia triloba L. ou du Salvia lavandulaefolia Vahl. et doit renfermer
a) au plus
(i) 12 pour cent de tiges, pétioles non compris, et de matières étrangères d’origine végétale,
(ii) 10 pour cent de cendres totales,
(iii) un pour cent de cendres insolubles dans l’acide chlorhydrique, et
(iv) 10 pour cent d’humidité; et
b) au moins un millilitre d’huile volatile par 100 grammes d’épice.
- DORS/79-659, art. 1
B.07.035 [N]. La sarriette, entière ou moulue, doit être la feuille et la fleur desséchées du Satureja hortensis L. ou du Satureja montana L. et doit renfermer
a) au plus
(i) 11 pour cent de cendres totales,
(ii) deux pour cent de cendres insolubles dans l’acide chlorhydrique, et
(iii) 14 pour cent d’humidité; et
b) au moins 0,8 millilitre d’huile volatile par 100 grammes d’épice.
- DORS/79-659, art. 1
B.07.036 [N]. La graine de sésame doit être la graine à balles desséchées du Sesamum indicum L. et doit renfermer
a) au plus huit pour cent d’humidité; et
b) au moins 50 pour cent d’extrait d’éther non volatil.
- DORS/79-659, art. 1
- DORS/2010-142, art. 4(F)
B.07.037 [N]. L’estragon, entier ou moulu, doit être la feuille et la fleur desséchées de l’Artemisia dracunculus L. et doit renfermer
a) au plus
(i) 15 pour cent de cendres totales,
(ii) 1,5 pour cent de cendres insolubles dans l’acide chlorhydrique, et
(iii) 10 pour cent d’humidité; et
b) au moins 0,3 millilitre d’huile volatile par 100 grammes d’épice.
- DORS/79-659, art. 1
B.07.038 [N]. Le thym, entier ou moulu, doit être la feuille et la fleur desséchées du Thymus vulgaris L. ou du Thymus zygis L. et doit renfermer
a) au plus
(i) 12 pour cent de cendres totales,
(ii) cinq pour cent de cendres insolubles dans l’acide chlorhydrique, et
(iii) neuf pour cent d’humidité; et
b) au moins 0,9 millilitre d’huile volatile par 100 grammes d’épice.
- DORS/79-659, art. 1
B.07.039 [N]. Le curcuma, entier ou moulu, doit être le rhizome desséché du Curcuma longa L. et doit renfermer
a) au plus
(i) sept pour cent de cendres totales,
(ii) 1,5 pour cent de cendres insolubles dans l’acide chlorhydrique, et
(iii) 10 pour cent d’humidité; et
b) au moins 3,5 millilitres d’huile volatile par 100 grammes d’épice.
- DORS/79-659, art. 1
B.07.040 [N]. La mayonnaise, sauce mayonnaise ou sauce mayonnaise à salade
a) doit être un mélange
(i) d’huile végétale,
(ii) d’oeufs entiers ou de jaunes d’oeufs, à l’état liquide, congelés ou desséchés, et
(iii) de vinaigre ou de jus de citron;
b) peut renfermer
(i) de l’eau,
(ii) du sel,
(iii) un agent édulcorant,
(iv) des épices ou autres condiments, excepté le curcuma et le safran,
(v) de l’acide citrique, tartrique ou lactique, et
(vi) un agent séquestrant; et
c) doit renfermer au moins 65 pour cent d’huile végétale.
- DORS/79-659, art. 1
B.07.041 [N]. La sauce française ou sauce vinaigrette
a) doit être un mélange
(i) d’huile végétale, et
(ii) de vinaigre ou de jus de citron;
b) peut renfermer
(i) de l’eau,
(ii) du sel,
(iii) un agent édulcorant,
(iv) des épices, des tomates ou d’autres condiments,
(v) un émulsif,
(vi) des oeufs entiers ou des jaunes d’oeufs, à l’état liquide, congelés ou desséchés,
(vii) de l’acide citrique, tartrique ou lactique, et
(viii) un agent séquestrant; et
c) doit renfermer au moins 35 pour cent d’huile végétale.
- DORS/79-659, art. 1
B.07.042 [N]. La sauce à salade ou sauce genre mayonnaise
a) doit être un mélange
(i) d’huile végétale,
(ii) d’oeufs entiers ou de jaunes d’oeufs, à l’état liquide, congelés ou desséchés,
(iii) de vinaigre ou de jus de citron, et
(iv) d’amidon, de farine, de farine de seigle ou de tapioca, ou un mélange de ces produits;
b) peut renfermer
(i) de l’eau,
(ii) du sel,
(iii) un agent édulcorant,
(iv) des épices ou autres condiments,
(v) un émulsif,
(vi) de l’acide citrique, tartrique ou lactique, et
(vii) un agent séquestrant; et
c) doit renfermer au moins 35 pour cent d’huile végétale.
- DORS/79-659, art. 1
B.07.043 Est interdite la vente d’une sauce d’assaisonnement qui contient plus de cinq pour cent d’acide gras monoénoïques en C22 par rapport aux acides totaux qu’elle renferme.
- DORS/79-659, art. 1
TITRE 8Produits laitiers
B.08.001 Les aliments mentionnés dans le présent Titre sont des produits laitiers.
B.08.001.1 Les définitions qui suivent s’appliquent au présent titre.
- produit du lait
produit du lait
a) Dans le cas du beurre ou du beurre de petit-lait, l’un ou l’autre des produits suivants :
(i) le lait partiellement écrémé, le lait écrémé, la crème, le babeurre ou la crème de petit-lait,
(ii) le lait sous forme concentrée, desséchée ou reconstituée ou tout produit visé au sous-alinéa (i) sous forme concentrée, desséchée ou reconstituée;
b) dans le cas du fromage, l’un ou l’autre des produits suivants :
(i) le lait partiellement écrémé, le lait écrémé, la crème, le babeurre, le petit-lait ou la crème de petit-lait,
(ii) le lait sous forme concentrée, desséchée, congelée ou reconstituée ou tout produit visé au sous-alinéa (i) sous forme concentrée, desséchée, congelée ou reconstituée,
(iii) le beurre, l’huile de beurre et le beurre de petit-lait,
(iv) tout composant du lait — sauf l’eau —, pris seul ou en combinaison avec d’autres,
(v) le concentré protéique de petit-lait;
c) dans le cas du fromage à la crème à tartiner, du fromage à la crème à tartiner (avec indication des ingrédients ajoutés), du fromage fondu à tartiner, du fromage fondu à tartiner (avec indication des ingrédients ajoutés), d’une préparation de fromage conditionné à froid, d’une préparation de fromage conditionné à froid (avec indication des ingrédients ajoutés), d’une préparation de fromage fondu ou d’une préparation de fromage fondu (avec indication des ingrédients ajoutés), l’un ou l’autre des produits suivants :
(i) le beurre, le beurre de petit-lait et le petit-lait,
(ii) le concentré protéique de petit-lait,
(iii) tout produit visé au sous-alinéa (i) sous forme concentrée ou desséchée;
d) dans le cas d’un mélange à lait glacé, d’un mélange à crème glacée et du sorbet laitier, les produits visés aux sous-alinéas a)(i) ou (ii) ou c)(i), (ii) ou (iii). (milk product)
- ultrafiltré
ultrafiltré Se dit du lait, du lait partiellement écrémé ou du lait écrémé qu’on fait passer à travers une ou plusieurs membranes semi-perméables pour partiellement en soustraire l’eau, le lactose, les minéraux et les vitamines hydrosolubles sans en altérer le rapport protéines de petit-lait à la caséine et qui résulte en un produit liquide. (ultrafiltered)
- DORS/92-400, art. 1
- DORS/97-543, art. 1(F)
- DORS/98-580, art. 1(F)
- DORS/2007-302, art. 1
- DORS/2010-94, art. 2
- DORS/2011-205, art. 41
B.08.002 Sauf l’exception prévue dans le présent règlement, tout produit laitier qui contient du gras autre que du gras de lait est falsifié.
B.08.002.1 Les articles B.08.003 à B.08.028, ne s’appliquent pas à la sécrétion lactée des glandes mammaires d’un animal autre qu’une vache, genre Bos, ni aux produits ou dérivés de cette sécrétion.
- DORS/85-623, art. 1
B.08.002.2 (1) Il est interdit de vendre la sécrétion lactée normale provenant des glandes mammaires d’une vache, genre Bos, ou d’un autre animal, ou tout produit laitier fabriqué à partir de cette sécrétion, à moins que la sécrétion ou le produit laitier n’aient été pasteurisés à une température et pendant une période qui assurent la réduction de l’activité de la phosphatase alcaline de façon que la limite de tolérance spécifiée dans la méthode officielle MFO-3, Détermination de l’activité phosphatasique des produits laitiers, en date du 30 novembre 1981, soit respectée.
(2) Le paragraphe (1) ne s’applique pas :
a) aux fromages;
b) aux aliments vendus pour être soumis à d’autres étapes de fabrication ou de transformation en vue de leur pasteurisation de la façon prévue au paragraphe (1).
- DORS/91-549, art. 1
- DORS/95-499, art. 1
Lait
B.08.003 [N]. Le lait ou lait entier
a) doit être la sécrétion lactée normale des glandes mammaires de la vache, genre Bos;
b) doit contenir 2 μg de vitamine D par 100 mL.
- DORS/95-499, art. 2
- DORS/2022-168, art. 22
B.08.004 [N]. Le lait écrémé
a) doit être un lait qui ne contient pas plus de 0,3 pour cent de gras de lait;
b) doit, nonobstant les articles D.01.009 et D.01.010, contenir de la vitamine A ajoutée en quantité telle qu’une ration quotidienne raisonnable du produit laitier contienne au moins 1 200 unités internationales et au plus 2 500 unités internationales de vitamine A; et
c) doit contenir 2 μg de vitamine D par 100 mL.
- DORS/78-656, art. 1
- DORS/2022-168, art. 23
B.08.005 [N]. Le lait partiellement écrémé ou en partie écrémé
a) doit provenir d’un lait dont la teneur en gras a été réduite par séparation mécanique ou ajustée par l’addition de crème, de lait ou de lait écrémé ou partiellement écrémé seuls ou en association;
b) doit, nonobstant les articles D.01.009 et D.01.010, contenir de la vitamine A ajoutée en quantité telle qu’une ration quotidienne raisonnable du produit laitier contienne au moins 1 200 unités internationales et au plus 2 500 unités internationales de vitamine A; et
c) doit contenir 2 μg de vitamine D par 100 mL.
- DORS/78-656, art. 2
- DORS/2022-168, art. 24
B.08.006 [N]. Le gras de lait ou gras de beurre doit être la matière grasse du lait de vache et doit avoir
a) une densité d’au moins 0,905 à la température de 40 °C,
b) une teneur en tocophérols d’au plus 50 microgrammes par gramme, déterminée selon la méthode officielle FO-16, Détermination de la teneur en tocophérols du gras de lait ou du gras de beurre, 15 octobre 1981,
c) un indice de Reichert-Meissl d’au moins 24, et
d) un indice de Polenske ne dépassant pas 10 pour cent de l’indice de Reichert-Meissl et ne dépassant 3,5 en aucun cas, et
si la teneur en tocophérols dépasse 50 microgrammes par gramme ou si l’indice de Polenske dépasse 10 pour cent de l’indice de Reichert-Meissl, le gras de lait sera censé avoir été additionné d’une matière grasse autre que celle du lait de vache.
- DORS/82-768, art. 14
B.08.007 [N]. Le lait stérilisé
a) et b) [Abrogés, DORS/97-148, art. 1]
c) doit renfermer au moins
(i) 11,75 pour cent de solides du lait, et
(ii) 3,25 pour cent de gras de lait; et
d) doit contenir 2 μg de vitamine D par 100 mL.
- DORS/97-148, art. 1
- DORS/2022-168, art. 25
B.08.008 Le pourcentage de matière grasse du lait contenu dans
a) du lait partiellement écrémé ou en partie écrémé,
b) du lait partiellement écrémé additionné de solides du lait ou du lait en partie écrémé additionné de solides du lait, ou
c) du lait évaporé partiellement écrémé ou du lait concentré partiellement écrémé
doit être indiqué sur l’espace principal suivi de l’expression « matière grasse du lait » ou de l’abréviation « M.G. ».
B.08.009 [N]. Le lait condensé ou lait condensé sucré doit être du lait dont l’eau a été évaporée et auquel on a ajouté du sucre, du dextrose, du glucose, des solides du glucose ou du lactose, ou un mélange quelconque de ces substances; il peut renfermer de la vitamine D ajoutée et doit renfermer au moins
a) 28 pour cent de solides du lait; et
b) huit pour cent de gras de lait.
B.08.010 [N]. Le lait évaporé
a) doit être du lait dont de l’eau a été évaporée;
b) doit contenir au moins
(i) 25,0 pour cent de solides du lait,
(ii) 7,5 pour cent de matière grasse du lait;
c) doit, nonobstant les articles D.01.009 à D.01.011, contenir de la vitamine C ajoutée en quantité telle qu’une ration quotidienne raisonnable du produit laitier contienne au moins 60 milligrammes et au plus 75 milligrammes de vitamine C;
d) une fois reconstitué à son volume original, doit contenir 2 μg de vitamine D par 100 mL;
e) peut renfermer
(i) du phosphate disodique ou du citrate de sodium ajoutés, ou les deux, et
(ii) un agent émulsifiant.
- DORS/78-656, art. 3
- DORS/92-400, art. 2
- DORS/2022-168, art. 26
B.08.011 [N]. Le lait écrémé évaporé ou écrémé concentré
a) doit être un lait qui a été concentré à la moitié au moins de son volume primitif par déshydratation;
b) doit contenir
(i) au plus 0,3 pour cent de gras de lait, et
(ii) au moins 17,0 pour cent de solides du lait autres que le gras;
c) doit, nonobstant les articles D.01.009 et D.01.010, contenir de la vitamine A ajoutée en quantité telle qu’une ration quotidienne raisonnable du produit laitier contienne au moins 1 200 unités internationales et au plus 2 500 unités internationales de vitamine A;
d) doit, nonobstant les articles D.01.009 à D.01.011, contenir de la vitamine C en quantité telle qu’une ration quotidienne raisonnable du produit laitier contienne au moins 60 milligrammes et au plus 75 milligrammes de vitamine C;
e) une fois reconstitué à son volume original, doit contenir 2 μg de vitamine D par 100 mL;
f) peut contenir du phosphate disodique ou du citrate de sodium ajoutés, ou les deux.
B.08.012 [N]. Le lait évaporé partiellement écrémé ou lait concentré partiellement écrémé
a) doit être un lait dont une partie du gras a été enlevé;
b) doit être concentré à la moitié au moins de son volume primitif par déshydratation;
c) doit contenir au moins 17,0 pour cent de solides du lait autres que le gras;
d) doit, nonobstant les articles D.01.009 et D.01.010, contenir de la vitamine A ajoutée en quantité telle qu’une ration quotidienne raisonnable du produit laitier contienne au moins 1 200 unités internationales et au plus 2 500 unités internationales de vitamine A;
e) doit, nonobstant les articles D.01.009 à D.01.011, contenir de la vitamine C ajoutée en quantité telle qu’une ration quotidienne raisonnable du produit laitier contienne au moins 60 milligrammes et au plus 75 milligrammes de vitamine C;
f) une fois reconstitué à son volume original, doit contenir 2 μg de vitamine D par 100 mL;
g) peut contenir
(i) un agent émulsifiant, et
(ii) du phosphate disodique ou du citrate de sodium ajoutés, ou les deux.
B.08.013 [N]. La poudre de lait, la poudre de lait entier, lait entier desséché ou lait entier en poudre
a) doit être du lait desséché;
b) doit renfermer au moins
(i) 95 pour cent de solides du lait, et
(ii) 26 pour cent de gras de lait;
c) une fois reconstitué selon le mode d’emploi, doit contenir 2 μg de vitamine D par 100 mL;
d) peut contenir l’agent émulsifiant lécithine en quantité n’excédant pas 0,5 pour cent.
- DORS/78-656, art. 4
- DORS/83-932, art. 2
- DORS/2022-168, art. 29
B.08.014 [N]. Le lait écrémé en poudre, la poudre de lait écrémé, ou le lait écrémé desséché
a) doivent être du lait écrémé desséché;
b) doivent contenir au moins 95 pour cent des solides du lait;
c) doit, nonobstant les articles D.01.009 et D.01.010, contenir de la vitamine A ajoutée en quantité telle qu’une ration quotidienne raisonnable du produit laitier contienne au moins 1 200 unités internationales et au plus 2 500 unités internationales de vitamine A;
d) une fois reconstitué selon le mode d’emploi, doit contenir 2 μg de vitamine D par 100 mL;
e) peut contenir un agent anti-mousse.
- DORS/78-656, art. 5
- DORS/80-501, art. 2(F)
- DORS/2022-168, art. 30
B.08.014A Est interdite la vente de poudre de lait, de poudre de lait entier, de lait entier desséché, de lait entier en poudre, de poudre de lait écrémé ou de lait écrémé desséché, à moins qu’ils ne soient, selon la méthode officielle MFO-12, Examen microbiologique de la poudre de lait, 30 novembre 1981, trouvés exempts de bactéries du genre Salmonella.
- DORS/78-656, art. 6
- DORS/82-768, art. 15
B.08.015 Est interdite la vente de lait, de lait écrémé, de lait partiellement écrémé, de lait (indication de l’arôme), de lait écrémé (indication de l’arôme), de lait partiellement écrémé (indication de l’arôme), de lait écrémé additionné de solides du lait, de lait partiellement écrémé additionné de solides du lait, de lait écrémé (indication de l’arôme) additionné de solides du lait, de lait partiellement écrémé (indication de l’arôme) additionné de solides du lait, de lait condensé, de lait évaporé, de lait écrémé et évaporé, de lait évaporé partiellement écrémé, de poudre de lait, ou de poudre de lait écrémé, dont la teneur en vitamines a été accrue par irradiation ou par addition, à moins que
a) dans le cas de l’addition de vitamine D, le dissolvant contenant ladite vitamine ne fournisse au lait au plus 0,01 pour cent de gras étranger au lait; et
b) dans les cas où la teneur en vitamine D est accrue par irradiation, l’espace principal de l’étiquette ne porte l’inscription « vitamine D accrue » précédant ou suivant immédiatement le nom de l’aliment sans interposition d’écrit, d’imprimé ou d’illustration.
- DORS/88-336, art. 3
B.08.016 [N]. Le lait (indication de l’arôme)
a) doit être le produit fabriqué
(i) soit exclusivement de lait, de lait en poudre, de lait écrémé, de lait écrémé en poudre, de lait partiellement écrémé, de lait évaporé, de lait évaporé partiellement écrémé, de lait écrémé évaporé ou de crème, soit d’un mélange quelconque de ces produits,
(ii) d’une préparation aromatisante, et
(iii) d’un agent édulcorant;
b) doit renfermer au moins trois pour cent de gras de lait;
c) doit contenir 2 μg de vitamine D par 100 mL;
d) peut contenir du sel, un colorant alimentaire, de la lactase, un agent stabilisant et au plus 0,5 pour cent d’amidon; et
e) peut contenir au plus 50 000 bactéries aérobies totales par centimètre cube, déterminées selon la méthode officielle MFO-7, Examen microbiologique du lait, 30 novembre 1981.
- DORS/78-656, art. 7
- DORS/82-768, art. 16
- DORS/84-762, art. 1
- DORS/2022-168, art. 31
B.08.017 [N]. Le lait écrémé (indication de l’arôme)
a) doit être le produit fabriqué
(i) soit exclusivement de lait écrémé en poudre ou de lait écrémé évaporé, soit d’un mélange quelconque de ces produits,
(ii) d’une préparation aromatisante, et
(iii) d’un agent édulcorant;
b) doit renfermer au plus 0,3 pour cent de gras de lait; et
c) doit, nonobstant les articles D.01.009 et D.01.010, contenir de la vitamine A ajoutée en quantité telle qu’une ration quotidienne raisonnable du produit laitier contienne au moins 1 200 unités internationales et au plus 2 500 unités internationales de vitamine A;
d) doit contenir 2 μg de vitamine D par 100 mL;
e) peut contenir du sel, un colorant alimentaire, de la lactase, un agent stabilisant et au plus 0,5 pour cent d’amidon.
- DORS/78-656, art. 8
- DORS/84-762, art. 2
- DORS/2022-168, art. 32
B.08.018 [N]. Le lait partiellement écrémé (indication de l’arôme) ou le lait en partie écrémé (indication de l’arôme)
a) doit être le produit fabriqué
(i) soit exclusivement de lait, de lait en poudre, de lait écrémé, de lait écrémé en poudre, de lait partiellement écrémé, de lait évaporé, de lait évaporé partiellement écrémé, de lait écrémé évaporé ou de crème, soit d’un mélange quelconque de ces produits,
(ii) d’une préparation aromatisante, et
(iii) d’un agent édulcorant;
b) doit renfermer plus de 0,3 pour cent et moins de trois pour cent de gras de lait;
c) doit, nonobstant les articles D.01.009 et D.01.010, contenir de la vitamine A ajoutée en quantité telle qu’une ration quotidienne raisonnable du produit laitier contienne au moins 1 200 unités internationales et au plus 2 500 unités internationales de vitamine A;
d) doit contenir 2 μg de vitamine D par 100 mL;
e) peut contenir du sel, un colorant alimentaire, de la lactase, un agent stabilisant et au plus 0,5 pour cent d’amidon; et
f) peut contenir au plus 50 000 bactéries aérobies totales par centimètre cube, déterminées selon la méthode officielle MFO-7, Examen microbiologique du lait, 30 novembre 1981.
- DORS/78-656, art. 9
- DORS/82-768, art. 17
- DORS/84-762, art. 3
- DORS/2022-168, art. 33
B.08.019 [N]. Le lait écrémé additionné de solides du lait
a) doit être du lait écrémé auquel a été ajouté du lait écrémé en poudre ou du lait écrémé évaporé, ou les deux;
b) doit renfermer au moins 10 pour cent de solides du lait;
c) doit renfermer au plus 0,3 pour cent de gras de lait;
d) doit, nonobstant les articles D.01.009 et D.01.010, contenir de la vitamine A ajoutée en quantité telle qu’une ration quotidienne raisonnable du produit laitier contienne au moins 1 200 unités internationales et au plus 2 500 unités internationales de vitamine A; et
e) doit contenir 2 μg de vitamine D par 100 mL.
- DORS/78-656, art. 10
- DORS/2022-168, art. 34
B.08.020 [N]. Le lait partiellement écrémé additionné de solides du lait ou le lait en partie écrémé additionné de solides du lait
a) doit être du lait partiellement écrémé auquel a été ajouté du lait écrémé en poudre, du lait en poudre, du lait évaporé, du lait évaporé partiellement écrémé ou du lait écrémé évaporé, ou un mélange quelconque de ces produits;
b) doit renfermer au moins 10 pour cent de solides du lait autres que le gras; et
c) doit, nonobstant les articles D.01.009 et D.01.010, contenir de la vitamine A ajoutée en quantité telle qu’une ration quotidienne raisonnable du produit laitier contienne au moins 1 200 unités internationales et au plus 2 500 unités internationales de vitamine A; et
d) doit contenir 2 μg de vitamine D par 100 mL.
B.08.021 [N]. Le lait malté, le lait malté en poudre ou la poudre de lait malté
a) doit être le produit fabriqué en mélangeant du lait avec le liquide séparé d’un moût de malt d’orge moulue et de farine d’orge;
b) peut renfermer, de manière à assurer la pleine action enzymatique, du sel et du bicarbonate de sodium ou du bicarbonate de potassium ajoutés;
c) peut être débarrassé d’eau; et
d) doit renfermer
(i) au moins 7,5 pour cent de gras de lait, et
(ii) au plus 3,5 pour cent d’humidité.
B.08.022 [N]. Le lait malté (indication de l’arôme) ou lait malté en poudre (indication de l’arôme)
a) doit être du lait malté ou du lait malté en poudre qui renferme une préparation aromatisante; et
b) peut contenir de la lactase.
- DORS/84-762, art. 4
B.08.023 [N]. Le lait écrémé (indication de l’arôme) additionné de solides du lait
a) doit être le produit fabriqué
(i) soit exclusivement de lait écrémé, de lait écrémé en poudre ou de lait écrémé évaporé, soit d’un mélange quelconque de ces produits,
(ii) d’une préparation aromatisante, et
(iii) d’un agent édulcorant;
b) doit renfermer au moins 10 pour cent de solides du lait autres que le gras;
c) doit renfermer au plus 0,3 pour cent de gras de lait;
d) doit, nonobstant les articles D.01.009 et D.01.010, contenir de la vitamine A ajoutée en quantité telle qu’une ration quotidienne raisonnable du produit laitier contienne au moins 1 200 unités internationales et au plus 2 500 unités internationales de vitamine A;
e) doit contenir 2 μg de vitamine D par 100 mL;
f) peut contenir du sel, un colorant alimentaire, de la lactase, un agent stabilisant et au plus 0,5 pour cent d’amidon.
- DORS/78-656, art. 11
- DORS/84-762, art. 5
- DORS/2022-168, art. 36
B.08.024 Est interdite la vente de lait aux fins de la fabrication de produits laitiers, si ce lait renferme plus de
a) deux millions de bactéries aérobies totales par millilitre, déterminées selon la méthode officielle MFO-7, Examen microbiologique du lait, 30 novembre 1981; ou
b) deux milligrammes de sédiments par 16 onces liquides, déterminés selon la méthode officielle MFO-8, Détermination de sédiments dans le lait, 30 novembre 1981.
- DORS/82-768, art. 18
B.08.025 Il est interdit à un fabricant d’acheter du lait aux fins de fabriquer des produits laitiers, et de fabriquer d’autres produits laitiers avec du lait, si le fabricant a lieu de croire que ce lait n’est pas conforme aux dispositions de l’article B.08.024.
B.08.026 [N]. Le lait partiellement écrémé (indication de l’arôme) additionné de solides du lait ou le lait en partie écrémé (indication de l’arôme) additionné de solides du lait
a) doit être le produit fabriqué
(i) soit exclusivement de lait, de lait en poudre, de lait écrémé, de lait écrémé en poudre, de lait partiellement écrémé, de lait évaporé, de lait évaporé partiellement écrémé, de lait écrémé évaporé ou de crème, soit d’un mélange quelconque de ces produits,
(ii) d’une préparation aromatisante, et
(iii) d’un agent édulcorant;
b) doit renfermer au moins 10 pour cent de solides du lait autres que le gras;
c) doit renfermer plus de 0,3 pour cent et moins de trois pour cent de gras de lait;
d) doit, nonobstant les articles D.01.009 et D.01.010, contenir de la vitamine A ajoutée en quantité telle qu’une ration quotidienne raisonnable du produit laitier contienne au moins 1 200 unités internationales et au plus 2 500 unités internationales de la vitamine A;
e) doit contenir 2 μg de vitamine D par 100 mL;
f) peut contenir du sel, un colorant alimentaire, de la lactase, un agent stabilisant et au plus 0,5 pour cent d’amidon; et
g) peut contenir au plus 50 000 bactéries aérobies totales par centimètre cube, déterminées selon la méthode officielle MFO-7, Examen microbiologique du lait, 30 novembre 1981.
- DORS/78-656, art. 12
- DORS/82-768, art. 19
- DORS/84-300, art. 21(F)
- DORS/84-762, art. 6
- DORS/2022-168, art. 37
B.08.027 Il n’est pas obligatoire d’ajouter des vitamines aux produits laitiers suivants qui sont utilisés ou vendus pour la fabrication d’autres produits alimentaires : lait; lait partiellement écrémé; lait en partie écrémé; lait écrémé; lait stérilisé; lait évaporé; lait écrémé évaporé; lait écrémé concentré; lait évaporé partiellement écrémé; lait concentré partiellement écrémé; la poudre de lait; lait entier desséché; lait entier en poudre; la poudre de lait écrémé; lait écrémé desséché; la poudre de lait partiellement écrémé; la poudre de lait en partie écrémé; lait écrémé additionné de solides du lait; lait partiellement écrémé additionné de solides du lait et lait en partie écrémé additionné de solides du lait.
- DORS/78-656, art. 13
B.08.028 (1) Doit être indiqué sur l’espace principal et être suivi de l’expression « matière grasse du lait » ou de l’abréviation « M.G. » le pourcentage de matière grasse contenue dans
a) le lait (nom de l’arôme);
b) le lait partiellement écrémé (nom de l’arôme);
c) le lait partiellement écrémé additionné de solides du lait (nom de l’arôme);
d) la crème;
e) la crème sure.
(2) En plus de la mention exigée au paragraphe (1), il peut être indiqué sur l’étiquette d’un aliment mentionné à ce paragraphe sa teneur en matières grasses exprimée en grammes par portion indiquée.
- DORS/79-23, art. 10
- DORS/88-559, art. 16
- DORS/2010-94, art. 3(F)
- DORS/2016-305, art. 75(F)
Lait de chèvre
B.08.028.1 La sécrétion lactée des glandes mammaires de tout animal autre que la vache, genre Bos, de même que tout produit ou dérivé de cette sécrétion doivent être étiquetés de façon qu’il soit fait mention du nom de l’animal.
- DORS/85-623, art. 2
B.08.029 (1) Il est interdit de vendre du lait de chèvre ou du lait de chèvre en poudre additionnés de vitamine D, à moins qu’ils ne contiennent 2 μg de vitamine D par 100 mL de l’aliment prêt à servir.
(2) Il est interdit de vendre du lait de chèvre partiellement écrémé, du lait de chèvre écrémé, du lait de chèvre partiellement écrémé en poudre ou du lait de chèvre écrémé en poudre additionnés de vitamine A ou D, à moins qu’ils ne contiennent, par 100 mL de l’aliment prêt à servir, ces deux vitamines dans les quantités suivantes :
a) au moins 140 U.I. et au plus 300 U.I. de vitamine A;
b) 2 μg de vitamine D.
(3) Il est interdit de vendre du lait de chèvre concentré additionné de toute vitamine ci-après, à moins qu’il ne contienne, par 100 mL de l’aliment reconstitué à son volume original, chacune de ces vitamines dans les quantités suivantes :
a) au moins 7 mg et au plus 9 mg de vitamine C;
b) 2 μg de vitamine D;
c) au moins 10 μg et au plus 20 μg d’acide folique.
(4) Il est interdit de vendre du lait de chèvre concentré partiellement écrémé ou du lait de chèvre concentré écrémé additionnés de toute vitamine ci-après, à moins qu’ils ne contiennent, par 100 mL de l’aliment reconstitué à son volume original, chacune de ces vitamines dans les quantités suivantes :
a) au moins 140 U.I. et au plus 300 U.I. de vitamine A;
b) au moins 7 mg et au plus 9 mg de vitamine C;
c) 2 μg de vitamine D;
d) au moins 10 μg et au plus 20 μg d’acide folique.
- DORS/85-623, art. 2
- DORS/2022-168, art. 38
Fromage
B.08.030 (1) Dans le présent titre, lorsqu’il s’agit de fromage,
- cornichons et achards
cornichons et achards désigne les aliments qui répondent à la norme prescrite à l’article B.11.051; (pickles and relishes)
- entier
entier se dit du produit ayant conservé la grosseur et la forme primitives qu’il avait lors de sa fabrication; (whole)
- entreposé
entreposé se dit du produit conservé à une température d’au moins 2 °C durant 60 jours ou plus après la date du début de la fabrication; (stored)
- matière première pasteurisée
matière première pasteurisée désigne le lait, le lait écrémé, la crème, le lait reconstitué à partir de sa poudre, le lait écrémé reconstitué à partir de sa poudre ou un mélange de ces produits, qui a été pasteurisé à une température d’au moins 61,6 °C durant une période minimale de 30 minutes, ou à une température et durant une période équivalentes dans le cas de la destruction de la phosphatase, déterminées selon la méthode officielle MFO-3, Détermination de l’activité phosphatasique des produits laitiers, 30 novembre 1981; (pasteurized source)
- produit laitier
produit laitier[Abrogée, DORS/92-400, art. 3]
(2) Dans le texte anglais des règlements, le mot « process » peut être utilisé au lieu du mot « processed » dans les noms usuels suivants : processed (naming the variety) cheese, processed (naming the variety) cheese with (naming the added ingredients), processed cheese food, processed cheese food with (naming the added ingredients), processed cheese spread, and processed cheese spread with (naming the added ingredients).
- DORS/79-752, art. 2
- DORS/82-768, art. 20
- DORS/92-400, art. 3
B.08.031 Un fromage fabriqué avec du lait qui est le produit de la sécrétion lactée normale des glandes mammaires d’animaux autres que les vaches genre Bos doit
a) être conforme à toutes les exigences du présent titre s’appliquant à la variété; et
b) porter l’origine du lait sur l’espace principal de son étiquette.
- DORS/79-752, art. 2
B.08.032 (1) Pour chacun des aliments suivants à l’égard desquels une norme est prescrite, à savoir
a) le fromage (indication de la variété),
b) le fromage cheddar,
c) le fromage à la crème,
d) le fromage de petit-lait,
e) le fromage de petit-lait (indication de la variété),
f) le fromage à la crème (avec indication des ingrédients ajoutés),
g) le fromage à la crème à tartiner,
h) le fromage à la crème à tartiner (avec indication des ingrédients ajoutés),
i) le fromage fondu (indication de la variété),
j) le fromage fondu (indication de la variété) (avec indication des ingrédients ajoutés),
k) une préparation de fromage fondu,
l) une préparation de fromage fondu (avec indication des ingrédients ajoutés),
m) le fromage fondu à tartiner,
n) le fromage fondu à tartiner (avec indication des ingrédients ajoutés),
o) le fromage conditionné à froid (indication de la variété),
p) le fromage conditionné à froid (indication de la variété) (avec indication des ingrédients ajoutés),
q) une préparation de fromage conditionné à froid, et
r) une préparation de fromage conditionné à froid (avec indication des ingrédients ajoutés),
il doit être indiqué, dans l’espace principal de l’étiquette, le pourcentage de matière grasse de lait suivi soit de l’expression « matière grasse de lait », soit de l’abréviation « M.G. », ainsi que le pourcentage d’humidité de l’aliment suivi soit du mot « humidité », soit du mot « eau ».
(2) Sous réserve du paragraphe (3), est interdite sur l’étiquette d’un aliment visé au paragraphe (1) toute mention expresse ou implicite de la teneur en matière grasse de lait ou de la teneur en humidité qui n’est pas conforme au paragraphe (1).
(3) En plus des mentions exigées au paragraphe (1), il peut être indiqué sur l’étiquette d’un aliment mentionné à ce paragraphe sa teneur en matières grasses exprimée en grammes par portion indiquée.
- DORS/79-752, art. 2
- DORS/88-559, art. 17
- DORS/94-689, art. 2(A)
- DORS/2010-94, art. 8(A)
- DORS/2016-305, art. 75(F)
B.08.033 (1) [N]. Le fromage (indication de la variété) autre que le fromage cheddar, le fromage à la crème, le fromage de petit-lait, le fromage à la crème (avec indication des ingrédients ajoutés), le fromage à la crème à tartiner, le fromage à la crème à tartiner (avec indication des ingrédients ajoutés), le fromage fondu (indication de la variété), le fromage fondu (indication de la variété) (avec indication des ingrédients ajoutés), une préparation de fromage fondu, une préparation de fromage fondu (avec indication des ingrédients ajoutés), le fromage fondu à tartiner, le fromage fondu à tartiner (avec indication des ingrédients ajoutés), le fromage conditionné à froid (indication de la variété), le fromage conditionné à froid (indication de la variété) (avec indication des ingrédients ajoutés), une préparation de fromage conditionné à froid, une préparation de fromage conditionné à froid (avec indication des ingrédients ajoutés), le fromage cottage et le fromage cottage en crème,
a) doit
(i) être le produit de la coagulation, à l’aide de bactéries, de lait, de produits du lait ou d’un mélange de ceux-ci, en vue de former, après égouttement du petit-lait, une masse homogène de caillé,
(i.1) sauf pour le fromage Féta, avoir une teneur en caséine dérivée du lait ou du lait ultrafiltré, du lait partiellement écrémé, du lait partiellement écrémé ultrafiltré, du lait écrémé, du lait écrémé ultrafiltré ou de la crème, plutôt que de tout autre produit du lait, au moins équivalente aux pourcentages ci-après de la teneur totale en protéines du fromage :
(A) 63 %, dans le cas du fromage Pizza mozzarella ou Pizza mozzarella partiellement écrémé,
(B) 83 %, dans le cas du fromage de lait écrémé, Brick, Brick canadien, Colby, Farmer’s, Jack, Monterey (Monterey Jack), Mozzarella (Scamorza), Mozzarella partiellement écrémé (Scamorza partiellement écrémé), Munster canadien, Pizza partiellement écrémé ou Pizza et des autres variétés de fromage non mentionnées aux divisions (A) ou (C),
(C) 95 %, dans le cas des autres variétés de fromage visées au tableau du présent article,
(i.2) avoir un rapport protéines de petit-lait à la caséine qui ne dépasse pas celui du lait,
(ii) posséder les propriétés physiques, chimiques et organoleptiques typiques de la variété,
(iii) s’il s’agit d’une variété de fromage nommée dans le tableau du présent article, ne pas contenir plus que le pourcentage maximal d’humidité indiqué pour cette variété dans la colonne II de ce tableau,
(iv) s’il s’agit d’une variété de fromage nommée dans la partie I du tableau du présent article, contenir au moins le pourcentage minimal de matière grasse de lait indiqué pour cette variété dans la colonne III de ce tableau, et
(v) s’il s’agit d’une variété de fromage nommée dans la partie II du tableau du présent article, ne pas contenir plus que le pourcentage maximal de matière grasse de lait indiqué pour cette variété dans la colonne III de ce tableau; et
b) peut contenir
(i) du sel, des assaisonnements, des condiments et des épices,
(ii) des préparations aromatisantes autres que les aromatisants de fromage,
(iii) des micro-organismes favorisant l’affinage,
(iv) les colorants suivants :
(A) en quantité conforme aux bonnes pratiques industrielles, le rocou, le ß-carotène, la chlorophylle, le paprika, la riboflavine, le curcuma,
(B) en quantité n’excédant pas 35 parties par million, le ß-apo-8′-caroténal, l’ester éthylique de l’acide ß-apo-8′-caroténoïque ou un mélange de ces produits, et
(C) en quantité n’excédant pas 0,10 partie par million, le bleu brillant FCF seulement dans le Feta,
(v) du chlorure de calcium comme agent raffermissant, en quantité n’excédant pas 0,02 pour cent du lait et des produits du lait utilisés,
(vi) de la cire de paraffine comme enrobage, en quantité conforme aux bonnes pratiques industrielles,
(vii) en quantité n’excédant pas 50 parties par million, des résidus de nitrate de potassium, de nitrate de sodium ou d’un mélange de ces produits utilisés aux fins et de la manière prévues au paragraphe (2),
(viii) de la fumée de bois comme agent de conservation, en quantité conforme aux bonnes pratiques industrielles,
(ix) les agents de conservation suivants :
(A) l’acide propionique, le propionate de calcium, le propionate de sodium ou un mélange de ces produits, en quantité n’excédant pas 2 000 parties par million, calculée en acide propionique,
(B) l’acide sorbique, le sorbate de calcium, le sorbate de potassium, le sorbate de sodium, ou un mélange de ces produits, en quantité n’excédant pas 3 000 parties par million, calculée en acide sorbique,
(C) un mélange des agents de conservation visés aux dispositions (A) et (B), en quantité n’excédant pas 3 000 parties par million, calculée respectivement en acide propionique et en acide sorbique, ou
(D) la natamycine appliquée à la surface du fromage, en une quantité n’excédant pas 20 parties par million ou, si le fromage est râpé fin ou en filaments, 10 parties par million,
(x) s’il est râpé fin ou en filaments, du silicate de calcium, de la cellulose microcristalline, de la cellulose ou un mélange de ces produits, utilisé comme agent anti-agglomérant, en quantité totale n’excédant pas 2,0 pour cent,
(xi) du dioxyde de carbone comme rajusteur du pH dans le lait pour la fabrication du fromage, en quantité conforme aux bonnes pratiques industrielles.
(1.1) Le fromage d’une variété visée à la colonne I de la partie I du tableau du présent article peut contenir plus que le pourcentage maximal d’humidité indiqué dans la colonne II et moins que le pourcentage minimal de matière grasse du lait indiqué dans la colonne III, si les conditions suivantes sont réunies :
a) la mention ou l’allégation figurant à la colonne 4 de l’un des articles 12 à 14, 16, 20, 21 et 45 du Tableau des mentions et des allégations autorisées concernant la teneur nutritive est indiquée sur l’étiquette du produit dans le nom usuel de celui-ci;
b) le fromage a la saveur et la texture caractéristiques de la variété de fromage visée.
(1.2) La mention « 83 % » dans la division (1)a)(i.1)(B) vaut mention de « 78 % » et la mention « 95 % » dans la division (1)a)(i.1)(C) vaut mention de « 90 % », dans le cas des variétés de fromage visées, si les conditions suivantes sont réunies :
a) la mention ou l’allégation figurant à la colonne 4 de l’un des articles 12 à 14, 16, 20, 21 et 45 du Tableau des mentions et des allégations autorisées concernant la teneur nutritive est indiquée sur l’étiquette du produit dans le nom usuel de celui-ci;
b) le fromage a la saveur et la texture caractéristiques de la variété de fromage visée.
(2) Le nitrate de potassium, le nitrate de sodium ou un mélange de ces produits peuvent être utilisés comme agents de conservation dans le fromage, pourvu que
a) la quantité de sel ou le mélange de sels ne dépasse pas 200 parties par million du lait et des produits du lait utilisés;
b) le fromage soit
(i) du fromage affiné aux moisissures conservé dans un contenant hermétique, ou
(ii) du fromage affiné
(A) qui contient au plus 68 pour cent d’humidité à l’état dégraissé, et
(B) dont la fermentation lactique et la salaison ont été faites plus de 12 heures après la coagulation du caillé par enzymes; et
c) la salaison soit, dans le cas du fromage visé au sous-alinéa b)(ii), appliquée à l’extérieur du fromage sous forme de sel ou de saumure.
(3) Il est interdit d’utiliser un enzyme qui n’est pas compris parmi les suivants :
a) l’aminopeptidase provenant de Lactococcus lactis, la chymosine A provenant de Escherichia coli K-12, GE81 (pPFZ87A), la chymosine B provenant de Aspergillus niger var. awamori, GCC0349 (pGAMpR) ou de Kluyveromyces marxianus var. lactis, DS1182 (pKS105), l’enzyme coagulant le lait provenant de Rhizomucor miehei (Cooney et Emerson) (précédemment nommé Mucor miehei (Cooney et Emerson)), de Mucor pusillus Lindt par fermentation de culture pure ou de Aspergillus oryzae RET-1 (pBoel777), la lipase provenant de Aspergillus niger var.; Aspergillus oryzae var.; Rhizopus oryzae var.; Tissus comestibles des préestomacs d’agneaux, de chevreaux ou de veaux; Tissus pancréatiques d’animaux ou de Aspergillus oryzae (MLT-2) (pRML 787) (p3SR2); Rhizomucor miehei (Cooney et Emerson) (précédemment nommé Mucor miehei (Cooney et Emerson)); Rhizopus niveus, la pepsine provenant de la muqueuse glandulaire de l’estomac de porc, la phospholipase provenant de Aspergillus oryzae (pPFJo142), la présure provenant de l’extrait aqueux du 4e (véritable) estomac de veaux, de chevreaux ou d’agneaux, la présure de bovin provenant de l’extrait aqueux du 4e (véritable) estomac de bovins, de moutons et de chèvres adultes et la protéase provenant de Micrococcus caseolyticus var., dans la fabrication d’un fromage visé au paragraphe (1);
b) [Abrogé, DORS/2010-143, art. 1]
c) l’enzyme coagulant le lait provenant d’Endothia parasitica et les enzymes mentionnés à l’alinéa a) dans la fabrication du fromage Emmentaler (Emmenthal, suisse), du fromage Mozzarella (Scamorza) et du fromage Mozzarella partiellement écrémé (Scamorza partiellement écrémé);
d) l’enzyme coagulant le lait provenant d’Endothia parasitica et les enzymes mentionnés à l’alinéa a), dans la fabrication du fromage Parmesan et du fromage Romano;
e) la protéase provenant d’Aspergillusoryzae var., Aspergillus niger var. ou Bacillus subtilis var., dans la fabrication du fromage Colby;
f) le lysozyme provenant de blanc d’oeuf.
(3.1) Il est interdit d’utiliser une enzyme visée au paragraphe (3) en quantité supérieure à celle conforme aux bonnes pratiques industrielles.
(4) Lorsqu’une préparation aromatisante, autre qu’une préparation aromatisante habituellement utilisée dans la variété de fromage, est ajoutée à un fromage conformément au paragraphe (1), l’expression « (avec indication de la préparation aromatisante) » doit être ajoutée au nom usuel sur l’étiquette.
(5) L’étiquette d’un fromage ne doit porter le terme « fumé » que si de la fumée de bois a été ajoutée au fromage conformément au paragraphe (1).
(6) Dans les cas visés au paragraphe (5), le terme « fumé » doit paraître dans l’espace principal de l’étiquette.
TABLEAU
PARTIE I
Article Colonne I Colonne II Colonne III Variété de fromage Pourcentage maximal d’humidité Pourcentage minimal de matière grasse du lait 1 Asiago 40,0 30,0 2 Petit Édam 47,0 21,0 3 Petit Gouda 45,0 26,0 4 Bleu 47,0 27,0 5 Fromage beurre (Butterkäse) 46,0 27,0 6 Bra 36,0 26,0 7 Brick 42,0 29,0 8 Brie 54,0 23,0 9 Caciocavallo 45,0 24,0 10 Camembert (Carré de l’est) 56,0 22,0 11 Brick canadien 42,0 29,0 12 Munster canadien 46,0 27,0 13 Colby 42,0 29,0 14 Danbo 46,0 25,0 15 Édam 46,0 22,0 16 Elbo 46,0 25,0 17 Emmenthal (Suisse) 40,0 27,0 18 Esrom 50,0 23,0 19 Farmer’s 44,0 27,0 20 Féta 55,0 22,0 21 Fontina 46,0 27,0 22 Fynbo 46,0 25,0 23 Gouda 43,0 28,0 24 Gournay 55,0 33,0 25 Gruyère 38,0 28,0 26 Havarti 50,0 23,0 27 Jack 50,0 25,0 28 Kasseri 44,0 25,0 29 Limburger 50,0 25,0 30 Maribo 43,0 26,0 31 Montasio 40,0 28,0 32 Monterey (Monterey Jack) 44,0 28,0 33 Mozzarella (Scamorza) 52,0 20,0 34 Muenster (Munster) 50,0 25,0 35 Neufchâtel 60,0 20,0 36 Parmesan 32,0 22,0 37 Mozzarella partiellement écrémé (Scamorza partiellement écrémé) 52,0 15,0 38 Pizza partiellement écrémé 48,0 15,0 38.1 Pizza mozzarella partiellement écrémé 61,0 11,0 39 Pizza 48,0 20,0 39.1 Pizza mozzarella 58,0 15,0 40 Provolone 45,0 24,0 41 Romano (Sardo) 34,0 25,0 42 St. Jorge 40,0 27,0 43 Saint-Paulin 50,0 25,0 44 Samsoë 44,0 26,0 45 Tilsiter (Tilsit) 45,0 25,0 46 Tybo 46,0 25,0 PARTIE II
Article Colonne I Colonne II Colonne III Variété de fromage Pourcentage maximal d’humidité Pourcentage maximal de matière grasse du lait 1 Harzkase (Harzer Käse, Mainzer Käse) 55,0 3,0 2 Lait écrémé 55,0 7,0
- DORS/79-752, art. 2
- DORS/80-632, art. 2
- DORS/82-383, art. 2 et 3
- DORS/82-566, art. 1
- DORS/84-302, art. 1
- DORS/86-89, art. 2
- DORS/87-640, art. 3
- DORS/88-534, art. 2
- DORS/89-198, art. 1
- DORS/90-469, art. 1
- DORS/91-88, art. 1
- DORS/92-197, art. 1
- DORS/92-400, art. 4
- DORS/93-477, art. 1
- DORS/94-212, art. 1
- DORS/94-417, art. 1
- DORS/95-183, art. 1
- DORS/97-191, art. 1
- DORS/98-458, art. 2
- DORS/2000-336, art. 1
- DORS/2000-353, art. 4
- DORS/2000-417, art. 2
- DORS/2001-94, art. 1
- DORS/2005-98, art. 7
- DORS/2007-302, art. 2 et 4(F)
- DORS/2010-94, art. 8(A)
- DORS/2010-143, art. 1 et 39(A)
- DORS/2012-43, art. 2(F)
- DORS/2022-168, art. 52
B.08.034 (1) [N]. Le fromage cheddar
a) doit
(i) être le produit de la coagulation — à l’aide de bactéries — du lait, de produits du lait ou d’un mélange de ceux-ci, en vue de former un caillé soumis par la suite soit au procédé cheddar, soit à tout autre procédé qui donne du fromage possédant les mêmes propriétés physiques, chimiques et organoleptiques que le fromage produit par le procédé cheddar,
(i.1) avoir une teneur en caséine dérivée du lait ou du lait ultrafiltré, du lait partiellement écrémé, du lait partiellement écrémé ultrafiltré, du lait écrémé, du lait écrémé ultrafiltré ou de la crème, plutôt que de tout autre produit du lait, d’au moins 83 % de la teneur totale en protéines du fromage,
(i.2) avoir un rapport protéines de petit-lait à la caséine qui ne dépasse pas celui du lait,
(ii) contenir
(A) au plus 39 pour cent d’humidité, et
(B) au moins 31 pour cent de matière grasse de lait, et
b) peut contenir
(i) du sel,
(ii) des préparations aromatisantes autres que les aromatisants de fromage,
(iii) des cultures bactériennes favorisant l’affinage,
(iv) les colorants suivants :
(A) en quantité conforme aux bonnes pratiques industrielles, le rocou, le ß-carotène, la chlorophylle, le paprika, la riboflavine, le curcuma, et
(B) en quantité n’excédant pas 35 parties par million, le ß-apo-8′-caroténal, l’ester éthylique de l’acide ß-apo-8′-caroténoïque ou un mélange de ces produits,
(v) du chlorure de calcium comme agent raffermissant, en quantité n’excédant pas 0,02 pour cent du lait et des produits du lait utilisés,
(vi) de la fumée de bois comme agent de conservation, en quantité conforme aux bonnes pratiques industrielles,
(vii) les agents de conservation suivants :
(A) l’acide propionique, le propionate de calcium, le propionate de sodium ou un mélange de ces produits, en quantité n’excédant pas 2 000 parties par million, calculée en acide propionique,
(B) l’acide sorbique, le sorbate de calcium, le sorbate de potassium, le sorbate de sodium, ou un mélange de ces produits, en quantité n’excédant pas 3 000 parties par million, calculée en acide sorbique,
(C) un mélange des agents de conservation visés aux dispositions (A) et (B), en quantité n’excédant pas 3 000 parties par million, calculée respectivement en acide propionique et en acide sorbique, ou
(D) la natamycine appliquée à la surface du fromage, en une quantité n’excédant pas 20 parties par million ou, si le fromage est râpé fin ou en filaments, 10 parties par million,
(viii) s’il est râpé fin ou en filaments, du silicate de calcium, de la cellulose microcristalline, de la cellulose ou un mélange de ces produits, utilisé comme agent anti-agglomérant, en quantité totale n’excédant pas 2,0 pour cent.
c) ne peut être étiqueté et annoncé comme étant un fromage cheddar qui a été vieilli que s’il remplit les conditions suivantes :
(i) il est fait uniquement de lait, de lait ultrafiltré, de lait partiellement écrémé, de lait partiellement écrémé ultrafiltré, de lait écrémé, de lait écrémé ultrafiltré, de crème ou d’un mélange de ceux-ci,
(ii) il a été vieilli pendant au moins neuf mois et la période pendant laquelle il a été vieilli est mentionnée sur l’espace principal de l’étiquette ou dans l’annonce.
(1.1) Le fromage cheddar peut contenir plus que le pourcentage maximal d’humidité prévu à la division (1)a)(ii)(A) et moins que le pourcentage minimal de matière grasse de lait prévu à la division (1)a)(ii)(B), si les conditions suivantes sont réunies :
a) la mention ou l’allégation figurant à la colonne 4 de l’un des articles 12 à 14, 16, 20, 21 et 45 du Tableau des mentions et des allégations autorisées concernant la teneur nutritive est indiquée sur l’étiquette du produit dans le nom usuel de celui-ci;
b) le fromage a la saveur et la texture caractéristiques du fromage cheddar.
(1.2) la mention « 83 % » au sous-alinéa (1)a)(i.1) vaut mention de « 78 % », si les conditions suivantes sont réunies :
a) la mention ou l’allégation figurant à la colonne 4 de l’un des articles 12 à 14, 16, 20, 21 et 45 du Tableau des mentions et des allégations autorisées concernant la teneur nutritive est indiquée sur l’étiquette du produit dans le nom usuel de celui-ci;
b) le fromage a la saveur et la texture caractéristiques du fromage cheddar.
(2) Dans la fabrication du fromage cheddar, il est interdit d’utiliser une enzyme qui n’est pas comprise parmi les suivantes :
a) l’aminopeptidase provenant de Lactococcus lactis, la chymosine A provenant de Escherichia coli K-12, GE81 (pPFZ87A), la chymosine B provenant de Aspergillus niger var. awamori, GCC0349 (pGAMpR) ou de Kluyveromyces marxianus var. lactis, DS1182 (pKS105), l’enzyme coagulant le lait provenant de Rhizomucor miehei (Cooney et Emerson) (précédemment nommé Mucor miehei (Cooney et Emerson)), de Mucor pusillus Lindt par fermentation de culture pure ou de Aspergillus oryzae RET-1 (pBoel777), la lipase provenant de Aspergillus niger var.; Aspergillus oryzae var.; Rhizopus oryzae var.; Tissus comestibles des préestomacs d’agneaux, de chevreaux ou de veaux; Tissus pancréatiques d’animaux ou de Aspergillus oryzae (MLT-2) (pRML 787) (p3SR2); Rhizomucor miehei (Cooney et Emerson) (précédemment nommé Mucor miehei (Cooney et Emerson)); Rhizopus niveus, la pepsine provenant de la muqueuse glandulaire de l’estomac de porc, la phospholipase provenant de Aspergillus oryzae (pPFJo142) et la présure provenant de l’extrait aqueux du 4e (véritable) estomac de veaux, de chevreaux ou d’agneaux;
b) la protéase provenant d’Aspergillus oryzae;
c) le lysozyme provenant de blanc d’oeuf.
(2.1) Il est interdit d’utiliser une enzyme visée au paragraphe (2) en quantité supérieure à celle conforme aux bonnes pratiques industrielles.
(3) Lorsqu’une préparation aromatisante est ajoutée à un fromage conformément au paragraphe (1), l’expression « (avec indication de la préparation aromatisante) » doit être ajoutée au nom usuel sur l’étiquette.
(4) L’étiquette d’un fromage ne doit porter le terme « fumé » que si de la fumée de bois a été ajoutée au fromage conformément au paragraphe (1).
(5) Dans les cas visés au paragraphe (4), le terme « fumé » doit paraître dans l’espace principal de l’étiquette.
- DORS/79-752, art. 2
- DORS/82-383, art. 4
- DORS/83-617, art. 1
- DORS/84-302, art. 2
- DORS/84-762, art. 7
- DORS/88-534, art. 3
- DORS/89-244, art. 1
- DORS/90-469, art. 2
- DORS/91-88, art. 2
- DORS/92-197, art. 2
- DORS/93-477, art. 2
- DORS/94-212, art. 2
- DORS/95-183, art. 2
- DORS/97-191, art. 2
- DORS/98-458, art. 3
- DORS/2000-336, art. 2
- DORS/2000-417, art. 3
- DORS/2005-98, art. 7
- DORS/2007-302, art. 3 et 4(F)
- DORS/2010-143, art. 2 et 39(A)
- DORS/2012-43, art. 3(F)
- DORS/2022-168, art. 52
B.08.035 (1) [N]. Le fromage à la crème
a) doit
(i) être le produit de la coagulation de la crème à l’aide de bactéries, en vue de former, après égouttement du petit-lait, une masse homogène de caillé, et
(ii) contenir
(A) au plus 55 pour cent d’humidité, et
(B) au moins 30 pour cent de matière grasse de lait; et
b) peut contenir
(i) de la crème ajoutée pour modifier la teneur en matière grasse de lait,
(ii) du sel,
(iii) de l’azote pour améliorer la tartinabilité, en quantité conforme aux bonnes pratiques industrielles,
(iv) les agents émulsifiants, gélatinisants, stabilisants et épaississants qui suivent :
en quantité ne dépassant pas 0,5 pour cent, la carragénine d’ammonium, la carragénine de calcium, la gomme de caroube (fève de l’acacia vulgaire ou faux acacia), la carragénine, la gélatine, la gomme de guar, la gélose de mousse d’Irlande, la carragénine de potassium, l’alginate de propylèneglycol, la carboxyméthylcellulose sodique (carboxyméthylcellulose, gomme de cellulose, glycolate sodique de cellulose), la carragénine sodique, la gomme adragante, la gomme xanthane ou un mélange de ces produits, et
(v) les agents de conservation suivants :
(A) l’acide propionique, le propionate de calcium, le propionate de sodium ou un mélange de ces produits, en quantité n’excédant pas 2 000 parties par million, calculée en acide propionique,
(B) l’acide sorbique, le sorbate de calcium, le sorbate de potassium, le sorbate de sodium ou un mélange de ces produits, en quantité n’excédant pas 3 000 parties par million, calculée en acide sorbique, ou
(C) un mélange des agents de conservation visés aux dispositions (A) et (B), en quantité n’excédant pas 3 000 parties par million, calculée respectivement en acide propionique et en acide sorbique.
(2) Il est interdit d’utiliser un enzyme
a) autre que la chymosine A provenant de Escherichia coli K-12, GE81 (pPFZ87A), la chymosine B provenant de Aspergillus niger var. awamori, GCC0349 (pGAMpR) ou de Kluyveromyces marxianus var. lactis, DS1182 (pKS 105), la pepsine provenant de la muqueuse glandulaire de l’estomac de porc ou la présure provenant de l’extrait aqueux du 4e (véritable) estomac de veaux, de chevreaux ou d’agneaux, dans la fabrication du fromage à la crème;
b) en quantité supérieure à ce qui est conforme aux bonnes pratiques industrielles.
- DORS/79-752, art. 2
- DORS/92-197, art. 3
- DORS/94-212, art. 3
- DORS/95-183, art. 3
- DORS/2010-143, art. 3
B.08.036 (1) [N]. Le fromage de petit-lait ou le fromage de petit-lait (indication de la variété)
a) doit être le produit de la coagulation, à l’aide d’une source de chaleur, du petit-lait ou du petit-lait concentré en vue de former un caillé auquel une forme est donnée; et
b) peut contenir
(i) des micro-organismes favorisant l’affinage,
(ii) du lait et des produits du lait ajoutés, et
(iii) en quantité conforme aux bonnes pratiques industrielles, de l’acide acétique, de l’acide citrique, de l’acide lactique, de l’acide malique, de l’acide phosphorique, de l’acide tartrique, du bicarbonate de potassium, du bicarbonate de sodium, du carbonate de calcium, du carbonate de potassium, du carbonate de sodium et de l’hydroxyde de sodium comme rajusteurs du pH.
(2) Il est interdit d’utiliser, pour favoriser la coagulation du petit-lait dans la fabrication du fromage de petit-lait, une substance autre que du vinaigre ou du petit-lait sûr.
- DORS/79-752, art. 2
- DORS/2007-302, art. 4(F)
- DORS/2010-142, art. 5
B.08.037 (1) [N]. Le fromage à la crème (avec indication des ingrédients ajoutés)
a) doit
(i) être le produit de la coagulation de la crème à l’aide de bactéries, en vue de former, après égouttement du petit-lait, une masse homogène de caillé,
(ii) contenir, en quantité suffisante pour pouvoir se distinguer du fromage à la crème, tout en conservant sa nature fondamentale, les ingrédients suivants :
(A) du fromage autre que du fromage à la crème,
(B) des assaisonnements, du chocolat, des condiments, des épices ou des préparations aromatisantes,
(C) des achards, des cornichons, des fruits, des légumes ou des noix,
(D) de la viande préparée ou conservée, ou
(E) du poisson préparé ou conservé, et
(iii) contenir
(A) au plus 60 pour cent d’humidité, et
(B) au moins 26 pour cent de matière grasse de lait; et
b) peut contenir
(i) de la crème ajoutée pour modifier la teneur en matière grasse de lait,
(ii) du sel,
(iii) de l’azote pour améliorer la tartinabilité, en une quantité conforme aux bonnes pratiques industrielles,
(iv) les colorants suivants :
(A) en quantité conforme aux bonnes pratiques industrielles, le rocou, le ß-carotène, la chlorophylle, le paprika, la riboflavine, le curcuma, et
(B) en quantité n’excédant pas 35 parties par million, le ß-apo-8′-caroténal, l’ester éthylique de l’acide ß-apo-8′-caroténoïque ou un mélange de ces produits,
(v) les agents émulsifiants, gélatinisants, stabilisants et épaississants qui suivent :
en quantité ne dépassant pas 0,5 pour cent, la carragénine d’ammonium, la carragénine de calcium, la gomme de caroube (fève de l’acacia vulgaire ou faux acacia), la carragénine, la gélatine, la gomme de guar, la gélose de mousse d’Irlande, la carragénine de potassium, l’alginate de propylèneglycol, la carboxyméthylcellulose sodique (carboxyméthylcellulose, gomme de cellulose glycolate sodique de cellulose), la carragénine sodique, la gomme adragante, la gomme xanthane ou un mélange de ces produits, et
(vi) les agents de conservation suivants :
(A) l’acide propionique, le propionate de calcium, le propionate de sodium ou un mélange de ces produits, en quantité n’excédant pas 2 000 parties par million, calculée en acide propionique,
(B) l’acide sorbique, le sorbate de calcium, le sorbate de potassium, le sorbate de sodium ou un mélange de ces produits, en quantité n’excédant pas 3 000 parties par million, calculée en acide sorbique, ou
(C) un mélange des agents de conservation visés aux dispositions (A) et (B), en quantité n’excédant pas 3 000 parties par million, calculée respectivement en acide propionique et en acide sorbique.
(2) Il est interdit d’utiliser un enzyme
a) autre que la chymosine A provenant de Escherichia coli K-12, GE81 (pPFZ87A), la chymosine B provenant de Aspergillus niger var. awamori, GCC0349 (pGAMpR) ou de Kluyveromyces marxianus var. lactis, DS1182 (pKS 105), la pepsine provenant de la muqueuse glandulaire de l’estomac de porc ou la présure provenant de l’extrait aqueux du 4e (véritable) estomac de veaux, de chevreaux ou d’agneaux, dans la fabrication d’un produit visé au paragraphe (1);
b) en quantité supérieure à ce qui est conforme aux bonnes pratiques industrielles.
- DORS/79-752, art. 2
- DORS/92-197, art. 4
- DORS/94-212, art. 4
- DORS/95-183, art. 4
- DORS/2010-143, art. 4
- DORS/2011-278, art. 2
B.08.038 (1) [N]. Le fromage à la crème à tartiner
a) doit
(i) être le produit de la coagulation de la crème à l’aide de bactéries, en vue de former, après égouttement du petit-lait, une masse homogène de caillé, et
(ii) contenir
(A) du lait et des produits du lait ajoutés,
(B) au moins 51 pour cent de fromage à la crème,
(C) au plus 60 pour cent d’humidité, et
(D) au moins 24 pour cent de matière grasse de lait; et
b) peut contenir
(i) de la crème ajoutée pour modifier la teneur en matière grasse de lait,
(ii) du sel, du vinaigre et des agents édulcorants,
(iii) de l’azote pour améliorer la tartinabilité, en quantité conforme aux bonnes pratiques industrielles,
(iv) les colorants suivants :
(A) en quantité conforme aux bonnes pratiques industrielles, le rocou, le ß-carotène, la chlorophylle, le paprika, la riboflavine, le curcuma, et
(B) en quantité n’excédant pas 35 parties par million, le ß-apo-8′-caroténal, l’ester éthylique de l’acide ß-apo-8′-caroténoïque ou un mélange de ces produits,
(v) les agents émulsifiants, gélatinisants, stabilisants et épaississants qui suivent :
(A) en quantité n’excédant pas 0,5 pour cent, la carragénine d’ammonium, la carragénine de calcium, la gomme de caroube (fève de l’acacia vulgaire ou faux acacia), la carragénine, la gélatine, la gomme de guar, la gélose de mousse d’Irlande, la carragénine de potassium, l’alginate de propylèneglycol, la carboxyméthylcellulose sodique (carboxyméthylcellulose, gomme de cellulose, glycolate sodique de cellulose), la carragénine sodique, la gomme adragante, la gomme xanthane ou un mélange de ces produits, et
(B) le phosphate de calcium dibasique, le phosphate de potassium dibasique, le pyrophosphate acide de sodium, le phosphate d’aluminium et de sodium, l’hexamétophosphate de sodium, le phosphate disodique, le phosphate monosodique, le phosphate trisodique, le pyrophosphate tétrasodique, le citrate de calcium, le citrate de potassium, le citrate de sodium, le tartrate double de sodium et de potassium, le tartrate de sodium, le gluconate de sodium ou un mélange de ces produits, en quantité qui, calculée en sels anhydres, ne dépasse pas 3,5 pour cent, dans le cas des sels de phosphate, et 4,0 pour cent en tout,
(vi) en quantité conforme aux bonnes pratiques industrielles, de l’acide acétique, du carbonate de calcium, de l’acide citrique, de l’acide lactique, de l’acide malique, de l’acide phosphorique, du bicarbonate de potassium, du carbonate de potassium, du bicarbonate de sodium, du carbonate de sodium et de l’acide tartarique comme rajusteurs du pH, et
(vii) les agents de conservation suivants :
(A) l’acide propionique, le propionate de calcium, le propionate de sodium ou un mélange de ces produits, en quantité n’excédant pas 2 000 parties par million, calculée en acide propionique,
(B) l’acide sorbique, le sorbate de calcium, le sorbate de potassium, le sorbate de sodium ou un mélange de ces produits, en quantité n’excédant pas 3 000 parties par million, calculée en acide sorbique, ou
(C) un mélange des agents de conservation visés aux dispositions (A) et (B), en quantité n’excédant pas 3 000 parties par million, calculée respectivement en acide propionique et en acide sorbique.
(2) Il est interdit d’utiliser un enzyme
a) autre que la chymosine A provenant de Escherichia coli K-12, GE81 (pPFZ87A), la chymosine B provenant de Aspergillus niger var. awamori, GCC0349 (pGAMpR) ou de Kluyveromyces marxianus var. lactis, DS1182 (pKS 105), la pepsine provenant de la muqueuse glandulaire de l’estomac de porc ou la présure provenant de l’extrait aqueux du 4e (véritable) estomac de veaux, de chevreaux ou d’agneaux, dans la fabrication d’un produit visé au paragraphe (1);
b) en quantité supérieure à ce qui est conforme aux bonnes pratiques industrielles.
- DORS/79-752, art. 2
- DORS/92-197, art. 5
- DORS/94-212, art. 5
- DORS/95-183, art. 5
- DORS/2007-302, art. 4(F)
- DORS/2010-143, art. 5
B.08.039 (1) [N]. Le fromage à la crème à tartiner (avec indication des ingrédients ajoutés)
a) doit
(i) être le produit de la coagulation de la crème à l’aide de bactéries, en vue de former une masse homogène de caillé après égouttement du petit-lait,
(ii) contenir, en quantité suffisante pour pouvoir se distinguer du fromage à la crème à tartiner, tout en conservant sa nature fondamentale, les ingrédients ajoutés suivants :
(A) du fromage autre que du fromage à la crème,
(B) des assaisonnements, du chocolat, des condiments, des épices ou des préparations aromatisantes,
(C) des achards, des cornichons, des fruits, des légumes ou des noix,
(D) de la viande préparée ou conservée, ou
(E) du poisson préparé ou conservé, et
(iii) contenir
(A) du lait et des produits du lait ajoutés,
(B) au plus 60 pour cent d’humidité, et
(C) au moins 24 pour cent de matière grasse de lait; et
b) peut contenir
(i) de la crème ajoutée pour modifier la teneur en matière grasse de lait,
(ii) du sel, du vinaigre et des agents édulcorants,
(iii) de l’azote pour améliorer la tartinabilité, en une quantité conforme aux bonnes pratiques industrielles,
(iv) les colorants suivants :
(A) en quantité conforme aux bonnes pratiques industrielles, le rocou, le ß-carotène, la chlorophylle, le paprika, la riboflavine, le curcuma,
(B) en quantité n’excédant pas 35 parties par million, le ß-apo-8′-caroténal, l’ester éthylique de l’acide ß-apo-8′-carothénoïque ou un mélange de ces produits,
(C) en quantité n’excédant pas 1,5 %, le caramel,
(v) les agents émulsifiants, gélatinisants, stalibisants et épaississants qui suivent :
(A) en quantité n’excédant pas 0,5 pour cent, la carragénine d’ammonium, la carragénine de calcium, la gomme de caroube (fève de l’acacia vulgaire ou faux acacia), la carragénine, la gélatine, la gomme de guar, la gélose de mousse d’Irlande, la carragénine de potassium, l’alginate de propylèneglycol, la carboxyméthylcellulose sodique (carboxyméthylcellulose, gomme de cellulose, glycolate sodique de cellulose), la carragénine sodique, la gomme adragante, la gomme xanthane ou un mélange de ces produits, et
(B) le phosphate de calcium dibasique, le phosphate de potassium dibasique, le pyrophosphate acide de sodium, le phosphate d’aluminium et de sodium, l’hexamétaphosphate de sodium, le phosphate disodique, le phosphate monosodique, le phosphate trisodique, le pyrophosphate tétrasodique, le citrate de calcium, le citrate de potassium, le citrate de sodium, le tartrate double de sodium et de potassium, le tartrate de sodium, le gluconate de sodium ou un mélange de ces produits, en quantité qui, calculée en sels anhydres, ne dépasse pas 3,5 pour cent, dans le cas de sels de phosphate, et 4,0 pour cent en tout,
(vi) en quantité conforme aux bonnes pratiques industrielles, de l’acide acétique, du carbonate de calcium, de l’acide citrique, de l’acide lactique, de l’acide malique, de l’acide phosphorique, du bicarbonate de potassium, du carbonate de potassium, du bicarbonate de sodium, du carbonate de sodium et de l’acide tartarique comme rajusteurs du pH, et
(vii) les agents de conservation suivants :
(A) l’acide propionique, le propionate de calcium, le propionate de sodium ou un mélange de ces produits, en quantité n’excédant pas 2 000 parties par million, calculée en acide propionique,
(B) l’acide sorbique, le sorbate de calcium, le sorbate de potassium, le sorbate de sodium ou un mélange de ces produits, en quantité n’excédant pas 3 000 parties par million, calculée en acide sorbique, ou
(C) un mélange des agents de conservation visés aux dispositions (A) et (B), en quantité n’excédant pas 3 000 parties par million, calculée respectivement en acide propionique et en acide sorbique.
(2) Il est interdit d’utiliser un enzyme
a) autre que la chymosine A provenant de Escherichia coli K-12, GE81 (pPFZ87A), la chymosine B provenant de Aspergillus niger var. awamori, GCC0349 (pGAMpR) ou de Kluyveromyces marxianus var. lactis, DS1182 (pKS 105), la pepsine provenant de la muqueuse glandulaire de l’estomac de porc ou la présure provenant de l’extrait aqueux du 4e (véritable) estomac de veaux, de chevreaux ou d’agneaux, dans la fabrication d’un produit visé au paragraphe (1);
b) en quantité supérieure à ce qui est conforme aux bonnes pratiques industrielles.
- DORS/79-752, art. 2
- DORS/92-197, art. 6
- DORS/94-212, art. 6
- DORS/95-183, art. 6
- DORS/2007-302, art. 4(F)
- DORS/2010-143, art. 6
- DORS/2011-278, art. 3
- DORS/2011-281, art. 1
B.08.040 (1) [N]. Le fromage fondu (indication de la variété)
a) doit
(i) sous réserve du sous-alinéa (ii), être le produit du broyage et du mélange, à l’aide d’une source de chaleur, des variétés de fromage nommées, autre que le fromage à la crème, le fromage cottage ou le fromage de petit-lait, en vue de former une masse homogène,
(ii) dans le cas du fromage cheddar fondu, être le produit du broyage et du mélange, à l’aide d’une source de chaleur, des fromages suivants en vue de former une masse homogène :
(A) fromage cheddar,
(B) fromage à caillé brassé,
(C) fromage à caillé granuleux, ou
(D) fromage à caillé lavé,
(iii) s’il est fait
(A) d’une seule variété de fromage dont le pourcentage maximal d’humidité permise est inférieur à 40 pour cent, ou
(B) de plusieurs variétés de fromage dont la moyenne des pourcentages maximaux d’humidité permise est inférieure à 40 pour cent,
contenir un pourcentage d’humidité non supérieur de plus de cinq pour cent au pourcentage maximal visé à la disposition (A) ou (B), selon le cas, et un pourcentage de matière grasse de lait non inférieur de plus de trois pour cent au pourcentage minimal ou à la moyenne des pourcentages minimaux permis pour cette ou ces variétés,
(iv) sous réserve du sous-alinéa (v), s’il est fait
(A) d’une seule variété de fromage dont le pourcentage maximal d’humidité permise est d’au moins 40 pour cent, ou
(B) de plusieurs variétés de fromage dont la moyenne des pourcentages maximaux d’humidité permise est d’au moins 40 pour cent,
contenir un pourcentage d’humidité non supérieur de plus de trois pour cent au pourcentage maximal visé à la disposition (A) ou (B), selon le cas, et un pourcentage de matière grasse de lait non inférieur de plus de deux pour cent au pourcentage minimal ou à la moyenne des pourcentages minimaux permis pour cette ou ces variétés, et
(v) dans le cas du fromage de lait écrémé fondu, contenir au plus
(A) 55 pour cent d’humidité, et
(B) sept pour cent de matière grasse de lait; et
b) peut contenir
(i) de l’eau ajoutée pour modifier la teneur en humidité,
(ii) de la matière grasse de lait ajoutée,
(iii) s’il s’agit de fromage de lait écrémé fondu, du lait écrémé en poudre, du lait de beurre en poudre et du petit-lait en poudre ajoutés,
(iv) du sel, du vinaigre et des agents édulcorants,
(v) les colorants suivants :
(A) en quantité conforme aux bonnes pratiques industrielles, le rocou, le ß-carotène, la chlorophylle, le paprika, la riboflavine, le curcuma, et
(B) en quantité n’excédant pas 35 parties par million, le ß-apo-8′-caroténal, l’ester éthylique de l’acide ß-apo-8′-caroténoïque ou un mélange de ces produits,
(vi) les agents émulsifiants, gélatinisants, stabilisants et épaississants qui suivent :
(A) en quantité n’excédant pas 0,5 pour cent, la carboxyméthylcellulose sodique (carboxyméthylcellulose, gomme de cellulose, glycolate sodique de cellulose),
(B) le phosphate de calcium dibasique, le phosphate de potassium dibasique, le pyrophosphate acide de sodium, le phosphate d’aluminium et de sodium, l’hexamétaphosphate de sodium, le phosphate disodique, le phosphate monosodique, le phosphate trisodique, le pyrophosphate tétrasodique, le citrate de calcium, le citrate de potassium, le citrate de sodium, le tartrate double de sodium et de potassium, le tartrate de sodium, le gluconate de sodium ou un mélange de ces produits, en quantité qui, calculée en sels anhydres, ne dépasse pas 3,5 pour cent, dans le cas des sels de phosphate, et 4,0 pour cent en tout,
(C) de la lécithine en quantité n’excédant pas 0,2 pour cent, et
(D) en quantité ne dépassant pas 0,5 pour cent, des monoglycérides et des mono- et diglycérides ou un mélange de ces produits,
(vi.1) du phosphate tricalcique comme agent pour améliorer la couleur, la texture, la consistance et la tartinabilité, en quantité n’excédant pas 1 pour cent,
(vii) en quantité conforme aux bonnes pratiques industrielles, de l’acide acétique, du carbonate de calcium, de l’acide citrique, de l’acide lactique, de l’acide malique, de l’acide phosphorique, du bicarbonate de potassium, du carbonate de potassium, du bicarbonate de sodium, du carbonate de sodium, et de l’acide tartarique comme rajusteurs du pH,
(viii) de la fumée de bois comme agent de conservation, en quantité conforme aux bonnes pratiques industrielles, et
(ix) les agents de conservation suivants :
(A) l’acide propionique, le propionate de calcium, le propionate de sodium ou un mélange de ces produits, en quantité n’excédant pas 2 000 parties par million, calculée en acide propionique,
(B) l’acide sorbique, le sorbate de calcium, le sorbate de potassium, le sorbate de sodium ou un mélange de ces produits, en quantité n’excédant pas 3 000 parties par million, calculée en acide sorbique, ou
(C) un mélange des agents de conservation visés aux dispositions (A) et (B), en quantité n’excédant pas 3 000 parties par million, calculée respectivement en acide propionique et en acide sorbique.
(2) L’étiquette d’un fromage ne doit porter le terme « fumé » que si de la fumée de bois a été ajoutée au fromage conformément au paragraphe (1).
(3) Dans les cas visés au paragraphe (2), le terme « fumé » doit paraître dans l’espace principal de l’étiquette.
- DORS/79-752, art. 2
- DORS/91-409, art. 1
- DORS/2017-18, art. 18(F)
- DORS/2018-69, art. 28(F)
B.08.041 (1) [N]. Le fromage fondu (indication de la variété) (avec indication des ingrédients ajoutés)
a) doit
(i) être le produit du broyage et du mélange, à l’aide d’une source de chaleur, des variétés de fromage nommées, autre que le fromage à la crème, le fromage cottage ou le fromage de petit-lait, en vue de former une masse homogène,
(ii) contenir, en quantité suffisante pour pouvoir se distinguer du fromage fondu (indication de la variété), tout en conservant la nature fondamentale, les ingrédients suivants :
(A) des préparations aromatisantes autres que celles qui ressemblent à l’arôme des variétés de fromage utilisées,
(B) des assaisonnements, du chocolat, des condiments ou des épices,
(C) des achards, des cornichons, des fruits, des légumes ou des noix,
(D) de la viande préparée ou conservée, ou
(E) du poisson préparé ou conservé,
(iii) s’il est fait
(A) d’une seule variété de fromage dont le pourcentage maximal d’humidité permise est inférieur à 40 pour cent, ou
(B) de plusieurs variétés de fromage dont la moyenne des pourcentages maximaux d’humidité permise est inférieure à 40 pour cent,
contenir un pourcentage d’humidité non supérieur de plus de cinq pour cent au pourcentage maximal visé à la disposition (A) ou (B), selon le cas, et un pourcentage de matière grasse de lait non inférieur de plus de trois pour cent au pourcentage minimal ou à la moyenne des pourcentages minimaux permis pour cette ou ces variétés, et
(iv) s’il est fait
(A) d’une seule variété de fromage dont le pourcentage maximal d’humidité permise est d’au moins 40 pour cent, ou
(B) de plusieurs variétés de fromage dont la moyenne des pourcentages maximaux d’humidité permise est d’au moins 40 pour cent,
contenir un pourcentage d’humidité non supérieur de plus de trois pour cent au pourcentage maximal visé à la disposition (A) ou (B), selon le cas, et un pourcentage de matière grasse de lait non inférieur de plus de deux pour cent au pourcentage minimal ou à la moyenne des pourcentages minimaux permis pour cette ou ces variétés; et
b) peut contenir
(i) de l’eau ajoutée pour modifier la teneur en humidité,
(ii) de la matière grasse de lait ajoutée,
(iii) du sel, du vinaigre et des agents édulcorants,
(iv) les colorants suivants :
(A) en quantité conforme aux bonnes pratiques industrielles, le rocou, le ß-carotène, la chlorophylle, le paprika, la riboflavine, le curcuma, et
(B) en quantité n’excédant pas 35 parties par million, le ß-apo-8′-caroténal, l’ester éthylique de l’acide ß-apo-8′-caroténoïque ou un mélange de ces produits,
(v) les agents émulsifiants, gélatinisants, stabilisants et épaississants qui suivent :
(A) en quantité n’excédant pas 0,5 pour cent, la carboxyméthylcellulose sodique (carboxyméthylcellulose, gomme de cellulose, glycolate sodique de cellulose),
(B) le phosphate de calcium dibasique, le phosphate de potassium dibasique, le pyrophosphate acide de sodium, le phosphate d’aluminium et de sodium, l’hexamétaphosphate de sodium, le phosphate disodique, le phosphate monosodique, le phosphate trisodique, le pyrophosphate tétrasodique, le citrate de calcium, le citrate de potassium, le citrate de sodium, le tartrate double de sodium et de potassium, le tartrate de sodium, le gluconate de sodium ou un mélange de ces produits, en quantité qui, calculée en sels anhydres, ne dépasse pas 3,5 pour cent, dans le cas des sels de phosphate, et 4,0 pour cent en tout,
(C) de la lécithine en quantité n’excédant pas 0,2 pour cent, et
(D) en quantité ne dépassant pas 0,5 pour cent, des monoglycérides et des mono- et diglycérides ou un mélange de ces produits,
(v.1) du phosphate tricalcique comme agent pour améliorer la couleur, la texture, la consistance et la tartinabilité, en quantité n’excédant pas 1 pour cent,
(vi) en quantité conforme aux bonnes pratiques industrielles, de l’acide acétique, du carbonate de calcium, de l’acide citrique, de l’acide lactique, de l’acide malique, de l’acide phosphorique, du bicarbonate de potassium, du carbonate de potassium, du bicarbonate de sodium, du carbonate de sodium, et de l’acide tartarique comme rajusteurs du pH,
(vii) de la fumée de bois comme agent de conservation, en quantité conforme aux bonnes pratiques industrielles, et
(viii) les agents de conservation suivants :
(A) l’acide propionique, le propionate de calcium, le propionate de sodium ou un mélange de ces produits, en quantité n’excédant pas 2 000 parties par million, calculée en acide propionique,
(B) l’acide sorbique, le sorbate de calcium, le sorbate de potassium, le sorbate de sodium ou un mélange de ces produits, en quantité n’excédant pas 3 000 parties par million, calculée en acide sorbique, ou
(C) un mélange des agents de conservation visés aux dispositions (A) et (B), en quantité n’excédant pas 3 000 parties par million, calculée respectivement en acide propionique et en acide sorbique.
(2) L’étiquette d’un fromage ne doit porter le terme « fumé » que si de la fumée de bois a été ajoutée au fromage conformément au paragraphe (1).
(3) Dans les cas visés au paragraphe (2), le terme « fumé » doit paraître dans l’espace principal de l’étiquette.
- DORS/79-752, art. 2
- DORS/91-409, art. 2
- DORS/92-400, art. 5
- DORS/2010-94, art. 4(A)
- DORS/2011-278, art. 4
- DORS/2017-18, art. 18(F)
- DORS/2018-69, art. 28(F)
B.08.041.1 (1) [N]. Une préparation de fromage fondu
a) doit
(i) être le produit du broyage et du mélange, à l’aide d’une source de chaleur, d’une ou de plusieurs variétés de fromage, autre que le fromage à la crème, le fromage cottage ou le fromage de petit-lait, en vue de former une masse homogène, et
(ii) contenir
(A) du lait ou des produits du lait ajoutés,
(B) au moins 51 pour cent de fromage,
(C) au plus 46 pour cent d’humidité, et
(D) au moins 23 pour cent de matière grasse de lait; et
b) peut contenir
(i) de l’eau ajoutée pour modifier la teneur en humidité,
(ii) de la matière grasse de lait ajoutée,
(iii) du sel, du vinaigre et des agents édulcorants,
(iv) les colorants suivants :
(A) en quantité conforme aux bonnes pratiques industrielles, le rocou, le ß-carotène, la chlorophylle, le paprika, la riboflavine, le curcuma, et
(B) en quantité n’excédant pas 35 parties par million, le ß-apo-8′-caroténal, l’ester éthylique de l’acide ß-apo-8′-caroténoïque ou d’un mélange de ces produits.
(v) les agents émulsifiants, gélatinisants, stabilisants et épaississants qui suivent :
(A) en quantité n’excédant pas 0,5 pour cent, la carboxyméthylcellulose sodique (carboxyméthylcellulose, gomme de cellulose, glycolate sodique de cellulose),
(B) le phosphate de calcium dibasique, le phosphate de potassium dibasique, le pyrophosphate acide de sodium, le phosphate d’aluminium et de sodium, l’hexamétaphosphate de sodium, le phosphate disodique, le phosphate monosodique, le phosphate trisodique, le pyrophosphate tétrasodique, le citrate de calcium, le citrate de potassium, le citrate de sodium, le tartrate double de sodium et de potassium, le tartrate de sodium, le gluconate de sodium ou un mélange de ces produits, en quantité qui, calculée en sels anhydres, ne dépasse pas 3,5 pour cent, dans le cas des sels de phosphate, et 4,0 pour cent en tout,
(C) de la lécithine, en quantité n’excédant pas 0,2 pour cent, et
(D) en quantité ne dépassant pas 0,5 pour cent, des monoglycérides et des mono- et diglycérides ou un mélange de ces produits,
(v.1) du phosphate tricalcique comme agent pour améliorer la couleur, la texture, la consistance et la tartinabilité, en quantité n’excédant pas 1 pour cent,
(vi) en quantité conforme aux bonnes pratiques industrielles, de l’acide acétique, du carbonate de calcium, de l’acide citrique, de l’acide lactique, de l’acide malique, de l’acide phosphorique, du bicarbonate de potassium, du carbonate de potassium, du bicarbonate de sodium, du carbonate de sodium et de l’acide tartarique comme rajusteurs du pH,
(vii) de la fumée de bois comme agent de conservation, en quantité conforme aux bonnes pratiques industrielles, et
(viii) les agents de conservation suivants :
(A) l’acide propionique, la propionate de calcium, le propionate de sodium ou un mélange de ces produits, en quantité n’excédant pas 2 000 parties par million, calculée en acide propionique,
(B) l’acide sorbique, la sorbate de calcium, le sorbate de potassium, le sorbate de sodium ou un mélange de ces produits, en quantité n’excédant pas 3 000 parties par million, calculée en acide sorbique, ou
(C) un mélange des agents de conservation visés aux dispositions (A) et (B), en quantité n’excédant pas 3 000 parties par million, calculée respectivement en acide propionique et en acide sorbique.
(2) L’étiquette d’un fromage ne doit porter le terme « fumé » que si de la fumée de bois a été ajoutée au fromage conformément au paragraphe (1).
(3) Dans les cas visés au paragraphe (2), le terme « fumé » doit paraître dans l’espace principal de l’étiquette.
- DORS/79-752, art. 2
- DORS/91-409, art. 3
- DORS/92-400, art. 6
- DORS/2007-302, art. 4(F)
- DORS/2017-18, art. 18(F)
- DORS/2018-69, art. 28(F)
B.08.041.2 (1) [N]. Une préparation de fromage fondu (avec indication des ingrédients ajoutés)
a) doit
(i) être le produit du broyage et du mélange, à l’aide d’une source de chaleur, d’une ou de plusieurs variétés de fromage, autre que le fromage à la crème, le fromage cottage ou le fromage de petit-lait, en vue de former une masse homogène,
(ii) contenir, en quantité suffisante pour pouvoir se distinguer de la préparation de fromage fondu, tout en conservant sa nature fondamentale, les ingrédients suivants :
(A) des assaisonnements, du chocolat, des condiments, des épices ou des préparations aromatisantes,
(B) des achards, des cornichons, des fruits, des légumes ou des noix,
(C) de la viande préparée ou conservée, ou
(D) du poisson préparé ou conservé, et
(iii) contenir
(A) du lait ou des produits du lait ajoutés,
(B) au plus 46 pour cent d’humidité, et
(C) au moins 22 pour cent de matière grasse de lait; et
b) peut contenir
(i) de l’eau ajoutée pour modifier la teneur en humidité,
(ii) de la matière grasse de lait ajoutée,
(iii) du sel, du vinaigre et des agents édulcorants,
(iv) les colorants suivants :
(A) en quantité conforme aux bonnes pratiques industrielles, le rocou, le ß-carotène, la chlorophylle, le paprika, la riboflavine, le curcuma, et
(B) en quantité n’excédant pas 35 parties par million, le ß-apo-8′-caroténal, l’ester éthylique de l’acide ß-apo-8′-caroténoïque ou un mélange de ces produits,
(v) les agents émulsifiants, gélatinisants, stabilisants et épaississants qui suivent :
(A) en quantité n’excédant pas 0,5 pour cent, la carboxyméthylcellulose sodique (carboxyméthylcellulose, gomme de cellulose, glycolate sodique de cellulose),
(B) le phosphate de calcium dibasique, le phosphate de potassium dibasique, le pyrophosphate acide de sodium, le phosphate d’aluminium et de sodium, l’hexamétaphosphate de sodium, le phosphate disodique, le phosphate monosodique, le phosphate trisodique, le pyrophosphate tétrasodique, le citrate de calcium, le citrate de potassium, le citrate de sodium, le tartrate double de sodium et de potassium, le tartrate de sodium, le gluconate de sodium ou un mélange de ces produits, en quantité qui, calculée en sels anhydres, ne dépasse pas 3,5 pour cent, dans le cas des sels de phosphate, et 4,0 pour cent en tout,
(C) de la lécithine, en quantité n’excédant pas 0,2 pour cent, et
(D) en quantité ne dépassant pas 0,5 pour cent, des monoglycérides et des mono- et diglycérides ou un mélange de ces produits,
(v.1) du phosphate tricalcique comme agent pour améliorer la couleur, la texture, la consistance et la tartinabilité, en quantité n’excédant pas 1 pour cent,
(vi) en quantité conforme aux bonnes pratiques industrielles, de l’acide acétique, du carbonate de calcium, de l’acide citrique, de l’acide lactique, de l’acide malique, de l’acide phosphorique, du bicarbonate de potassium, du carbonate de potassium, du bicarbonate de sodium, du carbonate de sodium et de l’acide tartarique comme rajusteurs du pH,
(vii) de la fumée de bois comme agent de conservation, en quantité conforme aux bonnes pratiques industrielles, et
(viii) les agents de conservation suivants :
(A) l’acide propionique, le propionate de calcium, le propionate de sodium ou un mélange de ces produits, en quantité n’excédant pas 2 000 parties par million, calculée en acide propionique,
(B) l’acide sorbique, le sorbate de calcium, le sorbate de potassium, le sorbate de sodium ou un mélange de ces produits, en quantité n’excédant pas 3 000 parties par million, calculée en acide sorbique, ou
(C) un mélange des agents de conservation visés aux dispositions (A) et (B), en quantité n’excédant pas 3 000 parties par million, calculée respectivement en acide propionique et en acide sorbique.
(2) L’étiquette d’un fromage ne doit porter le terme « fumé » que si de la fumée de bois a été ajoutée au fromage conformément au paragraphe (1).
(3) Dans les cas visés au paragraphe (2), le terme « fumé » doit paraître dans l’espace principal de l’étiquette.
- DORS/79-752, art. 2
- DORS/91-409, art. 4
- DORS/92-400, art. 7
- DORS/2007-302, art. 4(F)
- DORS/2011-278, art. 5
- DORS/2017-18, art. 18(F)
- DORS/2018-69, art. 28(F)
B.08.041.3 (1) [N]. Le fromage fondu à tartiner
a) doit
(i) être le produit du broyage et du mélange, à l’aide d’une source de chaleur, d’une ou de plusieurs variétés de fromage, autre que le fromage à la crème, le fromage cottage ou le fromage de petit-lait, en vue de former une masse homogène, et
(ii) contenir
(A) du lait ou des produits du lait ajoutés,
(B) au moins 51 pour cent de fromage,
(C) au plus 60 pour cent d’humidité, et
(D) au moins 20 pour cent de matière grasse de lait; et
b) peut contenir
(i) de l’eau ajoutée pour modifier la teneur en humidité,
(ii) de la matière grasse de lait ajoutée,
(iii) du sel, du vinaigre et des agents édulcorants,
(iv) les colorants suivants :
(A) en quantité conforme aux bonnes pratiques industrielles, le rocou, le ß-carotène, la chlorophylle, le paprika, la riboflavine, le curcuma, et
(B) en quantité n’excédant pas 35 parties par million, le ß-8po-8′-caroténal, l’ester éthylique de l’acide ß-apo-8′-caroténoïque ou un mélange de ces produits,
(v) les agents émulsifiants, gélatinisants, stabilisants et épaississants qui suivent :
(A) en quantité n’excédant pas 0,5 pour cent, la carraghénine d’ammonium, la carraghénine de calcium, la gomme de caroube (gomme de caroubier), la carraghénine, la gélatine, la gomme de guar, la gélose de mousse d’Irlande, la carraghénine de potassium, l’alginate de propylèneglycol, la carboxyméthylcellulose sodique (carboxyméthylcellulose, gomme de cellulose, glycolate sodique de cellulose), la carraghénine de sodium, la gomme adragante, la gomme xanthane ou un mélange de ces produits,
(B) le phosphate de calcium dibasique, le phosphate de potassium dibasique, le pyrophosphate acide de sodium, le phosphate d’aluminium et de sodium, l’hexamétaphosphate de sodium, le phosphate disodique, le phosphate monosodique, le phosphate trisodique, le pyrophosphate tétrasodique, le citrate de calcium, le citrate de potassium, le citrate de sodium, le tartrate double de sodium et de potassium, le tartrate de sodium, le gluconate de sodium ou un mélange de ces produits, en quantité qui, calculée en sels anhydres, ne dépasse pas 3,5 pour cent, dans le cas des sels de phosphate, et 4,0 pour cent en tout,
(C) de la lécithine, en quantité n’excédant pas 0,2 pour cent, et
(D) en quantité ne dépassant pas 0,5 pour cent, des monoglycérides et des mono- et diglycérides ou un mélange de ces produits,
(v.1) du phosphate tricalcique comme agent pour améliorer la couleur, la texture, la consistance et la tartinabilité, en quantité n’excédant pas 1 pour cent,
(vi) en quantité conforme aux bonnes pratiques industrielles, de l’acide acétique, du carbonate de calcium, de l’acide citrique, de l’acide lactique, de l’acide malique, de l’acide phosphorique, du bicarbonate de potassium, du carbonate de potassium, du bicarbonate de sodium, du carbonate de sodium et de l’acide tartarique comme rajusteurs du pH,
(vii) de la fumée de bois comme agent de conservation, en quantité conforme aux bonnes pratiques industrielles, et
(viii) les agents de conservation suivants :
(A) l’acide propionique, le propionate de calcium, le propionate de sodium ou un mélange de ces produits, en quantité n’exédant pas 2 000 parties par million, calculée en acide propionique,
(B) l’acide sorbique, le sorbate de calcium, le sorbate de potassium, le sorbate de sodium ou un mélange de ces produits, en quantité n’excédant pas 3 000 parties par million, calculée en acide sorbique, ou
(C) un mélange des agents de conservation visés aux dispositions (A) et (B), en quantité n’excédant pas 3 000 parties par million, calculée respectivement en acide propionique et en acide sorbique.
(2) L’étiquette d’un fromage ne doit porter le terme « fumé » que si de la fumée de bois a été ajoutée au fromage conformément au paragraphe (1).
(3) Dans les cas visés au paragraphe (2), le terme « fumé » doit paraître dans l’espace principal de l’étiquette.
- DORS/79-752, art. 2
- DORS/82-1071, art. 4
- DORS/91-409, art. 5
- DORS/2007-302, art. 4(F)
- DORS/2017-18, art. 18(F)
- DORS/2018-69, art. 28(F)
B.08.041.4 (1) [N]. Le fromage fondu à tartiner (avec indication des ingrédients ajoutés)
a) doit
(i) être le produit du broyage et du mélange, à l’aide d’une source de chaleur, d’une ou de plusieurs variétés de fromage, autre que le fromage à la crème, le fromage cottage ou le fromage de petit-lait, en vue de former une masse homogène,
(ii) contenir, en quantité suffisante pour pouvoir se distinguer du fromage fondu à tartiner, tout en conservant sa nature fondamentale, les ingrédients suivants :
(A) des assaisonnements, du chocolat, des condiments, des épices ou des préparations aromatisantes,
(B) des achards, des cornichons, des fruits, des légumes ou des noix,
(C) de la viande préparée ou conservée, ou
(D) du poisson préparé ou conservé, et
(iii) contenir
(A) du lait ou des produits du lait ajoutés,
(B) au plus 60 pour cent d’humidité, et
(C) au moins 20 pour cent de matière grasse de lait; et
b) peut contenir
(i) de l’eau ajoutée pour modifier la teneur en humidité,
(ii) de la matière grasse de lait ajoutée,
(iii) du sel, du vinaigre et des agents édulcorants,
(iv) les colorants suivants :
(A) en quantité conformant aux bonnes pratiques industrielles, le rocou, le ß-carotène, la chlorophylle, le paprika, la riboflavine, le curcuma, et
(B) en quantité n’excédant pas 35 parties par million, le ß-apo-8′-caroténal, l’ester éthylique de l’acide ß-apo-8′-caroténoïque ou un mélange de ces produits,
(v) les agents émulsifiants, gélatinisants, stabilisants et épaississants qui suivent :
(A) en quantité n’excédant pas 0,5 pour cent, la carraghénine d’ammonium, la carraghénine de calcium, la gomme de caroube (gomme de caroubier), la carraghénine, la gélatine, la gomme de guar, la gélose de mousse d’Irlande, la carraghénine de potassium, l’alginate de propylèneglycol, la carboxyméthylcellulose sodique (carboxyméthylcellulose, gomme de cellulose, glycolate sodique de cellulose), la carraghénine de sodium, la gomme adragante, la gomme xanthane ou un mélange de ces produits,
(B) le phosphate de calcium dibasique, le phosphate de potassium dibasique, le pyrophosphate acide de sodium, le phosphate d’aluminium et de sodium, l’hexamétaphosphate de sodium, le phosphate disodique, le phosphate monosodique, le phosphate trisodique, le pyrophosphate tétrasodique, le citrate de calcium, le citrate de potassium, le citrate de sodium, le tartrate double de sodium et de potassium, le tartrate de sodium, le gluconate de sodium ou un mélange de ces produits, en quantité qui, calculée en sels anhydres, ne dépasse pas 3,5 pour cent, dans le cas des sels de phosphate, et 4,0 pour cent en tout,
(C) de la lécithine, en quantité n’excédant pas 0,2 pour cent, et
(D) en quantité ne dépassant pas 0,5 pour cent, des monoglycérides et des mono- et diglycérides ou un mélange de ces produits,
(v.1) du phosphate tricalcique comme agent pour améliorer la couleur, la texture, la consistance et la tartinabilité, en quantité n’excédant pas 1 pour cent,
(vi) en quantité conforme aux bonnes pratiques industrielles, de l’acide acétique, du carbonate de calcium, de l’acide citrique, de l’acide lactique, de l’acide malique, de l’acide phosphorique, du bicarbonate de potassium, du carbonate de potassium, du bicarbonate de sodium, du carbonate de sodium, et de l’acide tartarique comme rajusteurs du pH,
(vii) de la fumée de bois comme agent de conservation, en quantité conforme aux bonnes pratiques industrielles, et
(viii) les agents de conservation suivants :
(A) l’acide propionique, le propionate de calcium, le propionate de sodium ou un mélange de ces produits, en quantité n’excédant pas 2 000 parties par million, calculée en acide propionique,
(B) l’acide sorbique, le sorbate de calcium, le sorbate de potassium, le sorbate de sodium ou un mélange de ces produits, en quantité n’excédant pas 3 000 parties par million, calculée en acide sorbique, ou
(C) un mélange des agents de conservation visés aux dispositions (A) et (B), en quantité n’excédant pas 3 000 parties par million, calculée respectivement en acide propionique et en acide sorbique.
(2) L’étiquette d’un fromage ne doit porter le terme « fumé » que si de la fumée de bois a été ajoutée au fromage conformément au paragraphe (1).
(3) Dans les cas visés au paragraphe (2), le terme « fumé » doit paraître dans l’espace principal de l’étiquette.
- DORS/79-752, art. 2
- DORS/82-1071, art. 5
- DORS/91-409, art. 6
- DORS/2007-302, art. 4(F)
- DORS/2011-278, art. 6
- DORS/2017-18, art. 18(F)
- DORS/2018-69, art. 28(F)
B.08.041.5 (1) [N]. Le fromage conditionné à froid (indication de la variété)
a) doit
(i) sous réserve du sous-alinéa (ii), être le produit du broyage et du mélange, sans l’aide d’une source de chaleur, des variétés de fromage nommées, autre que le fromage à la crème, le fromage cottage ou le fromage de petit-lait, en vue de former une masse homogène,
(ii) dans le cas du fromage cheddar conditionné à froid, être le produit du broyage et du mélange, sans l’aide d’une source de chaleur, des fromages suivants, en vue de former une masse homogène :
(A) fromage cheddar,
(B) fromage à caillé brassé,
(C) fromage à caillé granuleux, ou
(D) fromage à caillé lavé,
(iii) s’il est fait
(A) d’une seule variété de fromage, ne pas contenir plus d’humidité que le pourcentage maximal permis pour cette variété, et ne pas contenir moins de matière grasse de lait que le pourcentage minimal permis pour cette variété, ou
(B) de plusieurs variétés de fromage, ne pas contenir plus d’humidité que la moyenne des pourcentages maximaux permis pour ces variétés, et ne pas contenir moins de matière grasse de lait que la moyenne des pourcentages minimaux permis pour ces variétés; et
b) peut contenir
(i) de l’eau ajoutée pour modifier la teneur en humidité,
(ii) de la matière grasse de lait ajoutée,
(iii) du sel, du vinaigre et des agents édulcorants,
(iv) les colorants suivants :
(A) en quantité conforme aux bonnes pratiques industrielles, le rocou, le ß-carotène, la chlorophylle, le paprika, la riboflavine, le curcuma, et
(B) en quantité n’excédant pas 35 parties par million, le ß-apo-8′-caroténal, l’ester éthylique de l’acide ß-apo-8′-caroténoïque ou un mélange de ces produits,
(v) en quantité conforme aux bonnes pratiques industrielles, de l’acide acétique, du carbonate de calcium, de l’acide citrique, de l’acide lactique, de l’acide malique, de l’acide phosphorique, du bicarbonate de potassium, du carbonate de potassium, du bicarbonate de sodium, du carbonate de sodium et de l’acide tartarique comme rajusteurs du pH,
(vi) de la fumée de bois comme agent de conservation, en quantité conforme aux bonnes pratiques industrielles, et
(vii) les agents de conservation suivants :
(A) l’acide propionique, le propionate de calcium, le propionate de sodium ou un mélange de ces produits, en quantité n’excédant pas 2 000 parties par million, calculée en acide propionique,
(B) l’acide sorbique, le sorbate de calcium, le sorbate de potassium, le sorbate de sodium ou un mélange de ces produits, en quantité n’excédant pas 3 000 parties par million, calculée en acide sorbique, ou
(C) un mélange des agents de conservation visés aux dispositions (A) et (B), en quantité n’excédant pas 3 000 parties par million, calculée respectivement en acide propionique et en acide sorbique.
(2) L’étiquette d’un fromage ne doit porter le terme « fumé » que si de la fumée de bois a été ajoutée au fromage conformément au paragraphe (1).
(3) Dans les cas visés au paragraphe (2), le terme « fumé » doit paraître dans l’espace principal de l’étiquette.
- DORS/79-752, art. 2
- DORS/92-400, art. 8
- DORS/2017-18, art. 18(F)
- DORS/2018-69, art. 28(F)
B.08.041.6 (1) [N]. Le fromage conditionné à froid (indication de la variété) (avec indication des ingrédients ajoutés)
a) doit
(i) être le produit du broyage et du mélange, sans l’aide d’une source de chaleur, des variétés de fromage nommées, autre que le fromage à la crème, le fromage cottage ou le fromage de petit-lait, en vue de former une masse homogène,
(ii) contenir, en quantité suffisante pour pouvoir se distinguer du fromage conditionné à froid (indication de la variété), tout en conservant sa nature fondamentale, les ingrédients suivants :
(A) des préparations aromatisantes autres que celles qui ressemblent à l’arôme des variétés de fromage utilisées dans le produit,
(B) des assaisonnements, du chocolat, des condiments ou des épices,
(C) des achards, des cornichons, des fruits, des légumes ou des noix,
(D) de la viande préparée ou conservée, ou
(E) du poisson préparé ou conservé, et
(iii) s’il est fait
(A) d’une seule variété de fromage, avoir un pourcentage d’humidité non supérieur au maximum permis pour cette variété, et un pourcentage de matière grasse de lait non inférieur de plus de un pour cent au minimum permis pour cette variété, ou
(B) de plusieurs variétés de fromage, avoir un pourcentage d’humidité non supérieur à la moyenne des maximums permis pour ces variétés, et un pourcentage de matière grasse de lait non inférieur de plus de un pour cent à la moyenne des minimums permis pour ces variétés; et
b) peut contenir
(i) de l’eau ajoutée pour modifier la teneur en humidité,
(ii) de la matière grasse de lait ajoutée,
(iii) du sel, du vinaigre et des agents édulcorants,
(iv) les colorants suivants :
(A) en quantité conforme aux bonnes pratiques industrielles, le rocou, le ß-carotène, la chlorophylle, le paprika, la riboflavine, le curcuma, et
(B) en quantité n’excédant pas 35 parties par million, le ß-apo-8′-caroténal, l’ester éthylique de l’acide ß-apo-8′-caroténoïque ou un mélange de ces produits,
(v) les agents émulsifiants, gélatinisants, stabilisants et épaississants qui suivent :
en quantité ne dépassant pas 0,5 pour cent, la carragénine d’ammonium, la carragénine de calcium, la gomme de caroube (fève de l’acacia vulgaire ou faux acacia), la carragénine, la gélatine, la gomme du guar, la gélose de mousse d’Irlande, la carragénine de potassium, l’alginate de propylèneglycol, la carboxyméthylcellulose sodique (carboxyméthylcellulose, gomme de cellulose, glycolate sodique de cellulose), la carragénine sodique, la gomme adragante, la gomme xanthane ou un mélange de ces produits,
(vi) en quantité conforme aux bonnes pratiques industrielles, de l’acide acétique, du carbonate de calcium, de l’acide citrique, de l’acide lactique, de l’acide malique, de l’acide phosphorique, du bicarbonate de potassium, du carbonate de potassium, du bicarbonate de sodium, du carbonate de sodium et de l’acide tartarique comme rajusteurs du pH, et
(vii) de la fumée de bois comme agent de conservation, en quantité conforme aux bonnes pratiques industrielles, et
(viii) les agents de conservation suivants :
(A) l’acide propionique, le propionate de calcium, le propionate de sodium ou un mélange de ces produits, en quantité n’excédant pas 2 000 parties par million, calculée en acide propionique,
(B) l’acide sorbique, le sorbate de calcium, le sorbate de potassium, le sorbate de sodium ou un mélange de ces produits, en quantité n’excédant pas 3 000 parties par million, calculée en acide sorbique, ou
(C) un mélange des agents de conservation visés aux dispositions (A) et (B), en quantité n’excédant pas 3 000 parties par million, calculée respectivement en acide propionique et en acide sorbique.
(2) L’étiquette d’un fromage ne doit porter le terme « fumé » que si de la fumée de bois a été ajoutée au fromage conformément au paragraphe (1).
(3) Dans les cas visés au paragraphe (2), le terme « fumé » doit paraître dans l’espace principal de l’étiquette.
- DORS/79-752, art. 2
- DORS/92-400, art. 9
- DORS/2010-94, art. 5(A)
- DORS/2011-278, art. 7
- DORS/2017-18, art. 18(F)
- DORS/2018-69, art. 28(F)
B.08.041.7 (1) [N]. Une préparation de fromage conditionné à froid
a) doit
(i) être le produit du broyage et du mélange, sans l’aide d’une source de chaleur, d’une ou de plusieurs variétés de fromage, autre que le fromage à la crème, le fromage cottage ou le fromage de petit-lait, en vue de former une masse homogène,
(ii) contenir
(A) du lait ou des produits du lait ajoutés,
(B) au moins 51 pour cent de fromage,
(C) au plus 46 pour cent d’humidité, et
(D) au moins 23 pour cent de matière grasse de lait; et
b) peut contenir
(i) de l’eau ajoutée pour modifier la teneur en humidité,
(ii) de la matière grasse de lait ajoutée,
(iii) du sel, du vinaigre et des agents édulcorants,
(iv) les colorants suivants :
(A) en quantité conforme aux bonnes pratiques industrielles, le rocou, le ß-carotène, la chlorophylle, le paprika, la riboflavine, le curcuma, et
(B) en quantité n’excédant pas 35 parties par million, le ß-apo-8′-caroténal, l’ester éthylique de l’acide ß-apo-8′-caroténoïque ou un mélange de ces produits,
(v) les agents émulsifiants, gélatinisants, stabilisants et épaississants qui suivent :
en quantité ne dépassant pas 0,5 pour cent, la carragénine d’ammonium, la carragénine de calcium, la gomme de caroube (fève de l’acacia vulgaire ou faux acacia), la carragénine, la gélatine, la gomme de guar, la gélose de mousse d’Irlande, la carragénine de potassium, l’alginate de propylèneglycol, la carboxyméthylcellulose sodique (carboxyméthylcellulose, gomme de cellulose, glycolate sodique de cellulose), la carragénine sodique, la gomme adragante, la gomme xanthane ou un mélange de ces produits,
(vi) en quantité conforme aux bonnes pratiques industrielles, de l’acide acétique, du carbonate de calcium, de l’acide citrique, de l’acide lactique, de l’acide malique, de l’acide phosphorique, du bicarbonate de potassium, du carbonate de potassium, du bicarbonate de sodium, du carbonate de sodium et de l’acide tartarique comme rajusteurs du pH,
(vii) de la fumée de bois comme agent de conservation, en quantité conforme aux bonnes pratiques industrielles, et
(viii) les agents de conservation suivants :
(A) l’acide propionique, le propionate de calcium, le propionate de sodium ou un mélange de ces produits, en quantité n’excédant pas 2 000 parties par million, calculée en acide propionique,
(B) l’acide sorbique, le sorbate de calcium, le sorbate de potassium, le sorbate de sodium ou un mélange de ces produits, en quantité n’excédant pas 3 000 parties par million, calculée en acide sorbique, ou
(C) un mélange des agents de conservation visés aux dispositions (A) et (B), en quantité n’excédant pas 3 000 parties par million, calculée respectivement en acide propionique et en acide sorbique.
(2) L’étiquette d’un fromage ne doit porter le terme « fumé » que si de la fumée de bois a été ajoutée au fromage conformément au paragraphe (1).
(3) Dans les cas visés au paragraphe (2), le terme « fumé » doit paraître dans l’espace principal de l’étiquette.
- DORS/79-752, art. 2
- DORS/2007-302, art. 4(F)
- DORS/2017-18, art. 18(F)
- DORS/2018-69, art. 28(F)
B.08.041.8 (1) [N]. Une préparation de fromage conditionné à froid (avec indication des ingrédients ajoutés)
a) doit
(i) être le produit du broyage et du mélange, sans l’aide d’une source de chaleur, d’une ou de plusieurs variétés de fromage, autre que le fromage à la crème, le fromage cottage ou le fromage de petit-lait, en vue de former une masse homogène,
(ii) contenir, en quantité suffisante pour pouvoir se distinguer de la préparation de fromage conditionné à froid, tout en conservant sa nature fondamentale, les ingrédients suivants :
(A) des assaisonnements, du chocolat, des condiments, des épices ou des préparations aromatisantes,
(B) des achards, des cornichons, des fruits, des légumes ou des noix,
(C) de la viande préparée ou conservée, ou
(D) du poisson préparé ou conservé, et
(iii) contenir
(A) du lait ou des produits du lait ajoutés,
(B) au plus 46 pour cent d’humidité, et
(C) au moins 22 pour cent de matière grasse de lait; et
b) peut contenir
(i) de l’eau ajoutée pour modifier la teneur en humidité,
(ii) de la matière grasse de lait ajoutée,
(iii) des agents édulcorants, du sel et du vinaigre,
(iv) les colorants suivants :
(A) en quantité conforme aux bonnes pratiques industrielles, le rocou, le ß-carotène, la chlorophylle, le paprika, la riboflavine, le curcuma, et
(B) en quantité n’excédant pas 35 parties par million, le ß-apo-8′-caroténal, l’ester éthylique de l’acide ß-apo-8′-caroténoïque ou un mélange de ces produits,
(v) les agents émulsifiants, gélatinisants, stabilisants et épaississants qui suivent :
en quantité ne dépassant pas 0,5 pour cent, la carragénine d’ammonium, la carragénine de calcium, la gomme de caroube (fève de l’acacia vulgaire ou faux acacia), la carragénine, la gélatine, la gomme de guar, la gélose de mousse d’Irlande, la carragénine de potassium, l’alginate de propylèneglycol, la carboxyméthylcellulose sodique (carboxyméthylcellulose, gomme de cellulose, glycolate sodique de cellulose), la carragénine sodique, la gomme adragante, la gomme xanthane ou un mélange de ces produits,
(vi) en quantité conforme aux bonnes pratiques industrielles, de l’acide acétique, du carbonate de calcium, de l’acide citrique, de l’acide lactique, de l’acide malique, de l’acide phosphorique, du bicarbonate de potassium, du carbonate de potassium, du bicarbonate de sodium, du carbonate de sodium et de l’acide tartarique comme rajusteurs du pH,
(vii) de la fumée de bois comme agent de conservation, en quantité conforme aux bonnes pratiques industrielles, et
(viii) les agents de conservation suivants :
(A) l’acide propionique, le propionate de calcium, le propionate de sodium ou un mélange de ces produits, en quantité n’excédant pas 2 000 parties par million, calculée en acide propionique,
(B) l’acide sorbique, le sorbate de calcium, le sorbate de potassium, le sorbate de sodium ou un mélange de ces produits, en quantité n’excédant pas 3 000 parties par million, calculée en acide sorbique, ou
(C) un mélange des agents de conservation visés aux dispositions (A) et (B), en quantité n’excédant pas 3 000 parties par million, calculée respectivement en acide propionique et en acide sorbique.
(2) L’étiquette d’un fromage ne doit porter le terme « fumé » que si de la fumée de bois a été ajoutée au fromage conformément au paragraphe (1).
(3) Dans les cas visés au paragraphe (2), le terme « fumé » doit paraître dans l’espace principal de l’étiquette.
- DORS/79-752, art. 2
- DORS/2007-302, art. 4(F)
- DORS/2011-278, art. 8
- DORS/2017-18, art. 18(F)
- DORS/2018-69, art. 28(F)
B.08.042 Est interdite à tout fabricant la vente de fromage entier qui n’a pas été fabriqué à partir d’une matière première pasteurisée, à moins que la date du début de la fabrication ne soit
a) marquée ou timbrée sur ledit fromage dans les trois jours; ou
b) marquée sur l’étiquette au moment de l’empaquetage, si ledit fromage est d’un type tel qu’il soit difficile, en raison de sa texture, de sa consistance ou de sa structure physique, d’y marquer ou timbrer ladite date.
B.08.043 Est interdite à tout fabricant la vente de tout fromage qui n’a pas été fabriqué à partir d’une matière première pasteurisée, si ledit fromage a été subdivisé en petites portions, à moins
a) que ledit fromage n’ait été dûment entreposé; ou
b) que chaque portion du fromage découpé ne porte la date du début de sa fabrication marquée, timbrée ou imprimée.
B.08.044 (1) Est interdite la vente d’un fromage, y compris le caillé de fromagerie, qui n’a pas été fabriqué à partir d’une matière première pasteurisée sauf s’il a été entreposé.
(2) Le fromage, y compris le caillé de fromagerie, qui n’est pas fait d’une matière première pasteurisée, peut être utilisé comme ingrédient dans un aliment si celui-ci est fabriqué ou traité de façon à pasteuriser le fromage selon la méthode prévue dans la définition de « matière première pasteurisée » au paragraphe B.08.030(1).
- DORS/78-405, art. 1
- DORS/79-752, art. 3
B.08.045 Nonobstant l’article B.08.044, le fromage qui n’a pas été fabriqué à partir d’une matière première pasteurisée et qui n’a pas été entreposé, mais qui porte marquée ou timbrée la date du début de sa fabrication, peut être vendu à
a) un grossiste;
b) un intermédiaire; ou
c) en quantité d’au moins 900 livres, à un détaillant.
B.08.046 Est interdite la vente de tout fromage entier n’ayant pas été fabriqué à partir d’une matière première pasteurisée, à moins que la date du début de la fabrication ne soit timbrée sur ledit fromage.
B.08.047 Tout fabricant, grossiste, ou intermédiaire, qui vend du fromage n’ayant pas été fabriqué à partir d’une matière première pasteurisée et qui n’a pas été entreposé, doit tenir un registre
a) du numéro d’inscription de la fromagerie,
b) de la date de fabrication dudit fromage,
c) du ou des numéros de cuvées,
d) du nom et de l’adresse de la personne à laquelle le fromage est vendu, et
e) du poids vendu de fromage provenant de chaque cuvée,
pour chaque lot de fromage vendu.
B.08.048 (1) Sous réserve de l’article B.08.054, est interdite la vente d’un fromage, y compris le caillé de fromagerie, fabriqué à partir d’une matière première pasteurisée s’il renferme plus de
a) 100 Escherichia coli, ou
b) 100 Staphylococcus aureus
par gramme, après analyse selon la méthode officielle MFO-14, « Examen microbiologique du fromage », 30 novembre 1983.
(2) Est interdite la vente d’un fromage fabriqué à partir d’une matière première non pasteurisée, s’il renferme plus de
a) 500 Escherichia coli, ou
b) 1 000 Staphylococcus aureus
par gramme, après analyse selon la méthode officielle MFO-14, « Examen microbiologique du fromage », 30 novembre 1983.
- DORS/78-405, art. 2
- DORS/82-768, art. 21
- DORS/84-17, art. 4
B.08.049 [N]. Le petit-lait:
a) est le produit qui reste après que le caillé a été extrait du lait lors de la fabrication du fromage;
b) peut contenir :
(i) de la catalase, s’il s’agit de petit-lait liquide qui a été traité avec du peroxyde d’hydrogène,
(ii) de la lactase,
(iii) du peroxyde d’hydrogène, s’il s’agit de petit-lait liquide destiné à la fabrication de produits de petit-lait séché,
(iv) du peroxyde de benzoyle ainsi que du phosphate tricalcique et du sulfate de calcium, comme véhicules du peroxyde de benzoyle, s’il s’agit de petit-lait liquide destiné à la fabrication de produits de petit-lait séché autres que ceux entrant dans les préparations pour nourrissons,
(v) de l’hexamétaphosphate de sodium, s’il s’agit de petit-lait liquide destiné à la fabrication de produits de petit-lait concentré ou séché.
- DORS/79-752, art. 4
- DORS/89-555, art. 1
- DORS/2010-40, art. 1
- DORS/2011-282, art. 1
B.08.050 [Abrogé, DORS/95-281, art. 1]
B.08.051 [N]. Le fromage cottage:
a) doit être le produit, sous forme de petits grumeaux, préparé à partir de lait écrémé, de lait écrémé évaporé ou de lait écrémé en poudre et de cultures bactériennes anodines qui produisent un acide;
b) doit contenir au plus 80 pour cent d’humidité;
c) peut contenir au plus 0,5 pour cent d’agent stabilisant;
d) peut contenir :
(i) du lait,
(ii) de la crème,
(iii) du lait en poudre,
(iv) de la présure provenant de l’extrait aqueux du 4e (véritable) estomac de veaux, de chevreaux ou d’agneaux,
(v) l’enzyme coagulant le lait provenant de Rhizomucor miehei (Cooney et Emerson) (précédemment nommé Mucor miehei (Cooney et Emerson)), de Mucor pusillus Lindt par fermentation de culture pure ou de Aspergillus oryzae RET-1 (pBoel777), en quantité conforme aux bonnes pratiques industrielles,
(vi) de la chymosine A provenant de Escherichia coli K-12, GE81 (pPFZ87A), en quantité conforme aux bonnes pratiques industrielles,
(vi.1) de la chymosine B provenant de Aspergillus niger var. awamori, GCC0349 (pGAMpR) ou de Kluyveromyces marxianus var. lactis, DS1182 (pKS 105), en quantité conforme aux bonnes pratiques industrielles,
(vi.2) pepsine provenant de la muqueuse glandulaire de l’estomac de porc,
(vii) du sel,
(viii) du chlorure de calcium,
(ix) du lactose ajouté,
(x) des rajusteurs de pH,
(xi) des achards (relish),
(xii) des fruits,
(xiii) des légumes,
(xiv) du dioxyde de carbone.
- DORS/81-60, art. 4
- DORS/92-197, art. 7
- DORS/94-212, art. 7
- DORS/95-183, art. 7
- DORS/98-458, art. 4
- DORS/2001-94, art. 2
- DORS/2005-98, art. 7
- DORS/2010-143, art. 7 et 39(A)
B.08.052 [N]. Le fromage cottage en crème doit être du fromage cottage qui renferme de la crème, ou un mélange de crème et de lait ou de lait écrémé, ou les deux, en quantité telle que le produit fini doit renfermer
a) au moins quatre pour cent de gras de lait; et
b) pas plus de 80 pour cent d’humidité et peut renfermer des agents émulsifiants, gélatinisants, stabilisants ou épaississants.
B.08.053 Tout produit laitier employé dans la préparation du fromage cottage doit avoir été pasteurisé.
B.08.054 Est interdite la vente du fromage cottage et du fromage cottage en crème dont la teneur bactérienne dépasse 10 bactéries coliformes par gramme, déterminée selon la méthode officielle MFO-4, Examen microbiologique du fromage cottage, 30 novembre 1981.
- DORS/82-768, art. 22
Beurre
B.08.056 [N]. Le beurre:
a) doit :
(i) être l’aliment préparé, conformément aux bonnes pratiques industrielles, à partir du lait ou des produits du lait,
(ii) contenir au moins 80 pour cent de la matière grasse du lait;
b) peut contenir :
(i) des solides du lait,
(ii) des cultures bactériennes,
(iii) du sel,
(iv) un colorant alimentaire.
- DORS/92-400, art. 10
B.08.057 [N]. Le beurre de petit-lait doit être du beurre fabriqué de crème de petit-lait.
- DORS/92-400, art. 10
Crème glacée
B.08.061 [N]. Le mélange pour crème glacée
a) est un mélange pasteurisé, mais non congelé, de crème, de lait ou d’autres produits du lait, édulcoré avec du sucre, du sucre liquide, du sucre inverti, du miel, du dextrose, du glucose, du sirop de maïs, des solides du sirop de maïs ou avec un mélange de n’importe lesquels de ces édulcorants;
b) peut renfermer
(i) des oeufs,
(ii) une préparation aromatisante,
(iii) du cacao ou du sirop de chocolat,
(iv) un colorant pour aliments,
(v) des rajusteurs de pH,
(vi) de la cellulose microcristalline ou un agent stabilisant, ou les deux, en quantité telle que la crème glacée, faite du mélange, n’en contiendra pas plus de 0,5 pour cent,
(vii) un chélateur ou agent séquestrant,
(viii) du sel,
(ix) au plus un pour cent de caséine comestible ou de caséinates comestibles ajoutés,
(x) des esters monoacides gras de propylèneglycol en quantité telle que la crème glacée, faite du mélange, n’en contiendra pas plus de 0,35 pour cent et du tristéarate de sorbitan en quantité telle que la crème glacée, faite du mélange, n’en contiendra pas plus de 0,035 pour cent;
c) doit renfermer au moins
(i) 36 pour cent de solides, et
(ii) 10 pour cent de gras de lait ou, si du cacao ou du sirop de chocolat ont été ajoutés, huit pour cent de gras de lait.
- DORS/92-400, art. 11
- DORS/97-543, art. 2(F)
- DORS/2007-75, art. 2
- DORS/2007-302, art. 4(F)
- DORS/2010-142, art. 6(F)
B.08.062 [N]. La crème glacée
a) est l’aliment congelé obtenu par congélation d’un mélange à crème glacée, avec ou sans incorporation d’air;
b) peut renfermer du cacao ou du sirop de chocolat, des fruits, des noix et des confiseries;
c) doit renfermer au moins
(i) 36 pour cent de solides,
(ii) 10 pour cent de gras de lait ou, si du cacao ou du sirop de chocolat, des fruits, des noix ou des confiseries ont été ajoutés, huit pour cent de gras de lait, et
(iii) 180 grammes de solides au litre dont au moins 50 grammes doivent être de la matière grasse du lait, ou, si du cacao ou du sirop de chocolat, des fruits, des noix ou des confiseries ont été ajoutés, 180 grammes de solides au litre, dont au moins 40 grammes doivent être de la matière grasse du lait;
d) doit renfermer au plus
(i) 100 000 bactéries par gramme, et
(ii) 10 organismes coliformes par gramme,
déterminés selon la méthode officielle MFO-2, Examen microbiologique de la crème glacée ou du lait glacé, 30 novembre 1981.
- DORS/82-768, art. 23
- DORS/92-400, art. 12
Sorbet laitier
- DORS/98-580, art. 1(F)
B.08.063 [N]. Le sorbet laitier
a) doit être l’aliment congelé, autre que la crème glacée ou le lait glacé, fabriqué à partir d’un produit du lait;
b) peut renfermer
(i) de l’eau,
(ii) un agent édulcorant,
(iii) des fruits ou jus de fruits,
(iv) de l’acide citrique ou tartrique,
(v) une préparation aromatisante,
(vi) un colorant pour aliments,
(vii) au plus 0,75 pour cent d’agent stabilisant,
(viii) un chélateur ou agent séquestrant,
(ix) du lactose,
(x) au plus, 0,5 pour cent de cellulose microcristalline,
(xi) au plus un pour cent de caséine comestible ou de caséinates comestibles ajoutés;
c) doit renfermer
(i) au plus cinq pour cent de solides du lait, y compris le gras de lait, et
(ii) au moins 0,35 pour cent d’acide, déterminé par titration et exprimé en acide lactique.
- DORS/92-400, art. 13
- DORS/97-543, art. 3(F)
- DORS/98-580, art. 1(F)
- DORS/2007-302, art. 4(F)
Lait glacé
B.08.071 [N]. Le mélange pour lait glacé
a) est un mélange pasteurisé, mais non congelé, de crème, de lait ou d’autres produits du lait, édulcoré avec du sucre, du sucre liquide, du sucre inverti, du miel, du dextrose, du glucose, du sirop de maïs, des solides du sirop de maïs ou avec un mélange de n’importe lesquels de ces édulcorants;
b) peut renfermer
(i) des oeufs,
(ii) une préparation aromatisante,
(iii) du cacao ou du sirop de chocolat,
(iv) un colorant pour aliments,
(v) un rajusteur de pH,
(vi) un agent stabilisant en quantité telle que la teneur dans le lait glacé sera d’au plus 0,5 pour cent,
(vii) un chélateur ou agent séquestrant,
(viii) du lactose ajouté,
(ix) au plus, 1,5 pour cent de cellulose microcristalline,
(x) du sel,
(xi) au plus un pour cent de caséine comestible ou de caséinates comestibles ajoutés;
c) doit renfermer
(i) au moins 33 pour cent de solides, et
(ii) au moins trois pour cent et au plus cinq pour cent de gras de lait.
- DORS/92-400, art. 14
- DORS/97-543, art. 4(F)
- DORS/2007-302, art. 4(F)
B.08.072 [N]. Le lait glacé
a) est l’aliment congelé obtenu par congélation d’un mélange à lait glacé, avec ou sans incorporation d’air;
b) peut renfermer du cacao ou du sirop de chocolat, des fruits, des noix et des confiseries;
c) doit renfermer
(i) au moins 33 pour cent de solides,
(ii) au moins trois pour cent et au plus cinq pour cent de gras de lait, et
(iii) au moins 160 grammes de solides au litre, dont au moins 14 grammes doivent être de la matière grasse du lait;
d) doit renfermer au plus
(i) 100 000 bactéries par gramme, et
(ii) 10 organismes coliformes par gramme,
déterminés selon la méthode officielle MFO-2, Examen microbiologique de la crème glacée ou du lait glacé, 30 novembre 1981.
- DORS/82-768, art. 24
- DORS/92-400, art. 15
B.08.073 [Abrogé, DORS/92-626, art. 13]
B.08.074 (1) Le pourcentage de la matière grasse du lait contenu dans
a) le yogourt,
b) le fromage cottage, et
c) le fromage cottage en crème,
doit être indiqué sur l’espace principal et suivi de l’expression « matière grasse du lait » ou de l’abréviation « M.G. ».
(2) En plus de la mention exigée au paragraphe (1), il peut être indiqué sur l’étiquette d’un aliment mentionné à ce paragraphe sa teneur en matières grasses exprimée en grammes par portion indiquée.
- DORS/88-559, art. 18
- DORS/2016-305, art. 75(F)
Crème
B.08.075 [N]. La crème
a) doit être le liquide gras obtenu par séparation des éléments du lait, de manière à élever la teneur du liquide en gras de lait; et
b) peut contenir :
(i) un agent rajusteur de pH,
(ii) un agent stabilisant,
(iii) dans le cas de la crème à fouetter qui a été thermisée à une chaleur supérieure à 100 °C, les ingrédients et les additifs alimentaires suivants :
(A) du lait écrémé en poudre en quantité n’excédant pas 0,25 pour cent,
(B) des solides de glucose en quantité n’excédant pas 0,1 pour cent,
(C) du sulfate de calcium en quantité n’excédant pas 0,005 pour cent,
(D) de la gomme xanthane en quantité n’excédant pas 0,02 pour cent,
(E) [Abrogée, DORS/2010-142, art. 7]
(iv) dans le cas de la crème à fouetter, de la cellulose microcristalline en quantité n’excédant pas 0,2 pour cent.
- DORS/79-662, art. 2
- DORS/82-1071, art. 6
- DORS/88-419, art. 1
- DORS/2010-142, art. 7
B.08.076 (1) Le pourcentage de la matière grasse du lait contenue dans la crème en conserve doit être indiqué sur l’espace principal de l’étiquette et suivi de l’expression « matière grasse du lait » ou de l’abréviation « M.G. ».
(2) En plus de la mention exigée au paragraphe (1), il peut être indiqué sur l’étiquette de la crème en conserve sa teneur en matières grasses exprimée en grammes par portion indiquée.
- DORS/88-559, art. 19
- DORS/2016-305, art. 75(F)
B.08.077 [N]. La crème sure
a) est préparée à partir de crème pasteurisée surie au moyen d’une culture bactérienne productrice d’acide et doit renfermer au moins 14 pour cent de gras de lait; et
b) peut renfermer
(i) des solides de lait,
(ii) des solides de petit-lait,
(iii) du lait de beurre,
(iv) de l’amidon en quantité ne dépassant pas un pour cent,
(v) du sel,
(vi) de la présure provenant de l’extrait aqueux du 4e (véritable) estomac de veaux, de chevreaux ou d’agneaux, en quantité conforme aux bonnes pratiques industrielles,
(vii) les additifs alimentaires suivants faisant fonction d’agents émulsifiants, gélatinisants, stabilisants et épaississants :
(A) algine, gomme de caroube, carraghénine, gélatine, gomme de guar, pectine, alginate de propylèneglycol ou un mélange de ces substances, en quantité ne dépassant pas 0,5 pour cent,
(B) monoglycérides, mono et diglycérides, seuls ou combinés, en quantité ne dépassant pas 0,3 pour cent, et
(C) phosphate disodique en quantité ne dépassant pas 0,05 pour cent,
(viii) du citrate de sodium en tant que précurseur de saveur en quantité ne dépassant pas 0,1 pour cent,
(ix) l’enzyme coagulant le lait provenant de Rhizomucor miehei (Cooney et Emerson) (précédemment nommé Mucor miehei (Cooney et Emerson)), de Mucor pusillus Lindt par fermentation de culture pure ou de Aspergillus oryzae RET-1 (pBoel777), en quantité conforme aux bonnes pratiques industrielles,
(x) de la chymosine A provenant de Escherichia coli K-12, GE81 (pPFZ87A), en quantité conforme aux bonnes pratiques industrielles,
(xi) de la chymosine B provenant de Aspergillus niger var. awamori, GCC0349 (pGAMpR) ou de Kluyveromyces marxianus var lactis, DS1182 (pKS 105), en quantité conforme aux bonnes pratiques industrielles.
- DORS/78-876, art. 1
- DORS/80-500, art. 3
- DORS/81-60, art. 5
- DORS/92-197, art. 8
- DORS/94-212, art. 8
- DORS/95-183, art. 8
- DORS/98-458, art. 5
- DORS/2005-98, art. 7
- DORS/2010-143, art. 8 et 39(A)
TITRE 9Graisses et huiles
B.09.001 [N]. Les graisses et les huiles végétales doivent être entièrement obtenues de la source végétale d’où elles tirent leur nom et posséder une saveur et une odeur douces; elles peuvent, à l’exception de l’huile d’olive, contenir des agents émulsifiants, des agents de conservation de la catégorie IV, un agent antimousse et du carotène-B en quantité suffisante pour compenser la perte subie pendant le traitement, pourvu qu’une telle addition soit déclarée sur l’étiquette.
- DORS/85-179, art. 1
B.09.002 [N]. Les graisses et les huiles d’origine animale doivent être entièrement obtenues d’animaux sains au moment de l’abattage, posséder une saveur et une odeur douces et peuvent contenir,
a) à l’exception du gras de lait et du suif, des agents de conservation de la catégorie IV; et
b) à l’exception du saindoux, du gras de lait et du suif, un agent antimousse.
B.09.003 [N]. L’huile d’olive ou huile douce
a) doit être l’huile obtenue du fruit de l’olivier (Olea europaea L);
b) doit avoir la composition en acides gras
(i) d’au moins 56,0 et d’au plus 83,0 pour cent d’acide oléique,
(ii) d’au moins 7,5 et d’au plus 20,0 pour cent d’acide palmitique,
(iii) d’au moins 3,5 et d’au plus 20,0 pour cent d’acide linoléique,
(iv) d’au moins 0,5 et d’au plus 3,5 pour cent d’acide stéarique,
(v) d’au moins 0,3 et d’au plus 3,5 pour cent d’acide palmitoléique,
(vi) d’au plus 1,5 pour cent d’acide linolénique, et
(vii) d’au plus 0,05 pour cent d’acide myristique, calculé en esters méthyliques;
c) doit contenir en quantités minimes seulement l’acide arachidique, l’acide béhénique, l’acide gadoléique ou l’acide lignocérique;
d) doit avoir
(i) une densité relative (gravité spécifique), calculée lorsque l’huile est à 20 °C et l’eau à 20 °C (20 °C/eau à 20 °C), d’au moins 0,910 et d’au plus 0,916,
(ii) un indice de réfraction, lorsqu’on utilise la raie D du sodium comme source lumineuse et que l’huile d’olive est à 20 °C (nD20 °C), d’au moins 1,4677 et d’au plus 1,4705,
(iii) un indice d’iode, en utilisant l’épreuve de Wijs, d’au moins 75 et d’au plus 94,
(iv) un indice de saponification, exprimé en milligrammes d’hydroxyde de potassium par gramme d’huile, d’au moins 184 et d’au plus 196,
(v) un indice d’acidité d’au plus 6,6 mg d’hydroxyde de potassium par gramme d’huile,
(vi) une acidité libre d’au plus 3,3 pour cent exprimée en tant qu’acide oléique,
(vii) un indice de peroxyde d’au plus 20 milliéquivalents d’oxygène des peroxydes par kilogramme d’huile,
(viii) une teneur en substances insaponifiables d’au plus 15 g/kg, et
(ix) un indice de Bellier d’au plus 17;
e) doit donner des résultats négatifs pour les épreuves des huiles semi-siccatives, de l’huile de résidu d’olive, de l’huile de coton, de l’huile de thé et de l’huile de sésame; et
f) nonobstant l’article B.09.001, peut contenir de l’alphatocophérol en quantités suffisantes pour remplacer la quantité perdue au cours du raffinage, pourvu qu’une telle addition soit déclarée sur l’étiquette.
- DORS/78-655, art. 1
B.09.004 [N]. L’huile de coton
a) est l’huile des graines de l’espèce cultivée de Gossypium;
b) doit avoir
(i) une densité relative (20 °C/eau à 20 °C) d’au moins 0,918 et d’au plus 0,926,
(ii) un indice de réfraction (nD40 °C) d’au moins 1,458 et d’au plus 1,466,
(iii) un indice de saponification (milligrammes d’hydroxyde de potassium par gramme d’huile) d’au moins 189 et d’au plus 198,
(iv) un indice d’iode (Wijs) d’au moins 99 et d’au plus 119,
(v) une teneur en substances insaponifiables d’au plus 15 grammes par kilogramme,
(vi) un test Halphen positif,
(vii) un indice d’acidité d’au plus 0,6 milligramme d’hydroxyde de potassium par gramme d’huile, et
(viii) un indice de peroxyde d’au plus 10 milliéquivalents d’oxygène dégagé par kilogramme d’huile; et
c) peut renfermer de l’oxystéarine.
B.09.005 [N]. Le beurre de cacao est la matière grasse extraite de fèves de cacao décortiquées, avant ou après torréfaction, ou de la liqueur de cacao et possède les caractéristiques suivantes :
a) un indice de réfraction (à 40 °C) d’au moins 1,453 et d’au plus 1,458;
b) un indice de saponification d’au moins 188 et d’au plus 202;
c) un indice d’iode (Hanus) d’au moins 32 et d’au plus 41; et
d) un indice d’acidité d’au plus cinq.
- DORS/97-263, art. 3
B.09.006 [N]. L’huile de maïs ou huile de blé d’inde
a) est l’huile du germe ou de l’embryon de Zea mays L.; et
b) doit avoir
(i) une densité relative (20 °C/eau à 20 °C) d’au moins 0,917 et d’au plus 0,925,
(ii) un indice de réfraction (nD40 °C) d’au moins 1,465 et d’au plus 1,468,
(iii) un indice de saponification (milligrammes d’hydroxyde de potassium par gramme d’huile) d’au moins 187 et d’au plus 195,
(iv) un indice d’iode (Wijs) d’au moins 103 et d’au plus 128,
(v) une teneur en substances insaponifiables d’au plus 28 grammes par kilogramme,
(vi) un indice d’acidité d’au plus 0,6 milligramme d’hydroxyde de potassium par gramme d’huile, et
(vii) un indice de peroxyde d’au plus 10 milliéquivalents d’oxygène dégagé par kilogramme d’huile.
B.09.007 [N]. L’huile d’arachide
a) est l’huile des graines d’Arachis hypogaea L.;
b) doit avoir
(i) une densité relative (20 °C/eau à 20 °C) d’au moins 0,914 et d’au plus 0,917,
(ii) un indice de réfraction (nD40 °C) d’au moins 1,460 et d’au plus 1,465,
(iii) un indice de saponification (milligrammes d’hydroxyde de potassium par gramme d’huile) d’au moins 187 et d’au plus 196,
(iv) un indice d’iode (Wijs) d’au moins 80 et d’au plus 106,
(v) une teneur en substances insaponifiables d’au plus 10 grammes par kilogramme,
(vi) une proportion d’acide arachidique ou d’acides gras supérieurs, d’au moins 48 grammes par kilogramme,
(vii) un indice d’acidité d’au plus 0,6 milligramme d’hydroxyde de potassium par gramme d’huile, et
(viii) un indice de peroxyde d’au plus 10 milliéquivalents d’oxygène dégagé par kilogramme d’huile; et
c) peut renfermer de l’oxystéarine.
- DORS/84-300, art. 22(A)
B.09.008 [N]. L’huile de fève de soya, l’huile de soja ou l’huile de soya
a) est l’huile des graines de Glycine max (L.) Merr.;
b) doit avoir
(i) une densité relative (20 °C/eau à 20 °C) d’au moins 0,919 et d’au plus 0,925,
(ii) un indice de réfraction (nD40 °C) d’au moins 1,466 et d’au plus 1,470,
(iii) un indice de saponification (milligrammes d’hydroxyde de potassium par gramme d’huile) d’au moins 189 et d’au plus 195,
(iv) un indice d’iode (Wijs) d’au moins 120 et d’au plus 143,
(v) une teneur en substances insaponifiables d’au plus 15 grammes par kilogramme,
(vi) un indice d’acidité d’au plus 0,6 milligramme d’hydroxyde de potassium par gramme d’huile, et
(vii) un indice de peroxyde d’au plus 10 milliéquivalents d’oxygène dégagé par kilogramme d’huile; et
c) peut renfermer de l’oxystéarine.
- DORS/84-300, art. 23(A)
B.09.009 [N]. L’huile de graine de tournesol ou l’huile de tournesol
a) est l’huile des graines de Helianthus annuus L.; et
b) doit avoir
(i) une densité relative (20 °C/eau à 20 °C) d’au moins 0,918 et d’au plus 0,923,
(ii) un indice de réfraction (nD40 °C) d’au moins 1,467 et d’au plus 1,469,
(iii) un indice d’iode (Wijs) d’au moins 110 et d’au plus 143,
(iv) un indice de saponification (milligrammes d’hydroxyde de potassium par gramme d’huile) d’au moins 188 et d’au plus 194,
(v) une teneur en substances insaponifiables d’au plus 15 grammes par kilogramme,
(vi) un indice d’acidité d’au plus 0,6 milligramme d’hydroxyde de potassium par gramme d’huile, et
(vii) un indice de peroxyde d’au plus 10 milliéquivalents d’oxygène dégagé par kilogramme d’huile.
B.09.009A [N]. L’huile de graines de carthame ou l’huile de carthame
a) est l’huile des graines de Carthamus tinctorius L.; et
b) doit avoir
(i) une densité relative (20 °C/eau à 20 °C) d’au moins 0,922 et d’au plus 0,927,
(ii) un indice de réfraction (nD40 °C) d’au moins 1,467 et d’au plus 1,470,
(iii) un indice de saponification (milligrammes d’hydroxyde de potassium par gramme d’huile) d’au moins 186 et d’au plus 198,
(iv) un indice d’iode (Wijs) d’au moins 135 et d’au plus 150,
(v) une teneur en substances insaponifiables d’au plus 15 grammes par kilogramme,
(vi) un indice d’acidité d’au plus 0,6 milligramme d’hydroxyde de potassium par gramme d’huile, et
(vii) un indice de peroxyde d’au plus 10 milliéquivalents d’oxygène dégagé par kilogramme d’huile.
B.09.010 Malgré le nom usuel mentionné dans le document sur les noms usuels d’ingrédients et de constituants, lorsqu’elle est un ingrédient d’huile à friture ou de table, la graisse ou l’huile végétale doit être désignée dans la liste d’ingrédients par son nom usuel.
- DORS/98-458, art. 7(F)
- DORS/2022-143, art. 20
B.09.011 [N]. Le shortening autre que le beurre et le saindoux, est un aliment mi-solide préparé à partir de matières grasses, d’huile ou d’un mélange de matières grasses et d’huiles pouvant être soumis à une hydrogénation entière, et peut contenir les ingrédients suivants :
a) des agents de conservation de la catégorie IV,
b) un agent anti-mousse,
c) du monoglycéride citrate de stéaryle,
d) des monoglycérides, ou un mélange de monoglycérides et de diglycérides des acides gras lipogènes, le poids des monoglycérides ne dépassant pas 10 pour cent, et le poids global des monoglycérides et des diglycérides ne dépassant pas 20 pour cent du poids du shortening,
e) des monoglycérides lactylés, ou un mélange de monoglycérides et de diglycérides lactylés des acides gras lipogènes, le poids global ne dépassant pas huit pour cent du poids du shortening, et
f) tristéarate de sorbitan,
sauf que le poids global des ingrédients permis aux alinéas d) et e) ne doit pas dépasser 20 pour cent du poids du shortening.
B.09.012 [Abrogé, DORS/97-148, art. 2]
B.09.013 [N]. Le saindoux
a) doit être la graisse fondue provenant du porc;
b) doit avoir
(i) une densité relative (gravité spécifique) calculée lorsque le saindoux est à 40 °C et l’eau à 20 °C (40 °C/eau à 20 °C), d’au moins 0,894 et d’au plus 0,906,
(ii) un indice de réfraction, lorsqu’on utilise la raie D du sodium comme source lumineuse et que le saindoux est à 40 °C (nD40 °C), d’au moins 1,448 et d’au plus 1,461,
(iii) un titrage d’au moins 32 °C et d’au plus 45 °C,
(iv) un indice de saponification, exprimé en milligrammes d’hydroxyde de potassium par gramme de matière grasse, d’au moins 192 et d’au plus 203,
(v) un indice d’iode, en utilisant l’épreuve de Wijs, d’au moins 45 et d’au plus 70,
(vi) une teneur en substances insaponifiables d’au plus 12 g/kg,
(vii) un indice d’acidité d’au plus 2,5 mg d’hydroxyde de potassium par gramme de matière grasse, et
(viii) un indice de peroxyde d’au plus 16 milliéquivalents d’oxygène de peroxydes par kilogramme de matière grasse; et
c) peut contenir
(i) de la stéarine de saindoux ou du saindoux entièrement hydrogéné,
(ii) un agent de conservation de la catégorie IV, et
(iii) au plus un pour cent de substances provenant de la fonte de lard, autres que les acides gras ou des matières grasses.
- DORS/78-401, art. 1(F)
- DORS/84-300, art. 25(F)
- DORS/2022-168, art. 40
B.09.014 [N]. Le saindoux de panne doit être la graisse fondue à la température modérée, provenant du tissu adipeux interne de l’abdomen du porc, à l’exclusion de la graisse adhérant aux intestins, et doit avoir un indice d’iode (Hanus) d’au plus 65.
B.09.015 [N]. Le suif
a) doit être de matière grasse de l’aloyau ou de rognons, ou la graisse de la coiffe, obtenue d’une carcasse de boeuf;
b) doit avoir
(i) une densité relative (gravité spécifique), calculée lorsque le suif est à 40 °C et l’eau à 20 °C (40 °C/eau à 20 °C), d’au moins 0,893 et d’au plus 0,898,
(ii) un indice de réfraction, lorsqu’on utilise la raie D du sodium comme source lumineuse et que le suif est à 40 °C (nD40 °C), d’au moins 1,448 et d’au plus 1,460,
(iii) un titrage d’au moins 42,5 °C et d’au plus 47 °C,
(iv) un indice de saponification, exprimé en milligrammes d’hydroxyde de potassium par gramme de matière grasse, d’au moins 190 et d’au plus 200,
(v) un indice d’iode, en utilisant l’épreuve de Wijs, d’au moins 32 et d’au plus 47,
(vi) une teneur en substances insaponifiables d’au plus 10 g/kg,
(vii) un indice d’acidité d’au plus 2 mg d’hydroxyde de potassium par gramme de matière grasse, et
(viii) un indice de peroxyde d’au plus 10 milliéquivalents, d’oxygène de peroxydes par kilogramme de matière grasse; et
c) doit renfermer au plus trois pour cent de céréales et un pour cent de sel lorsqu’il est vendu sous forme de suif haché.
- DORS/78-655, art. 2(F)
B.09.016 [N]. La margarine
a) est une émulsion plastique ou liquide d’eau dans de la graisse, de l’huile ou des graisses et des huiles ne provenant pas du lait et pouvant avoir été soumises à une hydrogénation entière;
b) doit contenir :
(i) au moins 80 % de graisse, d’huile ou d’une combinaison de graisse et d’huile exprimées en gras,
(ii) au moins 3 300 U.I. de vitamine A par 100 g,
(iii) 26 μg de vitamine D par 100 g;
c) peut renfermer :
(i) de la poudre de lait écrémé, du babeurre en poudre ou du babeurre liquide,
(ii) du petit-lait ou des solides de petit-lait modifié,
(iii) des protéines,
(iv) de l’eau,
(v) de la vitamine E, si celle-ci est ajoutée en une quantité telle que le produit final contienne au moins 0,6 U.I. d’alpha-tocophérol par gramme d’acide linoléique présent dans la margarine,
(vi) un agent aromatisant,
(vii) un agent édulcorant,
(viii) du chlorure de potassium et du chlorure de sodium,
(ix) les colorants pour aliments suivants : ß-apo-8′-caroténal, canthaxanthine, carotène, curcuma, ester éthylique de l’acide ß-apo-8′-caroténoïque et rocou, visés au tableau III de l’article B.16.100,
(x) les émulsifs suivants : lécithine, mono- et diglycérides, monoglycérides et tristéarate de sorbitan, visés au tableau IV de l’article B.16.100,
(xi) les rajusteurs du pH suivants : acide citrique, acide lactique, acide tartrique, bicarbonate de potassium, bicarbonate de sodium, carbonate de potassium, carbonate de sodium, citrate de potassium, citrate de sodium, hydroxyde de potassium, hydroxyde de sodium, lactate de potassium, lactate de sodium et tartrate double de sodium et de potassium, visés au tableau X de l’article B.16.100,
(xii) les agents de conservation de la catégorie II et de la catégorie IV suivants : acide benzoïque, acide sorbique, benzoate de potassium, benzoate de sodium, citrate de monoglycéride, citrate de monoisopropyle, esters citriques des mono- et diglycérides, gallate de propyle, hydroxyanisole butylé, hydroxytoluène butylé, palmitate d’ascorbyle, sorbate de calcium, sorbate de potassium, sorbate de sodium et stéarate d’ascorbyle, visés au tableau XI de l’article B.16.100,
(xiii) les agents séquestrants suivants : citrate de stéaryle et éthylènediaminetétraacétate de calcium disodique, visés au tableau XII de l’article B.16.100.
- DORS/81-60, art. 6
- DORS/84-300, art. 26(F)
- DORS/93-466, art. 1
- DORS/2011-235, art. 1
- DORS/2022-168, art. 41
B.09.017 [N]. La margarine réduite en calories
a) doit être conforme à la norme pour la margarine, sauf qu’elle ne doit pas renfermer plus de
(i) 40 pour cent de gras, d’huile ou de graisse et d’huile compté en gras,
(ii) 50 pour cent des calories qui seraient normalement présentes dans le produit s’il n’était pas réduit en calories;
b) sous réserve de l’alinéa c), peut renfermer l’un ou plusieurs des ingrédients suivants, en une quantité totale d’au plus 0,5 pour cent :
(i) de la gomme arabique,
(ii) de l’agar,
(iii) de l’algine,
(iv) de la gomme de caroube,
(v) de la carragénine,
(vi) du furcelleran,
(vii) de la gomme gellane,
(viii) de la gomme de guar,
(ix) de la gomme de sterculia,
(x) de l’alginate de propylèneglycol,
(xi) de la gomme adragante,
(xii) de la gomme xanthane;
c) peut contenir des esters polyglycéroliques d’acides gras :
(i) soit seuls, en une quantité d’au plus 0,2 pour cent,
(ii) soit en combinaison avec tout ingrédient visé à l’alinéa b), en une quantité d’au plus 0,2 pour cent pourvu que la quantité de cette combinaison de tels esters et d’ingrédients n’excède pas au total 0,5 pour cent;
d) malgré le sous-alinéa B.09.016c)(x), peut contenir de la lécithine en une quantité d’au plus 0,5 pour cent;
e) peut renfermer :
(i) de l’amidon végétal,
(ii) de l’amidon végétal modifié,
(iii) de la maltodextrine.
- DORS/94-38, art. 1
- DORS/95-350, art. 1
- DORS/96-160, art. 1
B.09.020 et B.09.021 [Abrogés, DORS/88-559, art. 20]
B.09.022 Est interdite la vente d’huile de cuisson, de margarine, d’huile à salade, de simili-produits laitiers, de shortening, ou d’un aliment qui rappelle la margarine ou le shortening, s’ils contiennent plus de cinq pour cent d’acides gras monoénoïques en C22 par rapport aux acides gras totaux renfermés dans le produit.
TITRE 10Préparations aromatisantes
B.10.003 [N]. L’extrait de (nom de l’arôme) ou l’essence de (nom de l’arôme), doit être une solution de principes sapides ou odorants, ou doués de ces deux propriétés, et extraits de la plante d’où l’extrait ou l’essence aromatique tire son nom, dans l’alcool éthylique, le glycérol, le propylène glycol, seuls ou en mélange, et peut renfermer de l’eau, un agent édulcorant, un colorant pour aliments, et un agent de conservation de la catégorie II ou de la catégorie IV.
B.10.004 [N]. L’extrait artificiel de (nom de l’arôme), l’essence artificielle de (nom de l’arôme), l’extrait imitation de (nom de l’arôme), l’essence imitation de (nom de l’arôme), doivent être des extraits ou essences aromatiques, sauf que les principes aromatiques doivent provenir en tout ou en partie de sources autres que la plante aromatique dont ils tirent leur nom et, si ledit extrait ou essence sont définis dans le présent règlement, le pouvoir aromatisant de l’extrait ou de l’essence, artificiel ou imitation, doit être au moins égal à celui de l’extrait ou de l’essence.
B.10.005 [N]. Une préparation aromatisante de (nom de l’arôme)
a) doit être une préparation, autre qu’une préparation aromatisante définie à l’article B.10.003, de principes sapides ou odorants, ou des deux, extraits de la plante aromatique dont la préparation tire son nom;
b) peut contenir un édulcorant, un colorant alimentaire, un agent de conservation de la catégorie II, du thaumatin, un agent de conservation de la catégorie IV ou un agent émulsifiant; et
c) ne peut contenir que les liquides ajoutés suivants :
(i) eau,
(ii) un ou un mélange quelconque des liquides suivants : 1,3-butylèneglycol, acétate d’éthyle, alcool éthylique, glycérol, diacétate de glycéryle, triacétate de glycéryle, tributyrate de glycéryle, alcool isopropylique, monoglycérides et diglycérides; 1,2-propylèneglycol ou citrate d’éthyl,
(iii) huile végétale comestible, et
(iv) acétate isobutyrate de sucrose, huile végétale bromée ou un mélange de ces produits, si la préparation aromatisante est utilisée dans les boissons contenant des huiles d’agrumes ou d’épinette.
- DORS/84-300, art. 27(A)
- DORS/86-1112, art. 1
- DORS/2010-142, art. 8
B.10.006 [N]. Une préparation aromatisante artificielle de (nom de l’arôme) ou une préparation aromatisante imitation de (nom de l’arôme) doit être une préparation aromatisante, sauf que les principes aromatiques peuvent provenir en tout ou en partie de sources autres que la plante aromatique dont la préparation tire son nom et, si ladite préparation aromatisante est définie dans le présent règlement, le pouvoir aromatisant de ladite préparation aromatisante artificielle ou imitation doit être au moins égal à celui de ladite préparation aromatisante.
B.10.007 [N]. Nonobstant les articles B.10.003 et B.10.005, un extrait de (nom du fruit) naturellement fortifié, une essence de (nom du fruit) naturellement fortifiée, une préparation aromatisante de (nom du fruit) naturellement fortifiée doivent être un extrait, une essence, ou une préparation aromatisante obtenus du fruit nommé, auxquels ont été ajoutés d’autres extraits naturels et dont 51 pour cent du pouvoir aromatisant doit provenir du fruit nommé.
B.10.008 Sur toute étiquette ou dans toute réclame d’une préparation aromatisante artificielle ou d’une imitation d’une préparation aromatisante, le mot « artificiel » ou « imitation » doit faire partie intégrante du nom de ladite préparation aromatisante, être imprimé en caractères identiques à ceux dudit nom et être disposé de façon identique.
- DORS/84-300, art. 28
B.10.009 [N]. L’essence d’amande, l’extrait d’amande et la préparation aromatisante à l’amande, doivent être extraits du noyau de l’amande amère, de l’abricot ou de la pêche, et doivent renfermer au moins un pour cent en volume de l’huile volatile ainsi obtenue, exempte d’acide cyanhydrique.
B.10.010 [N]. L’essence d’anis, l’extrait d’anis et la préparation aromatisante à l’anis, doivent être l’essence, l’extrait ou la préparation aromatisante, préparés à partir d’huile d’anis, naturelle ou déterpénée, et leur pouvoir aromatisant doit correspondre à celui d’une solution alcoolique qui renferme au moins trois pour cent en volume d’huile d’anis, huile volatile extraite du fruit de Pimpinella anisum L. ou d’Illicium Verum Hook.
B.10.011 [N]. L’essence de graine de céleri, l’extrait de graine de céleri et la préparation aromatisante à la graine de céleri, doivent être l’essence, l’extrait ou la préparation aromatisante, préparés à partir de graine de céleri, huile de graine de céleri, ou huile de graine de céleri déterpénée, et leur pouvoir aromatisant doit correspondre à celui d’une solution alcoolique qui renferme au moins 0,3 pour cent en volume d’huile volatile de graine de céleri.
B.10.012 [N]. L’essence de fausse cannelle (ou cannelle bâtarde), l’extrait de fausse cannelle et la préparation aromatisante à la fausse cannelle, doivent être l’essence, l’extrait ou la préparation aromatisante, obtenus de l’huile, naturelle ou déterpénée, extraite des feuilles et des rameaux de Cinnamomum cassia L., doivent renfermer au moins 80 pour cent d’aldéhyde cinnamique, et leur pouvoir aromatisant doit correspondre à celui d’une solution alcoolique qui renferme au moins deux pour cent en volume d’huile volatile de fausse cannelle ou cannelle bâtarde.
B.10.013 [N]. L’essence de cannelle de Ceylan, l’extrait de cannelle de Ceylan et la préparation aromatisante à la cannelle de Ceylan, doivent être l’essence, l’extrait ou la préparation aromatisante obtenue de l’huile volatile extraite de l’écorce de Cinnamomum zeylanicum Nees, et doivent renfermer
a) au moins deux pour cent en volume d’huile de cannelle de Ceylan;
b) au moins 65 pour cent d’aldéhyde cinnamique; et
c) au plus 10 pour cent d’eugénol.
B.10.014 [N]. L’essence de clou de girofle, l’extrait de clou de girofle et la préparation aromatisante au clou de girofle, doivent être l’essence, l’extrait ou la préparation aromatisante obtenus de l’huile volatile extraite du bouton de girofle, et doivent renfermer au moins deux pour cent en volume d’huile de clou de girofle.
B.10.015 [N]. L’essence de gingembre, l’extrait de gingembre et la préparation aromatisante au gingembre, doivent être l’essence, l’extrait ou la préparation aromatisante obtenus du gingembre, et doivent renfermer, dans 100 millilitres, les matières solubles dans l’alcool d’au moins 20 grammes de gingembre.
B.10.016 [N]. L’essence de citron, l’extrait de citron et la préparation aromatisante au citron, doivent être l’essence, l’extrait ou la préparation aromatisante préparés à partir d’huile de citron, naturelle ou déterpénée, ou de zeste de citron, et doivent renfermer au moins 0,2 pour cent de citral dérivé de l’huile de citron.
B.10.017 [N]. L’essence de muscade, l’extrait de muscade et la préparation aromatisante à la muscade, doivent être l’essence, l’extrait ou la préparation aromatisante préparés à partir d’huile de muscade, naturelle ou déterpénée, et leur pouvoir aromatisant doit correspondre à celui d’une solution alcoolique qui renferme au moins deux pour cent en volume d’huile de muscade.
B.10.018 [N]. L’essence d’orange, l’extrait d’orange et la préparation aromatisante à l’orange, doivent être l’essence, l’extrait ou la préparation aromatisante préparés à partir de zeste d’oranges douces, d’huile d’oranges douces, ou d’huile d’oranges douces déterpénée, et leur pouvoir aromatisant doit correspondre à celui d’une solution alcoolique qui renferme cinq pour cent en volume d’huile d’oranges douces, c’est-à-dire l’huile volatile extraite du zeste frais de Citrus auranlium L. et ayant, dans un tube à essai de 100 millimètres de longueur, et à 25 °C, un pouvoir rotatoire de +95° au moins.
B.10.019 [N]. L’essence de menthe poivrée, l’extrait de menthe poivrée et la préparation aromatisante à la menthe poivrée, doivent être l’essence, l’extrait ou la préparation aromatisante préparés à partir de menthe poivrée ou d’huile de menthe poivrée, obtenue des feuilles et des fleurs de Mentha piperata L., ou de Mentha arvensis De. C., var piperascens Holmes, et leur pouvoir aromatisant doit correspondre à celui d’une solution alcoolique qui renferme au moins trois pour cent en volume d’huile de menthe poivrée, huile qui renferme au moins 50 pour cent de menthol, à l’état libre et à l’état combiné.
B.10.020 [N]. L’essence de rose, l’extrait de rose et la préparation aromatisante à la rose, doivent être l’essence, l’extrait ou la préparation aromatisante préparés à partir de l’huile volatile obtenue des pétales de Rosa damascena Mill., de R. centajolia L., ou de R. moschata Herrm, et doivent renfermer au moins 0,4 pour cent en volume d’huile de rose.
B.10.021 [N]. L’essence de sarriette, l’extrait de sarriette et la préparation aromatisante à la sarriette, doivent être l’essence, l’extrait ou la préparation aromatisante préparés à partir de sarriette ou d’huile de sarriette, et renfermer au moins 0,35 pour cent en volume d’huile de sarriette.
B.10.022 [N]. L’essence de menthe verte, l’extrait de menthe verte et la préparation aromatisante à la menthe verte, doivent être l’essence, l’extrait ou la préparation aromatisante préparés à partir de menthe verte ou d’huile de menthe verte, obtenue des feuilles et des fleurs de Mentha spicata L., et doivent renfermer au moins trois pour cent en volume d’huile de menthe verte.
B.10.023 [N]. L’essence de basilic (odorant), l’extrait de basilic et la préparation aromatisante au basilic, doivent être l’essence, l’extrait ou la préparation aromatisante préparés à partir de basilic ou d’huile de basilic, obtenue des feuilles et des fleurs d’Ocymum basilicum L., et doivent renfermer au moins 0,1 pour cent en volume de basilic odorant.
B.10.024 [N]. L’essence de marjolaine, l’extrait de marjolaine et la préparation aromatisante à la marjolaine, doivent être l’essence, l’extrait ou la préparation aromatisante préparés à partir de marjolaine ou d’huile de marjolaine et doivent renfermer au moins un pour cent en volume d’huile de marjolaine.
B.10.025 [N]. L’essence de thym, l’extrait de thym et la préparation aromatisante au thym, doivent être l’essence, l’extrait ou la préparation aromatisante préparés à partir de thym ou d’huile de thym, et doivent renfermer au moins 0,2 pour cent en volume d’huile de thym.
B.10.026 [N]. L’essence de vanille, l’extrait de vanille et la préparation aromatisante à la vanille
a) doivent être l’essence, l’extrait ou la préparation aromatisante préparés à partir de la gousse de vanille, fruit desséché et traité de Vanilla planifolia Andrews ou de Vanilla tahitensia J. W. Moore;
b) doivent contenir par 100 ml, quelle que soit la méthode d’extraction, une quantité de substances solubles, dans leurs proportions naturelles, au moins égale à celle extraite des quantités suivantes de gousses de vanille selon la méthode officielle FO-17, Extraction de substances solubles de gousses de vanille, en date du 15 septembre 1989 :
(i) au moins 10 g de gousses de vanille, dans le cas de gousses ayant une teneur en humidité d’au plus 25 pour cent,
(ii) au moins 7,5 g de gousses de vanille à l’état desséché, dans le cas de gousses ayant une teneur en humidité de plus de 25 pour cent;
c) ne doivent pas, nonobstant les articles B.10.003 et B.10.005, renfermer de matière colorante ajoutée.
- DORS/82-768, art. 25
- DORS/84-300, art. 29(F)
- DORS/91-149, art. 1
B.10.027 [N]. L’essence de gaulthérie, de thé du Canada ou de wintergreen, l’extrait de gaulthérie, la préparation aromatisante à la gaulthérie, doivent être l’essence, l’extrait ou la préparation aromatisante, préparés à partir d’huile de gaulthérie, huile volatile distillée des feuilles de Gaultheria procumbens L. ou de Betula lenta L., et doivent renfermer au moins trois pour cent en volume d’huile de gaulthérie ou de thé des bois.
TITRE 11Fruits, légumes, leurs produits et succédanés
- DORS/78-478, art. 1
B.11.001 Dans le présent titre,
- ingrédient acide
ingrédient acide désigne
a) l’acide citrique, malique ou tartrique,
b) le jus de citron ou de limette, ou
c) le vinaigre; (acid ingredient)
- ingrédient édulcorant
ingrédient édulcorant désigne le sucre, le sucre inverti, le miel, le dextrose, le glucose ou les solides du glucose, ou un mélange quelconque de ces produits, à l’état sec ou liquide; (sweetening ingredient)
- jus de fruit
jus de fruit désigne le liquide non fermenté, exprimé de fruits mûrs, sains et frais qui peut être traité par la chaleur et refroidi. (fruit juice)
B.11.001.1 Est interdite la vente de fruits ou de légumes frais destinés à être consommés crus, à l’exception de raisins frais, s’ils sont additionnés d’anhydride sulfureux ou de ses sels.
- DORS/87-374, art. 1
Légumes
B.11.002 [N]. Le ou les (nom du légume) en conserve
a) doivent être le produit obtenu par traitement thermique du légume frais qui est nommé, après préparation appropriée;
b) doivent être conditionnés en récipients hermétiquement scellés;
c) peuvent renfermer
(i) un ingrédient édulcorant,
(ii) du sel,
(iii) de l’eau,
(iv) un agent raffermissant,
(v) de l’acide citrique;
d) peuvent contenir
(i) pour les haricots verts en conserve et les haricots jaunes en conserve, une quantité de morceaux de poivron vert, de poivron rouge et de tomate représentant au plus 15 pour cent du produit final, ainsi que des assaisonnements à l’aneth et du vinaigre,
(ii) pour les pois en conserve, des garnitures composées d’un ou de plusieurs des éléments suivants : laitue, oignons, carottes, morceaux de poivron vert ou rouge, dont la quantité représente au plus 15 pour cent de l’ensemble de l’ingrédient végétal égoutté, des herbes aromatiques, des épices et des assaisonnements, du bouillon ou du jus de légumes et des herbes aromatiques, une quantité d’hydroxyde de calcium d’au plus 0,01 pour cent du produit final et une quantité d’hydroxyde de magnésium d’au plus 0,05 pour cent du produit final,
(iii) pour
(A) les asperges en conserve, une quantité d’acide acétique, d’acide malique et d’acide tartrique conforme aux bonnes pratiques industrielles,
(B) les asperges blanches en conserve, une quantité d’acide acétique, d’acide ascorbique, d’acide malique et d’acide tartrique conforme aux bonnes pratiques industrielles,
(C) [Abrogée, DORS/2012-43, art. 4]
(iv) pour les asperges conservées dans des contenants en verre ou des contenants métalliques vernis sur toute leur surface intérieure, une quantité de chlorure stanneux d’au plus 2,5 [25] parties par million, calculée en étain,
(v) pour les légumineuses en conserve, à l’exception des haricots jaunes en conserve, des haricots verts en conserve et des pois en conserve, une quantité d’éthylènediaminetétraacétate de calcium disodique d’au plus 365 parties par million, calculée sous forme anhydre, ou une quantité d’éthylènediaminetétraacétate disodique d’au plus 165 parties par million,
(vi) à (vii) [Abrogés, DORS/2012-43, art. 4]
(viii) pour les asperges en conserve, les haricots verts en conserve, les haricots jaunes en conserve et les pois en conserve,
(A) une quantité de beurre représentant au moins trois pour cent du produit final, ou d’autres graisses ou huiles animales ou végétales comestibles,
(B) des amidons naturels ou modifiés de façon enzymatique ou physique s’ils sont utilisés avec du beurre ou d’autres graisses ou huiles animales ou végétales comestibles,
(C) une quantité d’un ou de plusieurs des éléments suivants : gomme de caroubier, algine, caragénine, furcelleran gomme de guar et alginate de propylèneglycol, qui, utilisée avec du beurre ou d’autres graisses ou huiles animales ou végétales comestibles, représente au plus un pour cent du produit final, et
(D) des sauces, des assaisonnements ou des agents aromatisants caractéristiques s’ils figurent dans le nom usuel du produit.
- DORS/79-660, art. 1
- DORS/84-300, art. 30
- DORS/95-435, art. 1
- DORS/97-561, art. 1
- DORS/2012-43, art. 4
B.11.003 [N]. Les champignons en conserve
a) doivent être le produit obtenu par traitement thermique de champignons cultivés convenablement préparés;
b) doivent être conditionnés en récipients hermétiquement scellés; et
c) peuvent contenir de l’acide ascorbique, de l’acide citrique et du sel.
- DORS/84-300, art. 31
B.11.003A [N]. Les champignons congelés
a) doivent être le produit obtenu par congélation de champignons cultivés convenablement préparés; et
b) peuvent renfermer de l’acide citrique, du métabisulfite de sodium, du phosphate dibasique de sodium, du sulfate de sodium et du sel.
- DORS/2012-43, art. 5
B.11.004 [N]. Le (nom du légume) congelé doit être le produit obtenu par la congélation de ce légume à l’état frais après qu’il a été préparé et soumis au blanchiment, et il peut renfermer de l’acide citrique et du sel ajouté.
- DORS/2012-43, art. 6
B.11.005 [N]. Les tomates ou tomates en conserve
a) doivent être le produit obtenu par traitement thermique de tomates mûres, fraîches et convenablement préparées;
b) peuvent renfermer
(i) un ingrédient édulcorant à l’état sec,
(ii) du sel,
(iii) un agent raffermissant,
(iv) de l’acide citrique,
(v) des épices et autres condiments; et
c) doivent renfermer au moins 50 pour cent de solides de tomates égouttés, déterminé selon la méthode officielle FO-18, Détermination de solides de tomates égouttés, 15 octobre 1981.
- DORS/82-768, art. 26
B.11.007 [N]. Le jus de tomates doit être le liquide, pasteurisé mais non concentré, renfermant une partie substantielle de fine pulpe de tomates, obtenu de tomates saines, mûres et entières, débarrassées des queues et des autres parties impropres à la consommation par n’importe quel procédé qui n’ajoute pas d’eau au liquide, et il peut renfermer de l’acide citrique, du sel et un ingrédient édulcorant à l’état sec.
- DORS/2012-43, art. 7
B.11.009 [N]. La pâte de tomates doit être le produit obtenu par l’évaporation d’une partie de l’eau provenant de tomates ou de parures saines de tomates; elle peut renfermer de l’acide citrique, du sel et un agent de conservation de la catégorie II et doit renfermer au moins 20 pour cent de solides de tomates, déterminé selon la méthode officielle FO-19, Détermination de solides de tomates, 15 octobre 1981.
- DORS/82-768, art. 27
- DORS/2012-43, art. 8
B.11.010 [N]. La pâte de tomates concentrée ou pâte concentrée de tomates doit être de la pâte de tomates qui renferme au moins 30 pour cent de solides de tomates, déterminé selon la méthode officielle FO-19, Détermination de solides de tomates, 15 octobre 1981.
- DORS/82-768, art. 27
B.11.011 [N]. La pulpe de tomates doit être le produit obtenu par traitement thermique et fait de tomates saines, mûres et entières, ou de parures saines de tomates, concentré jusqu’à l’obtention d’un produit d’une densité d’au moins 1,050 (à 20 °C/20 °C); elle peut renfermer de l’acide citrique, du sel et un agent de conservation de la catégorie II.
- DORS/2012-43, art. 9
B.11.012 [N]. La purée de tomates doit être le produit obtenu par traitement thermique et fait de tomates saines, mûres et entières, débarrassées des pelures et des graines et concentré jusqu’à l’obtention d’un produit d’une densité d’au moins 1,050 (à 20 °C/20 °C); elle peut renfermer de l’acide citrique, du sel et un agent de conservation de la catégorie II.
- DORS/2012-43, art. 10
B.11.014 [N]. Le catsup de tomates, le catsup et les produits dont le nom usuel est une variante du mot catsup
a) doivent être le produit obtenu par traitement thermique du jus de tomates rouges à maturité, ou de parures saines de tomates débarrassées des pelures et des graines;
b) doivent renfermer
(i) du vinaigre,
(ii) du sel,
(iii) des condiments, et
(iv) un ingrédient édulcorant; et
c) peuvent renfermer
(i) un agent de conservation de la catégorie II, et
(ii) un colorant pour aliments.
B.11.015 [Abrogé, DORS/97-151, art. 19]
B.11.016 Est interdite la vente de tomates en conserve, de jus de tomates ou d’un jus de légume qui renferme des filaments de moisissures dans plus de 25 pour cent du champ microscopique, à l’examen selon la méthode officielle MFO-5, Examen de tomates en conserve, de jus de tomates et de jus de légumes, de purée de tomates, de pâte de tomates, de pulpe de tomates et de catsup de tomates pour la détermination des filaments de moisissures, 30 novembre 1981.
- DORS/82-768, art. 28
B.11.017 Est interdite la vente de purée de tomates, de pâte de tomates, de pulpe de tomates ou de catsup de tomates qui renferme des filaments de moisissures dans plus de 50 pour cent du champ microscopique, à l’examen selon la méthode officielle MFO-5, Examen de tomates en conserve, de jus de tomates et de jus de légumes, de purée de tomates, de pâte de tomates, de pulpe de tomates et de catsup de tomates pour la détermination des filaments de moisissures, 30 novembre 1981.
- DORS/82-768, art. 28
B.11.025 Est interdite la vente de pommes de terre, de patates (sucrées) ou patates douces, qui ont été colorées artificiellement.
B.11.040 [N]. Les fèves au lard doivent être l’aliment préparé avec des haricots secs et du lard; elles peuvent renfermer de l’acide citrique, un agent édulcorant, des assaisonnements, des épices, de l’éthylènediaminetétraacétate de calcium disodique, de l’éthylènediaminetétraacétate disodique et une sauce, et doivent renfermer au moins 60 pour cent de solides égouttés, déterminé selon la méthode officielle FO-20, Détermination de solides égouttés dans le cas de fèves au lard ou fèves de régime végétarien, 15 octobre 1981.
- DORS/82-768, art. 29
- DORS/2012-43, art. 11
B.11.041 [N]. Les fèves ou haricots ou les fèves de régime végétarien doivent être l’aliment préparé avec des haricots secs; elles peuvent renfermer de l’acide citrique, un agent édulcorant, des assaisonnements, des épices, de l’éthylènediaminetétraacétate de calcium disodique, de l’éthylènediaminetétraacétate disodique et une sauce, et doivent renfermer au moins 60 pour cent de solides égouttés, déterminé selon la méthode officielle FO-20, Détermination de solides égouttés dans le cas de fèves au lard ou fèves de régime végétarien, 15 octobre 1981.
- DORS/82-768, art. 29
- DORS/2012-43, art. 12
B.11.050 [N]. Les olives doivent être le fruit, nature ou farci, de l’olivier, et peuvent renfermer
a) du vinaigre;
b) du sel;
c) un ingrédient édulcorant;
d) des épices;
e) des condiments;
f) de l’acide lactique;
g) de l’acide sorbique ou son sel de potassium ou de sodium;
h) du chlorure de calcium;
i) de l’acide citrique;
j) dans le cas des olives mûres, du gluconate ferreux.
- DORS/97-561, art. 2
B.11.051 [N]. Les pickles, cornichons, achards (relish), ou marinades, doivent être le produit préparé à partir de légumes et de fruits, avec du sel et du vinaigre, et peuvent renfermer
a) des épices;
b) des condiments;
c) du sucre, du sucre inverti, du dextrose ou du glucose, à l’état sec ou à l’état liquide;
d) un colorant pour aliments;
e) un agent de conservation de la catégorie II;
f) un agent raffermissant;
g) du monooléate polyoxyéthylénique (20) de sorbitan, en quantité d’au plus 0,05 pour cent;
h) de l’acide lactique;
h.1) de l’acide citrique;
h.2) du sucralose;
i) des huiles végétales;
j) dans le cas des achards, des cornichons ou des marinades à la moutarde, un agent épaississant.
- DORS/84-300, art. 32
- DORS/2012-43, art. 13
- DORS/2012-104, art. 1
Fruits
B.11.101 [N]. Le ou les (nom du fruit) en conserve
a) doivent être le produit préparé par traitement thermique du fruit frais qui est nommé, après qu’il a été convenablement préparé;
b) doivent être conditionnés en récipients hermétiquement scellés;
c) peuvent renfermer :
(i) un ingrédient édulcorant,
(ii) de l’eau,
(iii) du jus de (nom du fruit), du jus de (noms des fruits), du jus de (nom du fruit) concentré, du jus de (nom du fruit) fait de concentré ou un mélange quelconque de ces produits,
(iv) de l’acide citrique,
(v) de l’acésulfame-potassium,
(vi) du sucralose;
d) peuvent renfermer :
(i) dans le cas des poires en conserve, de l’acide lactique, de l’acide malique, de l’acide tartrique, des épices, des huiles d’épices, du jus de citron, de la menthe et une préparation aromatisante autre que celle qui simule l’arôme des poires en conserve,
(ii) dans le cas des pommes en conserve, un agent raffermissant,
(iii) dans le cas de la compote de pommes en conserve, de l’acide ascorbique, de l’acide isoascorbique, de l’acide malique, des épices, du sel et une préparation aromatisante autre que celle qui simule l’arôme de la compote de pommes en conserve,
(iv) dans le cas des pamplemousses en conserve, du chlorure de calcium, des épices, du jus de citron, du lactate de calcium et une préparation aromatisante autre que celle qui simule l’arôme des pamplemousses en conserve,
(v) dans le cas des mandarines en conserve, de l’acide ascorbique,
(vi) dans le cas des pêches en conserve, des épices, des graines de pêches et des noyaux de pêches pour rehausser la saveur, de l’acide ascorbique, et une préparation aromatisante autre que celle qui simule l’arôme des pêches en conserve,
(vii) dans le cas de l’ananas en conserve, du diméthylpolysiloxane lorsque du jus d’ananas est utilisé comme véhicule de conditionnement, des épices, des huiles d’épices, de la menthe, et une préparation aromatisante autre que celle qui simule l’arôme de l’ananas en conserve,
(viii) dans le cas des prunes en conserve, une préparation aromatisante autre que celle qui simule l’arôme des prunes en conserve,
(ix) dans le cas des fraises en conserve, de l’acide lactique, de l’acide malique ou de l’acide tartrique,
(x) dans le cas des abricots en conserve, du chlorure de calcium.
- DORS/84-300, art. 33
- DORS/2012-43, art. 14
- DORS/2012-104, art. 2
B.11.102 [N]. Le ou les (nom du fruit) congelés doivent être le produit obtenu par congélation du fruit frais qui est nommé, après qu’il a été convenablement préparé, et ils peuvent renfermer
a) un ingrédient édulcorant;
b) de l’eau;
c) du jus de fruit, du jus de fruit préparé à partir de concentré, du jus de fruit concentré ou un mélange quelconque de ces produits;
d) de l’acide ascorbique, de l’acide citrique, de l’acide érythorbique ou de l’acide malique pour prévenir la décoloration;
e) dans le cas des pommes tranchées, congelées,
(i) un agent raffermissant, et
(ii) de l’acide sulfureux.
- DORS/84-300, art. 34
- DORS/95-436, art. 1
B.11.103 et B.11.104 [Abrogés, DORS/79-252, art. 1]
B.11.105 [Abrogé, DORS/97-151, art. 20]
Jus de fruits
B.11.120 [N]. Le jus de (nom du fruit):
a) doit être le jus du fruit qui est nommé;
b) peut renfermer un ingrédient édulcorant à l’état sec, un agent de conservation de la catégorie II, de l’amylase, de la cellulase et de la pectinase.
- DORS/78-402, art. 2
- DORS/84-300, art. 35
- DORS/90-87, art. 1
- DORS/92-591, art. 2
B.11.121 Nonobstant l’article B.11.120, le jus de fruit préparé, à partir de n’importe quel fruit nommé dans les articles B.11.123 à B.11.128A inclusivement, doit être conforme à la norme prescrite pour ledit jus de fruit audit article.
B.11.123 [N]. Le jus de pommes
a) doit être le jus de fruit exprimé des pommes;
b) peut contenir un agent de conservation de la catégorie II, de la vitamine C, de l’amylase, de la cellulase et de la pectinase;
c) doit avoir une densité d’au moins 1,041 et d’au plus 1,065 (à 20 °C/20 °C); et
d) doit, dans 100 millilitres mesurés à 20 °C, renfermer au moins 0,24 gramme et au plus 0,60 gramme de cendres, dont au moins 50 pour cent doit être du carbonate de potassium.
- DORS/90-87, art. 2
B.11.124 [N]. Le jus de raisin
a) doit être le jus de fruit obtenu de raisin frais;
b) doit avoir une densité d’au moins 1,040 et d’au plus 1,124 (à 20 °C/20 °C);
c) doit, avant que soit ajouté un ingrédient édulcorant, renfermer dans 100 millilitres mesurés à 20 °C,
(i) au moins 0,20 gramme et au plus 0,55 gramme de cendres, et
(ii) au moins 0,015 gramme et au plus 0,070 gramme d’acide phosphorique calculé en pentoxyde de phosphore; et
d) peut contenir un agent rajusteur du pH, un ingrédient édulcorant à l’état sec, un agent de conservation de la catégorie II, de la vitamine C, de l’amylase, de la cellulase et de la pectinase.
- DORS/84-300, art. 36(A)
- DORS/86-1112, art. 2
- DORS/90-87, art. 3
B.11.125 [N]. Le jus de pamplemousse
a) doit être le jus de fruit exprimé de pamplemousses propres, sains et mûrs;
b) doit
(i) renfermer au moins 1,15 milliéquivalents d’aminoacides libres pour 100 millilitres, déterminés selon la méthode officielle FO-21, Détermination d’aminoacides dans le jus de pamplemousse et le jus d’orange, 15 octobre 1981,
(ii) renfermer au moins 70 milligrammes de potassium pour 100 millilitres, déterminés selon la méthode officielle FO-22, Détermination de potassium dans le jus de pamplemousse et le jus d’orange, 15 octobre 1981, et
(iii) pour les composés-polyphénoliques totaux, avoir une densité optique d’au moins 0,310, déterminée selon la méthode officielle FO-23, Détermination de densité optique pour les composés polyphénoliques totaux du jus de pamplemousse et du jus d’orange, 15 octobre 1981;
c) doit, avant que soient ajoutées le sucre, le sucre inverti, le dextrose ou les solides de glucose,
(i) avoir un degré Brix d’au moins 9,3°, déterminé selon la méthode officielle FO-24, Détermination de degré Brix pour le jus de pamplemousse et le jus d’orange, 15 octobre 1981, et
(ii) renfermer au moins 0,7 pour cent et au plus 2,1 pour cent d’acide, en poids, calculé en acide citrique anhydre selon la méthode officielle FO-25, Détermination d’acide dans le jus de pamplemousse ou le jus d’orange, 15 octobre 1981; et
d) peut contenir du sucre, du sucre inverti, du dextrose à l’état sec, des solides de glucose, un agent de conservation de la catégorie II, de l’amylase, de la cellulase et de la pectinase.
- DORS/82-768, art. 30
- DORS/90-87, art. 4
B.11.126 [N]. Le jus de citron
a) doit être le jus de fruit exprimé du citron;
b) doit, avant l’addition d’un ingrédient édulcorant, renfermer, dans 100 millilitres mesurés à 20 °C, au moins
(i) 8,0 grammes de solides solubles, déterminés selon la méthode officielle FO-26, Détermination de solides solubles dans le jus de citron, le jus de lime ou le jus de limette, 15 octobre 1981, et
(ii) 5,0 grammes d’acide, calculé en acide citrique anhydre selon la méthode officielle FO-27, Détermination d’acide dans le jus de citron, le jus de lime ou le jus de limette, 15 octobre 1981;
c) peut renfermer du chlorure stanneux; et
d) peut contenir un édulcorant à l’état sec, un agent de conservation de la catégorie II, de l’amylase, de la cellulase et de la pectinase.
- DORS/82-768, art. 31
- DORS/90-87, art. 5
B.11.127 [N]. Le jus de lime ou le jus de limette
a) doit être le jus de fruit exprimé de limes;
b) doit avoir
(i) une densité d’au moins 1,030 et d’au plus 1,040 (à 20 °C/20 °C),
(ii) un pouvoir rotatoire entre +0,5 et -1,5 degré Ventzke déterminé à 20 °C, et dans un tube à essai de 200 millimètres de longueur;
c) doit, avant l’addition d’un ingrédient édulcorant, renfermer, dans 100 millilitres mesurés à 20 °C, au moins
(i) 8,0 grammes de solides solubles, déterminés selon la méthode officielle FO-26, Détermination de solides solubles dans le jus de citron, le jus de lime ou le jus de limette, 15 octobre 1981, et
(ii) 5,5 grammes d’acide, calculé en acide citrique anhydre selon la méthode officielle FO-27, Détermination d’acide dans le jus de citron, le jus de lime ou le jus de limette, 15 octobre 1981;
d) peut renfermer du chlorure stanneux; et
e) peut contenir un édulcorant à l’état sec, un agent de conservation de la catégorie II, de l’amylase, de la cellulase et de la pectinase.
- DORS/82-768, art. 32
- DORS/90-87, art. 6
B.11.128 [N]. Le jus d’orange
a) doit être le jus de fruit exprimé d’oranges propres, saines et mûres;
b) doit
(i) renfermer au moins 1,20 milliéquivalents d’aminoacides libres pour 100 millilitres, déterminés selon la méthode officielle FO-21, Détermination d’aminoacides dans le jus de pamplemousse et le jus d’orange, 15 octobre 1981,
(ii) renfermer au moins 115 milligrammes de potassium pour 100 millilitres, déterminés selon la méthode officielle FO-22, Détermination de potassium dans le jus de pamplemousse et le jus d’orange, 15 octobre 1981, et
(iii) pour les composés polyphénoliques totaux, avoir une densité optique d’au moins 0,380, déterminée selon la méthode officielle FO-23, Détermination de densité optique pour les composés polyphénoliques totaux du jus de pamplemousse et du jus d’orange, 15 octobre 1981;
c) doit avant que soient ajoutés le sucre, le sucre inverti, le dextrose ou les solides de glucose,
(i) avoir un degré Brix d’au moins 9,7°, déterminé selon la méthode officielle FO-24, Détermination de degré Brix pour le jus de pamplemousse et le jus d’orange, 15 octobre 1981, et
(ii) renfermer au moins 0,5 pour cent et au plus 1,8 pour cent d’acide, en poids, calculé en acide citrique anhydre selon la méthode officielle FO-25, Détermination d’acide dans le jus de pamplemousse ou le jus d’orange, 15 octobre 1981;
d) peut renfermer des essences d’orange, des huiles d’orange et de la pulpe d’orange, dont la teneur est rectifiée conformément aux bonnes pratiques industrielles; et
e) peut contenir du sucre, du sucre inverti, du dextrose à l’état sec, des solides de glucose, un agent de conservation de la catégorie II, de l’amylase, de la cellulase et de la pectinase.
- DORS/82-768, art. 33
- DORS/90-87, art. 7
B.11.128A [N]. Le jus d’ananas
a) doit être le jus de fruit exprimé des ananas; et
b) peut renfermer un ingrédient édulcorant à l’état sec, un agent de conservation de la catégorie II, de la vitamine C, de l’amylase, de la cellulase, de la pectinase et un agent anti-mousse.
- DORS/90-87, art. 8
- DORS/91-90, art. 1
B.11.129 [N]. Le jus de (nom du fruit) gazeux ou le jus de (nom du fruit) mousseux, doit être le jus du fruit nommé, qui a été imprégné d’anhydride carbonique sous pression.
B.11.130 [N]. (1) Le jus de (nom du fruit) concentré :
a) doit être du jus de fruit qui est concentré à la moitié au moins de son volume original par élimination d’eau;
b) peut contenir :
(i) de la vitamine C,
(ii) un colorant pour aliments,
(iii) du chlorure stanneux,
(iv) un édulcorant,
(v) un agent de conservation de la catégorie II;
c) peut être additionné, à des fins de normalisation et conformément aux bonnes pratiques industrielles, de l’une ou plusieurs des substances suivantes :
(i) essence, huile ou pulpe du fruit désigné,
(ii) eau.
(2) Les sous-alinéas (1)b)(i), (ii), (iii) et (v) ne s’appliquent pas au jus d’orange concentré congelé.
- DORS/89-198, art. 2
- DORS/91-124, art. 3
B.11.131 [N]. Le jus de (noms des fruits) doit être un mélange de jus de fruits dont chacun est conforme à la norme prescrite pour ce jus de fruit au présent titre.
B.11.132 [N]. Le jus de pomme et de (nom du fruit)
a) doit être un mélange de jus de pomme et de jus d’un autre fruit, où chacun des deux est conforme aux normes prescrites pour ce jus de fruit au présent titre, s’il y a lieu; et
b) peut renfermer de la vitamine C ajoutée.
B.11.133 [N]. Le jus de (nom du fruit) reconstitué, le jus de concentré de (nom du fruit) ou le jus de (nom du fruit) fait de concentré
a) doit être le jus de fruit qui a été préparé par l’adjonction d’eau au jus de fruit du même nom dont l’eau avait été enlevée;
b) peut renfermer du jus, de la pulpe, des huiles et des esters naturels du fruit nommé ainsi qu’un ingrédient édulcorant;
c) doit être conforme aux normes des jus de fruits nommés telles qu’elles sont prescrites au présent titre; et
d) peut renfermer, quant au jus de citron reconstitué ou du jus de lime reconstitué, au plus 10 parties par million de diméthylpolysiloxane.
- DORS/78-637, art. 2
B.11.134 [N]. Le nectar d’abricot, le nectar de pêche ou le nectar de poire
a) doit être le produit pulpeux non fermenté mais fermentable, destiné à une consommation directe et obtenu par le mélange de toute la partie comestible de pêches, de poires ou d’abricots sains et mûrs, sous forme concentrée ou non concentrée, avec de l’eau et, sous réserve de l’alinéa e)(i), un ingrédient édulcorant;
b) doit être composé
(i) dans le cas du nectar de pêche et du nectar de poire, d’au moins 40 pour cent de fruit en poids ou de l’équivalent obtenu du concentré de fruit, et
(ii) dans le cas du nectar d’abricot, d’au moins 35 pour cent de fruit en poids ou de l’équivalent obtenu du concentré de fruit;
c) doit comprendre au moins 13 pour cent de solides solubles en poids exprimé en °Brix selon l’échelle internationale prévue pour la saccharose et calculé à l’aide d’un réfractomètre à 20 °C et non corrigé pour l’acidité;
d) doit comprendre au plus 3 g/kg (3000 p.p.m.) d’éthanol et 10 mg/kg (10 p.p.m.) de furfurol hydroxyméthylique; et
e) peut comprendre
(i) du miel si aucun autre ingrédient édulcorant n’est utilisé,
(ii) une quantité d’acide citrique et d’acide malique conforme aux bonnes pratiques industrielles,
(iii) du jus de citron, et
(iv) de la vitamine C.
- DORS/79-660, art. 2
- DORS/2010-94, art. 9(A)
Boissons à arôme de fruit
B.11.150 Il est interdit d’étiqueter, d’empaqueter, de vendre ou d’annoncer une boisson à arôme de fruit de façon à créer l’impression qu’elle contient une vitamine ou présente toute autre valeur nutritive normalement attribuée à un jus de fruits à moins que les exigences suivantes ne soient respectées :
a) qu’elle soit vendue comme succédané d’un jus de fruits ou comme boisson pour le petit déjeuner;
b) qu’elle ne soit pas gazeuse;
c) qu’elle ne soit pas offerte ni habituellement connue comme
(i) une boisson gazeuse, ou
(ii) une boisson désaltérante ou rafraîchissante; et
d) qu’elle contienne, nonobstant les articles D.01.009, D.01.011 et D.02.009, lorsque la boisson est prête à servir, par 100 ml,
(i) de la vitamine C en quantité d’au moins 24 mg et d’au plus 48 mg, et
(ii)
(A) de l’acide folique, si ajouté, en quantité d’au moins 40 µg et d’au plus 80 µg,
(B) de la thiamine, si ajoutée, en quantité d’au moins 0,08 mg et d’au plus 0,11 mg,
(C) du fer, si ajouté, en quantité d’au moins 0,56 mg et d’au plus 0,80 mg, ou
(D) du potassium, si ajouté, en quantité d’au moins 100 mg et d’au plus 200 mg.
- DORS/78-478, art. 2
B.11.151 Il est interdit d’étiqueter, d’empaqueter, de vendre ou d’annoncer une base, un concentré ou un mélange pour préparer une boisson à arôme de fruit de façon à créer l’impression qu’il contient une vitamine ou qu’il présente toute autre valeur nutritive normalement attribuée à un jus de fruits à moins que les exigences suivantes ne soient respectées :
a) qu’une telle base, concentré ou mélange
(i) soit vendu pour faire une boisson pour le petit déjeuner ou un succédané de jus de fruits,
(ii) ne soit pas offert ni habituellement connu comme un produit pour faire une boisson gazeuse ou une boisson désaltérante ou rafraîchissante; et
b) que la boisson préparée à partir d’eux soit conforme aux exigences prescrites à l’alinéa B.11.150d).
- DORS/78-478, art. 2
Confiture
B.11.201 [N]. La confiture de (nom du fruit)
a) doit être le produit obtenu en traitant des fruits, de la pulpe de fruits ou des fruits en conserve, par ébullition jusqu’à une consistance convenable, avec de l’eau et un agent édulcorant;
b) doit renfermer au moins
(i) 45 pour cent du fruit nommé,
(ii) 66 pour cent de solides solubles dans l’eau, déterminés au réfractomètre;
c) peut renfermer
(i) la quantité ajoutée de pectine, de préparation pectique ou d’ingrédient acide, requise pour compenser raisonnablement toute déficience en pectine ou en acidité naturelle du fruit nommé,
(ii) un agent de conservation de la catégorie II,
(iii) un agent rajusteur du pH, et
(iv) un agent anti-mousse; et
d) ne doit renfermer ni pommes ni rhubarbe.
- DORS/92-400, art. 16
B.11.202 [N]. La confiture de (nom du fruit) avec pectine
a) doit être le produit obtenu en traitant des fruits, de la pulpe de fruits ou des fruits en conserve, par ébullition jusqu’à une consistance convenable, avec de l’eau et un agent édulcorant;
b) doit renfermer
(i) au moins 27 pour cent du fruit nommé,
(ii) au moins 66 pour cent de solides solubles dans l’eau, déterminés au réfractomètre, et
(iii) de la pectine ou une préparation pectique;
c) peut renfermer
(i) la quantité d’ingrédient acide requise pour compenser raisonnablement toute déficience en acidité naturelle du fruit nommé,
(ii) un colorant pour aliments,
(iii) un agent de conservation de la catégorie II,
(iv) un agent rajusteur du pH, et
(v) un agent anti-mousse; et
d) ne doit renfermer ni pommes ni rhubarbe.
- DORS/92-400, art. 17
B.11.203 [N]. La confiture de pommes (ou de rhubarbe) et de (nom du fruit)
a) doit être le produit obtenu en traitant des fruits, de la pulpe de fruits ou des fruits en conserve, par ébullition jusqu’à une consistance convenable, avec de l’eau et un agent édulcorant;
b) doit renfermer au moins
(i) 12,5 pour cent du fruit nommé, sauf que si le fruit nommé est la fraise, elle doit renfermer au moins 15 pour cent de fraises,
(ii) 20 pour cent de pulpe de pommes ou de rhubarbe, et
(iii) 66 pour cent de solides solubles dans l’eau, déterminés au réfractomètre; et
c) peut renfermer
(i) de la pectine ou une préparation pectique,
(ii) la quantité d’ingrédient acide requise pour compenser raisonnablement toute déficience en acidité naturelle du fruit utilisé dans la préparation,
(iii) un colorant pour aliments,
(iv) un agent de conservation de la catégorie II,
(v) un agent rajusteur du pH, et
(vi) un agent anti-mousse.
B.11.204 [Abrogé, DORS/2022-143, art. 21]
Marmelade
B.11.220 [N]. La marmelade de (nom de l’agrume) doit être le produit alimentaire à consistance de gelée, préparé à partir de tout mélange de zeste ou d’écorce, de pulpe, et de jus de l’agrume nommé, par ébullition avec de l’eau et un agent édulcorant; elle doit renfermer au moins 65 pour cent de solides solubles dans l’eau, déterminés au réfractomètre, et peut renfermer
a) la quantité d’ingrédient acide requise pour compenser raisonnablement toute déficience en acidité naturelle des agrumes nommés;
b) un agent rajusteur du pH; et
c) un agent anti-mousse.
B.11.221 [N]. La marmelade de (nom de l’agrume) avec pectine
a) doit être le produit alimentaire à consistance de gelée, préparé à partir de tout mélange de zeste ou d’écorce, de pulpe, et de jus de l’agrume nommé, par ébullition avec de l’eau et un agent édulcorant;
b) doit renfermer
(i) au moins 27 pour cent de tout mélange de zeste ou d’écorce, de pulpe et de jus de l’agrume nommé,
(ii) au moins 65 pour cent de solides solubles dans l’eau, déterminés au réfractomètre, et
(iii) de la pectine ou une préparation pectique; et
c) peut renfermer
(i) la quantité d’ingrédient acide requise pour compenser raisonnablement toute déficience en acidité naturelle de l’agrume utilisé dans sa préparation,
(ii) un agent de conservation de la catégorie II,
(iii) un agent rajusteur du pH, et
(iv) un agent anti-mousse.
B.11.222 [N]. La marmelade d’ananas et la marmelade de figues
a) doivent être le produit alimentaire à consistance de gelée, préparé à partir de la pulpe et du jus de fruit nommé, par ébullition avec de l’eau et un agent édulcorant;
b) doivent renfermer
(i) au moins 45 pour cent du fruit nommé, et
(ii) 65 pour cent de solides solubles dans l’eau, déterminés au réfractomètre;
c) peuvent renfermer la quantité ajoutée de pectine, de préparation pectique ou d’ingrédient acide, qui est requise pour compenser raisonnablement toute déficience en pectine naturelle ou en acidité naturelle du fruit nommé;
d) un agent rajusteur du pH; et
e) un agent anti-mousse.
B.11.223 [N]. La marmelade d’ananas avec pectine ou la marmelade de figues avec pectine
a) doivent être le produit alimentaire à consistance de gelée, préparé à partir de la pulpe et du jus du fruit nommé, par ébullition avec de l’eau et un agent édulcorant;
b) doivent renfermer
(i) au moins 27 pour cent du fruit nommé,
(ii) au moins 65 pour cent de solides solubles dans l’eau, déterminés au réfractomètre, et
(iii) de la pectine ou une préparation pectique; et
c) peuvent renfermer
(i) la quantité d’ingrédient acide requise pour compenser raisonnablement toute déficience en acidité naturelle du fruit nommé,
(ii) un colorant pour aliments,
(iii) un agent de conservation de la catégorie II,
(iv) un agent rajusteur du pH, et
(v) un agent anti-mousse.
- DORS/84-300, art. 37(A)
B.11.224 [N]. Les conserves (nom du fruit) doivent être le produit alimentaire fabriqué en traitant des fruits autres que les pommes ou la rhubarbe avec un ingrédient édulcorant, et doivent renfermer au moins
a) 45 parties en poids du fruit nommé pour 55 parties en poids de la matière desséchée de l’ingrédient édulcorant; et
b) 60 pour cent de solides solubles dans l’eau, déterminés au réfractomètre.
Gelée
B.11.240 [N]. La gelée de (nom du fruit) doit être l’aliment gélatineux, exempt de graines et de pulpe, fabriqué avec le fruit nommé, le jus du fruit nommé, ou un concentré du jus du fruit nommé, par ébullition avec de l’eau et un agent édulcorant; elle doit renfermer au moins 62 pour cent de solides solubles dans l’eau, déterminés au réfractomètre, et elle peut renfermer
a) la quantité ajoutée de pectine, de préparation pectique, ou d’ingrédient acide, requise pour compenser raisonnablement toute déficience en pectine naturelle ou en acidité du fruit nommé;
b) un agent rajusteur du pH; et
c) un agent anti-mousse.
B.11.241 [N]. La gelée de (nom du fruit) avec pectine
a) doit être l’aliment gélatineux, exempt de graines et de pulpe, fabriqué avec le fruit nommé, le jus du fruit nommé ou un concentré du jus du fruit nommé, par ébullition avec de l’eau et un agent édulcorant;
b) doit renfermer
(i) au moins l’équivalent de 32 pour cent de jus du fruit nommé,
(ii) au moins 62 pour cent de solides solubles dans l’eau, déterminés au réfractomètre, et
(iii) de la pectine ou une préparation pectique; et
c) peut renfermer
(i) la quantité d’ingrédient acide requise pour compenser raisonnablement toute déficience en acidité naturelle du fruit nommé,
(ii) le jus d’un autre fruit,
(iii) un agent gélatinisant,
(iv) un colorant pour aliments,
(v) un agent de conservation de la catégorie II,
(vi) un agent rajusteur du pH, et
(vii) un agent anti-mousse.
B.11.242 Les normes prescrites dans le présent règlement ne s’appliquent ni à la sauce aux canneberges (ou atocas), ni à la gelée de canneberges, ni aux canneberges en gelée, ni à la gelée de menthe ni à la menthe en gelée.
Mincemeat
B.11.250 [N]. Le mincemeat, mince-meat, mince ou fruit-mince
a) doit être le produit alimentaire préparé avec
(i) des fruits frais ou des fruits secs,
(ii) du suif,
(iii) du sel,
(iv) des épices, et
(v) un agent édulcorant; et
b) peut renfermer
(i) du vinaigre,
(ii) du jus de fruits frais, concentré ou fermenté,
(iii) un spiritueux,
(iv) des noix,
(v) de la viande cuite,
(vi) un agent de conservation de la catégorie II,
(vii) un agent épaississant,
(viii) de l’acide citrique, et
(ix) du caramel.
- DORS/84-300, art. 38(F)
- DORS/2011-278, art. 9
Cidre bouilli
B.11.260 [N]. Le cidre bouilli doit être le liquide exprimé de pommes entières, de coeurs, de parures, ou de rebuts de pommes, concentré par ébullition.
TITRE 12Eau et glace préemballées
- DORS/80-633, art. 1
B.12.001 [N]. Une eau dite eau minérale ou eau de source
a) doit être de l’eau potable obtenue d’une source souterraine et non d’un réseau de distribution publique;
b) ne doit contenir aucune bactérie coliforme, après analyse selon la méthode officielle MFO-9, Examen microbiologique de l’eau minérale, 30 novembre 1981;
c) ne doit pas être modifiée dans sa composition par l’emploi de substances chimiques; et
d) peut contenir, nonobstant le sous-alinéa c),
(i) de l’anhydride carbonique ajouté,
(ii) du fluorure ajouté, si la teneur totale en ion fluorure n’excède pas une partie par million, et
(iii) de l’ozone ajouté.
- DORS/80-633, art. 2
- DORS/82-768, art. 34
B.12.002 L’étiquette d’un récipient contenant une eau dite eau minérale ou eau de source doit indiquer :
a) la position géographique de la source souterraine dont provient l’eau;
b) la teneur totale en sels minéraux dissous, exprimée en parties par million;
c) la teneur totale en ion fluorure, exprimée en parties par million.
d) [Abrogé, DORS/2022-143, art. 22]
- DORS/84-300, art. 39(F)
- DORS/88-336, art. 3
- DORS/92-626, art. 14(F)
- DORS/2022-143, art. 22
B.12.003 [Abrogé, DORS/2022-143, art. 23]
B.12.004 Il est interdit de vendre de l’eau en contenants scellés, à l’exclusion de l’eau minérale et de l’eau de source, qui contient
a) des bactéries coliformes, après analyse selon la méthode officielle MFO-15, Examen microbiologique de l’eau présentée dans des contenants hermétiques (à l’exclusion de l’eau minérale et de l’eau de source) et de la glace pré-emballée, 30 novembre 1981;
b) plus de 100 bactéries aérobies totales par millilitre après analyse selon la méthode officielle MFO-15, Examen microbiologique de l’eau présentée dans des contenants hermétiques (à l’exclusion de l’eau minérale et l’eau de source) et de la glace pré-emballée, 30 novembre 1981;
c) une quantité d’ion fluorure présent à l’état naturel qui dépasse la quantité normale; ou
d) une quantité de fluorure ajouté telle que la teneur totale en fluorure ajouté et en ion fluorure présent à l’état naturel dépasse une partie par million.
- DORS/80-633, art. 3
- DORS/82-768, art. 35
B.12.005 (1) Il est interdit de vendre de la glace préemballée qui contient
a) des bactéries coliformes, après analyse selon la méthode officielle MFO-15, Examen microbiologique de l’eau présentée dans des contenants hermétiques (à l’exclusion de l’eau minérale et de l’eau de source) et de la glace pré-emballée, 30 novembre 1981;
b) une quantité d’ion fluorure présent à l’état naturel qui dépasse la quantité normale; ou
c) une quantité de fluorure ajouté telle que la teneur totale en fluorure ajouté et en ion fluorure présent à l’état naturel dépasse une partie par million.
(2) Il est interdit de fabriquer de la glace préemballée en vue de la vente, faite à partir d’eau qui contient
a) des bactéries coliformes, après analyse selon la méthode officielle MFO-15, Examen microbiologique de l’eau présentée dans des contenants hermétiques (à l’exclusion de l’eau minérale et de l’eau de source) et de la glace pré-emballée, 30 novembre 1981;
b) une quantité d’ion fluorure présent à l’état naturel qui dépasse la quantité normale; ou
c) une quantité de fluorure ajoutée telle que la teneur totale en fluorure ajouté et en ion fluorure présent à l’état naturel dépasse une partie par million.
- DORS/80-633, art. 3
- DORS/82-768, art. 36
B.12.006 [Abrogé, DORS/2022-143, art. 24]
B.12.007 Nonobstant l’article B.01.008, si du chlore ou de ses composés
a) ont été utilisés dans le traitement de l’eau en contenants scellés, à l’exclusion de l’eau minérale et de l’eau de source, et
b) ont été par la suite éliminés avec tout chlore ou composé de chlore produit dans l’eau,
il n’est pas nécessaire de les déclarer dans la liste des ingrédients sur l’étiquette du contenant.
- DORS/80-633, art. 3
B.12.008 La teneur totale en ion fluorure doit être indiquée, en parties par million, dans l’espace principal de l’étiquette de l’eau vendue en contenants scellés, à l’exclusion de l’eau minérale et de l’eau de source, ainsi que sur l’étiquette de la glace préemballée.
- DORS/80-633, art. 3
- DORS/2000-353, art. 5(A)
B.12.009 [Abrogé, DORS/2022-143, art. 25]
TITRE 13Céréales et produits de boulangerie
B.13.001 [N]. La farine, farine blanche, farine enrichie ou farine blanche enrichie
a) est le produit alimentaire obtenu par mouture et blutage de blé nettoyé de qualité à farine à l’aide d’un tamis dont l’ouverture de maille ne dépasse pas celle de la toile métallique de « 149 microns (no 100) »;
b) doit être débarrassée de son et de germe au point que son pourcentage de cendres, avant l’addition d’une autre matière permise par cet article, calculée sur la matière desséchée, ne dépasse pas 1,20 pour cent;
c) doit avoir une teneur en humidité d’au plus 15 pour cent;
d) doit renfermer, par 100 grammes de farine :
(i) 0,64 milligramme de thiamine,
(ii) 0,40 milligramme de riboflavine,
(iii) 5,30 milligrammes de niacine ou de niacinamide,
(iv) 0,15 milligramme d’acide folique,
(v) 4,4 milligrammes de fer;
e) peut renfermer
(i) de la farine de blé malté,
(ii) de la farine d’orge malté, en quantité d’au plus 0,50 pour cent du poids de la farine,
(iii) de l’amylase, de l’amylase maltogène, de l’asparaginase, de la broméline, de la glucoamylase, de la glucose-oxydase, de la lactase, de la lipase, de la lipoxydase, de la pentosanase, de la phospholipase, de la protéase, de la pullulanase ou de la xylanase,
(iv) du chlore,
(v) du bioxyde de chlore,
(vi) du peroxyde de benzoyle, en quantité d’au plus 150 parties en poids par million de parties de farine, avec ou sans véhicule constitué d’au plus 900 parties en poids par million de parties de farine de l’une ou d’un mélange des substances suivantes : carbonate de calcium, sulfate de calcium, phosphate bicalcique, carbonate de magnésium, sulfate double d’aluminium et de potassium, sulfate double d’aluminium et de sodium, amidon et phosphate tricalcique,
(vii) [Abrogé, DORS/94-227, art. 1]
(viii) du persulfate d’ammonium, en quantité d’au plus 250 parties en poids par million de parties de farine,
(ix) du chlorure d’ammonium, en quantité d’au plus 2 000 parties en poids par million de parties de farine,
(x) du peroxyde d’acétone,
(xi) de l’azodicarbonamide, en quantité d’au plus 45 parties en poids par million de parties de farine,
(xii) de l’acide ascorbique, en quantité d’au plus 200 parties en poids par million de parties de farine,
(xiii) du l-cystéine (chlorhydrate), en quantité d’au plus 90 parties en poids par million de parties de farine,
(xiv) du phosphate monocalcique en quantité d’au plus 7 500 parties en poids par million de parties de farine, et
(xv) par 100 grammes de farine :
(A) 0,31 milligramme de vitamine B6,
(B) 1,3 milligramme d’acide-d-pantothénique,
(C) 190 milligrammes de magnésium;
f) peut contenir du carbonate de calcium, de la farine d’os comestible, de la craie (B.P.), du calcaire broyé ou du sulfate de calcium, en quantité suffisante pour que 100 grammes de farine contiennent au moins 140 milligrammes de calcium.
g) [Abrogé, DORS/97-151, art. 21]
- DORS/78-402, art. 3
- DORS/78-698, art. 2
- DORS/80-632, art. 3
- DORS/82-383, art. 5
- DORS/84-300, art. 41(A)
- DORS/89-145, art. 1
- DORS/92-63, art. 1
- DORS/92-94, art. 1
- DORS/94-227, art. 1
- DORS/94-689, art. 2
- DORS/96-527, art. 1
- DORS/97-122, art. 1
- DORS/97-151, art. 21
- DORS/97-558, art. 1
- DORS/98-550, art. 1
- DORS/2003-130, art. 1
- DORS/2012-26, art. 1
- DORS/2012-46, art. 1
B.13.002 Malgré l’article B.13.001, il n’est pas nécessaire que la farine, la farine blanche, la farine enrichie ou la farine blanche enrichie utilisée ou vendue pour la fabrication de gluten ou d’amidon renferme de la thiamine, de la riboflavine, de la niacine, de l’acide folique ou du fer ajoutés.
- DORS/98-550, art. 2
B.13.003 [N]. La farine blanche à vitamine B (Approuvée-Canada)
a) doit être de la farine qui a été moulue de façon à conserver une forte proportion des vitamines naturelles du grain de blé original;
b) doit correspondre à un taux d’extraction d’au moins 70 pour cent du blé dont elle provient;
c) doit être blutée sur au moins un tamis ayant une ouverture de maille ne dépassant pas celle de la toile métallique dite 149 microns (tamis no 100); et
d) doit, sur la matière desséchée, renfermer
(i) par livre, une quantité de complexe vitaminique B fournissant au moins 1,2 milligramme de thiamine, et
(ii) au plus 0,70 pour cent et au moins 0,61 pour cent de cendres.
B.13.004 [Abrogé, DORS/79-252, art. 1]
B.13.005 [N]. La farine de blé entier, farine de blé complet,
a) doit être le produit alimentaire obtenu par mouture et blutage de blé nettoyé de qualité à farine, dont une partie de la couche externe du son ou épiderme, a été enlevée;
b) doit renfermer les constituants naturels du grain de blé dans la proportion d’au moins 95 pour cent du poids total du blé dont elle provient;
c) doit avoir
(i) une teneur en cendres, calculée sur la matière desséchée, d’au moins 1,25 pour cent et d’au plus 2,25 pour cent,
(ii) une teneur en humidité d’au plus 15 pour cent, et
(iii) un degré de finesse tel qu’au moins 90 pour cent passe librement au travers d’un tamis no 8 (2 380 microns), et au moins 50 pour cent, au travers d’un tamis no 20 (840 microns); et
d) peut renfermer
(i) de la farine de blé maltée,
(ii) de la farine d’orge maltée, en quantité d’au plus 0,50 pour cent du poids de la farine,
(iii) de l’amylase, de l’amylase maltogène, de l’asparaginase, de la broméline, de la glucoamylase, de la glucose-oxydase, de la lactase, de la lipase, de la lipoxydase, de la pentosanase, de la phospholipase, de la protéase, de la pullulanase ou de la xylanase,
(iv) du chlore,
(v) du bioxyde de chlore,
(vi) du peroxyde de benzoyle, en quantité d’au plus 150 parties en poids par million de parties de farine, avec ou sans véhicule constitué d’au plus 900 parties en poids par million de parties de farine de l’une ou d’un mélange des substances suivantes : carbonate de calcium, sulfate de calcium, phosphate bicalcique, carbonate de magnésium, sulfate double d’aluminium et de potassium, sulfate double d’aluminium et de sodium, amidon et phosphate tricalcique,
(vii) [Abrogé, DORS/94-227, art. 2]
(viii) du persulfate d’ammonium, en quantité d’au plus 250 parties en poids par million de parties de farine,
(ix) du chlorure d’ammonium, en quantité d’au plus 2 000 parties en poids par million de parties de farine,
(x) de l’azodicarbonamide, en quantité d’au plus 45 parties en poids par million de parties de farine,
(xi) de peroxyde d’acétone,
(xii) de l’acide ascorbique, en quantité d’au plus 200 parties en poids par million de parties de farine, et
(xiii) du l-cystéine (chlorhydrate), en quantité d’au plus 90 parties en poids par million de parties de farine.
e) [Abrogé, DORS/97-151, art. 22]
- DORS/78-402, art. 4
- DORS/80-632, art. 4
- DORS/82-383, art. 6
- DORS/92-63, art. 2
- DORS/92-94, art. 2
- DORS/94-227, art. 2
- DORS/94-689, art. 2
- DORS/97-122, art. 2
- DORS/97-151, art. 22
- DORS/97-558, art. 2
- DORS/2000-184, art. 63(F)
- DORS/2003-130, art. 2
- DORS/2012-26, art. 2
- DORS/2012-46, art. 2
B.13.006 [N]. La farine Graham doit être de la farine à laquelle a été ajoutée une partie du son et autres constituants du grain de blé, et doit avoir une teneur en cendres, calculée sur la matière desséchée, d’au moins 1,20 pour cent et d’au plus 2,25 pour cent.
B.13.007 [N]. La farine de gluten doit être le produit alimentaire obtenu en enlevant de la farine une partie de l’amidon, et elle doit renfermer au plus
a) 10 pour cent d’humidité, et
b) 44 pour cent d’amidon, calculé sur la matière desséchée, selon la méthode officielle FO-28, Détermination d’amidon dans la farine de gluten, 15 octobre 1981.
- DORS/82-768, art. 37
B.13.008 [N]. Le blé broyé, blé de mouture grossière, doit être le produit alimentaire préparé par mouture de blé nettoyé, de façon que 40 pour cent ou plus passe au travers d’un tamis no 8 (2 380 microns) et moins de 50 pour cent au travers d’un tamis no 20 (840 microns), sans modifier les proportions des constituants naturels dudit blé, à part l’humidité, et doit avoir
a) une teneur en cendres, calculée sur la matière desséchée, d’au moins 1,50 pour cent et d’au plus 2,25 pour cent; et
b) une teneur en humidité d’au plus 15,5 pour cent.
B.13.009 [N]. Le blé concassé doit être le produit alimentaire obtenu par concassage ou par coupage de blé nettoyé en fragments anguleux, de sorte qu’au moins 90 pour cent passe au travers d’un tamis no 8 (2 380 microns) et au plus 20 pour cent au travers d’un tamis no 20 (840 microns), sans modifier les proportions des constituants naturels dudit blé, sauf l’humidité, et doit avoir
a) une teneur en cendres, calculée sur la matière desséchée, d’au moins 1,50 pour cent et d’au plus 2,25 pour cent; et
b) une teneur en humidité d’au plus 15,5 pour cent.
B.13.010 [N]. Le riz doit être le grain du riz, décortiqué, ou décortiqué et poli, et, dans le cas de grains décortiqués et polis, il peut porter un enrobage de silicate de magnésium, de talc et de glucose.
- DORS/78-403, art. 3
B.13.010.1 (1) Aux fins du présent titre, le terme riz précuit s’entend du riz poli qui a été cuit à l’eau ou à la vapeur et séché de façon que les grains de riz conservent leur caractère poreux et leur structure ouverte.
(2) Nonobstant les articles D.01.009, D.01.011 et D.02.009, il est interdit de vendre du riz précuit auquel a été ajouté une vitamine ou un minéral nutritif mentionné à la colonne I du tableau du présent article ou une combinaison de ceux-ci, en une quantité autre que celle prévue à la colonne II de ce tableau par 100 g de riz précuit.
TABLEAU
Colonne I Colonne II Article Vitamine ou minéral nutritif Quantité par 100 g de riz précuit 1 Thiamine 0,45 mg 2 Niacine 4,2 mg 3 Vitamine B6 0,6 mg 4 Acide folique 0,016 mg 5 Acide pantothénique 1,2 mg 6 Fer 1,6 mg (3) Il est interdit de présenter du riz précuit comme étant « enrichi » à moins qu’il n’ait été additionné de thiamine, de niacine et de fer.
- DORS/86-320, art. 1
- DORS/98-458, art. 7(F)
B.13.011 [N]. L’amidon de maïs ou la fécule de maïs doit être l’amidon extrait du maïs et doit contenir au moins 84 % d’amidon.
- DORS/84-300, art. 42
- DORS/2011-28, art. 5
B.13.014 Aux fins du présent titre, la teneur en humidité, la teneur en cendres et le degré de finesse doivent être déterminés selon la méthode officielle applicable suivante :
a) FO-29, Détermination d’humidité dans les céréales, 15 octobre 1981;
b) FO-30, Détermination de cendres dans les céréales, 15 octobre 1981; ou
c) FO-31, Détermination de degré de finesse des produits de céréales, 15 octobre 1981.
- DORS/82-768, art. 38
B.13.015 [N]. La farine de graine de coton ou les produits analogues à base de graine de coton seront tirés de graines décortiquées, dégraissées ou partiellement dégraissées, cuites et moulues, et ils renfermeront au plus 450 parties par million de gossypol libre.
B.13.020 Dans le présent titre, solides de lait s’entend de la quantité totale des solides provenant du lait, du lait partiellement écrémé, du lait écrémé ou de l’un de ceux-ci sous forme concentrée, desséchée ou reconstituée, seul ou dans une combinaison quelconque.
- DORS/89-170, art. 1
Pain
B.13.021 [N]. Le pain ou pain blanc, doit être l’aliment fabriqué par cuisson d’une pâte à levain, préparée avec de la farine et de l’eau, et il peut renfermer
a) du sel;
b) du shortening, du saindoux, du beurre, ou de la margarine;
c) du lait ou un produit du lait;
d) des oeufs, du blanc d’oeuf, du jaune d’oeuf (à l’état frais, en poudre ou congelé);
e) un agent édulcorant;
f) du sirop de malt, de l’extrait de malt, ou de la farine maltée;
g) de la levure sèche inactive de l’espèce Saccharomyces cerevisiae, en quantité d’au plus deux parties en poids par 100 parties de farine employée;
h) de l’amylase, de l’amylase maltogène, de l’asparaginase, de la broméline, de la glucoamylase, de la glucose-oxydase, de la lactase, de la lipase, de la lipoxydase, de la pentosanase, de la phospholipase, de la protéase, de la pullulanase ou de la xylanase;
i) sous réserve de l’article B.13.029, un ou plusieurs des ingrédients suivants, en quantité d’au plus cinq parties en poids par 100 parties de farine employée : farine de blé complet, farine blé entier, farine Graham, farine de gluten, farine de blé, amidon de blé, farine autre que le blé ou amidon autre que le blé, chacun pouvant être entièrement ou partiellement dextrinisé;
j) d’autres parties du grain de blé;
k) de la lécithine ou du sel d’ammonium de glycéride phosphorylé;
l) des monoglycérides et des diglycérides des acides gras qui entrent dans la composition des matières grasses;
m) du chlorure d’ammonium, du sulfate d’ammonium, du carbonate de calcium, du lactate de calcium, du phosphate diammonique, du phosphate dicalcique, du phosphate monoammonique, ou un mélange quelconque desdits, en quantité n’excédant pas, pour l’ensemble des additifs, 0,25 parties en poids par 100 parties de farine employée;
n) du phosphate monocalcique en quantité d’au plus 0,75 parties en poids par 100 parties de farine employée;
o) du peroxyde de calcium, du persulfate d’ammonium, du persulfate de potassium ou une combinaison de ces additifs, en quantité n’excédant pas, pour l’ensemble de ces additifs, 0,01 partie en poids pour 100 parties de farine employée;
p) du peroxyde d’acétone;
q) du vinaigre;
r) un agent de conservation de la catégorie III;
s) un colorant pour aliments;
t) du stéaroyl-2-lacylate de calcium ou stéaroyl-2-lactylate de sodium en quantité d’au plus 0,375 partie, en poids, par 100 parties de farine employée;
u) du l-cystéine (chlorhydrate), en quantité d’au plus 0,009 partie en poids par 100 parties de farine employée;
v) du sulfate de calcium, en quantité d’au plus 0,5 partie en poids par 100 parties de farine employée;
w) du stéaryl-fumarate de sodium, en quantité d’au plus 0,5 partie en poids par 100 parties de farine employée;
x) de l’acide ascorbique, en quantité d’au plus 0,02 partie en poids par 100 parties de farine employée;
y) de l’acide lactique;
z) de l’azodicarbonamide en quantité d’au plus 45 parties en poids par million de parties de farine;
aa) de l’iodate de calcium, de l’iodate de potassium ou un mélange quelconque desdits, en quantité n’excédant pas, pour l’ensemble des additifs 45 parties en poids par million de parties de farine employée;
bb) des esters tartriques des mono- et diglycérides acétylés, en une quantité n’excédant pas au poids 0,6 partie par 100 parties de farine employée;
cc) de la gomme de guar.
- DORS/78-402, art. 5
- DORS/79-251, art. 2
- DORS/82-383, art. 7 et 8
- DORS/84-300, art. 43(A)
- DORS/92-63, art. 3
- DORS/92-94, art. 3
- DORS/94-227, art. 3
- DORS/97-122, art. 3
- DORS/97-558, art. 3
- DORS/2003-130, art. 3
- DORS/2007-302, art. 4(F)
- DORS/2011-278, art. 10
- DORS/2012-26, art. 3
- DORS/2012-43, art. 15(F)
- DORS/2012-46, art. 3
B.13.022 [N]. Le pain enrichi ou le pain blanc enrichi:
a) doit être du pain fabriqué à partir d’une pâte dans laquelle la farine de blé enrichi est la seule farine de blé utilisée;
b) doit contenir :
(i) par 100 parties de farine employée, au moins :
(A) soit deux parties en poids de solides de lait écrémé,
(B) soit quatre parties en poids de poudre de petit-lait,
(C) soit la quantité d’un produit protéique à base de pois (Pisum sativum) ou de fèves de soja (Glycine max) qui donnera 0,5 partie en poids de protéine,
(ii) par 100 grammes de pain, au moins :
(A) 0,40 milligramme de thiamine,
(B) 0,24 milligramme de riboflavine,
(C) 3,3 milligrammes de niacine ou de niacinamide,
(D) 0,10 milligramme d’acide folique,
(E) 2,76 milligrammes de fer;
c) peut contenir par 100 grammes de pain au moins :
(i) 0,14 milligramme de vitamine B6,
(ii) 0,6 milligramme d’acide d-pantothénique,
(iii) 90 milligrammes de magnésium,
(iv) 66 milligrammes de calcium;
d) peut être désigné par le nom usuel « pain au lait » s’il contient au moins six parties en poids de solides de lait par 100 parties de farine enrichie employée.
- DORS/78-698, art. 3
- DORS/87-704, art. 1
- DORS/89-170, art. 2
- DORS/89-198, art. 3
- DORS/98-550, art. 3
B.13.023 et B.13.024 [Abrogés, DORS/79-252, art. 1]
B.13.025 [N]. Le pain aux raisins ou pain de raisin, doit être du pain qui renferme, par 100 parties de la farine employée, au moins 50 parties en poids de raisin sec épépiné, ou sans pépins, ou de raisin sec et de raisin de Corinthe, dont au moins 35 parties doivent être du raisin, et il peut renfermer des épices et des écorces ou zeste de fruits.
B.13.026 [N]. Le pain à (indication du pourcentage) de blé entier :
a) doit :
(i) être du pain pour lequel le pourcentage indiqué de farine représente le pourcentage de farine de blé entier employée,
(ii) contenir au moins 60 pour cent de farine de blé entier par rapport à la quantité totale de farine employée;
b) peut :
(i) contenir du caramel,
(ii) être désigné par le nom usuel « pain au lait à (indication du pourcentage) de blé entier » s’il contient au moins six parties en poids de solides de lait par 100 parties de la quantité totale de farine enrichie et de farine de blé entier employées.
- DORS/89-170, art. 3
B.13.027 [N]. Le pain brun ou pain bis, doit être du pain coloré au moyen de farine de blé entier, de farine graham, de son, de mélasse ou de caramel.
B.13.028 [Abrogé, DORS/97-151, art. 23]
B.13.029 Les pains de composition spéciale peuvent être composés
a) d’un ou de plusieurs ingrédients à l’alinéa B.13.021i) en quantité supérieure à celle spécifiée dans cet alinéa; et
b) de fruits, de noix, de graines et d’ingrédients aromatisants.
- DORS/79-251, art. 3
Pâtes alimentaires
B.13.051 Est interdite la vente de macaroni, de spaghetti, de nouilles et toute pâte alimentaire semblable, sous la désignation de macaroni aux oeufs, spaghetti aux oeufs, nouilles aux oeufs, ou pâtes alimentaires aux oeufs, respectivement, à moins que ces aliments ne contiennent, sur la matière desséchée, au moins quatre pour cent de solides du jaune d’oeufs provenant d’oeufs entiers, d’oeufs séchés, d’oeufs congelés ou de jaune d’oeuf congelé.
B.13.052 (1) Par dérogation aux articles D.01.009, D.01.011 et D.02.009, il est interdit de vendre une pâte alimentaire à laquelle a été ajouté une vitamine ou un minéral nutritif énuméré à la colonne I du tableau du présent article, à moins que chaque portion de 100 g de la pâte alimentaire ne renferme au moins la quantité minimale de vitamine ou de minéral nutritif ajouté qui est prévue à la colonne II et au plus la quantité maximale prévue à la colonne III.
(2) Il est interdit de présenter une pâte alimentaire comme « enrichie » à moins qu’elle ne renferme une quantité ajoutée de thiamine, de riboflavine, de niacine, d’acide folique et de fer conforme au tableau du présent article.
TABLEAU
Article Colonne I Colonne II Colonne III Vitamine ou minéral nutritif ajouté Quantité minimale par 100 g de la pâte alimentaire Quantité maximale par 100 g de la pâte alimentaire 1 Thiamine 0,63 mg 1,50 mg 2 Riboflavine 0,11 mg 0,60 mg 3 Niacine 5,90 mg 7,50 mg 4 Acide folique 0,20 mg 0,27 mg 5 Acide pantothénique 1,00 mg 2,00 mg 6 Vitamine B6 0,40 mg 0,80 mg 7 Fer 2,90 mg 4,30 mg 8 Magnésium 150,00 mg 300,00 mg
- DORS/94-37, art. 1
- DORS/94-689, art. 2
- DORS/96-527, art. 2
- DORS/98-550, art. 4 et 5
Céréales à déjeuner
B.13.060 Nonobstant les articles D.01.009, D.01.011 et D.02.009, il est interdit de vendre une céréale à déjeuner à laquelle ont été ajoutés un ou plusieurs des vitamines ou minéraux nutritifs énumérés à la colonne I du tableau du présent article, à moins que chaque portion de 100 g de la céréale ne renferme la quantité de vitamines ou de minéraux nutritifs ajoutés qui est prévue à la colonne II de ce tableau.
TABLEAU
| Colonne I | Colonne II | |
|---|---|---|
| Article | Vitamine ou minéral nutritif | Quantité par 100 g de la céréale à déjeuner |
| 1 | Thiamine | 2,0 mg |
| 2 | Niacine | 4,8 mg |
| 3 | Vitamine B6 | 0,6 mg |
| 4 | Acide folique | 0,06 mg |
| 5 | Acide pantothénique | 1,6 mg |
| 6 | Magnésium | 160,0 mg |
| 7 | Fer | 13,3 mg |
| 8 | Zinc | 3,5 mg |
- DORS/83-858, art. 1
- DORS/89-145, art. 2
- DORS/98-458, art. 7(F)
TITRE 14Viande, préparations et produits de la viande
B.14.001 Dans le présent titre,
- agent de remplissage
agent de remplissage désigne toute substance végétale, (à l’exception de la tomate et de la pulpe de betterave), le lait, les oeufs, la levure, ou tout dérivé ou combinaison de ces produits qui serait acceptable comme aliment; (filler)
- animal
animal comprend les animaux utilisés comme aliments, mais ne comprend ni les animaux marins ni les animaux d’eau douce. (animal)
- remplissage
remplissage[Abrogée, DORS/86-875, art. 1]
- DORS/82-768, art. 39
- DORS/86-875, art. 1
B.14.002 [N]. La viande doit être la portion comestible du muscle squelettique d’un animal sain au moment de l’abattage, ou du muscle que l’on trouve dans la langue, le diaphragme, le coeur ou l’oesophage; elle peut renfermer la graisse qui y adhère ou le recouvre, ainsi que les portions d’os, de peau, de tendons, de nerfs ou de vaisseaux sanguins, qui accompagnent normalement le tissu musculaire et n’en sont pas séparés au moment de l’habillage, mais ne comprend pas le muscle trouvé dans les lèvres, le groin ou le museau, la peau de la tête ou les oreilles.
B.14.003 [N]. Les sous-produits de viande doivent être toute portion comestible d’un animal, autre que la viande, qui provient d’un ou de plusieurs animaux sains au moment de l’abattage.
B.14.004 La viande, les sous-produits de viande ou leurs préparations sont falsifiés s’ils renferment ou si on leur a ajouté l’une des substances ou catégories de substances nommées ci-dessous :
a) des muqueuses, des organes ou des parties d’organes de l’appareil génital, du caecum, de la rate, du pis, des poumons, ou tout autre organe ou partie d’un animal qui ne sont pas vendus d’habitude comme article d’alimentation;
b) un agent de conservation autre que ceux qui sont prévus au présent titre; ou
c) un colorant autre que le rocou, le rouge allura et le jaune soleil FCF, visés par le présent titre, ainsi que le caramel.
- DORS/92-725, art. 2
- DORS/97-516, art. 2
- DORS/2016-74, art. 6(F)
B.14.005 [N]. La viande préparée et les sous-produits de viande préparée doivent être, respectivement, de la viande ou des sous-produits de viande, hachés ou non, auxquels a été ajouté tout ingrédient permis par le présent règlement, ou qui ont subi un procédé de conservation, qui ont été placés dans un contenant hermétiquement fermé ou qui ont été cuits, et peuvent renfermer :
a) un agent de conservation de la catégorie II;
a.1) dans le cas de jambons, d’épaules, de socs de porc, de jambons pique-nique et de jambons de longe préparés : de la gélatine;
b) dans le cas des tissus gras de porc ou de boeuf partiellement dégraissés : un agent de conservation de la catégorie IV;
c) lorsque le présent titre prescrit une teneur totale minimale en protéines ou une teneur minimale en protéines de viande, un ou plusieurs des sels de phosphate suivants, en une proportion n’excédant pas la limite de tolérance calculée en phosphate disodique conformément au tableau XII de l’article B.16.100 :
(i) du pyrophosphate acide de sodium,
(ii) de l’hexamétaphosphate de sodium,
(iii) du phosphate disodique,
(iv) du phosphate monosodique,
(v) du pyrophosphate tétrasodique,
(vi) du tripolyphosphate de sodium,
(vii) du phosphate monopotassique,
(viii) du phosphate dipotassique,
(ix) du pyrophosphate tétrapotassique;
d) dans le cas de rôtis de boeuf tranchés emballés sous vide et de jambons cuits tranchés emballés sous vide : du Carnobacterium maltaromaticum CB1.
- DORS/94-262, art. 2
- DORS/2010-264, art. 1
- DORS/2011-280, art. 1
B.14.006 L’huile de coton entièrement hydrogénée en poudre peut être appliquée comme agent de démoulage sur la surface de la viande, des sous-produits de viande, des viandes préparées, des sous-produits de viande préparés, des produits de viande avec allongeur et des simili-produits de viande en une quantité n’excédant pas 0,25 % du produit.
- DORS/2010-142, art. 59(F)
- DORS/2022-168, art. 42
B.14.007 [N]. Le liant à viande ou le liant à (désignation du produit de viande) est un agent de remplissage contenant une combinaison quelconque de sel, d’agents édulcorants, d’épices ou d’autres condiments (sauf la tomate), d’oeufs, de blancs d’oeufs, et
a) lorsqu’il est vendu pour servir dans les viandes conservées et dans les sous-produits de viande conservés, il peut renfermer de l’acide ascorbique, de l’acide érythorbique, de l’acide isoascorbique, de l’ascorbate de calcium, de l’ascorbate de sodium, du carbonate de sodium, de l’érythorbate de sodium, de l’iso-ascorbate de sodium, du nitrate de potassium, du nitrite de potassium, du nitrate de sodium ou du nitrite de sodium, pourvu que ces nitrates et nitrites, le cas échéant, soient emballés séparément des épices et condiments;
b) lorsqu’il est vendu pour servir dans la viande préparée ou dans les sous-produits de viande dans lesquels il est permis d’ajouter un agent gélatinisant, il peut renfermer un tel agent gélatinisant;
c) lorsque le liant est vendu pour servir dans la saucisse fraîche, crue, il peut contenir un arôme artificiel d’érable; et
d) peut contenir un agent anti-agglomérant.
- DORS/80-13, art. 1
- DORS/82-913, art. 1
- DORS/86-875, art. 2(F)
- DORS/2010-143, art. 9
- DORS/2017-18, art. 3(F)
B.14.008 Est interdite la vente d’un liant à viande, d’un agent de remplissage ou de préparations pour marinades, saumures ou mélanges de salaison à sec, présentés comme devant servir dans les produits de viande, à moins que l’étiquette ne donne un mode d’emploi qui, s’il est suivi, produira un aliment conforme aux dispositions de l’article B.14.030 touchant l’agent de remplissage et que l’aliment ne contienne au maximum que la quantité d’additifs alimentaires correspondant aux limites de tolérance prescrites dans le présent règlement.
- DORS/84-300, art. 44(A)
B.14.009 [N]. La marinade, la saumure et le mélange de salaison à sec employés dans le marinage des viandes conservées et des sous-produits de viande conservés peuvent renfermer :
a) des agents de conservation de la catégorie I, si les nitrates ou les nitrites, ou les deux, d’une part, et les épices et condiments, d’autre part, sont emballés séparément;
b) de l’acide citrique, du citrate de sodium ou du vinaigre;
c) des agents édulcorants, y compris le sucre d’érable et le sirop d’érable;
d) un arôme de fumée liquide, un arôme de fumée liquide concentré, du sel, des assaisonnements, des épices, des extraits d’épice, des huiles d’épice ou des oléorésines d’épice;
e) du bicarbonate de sodium, de l’hydroxyde de sodium ou de l’hydroxyde de potassium;
f) dans la marinade servant à la salaison de coupes de porc, de boeuf, ou d’agneau : du phosphate disodique, du phosphate monosodique, de l’hexamétaphosphate de sodium, du tripolyphosphate de sodium, du pyrophosphate tétrasodique et du pyrophosphate acide de sodium, en telle quantité, calculée en phosphate disodique, que le produit fini renferme au plus 0,5 pour cent de phosphate ajouté;
g) dans le cas de marinade servant à la salaison de parties de boeufs, des enzymes, si l’espace principal de l’étiquette du boeuf salé porte, immédiatement avant ou après le nom ordinaire, la mention « Attendri par...(nom de l’enzyme ou des enzymes protéolytiques) »;
h) dans le cas du mélange de salaison à sec : un agent anti-agglomérant ou un agent humidifiant; et
i) dans le cas de la marinade servant à la salaison
(i) de jambon, d’épaules et de dos de porc, de l’arôme artificiel d’érable, et
(ii) de poitrines de porc : de l’arôme artificiel d’érable, et un arôme d’orange conforme à la norme prescrite à l’article B.10.005.
- DORS/79-251, art. 4
- DORS/80-13, art. 2
- DORS/82-596, art. 1
- DORS/88-336, art. 3
- DORS/94-567, art. 1
- DORS/2010-143, art. 10(F)
- DORS/2017-18, art. 4(F)
- DORS/2018-69, art. 4(F)
B.14.010 Est interdite la vente comme aliment d’un animal mort ou de n’importe quelle partie d’un tel animal.
B.14.011 Est interdite la vente comme aliment de la viande, des sous-produits de la viande, des préparations contenant de la viande ou des dérivés de la viande, obtenus, préparés ou fabriqués à partir d’un animal mort.
B.14.012 Aux fins des articles B.14.010 et B.14.011, animal mort signifie un animal mort qui
a) n’a pas été abattu pour servir comme aliment, conformément aux pratiques acceptées couramment d’abattre les animaux pour utiliser comme aliment, et qui doit comprendre la saignée; ou
b) était atteint de maladie au moment de l’abattre.
B.14.013 et B.14.014 [Abrogés, DORS/97-148, art. 3]
Viande, sous-produits de la viande
B.14.015 [N]. Le boeuf haché ordinaire doit être de la viande de boeuf hachée finement et doit contenir tout au plus 30 pour cent de gras de boeuf, déterminé selon la méthode officielle FO-33, Détermination de matières grasses dans des produits de viande et des simili-produits de viande, 15 octobre 1981.
- DORS/82-768, art. 40
B.14.015A [N]. Le boeuf haché mi-maigre doit être de la viande de boeuf hachée finement et doit contenir tout au plus 23 pour cent de gras de boeuf, déterminé selon la méthode officielle FO-33, Détermination de matières grasses dans des produits de viande et des simili-produits de viande, 15 octobre 1981.
- DORS/82-768, art. 40
B.14.015B [N]. Le boeuf haché maigre doit être de la viande de boeuf hachée finement et doit contenir tout au plus 17 pour cent de gras de boeuf, déterminé selon la méthode officielle FO-33, Détermination de matières grasses dans des produits de viande et des simili-produits de viande, 15 octobre 1981.
- DORS/82-768, art. 40
B.14.015C Est interdite la vente de boeuf haché contenant plus de 30 pour cent de gras de boeuf, déterminé selon la méthode officielle FO-33, Détermination de matières grasses dans des produits de viande et des simili-produits de viande, 15 octobre 1981.
- DORS/82-768, art. 40
B.14.016 Est interdite la vente de viande de cheval, de sous-produits de viande de cheval, ou de tout aliment en contenant, à moins
a) qu’ils ne soient étiquetés comme tels, lorsqu’ils sont offerts ou exposés en vente; et
b) lorsqu’ils sont sous forme d’emballages, que l’espace principal de l’étiquette ne porte une déclaration de la présence de viande de cheval ou d’un sous-produit de viande de cheval en caractères au moins aussi lisibles et aussi en évidence que n’importe quels autres caractères sur ledit espace principal.
- DORS/88-336, art. 3
B.14.017 [Abrogé, DORS/2003-292, art. 2]
B.14.018 (1) Sous réserve du paragraphe (2), l’annonce pour la vente d’une carcasse de boeuf ou de veau ou d’une partie de celle-ci pesant au moins 7 kg doit indiquer :
a) s’il s’agit d’une carcasse autre qu’une carcasse importée, la catégorie qui a été attribuée à la carcasse en application de la Loi sur la salubrité des aliments au Canada ou d’une loi provinciale;
b) s’il s’agit d’une carcasse de boeuf importée, la catégorie qui a été attribuée à la carcasse en application de la Loi sur la salubrité des aliments au Canada ou d’une loi provinciale ou la catégorie qui a été attribuée à la carcasse par l’autorité responsable constituée en vertu des lois du pays d’origine;
c) s’il s’agit d’une carcasse de veau importée, la catégorie qui a été attribuée à la carcasse par l’autorité responsable constituée en vertu des lois du pays d’origine;
d) s’il s’agit d’une carcasse de boeuf, la catégorie de rendement qui a été attribuée à la carcasse, le cas échéant, en application de la Loi sur la salubrité des aliments au Canada.
(2) Si la carcasse visée au paragraphe (1) n’a fait l’objet d’aucune classification et que toute la carcasse ou partie de celle-ci pesant au moins 7 kilogrammes est annoncée pour la vente, l’annonce doit indiquer clairement que la carcasse n’a pas été classée.
- DORS/92-626, art. 15
- DORS/2003-6, art. 79
- DORS/2018-108, art. 398
B.14.019 (1) L’annonce, pour la vente, d’une carcasse de boeuf, de veau, de porc ou d’agneau ou d’une partie de celle-ci pesant au moins 7 kilogrammes qui indique le prix de vente doit :
a) contenir la mention « le prix au kilogramme est établi en fonction du poids de la carcasse avant le débitage, le désossage et le parage » ou la mention « le prix au kilogramme est établi en fonction du poids de la viande après le débitage, le désossage et le parage », selon le cas;
b) si, en sus du prix de vente, des frais sont exigibles pour le débitage, le désossage, le parage, l’emballage ou la congélation de la carcasse ou de la partie de carcasse :
(i) préciser le montant de ces frais,
(ii) lorsque ces frais sont établis d’après un prix unitaire au poids, préciser s’ils sont calculés selon le poids avant ou après le débitage, le désossage et le parage de la carcasse.
(2) Les renseignements exigés au paragraphe (1) doivent figurer juste à côté du prix de vente, sans qu’aucun texte imprimé ou écrit ni aucun signe graphique soient intercalés entre les deux.
- DORS/92-626, art. 15
- DORS/95-548, art. 5(F)
B.14.020 [N]. La viande coupée solide doit consister :
a) soit en une pièce de viande entière;
b) soit en un produit constitué de morceaux de viande dont plus de 80 pour cent pèsent au moins 25 g chacun.
- DORS/94-262, art. 3
B.14.021 (1) Est interdite la vente de viande coupée solide à laquelle ont été ajoutés des sels de phosphate ou de l’eau, à moins que les conditions suivantes ne soient réunies :
a) la viande, à l’exception du bacon de flanc, du bacon Wiltshire, des bajoues de porc, et du porc et du boeuf salés, a :
(i) si elle est cuite, une teneur minimale en protéines de viande de 12 pour cent,
(ii) si elle n’est pas cuite, une teneur minimale en protéines de viande de 10 pour cent;
b) la viande contient un ou plusieurs des sels de phosphate suivants, en une proportion n’excédant pas la limite de tolérance calculée en phosphate disodique conformément au tableau XII de l’article B.16.100 :
(i) du pyrophosphate acide de sodium,
(ii) de l’hexamétaphosphate de sodium,
(iii) du phosphate disodique,
(iv) du phosphate monosodique,
(v) du pyrophosphate tétrasodique,
(vi) du tripolyphosphate de sodium,
(vii) du phosphate monopotassique,
(viii) du phosphate dipotassique,
(ix) du pyrophosphate tétrapotassique.
(2) Aux fins du calcul de la teneur en protéines de viande visée à l’alinéa (1)a), les os et les couches de gras visible ne doivent pas être pris en compte.
- DORS/94-262, art. 3
B.14.022 Est interdite la vente de boeuf attendri mécaniquement à moins que les conditions ci-après ne soient réunies :
a) le boeuf est identifié comme tel lorsqu’il est offert ou exposé en vente;
b) il porte une étiquette ayant un espace principal qui, sous réserve de l’article B.01.012, contient les renseignements suivants :
(i) en caractères au moins aussi lisibles et en évidence que ceux du nom usuel :
(A) pour ce qui est de la version française de l’étiquette, les mots « attendri mécaniquement », avec les adaptations nécessaires, le cas échéant,
(B) pour ce qui est de la version anglaise de l’étiquette, les mots « mechanically tenderized »,
(ii) en caractères au moins aussi lisibles et en évidence que ceux de tout autre renseignement autre que le nom usuel :
(A) pour ce qui est de la version française de l’étiquette, les mentions ci-après :
(I) « Faire cuire jusqu’à ce que la température interne atteigne au moins 63 °C (145 °F). »,
(II) en outre, s’agissant de bifteck, « Retourner le bifteck au moins deux fois durant la cuisson. »,
(B) pour ce qui est de la version anglaise de l’étiquette, les mentions ci-après :
(I) « Cook to a minimum internal temperature of 63°C (145°F). »,
(II) en outre, s’agissant de bifteck, « Turn steak over at least twice during cooking. ».
- DORS/2014-99, art. 2
Viandes préparées, sous-produits de viande préparés
B.14.030 (1) Sous réserve des paragraphes (2) et (3) et de l’article B.14.030A, il est interdit de vendre de la viande préparée ou un sous-produit de viande préparée dont la teneur en protéines est de moins de 1,5 point de pourcentage inférieure à la teneur totale en protéines exigée pour cet aliment.
(2) Le paragraphe (1) ne s’applique pas à un produit de viande avec allongeur.
(3) Dans le cas où la viande préparée ou le sous-produit de viande préparée contient de la gélatine, cet ingrédient ne doit pas être pris en compte dans le calcul de la teneur totale en protéines de cet aliment.
- DORS/78-637, art. 3
- DORS/79-251, art. 5(F)
- DORS/80-13, art. 3
- DORS/82-768, art. 41
- DORS/86-875, art. 3
B.14.030A Pour l’application des articles B.14.030, B.14.032, B.14.033, B.14.035, B.14.074, B.14.075, B.14.076 et B.14.077, dans le cas où l’un ou l’autre des ingrédients non carnés énumérés aux sous-alinéas B.14.032Aa) à g) est présent dans une viande préparée ou un sous-produit de viande préparée, en morceaux identifiables et en quantité suffisante pour différencier ces ingrédients de la viande préparée ou du sous-produit de viande préparée, cet ingrédient ne doit pas être pris en compte dans le calcul de la quantité totale de gras ou de protéines.
- DORS/86-875, art. 3
B.14.031 [N]. La viande conservée et les sous-produits de viande conservés sont faits de viande crue ou cuite ou d’un sous-produit de viande crue ou cuite, qui ont été salés, asséchés, marinés, saumurés ou fumés et peuvent être garnis d’une glace et renfermer :
a) un agent de conservation de la catégorie I;
a.1) un agent de conservation de la catégorie II;
b) des agents édulcorants;
c) des épices et des condiments, sauf la tomate;
d) du vinaigre;
e) de l’alcool;
f) de l’arôme de fumée ou de l’arôme artificiel de fumée;
g) dans le cas de jambons, d’épaules, de dos et de poitrines de porc fumés : de l’arôme artificiel d’érable;
gg) dans le cas des poitrines de porc de salaison : un arôme d’orange conforme à la norme prescrite à l’article B.10.005;
h) dans le cas des coupes de porc, de boeuf ou d’agneau de salaison préparées à l’aide de marinade, du phosphate disodique, du phosphate monosodique, de l’hexamétaphosphate de sodium, du tripolyphosphate de sodium, du pyrophosphate tétrasodique et du phyrophosphate acide de sodium, en telle quantité, calculée en phosphate disodique, que le produit fini renferme au plus 0,5 pour cent de phosphate ajouté;
i) dans le cas du tocino, du rocou en telle quantité que le produit fini renferme au plus 0,1 % de rocou;
j) dans le cas de jambons cuits tranchés emballés sous vide : du Carnobacterium maltaromaticum CB1.
- DORS/79-251, art. 6
- DORS/80-13, art. 4
- DORS/82-596, art. 2
- DORS/84-300, art. 45(A)
- DORS/88-336, art. 2 et 3
- DORS/92-725, art. 3
- DORS/97-151, art. 24
- DORS/2010-264, art. 2
- DORS/2011-280, art. 2
- DORS/2016-305, art. 57
- DORS/2017-18, art. 5(F)
- DORS/2018-69, art. 5(F)
B.14.032 [N]. La saucisse, chair à saucisse ou viande à saucisse
a) est faite de viande hachée, fraîche ou conservée;
b) peut être renfermée dans des boyaux ou avoir un enrobage comestible;
c) peut être mouillée de vinaigre, fumée, cuite ou asséchée;
d) peut renfermer
(i) de la graisse animale,
(ii) un agent de remplissage,
(iii) de la tripe de boeuf,
(iv) du foie,
(v) du sang de boeuf ou de porc, frais ou congelé,
(vi) des agents édulcorants,
(vii) du sel et des épices,
(viii) des condiments autres que la tomate,
(ix) un pied-de-cuve produisant de l’acide lactique,
(x) du liant à viande,
(xi) du plasma sanguin de boeuf et de porc,
(xi.1) un agent de conservation de la catégorie II,
(xii) dans le cas de la viande hachée, en conserve : de l’arôme de fumée ou de l’arôme artificiel de fumée,
(xiii) si elle est cuite,
(A) de la glucono-delta-lactone,
(B) des tissus gras de boeuf ou de porc partiellement dégraissés, et
(C) un produit de lait écrémé desséché obtenu du lait écrémé par la réduction de sa teneur en calcium et une augmentation correspondante de sa teneur en sodium, dans une proportion ne dépassant pas trois pour cent du produit fini,
(xiv) dans le cas de la saucisse fraîche, crue : de l’arôme artificiel d’érable, et de la poudre de pomme comme aromatisant,
(xv) dans le cas de la saucisse sèche ou de la chair à saucisse sèche, de la glucono-delta-lactone,
(xvi) dans le cas du longaniza :
(A) du rocou en une quantité telle que le produit fini renferme au plus 0,1 % de rocou,
(B) du rouge allura en une quantité telle que le produit fini renferme au plus 80 parties par million de rouge allura,
(C) du jaune soleil FCF en une quantité telle que le produit fini renferme au plus 20 parties par million de jaune soleil FCF,
(xvii) dans le cas de la saucisse fumée emballée sous vide : du Carnobacterium maltaromaticum CB1,
(xviii) dans le cas de la saucisse avec enrobage comestible, du chlorure de calcium ou du lactate de calcium;
e) doit contenir, dans le cas d’un produit vendu comme saucisse fraîche, au plus 40 pour cent de matières grasses, déterminé selon la méthode officielle FO-33, Détermination de matières grasses dans des produits de viande et des simili-produits de viande, 15 octobre 1981;
f) doit avoir, si elle est cuite, une teneur totale en protéines d’au moins 11 pour cent;
g) doit avoir, dans le cas de la saucisse fraîche crue et de la chair ou viande à saucisse fraîche crue, une teneur totale en protéines d’au moins neuf pour cent.
- DORS/80-13, art. 5
- DORS/82-768, art. 42
- DORS/88-336, art. 3
- DORS/92-725, art. 4
- DORS/97-151, art. 25
- DORS/97-516, art. 3
- DORS/2010-264, art. 3
- DORS/2011-280, art. 3
- DORS/2012-111, art. 1
- DORS/2016-305, art. 58
B.14.032A [N]. (Nom de la viande préparée ou du sous-produit de viande préparée) avec (nom des ingrédients non carnés) doit être de la viande préparée à laquelle sont ajoutés d’autres ingrédients non carnés, notamment
a) des fruits;
b) des légumes;
c) des noix;
d) du fromage ou du fromage fondu;
e) du macaroni;
f) des cornichons; ou
g) des olives.
- DORS/84-300, art. 46
B.14.032AA Lorsque les ingrédients non carnés visés à l’article B.14.032A sont ajoutés à de la viande préparée de façon telle qu’ils ne sont pas présents en morceaux identifiables et en quantité suffisante dans le produit fini, ce dernier doit renfermer les quantités de protéines établies pour (nom de la viande préparée ou du sous-produit de viande préparée) que mentionne l’article B.14.032A.
- DORS/86-875, art. 4
B.14.033 [N]. La viande en pot, le pâté de viande ou la viande à tartiner sont faits de viande fraîche ou conservée, hachée et cuite; ils peuvent renfermer un liant à viande, du sel, des agents édulcorants, des épices ou d’autres condiments, un agent gélatinisant, de l’acétate de sodium et du diacétate de sodium; leur teneur totale en protéines doit être d’au moins 9 pour cent.
- DORS/80-13, art. 6
- DORS/2011-280, art. 4
- DORS/2017-18, art. 19(F)
B.14.034 [N]. Les sous-produits de viande en pot, les sous-produits de viande en pâte et les sous-produits de viande à tartiner doivent
a) consister, au moins en partie, de sous-produits de viande et être conformes à la norme relative à la viande en pot; et
b) dans le cas du pâté de foie ou du saucisson de foie à tartiner, peuvent contenir du germe de blé et de la levure.
- DORS/78-637, art. 4
- DORS/80-13, art. 7
- DORS/86-875, art. 5
B.14.035 [N]. Le pain de viande, la viande en pain, la viande en brique ou en rouleau et la viande à lunch sont faits de viande fraîche ou conservée, hachée, cuite et pressée; ils peuvent renfermer, dans une proportion d’au plus trois pour cent du produit fini, un produit de lait écrémé desséché obtenu du lait écrémé par la réduction de la quantité de calcium à laquelle est substituée une quantité égale de sodium, et contenir un agent de remplissage, un liant à viande, du sel, des agents édulcorants, de la glucono-delta-lactone, des épices ou d’autres condiments, du lait, des œufs, un agent gélatinisant, de l’acétate de sodium et du diacétate de sodium, des tissus gras de bœuf ou de porc partiellement dégraissés; leur teneur totale en protéines doit être d’au moins onze pour cent.
- DORS/80-13, art. 8
- DORS/2011-280, art. 5
- DORS/2017-18, art. 19(F)
B.14.036 [N]. Le pain de sous-produits de viande ou sous-produits de viande en pain, et le pain de viande et de sous-produits de viande ou viande et sous-produits de viande en pain, doivent être l’aliment qui consiste, en tout ou en partie, de sous-produits de viande, et être autrement conformes en tous points à la norme prescrite pour le pain de viande.
B.14.037 (1) [N]. La tête en fromage ou tête fromagée
a) doit être de la viande cuite hachée, ou de la viande conservée cuite et hachée,
b) ne doit pas renfermer
(i) moins de 50 pour cent de viande de tête, ni
(ii) aucune peau autre que celle qui adhère naturellement à la viande de porc employée,
c) peut renfermer la peau de la tête, du groin de porc, de la tripe de boeuf, du sel, des épices, des condiments et un agent gélatinisant ajouté, et
d) peut renfermer
(i) un agent de conservation de la catégorie I,
(ii) un agent de conservation de la catégorie II.
(2) Pour l’application du paragraphe (1), la peau de tête et le groin sont considérés comme de la viande de tête.
- DORS/80-500, art. 5
- DORS/2011-280, art. 6
- DORS/2017-18, art. 19(F)
B.14.038 [N]. Le fromage de porc ou fromage de hure doit être de la tête en fromage, sauf qu’il peut renfermer moins de 50 pour cent de viande de tête.
B.14.039 [Abrogé, DORS/2022-143, art. 26]
B.14.040 Sous réserve de l’article B.14.032 et des articles B.14.033 à B.14.036, est interdite la vente d’un aliment qui consiste en un mélange de viande hachée et d’agent de remplissage, de sous-produit de viande hachée et d’agent de remplissage ou de viande hachée, de sous-produit de viande hachée et d’agent de remplissage, à moins que cet aliment
a) n’ait une teneur totale en protéines d’au moins 13 pour cent;
b) n’ait une teneur en matières grasses d’au plus 40 pour cent, déterminée selon la méthode officielle FO-33, Détermination de matières grasses dans des produits de viande et des simili-produits de viande, 15 octobre 1981, dans le cas d’un mélange contenant de la viande de porc ou de sous-produit de porc, ou les deux; et
c) n’ait une teneur en matières grasses d’au plus 30 pour cent, déterminée selon la méthode officielle FO-33, Détermination de matières grasses dans des produits de viande et des simili-produits de viande, 15 octobre 1981, dans le cas de tout autre mélange de viande.
- DORS/79-251, art. 7(F)
- DORS/82-768, art. 43
B.14.041 Sous réserve de l’article B.14.032 et des articles B.14.033 à B.14.036, est interdite la vente d’un aliment qui consiste en un mélange de viande hachée, d’épices et de condiments, de sous-produit de viande hachée, d’épices et de condiments, de viande hachée, de sous-produit de viande hachée, d’épices et de condiments, ou de viande hachée et de sous-produit de viande hachée, à moins que cet aliment
a) n’ait une teneur totale en protéines d’au moins 16 pour cent;
b) n’ait une teneur en matières grasses d’au plus 40 pour cent, déterminée selon la méthode officielle FO-33, Détermination de matières grasses dans des produits de viande et des simili-produits de viande, 15 octobre 1981, dans le cas d’un mélange contenant de la viande de porc, ou de sous-produit de porc, ou les deux; et
c) n’ait une teneur en matières grasses d’au plus 30 pour cent, déterminée selon la méthode officielle FO-33, Détermination de matières grasses dans des produits de viande et des simili-produits de viande, 15 octobre 1981, dans le cas de tout autre mélange de viande.
- DORS/79-251, art. 7(F)
- DORS/82-768, art. 44
Dérivés de la viande
B.14.061 [N]. La farine d’os comestible doit être le produit alimentaire provenant du broyage d’os secs et dégraissés d’animaux sains au moment de l’abattage, et elle doit
a) renfermer au moins 85 pour cent de cendres, déterminé selon la méthode officielle FO-34, Détermination de cendres dans la farine d’os comestible, 15 octobre 1981.
b) et c) [Abrogés, DORS/97-148, art. 4]
- DORS/82-768, art. 45
- DORS/97-148, art. 4
B.14.062 [N]. (1) La gélatine ou gélatine comestible
a) est un aliment purifié, obtenu par le traitement de la peau, des ligaments ou des os d’animaux;
b) contient au moins 82 pour cent de solides exempts de cendres, déterminé selon la méthode officielle FO-35, Détermination de solides exempts de cendres dans la gélatine, 15 octobre 1981;
c) qui est exempt de goût ou d’odeur désagréable lorsque 2,5 grammes sont dissous dans 100 millilitres d’eau tiède;
d) [Abrogé, DORS/97-148, art. 5]
e) ne contient aucun résidus de peroxyde d’hydrogène lorsqu’utilisé au cours de la fabrication; et
f) peut contenir
(i) au plus 2,6 pour cent de cendres rapportées à la matière desséchée,
(ii) au plus 500 parties par million d’acide sulfureux, y compris ses sels, calculé en anhydride sulfureux, et
(iii) lorsque destinée à la fabrication de guimauves, de l’hexamétaphosphate de sodium ou du lauryl sulfate de sodium.
(2) Il est interdit d’utiliser, au cours de la fabrication de la gélatine ou de la gélatine comestible,
a) des composés acides ou basiques autres que l’acide acétique, l’hydroxyde d’ammonium, l’acide citrique, l’acide fumarique, l’acide chlorhydrique, la chaux, l’hydroxyde de magnésium, l’acide phosphorique, le carbonate de sodium, l’hydroxyde de sodium, le sulfure de sodium, l’acide sulfurique, l’acide sulfureux ou l’acide tartique; ou
b) des agents de filtration et de clarification autre que le charbon activé, l’alumine, le sulfate d’aluminium, le phosphate dicalcique, la cellulose, la terre de diatomées, la perlite, une résine échangeuse de cations de forte acidité sous forme d’ions hydrogènes, ou une résine échangeuse d’anions basiques sous forme d’ions de chlorure ou d’ions basiques libres.
- DORS/78-401, art. 2(A)
- DORS/78-874, art. 1
- DORS/80-501, art. 3
- DORS/82-768, art. 46
- DORS/97-148, art. 5
Ragoûts de viande
B.14.063 Aux fins des articles B.14.064 à B.014.068, on entend par viande pour ragoûts de la viande contenant lorsque crue, au plus
a) 25 pour cent de gras, dans le cas de ragoût de boulettes, et
b) 20 pour cent de gras, dans le cas de tout autre ragoût.
- DORS/78-874, art. 2
B.14.064 [N]. Le ragoût de légumes avec (nom de la viande)
a) doit contenir des légumes et (le nom de la viande) dans les quantités suivantes, calculées et d’après les aliments crus :
(i) au moins 12 pour cent de viande pour ragoût, et
(ii) au moins 38 pour cent de légumes, et
b) peut contenir de la sauce, du sel, des assaisonnements et des épices.
- DORS/78-874, art. 2
B.14.065 [N]. Le ragoût de (nom de la viande)
a) doit contenir des légumes et (le nom de la viande) dans les quantités suivantes, calculées d’après les aliments crus :
(i) au moins 20 pour cent de viande pour ragoût, et
(ii) au moins 30 pour cent de légumes, et
b) peut contenir de la sauce, du sel, des assaisonnements et des épices.
- DORS/78-874, art. 2
B.14.066 [N]. Le ragoût irlandais
a) doit contenir du mouton, de l’agneau ou du boeuf, seul ou en association, et des légumes dans les quantités suivantes, calculées d’après les aliments crus :
(i) au moins 20 pour cent de viande pour ragoût,
(ii) au moins 30 pour cent de légumes, et
b) peut contenir de la sauce, du sel, des assaisonnements et des épices.
- DORS/78-874, art. 2
B.14.067 [N]. Les boulettes de viande avec légumes en sauce
a) doivent contenir des légumes et des boulettes dans les quantités suivantes, calculées d’après les aliments crus :
(i) au moins 22 pour cent de boulettes de viande,
(ii) au moins 30 pour cent de légumes, et
b) peuvent contenir de la sauce, du sel, des assaisonnements et des épices.
- DORS/78-874, art. 2
B.14.068 [N]. Le ragoût spécial de viande
a) doit contenir de la viande et des légumes dans les quantités suivantes, calculés d’après les aliments crus :
(i) au moins 25 pour cent de viande pour ragoût,
(ii) au moins 30 pour cent de légumes, et
b) peut contenir de la sauce, du sel, des assaisonnements et des épices.
- DORS/78-874, art. 2
Spécialités de viande
B.14.070 [N]. Les saucisses fumées (wieners ou saucissons de Francfort) avec haricots ou les saucisses aux fèves doivent être l’aliment préparé avec des haricots secs et des saucisses fumées; elles peuvent renfermer une sauce, des condiments, des épices et un agent édulcorant et doivent renfermer au moins 25 pour cent de saucisses fumées, déterminé selon la méthode officielle FO-36, Détermination de la teneur en saucisses fumées dans des spécialités de viande telles que les saucisses fumées avec haricots, 15 octobre 1981.
- DORS/82-768, art. 47
B.14.071 [N]. Les haricots aux saucisses fumées ou fèves aux saucisses fumées (haricots avec saucisses fumées, ou haricots avec wieners) doivent être l’aliment préparé avec des haricots secs et des saucisses fumées; ils peuvent renfermer une sauce, des condiments, des épices et un agent édulcorant et doivent renfermer au moins 10 pour cent de saucisses fumées, déterminé selon la méthode officielle FO-36, Détermination de la teneur en saucisses fumées dans des spécialités de viande telles que les saucisses fumées avec haricots, 15 octobre 1981.
- DORS/82-768, art. 47
Vente de viandes ou de sous-produits de la viande cuits à la broche, rôtis ou grillés
B.14.072 Est interdite la vente de viande ou de sous-produits de la viande cuits à la broche, rôtis ou grillés et prêts à la consommation à moins que la viande ou le sous-produit de la viande cuits
a) n’aient constamment
(i) indiqué une température de 40 °F (4,4 °C) ou moins, ou de 140 °F (60 °C) ou plus, ou
(ii) été conservés à une température ambiante de 40 °F (4,4 °C) ou moins, ou de 140 °F (60 °C) ou plus; et
b) ne portent, sur l’espace principal de l’étiquette, mention qu’ils doivent être conservés à une température de 40 °F (4,4 °C) ou moins, ou de 140 °F (60 °C) ou plus.
- DORS/78-403, art. 4(F)
- DORS/88-336, art. 3
Allongeur de produits de viande
B.14.073 Est interdite la vente d’un allongeur de produits de viande pour usage dans un aliment qui consiste en un mélange décrit aux articles B.14.074, B.14.075, B.14.076, B.14.077 ou B.14.078, à moins que cet allongeur
a) n’ait, à l’état réhydraté,
(i) une teneur totale en protéines d’au moins 16 pour cent, et
(ii) une cote protéique d’au moins 40, déterminée selon la méthode officielle FO-1, Détermination de cote protéique, 15 octobre 1981;
b) par dérogation aux articles D.01.009 et D.02.009, ne contienne toutes les vitamines et tous les minéraux nutritifs énumérés au tableau du présent Titre, à la colonne I, en quantité au moins égale à celle indiquée audit tableau, à la colonne II, au regard de chacune de ces vitamines et de chacun de ces minéraux nutritifs; et que,
c) lorsque des acides aminés essentiels isolés ont été ajoutés, il ne contienne ces acides en quantités non supérieures aux quantités qui améliorent la qualité nutritive de la protéine.
- DORS/82-768, art. 48
Produits de viande avec allongeur
B.14.074 Sous réserve des articles B.14.075 à B.14.079, est interdite la vente d’un aliment qui consiste en un mélange de produit de viande et d’allongeur de produits de viande, à moins que cet aliment
a) n’ait une teneur totale en protéines d’au moins 16 pour cent;
b) n’ait une teneur en matières grasses d’au plus 25 pour cent, déterminée selon la méthode officielle FO-33, Détermination de matières grasses dans des produits de viande et des simili-produits de viande, 15 octobre 1981; et que,
c) en ce qui a trait à l’allongeur de produits de viande, il ne satisfasse aux exigences des alinéas B.14.073a) à c).
- DORS/82-768, art. 49
B.14.075 Est interdite la vente d’un aliment qui consiste en un mélange de produit de viande et d’allongeur de produits de viande et qui rappelle la saucisse fraîche, à moins que cet aliment
a) n’ait une teneur totale en protéines d’au moins neuf pour cent;
b) n’ait une teneur en matières grasses d’au plus 40 pour cent, déterminée selon la méthode officielle FO-33, Détermination de matières grasses dans des produits de viande et des simili-produits de viande, 15 octobre 1981; et que,
c) en ce qui a trait à l’allongeur de produit de viande, il ne satisfasse aux exigences des alinéas B.14.073a) à c).
- DORS/82-768, art. 50
- DORS/84-300, art. 47(F)
B.14.076 Est interdite la vente d’un aliment qui consiste en un mélange de produit de viande et d’allongeur de produits de viande et qui rappelle la saucisse cuite, le pain de viande, le pain de sous-produit de viande, la viande en brique ou en rouleau ou la viande à lunch, à moins que cet aliment
a) n’ait une teneur totale en protéines d’au moins 11 pour cent;
b) n’ait une teneur en matières grasses d’au plus 25 pour cent, déterminée selon la méthode officielle FO-33, Détermination de matières grasses dans des produits de viande et des simili-produits de viande, 15 octobre 1981; et que,
c) en ce qui a trait à l’allongeur de produits de viande, il ne satisfasse aux exigences des alinéas B.14.073a) à c).
- DORS/82-768, art. 51
B.14.077 Est interdite la vente d’un aliment qui consiste en un mélange de produit de viande et d’allongeur de produits de viande et qui rappelle la viande en pot, un sous-produit de viande en pot, le pâté de viande, le pâté de sous-produit de viande, la viande à tartiner ou un sous-produit de viande à tartiner, à moins que cet aliment
a) n’ait une teneur totale en protéines d’au moins neuf pour cent;
b) n’ait une teneur en matières grasses d’au plus 30 pour cent, déterminée selon la méthode officielle FO-33, Détermination de matières grasses dans des produits de viande et des simili-produits de viande, 15 octobre 1981; et que,
c) en ce qui a trait à l’allongeur de produits de viande, il ne satisfasse aux exigences des alinéas B.14.073a) à c).
- DORS/82-768, art. 52
- DORS/84-300, art. 48(A)
B.14.078 Est interdite la vente d’un aliment qui consiste en un mélange de produit de viande et d’allongeur de produits de viande et qui rappelle le boeuf haché ordinaire, le boeuf haché mi-maigre ou le boeuf haché maigre, à moins que cet aliment
a) n’ait une teneur totale en protéines d’au moins 16 pour cent;
b) n’ait une teneur en matières grasses
(i) d’au plus 30 pour cent, déterminée selon la méthode officielle FO-33, Détermination de matières grasses dans des produits de viande et des simili-produits de viande, 15 octobre 1981, lorsque le produit est présenté comme étant ordinaire,
(ii) d’au plus 23 pour cent, déterminée selon la méthode officielle FO-33, Détermination de matières grasses dans des produits de viande et des simili-produits de viande, 15 octobre 1981, lorsque le produit est présenté comme étant mi-maigre, ou
(iii) d’au plus 17 pour cent, déterminée selon la méthode officielle FO-33, Détermination de matières grasses dans des produits de viande et des simili-produits de viande, 15 octobre 1981, lorsque le produit est présenté comme étant maigre; et que,
c) en ce qui a trait à l’allongeur de produit de viande, il ne rencontre les exigences des alinéas B.14.073a) à c).
- DORS/82-768, art. 53
B.14.079 Est interdite la vente d’un aliment qui consiste en un mélange de produit de viande, d’un agent de remplissage, et d’un allongeur de produit de viande, à moins que cet aliment
a) n’ait une teneur totale en protéines d’au moins 13 pour cent;
b) n’ait une teneur en matières grasses d’au plus 25 pour cent, déterminée selon la méthode officielle FO-33, Détermination de matières grasses dans des produits de viande et des simili-produits de viande, 15 octobre 1981; et que,
c) en ce qui a trait à l’allongeur de produit de viande, il ne rencontre les exigences des alinéas B.14.073a) à c).
- DORS/82-768, art. 54
Simili-produits de viande
B.14.085 Sous réserve des articles B.14.086 à B.14.090, est interdite la vente d’un simili-produit de viande, à moins que ce produit
a) n’ait, à l’état réhydraté,
(i) une teneur totale en protéines d’au moins 16 pour cent,
(ii) une cote protéique d’au moins 40, déterminée selon la méthode officielle FO-1, Détermination de cote protéique, 15 octobre 1981, et
(iii) une teneur en matières grasses d’au plus 25 pour cent, déterminée selon la méthode officielle FO-33, Détermination de matières grasses dans des produits de viande et des simili-produits de viande, 15 octobre 1981;
b) par dérogation aux articles D.01.009 et D.02.009, ne contienne toutes les vitamines et minéraux nutritifs énumérés au tableau du présent titre, à la colonne I, en quantité au moins égale à celle indiquée audit tableau, à la colonne II, au regard de chacune de ces vitamines et de chacun de ces minéraux nutritifs; et que
c) lorsque des acides aminés essentiels isolés ont été ajoutés, il ne contienne ces acides en quantités non supérieures aux quantités qui améliorent la qualité nutritive de la protéine.
- DORS/82-768, art. 55
B.14.086 Est interdite la vente d’un simili-produit de viande qui rappelle la saucisse fraîche à moins que ce produit
a) n’ait une teneur totale en protéines d’au moins neuf pour cent;
b) n’ait une cote protéique d’au moins 23, déterminée selon la méthode officielle FO-1, Détermination de cote protéique, 15 octobre 1981;
c) n’ait une teneur en matières grasses d’au plus 40 pour cent, déterminée selon la méthode officielle FO-33, Détermination de matières grasses dans des produits de viande et des simili-produits de viande, 15 octobre 1981;
d) par dérogation aux articles D.01.009 et D.02.009, ne contienne toutes les vitamines et tous les minéraux nutritifs énumérés au tableau du présent titre, à la colonne I, en quantité au moins égale à celle indiquée audit tableau, à la colonne II, au regard de chacune de ces vitamines et de chacun de ces minéraux nutritifs; et que
e) lorsque des acides aminés essentiels isolés ont été ajoutés, ne contienne ces acides en quantités non supérieures aux quantités qui améliorent la qualité nutritive de la protéine.
- DORS/82-768, art. 56
B.14.087 Est interdite la vente d’un simili-produit de viande qui rappelle la saucisse cuite, le pain de viande, le pain de sous-produit de viande, la viande en brique ou en rouleau ou la viande à lunch, à moins que ce produit
a) n’ait une teneur totale en protéines d’au moins 11 pour cent;
b) n’ait une cote protéique d’au moins 28, déterminée selon la méthode officielle FO-1, Détermination de cote protéique, 15 octobre 1981;
c) n’ait une teneur en matières grasses d’au plus 25 pour cent, déterminée selon la méthode officielle FO-33, Détermination de matières grasses dans des produits de viande et des simili-produits de viande, 15 octobre 1981;
d) par dérogation aux articles D.01.009 et D.02.009, ne contienne toutes les vitamines et tous les minéraux nutritifs énumérés au tableau du présent titre, à la colonne I, en quantité au moins égale à celle indiquée audit tableau, à la colonne II, au regard de chacune de ces vitamines et de chacun de ces minéraux nutritifs; et que
e) lorsque des acides aminés essentiels isolés ont été ajoutés, il ne contienne ces acides en quantités supérieures aux quantités qui améliorent la qualité nutritive de la protéine.
- DORS/82-768, art. 57
B.14.088 Est interdite la vente d’un simili-produit de viande qui rappelle la viande en pot, un sous-produit de viande en pot, le pâté de viande, le pâté de sous-produit de viande, la viande à tartiner ou un sous-produit de viande à tartiner, à moins que ce produit
a) n’ait une teneur totale en protéines d’au moins neuf pour cent;
b) n’ait une cote protéique d’au moins 23, déterminée selon la méthode officielle FO-1, Détermination de cote protéique, 15 octobre 1981;
c) n’ait une teneur en matières grasses d’au plus 30 pour cent, déterminée selon la méthode officielle FO-33, Détermination de matières grasses dans des produits de viande et des simili-produits de viande, 15 octobre 1981;
d) par dérogation aux articles D.01.009 et D.02.009, ne contienne toutes les vitamines et tous les minéraux nutritifs énumérés au tableau du présent titre, à la colonne I, en quantité au moins égale à celle indiquée audit tableau, à la colonne II, au regard de chacune de ces vitamines et de chacun de ces minéraux nutritifs; et que
e) lorsque des acides aminés essentiels isolés ont été ajoutés, il ne contienne ces acides en quantités supérieures aux quantités qui améliorent la qualité nutritive de la protéine.
- DORS/82-768, art. 58
B.14.089 Est interdite la vente d’un simili-produit de viande qui rappelle le boeuf haché ordinaire, le boeuf haché mi-maigre ou le boeuf haché maigre, à moins que ce produit
a) n’ait une teneur totale en protéines d’au moins 16 pour cent;
b) n’ait une cote protéique d’au moins 40, déterminée selon la méthode officielle FO-1, Détermination de cote protéique, 15 octobre 1981;
c) n’ait une teneur en matières grasses
(i) d’au plus 30 pour cent, déterminée selon la méthode officielle FO-33, Détermination de matières grasses dans des produits de viande et des simili-produits de viande, 15 octobre 1981, lorsque le produit est présenté comme étant ordinaire,
(ii) d’au plus 23 pour cent, déterminée selon la méthode officielle FO-33, Détermination de matières grasses dans des produits de viande et des simili-produits de viande, 15 octobre 1981, lorsque le produit est présenté comme étant mi-maigre, ou
(iii) d’au plus 17 pour cent, déterminée selon la méthode officielle FO-33, Détermination de matières grasses dans des produits de viande et des simili-produits de viande, 15 octobre 1981, lorsque le produit est présenté comme étant maigre;
d) par dérogation aux articles D.01.009 et D.02.009, ne contienne toutes les vitamines et tous les minéraux nutritifs énumérés à la colonne I du tableau du présent titre, en quantité au moins égale à celle indiquée à la colonne II de ce tableau, pour chacune de ces vitamines et chacun de ces minéraux nutritifs; et que
e) lorsque des acides aminés essentiels isolés ont été ajoutés, il ne contienne ces acides aminés en quantité non supérieure à celle qui améliore la qualité nutritive de la protéine.
- DORS/82-768, art. 59
B.14.090 Est interdite la vente d’un simili-produit de viande qui rappelle le bacon de flanc, à moins que ce produit
a) n’ait une teneur totale en protéines d’au moins 25 pour cent;
b) n’ait une cote protéique d’au moins 20, déterminée selon la méthode officielle FO-1, Détermination de cote protéique, 15 octobre 1981;
c) par dérogation aux articles D.01.009 et D.02.009, ne contienne toutes les vitamines et tous les minéraux nutritifs énumérés au tableau du présent titre, à la colonne I, en quantité au moins égale à celle indiquée audit tableau, à la colonne II, au regard de chacune de ces vitamines et de chacun de ces minéraux nutritifs; et que
d) lorsque des acides aminés essentiels isolés ont été ajoutés, il ne contienne ces acides en quantités supérieures aux quantités qui améliorent la qualité nutritive de la protéine.
- DORS/82-768, art. 60
TABLEAU
| Article | Colonne I | Colonne II |
|---|---|---|
| Vitamines ou minéraux nutritifs | Quantité par gramme de protéines | |
C.1  | Cuivre  | 4,4 microgrammes |
F.1  | Acide folique  | 0,45 microgramme |
I.1  | Fer  | 0,25 milligramme |
M.1  | Magnésium  | 1,1 milligramme |
N.1  | Niacine  | 0,34 milligramme |
P.1  | Acide pantothénique  | 0,04 milligramme |
P.2  | Potassium  | 20 milligrammes |
P.3  | Pyridoxine  | 0,02 milligramme |
R.1  | Riboflavine  | 0,01 milligramme |
T.1  | Thiamine  | 0,02 milligramme |
V.1  | Vitamine B12 | 0,08 microgramme |
Z.1  | Zinc  | 0,20 milligramme |
- DORS/98-458, art. 7(F)
TITRE 15Falsification des produits alimentaires
B.15.001 (1) Un aliment visé à la colonne 2 de la partie 1 de la Liste de contaminants et d’autres substances adultérantes dans les aliments est falsifié si est présente dans l’aliment ou sur sa surface une substance dont le nom ou la catégorie figure à la colonne 1.
(2) Un aliment visé à la colonne 2 de la partie 2 de la Liste de contaminants et d’autres substances adultérantes dans les aliments est falsifié si est présente dans l’aliment ou sur sa surface une substance dont le nom ou la catégorie figure à la colonne 1 en une quantité dépassant la limite maximale prévue à la colonne 3.
(3) Un aliment visé à la colonne 2 de la partie 2 de la Liste de contaminants et d’autres substances adultérantes dans les aliments est soustrait à l’application de l’alinéa 4(1)a) de la Loi, en ce qui concerne une substance dont le nom ou la catégorie figure à la colonne 1, si la substance est présente dans l’aliment ou sur sa surface en une quantité ne dépassant pas la limite maximale prévue à la colonne 3.
(4) Les paragraphes (1) à (3) ne s’appliquent pas à une substance présente dans l’aliment ou sur sa surface, à titre, selon le cas :
a) d’additif alimentaire;
a.1) d’ingrédient supplémentaire;
b) de produit antiparasitaire au sens du paragraphe 2(1) de la Loi sur les produits antiparasitaires, ou d’un de ses composants ou dérivés;
c) d’une drogue pour usage vétérinaire ou d’un de ses métabolites.
- DORS/78-404, art. 1
- DORS/79-249, art. 1
- DORS/2016-74, art. 7
- DORS/2022-169, art. 19
B.15.002 (1) Sous réserve du paragraphe (2), un aliment est falsifié dans l’un ou l’autre des cas suivants :
a) des produits antiparasitaires au sens du paragraphe 2(1) de la Loi sur les produits antiparasitaires ou leurs composants ou dérivés, pour lesquels aucune limite maximale de résidus n’a été fixée en vertu des articles 9 ou 10 de cette loi pour l’aliment, sont présents — seuls ou en combinaison — dans l’aliment ou sur sa surface en une quantité supérieure à 0,1 partie par million;
b) des produits chimiques agricoles ou des composants ou dérivés de ceux-ci, autres que les produits antiparasitaires au sens du paragraphe 2(1) de la Loi sur les produits antiparasitaires ou leurs composants ou dérivés, sont présents — seuls ou en combinaison — dans l’aliment ou sur sa surface en une quantité supérieure à 0,1 partie par million.
(2) L’aliment est exempté de l’application de l’alinéa 4(1)d) de la Loi si les produits chimiques agricoles ci-après ou leurs composants ou dérivés — seuls ou en combinaison — sont les seuls produits chimiques agricoles ou composants ou dérivés de ces produits présents dans l’aliment ou sur sa surface :
a) un produit fertilisant;
b) un adjuvant ou un véhicule de produit chimique agricole;
c) un sel de bromure inorganique;
d) du dioxyde de silicium;
e) du soufre;
f) des spores viables de Bacillus thuringiensis Berliner ou
g) du kaolin.
(3) Le paragraphe (2) ne s’applique pas à l’aliment si est présent dans celui-ci, ou sur sa surface, tout produit chimique agricole visé à ce paragraphe, ou un de ses composants ou dérivés, qui est un produit antiparasitaire au sens du paragraphe 2(1) de la Loi sur les produits antiparasitaires ou un de ses composants ou dérivés pour lequel une limite maximale de résidus a été fixée en vertu des articles 9 ou 10 de cette loi pour l’aliment.
(4) [Abrogé, DORS/2008-181, art. 3]
- DORS/78-404, art. 1
- DORS/79-249, art. 1
- DORS/81-83, art. 2
- DORS/97-313, art. 2
- DORS/98-98, art. 1
- DORS/2005-67, art. 1
- DORS/2008-181, art. 3
- DORS/2008-182, art. 2
B.15.003 [Abrogé, DORS/2016-74, art. 8]
TITRE 16Additifs alimentaires
B.16.001 En ce qui concerne toute substance ou tout mélange de substances à utiliser comme additif alimentaire, l’indication, soit de la quantité de chacun des additifs présents, soit du mode d’emploi donnant comme résultat un aliment qui ne contient pas ces additifs dans une proportion supérieure aux limites de tolérance prescrites par le présent règlement, doit être groupée avec la liste d’ingrédients.
B.16.002 Toute demande tendant à ajouter un additif alimentaire, ou à modifier de quelque façon les tableaux qui suivent l’article B.16.100 doit être accompagnée d’une présentation au ministre, dans une forme, d’une teneur et d’une manière que le ministre jugera satisfaisantes, et doit comprendre
a) une description de l’additif alimentaire, y compris son nom chimique et le nom sous lequel on se propose de le vendre, la méthode de fabrication qui s’y applique, ses propriétés physiques et chimiques, sa composition, et ses caractères distinctifs, ou, lorsque ces renseignements ne sont pas disponibles, une explication détaillée;
b) la déclaration de la quantité d’additif alimentaire que l’on projette d’utiliser, les fins proposées pour son emploi, ainsi que le détail du mode d’emploi, des recommandations et conseils quant à son usage;
c) lorsque de l’avis du ministre cela sera nécessaire, une méthode d’analyse acceptable qui convienne aux fins de contrôle et de réglementation, et qui permette de déterminer la quantité d’additif alimentaire et de toute autre substance résultant de son emploi, dans le produit alimentaire fini;
d) les données établissant que l’additif alimentaire aura l’effet physique, ou tout autre effet technique, qui est prévu;
e) les rapports détaillés de toutes les épreuves effectuées pour établir l’innocuité de l’additif alimentaire, dans les conditions recommandées pour son usage;
f) les données indiquant les quantités de résidus qui peuvent rester dans ou sur le produit alimentaire fini, lorsque l’additif est utilisé conformément aux bonnes pratiques industrielles;
g) une limite de tolérance proposée, pour les résidus de l’additif alimentaire dans ou sur le produit alimentaire fini;
h) des échantillons des étiquettes proposées pour l’additif alimentaire; et
i) un échantillon de l’additif alimentaire dans la forme définitive prévue pour son usage, un échantillon de l’ingrédient actif et, sur demande, un échantillon de l’aliment qui renferme ledit additif alimentaire.
- DORS/2018-69, art. 27
B.16.003 Dans un délai d’au plus 90 jours après avoir reçu une présentation en vertu de l’article B.16.002, le ministre doit faire savoir à la personne qui a soumis la présentation s’il a ou non l’intention de recommander au gouverneur en conseil que ledit additif soit ajouté à la liste, ainsi que le détail de cette inscription à la liste.
B.16.004 [Abrogé, DORS/97-148, art. 6]
B.16.006 L’alinéa B.01.042c) et l’alinéa B.01.043a), ne s’appliquent pas aux épices, aux condiments, aux préparations aromatisantes, aux huiles essentielles, aux matières extractives naturelles, ni aux oléorésines.
B.16.007 Il est interdit de vendre un aliment qui contient un additif alimentaire autre que l’un de ceux visés aux articles B.01.042, B.01.043 et B.25.062.
- DORS/87-640, art. 5
B.16.008 [Abrogé, DORS/88-418, art. 5]
B.16.100 Est interdite la vente de toute substance comme additif alimentaire, à moins que ledit additif ne soit nommé à l’un ou plusieurs des tableaux ci-après :
TABLEAU I
Additifs alimentaires autorisés comme agents anti-agglomérants
| Article | Colonne I | Colonne II | Colonne III |
|---|---|---|---|
| Additifs | Permis dans ou sur | Limites de tolérance | |
| C.1 | Silicate double d’aluminium et de calcium | (1) Sel | (1) 1,0 % sauf pour le sel à fins 2,0 %, conformément aux exigences de l’alinéa B.17.001(1)a). |
| (2) Sel d’ail, sel d’oignon | (2) 2,0 % conformément aux exigences des alinéas B.07.020b) et B.07.02b) respectivement. | ||
| (3) Mélanges secs non normalisés | (3) Bonnes pratiques industrielles | ||
| C.2 | Phosphate tricalcique | (1) Sel | (1) 1,0 %, sauf pour le sel à grains fins, 2,0 %, conformément aux exigences de l’alinéa B.17.001(1)a). |
| (2) Sel d’ail, sel d’oignon | (2) 2,0 % conformément aux exigences des alinéas B.07.020b) et B.07.027b) respectivement. | ||
| (3) Mélanges de salaison à sec | (3) Bonnes pratiques industrielles | ||
| (4) Mélanges secs non normalisés | (4) Bonnes pratiques industrielles | ||
| (5) Rocou soluble dans l’huile | (5) Bonnes pratiques industrielles | ||
| (6) Sucre à glacer | (6) Si on l’emploie seul ou avec du silicate de calcium, du carbonate de magnésium, du silicate de magnésium, du stéarate de magnésium, du dioxyde de silicium ou du silicate double d’aluminium et de sodium, le total ne doit pas dépasser 1,5 % | ||
| C.3 | Silicate de calcium | (1) Sel | (1) 1,0 %, pour le sel à grains fins, 2,0 %, conformément aux exigences de l’alinéa B.17.001(1)a). |
| (2) Sel d’ail, sel d’oignon | (2) 2,0 % conformément aux exigences des alinéas B.07.020b) et B.07.027b) respectivement. | ||
| (3) Poudre à pâte | (3) 5,0 % | ||
| (4) Mélange de salaison à sec | (4) Bonnes pratiques industrielles | ||
| (5) Mélanges secs non normalisés | (5) Bonnes pratiques industrielles | ||
| (6) Sucre à glacer | (6) Si on l’emploie seul ou avec du phosphate tricalcique, du carbonate de magnésium, du silicate de magnésium, du stéarate de magnésium, du dioxyde de silicium ou du silicate double d’aluminium et de sodium, le total ne doit pas dépasser 1,5 % | ||
| (7) Liant à viande ou liant à (désignation du produit de viande) | (7) 1,0 % | ||
| (8) Fromage râpé fin ou en filaments (indication de la variété); fromage cheddar râpé fin ou en filaments; préparations de fromage râpé fin ou en filaments non normalisées | (8) Si on l’emploie seul ou avec la cellulose microcrystalline ou la cellulose, la quantité totale n’excédant pas 2,0 % | ||
| (9) Mélange de poudre de jaunes d’oeufs; mélange de poudre d’oeufs entiers; poudre de blanc d’oeuf (poudre d’albumen); poudre de jaune d’oeuf; poudre d’oeuf entier | (9) 2,0 % | ||
| C.4 | Stéarate de calcium | (1) Sel | (1) 1,0 %, sauf pour le sel à grains fins 2,0 %, conformément aux exigences de l’alinéa B.17.001(1)a). |
| (2) Sel d’ail, sel d’oignon | (2) 2,0 % conformément aux exigences des alinéas B.07.020b) et B.07.027b) respectivement. | ||
| (3) Mélanges secs non normalisés | (3) Bonnes pratiques industrielles | ||
| C.5 | Cellulose | Fromage râpé fin ou en filaments (indication de la variété); fromage cheddar râpé fin ou en filaments; préparations de fromage râpé fin ou en filaments non normalisées | Si on l’emploie seul ou avec le silicate de calcium ou la cellulose microcristalline, la quantité totale n’excédant pas 2,0 % |
| M.1 | Carbonate de magnésium | (1) Sel (sauf si employé dans les préparations de viande et de sous-produits de viande du Titre 14) | (1) 1,0 % pour le sel à grains fins 2,0 %, conformément aux exigences de l’alinéa B.17.001(1)a). |
| (2) Sel d’ail, sel d’oignon (sauf si employé dans les préparations de viande et de sous-produits de viande du Titre 14) | (2) 2,0 % conformément aux exigences des alinéas B.07.020b) et B.07.027b) respectivement. | ||
| (3) Mélanges secs non normalisés (sauf lorsqu’il est utilisé dans les préparations de viande et de sous-produits de la viande du Titre 14) | (3) Bonnes pratiques industrielles | ||
| (4) Sucre à glacer | (4) Si on l’emploie seul ou avec du phosphate tricalcique, du silicate de calcium, du silicate de magnésium, du stéarate de magnésium, du dioxyde de silicium ou du silicate double d’aluminium et de sodium, le total ne doit pas dépasser 1,5 % | ||
| M.2 | Oxyde de magnésium | Mélanges secs non normalisés (sauf lorsqu’il est utilisé dans les préparations de viande et de sous-produits de la viande du Titre 14) | Bonnes pratiques industrielles |
| M.3 | Silicate de magnésium | (1) Sel | (1) 1,0 %, sauf pour le sel à grains fins 2,0 %, conformément aux exigences de l’alinéa B.17.001(1)a). |
| (2) Sel d’ail et d’oignon | (2) 2,0 % conformément aux exigences des alinéas B.07.020b) et B.07.027b) respectivement. | ||
| (3) Mélanges secs non normalisés | (3) Bonnes pratiques industrielles | ||
| (4) Sucre à glacer | (4) Si on l’emploie seul ou avec du phosphate tricalcique, du silicate de calcium, du carbonate de magnésium, du stéarate de magnésium, du dioxyde de silicium ou du silicate double d’aluminium et de sodium, le total ne doit pas dépasser 1,5 % | ||
| M.4 | Stéarate de magnésium | (1) Sel | (1) 1,0 %, sauf pour le sel à grains fins 2,0 %, conformément aux exigences de l’alinéa B.17.001(1)a). |
| (2) Sel d’ail, sel d’oignon | (2) 2,0 % conformément aux exigences des alinéas B.07.020b) et B.07.027b) respectivement. | ||
| (3) Mélanges secs non normalisés | (3) Bonnes pratiques industrielles | ||
| (4) Sucre à glacer | (4) Si on l’emploie seul ou avec du phosphate tricalcique, du silicate de calcium, du carbonate de magnésium, du silicate de magnésium, du dioxyde de silicium ou du silicate double d’aluminium et de sodium, le total ne doit pas dépasser 1,5 % | ||
| M.5 | Cellulose microcristalline | Fromage râpé fin ou en filaments (indication de la variété); fromage cheddar râpé fin ou en filaments; préparations de fromage râpé fin ou en filaments non normalisées | Si on l’emploie seul ou avec le silicate de calcium ou la cellulose, la quantité totale n’excédant pas 2,0 % |
| P.1 | Propylèneglycol | Sel | 0,035 % |
| S.1 | Bioxyde de silicium | (1) Sel d’ail; sel d’oignon | (1) 1,0 % conformément aux exigences des alinéas B.07.020b) et B.07.027b) respectivement. |
| (2) Sel de céleri; poivre de céleri | (2) 0,5 %. | ||
| (3) Mélanges secs non normalisés | (3) Bonnes pratiques industrielles. | ||
| (4) Sucre à glacer | (4) Si on l’emploie seul ou avec du phosphate tricalcique, du silicate de calcium, du carbonate de magnésium, du silicate de magnésium, du stéarate de magnésium ou du silicate double d’aluminium et de sodium, le total ne doit pas dépasser 1,5 %. | ||
| (5) Aliments vendus sous forme de comprimés | (5) Bonnes pratiques industrielles. | ||
| (6) Poivre de cayenne; chili; assaisonnement au chili; paprika; poivre rouge | (6) 2,0 %. | ||
| (7) Sel | (7) 1,0 % (sauf pour le sel à grains fins : 2,0 %) conformément aux exigences de l’alinéa B.17.001(1)a) | ||
| S.2 | Silicate double d’aluminium et de sodium | (1) Sel | (1) 1,0 %, sauf pour le sel à grains fins 2,0 %, conformément aux exigences de l’alinéa B.17.001(1)a). |
| (2) Sucre à glacer | (2) Si on l’emploie seul ou avec du phosphate tricalcique, du silicate de calcium, du carbonate de magnésium, du silicate de magnésium, du stéarate de magnésium ou du dioxyde de silicium, le total ne doit pas dépasser 1,5 %. | ||
| (3) Mélange de poudre de jaunes d’oeufs; mélange de poudre d’oeufs entiers; poudre de blanc d’oeuf (poudre d’albumen); poudre de jaune d’oeuf; poudre d’oeuf entier | (3) 2,0 % | ||
| (4) Sel d’ail, sel d’oignon | (4) 2,0 %, conformément aux exigences des alinéas B.07.020b) et B.07.027b) respectivement. | ||
| (5) Mélanges secs non normalisés | (5) Bonnes pratiques industrielles. | ||
| S.3 | Decahydrate ferrocyanure de sodium | Sel | 13 p.p.m. calculé en ferrocyanure de sodium anhydre |
- DORS/79-662, art. 3 à 13
- DORS/82-913, art. 4
- DORS/83-410, art. 2
- DORS/84-17, art. 5
- DORS/84-801, art. 2
- DORS/86-1125, art. 1
- DORS/88-534, art. 4
- DORS/91-88, art. 3 et 4
- DORS/93-477, art. 3 à 5
- DORS/94-689, art. 2(F)
- DORS/97-191, art. 3
- DORS/2010-94, art. 8(A)
- DORS/2010-143, art. 11 et 12
TABLEAU II
Additifs alimentaires autorisés comme agents de blanchiment, de maturation, ou pour conditionner les pâtes
| Article | Colonne I | Colonne II | Colonne III |
|---|---|---|---|
| Additifs | Permis dans ou sur | Limites de tolérance | |
| A.1 | Peroxyde d’acétone | (1) Farine; farine de blé entier; pain | (1) Bonnes pratiques industrielles |
| (2) Produits de boulangerie non normalisés | (2) Bonnes pratiques industrielles | ||
| A.1A | [Abrogé, DORS/79-660, art. 3] | ||
| A.2 | Persulfate d’ammonium | (1) Farine; farine de blé entier | (1) 250 p.p.m. |
| (2) Pain | (2) 100 p.p.m. de farine | ||
| (3) Produits de boulangerie non normalisés | (3) Bonnes pratiques industrielles | ||
| A.2A | Acide ascorbique | (1) Farine; farine de blé entier; pain | (1) 200 p.p.m. de farine |
| (2) Produits de boulangerie non normalisés | (2) 200 p.p.m. de farine | ||
| A.3 | [Abrogé, DORS/79-660, art. 4] | ||
| A.3A | [Abrogé, DORS/79-660, art. 4] | ||
| A.4 | Azodicarbonamide | Farine; farine de blé entier; pain | 45 p.p.m. de farine |
| B.1 | Peroxyde de benzoyle | Farine; farine de blé entier | 150 p.p.m. |
| C.1 | Iodate de calcium | (1) Pain | (1) 45 p.p.m. de farine |
| (2) Produits de boulangerie non normalisés | (2) 45 p.p.m. de farine | ||
| C.2 | Peroxyde de calcium | (1) Pain | (1) 100 p.p.m. de farine |
| (2) Produits de boulangerie non normalisés | (2) Bonnes pratiques industrielles | ||
| C.3 | Stéaroyl-2-lactylate de calcium | (1) Pain | (1) 3 750 p.p.m. de farine |
| (2) Produits de boulangerie non normalisés | (2) 3 750 p.p.m. de farine | ||
| (3) Mélanges à gâteaux | (3) 0,5 % du poids sec du mélange | ||
| C.4 | Chlore | Farine; farine de blé entier | Bonnes pratiques industrielles |
| C.5 | Bioxyde de chlore | Farine; farine de blé entier | Bonnes pratiques industrielles |
| C.6 | Chlorhydrate de L-cystéine | (1) Farine; farine de blé entier; pain | (1) 90 p.p.m. |
| (2) Produits de boulangerie non normalisés | (2) Bonnes pratiques industrielles | ||
| P.1 | [Abrogé, DORS/94-227, art. 4] | ||
| P.2 | Iodate de potassium | (1) Pain | (1) 45 p.p.m. de farine |
| (2) Produits de boulangerie non normalisés | (2) 45 p.p.m. de farine | ||
| P.3 | Persulfate de potassium | (1) Pain | (1) 100 p.p.m. de farine |
| (2) Produits de boulangerie non normalisés | (2) Bonnes pratiques industrielles | ||
| S.1 | Stéaroyl-2-lactylate de sodium | (1) Pain | (1) 3 750 p.p.m. de farine |
| (2) Produits de boulangerie non normalisés | (2) 3 750 p.p.m. de farine | ||
| (3) Crêpes et mélanges à crêpes | (3) 0,3 % du poids des ingrédients secs | ||
| (4) Gaufres et mélanges à gaufres | (4) 0,3 % du poids des ingrédients secs | ||
| (5) Mélanges à gâteaux | (5) 0,5 % du poids sec du mélange | ||
| S.2 | Stéaryl-fumarate de sodium | (1) Pain | (1) 5 000 p.p.m. de farine |
| (2) Produits de boulangerie non normalisés | (2) 5 000 p.p.m. de farine | ||
| S.3 | Sulfite de sodium | Pâte à biscuit | 500 p.p.m., calculé en bioxyde de soufre |
- DORS/79-660, art. 3 et 4
- DORS/87-640, art. 6
- DORS/92-591, art. 2
- DORS/94-227, art. 4
- DORS/94-689, art. 2(F)
- DORS/2005-98, art. 3
- DORS/2005-98, art. 8(F)
- DORS/2010-41, art. 9(A)
TABLEAU III
Additifs alimentaires autorisés comme colorants pour aliments
| Article | Colonne I | Colonne II | Colonne III |
|---|---|---|---|
| Additifs | Permis dans ou sur | Limites de tolérance | |
| 1 |
| (1) Achards (relish); beurre; catsup de tomates; confiture de (nom du fruit) avec pectine; confiture de pommes (ou de rhubarbe) et de (nom du fruit); cornichons; gelée de (nom du fruit) avec pectine; jus de (nom du fruit) concentré sauf le jus d’orange concentré congelé; lait écrémé (indication de l’arôme); lait écrémé (indication de l’arôme) additionné de solides du lait; lait (indication de l’arôme); lait partiellement écrémé (indication de l’arôme); lait partiellement écrémé (indication de l’arôme) additionné de solides du lait; liqueur; marmelade d’ananas avec pectine; marmelade de figues avec pectine; mélange pour crème glacée; mélange pour lait glacé; œufs de poisson (caviar); pain; pâte de homard; poisson fumé; produits de poisson ou de chair de poisson emballés, marinés ou conditionnés à froid par une autre méthode (Titre 21); sorbet laitier; sucre à glacer | (1) Bonnes pratiques industrielles |
| (2) Jaune d’oeuf congelé; jaune d’oeuf liquide; oeuf entier congelé; oeuf entier liquide; poudre de jaune d’oeuf; poudre d’oeuf entier | (2) Bonnes pratiques industrielles selon les alinéas B.22.034b) et B.22.035b) | ||
| (3) Aliments non normalisés | (3) Bonnes pratiques industrielles | ||
| (4) Les graisses et huiles végétales | (4) Bonnes pratiques industrielles selon l’article B.09.001 | ||
| (5) Margarine | (5) Bonnes pratiques industrielles | ||
| (6) Fromage (indication de la variété); fromage cheddar; fromage à la crème (avec indication des ingrédients ajoutés); fromage à la crème à tartiner, fromage à la crème à tartiner (avec indication des ingrédients ajoutés); fromage fondu (indication de la variété); fromage fondu (indication de la variété) (avec indication des ingrédients ajoutés); préparation de fromage fondu; préparation de fromage fondu (avec indication des ingrédients ajoutés); fromage fondu à tartiner; fromage fondu à tartiner (avec indication des ingrédients ajoutés); fromage conditionné à froid (indication de la variété); fromage conditionné à froid (indication de la variété) (avec indication des ingrédients ajoutés); préparation de fromage conditionné à froid; préparation de fromage conditionné à froid (avec indication des ingrédients ajoutés) | (6) Bonnes pratiques industrielles, conformément aux exigences des articles B.08.033, B.08.034, B.08.037, B.08.038, B.08.039, B.08.040, B.08.041, B.08.041.1, B.08.041.2, B.08.041.3, B.08.041.4, B.08.041.5, B.08.041.6, B.08.041.7, et B.08.041.8. | ||
| (7) Mélange de poisson et de viande préparés visé à l’alinéa B.21.006n) | (7) Bonnes pratiques industrielles | ||
| (8) Longaniza; Tocino | (8) 0,1 % conformément aux exigences de l’alinéa B.14.031i) ou du sous-alinéa B.14.032d)(xvi) | ||
| (9) Pellicule de collagène comestible (oxyde de fer seulement) | (9) Bonnes pratiques industrielles | ||
| (10) Boyaux de saucisse (rocou seulement) | (10) 1,0 % (les résidus de rocou dans les saucisses préparées avec ces boyaux ne doivent pas dépasser 100 p.p.m.) | ||
| (11) Boyaux de saucisse (cochenille seulement) | (11) 0,75 % (les résidus de cochenille dans les saucisses préparées avec ces boyaux ne doivent pas dépasser 75 p.p.m.) | ||
| 1A | ß-apo-8′- Caroténal Ester éthylique de l’acide ß-apo-8′-caroténoïque | (1) Achards (relish); beurre; catsup de tomates; confiture de (nom du fruit) avec pectine; confiture de pommes (ou de rhubarbe) et de (nom du fruit); cornichons; gelée de (nom du fruit) avec pectine; jus de (nom du fruit) concentré sauf le jus d’orange concentré congelé; lait écrémé (indication de l’arôme); lait écrémé (indication de l’arôme) additionné de solides du lait; lait (indication de l’arôme); lait partiellement écrémé (indication de l’arôme); lait partiellement écrémé (indication de l’arôme) additionné de solides du lait; liqueur; margarine; marmelade d’ananas avec pectine; marmelade de figues avec pectine; mélange pour crème glacée; mélange pour lait glacé; œufs de poisson (caviar); pain; pâte de homard; poisson fumé; sorbet laitier; sucre à glacer | (1) 35 p.p.m. |
| (2) Aliments non normalisés | (2) 35 p.p.m. | ||
| (3) Fromage (indication de la variété); fromage cheddar; fromage à la crème (avec indication des ingrédients ajoutés); fromage à la crème à tartiner; fromage à la crème à tartiner (avec indication des ingrédients ajoutés); fromage fondu (indication de la variété); fromage fondu (indication de la variété) (avec indication des ingrédients ajoutés); préparation de fromage fondu; préparation de fromage fondu (avec indication des ingrédients ajoutés); fromage fondu à tartiner; fromage fondu à tartiner (avec indication des ingrédients ajoutés); fromage conditionné à froid (indication de la variété); fromage conditionné à froid (indication de la variété) (avec indication des ingrédients ajoutés); préparation de fromage conditionné à froid; préparation de fromage conditionné à froid (avec indication des ingrédients ajoutés) | (3) 35 p.p.m., conformément aux exigences des articles B.08.033, B.08.034, B.08.037, B.08.038, B.08.039, B.08.040, B.08.041, B.08.041.1, B.08.041.2, B.08.041.3, B.08.041.4, B.08.041.5, B.08.041.6, B.08.041.7 et B.08.041.8 | ||
| (4) Mélange de poisson et de viande préparés visé à l’alinéa B.21.006n) | (4) 35 p.p.m. | ||
| 2 | Caramel | (1)Achards (relish); ale; beurre; bière; catsup de tomates; cidre; confiture de (nom du fruit) avec pectine; confiture de pommes (ou de rhubarbe) et de (nom du fruit); cornichons; eau-de-vie de vin (brandy); gelée de (nom du fruit) avec pectine; genièvre Hollands; jus de (nom du fruit) concentré sauf le jus d’orange concentré congelé; lait écrémé (indication de l’arôme); lait écrémé (indication de l’arôme) additionné de solides du lait; lait (indication de l’arôme); lait partiellement écrémé (indication de l’arôme); lait partiellement écrémé (indication de l’arôme) additionné de solides du lait; liqueur de malt; liqueur; marmelade d’ananas avec pectine; marmelade de figues avec pectine; mélange pour crème glacée; mélange pour lait glacé; mincemeat; oeufs de poisson (caviar); pain; pain brun; pâte de homard; poisson fumé; porter; rhum; sorbet laitier; stout; sucre à glacer; vin; vinaigre de cidre; vinaigre de malt; vinaigre de vin; vin de miel; whisky | (1) Bonnes pratiques industrielles |
| (2) Aliments non normalisés | (2) Bonnes pratiques industrielles | ||
| (3) Mélange de poisson et de viande préparés visé à l’alinéa B.21.006n) | (3) Bonnes pratiques industrielles | ||
| (4) Boyaux de saucisse | (4) 15 % (les résidus de caramel dans les saucisses préparées avec ces boyaux ne doivent pas dépasser 0,15 %) | ||
| (5) Fromage à la crème à tartiner (avec indication des ingrédients ajoutés) | (5) 1,5 % | ||
| 3 |
| (1) Achards (relish); beurre; catsup de tomates; confiture de (nom du fruit) avec pectine; confiture de pommes (ou de rhubarbe) et de (nom du fruit); cornichons; gelée de (nom du fruit) avec pectine; jus de (nom du fruit) concentré sauf le jus d’orange concentré congelé; lait écrémé (indication de l’arôme); lait écrémé (indication de l’arôme) additionné de solides du lait; lait (indication de l’arôme); lait partiellement écrémé (indication de l’arôme); lait partiellement écrémé (indication de l’arôme) additionné de solides du lait; liqueur; marmelade d’ananas avec pectine; marmelade de figues avec pectine; mélange pour crème glacée; mélange pour lait glacé; œufs de poisson (caviar); pain; pâte de homard; poisson fumé; sorbet laitier; sucre à glacer | (1) 300 p.p.m., isolément ou en mélange, en conformité de l’article B.06.002 |
| (2) Aliments non normalisés | (2) 300 p.p.m., isolément ou en mélange, en conformité de l’article B.06.002 | ||
| (3) Mélange de poisson et de viande préparés visé à l’alinéa B.21.006n) | (3) 300 p.p.m., isolément ou en mélange, en conformité avec l’article B.06.002 | ||
| (4) Anchois salé, chinchard salé et crevette salée | (4) 125 p.p.m. conformément aux exigences de l’alinéa B.21.021d) | ||
| (5) Longaniza | (5) 80 p.p.m. de rouge allura conformément aux exigences de la division B.14.032d)(xvi)(B) et 20 p.p.m. de jaune soleil FCF conformément aux exigences de la division B.14.032d)(xvi)(C) | ||
| (6) Boyaux de saucisse (jaune soleil FCF seulement) | (6) 0,15 % (les résidus de jaune soleil FCF dans les saucisses préparées avec ces boyaux ne doivent pas dépasser 15 p.p.m.) | ||
| (7) Grignotines de maïs à saveur de fromage (jaune soleil FCF seulement) | (7) 600 p.p.m. isolément. Si combiné avec d’autres colorants nommés à la colonne I du présent article et de l’article 4 du présent tableau, la limite de tolérance permise est de 300 p.p.m. conformément à l’alinéa B.06.002c) | ||
| 4 |
| (1) Achards (relish); beurre; catsup de tomates; confiture de (nom du fruit) avec pectine; confiture de pommes (ou de rhubarbe) et de (nom du fruit); cornichons; gelée de (nom du fruit) avec pectine; jus de (nom du fruit) concentré sauf le jus d’orange concentré congelé; lait écrémé (indication de l’arôme); lait écrémé (indication de l’arôme) additionné de solides du lait; lait (indication de l’arôme); lait partiellement écrémé (indication de l’arôme); lait partiellement écrémé (indication de l’arôme) additionné de solides du lait; liqueur; marmelade d’ananas avec pectine; marmelade de figues avec pectine; mélange pour crème glacée; mélange pour lait glacé; œufs de poisson (caviar); pain; pâte de homard; poisson fumé; sorbet laitier; sucre à glacer | (1) 100 p.p.m., isolément ou en mélange, en conformité de l’article B.06.002 |
| (2) Aliments non normalisés | (2) 100 p.p.m., isolément ou en mélange, en conformité de l’article B.06.002 | ||
| (3) Mélange de poisson et de viande préparés visé à l’alinéa B.21.006n) | (3) 100 p.p.m., isolément ou en mélange, en conformité avec l’article B.06.002 | ||
| (4) Feta (bleu brillant FCF seulement) | (4) 0,10 p.p.m. | ||
| 5 | Rouge citrin no 2 | Écorce des oranges entières | 2 p.p.m. |
| 6 | Ponceau SX | Écorce de fruits; fruits glacés; cerises glacées; marasques | 150 p.p.m. |
| 7 | Or | Boissons alcooliques | Bonnes pratiques industrielles |
- DORS/79-752, art. 5
- DORS/80-500, art. 6
- DORS/82-596, art. 3
- DORS/84-440, art. 4
- DORS/84-602, art. 1
- DORS/89-198, art. 6 à 10
- DORS/92-725, art. 5
- DORS/93-466, art. 2
- DORS/94-689, art. 2(F)
- DORS/95-434, art. 1
- DORS/95-493, art. 1
- DORS/97-516, art. 4
- DORS/98-580, art. 1(F)
- DORS/99-96, art. 1
- DORS/2000-50, art. 1
- DORS/2000-146, art. 1 à 3
- DORS/2007-75, art. 3
- DORS/2010-94, art. 8(A)
- DORS/2010-143, art. 13
- DORS/2011-235, art. 2(F)
- DORS/2011-281, art. 2
- DORS/2012-43, art. 16 à 20
TABLEAU IV
Additifs alimentaires autorisés comme émulsifs, agents gélatinisants, stabilisants ou épaississants
| Article | Colonne I | Colonne II | Colonne III |
|---|---|---|---|
| Additifs | Permis dans ou sur | Limites de tolérance | |
| A.1 | Gomme arabique | (1) Achards (relish); cornichons à la moutarde; crème; lait (indication de l’arôme); lait écrémé (indication de l’arôme); lait écrémé (indication de l’arôme) additionné de solides du lait; lait partiellement écrémé (indication de l’arôme); lait partiellement écrémé (indication de l’arôme) additionné de solides du lait; sauce à salade; sauce française | (1) Bonnes pratiques industrielles |
| (2) Crème glacée; mélange pour crème glacée; lait glacé; mélange pour lait glacé | (2) 0,5 % | ||
| (3) Sorbet laitier | (3) 0,75 % | ||
| (4) Aliments non normalisés | (4) Bonnes pratiques industrielles | ||
| (5) Margarine réduite en calories | (5) 0,5 % selon les exigences de l’article B.09.017 | ||
| (6) Asperges en conserve, haricots jaunes en conserve; haricots verts en conserve; pois en conserve | (6) 1,0 % selon les exigences de la disposition B.11.002d)(viii)(C). | ||
| A.1A | Gomme d’acacia modifiée avec l’anhydride octénylsuccinique (AOS) | (1) Glaces; sauce à salade; sauces d’assaisonnement non normalisées; sauces non normalisées; sauce vinaigrette | (1) 1 % |
| (2) Boissons non normalisées | (2) 0,1 % | ||
| (3) Préparations aromatisantes non normalisées | (3) 0,05 % | ||
| A.2 | Monoglycérides acétylés | Aliments non normalisés | Bonnes pratiques industrielles |
| A.3 | Esters tartriques des mono- et diglycérides acétylés | (1) Pain | (1) 6 000 p.p.m. de farine |
| (2) Aliments non normalisés | (2) Bonnes pratiques industrielles | ||
| (3) Préparations pour nourrissons à base d’acides aminés cristallisés | (3) 0,024 % de la préparation pour nourrissons prête à consommer | ||
| A.4 | Agar-agar | (1) Achards (relish); cornichons à la moutarde; crème; fromage de porc; gelée de (nom du fruit) avec pectine; lait écrémé (indication de l’arôme); lait écrémé (indication de l’arôme) additionné de solides du lait; lait (indication de l’arôme); lait partiellement écrémé (indication de l’arôme); lait partiellement écrémé (indication de l’arôme) additionné de solides du lait; liant à viande ou liant à (désignation du produit de viande) lorsqu’il est vendu pour servir dans la viande préparée et dans les sous-produits de viande préparés dans lesquels il est permis d’ajouter un agent gélatinisant; (nom de la volaille) en conserve; pain de viande; poisson et viande préparés (Titre 21); sous-produits de viande en pain; sous-produits de viande en pot; tête fromagée; viande en pot | (1) Bonnes pratiques industrielles |
| (2) Crème glacée; mélange pour crème glacée; lait glacé; mélange pour lait glacé | (2) 0,5 % | ||
| (3) Sorbet laitier | (3) 0,75 % | ||
| (4) Aliments non normalisés | (4) Bonnes pratiques industrielles | ||
| (5) Margarine réduite en calories | (5) 0,5 % selon les exigences de l’article B.09.017 | ||
| A.5 | Algine | (1) Achards (relish); ale; bière; cornichons à la moutarde; crème; lait écrémé (indication de l’arôme); lait écrémé (indication de l’arôme) additionné de solides du lait; lait (indication de l’arôme); lait partiellement écrémé (indication de l’arôme); lait partiellement écrémé (indication de l’arôme) additionné de solides du lait; liqueur de malt; porter; sauce à salade; sauce vinaigrette; stout | (1) Bonnes pratiques industrielles |
| (2) Préparations pour nourrissons | (2) 0,03 % de la préparation pour nourrissons prête à consommer. Si l’on emploie aussi la carraghénine ou la gomme de guar, ou les deux, le total ne doit pas dépasser 0,03 % | ||
| (3) Fromage cottage; fromage cottage en crème; crème glacée; mélange pour crème glacée; lait glacé; mélange pour le lait glacé | (3) 0,5 % | ||
| (4) Sorbet laitier | (4) 0,75 % | ||
| (5) Aliments non normalisés | (5) Bonnes pratiques industrielles | ||
| (6) Margarine réduite en calories | (6) 0,5 % selon les exigences de l’article B.09.017 | ||
| (7) Crème sure | (7) 0,5 % selon les exigences de la disposition B.08.077b)(vii)(A) | ||
| (8) Asperges en conserve; haricots jaunes en conserves; haricots verts en conserves; pois en conserve | (8) 1,0 % selon les exigences de la disposition B.11.002d)(viii)(C) | ||
| (9) Préparations pour nourrissons à base d’acides aminés isolés ou d’hydrolysats de protéines, ou des deux | (9) 0,1 % de la préparation pour nourrissons prête à consommer. Si l’on emploie aussi la carraghénine ou la gomme de guar, ou les deux, le total ne doit pas dépasser 0,1 % | ||
| (10) Préparations pour nourrissons sans lactose, à base de protéines du lait | (10) 0,05 % de la préparation pour nourrissons prête à consommer. Si l’on emploie aussi la carraghénine ou la gomme de guar, ou les deux, le total ne doit pas dépasser 0,05 % | ||
| A.6 | Acide alginique | Mêmes aliments que pour l’algine | Mêmes limites de tolérance que pour l’algine |
| A.7 | Alginate d’ammonium | Mêmes aliments que pour l’algine | Mêmes limites de tolérance que pour l’algine |
| A.8 | Carraghénine ammoniacale | Mêmes aliments que pour la carragénine | Mêmes limites de tolérance que pour la carraghénine |
| A.9 | Furcelleran d’ammonium | Mêmes aliments que pour le furcelleran | Mêmes limites de tolérance que pour le furcelleran |
| A.9A | Sel d’ammonium de glycéride phosphorylé | (1) Achards (relish); cornichons à la moutarde; crème; lait écrémé (indication de l’arôme); lait écrémé (indication de l’arôme) additionné de solides du lait; lait (indication de l’arôme); lait partiellement écrémé (indication de l’arôme); lait partiellement écrémé (indication de l’arôme) additionné de solides du lait; pain | (1) Bonnes pratiques industrielles |
| (2) Crème glacée; mélange pour crème glacée; lait glacé; mélange pour lait glacé | (2) 0,5 % | ||
| (3) Sorbet laitier | (3) 0,75 % | ||
| (4) Aliments non normalisés | (4) Bonnes pratiques industrielles | ||
| (5) Produits de chocolat; produits du cacao | (5) 0,7 % | ||
| A.10 | Arabinogalactane | Bases pour boissons non normalisées; huiles essentielles; mélanges pour boissons non normalisés; mélanges pour garnitures à tarte; mélanges pour poudings; sauces d’assaisonnement non normalisées | Bonnes pratiques industrielles |
| B.1 | Levure de boulanger Glycan | Aliments non normalisés | Bonnes pratiques industrielles |
| C.1 | Alginate de calcium | Mêmes aliments que pour l’algine | Mêmes limites de tolérance que pour l’algine |
| C.2 | Carbonate de calcium | (1) Aliments non normalisés | (1) Bonnes pratiques industrielles |
| (2) Mélange de poisson et de viande préparés visé à l’alinéa B.21.006n) | (2) Bonnes pratiques industrielles | ||
| C.3 | Carraghénine calcique | Mêmes aliments que pour la carraghénine | Mêmes limites de tolérance que pour la carraghénine |
| C.4 | Citrate de calcium | (1) Fromage à la crème à tartiner; fromage à la crème à tartiner (avec indication des ingrédients ajoutés); fromage fondu (indication de la variété); fromage fondu (indication de la variété) (avec indication des ingrédients ajoutés); préparation de fromage fondu; préparation de fromage fondu (avec indication des ingrédients ajoutés); fromage fondu à tartiner; fromage fondu à tartiner (avec indication des ingrédients ajoutés) | (1) 4,0 %, conformément aux exigences des articles B.08.038, B.08.039, B.08.040, B.08.041, B.08.041.1, B.08.041.2, B.08.041.3 et B.08.041.4 |
| (2) Aliments non normalisés | (2) Bonnes pratiques industrielles | ||
| C.5 | Furcelleran de calcium | Mêmes aliments que pour le furcelleran | Mêmes limites de tolérance que pour le furcelleran |
| C.6 | Gluconate de calcium | Aliments non normalisés | Bonnes pratiques industrielles |
| C.7 | Glycérophosphate de calcium | Mélanges pour desserts non normalisés | Bonnes pratiques industrielles |
| C.8 | Hypophosphite de calcium | Mélanges pour desserts non normalisés | Bonnes pratiques industrielles |
| C.9 | Phosphate bicalcique | (1) Fromage à la crème à tartiner; fromage à la crème à tartiner (avec indication des ingrédients ajoutés); fromage fondu (indication de la variété); fromage fondu (indication de la variété) (avec indication des ingrédients ajoutés); préparation de fromage fondu; préparation de fromage fondu (avec indication des ingrédients ajoutés); fromage fondu à tartiner; fromage fondu à tartiner (avec indication des ingrédients ajoutés) | (1) 3,5 %, conformément aux exigences des articles B.08.038, B.08.039, B.08.040, B.08.041, B.08.041.1, B.08.041.2, B.08.041.3 et B.08.041.4 |
| (2) Aliments non normalisés | (2) Bonnes pratiques industrielles | ||
| C.10 | Phosphate tricalcique | Aliments non normalisés | Bonnes pratiques industrielles |
| C.11 | Sulfate de calcium | (1) Crème glacée; mélange pour crème glacée; lait glacé; mélange pour lait glacé | (1) 0,5 % |
| (2) Sorbet laitier | (2) 0,75 % | ||
| (3) Aliments non normalisés | (3) Bonnes pratiques industrielles | ||
| (4) Fromage cottage en crème | (4) 0,05 % | ||
| (5) Crème à fouetter thermisée à une chaleur supérieure à 100 °C | (5) 0,005 % | ||
| (6) Mélange de poisson et de viande préparés visé à l’alinéa B.21.006n) | (6) 0,06 % | ||
| C.12 | Tartrate de calcium | Aliments non normalisés | Bonnes pratiques industrielles |
| C.13 | Carboxyméthylcellulose | Mêmes aliments que pour la carboxyméthylcellulose sodique | Mêmes limites de tolérance que pour la carboxyméthylcellulose sodique |
| C.14 | Gomme de caroube | (1) Achards (relish); cornichons à la moutarde; crème; lait écrémé (indication de l’arôme); lait écrémé (indication de l’arôme) additionné de solides du lait; lait (indication de l’arôme); lait partiellement écrémé (indication de l’arôme); lait partiellement écrémé (indication de l’arôme) additionné de solides du lait; sauce à salade; sauce vinaigrette | (1) Bonnes pratiques industrielles |
| (2) Fromage cottage; fromage cottage en crème; crème glacée; mélange pour crème glacée; lait glacé; mélange pour lait glacé | (2) 0,5 % | ||
| (3) Margarine hypocalorique | (3) 0,5 % selon les exigences de l’alinéa B.09.017b) | ||
| (4) Sorbet laitier | (4) 0,75 % | ||
| (5) Crème sure | (5) 0,5 % selon les exigences de la disposition B.08.077b)(vii)(A) | ||
| (6) Aliments non normalisés | (6) Bonnes pratiques industrielles | ||
| (7) Fromage à la crème; fromage à la crème (avec indication des ingrédients ajoutés); fromage à la crème à tartiner; fromage à la crème à tartiner (avec indication des ingrédients ajoutés); fromage fondu à tartiner; fromage fondu à tartiner (avec indication des ingrédients ajoutés); fromage (indication de la variété) conditionné à froid (avec indication des ingrédients ajoutés); préparation de fromage conditionné à froid; préparation de fromage conditionné à froid (avec indication des ingrédients ajoutés) | (7) 0,5 %, conformément aux exigences des articles B.08.035, B.08.037, B.08.038, B.08.039, B.08.041.3, B.08.041.4, B.08.041.6, B.08.041.7 et B.08.041.8 | ||
| C.15 | Carraghénine | (1) Ale; bière; fromage de porc; (nom de la volaille) en conserve; crème; sauce vinaigrette; fromage de tête ou tête fromagée; gelée à (nom du fruit) avec pectine; bière légère; liqueur de malt; liant à viande (quand il est vendu pour servir dans les viandes ou dans les sous-produits de la viande conditionnés dans lesquels un agent gélatinisant est autorisé); sous-produits de la viande en pain; pain de viande; lait (indication de l’arôme); cornichons à la moutarde; porter; viande en pot; sous-produits de la viande en pot; poisson ou viande conditionnés (Titre 21); achards (relish); sauce à salade; lait écrémé (indication de l’arôme); lait partiellement écrémé (indication de l’arôme); lait écrémé (indication de l’arôme) additionné de solides de lait; lait partiellement écrémé (indication de l’arôme) additionné de solides du lait; stout | (1) Bonnes pratiques industrielles |
| (2) Fromage cottage; fromage cottage en crème; crème glacée; mélange pour crème glacée; lait glacé; mélange pour lait glacé | (2) 0,5 % | ||
| (3) Lait évaporé | (3) 0,015 % | ||
| (4) Sorbet laitier | (4) 0,75 % | ||
| (5) Lait évaporé partiellement écrémé; lait concentré partiellement écrémé | (5) 0,01 % | ||
| (6) Préparations pour nourrissons à base d’acides aminés isolés ou d’hydrolysats de protéines, ou les deux | (6) 0,1 % de la préparation pour nourrissons prête à consommer. Si l’on emploie aussi l’algine ou la gomme de guar, ou les deux, le total ne doit pas dépasser 0,1 % | ||
| (7) Préparations pour nourrissons | (7) 0,03 % de la préparation pour nourrissons prête à consommer. Si l’on emploie aussi l’algine ou la gomme de guar ou les deux, le total ne doit pas dépasser 0,03 % | ||
| (8) Aliments non normalisés | (8) Bonnes pratiques industrielles | ||
| (9) Margarine réduite en calories | (9) 0,5 % selon les exigences de l’article B.09.017 | ||
| (10) Crème sure | (10) 0,5 % selon les exigences de la disposition B.08.077b)(vii)(A) | ||
| (11) Asperges en conserve; haricots jaunes en conserve, haricots verts en conserve, pois en conserve | (11) 1,0 % selon les exigences de la disposition B.11.022d)(viii)(C) | ||
| (12) Fromage à la crème; fromage à la crème (avec indication des ingrédients ajoutés); fromage à la crème à tartiner; fromage à la crème à tartiner (avec indication des ingrédients ajoutés); fromage fondu à tartiner; fromage fondu à tartiner (avec indication des ingrédients ajoutés); fromage (indication de la variété) conditionné à froid (avec indication des ingrédients ajoutés); préparation de fromage conditionné à froid; préparation de fromage conditionné à froid (avec indication des ingrédients ajoutés) | (12) 0,5 %, conformément aux exigences des articles B.08.035, B.08.037, B.08.038, B.08.039, B.08.041.3, B.08.041.4, B.08.041.6, B.08.041.7 et B.08.041.8 | ||
| (13) Préparations pour nourrissons sans lactose, à base de protéines du lait | (13) 0,05 % de la préparation pour nourrissons prête à consommer. Si l’on emploie aussi l’algine ou la gomme de guar, ou les deux, le total ne doit pas dépasser 0,05 % | ||
| C.17 | Gomme de cellulose | Mêmes aliments que pour la carboxyméthylcellulose sodique | Mêmes limites de tolérance que pour la carboxyméthylcellulose sodique |
| C.18 | Esters citriques des mono- et diglycérides | (1) Préparations pour nourrissons à base d’acides aminés cristallisés ou d’hydrolysats de protéines, ou des deux | (1) 0,155 % de la préparation pour nourrissons prête à consommer |
| (2) Aliments non normalisés | (2) Bonnes pratiques industrielles | ||
| F.1 | Furcelleran | (1) Ale; bière; bière légère; liqueur de malt; porter; stout | (1) Bonnes pratiques industrielles |
| (2) Aliments non normalisés | (2) Bonnes pratiques industrielles | ||
| (3) Margarine réduite en calories | (3) 0,5 % selon les exigences de l’article B.09.017 | ||
| (4) Asperges en conserve; haricots jaunes en conserve; haricots verts en conserve; pois en conserve | (4) 1,0 % selon les exigences de la disposition B.11.002d)(viii)(C) | ||
| G.1 | Gélatine | (1) Achards (relish); cornichons à la moutarde; crème; fromage de porc; gelée de (nom du fruit) avec pectine; jambons, épaules, socs de porc, jambons pique-nique et jambons de longe préparés; lait écrémé (indication de l’arôme); lait écrémé (indication de l’arôme) additionné de solides du lait; lait (indication de l’arôme); lait partiellement écrémé (indication de l’arôme); lait partiellement écrémé (indication de l’arôme) additionné de solides du lait; liant à viande ou liant à (désignation du produit de viande) lorsqu’il est vendu pour servir dans la viande préparée et dans les sous-produits de viande préparés dans lesquels il est permis d’ajouter un agent gélatinisant; (nom de la volaille) en conserve; pain de viande; poisson et viande préparés (Titre 21); sous-produits de viande en pain; sous-produits de viande en pot; tête fromagée; viande en pot | (1) Bonnes pratiques industrielles |
| (2) Fromage cottage; fromage cottage en crème; crème glacée; mélange pour crème glacée; lait glacé; mélange pour lait glacé | (2) 0,5 % | ||
| (3) Sorbet laitier | (3) 0,75 % | ||
| (4) Crème sure de la disposition B.08.077b)(vii)(A) | (4) 0,5 % selon les exigences | ||
| (5) Aliments non normalisés | (5) Bonnes pratiques industrielles | ||
| (6) Fromage à la crème; fromage à la crème (avec indication des ingrédients ajoutés); fromage à la crème à tartiner; fromage à la crème à tartiner (avec indication des ingrédients ajoutés); fromage fondu à tartiner; fromage fondu à tartiner (avec indication des ingrédients ajoutés); fromage conditionné à froid (indication de la variété) (avec indication des ingrédients ajoutés); préparation de fromage conditionné à froid; préparation de fromage conditionné à froid (avec indication des ingrédients ajoutés) | (6) 0,5 %, conformément aux exigences des articles B.08.035, B.08.037, B.08.038, B.08.039, B.08.041.3, B.08.041.4, B.08.041.6, B.08.041.7 et B.08.041.8 | ||
| G.2 | Gomme gellan | (1) Confiseries non normalisées; produits de glaçage | (1) 0,5 % |
| (2) Aspics; produits de fruits transformés non normalisés; tartinades de fruits non normalisées | (2) 0,3 % | ||
| (3) Margarine réduite en calories; tartinades réduites en matière grasse | (3) 0,25 % | ||
| (4) Produits laitiers non normalisés | (4) 0,15 % | ||
| (5) Garnitures; gélatines non normalisées; mélanges pour garnitures; mélanges pour poudings; poudings; sauce à salade; sauces d’assaisonnement non normalisées; sauce vinaigrette | (5) 0,1 % | ||
| (6) Mélanges pour pâtisseries; produits de boulangerie non normalisés | (6) 0,1 % du mélange sec | ||
| (7) Glaçages; mélanges pour glaçages; sauces non normalisées; sirops de table non normalisés | (7) 0,05 % | ||
| (8) Boissons non normalisées | (8) 0,08 % | ||
| (9) Grignotines | (9) 0,1 % | ||
| G.3 | Gomme de guar | (1) Achards (relish); cornichons à la moutarde; crème; lait écrémé (indication de l’arôme); lait écrémé (indication de l’arôme) additionné de solides du lait; lait (indication de l’arôme); lait partiellement écrémé (indication de l’arôme); lait partiellement écrémé (indication de l’arôme) additionné de solides du lait; mincemeat; pain; sauce à salade; sauce vinaigrette | (1) Bonnes pratiques industrielles |
| (2) Fromage cottage; fromage cottage en crème; crème glacée; mélange pour crème glacée; lait glacé; mélange pour lait glacé | (2) 0,5 % | ||
| (3) Préparations pour nourrissons | (3) 0,03 % de la préparation pour nourrissons prête à consommer. Si l’on emploie aussi l’algine ou la carragénine ou les deux, le total ne doit pas dépasser 0,03 % | ||
| (4) Sorbet laitier | (4) 0,75 % | ||
| (5) Aliments non normalisés | (5) Bonnes pratiques industrielles | ||
| (6) Margarine réduite en calories | (6) 0,5 % selon les exigences de l’article B.09.017 | ||
| (7) Crème sure de la disposition B.08.077b)(vii)(A) | (7) 0,5 % selon les exigences | ||
| (8) Asperges en conserve; haricots jaunes en conserve; haricots verts en conserve; pois en conserve | (8) 1,0 % selon les exigences de la disposition B.11.002d)(viii)(C) | ||
| (9) Fromage à la crème; fromage à la crème (avec indication des ingrédients ajoutés); fromage à la crème à tartiner; fromage à la crème à tartiner (avec indication des ingrédients ajoutés); fromage fondu à tartiner; fromage fondu à tartiner (avec indication des ingrédients ajoutés); fromage (indication de la variété) conditionné à froid (avec indication des ingrédients ajoutés); préparation de fromage conditionné à froid; préparation de fromage conditionné à froid (avec indication des ingrédients ajoutés) | (9) 0,5 %, conformément aux exigences des articles B.08.035, B.08.037, B.08.038, B.08.039, B.08.041.3, B.08.041.4, B.08.041.6, B.08.041.7 et B.08.041.8 | ||
| (10) Préparations pour nourrissons à base d’acides aminés isolés ou d’hydrolysats de protéines, ou des deux | (10) 0,1 % de la préparation pour nourrissons prête à consommer. Si l’on emploie aussi l’algine ou la carraghénine, ou les deux, le total ne doit pas dépasser 0,1 % | ||
| (11) Préparations pour nourrissons sans lactose, à base de protéines du lait | (11) 0,05 % de la préparation pour nourrissons prête à consommer. Si l’on emploie aussi l’algine ou la carraghénine, ou les deux, le total ne doit pas dépasser 0,05 % | ||
| G.4 | Gomme sénégal | Mêmes aliments que pour la gomme arabique | Mêmes limites de tolérance que pour la gomme arabique |
| H.1 | Hydroxylécithine | (1) Produits de chocolat; produits du cacao | (1) 1,0 % |
| (2) Aliments non normalisés | (2) Bonnes pratiques industrielles | ||
| H.1A | Hydroxypropyl cellulose | Aliments non normalisés | Bonnes pratiques industrielles |
| H.2 | Hydroxypropyl méthylcellulose | (1) Sauce vinaigrette; lait (indication de l’arôme); cornichons à la moutarde; achards (relish); lait écrémé (indication de l’arôme); lait partiellement écrémé (indication de l’arôme); lait écrémé (indication de l’arôme) additionné de solides du lait; lait partiellement écrémé (indication de l’arôme) additionné de solides du lait; sauce à salade | (1) Bonnes pratiques industrielles |
| (2) Aliments non normalisés | (2) Bonnes pratiques industrielles | ||
| I.1 | Gélose de mousse d’Irlande | Mêmes aliments que pour la carraghénine | Mêmes limites de tolérance que pour la carraghénine |
| K.1 | Gomme sterculia (Karaya) | (1) Sauce vinaigrette; lait (indication de l’arôme); cornichons à la moutarde; achards (relish); lait écrémé (indication de l’arôme); lait partiellement écrémé (indication de l’arôme); lait écrémé (indication de l’arôme) additionné de solides du lait; lait partiellement écrémé (indication de l’arôme) additionné de solides du lait | (1) Bonnes pratiques industrielles |
| (2) Fromage cottage; fromage cottage en crème; crème glacée; mélange pour crème glacée; lait glacé; mélange pour lait glacé | (2) 0,5 % | ||
| (3) Sorbet laitier | (3) 0,75 % | ||
| (4) Aliments non normalisés | (4) Bonnes pratiques industrielles | ||
| (5) Margarine réduite en calories | (5) 0,5 % selon les exigences de l’article B.09.017 | ||
| L.1 | Mono- et diglycérides lactylés | (1) Shortening | (1) 8,0 % (sauf que le total des mono- et des diglycérides et des mono- et diglycérides lactylés, ne doit pas dépasser 20,0 % du shortening) |
| (2) Aliments non normalisés | (2) 8,0 % de la teneur en gras | ||
| L.1A | Esters lactyliques d’acides gras | Aliments non normalisés | Bonnes pratiques industrielles |
| L.2 | Lécithine | (1) Pain; crème; lait (indication de l’arôme); cornichons à la moutarde; achards (relish); lait écrémé (indication de l’arôme); lait partiellement écrémé (indication de l’arôme); lait écrémé (indication de l’arôme) additionné de solides du lait; lait partiellement écrémé (indication de l’arôme) additionné de solides du lait | (1) Bonnes pratiques industrielles |
| (2) Crème glacée; mélange pour crème glacée; lait glacé; mélange pour lait glacé | (2) 0,5 %, seul ou en combinaison avec d’autres agents émulsifiants | ||
| (3) Préparations pour nourrissons | (3) 0,03 % de la préparation pour nourrissons prête à consommer | ||
| (4) Sorbet laitier | (4) 0,75 % | ||
| (5) Aliments non normalisés | (5) Bonnes pratiques industrielles | ||
| (6) Margarine | (6) 0,2 % | ||
| (7) Margarine réduite en calories | (7) 0,5 % | ||
| (8) Fromage fondu (indication de la variété); fromage fondu (indication de la variété) (avec indication des ingrédients ajoutés); préparation de fromage fondu; préparation de fromage fondu (avec indication des ingrédients ajoutés); fromage fondu à tartiner; fromage fondu à tartiner (avec indication des ingrédients ajoutés) | (8) 0,2 % | ||
| (9) Poudre de lait | (9) 0,5 % | ||
| (10) Produits de chocolat; produits du cacao | (10) 1,0 % | ||
| L.3 | Gomme de caroubier | Mêmes aliments que pour la gomme de caroube | Mêmes limites de tolérance que pour la gomme de caroube. |
| M.1 | Chlorure de magnésium | Tofu | 0,3 %, calculé en sel anhydre |
| M.2 | Méthylcellulose | (1) Ale; bière; sauce vinaigrette; bière légère; liqueur de malt; porter; sauce à salade; stout | (1) Bonnes pratiques industrielles |
| (2) Aliments non normalisés | (2) Bonnes pratiques industrielles | ||
| M.3 | Cellulose méthyl-éthylique | Aliments non normalisés | Bonnes pratiques industrielles |
| M.4 | Monoglycérides | (1) Pain; crème; pâte de poisson | (1) Bonnes pratiques industrielles |
| (2) Produits de chocolat; produits du cacao | (2) 1,5 % | ||
| (3) Mélange pour crème glacée; mélange pour lait glacé | (3) Stabilisants dans la proportion totale de 0,5 %, conformément aux sous-alinéas B.08.061b)(vi) et B.08.071b)(vi) | ||
| (4) Fromage cottage en crème | (4) Bonnes pratiques industrielles | ||
| (5) Préparations pour nourrissons | (5) 0,25 % de la préparation pour nourrissons prête à consommer | ||
| (6) Boyaux de saucisse | (6) 0,35 % du boyau | ||
| (7) Margarine | (7) 0,5 % | ||
| (8) Sorbet laitier | (8) 0,75 % | ||
| (9) Shortening | (9) 10,0 % (sauf que le total des mono et diglycérides et des mono et diglycérides lactylés ne doit pas dépasser 20,0 % du shortening) | ||
| (10) Crème sure | (10) 0,3 % | ||
| (11) Aliments non normalisés | (11) Bonnes pratiques industrielles | ||
| (12) Fromage fondu (indication de la variété); fromage fondu (indication de la variété) (avec indication des ingrédients ajoutés); préparation de fromage fondu; préparation de fromage fondu (avec indication des ingrédients ajoutés); fromage fondu à tartiner; fromage fondu à tartiner (avec indication des ingrédients ajoutés) | (12) 0,5 % conformément aux exigences des articles B.08.040, B.08.041, B.08.041.1, B.08.041.2, B.08.041.3 et B.08.041.4 | ||
| M.5 | Mono- et diglycérides | (1) Pain; crème; pâte de poisson | (1) Bonnes pratiques industrielles |
| (2) Produits de chocolat; produits du cacao | (2) 1,5 % | ||
| (3) Mélange pour crème glacée; mélange pour lait glacé | (3) Stabilisants dans la proportion totale de 0,5 %, conformément aux sous-alinéas B.08.061b)(vi) et B.08.071b)(vi) | ||
| (4) Fromage cottage; Fromage cottage en crème | (4) Bonnes pratiques industrielles | ||
| (5) Préparations pour nourrissons | (5) 0,25 % de la préparation pour nourrissons prête à consommer | ||
| (6) Boyaux de saucisse | (6) 0,35 % du boyau | ||
| (7) Margarine | (7) 0,5 % | ||
| (8) Sorbet laitier | (8) 0,75 % | ||
| (9) Shortening | (9) 10,0 % (sauf que le total des mono et diglycérides et des mono et diglycérides lactylés ne doit pas dépasser 20,0 % du shortening) | ||
| (10) Crème sure | (10) 0,3 % | ||
| (11) Aliments non normalisés | (11) Bonnes pratiques industrielles | ||
| (12) Fromage fondu (indication de la variété); fromage fondu (indication de la variété) (avec indication des ingrédients ajoutés); préparation de fromage fondu; préparation de fromage fondu (avec indication des ingrédients ajoutés); fromage fondu à tartiner; fromage fondu à tartiner (avec indication des ingrédients ajoutés) | (12) 0,5 % conformément aux exigences des articles B.08.040, B.08.041, B.08.041.1, B.08.041.2, B.08.041.3 et B.08.041.4 | ||
| M.6 | Sels monosodiques de mono- et diglycérides phosphorylés | (1) Émulsions à base d’huiles végétales comestibles servant d’enduits pour batterie de cuisine | (1) 4,0 % |
| O.1 | Gomme d’avoine | (1) Aliments non normalisés | (1) Bonnes pratiques industrielles |
| P.1 | Pectine | (1) Achards (relish); confiture de (nom du fruit); confiture de (nom du fruit) avec pectine; confiture de pommes (ou de rhubarbe) et de (nom du fruit); cornichons à la moutarde; crème; gelée de (nom du fruit); gelée de (nom du fruit) avec pectine; lait écrémé (indication de l’arôme); lait écrémé (indication de l’arôme) additionné de solides du lait; lait (indication de l’arôme); lait partiellement écrémé (indication de l’arôme); lait partiellement écrémé (indication de l’arôme) additionné de solides du lait; marmelade d’ananas; marmelade d’ananas avec pectine; marmelade de figues; marmelade de figues avec pectine; marmelade de (nom de l’agrume) avec pectine; mincemeat; sauce à salade; sauce vinaigrette | (1) Bonnes pratiques industrielles |
| (2) Crème glacée; mélange pour crème glacée; lait glacé; mélange pour lait glacé | (2) 0,5 % | ||
| (3) Crème sure | (3) 0,5 % conformément à la disposition B.08.077b)(vii)(A) | ||
| (4) Sorbet laitier | (4) 0,75 % | ||
| (5) Aliments non normalisés | (5) Bonnes pratiques industrielles | ||
| P.1A | Esters polyglycéroliques d’acides gras | (1) Aliments non normalisés | (1) Bonnes pratiques industrielles |
| (2) Huiles végétales | (2) 0,025 % | ||
| (3) Margarine réduite en calories | (3) 0,2 % conformément aux exigences de l’alinéa B.09.017c) | ||
| P.1B | Esters polyglycériques d’acides gras d’huile de ricin transestérifiés | (1) Produits de chocolat | (1) 0,5 % |
| (2) Enrobages de confiserie non normalisés à saveur de chocolat | (2) 0,25 % | ||
| (3) Émulsions à base d’huiles végétales comestibles pour enduire les moules à cuisson | (3) 2,0 % | ||
| P.2 | Mono-oélate polyoxyéthylénique (20) de sorbitan Polysorbate 80 | (1) Crème glacée; mélange pour crème glacée; lait glacé; mélange pour lait glacé; sorbet laitier | (1) 0,1 %. Si l’on emploie le tristéarate polyoxyéthylénique (20) de sorbitan, le total ne doit pas dépasser 0,1 % |
| (2) Desserts congelés non normalisés | (2) 0,1 % | ||
| (3) Achards (relish) et cornichons | (3) 0,05 % | ||
| (4) Bases pour boissons non normalisées; mélanges pour boissons non normalisés | (4) 0,05 % de la boisson. Si l’on emploie aussi le monostéarate de sorbitan, le total ne doit pas dépasser 0,05 % de la boisson | ||
| (5) Mélange imitation de crème en poudre | (5) 0,1 %. Si l’on emploie aussi le monostéarate polyoxyéthylénique (20) de sorbitan, le tristéarate polyoxyéthylénique (20) de sorbitan ou le monostéarate de sorbitan, seuls ou mélangés, le total ne doit pas dépasser 0,4 % | ||
| (6) Garnitures fouettées à l’huile végétale | (6) 0,05 %. Si l’on emploie aussi le monostéarate polyoxyéthylénique (20) de sorbitan, le tristéarate polyoxyéthylénique (20) de sorbitan ou le monostéarate de sorbitan, seuls ou mélangés, le total ne doit pas dépasser 0,4 % | ||
| (7) Glaces à gâteaux; mélanges pour glaces à gâteaux | (7) 0,5 % de la glace à gâteau finie. Si l’on emploie aussi le monostéarate polyoxyéthylénique (20) de sorbitan ou le monostéarate de sorbitan, seuls ou mélangés, le total ne doit pas dépasser 0,5 % de la glace à gâteau finie | ||
| (8) Sel | (8) 10 parties par million | ||
| (9) Crème fouettée | (9) 0,1 % | ||
| (10) Rafraîchisseurs d’haleine | (10) 100 p.p.m. | ||
| (11) Fromage cottage en crème | (11) 80 p.p.m. | ||
| (12) Huiles d’épice et oléorésines d’épice utilisées dans le mélange de salaison pour mariner des viandes de salaison ou des sous-produits de viande de salaison (Titre 14) | (12) 0,2 % de la marinade | ||
| (13) Boyaux de saucisse | (13) 0,15 % de boyau | ||
| (14) Agents aromatisants à saveur de fumée | (14) Bonnes pratiques industrielles. Les résidus de polysorbate 80 ne doivent pas dépasser 275 p.p.m. dans le produit fini. | ||
| (15) Huiles végétales | (15) 0,125 % | ||
| (16) Préparations de rocou | (16) 25 % de la préparation colorante totale | ||
| (17) Préparations de curcuma | (17) 50 % de la préparation colorante totale | ||
| (18) Arômes de fumée liquide concentrés | (18) Bonne pratiques industrielles. Les résidus de polysorbate 80 ne peuvent dépasser 0,3 % dans le produit fini. | ||
| (19) Sauces à salade non normalisées | (19) 0,25 % | ||
| P.3 | Monostéarate polyoxyéthylénique (20) de sorbitan Polysorbate 60 | (1) Mélange imitation de crème en poudre; agents de crémage à l’huile végétale; garnitures fouettées à l’huile végétale; mélange pour garnitures à l’huile végétale | (1) 0,4 %. Si l’on emploie aussi le tristéarate polyoxyéthylénique (20) de sorbitan, le monostéarate de sorbitan, ou le mono-oléate polyoxyéthylénique (20) de sorbitan, soit séparément, soit ensemble, le total ne doit pas dépasser 0,4 %, sauf que, dans les garnitures fouettées renfermant de l’huile végétale, on peut employer une combinaison de polysorbate (60) et de monostéarate de sorbitan de plus de 0,4 %, si la proportion de polysorbate (60) ne dépasse pas 0,77 % et celle du monostéarate de sorbitan ne dépasse pas 0,27 % de la garniture fouettée renfermant de l’huile végétale |
| (2) Gâteaux | (2) 0,5 % du poids à l’état sec. Si l’on emploie aussi le tristéarate polyoxyéthylénique (20) de sorbitan, le total ne doit pas dépasser 0,5 % du poids sec | ||
| (3) Gâteaux; mélanges à gâteaux | (3) 0,5 % du poids à l’état sec. Si l’on emploie aussi le monostéarate de sorbitan, le total ne doit pas dépasser 0,7 % du poids à l’état sec | ||
| (4) Enrobages de confiserie non normalisés et produits de confiserie moulés non normalisés utilisés comme confiserie ou pour la cuisson | (4) 0,5 %. Si l’on emploie aussi un mélange de l’un quelconque des ingrédients suivants : tristéarate polyoxyéthymique [polyoxyéthylénique] (20) de sorbitan, monostéarate de sorbitan ou tristéarate de sorbitan, le total ne doit pas dépasser 1,0 % | ||
| (5) Glaces à gâteaux; mélange pour glaces à gâteaux | (5) 0,5 % de la glace à gâteau finie. Si l’on emploie aussi le monostéarate de sorbitan ou le mono-oléate polyoxyéthylénique (20) de sorbitan, seuls ou mélangés, le total ne doit pas dépasser 0,5 % de la glace à gâteau finie | ||
| (6) Garnitures à tarte; poudings | (6) 0,5 % du poids à l’état sec | ||
| (7) Bases pour boissons non normalisées; mélanges pour boissons non normalisés | (7) 0,05 % de la boisson. Si l’on emploie aussi le monostéarate de sorbitan, le total ne doit pas dépasser 0,05 % de la boisson | ||
| (8) Substitut de crème sure (aigre) | (8) 0,1 % | ||
| (9) Sauces cuisinées, non normalisées, en conserve; sauces d’assaisonnement non normalisées | (9) 0,3 % | ||
| (10) Base de matière grasse pour l’auto-arrosage de la volaille par injection | (10) 0,25 % | ||
| (11) Tartinades à sandwich non normalisées; trempettes non normalisées | (11) 0,2 % | ||
| (12) Bases ou mélanges secs pour soupes | (12) 250 p.p.m. dans la soupe prête à consommer | ||
| (13) Mélange sec de pâte à frire d’enrobage | (13) 0,5 % du mélange sec | ||
| (14) Cocktails alcoolisés préparés | (14) 120 p.p.m. dans la boisson prête à consommer | ||
| P.4 | Polyoxyéthylène (20) Tristéarate de sorbitan; Polysorbate 65 | (1) Lait (indication de l’arôme); lait écrémé (indication de l’arôme); lait partiellement écrémé (indication de l’arôme); lait écrémé (indication de l’arôme) additionné de solides du lait; lait partiellement écrémé (indication de l’arôme) additionné de solides du lait | (1) 0,5 % |
| (2) Crème glacée; mélange pour crème glacée; lait glacé; mélange pour lait glacé; sorbet laitier | (2) 0,1 %. Si l’on emploie aussi le mono-oléate polyoxyéthylénique (20) de sorbitan, le total ne doit pas dépasser 0,1 % | ||
| (3) Desserts congelés non normalisés | (3) 0,1 % | ||
| (4) Gâteaux | (4) 0,3 % du poids à l’état sec. Si l’on emploie aussi le monostéarate polyoxyéthylénique (20) de sorbitan, le total ne doit pas dépasser 0,5 % du poids sec | ||
| (5) Enrobages de confiserie non normalisés | (5) 0,5 %. Si l’on emploie aussi un mélange de l’un quelconque des ingrédients suivants : monostéarate polyoxyéthylénique (20) de sorbitan, monostéarate de sorbitan ou tristéarate de sorbitan, le total ne doit pas dépasser 1,0 % | ||
| (6) Bases pour boissons non normalisées; mélanges pour boissons non normalisés | (6) 0,05 % de la boisson. Si l’on emploie aussi le monostéarate de sorbitan, le total ne doit pas dépasser 0,05 % de la boisson | ||
| (7) Mélange imitation de crème en poudre; agents de crémage à l’huile végétale; garnitures fouettées à l’huile végétale; mélange pour garniture à l’huile végétale | (7) 0,4 %. Si l’on emploie aussi le monostéarate polyoxyéthylénique (20) de sorbitan, le monostéarate de sorbitan ou le mono-oléate polyoxyéthylénique (20) de sorbitan, seuls ou mélangés, le total ne doit pas dépasser 0,4 % | ||
| (8) Rafraîchisseurs d’haleine | (8) 200 p.p.m. | ||
| P.5 | Stéarate polyoxyéthylénique (8) | Produits de boulangerie non normalisés | 0,4 % |
| P.6 | Alginate de potassium | Mêmes aliments que pour l’algine | Mêmes limites de tolérance que pour l’algine |
| P.7 | Carragénine potassique | Mêmes aliments que pour la carraghénine | Mêmes limites de tolérance que pour la carraghénine |
| P.8 | Chlorure de potassium | Aliments non normalisés | Bonnes pratiques industrielles |
| P.9 | Citrate de potassium | (1) Fromage à la crème à tartiner; fromage à la crème à tartiner (avec indication des ingrédients ajoutés); fromage fondu (indication de la variété); fromage fondu (indication de la variété) (avec indication des ingrédients ajoutés); préparation de fromage fondu; préparation de fromage fondu (avec indication des ingrédients ajoutés); fromage fondu à tartiner; fromage fondu à tartiner (avec indication des ingrédients ajoutés) | (1) 4,0 %, conformément aux exigences des articles B.08.038, B.08.039, B.08.040, B.08.041, B.08.041.1, B.08.041.2, B.08.041.3 et B.08.041.4 |
| P.10 | Furcelleran de potassium | Mêmes aliments que pour le furcelleran | Mêmes limites de tolérance que pour le furcelleran |
| P.11 | Phosphate dipotassique | (1) Fromage à la crème à tartiner; fromage à la crème à tartiner (avec indication des ingrédients ajoutés); fromage fondu (indication de la variété); fromage fondu (indication de la variété) (avec indication des ingrédients ajoutés); préparation de fromage fondu; préparation de fromage fondu (avec indication des ingrédients ajoutés); fromage fondu à tartiner; fromage fondu à tartiner (avec indication des ingrédients ajoutés) | (1) 3,5 %, conformément aux exigences des articles B.08.038, B.08.039, B.08.040, B.08.041, B.08.041.1, B.08.041.2, B.08.041.3 et B.08.041.4 |
| P.12 | Alginate de propylèneglycol | (1) Ale; bière; sauce vinaigrette; bière légère; liqueur de malt; cornichons à la moutarde; porter; fromage fondu; fromage à la crème fondu; achards (relish); sauce à salade; stout | (1) Bonnes pratiques industrielles |
| (2) Fromage cottage; fromage cottage en crème; crème glacée; mélange pour crème glacée; | (2) 0,5 % | ||
| (3) Sorbet laitier | (3) 0,75 % | ||
| (4) Aliments non normalisés | (4) Bonnes pratiques industrielles | ||
| (5) Margarine réduite en calories | (5) 0,5 % selon les exigences de l’article B.09.017 | ||
| (6) Crème sure | (6) 0,5 % selon les exigences de la disposition B.08.077b)(vii)(A) | ||
| (7) Asperges et conserve; haricots jaunes en conserve; haricots verts en conserve; pois en conserve | (7) 1,0 % selon les exigences de la disposition B.11.002d)(viii)(C) | ||
| (8) Fromage à la crème; fromage à la crème (avec indication des ingrédients ajoutés); fromage à la crème à tartiner; fromage à la crème à tartiner (avec indication des ingrédients ajoutés); fromage fondu à tartiner; fromage fondu à tartiner (avec indication des ingrédients ajoutés); fromage (indication de la variété) conditionné à froid (avec indication des ingrédients ajoutés); préparation de fromage conditionné à froid; préparation de fromage conditionné à froid (avec indication des ingrédients ajoutés) | (8) 0,5 %, conformément aux exigences des articles B.08.035, B.08.037, B.08.038, B.08.039, B.08.041.3, B.08.041.4, B.08.041.6, B.08.041.7 et B.08.041.8 | ||
| P.13 | Ether propylèneglycolique de méthylcellulose | Mêmes aliments que l’hydroxypropyl méthylcellulose | Mêmes limites de tolérance que pour l’hydroxypropyl méthylcellulose |
| P.14 | Esters monoacides gras de propylèneglycol | (1) Mélange pour crème glacée | (1) 0,35 % de la crème glacée faite du mélange |
| (2) Aliments non normalisés | (2) Bonnes pratiques industrielles | ||
| S.1 | Pyrophosphate acide de sodium | (1) Fromage à la crème à tartiner; fromage à la crème à tartiner (avec indication des ingrédients ajoutés); fromage fondu (indication de la variété); fromage fondu (indication de la variété) (avec indication des ingrédients ajoutés); préparation de fromage fondu; préparation de fromage fondu (avec indication des ingrédients ajoutés); fromage fondu à tartiner; fromage fondu à tartiner avec (indication des ingrédients ajoutés) | (1) 3,5 %, conformément aux exigences des articles B.08.038, B.08.039, B.08.040, B.08.041, B.08.041.1, B.08.041.2, B.08.041.3 et B.08.041.4 |
| S.2 | Alginate de sodium | (1) Mêmes aliments que pour l’algine | (1) Mêmes limites de tolérance que pour l’algine |
| (2) Gros cristaux de sel | (2) 15 p.p.m. | ||
| (3) Lustre de poisson congelé | (3) Bonnes pratiques industrielles | ||
| S.2A | Phosphate double d’aluminium et de sodium | (1) Fromage à la crème à tartiner; fromage à la crème à tartiner avec (indication des ingrédients ajoutés); fromage fondu (indication de la variété); fromage fondu (indication de la variété) (avec indication des ingrédients ajoutés); préparation de fromage fondu; préparation de fromage fondu (avec indication des ingrédients ajoutés); fromage fondu à tartiner; fromage fondu à tartiner (avec indication des ingrédients ajoutés) | (1) 3,5 %, conformément aux exigences des articles B.08.038, B.08.039, B.08.040, B.08.041, B.08.041.1, B.08.041.2, B.08.041.3 et B.08.041.4 |
| S.3 | Carboxyméthylcellulose sodique | (1) Achards (relish); cornichons à la moutarde; crème; lait écrémé (indication de l’arôme); lait écrémé (indication de l’arôme) additionné de solides du lait; lait (indication de l’arôme); lait partiellement écrémé (indication de l’arôme); lait partiellement écrémé (indication de l’arôme) additionné de solides du lait; sauce à salade; sauce vinaigrette | (1) Bonnes pratiques industrielles |
| (2) Fromage cottage; fromage cottage en crème; crème glacée; mélange pour crème glacée; lait glacé; mélange pour lait glacé | (2) 0,5 % | ||
| (3) Sorbet laitier | (3) 0,75 % | ||
| (4) Aliments non normalisés | (4) Bonnes pratiques industrielles | ||
| (5) Lustre de poisson congelé | (5) Bonnes pratiques industrielles | ||
| (6) Fromage (indication de la variété) fondu; fromage (indication de la variété) fondu (avec indication des ingrédients ajoutés); préparation de fromage fondu; préparation de fromage fondu (avec indication des ingrédients ajoutés) | (6) 0,5 % | ||
| (7) Fromage à la crème; fromage à la crème (avec indication des ingrédients ajoutés); fromage à la crème à tartiner; fromage à la crème à tartiner (avec indication des ingrédients ajoutés); fromage fondu à tartiner; fromage fondu à tartiner (avec indication des ingrédients ajoutés); fromage (indication de la variété) conditionné à froid (avec indication des ingrédients ajoutés); préparation de fromage conditionné à froid; préparation de fromage conditionné à froid (avec indication des ingrédients ajoutés) | (7) 0,5 %, conformément aux exigences des articles B.08.035, B.08.037, B.08.038, B.08.039, B.08.041.3, B.08.041.4, B.08.041.6, B.08.041.7 et B.08.041.8 | ||
| S.4 | Carraghénine sodique | Mêmes aliments que pour la carraghénine | Mêmes limites de tolérance que pour la carraghénine |
| S.5 | Glycolate sodique de cellulose | Mêmes aliments que pour la carboxyméthylcellulose sodique | Mêmes limites de tolérance que pour la carboxyméthylcellulose sodique |
| S.6 | Citrate de sodium | (1) Fromage à la crème à tartiner; fromage à la crème à tartiner (avec indication des ingrédients ajoutés); fromage fondu (indication de la variété); fromage fondu (indication de la variété) (avec indication des ingrédients ajoutés); préparation de fromage fondu; préparation de fromage fondu (avec indication des ingrédients ajoutés); fromage fondu à tartiner; fromage fondu à tartiner (avec indication des ingrédients ajoutés) | (1) 4,0 %, conformément aux exigences des articles B.08.038, B.08.039, B.08.040, B.08.041, B.08.041.1, B.08.041.2, B.08.041.3 et B.08.041.4 |
| (2) Lait évaporé; lait écrémé évaporé ou lait écrémé concentré; lait évaporé partiellement écrémé ou lait concentré partiellement écrémé | (2) 0,1 % seul ou associé à du phosphate disodique | ||
| (3) Crème glacée; mélange pour crème glacée; lait glacé; mélange pour lait glacé | (3) 0,5 % | ||
| (4) Sorbet laitier | (4) 0,75 % | ||
| S.7 | Furcelleran sodique | Mêmes aliments que pour le furcelleran | Mêmes limites de tolérance que pour le furcelleran |
| S.8 | Gluconate de sodium | (1) Fromage à la crème à tartiner; fromage à la crème à tartiner (avec indication des ingrédients ajoutés); fromage fondu (indication de la variété); fromage fondu (indication de la variété) (avec indication des ingrédients ajoutés); préparation de fromage fondu; préparation de fromage fondu (avec indication des ingrédients ajoutés); fromage fondu à tartiner; fromage fondu à tartiner (avec indication des ingrédients ajoutés) | (1) 4,0 %, conformément aux exigences des articles B.08.038, B.08.039, B.08.040, B.08.041, B.08.041.1, B.08.041.2, B.08.041.3 et B.08.041.4 |
| S.9 | Hexamétaphosphate de sodium | (1) Cornichons à la moutarde; achards (relish); | (1) Bonnes pratiques industrielles |
| (2) Crème glacée; mélange pour crème glacée; lait glacé; mélange pour lait glacé | (2) 0,5 % | ||
| (3) Préparations pour nourrissons | (3) 0,05 % de la préparation pour nourrissons prête à consommer | ||
| (4) Sorbet laitier | (4) 0,75 % | ||
| (5) Aliments non normalisés | (5) Bonnes pratiques industrielles | ||
| (6) Fromage à la crème à tartiner; fromage à la crème à tartiner (avec indication des ingrédients ajoutés); fromage fondu (indication de la variété); fromage fondu (indication de la variété) (avec indication des ingrédients ajoutés); préparation de fromage fondu; préparation de fromage fondu (avec indication des ingrédients ajoutés); fromage fondu à tartiner; fromage fondu à tartiner (avec indication des ingrédients ajoutés) | (6) 3,5 %, conformément aux exigences des articles B.08.038, B.08.039, B.08.040, B.08.041, B.08.041.1, B.08.041.2, B.08.041.3 et B.08.041.4 | ||
| (7) Mélange de poisson et de viande préparés visé à l’alinéa B.21.006n) | (7) 0,1 % | ||
| S.11 | Phosphate disodique | (1) Achards (relish); cornichons à la moutarde; lait écrémé (indication de l’arôme); lait écrémé (indication de l’arôme) additionné de solides du lait; lait (indication de l’arôme); lait partiellement écrémé (indication de l’arôme); lait partiellement écrémé (indication de l’arôme) additionné de solides du lait | (1) Bonnes pratiques industrielles |
| (2) Fromage cottage; fromage cottage en crème | (2) 0,5 % | ||
| (3) Lait évaporé; lait écrémé évaporé ou lait écrémé concentré; lait évaporé partiellement écrémé ou lait concentré partiellement écrémé | (3) 0,1 % seul ou associé à du citrate de sodium | ||
| (4) Crème sure | (4) 0,05 % selon les exigences de la disposition B.08.077b)(vii)(C) | ||
| (5) Aliments non normalisés | (5) Bonnes pratiques industrielles | ||
| (6) Fromage à la crème à tartiner; fromage à la crème à tartiner (avec indication des ingrédients ajoutés); fromage fondu (indication de la variété); fromage fondu (indication de la variété) (avec indication des ingrédients ajoutés); préparation de fromage fondu; préparation de fromage fondu (avec indication des ingrédients ajoutés); fromage fondu à tartiner; fromage fondu à tartiner (avec indication des ingrédients ajoutés) | (6) 3,5 %, conformément aux exigences des articles B.08.038, B.08.039, B.08.040, B.08.041, B.08.041.1, B.08.041.2, B.08.041.3 et B.08.041.4 | ||
| S.12 | Phosphate monosodique | (1) Fromage à la crème à tartiner; fromage à la crème à tartiner (avec indication des ingrédients ajoutés); fromage fondu (indication de la variété); fromage fondu (indication de la variété) (avec indication des ingrédients ajoutés); préparation de fromage fondu; préparation de fromage fondu (avec indication des ingrédients ajoutés); fromage fondu à tartiner; fromage fondu à tartiner (avec indication des ingrédients ajoutés) | (1) 3,5 %, conformément aux exigences des articles B.08.038, B.08.039, B.08.040, B.08.041, B.08.041.1, B.08.041.2, B.08.041.3 et B.08.041.4 |
| (2) Aliments non normalisés | (2) Bonnes pratiques industrielles | ||
| S.13 | Phosphate trisodique | (1) Fromage à la crème à tartiner; fromage à la crème à tartiner (avec indication des ingrédients ajoutés); fromage fondu (indication de la variété); fromage fondu (indication de la variété) (avec indication des ingrédients ajoutés); préparation de fromage fondu; préparation de fromage fondu (avec indication des ingrédients ajoutés); fromage fondu à tartiner; fromage fondu à tartiner (avec indication des ingrédients ajoutés) | (1) 3,5 %, conformément aux exigences des articles B.08.038, B.08.039, B.08.040, B.08.041, B.08.041.1, B.08.041.2, B.08.041.3 et B.08.041.4 |
| (2) Aliments non normalisés | (2) Bonnes pratiques industrielles | ||
| S.14 | Tartrate double de potassium et de sodium | (1) Fromage à la crème à tartiner; fromage à la crème à tartiner (avec indication des ingrédients ajoutés); fromage fondu (indication de la variété); fromage fondu (indication de la variété) (avec indication des ingrédients ajoutés); préparation de fromage fondu; préparation de fromage fondu (avec indication des ingrédients ajoutés); fromage fondu à tartiner; fromage fondu à tartiner (avec indication des ingrédients ajoutés) | (1) 4,0 %, conformément aux exigences des articles B.08.038, B.08.039, B.08.040, B.08.041, B.08.041.1, B.08.041.2, B.08.041.3 et B.08.041.4 |
| (2) Aliments non normalisés | (2) Bonnes pratiques industrielles | ||
| S.15 | Pyrophosphate tétrasodique | (1) Fromage à la crème à tartiner; fromage à la crème à tartiner (avec indication des ingrédients ajoutés); fromage fondu (indication de la variété); fromage fondu (indication de la variété) (avec indication des ingrédients ajoutés); préparation de fromage fondu; préparation de fromage fondu (avec indication des ingrédients ajoutés); fromage fondu à tartiner; fromage fondu à tartiner (avec indication des ingrédients ajoutés) | (1) 3,5 %, conformément aux exigences des articles B.08.038, B.08.039, B.08.040, B.08.041, B.08.041.1, B.08.041.2, B.08.041.3 et B.08.041.4 |
| (2) Aliments non normalisés | (2) Bonnes pratiques industrielles | ||
| (3) Mélange de poisson et de viande préparés visé à l’alinéa B.21.006n) | (3) 0,1 % | ||
| S.15A | Stéaroyl-2-lactylate de sodium | (1) Glaces et mélanges à glaces | (1) 0,4 % du poids des ingrédients secs |
| (2) Garnitures et mélanges pour garnitures | (2) 0,5 % du poids des ingrédients secs | ||
| (3) Poudings et mélanges à poudings | (3) 0,2 % du produit fini | ||
| (4) Substituts de crème sure (aigre) | (4) 1,0 % du poids des ingrédients secs | ||
| (5) Agents de crémage à l’huile végétale | (5) 2,0 % du poids des ingrédients secs | ||
| (6) Mélange de pâte à frire | (6) 0,75 % du poids des ingrédients secs | ||
| (7) Spiritueux à base de crème non normalisés | (7) 0,35 % dans le produit fini | ||
| (8) Sauce à salade; sauce vinaigrette | (8) 0,4 % du produit fini | ||
| (9) Soupes | (9) 0,2 % du produit fini | ||
| S.16 | Tartrate de sodium | (1) Fromage à la crème à tartiner; fromage à la crème à tartiner (avec indication des ingrédients ajoutés); fromage fondu (indication de la variété); fromage fondu (indication de la variété) (avec indication des ingrédients ajoutés); préparation de fromage fondu; préparation de fromage fondu (avec indication des ingrédients ajoutés); fromage fondu à tartiner; fromage fondu à tartiner (avec indication des ingrédients ajoutés) | (1) 4,0 %, conformément aux exigences des articles B.08.038, B.08.039, B.08.040, B.08.041, B.08.041.1, B.08.041.2, B.08.041.3 et B.08.041.4 |
| S.16A | Tripolyphosphate de sodium | Mélange de poisson et de viande préparés visé à l’alinéa B.21.006n) | 0,1 % |
| S.18 | Monostéarate de sorbitan | (1) Mélange imitation de crème en poudre; agents de crémage à l’huile végétale; garnitures fouettées à l’huile végétale; mélange pour garnitures à l’huile végétale | (1) 0,4 %. Si l’on emploie aussi le tristéarate polyoxyéthylénique (20) de sorbitan, le polysorbate (60) ou le mono-oléate polyoxyéthylénique (20) de sorbitan, soit séparément, soit ensemble, le total ne doit pas dépasser 0,4 %, sauf que, dans les garnitures fouettées renfermant de l’huile végétale, on peut employer une combinaison de monostéarate de sorbitan et de polysorbate (60) de plus de 0,4 %, si la proportion de monostéarate de sorbitan ne dépasse pas 0,27 % et celle du polysorbate (60) ne dépasse pas 0,77 % du poids de la garniture fouettée renfermant de l’huile végétale |
| (2) Gâteaux; mélanges à gâteaux | (2) 0,6 % du poids à l’état sec. Si l’on emploie aussi le monostéarate polyoxyéthylénique (20) de sorbitan le total ne doit pas dépasser 0,7 % du poids à l’état sec | ||
| (3) Enrobages de confiserie non normalisés et produits de confiserie moulés non normalisés utilisés comme confiserie ou pour la cuisson | (3) 1,0 %. Si l’on emploie aussi un mélange de l’un quelconque des ingrédients suivants : monostéarate polyoxyéthylénique (20) de sorbitan, tristéarate polyoxyéthylénique (20) de sorbitan ou tristéarate de sorbitan, le total ne doit pas dépasser 1,0 % | ||
| (4) Glaces à gâteaux; mélanges pour glaces à gâteaux | (4) 0,5 % de la glace à gâteau finie. Si l’on emploie aussi le mono-oléate polyoxyéthylénique (20) de sorbitan ou le monostéarate polyoxyéthylénique (20) de sorbitan, seuls ou mélangés, le total ne doit pas dépasser 0,5 % de la glace à gâteau finie | ||
| (5) Bases pour boissons non normalisées; mélanges pour boissons non normalisés | (5) 0,05 % de la boisson. Si l’on emploie aussi le mono-oléate polyoxyéthylénique (20) de sorbitan, le total ne doit pas dépasser 0,05 % de la boisson. Si l’on emploie aussi le monostéarate polyoxyéthylénique (20) de sorbitan, le total ne doit pas dépasser 0,05 % de la boisson. Si l’on emploie aussi le tristéarate polyoxyéthylénique (20) de sorbitan, le total ne doit pas dépasser 0,05 % de la boisson | ||
| (6) Bases ou mélanges secs pour soupes | (6) 250 p.p.m. dans la soupe prête à consommer | ||
| (7) Levure sèche | (7) 1,5 % (les résidus de monostéarate de sorbitan dans le pain et les autres produits de boulangerie au levain ne doivent pas dépasser 0,05 %). | ||
| (8) Produits de chocolat | (8) 1,0 % | ||
| (9) Poudings | (9) 0,5 % | ||
| S.18A | Trioléate de sorbitan | Boyaux de saucisse | 0,35 % de boyau |
| S.18B | Tristéarate de sorbitan | (1) Margarine; shortening | (1) 1 % |
| (2) Enrobages de confiserie non normalisés et produits de confiserie moulés non normalisés utilisés comme confiserie ou pour la cuisson | (2) 1 %, si l’on emploie aussi un mélange de n’importe quel des ingrédients suivants : monostéarate polyoxyéthylénique (20) de sorbitan, tristéarate polyoxyéthylénique (20) de sorbitan ou monostéarate de sorbitan, le total ne doit pas dépasser 1 % | ||
| (3) Mélange pour crème glacée | (3) 0,035 % de la crème glacée faite du mélange | ||
| (4) Desserts congelés non normalisés | (4) 0,035 % | ||
| S.19 | Monoglycéryl- citrate de stéaryle | Shortening | Bonnes pratiques industrielles |
| S.20 | Esters saccharosiques d’acides gras | (1) Préparations colorantes de caroténoïdes | (1) 1,5 % |
| (2) Confiseries non normalisées; enrobages de confiserie non normalisés | (2) 0,5 % | ||
| T.2 | [Abrogé, DORS/2006-91, art. 5] | ||
| T.3 | Gomme adragante | (1) Sauce vinaigrette; cornichons à la moutarde; sauce à salade; achards (relish) | (1) Bonnes pratiques industrielles |
| (2) Fromage cottage; fromage cottage en crème; crème glacée; mélange pour crème glacée; lait glacé; mélange pour lait glacé | (2) 0,5 % | ||
| (3) Sorbet laitier | (3) 0,75 % | ||
| (4) Caviar de lump | (4) 1,0 % | ||
| (5) Aliments non normalisés | (5) Bonnes pratiques industrielles | ||
| (6) Margarine réduite en calories | (6) 0,5 % selon les exigences de l’article B.09.017 | ||
| (7) Fromage à la crème; fromage à la crème (avec indication des ingrédients ajoutés); fromage à la crème à tartiner; fromage à la crème à tartiner (avec indication des ingrédients ajoutés); fromage (indication de la variété) conditionné à froid (avec indication des ingrédients ajoutés); préparation de fromage conditionné à froid; préparation de fromage conditionné à froid (avec indication des ingrédients ajoutés); fromage fondu à tartiner; fromage fondu à tartiner (avec indication des ingrédients ajoutés) | (7) 0,5 %, conformément aux exigences des articles B.08.035, B.08.037, B.08.038, B.08.039, B.08.041.3, B.08.041.4, B.08.041.6, B.08.041.7 et B.08.041.8 | ||
| (8) Poisson et viande préparés déchiquetés, sauf le caviar de lompe; poisson de salaison et chair de poisson de salaison déchiquetés (Titre 21) | (8) 0,75 % | ||
| X.1 | Gomme xanthane | (1) Sauce vinaigrette; sauce à salade; aliments non normalisés | (1) Bonnes pratiques industrielles |
| (2) Fromage cottage; fromage cottage en crème | (2) 0,5 %. Si l’on emploie aussi d’autres stabilisants, le total ne doit pas dépasser 0,5 % | ||
| (3) Margarine réduite en calories | (3) 0,5 % selon les exigences de l’article B.09.017 | ||
| (4) Fromage à la crème; fromage à la crème (avec indication des ingrédients ajoutés); fromage à la crème à tartiner; fromage à la crème à tartiner (avec indication des ingrédients ajoutés); fromage fondu à tartiner; fromage fondu à tartiner (avec indication des ingrédients ajoutés); fromage (indication de la variété) conditionné à froid (avec indication des ingrédients ajoutés); préparation de fromage conditionné à froid; préparation de fromage conditionné à froid (avec indication des ingrédients ajoutés) | (4) 0,5 %, conformément aux exigences des articles B.08.035, B.08.037, B.08.038, B.08.039, B.08.041.3, B.08.041.4, B.08.041.6, B.08.041.7 et B.08.041.8 | ||
| (5) Cornichons à la moutarde; achards (relish) | (5) 0,1 % | ||
| (6) Mélange pour crème glacée | (6) 0,1 %. Si l’on emploie aussi de la cellulose mycrocristalline et d’autres stabilisants, le total ne doit pas dépasser 0,5 % | ||
| (7) Mélange pour lait glacé | (7) 0,1 %. Si l’on emploi aussi d’autres stabilisants, le total ne doit pas dépasser 0,5 % | ||
| (8) Sorbet laitier | (8) 0,1 %. Si l’on emploie aussi d’autres stabilisants, le total ne doit pas dépasser 0,75 % | ||
| (9) Crème à fouetter thermisée à une chaleur supérieure à 100 °C | (9) 0,02 % | ||
- DORS/78-403, art. 5(F) à 13(F), 14 à 16, 17(F) à 21(F) et 22
- DORS/78-656, art. 14 et 15
- DORS/78-876, art. 2
- DORS/79-660, art. 5 à 10
- DORS/79-752, art. 6
- DORS/80-501, art. 4
- DORS/81-60, art. 7 à 10
- DORS/81-565, art. 4 et 5
- DORS/81-934, art. 2 à 6
- DORS/82-383, art. 9
- DORS/82-1071, art. 9 à 16
- DORS/83-932, art. 3 et 4
- DORS/84-300, art. 50(A)
- DORS/84-602, art. 2
- DORS/84-801, art. 3
- DORS/85-179, art. 2 à 4
- DORS/85-623, art. 3(A)
- DORS/88-99, art. 3
- DORS/88-419, art. 2 et 3
- DORS/90-87, art. 9
- DORS/91-710, art. 1
- DORS/92-64, art. 1
- DORS/92-93, art. 2
- DORS/92-344, art. 1
- DORS/93-466, art. 3 et 4
- DORS/94-38, art. 2
- DORS/94-567, art. 2
- DORS/94-689, art. 2(F)
- DORS/96-160, art. 2
- DORS/96-376, art. 1
- DORS/96-497, art. 1
- DORS/96-499, art. 1
- DORS/97-29, art. 1
- DORS/97-263, art. 4 à 10
- DORS/98-580, art. 1(F)
- DORS/2000-353, art. 7(F)
- DORS/2005-316, art. 1
- DORS/2005-395, art. 1(F), 2 à 4 et 5(F)
- DORS/2006-91, art. 4 et 5
- DORS/2007-75, art. 4 à 6
- DORS/2007-76, art. 1 et 2
- DORS/2010-41, art. 9(A)
- DORS/2010-94, art. 8(A) et 9(A)
- DORS/2010-142, art. 9, 10(F), 11 à 13, 14(F), 15(F) et 16
- DORS/2011-235, art. 3 à 6 et 16(F)
- DORS/2011-278, art. 11 et 12(A)
- DORS/2012-43, art. 21 à 25, 26(F), 27 et 28
- DORS/2012-104, art. 3, 4(F), 5 à 9 et 20(F)
- DORS/2012-106, art. 1
TABLEAU V
Additifs alimentaires autorisés comme enzymes dans les aliments
| Article | Colonne I | Colonne II | Colonne III | Colonne IV |
|---|---|---|---|---|
| Additifs | Source permise | Permis dans ou sur | Limites de tolérance | |
| A.01 | α-Acétolactate décarboxylase | Bacillus subtilis ToC46 (pUW235) | (1) Moût de bière | (1) Bonnes pratiques industrielles |
| (2) Moût de distillerie | (2) Bonnes pratiques industrielles | |||
| A.02 | Aminopeptidase | Lactococcus lactis | (1) Fromage cheddar; fromage (indication de la variété) | (1) Bonnes pratiques industrielles |
| (2) Préparations aromatisantes à base de produits laitiers | (2) Bonnes pratiques industrielles | |||
| (3) Protéines hydrolysées d’origine animale, végétale ou provenant du lait | (3) Bonnes pratiques industrielles | |||
| A.1 | Amylase | Aspergillus niger var.; Aspergillus oryzae var.; Bacillus subtilis var.; Rhizopus oryzae var.; Malt d’orge | (1) Ale; bière; bière légère; liqueur de malt; porter; stout | (1) Bonnes pratiques industrielles |
| (2) Farine; farine de blé entier; pain | (2) Bonnes pratiques industrielles | |||
| (3) Cidre; vin | (3) Bonnes pratiques industrielles | |||
| (4) Sirop au chocolat | (4) Bonnes pratiques industrielles | |||
| (5) Moût de distillerie | (5) Bonnes pratiques industrielles | |||
| (6) Céréales à déjeuner sèches à saveur de malt | (6) Bonnes pratiques industrielles | |||
| (7) Jus de fruits non concentrés | (7) Bonnes pratiques industrielles | |||
| (8) Céréales à déjeuner précuites (instantanées) | (8) Bonnes pratiques industrielles | |||
| (9) Amidon utilisé dans la production des dextrines, du maltose, du dextrose, du glucose (sirop de glucose) ou de solides de glucose (sirop de glucose déshydraté) | (9) Bonnes pratiques industrielles | |||
| (10) Produits de boulangerie non normalisés | (10) Bonnes pratiques industrielles | |||
| (11) Boissons végétales | (11) Bonnes pratiques industrielles | |||
| (12) Produits céréaliers pour bébés | (12) Bonnes pratiques industrielles | |||
| Aspergillus niger STz18-9 (pHUda7) | (1) Ale; bière; bière légère; liqueur de malt; porter; stout | (1) Bonnes pratiques industrielles | ||
| (2) Moût de distillerie | (2) Bonnes pratiques industrielles | |||
| (3) Amidon utilisé dans la production des dextrines, du dextrose, du glucose (sirop de glucose) ou de solides de glucose (sirop de glucose déshydraté), du maltose | (3) Bonnes pratiques industrielles | |||
| Bacillus amyloliquefaciens EBA 20 (pUBH2); Bacillus licheniformis; Bacillus licheniformis BML 592 (pAmyAmp); Bacillus licheniformis BML 730 (pAmyAmp); Bacillus licheniformis LA 57 (pDN1981); Bacillus licheniformis LAT8 (pLAT3); Bacillus licheniformis LiH 1159 (pLiH1108); Bacillus licheniformis LiH 1464 (pLiH1346); Bacillus licheniformis PL 1303 (pPL1117); Bacillus licheniformis MOL2083 (pCA164-LE399) | (1) Moût de distillerie | (1) Bonnes pratiques industrielles | ||
| (2) Amidon utilisé dans la production des dextrines, du maltose, du dextrose, du glucose (sirop de glucose) ou de solides de glucose (sirop de glucose déshydraté) | (2) Bonnes pratiques industrielles | |||
| (3) Moût de bière | (3) Bonnes pratiques industrielles | |||
| Bacillus licheniformis 3253 (plCatH-3253); Bacillus licheniformis 3266 (plCatH-3266ori1); Bacillus stearothermophilus; Bacillus subtilis B1.109 (pCPC800) | (1) Amidon utilisé dans la production des dextrines, du maltose, du dextrose, du glucose (sirop de glucose) ou de solides de glucose (sirop de glucose déshydraté) | (1) Bonnes pratiques industrielles | ||
| (2) Moût de distillerie | (2) Bonnes pratiques industrielles | |||
| (3) Moût de bière | (3) Bonnes pratiques industrielles | |||
| (4) Farine; farine de blé entier; pain | (4) Bonnes pratiques industrielles | |||
| (5) Produits de boulangerie non normalisés | (5) Bonnes pratiques industrielles | |||
| Bacillus subtilis B1.109 (pCPC720) (ATCC 39, 705) | (1) Amidon utilisé dans la production des dextrines, du maltose, du dextrose, du glucose (sirop de glucose) ou de solides de glucose (sirop de glucose déshydraté) | (1) Bonnes pratiques industrielles | ||
| A.2 | Amylase maltogène | Bacillus subtilis BRG-1 (pBRG1); Bacillus subtilis DN1413 (pDN1413); Bacillus subtilis LFA 63 (pLFA63); Bacillus subtilis RB-147 (pRB147) | (1) Amidon utilisé dans la production des dextrines, du maltose, du dextrose, du glucose, (sirop de glucose) ou de solides de glucose (sirop de glucose déshydraté) | (1) Bonnes pratiques industrielles |
| (2) Farine; farine de blé entier; pain | (2) Bonnes pratiques industrielles | |||
| (3) Produits de boulangerie non normalisés | (3) Bonnes pratiques industrielles | |||
| A.3 | Asparaginase | Aspergillus niger ASP72; Aspergillus oryzae (pCaHj621/BECh2#10) | (1) Farine; farine de blé entier; pain | (1) Bonnes pratiques industrielles |
| (2) Aliments non normalisés | (2) Bonnes pratiques industrielles | |||
| B.1 | Présure de bovin | Extrait aqueux du 4e (véritable) estomac de bovins, de moutons et de chèvres adultes | Fromage à la crème; fromage à la crème à tartiner; fromage à la crème à tartiner (avec indication des ingrédients ajoutés); fromage à la crème (avec indication des ingrédients ajoutés); fromage cheddar; fromage cottage; fromage (indication de la variété) | Bonnes pratiques industrielles |
| B.2 | Broméline | Les ananas Ananas comosus et Ananas bracteatus | (1) Ale; bière; bière légère; liqueur de malt; porter; stout | (1) Bonnes pratiques industrielles |
| (2) Farine; farine de blé entier; pain | (2) Bonnes pratiques industrielles | |||
| (3) Boyaux de saucisse | (3) Bonnes pratiques industrielles | |||
| (4) Protéine hydrolysée d’origine animale, végétale ou provenant du lait | (4) Bonnes pratiques industrielles | |||
| (5) Pièces de viande | (5) Bonnes pratiques industrielles | |||
| (6) Produits pour attendrir la viande | (6) Bonnes pratiques industrielles | |||
| (7) Marinade employée dans la salaison de parties de boeuf | (7) Bonnes pratiques industrielles selon l’alinéa B.14.009g) | |||
| (8) Gaufrettes sucrées, gaufres, crêpes | (8) Bonnes pratiques industrielles | |||
| C.1 | Catalase | Aspergillus niger var.; Micrococcus lysodeikticus; Foie de boeuf (Bos taurus) | (1) Boissons préparées (gazeuses et non gazeuses) | (1) Bonnes pratiques industrielles |
| (2) Blanc d’oeuf liquide (albumen liquide), jaune d’oeuf liquide ou oeuf entier liquide, destinés au séchage | (2) Bonnes pratiques industrielles | |||
| (3) Petit-lait liquide traité au peroxyde d’hydrogène, conformément à l’article H.1, du tableau VIII | (3) Bonnes pratiques industrielles | |||
| C.2 | Cellulase | Aspergillus niger var. | (1) Moût de distillerie | (1) Bonnes pratiques industrielles |
| (2) Concentré de café liquide | (2) Bonnes pratiques industrielles | |||
| (3) Extraits d’épices; préparations aromatisantes naturelles et colorants | (3) Bonnes pratiques industrielles | |||
| Trichoderma reesei QM 9414 | (1) Jus de fruits non concentrés | (1) Bonnes pratiques industrielles | ||
| (2) Feuilles de thé destinées à la production de solides de thé | (2) Bonnes pratiques industrielles | |||
| C.3 | Chymosine | |||
| (i) Chymosine A | Escherichia coli K-12, GE81 (pPFZ87A) | (1) Fromage cheddar; fromage (indication de la variété); fromage cottage; fromage à la crème; fromage à la crème (avec indication des ingrédients ajoutés); fromage à la crème à tartiner; fromage à la crème à tartiner (avec indication des ingrédients ajoutés); crème sure | (1) Bonnes pratiques industrielles | |
| (2) Produits pour desserts à base de lait non normalisés | (2) Bonnes pratiques industrielles | |||
| (ii) Chymosine B | Aspergillus niger var. awamori, GCC0349 (pGAMpR); Kluyveromyces marxianus var. lactis, DS1182 (pKS105) | (1) Fromage cheddar; fromage (indication de la variété); fromage cottage; fromage à la crème; fromage à la crème (avec indication des ingrédients ajoutés); fromage à la crème à tartiner; fromage à la crème à tartiner (avec indication des ingrédients ajoutés); crème sure | (1) Bonnes pratiques industrielles | |
| (2) Produits pour desserts à base de lait non normalisés | (2) Bonnes pratiques industrielles | |||
| F.1 | Ficine | Latex de figuier (Ficus sp.) | (1) Ale; bière; bière légère; liqueur de malt; porter; stout | (1) Bonnes pratiques industrielles |
| (2) Boyaux de saucisse | (2) Bonnes pratiques industrielles | |||
| (3) Protéine hydrolysée d’origine animale, végétale ou provenant du lait | (3) Bonnes pratiques industrielles | |||
| (4) Pièces de viande | (4) Bonnes pratiques industrielles | |||
| (5) Produits pour attendrir la viande | (5) Bonnes pratiques industrielles | |||
| (6) Marinade employée dans la salaison de parties de boeuf | (6) Bonnes pratiques industrielles selon l’alinéa B.14.009g) | |||
| G.1 | Glucoamylase (Amyloglucosidase; maltase) | Aspergillus niger var.; Aspergillus oryzae var.; Rhizopus oryzae var. | (1) Ale; bière; bière légère; liqueur de malt; porter; stout | (1) Bonnes pratiques industrielles |
| (2) Farine; farine de blé entier; pain | (2) Bonnes pratiques industrielles | |||
| (3) Sirop au chocolat | (3) Bonnes pratiques industrielles | |||
| (4) Moût de distillerie | (4) Bonnes pratiques industrielles | |||
| (5) Céréales à déjeuner précuites (instantanées) | (5) Bonnes pratiques industrielles | |||
| (6) Amidon employé dans la production des dextrines, du maltose, du dextrose, du glucose (sirop de glucose) ou de solides de glucose (sirop de glucose déshydraté) | (6) Bonnes pratiques industrielles | |||
| (7) Produits de boulangerie non normalisés | (7) Bonnes pratiques industrielles | |||
| Aspergillus niger STz18-9 (pHUda7) | (1) Ale; bière; bière légère; liqueur de malt; porter; stout | (1) Bonnes pratiques industrielles | ||
| (2) Moût de distillerie | (2) Bonnes pratiques industrielles | |||
| (3) Amidon utilisé dans la production des dextrines, du dextrose, du glucose (sirop de glucose) ou de solides de glucose (sirop de glucose déshydraté), du maltose | (3) Bonnes pratiques industrielles | |||
| Rhizopus niveus var. | (1) Moût de distillerie | (1) Bonnes pratiques industrielles | ||
| (2) Moût servant à la fabrication du vinaigre | (2) Bonnes pratiques industrielles | |||
| Rhizopus delemar var.; Multiplici sporus | (1) Moût de bière | (1) Bonnes pratiques industrielles | ||
| (2) Moût de distillerie | (2) Bonnes pratiques industrielles | |||
| (3) Moût servant à la fabrication du vinaigre | (3) Bonnes pratiques industrielles | |||
| (4) Amidon employé dans la production des dextrines, du maltose, du dextrose, du glucose (sirop de glucose) ou de solides de glucose (sirop de glucose déshydraté) | (4) Bonnes pratiques industrielles | |||
| G.2 | Glucanase | Aspergillus niger var.; Bacillus subtilis var. | (1) Ale; bière; bière légère; liqueur de malt; porter; stout | (1) Bonnes pratiques industrielles |
| (2) Maïs pour égrenage | (2) Bonnes pratiques industrielles | |||
| (3) Moût de distillerie | (3) Bonnes pratiques industrielles | |||
| (4) Moût servant à la fabrication du vinaigre | (4) Bonnes pratiques industrielles | |||
| (5) Produits de boulangerie non normalisés | (5) Bonnes pratiques industrielles | |||
| Humicola insolens var. | (1) Ale; bière; bière légère; liqueur de malt; porter; stout | (1) Bonnes pratiques industrielles | ||
| (2) Moût de distillerie | (2) Bonnes pratiques industrielles | |||
| G.3 | Glucose-oxydase | Aspergillus niger var.; Aspergillus oryzae Mtl-72 (pHUda107) | (1) Boissons préparées (gazeuses et non gazeuses) | (1) Bonnes pratiques industrielles |
| (2) Blanc d’oeuf liquide (albumen liquide), jaune d’oeuf liquide ou oeuf entier liquide, destinés au séchage | (2) Bonnes pratiques industrielles selon les alinéas B.22.034b), B.22.035b) et B.22.036b) | |||
| (3) Farine; farine de blé entier; pain | (3) Bonnes pratiques industrielles | |||
| (4) Produits de boulangerie non normalisés | (4) Bonnes pratiques industrielles | |||
| G.4 | Glucose-isomérase | Bacillus coagulans var.; Streptomyces olivochromogenes var.; Actinoplanes missouriensis var.; Streptomyces olivaceus var.; Microbacterium arborescens NRRL B-11022; Streptomyces murinus DSM 3252; Streptomyces rubiginosus ATCC No. 21,175; Streptomyces rubiginosus SYC 5406 (pSYC5239) | (1) Glucose (sirop de glucose) à être partiellement ou complètement transformé en fructose par isomérisation | (1) Bonnes pratiques industrielles |
| H.1 | Hemicellulase | Bacillus subtilis var. | (1) Moût de distillerie | (1) Bonnes pratiques industrielles |
| (2) Concentré de café liquide | (2) Bonnes pratiques industrielles | |||
| (3) Moût destiné à la fabrication du vinaigre | (3) Bonnes pratiques industrielles | |||
| I.01 | Inulinase | Aspergillus niger var. Tieghem | Inuline | Bonnes pratiques industrielles |
| I.1 | Invertase | Aspergillus japonicus | Saccharose utilisé dans la production de fructo-oligosaccharides | Bonnes pratiques industrielles |
| Saccharomyces sp. | (1) Confiseries non normalisées avec centre mou ou liquide | (1) Bonnes pratiques industrielles | ||
| (2) Produits de boulangerie non normalisés | (2) Bonnes pratiques industrielles | |||
| L.1 | Lactase | Aspergillus niger var.; Aspergillus oryzae var.; Kluyveromyces fragilis (Kluyveromyces Marxianus var. marxianus); Kluyveromyces lactis (Kluyveromyces Marxianus var. lactis); Saccharomyces sp. | (1) Produits enzymatiques pour la réduction du lactose | (1) Bonnes pratiques industrielles |
| (2) Lait destiné à la fabrication du mélange pour la crème glacée | (2) Bonnes pratiques industrielles | |||
| (3) Farine; farine de blé entier; pain | (3) Bonnes pratiques industrielles | |||
| (4) Lait (indication de l’arôme); lait écrémé (indication de l’arôme); lait partiellement écrémé (indication de l’arôme); lait malté (indication de l’arôme); lait écrémé additionné de solides du lait (indication de l’arôme); lait partiellement écrémé additionné de solides du lait (indication de l’arôme); | (4) Bonnes pratiques industrielles | |||
| Extraits acellulaires de Candida pseudotropicalis | (1) Lait destiné à la fabrication du mélange pour la crème glacée | (1) Bonnes pratiques industrielles | ||
| (2) Yogourt | (2) Bonnes pratiques industrielles | |||
| (3) Petit-lait | (3) Bonnes pratiques industrielles | |||
| (4) Lait (indication de l’arôme); lait écrémé (indication de l’arôme); lait partiellement écrémé (indication de l’arôme); lait malté (indication de l’arôme); lait écrémé additionné de solides du lait (indication de l’arôme); lait partiellement écrémé additionné de solides du lait (indication de l’arôme) | (4) Bonnes pratiques industrielles | |||
| L.2 | Lipase | Aspergillus niger var.; Aspergillus oryzae var.; Rhizopus oryzae var.; Tissus comestibles des préestomacs d’agneaux, de chevreaux ou de veaux; Tissus pancréatiques d’animaux | (1) Préparations aromatisantes à base de produits laitiers | (1) Bonnes pratiques industrielles |
| (2) Blanc d’oeuf liquide (albumen liquide); poudre de blanc d’oeuf (poudre d’albumen) | (2) Bonnes pratiques industrielles | |||
| (3) Fromage cheddar; fromage fondu cheddar; fromage (indication de la variété) | (3) Bonnes pratiques industrielles | |||
| (4) Farine; farine de blé entier; pain | (4) Bonnes pratiques industrielles | |||
| (5) Produits de boulangerie non normalisés | (5) Bonnes pratiques industrielles | |||
| (6) Protéines hydrolysées d’origine animale, végétale ou provenant du lait | (6) Bonnes pratiques industrielles | |||
| Aspergillus oryzae (MLT-2) (pRML 787) (p3SR2); Rhizomucor miehei (Cooney et Emerson) (précédemment nommé Mucor miehei (Cooney et Emerson)); Rhizopus niveus | (1) Graisses et huiles modifiées | (1) Bonnes pratiques industrielles | ||
| (2) Fromage cheddar; fromage (indication de la variété) | (2) Bonnes pratiques industrielles | |||
| (3) Préparations aromatisantes à base de produits laitiers | (3) Bonnes pratiques industrielles | |||
| (4) Protéines hydrolysées d’origine animale, végétale ou provenant du lait | (4) Bonnes pratiques industrielles | |||
| Aspergillus oryzae AI-11 (pBoel 960) | (1) Farine; farine de blé entier; pain | (1) Bonnes pratiques industrielles | ||
| (2) Produits de boulangerie non normalisés | (2) Bonnes pratiques industrielles | |||
| (3) Graisses et huiles modifiées | (3) Bonnes pratiques industrielles | |||
| Aspergillus oryzae BECh2#3 (pCaHj559); Aspergillus oryzae (MStr115) (pMStr20) | (1) Farine; farine de blé entier; pain | (1) Bonnes pratiques industrielles | ||
| (2) Produits de boulangerie non normalisés | (2) Bonnes pratiques industrielles | |||
| (3) Lécithine modifiée | (3) Bonnes pratiques industrielles | |||
| (4) Produits des oeufs non normalisés | (4) Bonnes pratiques industrielles | |||
| Aspergillus niger (pCaHj600/MBin118#11) | Graisses et huiles modifiées | Bonnes pratiques industrielles | ||
| Penicillium camembertii | (1) Graisses et huiles comestibles | (1) Bonnes pratiques industrielles | ||
| L.3 | Lipoxydase | Grumeaux ou farine de fine Soja | (1) Farine; farine de blé entier; pain | (1) Bonnes pratiques industrielles |
| L.4 | Lysozyme | Blanc d’oeuf | Fromage cheddar; fromage (indication de la variété) | Bonnes pratiques industrielles |
| M.1 | Enzyme coagulant le lait | Rhizomucor miehei (Cooney et Emerson) (précédemment nommé Mucor miehei (Cooney et Emerson)) ou Mucor pusillus Lindt par fermentation de culture pure ou Aspergillus oryzae RET-1 (pBoel777) | (1) Crème sure; fromage cheddar; fromage cottage; fromage (indication de la variété) | (1) Bonnes pratiques industrielles |
| (2) Préparations aromatisantes à base de produits laitiers | (2) Bonnes pratiques industrielles | |||
| (3) Protéines hydrolysées d’origine animale, végétale ou provenant du lait | (3) Bonnes pratiques industrielles | |||
| Endothia parasitica par fermentation de culture pure | (1) Fromage Emmentaler (Emmental ou Suisse) | (1) Bonnes pratiques industrielles | ||
| (2) Fromage Parmesan | (2) Bonnes pratiques industrielles | |||
| (3) Fromage Romano | (3) Bonnes pratiques industrielles | |||
| (4) Fromage Mozzarella (Scamorza) | (4) Bonnes pratiques industrielles | |||
| (5) Fromage Mozzarella partiellement écrémé (Scamorza partiellement écrémé) | (5) Bonnes pratiques industrielles | |||
| P.1 | Pancréatine | Pancréas de porc (Sus scrofa) ou de boeuf (Bos taurus) | (1) Blanc d’oeuf liquide (albumen liquide); poudre de blanc d’oeuf (poudre d’albumen) | (1) Bonnes pratiques industrielles |
| (2) Céréales à déjeuner précuites (instantanées) | (2) Bonnes pratiques industrielles | |||
| (3) Amidon utilisé dans la production des dextrines, du maltose, du dextrose, du glucose (sirop de glucose) ou de solides de glucose (sirop de glucose déshydraté) | (3) Bonnes pratiques industrielles | |||
| (4) Protéines hydrolysées d’origine animale ou végétale ou provenant du lait | (4) Bonnes pratiques industrielles | |||
| P.2 | Papaïne | Fruit du papayer Carica papaya L. (Fam. du Caricaceae) | (1) Ale; bière; bière légère; liqueur de malt; porter; stout | (1) Bonnes pratiques industrielles |
| (2) Boeuf avant l’abattage | (2) Bonnes pratiques industrielles | |||
| (3) Boyaux de saucisse; pellicules de collagène hydrosolubles comestibles | (3) Bonnes pratiques industrielles | |||
| (4) Protéine hydrolysée d’origine animale, végétale ou provenant du lait | (4) Bonnes pratiques industrielles | |||
| (5) Pièces de viande | (5) Bonnes pratiques industrielles | |||
| (6) Produits pour attendrir la viande | (6) Bonnes pratiques industrielles | |||
| (7) Céréales à déjeuner précuites (instantanées) | (7) Bonnes pratiques industrielles | |||
| (8) Marinade employée dans la salaison de parties de boeuf | (8) Bonnes pratiques industrielles | |||
| (9) Produits de boulangerie non normalisés | (9) Bonnes pratiques industrielles | |||
| P.3 | Pectinase | Aspergillus niger var.; Rhizopus oryzae var. | (1) Cidre; vin | (1) Bonnes pratiques industrielles |
| (2) Moût de distillerie | (2) Bonnes pratiques industrielles | |||
| (3) Jus de fruits non concentrés | (3) Bonnes pratiques industrielles | |||
| (4) Préparations naturelles aromatisantes et colorants | (4) Bonnes pratiques industrielles | |||
| (5) Pelures d’agrumes destinées à la fabrication de confiture, de marmelade et de fruits confits | (5) Bonnes pratiques industrielles | |||
| (6) Bouillon de légume employé dans les soupes | (6) Bonnes pratiques industrielles | |||
| (7) Feuilles de thé destinées à la production de solides de thé | (7) Bonnes pratiques industrielles | |||
| Aspergillus oryzae Km-1-1 (pA2PEI) | (1) Cidre; vin | (1) Bonnes pratiques industrielles | ||
| (2) Jus de fruits non concentrés | (2) Bonnes pratiques industrielles | |||
| (3) Produits à base de fruits et de légumes non normalisés | (3) Bonnes pratiques industrielles | |||
| P.4 | Pentosanase | Aspergillus niger var.; Bacillus subtilis var. | (1) Ale; bière; bière légère; liqueur de malt; porter; stout | (1) Bonnes pratiques industrielles |
| (2) Maïs pour égrenage | (2) Bonnes pratiques industrielles | |||
| (3) Moût de distillerie | (3) Bonnes pratiques industrielles | |||
| (4) Moût destiné à la fabrication du vinaigre | (4) Bonnes pratiques industrielles | |||
| (5) Produits de boulangerie non normalisés | (5) Bonnes pratiques industrielles | |||
| (6) Farine; farine de blé entier, pain | (6) Bonnes pratiques industrielles | |||
| Trichoderma reesei (QM9414) | (1) Farine; farine de blé entier, pain | (1) Bonnes pratiques industrielles | ||
| (2) Moût de distillerie | (2) Bonnes pratiques industrielles | |||
| (3) Produits de boulangerie non normalisés | (3) Bonnes pratiques industrielles | |||
| P.5 | Pepsine | Muqueuse glandulaire de l’estomac de porc | (1) Ale; bière; bière légère; liqueur de malt; porter; stout | (1) Bonnes pratiques industrielles |
| (2) Fromage à la crème; fromage à la crème à tartiner; fromage à la crème à tartiner (avec indication des ingrédients ajoutés); fromage à la crème (avec indication des ingrédients ajoutés); fromage cheddar; fromage cottage; fromage (indication de la variété) | (2) Bonnes pratiques industrielles | |||
| (3) Farine de soja dégraissée | (3) Bonnes pratiques industrielles | |||
| (4) Céréales à déjeuner précuites (instantanées) | (4) Bonnes pratiques industrielles | |||
| (5) Protéines hydrolysées d’origine animale ou végétale ou provenant du lait | (5) Bonnes pratiques industrielles | |||
| P.5A | Phospholipase | Streptomyces violaceoruber | (1) Lécithine modifiée | (1) Bonnes pratiques industrielles |
| (2) Produits des oeufs non normalisés | (2) Bonnes pratiques industrielles | |||
| Aspergillus oryzae (pPFJo142) | Fromage cheddar; fromage (indication de la variété) | Bonnes pratiques industrielles | ||
| Aspergillus niger (PLA-54) | (1) Farine; farine de blé entier; pain | (1) Bonnes pratiques industrielles | ||
| (2) Produits de boulangerie non normalisés | (2) Bonnes pratiques industrielles | |||
| (3) Oeuf entier non normalisé; jaune d’oeuf non normalisé | (3) Bonnes pratiques industrielles | |||
| (4) Lécithine modifiée | (4) Bonnes pratiques industrielles | |||
| P.6 | Protéase | Aspergillus oryzae var.; Aspergillus niger var.; Bacillus subtilis var. | (1) Ale; bière; bière légère; liqueur de malt; porter; stout | (1) Bonnes pratiques industrielles |
| (2) Farine; farine de blé entier; pain | (2) Bonnes pratiques industrielles | |||
| (3) Préparations aromatisantes à base de produits laitiers | (3) Bonnes pratiques industrielles | |||
| (4) Moût de distillerie | (4) Bonnes pratiques industrielles | |||
| (5) Boyaux de saucisses | (5) Bonnes pratiques industrielles | |||
| (6) Protéines hydrolysées d’origine animale, végétale, ou provenant du lait | (6) Bonnes pratiques industrielles | |||
| (7) Poudre de fromage de pulvérisation sèche industrielle | (7) Bonnes pratiques industrielles | |||
| (8) Pièces de viande | (8) Bonnes pratiques industrielles | |||
| (9) Produits pour attendrir la viande | (9) Bonnes pratiques industrielles | |||
| (10) Céréales à déjeuner précuites (instantanées) | (10) Bonnes pratiques industrielles | |||
| (11) Produits de boulangerie non normalisés | (11) Bonnes pratiques industrielles | |||
| (12) Fromage cheddar; fromage cheddar destiné à la transformation (fromage à caillé brassé; fromage à caillé granuleux; fromage à caillé lavé); fromage Colby | (12) Bonnes pratiques industrielles | |||
| (13) Boissons végétales | (13) Bonnes pratiques industrielles | |||
| Micrococcus caseolyticus var. | (1) Fromage (indication de la variété) | (1) Bonnes pratiques industrielles | ||
| Bacillus licheniformis (Cx) | (1) Protéines hydrolysées d’origine animale, végétale ou provenant du lait | (1) Bonnes pratiques industrielles | ||
| P.7 | Pullulanase | Bacillus acidopullulyticus NCIB 11647; Bacillus licheniformis SE2-Pul-int211 (pUBCDEBRA11DNSI) | (1) Farine; farine de blé entier; pain | (1) Bonnes pratiques industrielles |
| (2) Amidon utilisé dans la production des dextrines, du dextrose, du glucose (sirop de glucose), de solides de glucose (sirop de glucose déshydraté) ou de sirops et de solides de fructose, du maltose | (2) Bonnes pratiques industrielles | |||
| (3) Produits de boulangerie non normalisés | (3) Bonnes pratiques industrielles | |||
| Bacillus licheniformis BMP 139 (pR11Amp) | (1) Farine; farine de blé entier; pain | (1) Bonnes pratiques industrielles | ||
| (2) Moût de bière | (2) Bonnes pratiques industrielles | |||
| (3) Amidon utilisé dans la production des dextrines, du dextrose, du glucose (sirop de glucose), de solides de glucose (sirop de glucose déshydraté) ou de sirops et de solides de fructose, du maltose | (3) Bonnes pratiques industrielles | |||
| (4) Produits de boulangerie non normalisés | (4) Bonnes pratiques industrielles | |||
| Bacillus subtilis B1-163 (pEB301) | (1) Farine; farine de blé entier; pain | (1) Bonnes pratiques industrielles | ||
| (2) Moût de bière | (2) Bonnes pratiques industrielles | |||
| (3) Moût de distillerie | (3) Bonnes pratiques industrielles | |||
| (4) Amidon utilisé dans la production des dextrines, du dextrose, du glucose (sirop de glucose), de solides de glucose (sirop de glucose déshydraté) ou de sirops et de solides de fructose, du maltose | (4) Bonnes pratiques industrielles | |||
| (5) Produits de boulangerie non normalisés | (5) Bonnes pratiques industrielles | |||
| Bacillus subtilis RB121 (pDG268) | (1) Moût de bière | (1) Bonnes pratiques industrielles | ||
| (2) Moût de distillerie | (2) Bonnes pratiques industrielles | |||
| (3) Amidon utilisé dans la production des dextrines, du dextrose, du glucose (sirop de glucose), du maltose ou de solides de glucose (sirop de glucose déshydraté) | (3) Bonnes pratiques industrielles | |||
| R.1 | Présure | Extrait aqueux du 4e (véritable) estomac de veaux, de chevreaux ou d’agneaux | (1) Crème sure; fromage à la crème; fromage à la crème à tartiner; fromage à la crème à tartiner (avec indication des ingrédients ajoutés); fromage à la crème (avec indication des ingrédients ajoutés); fromage cheddar; fromage cottage; fromage (indication de la variété) | (1) Bonnes pratiques industrielles |
| (2) Produits pour desserts à base de lait non normalisés | (2) Bonnes pratiques industrielles | |||
| T.01 | Transglutaminase | Streptoverticillium mobaraense souche S-8112 | (1) Produits de poisson préparé non normalisés | (1) Bonnes pratiques industrielles |
| (2) Simili-produits de viande | (2) Bonnes pratiques industrielles | |||
| (3) Produits de fromage non normalisés | (3) Bonnes pratiques industrielles | |||
| (4) Produits de fromage fondu non normalisés | (4) Bonnes pratiques industrielles | |||
| (5) Produits de fromage à la crème non normalisés | (5) Bonnes pratiques industrielles | |||
| (6) Yogourt | (6) Bonnes pratiques industrielles | |||
| (7) Desserts laitiers congelés non normalisés | (7) Bonnes pratiques industrielles | |||
| T.1 | Trypsine | Pancreas de porc (Sus scrofa) | (1) Protéines hydrolysées d’origine animale ou végétale ou provenant du lait | (1) Bonnes pratiques industrielles |
| X.1 | Xylanase | Aspergillus oryzae Fa 1–1 (pA2X1TI) | (1) Farine; farine de blé entier; pain | (1) Bonnes pratiques industrielles |
| (2) Produits de boulangerie non normalisés | (2) Bonnes pratiques industrielles | |||
| Aspergillus oryzae JaL 339 (pJaL537); Bacillus subtilis DIDK 0115 (pUB110 OIS2) | (1) Farine; farine de blé entier; pain | (1) Bonnes pratiques industrielles | ||
| (2) Produits de boulangerie non normalisés | (2) Bonnes pratiques industrielles | |||
| Bacillus subtilis CF 307 (pJHPaprE-xynAss-BS3xylanase#1) | (1) Farine; farine de blé entier; pain | (1) Bonnes pratiques industrielles | ||
| (2) Produits de boulangerie non normalisés | (2) Bonnes pratiques industrielles | |||
- DORS/78-402, art. 6
- DORS/78-876, art. 3
- DORS/79-662, art. 14 à 17
- DORS/80-501, art. 4
- DORS/80-632, art. 5
- DORS/81-60, art. 11
- DORS/81-934, art. 7 à 10
- DORS/82-383, art. 10
- DORS/82-566, art. 2
- DORS/82-1071, art. 17
- DORS/84-302, art. 4
- DORS/84-762, art. 8 et 9
- DORS/84-801, art. 4
- DORS/86-89, art. 4 à 6
- DORS/86-1112, art. 4
- DORS/87-254, art. 2
- DORS/87-640, art. 7
- DORS/88-281, art. 1
- DORS/90-24, art. 1 à 3
- DORS/90-87, art. 10 à 12
- DORS/90-469, art. 3
- DORS/91-124, art. 5(F)
- DORS/91-487, art. 1
- DORS/91-691, art. 1
- DORS/92-63, art. 4
- DORS/92-94, art. 4
- DORS/92-195, art. 1
- DORS/92-197, art. 9
- DORS/92-231, art. 1
- DORS/92-518, art. 1
- DORS/92-591, art. 2(F)
- DORS/94-29, art. 1
- DORS/94-182, art. 1
- DORS/94-212, art. 9
- DORS/94-417, art. 2
- DORS/94-552, art. 1
- DORS/94-689, art. 2
- DORS/94-712, art. 1
- DORS/95-65, art. 1
- DORS/95-183, art. 9
- DORS/95-525, art. 1 et 2
- DORS/96-375, art. 1
- DORS/97-81, art. 1
- DORS/97-82, art. 1
- DORS/97-122, art. 4(F) et 5
- DORS/97-508, art. 1 et 2
- DORS/97-513, art. 1
- DORS/97-558, art. 4
- DORS/98-454, art. 1
- DORS/98-458, art. 6 et 7(F)
- DORS/2000-336, art. 3 à 5
- DORS/2000-417, art. 4
- DORS/2003-130, art. 4
- DORS/2004-84, art. 1
- DORS/2005-98, art. 3 à 7 et 8(F)
- DORS/2005-394, art. 1 à 6
- DORS/2007-225, art. 1
- DORS/2010-41, art. 1 à 6 et 9(A)
- DORS/2010-42, art. 1 à 4
- DORS/2010-94, art. 8(A)
- DORS/2010-142, art. 17
- DORS/2010-143, art. 14 à 26
- DORS/2012-26, art. 4
- DORS/2012-45, art. 1
- DORS/2012-46, art. 4
- DORS/2012-104, art. 10 et 21
TABLEAU VI
Additifs alimentaires autorisés comme agents raffermissants
| Article | Colonne I | Colonne II | Colonne III |
|---|---|---|---|
| Additifs | Permis dans ou sur | Limites de tolérance | |
| A.1 | Sulfate d’aluminium | (1) Crabe; homard; saumon; crevettes et thon en conserve; cornichons et achards (relish) | (1) Bonnes pratiques industrielles |
| (2) Aliments non normalisés | (2) Bonnes pratiques industrielles | ||
| A.2 | Sulfate double d’aluminium et d’ammonium | (1) Cornichons et achards (relish) | (1) Bonnes pratiques industrielles |
| (2) Aliments non normalisés | (2) Bonnes pratiques industrielles | ||
| C.1 | Chlorure de calcium | (1) Pommes en conserve | (1) 0,026 %, calculé en calcium |
| (2) Pamplemousses en conserve | (2) 0,035 % de la teneur totale en calcium, qu’il soit ajouté ou autrement présent | ||
| (3) Fromage (indication de la variété); fromage cheddar | (3) 0,02 % du lait et des produits du lait utilisés | ||
| (4) Fromage cottage | (4) Bonnes pratiques industrielles | ||
| (5) Glaçage de poisson congelé | (5) Bonnes pratiques industrielles | ||
| (6) Olives | (6) 1,5 % de la saumure | ||
| (7) Cornichons et achards (relish) | (7) 0,4 % | ||
| (8) Tomates; légumes en conserve (nom du légume); pommes congelées | (8) 0,026 %, calculé en calcium et, dans le cas des pois en conserve, 0,035 %, calculé en calcium | ||
| (9) Aliments non normalisés | (9) Bonnes pratiques industrielles | ||
| (10) Abricots en conserve | (10) 0,022 %, calculé en calcium | ||
| C.2 | Citrate de calcium | (1) Tomates; légumes en conserve; pommes congelées; pommes tranchées congelées | (1) 0,026 %, calculé en calcium |
| (2) Pommes en conserve | (2) 0,026 %, calculé en calcium | ||
| (3) Aliments non normalisés | (3) Bonnes pratiques industrielles | ||
| C.3 | Gluconate de calcium | Aliments non normalisés | Bonnes pratiques industrielles |
| C.3A | Lactate de calcium | (1) Pamplemousses en conserve | (1) 0,035 % de la teneur totale en calcium, qu’il soit ajouté ou autrement présent |
| (2) Pois en conserve | (2) 0,035 % calculé en calcium | ||
| C.4 | Phosphate bicalcique | Aliments non normalisés | Bonnes pratiques industrielles |
| C.5 | Phosphate monocalcique | (1) Tomates; légumes en conserve; pommes congelées | (1) 0,026 %, calculé en calcium |
| (2) Pommes en conserve | (2) 0,026 %, calculé en calcium | ||
| (3) Aliments non normalisés | (3) Bonnes pratiques industrielles | ||
| C.6 | Sulfate de calcium | (1) Tomates; légumes en conserve; pommes congelées | (1) 0,026 %, calculé en calcium |
| (2) Pommes en conserve | (2) 0,026 %, calculé en calcium | ||
| P.1 | Sulfate double d’aluminium et de potassium | (1) Cornichons et achards (relish) | (1) Bonnes pratiques industrielles |
| (2) Aliments non normalisés | (2) Bonnes pratiques industrielles | ||
| S.1 | Sulfate double d’aluminium et de sodium | (1) Cornichons et achards (relish) | (1) Bonnes pratiques industrielles |
| (2) Aliments non normalisés | (2) Bonnes pratiques industrielles |
- DORS/78-402, art. 7
- DORS/79-660, art. 11 et 12
- DORS/79-752, art. 7
- DORS/93-445, art. 1
- DORS/94-689, art. 2(F)
- DORS/2007-302, art. 4(F)
- DORS/2010-94, art. 8(A)
- DORS/2012-43, art. 29 et 30
TABLEAU VII
Additifs alimentaires autorisés comme agents de satinage ou de glaçage
| Article | Colonne I | Colonne II | Colonne III |
|---|---|---|---|
| Additifs | Permis dans ou sur | Limites de tolérance | |
| A.1 | Monoglycérides acétylés | (1) Confiseries non normalisées | (1) 0,4 % |
| (2) Poisson congelé | (2) Bonnes pratiques industrielles | ||
| B.1 | Cire d’abeilles | Confiseries non normalisées | 0,4 % |
| C.1 | Cire de carnauba | Confiseries non normalisées | 0,4 % |
| C.2 | Cire de candélilla | Confiseries non normalisées | 0,4 % |
| G.1 | Gomme arabique | Confiseries non normalisées | 0,4 % |
| G.2 | Résine de benjoin | Confiseries non normalisées | 0,4 % |
| M.1 | Silicate de magnésium | Confiseries non normalisées | 0,4 % |
| M.2 | Huile minérale | Confiseries non normalisées | 0,15 % |
| P.1 | Vaseline | Confiseries non normalisées | 0,15 % |
| S.1 | Gomme laque | Confiseries non normalisées; décorations à gâteaux | 0,4 % |
| S.2 | Spermaceti | Confiseries non normalisées | 0,4 % |
| Z.1 | Zéine | Confiseries non normalisées | 1,0 % |
- DORS/94-689, art. 2(F)
- DORS/2010-142, art. 18 à 29
TABLEAU VIII
Additifs alimentaires divers
| Article | Colonne I | Colonne II | Colonne III | Colonne IV |
|---|---|---|---|---|
| Additifs | Permis dans ou sur | But de l’emploi | Limites de tolérance | |
| A.01 | Gomme arabique | Ale; bière; bière légère; liqueur de malt; porter; stout; vin | Agent de collage | Bonnes pratiques industrielles |
| A.1 | Mono-glycérides acétylés | Aliments non normalisés | Couverture; agent de démoulage | Bonnes pratiques industrielles |
| A.1.01 | Agar-agar | Vin | Agent de collage | Bonnes pratiques industrielles |
| A.1.1 | Sulphate d’aluminium | Blanc d’oeuf congelé (albumen congelé); blanc d’oeuf liquide (albumen liquide); jaune d’oeuf congelé; jaune d’oeuf liquide; oeuf entier congelé; oeuf entier liquide; poudre de blanc d’oeuf (poudre d’albumen); poudre de jaune d’oeuf; poudre d’oeuf entier | Pour stabiliser l’albumen durant la pasteurisation | 0,036 % |
| A.2 | Persulfate d’ammoniaque | Levure de bière | Agent anti- microbien | 0,1 % |
| A.3 | [Abrogé, DORS/93-276, art. 4] | |||
| A.4 | [Abrogé, DORS/93-276, art. 5] | |||
| B.2 | Cire d’abeilles | Aliments non normalisés | Agent anticollant | 0,4 % |
| B.2.1 | Peroxyde de benzoyle | Petit-lait liquide destiné à la fabrication de produits de petit-lait séché autres que ceux entrant dans les préparations pour nourrissons | Décolorer | 100 p.p.m. |
| B.3 | Huile végétale bromée | Préparation aromatisante de (nom de l’arôme) pour utilisation dans les boissons contenant des huiles d’agrumes ou d’épinette | Agent modificateur de la densité | 15 p.p.m. dans les boissons contenant des huiles d’agrumes ou d’épinette sous leur forme consommable |
| B.4 | n-Butane | Enduits aux casseroles, à base d’huile végétale comestible, de lécithine ou d’un mélange des deux | Agent de propulsion | Bonnes pratiques industrielles |
| C.1 | Caféine | Breuvages de type cola | Caractéristique du produit | 200 p.p.m. dans le produit fini |
| C.2 | Citrate de caféine | Breuvages de type cola | Caractéristique du produit | 200 p.p.m., calculé en caféine, dans le produit fini |
| C.3 | Carbonate de calcium | (1) Farine; farine de blé entier | (1) Véhicule du peroxyde de benzoyle | (1) 900 p.p.m., conformément aux sous-alinéas B.13.001e)(vi) et B.13.005d)(vi) |
| (2) [Abrogé, DORS/94-227, art. 5] | ||||
| (3) Confiseries non normalisées | (3) Crémer et fixer | (3) Bonnes pratiques industrielles | ||
| (4) Gomme à mâcher | (4) Agent de remplissage | (4) Bonnes pratiques industrielles | ||
| (5) Aliments non normalisés | (5) Véhicule et agent de saupoudrage | (5) Bonnes pratiques industrielles | ||
| C.3.01 | Chlorure de calcium | Saucisse avec enrobage comestible | Stabiliser l’enrobage comestible | Bonnes pratiques industrielles |
| C.3A | Lactate de calcium | (1) Albumine de l’oeuf (délysozymisée) | (1) Restauration des propriétés fonctionnelles | (1) Bonnes pratiques industrielles (la quantité de calcium ajoutée ne doit pas excéder celle perdue lors du processus de transformation) |
| (2) Mélange de poisson et de viande préparés visé à l’alinéa B.21.006n) | (2) Modifier la texture | (2) Bonnes pratiques industrielles | ||
| (3) Saucisse avec enrobage comestible | (3) Stabiliser l’enrobage comestible | (3) Bonnes pratiques industrielles | ||
| C.4 | Oxyde de calcium | (1) Crustacés et mollusques congelés | (1) Faciliter l’enlèvement des matières étrangères et réduire la déperdition d’humidité pendant la cuisson | (1) Lorsque employé en combinaison avec le chlorure de sodium (sel) et l’hydroxyde de sodium en solution, l’oxyde de calcium ne doit pas dépasser 30 p.p.m. |
| (2) Mélange de poisson et de viande préparés visés à l’alinéa B.21.006n) | (2) Modifier la texture | (2) Bonnes pratiques industrielles | ||
| C.5 | Phosphate bicalcique | (1) Farine; farine de blé entier | (1) Véhicule du peroxyde de benzoyle | (1) 900 p.p.m. conformément aux sous-alinéas B.13.001e)(vi) et B.13.005d)(vi) |
| (2) [Abrogé, DORS/94-227, art. 6] | ||||
| C.6 | Phosphate tricalcique | (1) Farine; farine de blé entier | (1) Véhicule du peroxyde de benzoyle | (1) 900 p.p.m. conformément aux sous-alinéas B.13.001e)(vi) et B.13.005d)(vi) |
| (2) [Abrogé, DORS/94-227, art. 7] | ||||
| (3) Petit-lait liquide destiné à la fabrication de produits de petit-lait séché autres que ceux entrant dans les préparations pour nourrissons | (3) Véhicule du peroxyde de benzoyle | (3) 0,04 % des produits de petit-lait séché | ||
| (4) Fromage fondu (indication de la variété); fromage fondu (indication de la variété) (avec indication des ingrédients ajoutés); préparation de fromage fondu; préparation de fromage fondu (avec indication des ingrédients ajoutés); fromage fondu à tartiner; fromage fondu à tartiner (avec indication des ingrédients ajoutés) | (4) Améliorer la couleur, la texture, la consistance et la tartinabilité | (4) 1,0 % | ||
| C.7 | Silicate de calcium | Rocou soluble dans l’huile | Véhicule | Bonnes pratiques industrielles |
| C.8 | Stéarate de calcium | Confiseries non normalisées | Agent de démoulage | Bonnes pratiques industrielles |
| C.9 | Stéaroyl-2- lactylate de calcium | (1) Blanc d’oeuf congelé (albumen congelé); blanc d’oeuf liquide (albumen liquide) | (1) Faire monter en neige | (1) 0,05 % |
| (2) Poudre de blanc d’oeuf (poudre d’albumen) | (2) Faire monter en neige | (2) 0,5 % | ||
| (3) Garnitures de graisse végétale | (3) Faire mousser | (3) 0,3 % | ||
| (4) Pommes de terre déshydratées | (4) Agent de conditionnement | (4) 0,2 % du poids à l’état sec | ||
| C.10 | Sulfate de calcium | (1) Farine; farine de blé entier | (1) Véhicule du peroxyde de benzoyle | (1) 900 p.p.m. conformément aux sous-alinéas B.13.001e)(vi) et B.13.005d)(vi) |
| (2) [Abrogé, DORS/94-227, art. 8] | ||||
| (3) Poudre à pâte | (3) Remplissage neutre | (3) Bonnes pratiques industrielles | ||
| (4) Petit-lait liquide destiné à la fabrication de produits de petit-lait séché autres que ceux entrant dans les préparations pour nourrissons | (4) Véhicule du peroxyde de benzoyle | (4) 0,3 % des produits de petit-lait séché | ||
| C.11 | Anhydride carbonique | (1) Ale; bière; jus de (nom du fruit) gazeux; bière légère; liqueur de malt; porter; cidre; stout; vins; eau dite eau minérale ou eau de source | (1) Rendre mousseux | (1) Bonnes pratiques industrielles |
| (2) Aliments non normalisés | (2) Agent pulseur ou pour rendre mousseux | (2) Bonnes pratiques industrielles | ||
| (3) Fromage cottage; fromage cottage en crème | (3) Prolonger la durée de conservation | (3) Bonnes pratiques industrielles | ||
| C.11.1 | Carboxyméthylcellulose, réticulé (Carboxyméthylcellulose sodique, réticulé) | Édulcorants de table sous forme de comprimé contenant de l’acésulfame-potassium, de l’aspartame, de l’érythritol, du néotame ou du sucralose | Désagrégation des comprimés | Bonnes pratiques industrielles |
| C.12 | Huile de ricin | Confiseries non normalisées | Agent de démoulage | Bonnes pratiques industrielles |
| C.13 | [Abrogé, DORS/2010-142, art. 35] | |||
| C.13.1 | Cellulose en poudre | (1) Pâte à frire et chapelure | (1) Agent de remplissage | (1) 1 % |
| (2) Biscottes | (2) Agent de remplissage | (2) 2 % | ||
| (3) Confiseries non normalisées qui répondent aux critères mentionnés à la colonne 2 de l’article 3 du tableau suivant l’article B.01.513 en regard du sujet « énergie réduite » visé à la colonne 1 | (3) Agent de remplissage | (3) 25 % | ||
| (4) Glaces comestibles non normalisées | (4) Agent de remplissage | (4) 3 % | ||
| (5) Garnitures | (5) Agent de remplissage | (5) 0,5 % | ||
| (6) Aliments vendus sous forme de comprimés | (6) Agent de remplissage | (6) 50 % | ||
| (7) Glaçages | (7) Agent de remplissage | (7) 1 % | ||
| (8) Assaisonnements | (8) Agent de remplissage | (8) 3 % | ||
| (9) Produits de boulangerie sucrés | (9) Agent de remplissage | (9) 8 % | ||
| C.14A | Chloropentafluoréthane | Aliments non normalisés | Agent pulseur et agent d’aération | Bonnes pratiques industrielles |
| C.15 | Acide citrique | (1) Sang de boeuf | (1) Anticoagulant | (1) Bonnes pratiques industrielles |
| (2) Aliments non normalisés | (2) Nourrir les cultures | (2) Bonnes pratiques industrielles | ||
| C.16 | Gluconate de cuivre | Rafraîchisseurs d’haleine | Caractéristique du produit | 50 p.p.m. |
| C.17 | Sulfate de cuivre | Vin | Agent de collage | 0,0001 % calculé en cuivre dans le produit fini |
| D.1 | Formules à base de diméthyl-polysiloxane | (1) Confiture de (nom du fruit); confiture de (nom du fruit) avec pectine; confiture de pommes (ou de rhubarbe) et de (nom du fruit); gelée de (nom du fruit); gelée de (nom du fruit) avec pectine; huiles et graisses; jus de citron reconstitué; jus de lime reconstitué; lait écrémé en poudre; marmelade d’ananas; marmelade d’ananas avec pectine; marmelade de (nom de l’agrume); marmelade de (nom de l’agrume) avec pectine; marmelade de figues; marmelade de figues avec pectine; shortening; vin | (1) Agent antimousse | (1) 10 p.p.m. de diméthylpolysiloxane |
| (2) Jus d’ananas; Mélanges de jus d’ananas avec d’autres jus de fruits; ananas en conserve (lorsque le jus d’ananas est utilisé comme véhicule de conditionnement) | (2) Agent anti-mousse | (2) 10 p.p.m. de diméthylpolysiloxane | ||
| (3) Surfaces entrant en contact avec les aliments | (3) Agent de démoulage | (3) Bonnes pratiques industrielles. (Les résidus de diméthylpolysiloxane dans l’aliment ne doivent pas excéder 10 p.p.m.) | ||
| (4) Aliments non normalisés | (4) Agent antimousse | (4) 10 p.p.m. de diméthylpolysiloxane | ||
| (5) Moût utilisé dans la fabrication d’ale, de bière, de bière légère, de liqueur de malt, de porter et de stout | (5) Agent antimousse | (5) 10 p.p.m. de diméthylpolysiloxane | ||
| D.3 | Dioctyl sulfo-succinate sodique | (1) Bases sèches de boissons, acidulées à l’acide fumarique | (1) Agent humidifiant | (1) 10 p.p.m. dans la boisson finie |
| (2) Boyaux de saucisse | (2) Réduit la rupture du boyau | (2) 200 p.p.m. du boyau | ||
| E.1 | Ethoxyquin | Paprika; piment rouge moulu | Pour favoriser la conservation de la couleur | 100 p.p.m. |
| E.2 | [Abrogé, DORS/2016-143, art. 1] | |||
| F.1 | Gluconate ferreux | Olives mûres | Fixer la couleur | Bonnes pratiques industrielles |
| G.1 | Gélatine | Bière; cidre; vin | Agent de collage | Bonnes pratiques industrielles |
| G.2 | [Abrogé, DORS/89-175, art. 2] | |||
| G.2A | Glucono-delta-lactone | (1) Pain de viande; saucisse cuite | (1) Activer la fixation de la couleur | (1) 0,5 % |
| (2) Saucisse sèche | (2) Faciliter le séchage | (2) Bonnes pratiques industrielles | ||
| G.3 | Glycérol | (1) Mélanges de salaison des viandes; boyaux à saucisse | (1) Humidifier | (1) Bonnes pratiques industrielles |
| (2) Viandes de salaison (Titre 14) | (2) Glacer la surface de ces viandes | (2) Bonnes pratiques industrielles | ||
| (3) Aliments non normalisés | (3) Humidifier; lustrer | (3) Bonnes pratiques industrielles | ||
| G.4 | Ester glycérique de la colophane | Boissons contenant des huiles d’agrumes ou d’épinette | Agent modificateur de la densité | 100 p.p.m. |
| H.1 | Peroxyde d’hydrogène | (1) Moût de bière | (1) Adjuvant de clarification | (1) 135 p.p.m. dans le moût |
| (2) Petit-lait liquide destiné à la fabrication de produits de petit-lait séché | (2) Pour décolorer et maintenir le pH | (2) 100 p.p.m. (voir aussi le paragraphe C.1(3) du tableau V) | ||
| (3) Balle d’avoine utilisée dans la fabrication de fibre de balle d’avoine | (3) Agent de blanchiment | (3) Bonnes pratiques industrielles | ||
| I | Isobutane | Enduits pour casseroles à base d’huile végétale comestible, de lécithine ou d’un mélange des deux | Agent de propulsion | Bonnes pratiques industrielles |
| L.1 | Esters lactyliques d’acides gras | Aliments non normalisés | Agent plastifiant | Bonnes pratiques industrielles |
| L.2 | Lanoline | Gomme à mâcher | Agent plastifiant | Bonnes pratiques industrielles |
| L.3 | Lécithine | (1) Surfaces entrant en contact avec les aliments | (1) Agent de démoulage | (1) Bonnes pratiques industrielles |
| (2) Produits céréaliers pour bébés | (2) Agent de démoulage | (2) 1,75 % du produit céréalier pour bébés prêt à consommer | ||
| L.4 | L-Leucine | Édulcorants de table sous forme de comprimé contenant de l’acésulfame-potassium, de l’aspartame, de l’érythritol, du néotame ou du sucralose | Lubrifiant ou liant utilisé dans la fabrication des comprimés | Bonnes pratiques industrielles |
| M.1 | Silicate d’aluminium et de magnésium | Gomme à mâcher | Agent de saupoudrage | Bonnes pratiques industrielles |
| M.2 | Carbonate de magnésium | (1) Farine; farine de blé entier | (1) Véhicule du peroxyde de benzoyle | (1) 900 p.p.m. conformément aux sous-alinéas B.13.001e)(vi) et B.13.005d)(vi) |
| (2) [Abrogé, DORS/94-227, art. 9] | ||||
| (3) Confiseries non normalisées | (3) Agent de démoulage | (3) Bonnes pratiques industrielles | ||
| M.2A | Chlorure de magnésium | Albumine de l’oeuf (délysozymisée) | Restauration des propriétés fonctionnelles | Bonnes pratiques industrielles (la quantité de magnésium ajoutée ne doit pas excéder celle perdue lors du processus de transformation) |
| M.3 | Silicate de magnésium | (1) Confiseries non normalisées | (1) Agent de démoulage | (1) Bonnes pratiques industrielles |
| (2) Gomme à mâcher | (2) Agent de saupoudrage | (2) Bonnes pratiques industrielles | ||
| (3) Riz | (3) Enrober | (3) Bonnes pratiques industrielles | ||
| M.4 | Stéarate de magnésium | (1) Confiseries non normalisées | (1) Agent de démoulage | (1) Bonnes pratiques industrielles |
| (2) Aliments vendus sous forme de comprimés | (2) Liant | (2) Bonnes pratiques industrielles | ||
| M.4A | Sulfate de magnésium | Albumine de l’oeuf (délysozymisée) | Restauration des propriétés fonctionnelles | Bonnes pratiques industrielles (la quantité de magnésium ajoutée ne doit pas excéder celle perdue lors du processus de transformation) |
| M.5A | [Abrogé, DORS/93-276, art. 6] | |||
| M.5C | Cellulose méthyl-éthylique | Aliments non normalisés | Agent d’aération | Bonnes pratiques industrielles |
| M.6 | Cellulose microcristalline | (1) Mélange pour lait glacé | (1) Agent texturant et épaississant | (1) 1,5 % |
| (2) Sorbet laitier | (2) Agent texturant et épaississant | (2) 0,5 % | ||
| (3) Aliments non normalisés qui répondent aux critères mentionnés à la colonne 2 de l’article 3 du tableau suivant l’article B.01.513 en regard du sujet « énergie réduite » visé à la colonne 1 | (3) Agent de remplissage | (3) Bonnes pratiques industrielles | ||
| (4) Garniture fouettée à l’huile végétale | (4) Agent texturant et épaississant | (4) 1,5 % | ||
| (5) Desserts congelés non normalisés | (5) Agent texturant et épaississant | (5) 0,5 % | ||
| (6) Tartinades à sandwich non normalisées; trempettes non normalisées | (6) Agent texturant et épaississant | (6) 3,0 % | ||
| (7) Aliments non normalisés autres que les aliments non normalisés mentionnés au présent article | (7) Agent texturant et épaississant | (7) 2,0 % | ||
| (8) Mélange pour crème glacée | (8) Agent texturant et épaississant | (8) 0,5 % ou, s’il est employé en association avec des agents stabilisants, la quantité totale ne doit pas dépasser 0,5 % de la crème glacée faite du mélange | ||
| (9) Édulcorant de table sous forme de comprimé contenant de l’aspartame | (9) Désagrégation des comprimés | (9) 2,2 % | ||
| (10) Crème à fouetter | (10) Agent stabilisant et épaississant | (10) 0,2 % | ||
| (11) Rafraîchisseurs d’haleine | (11) Agent texturant et épaississant | (11) 9,0 % | ||
| M.7 | Huile minérale | (1) Confiseries non normalisées; produits de boulangerie; raisins secs épépinés | (1) Agent de démoulage | (1) 0,3 %, conformément à l’article B.01.047. Si la vaseline est également utilisée dans les produits de boulangerie, comme agent de démoulage, la quantité totale de toute combinaison de vaseline et d’huile minérale ne doit pas dépasser 0,15 % |
| (2) Fruits et légumes frais | (2) Badigeonner | (2) 0,3 % conformément à l’article B.01.047 | ||
| (3) Boyaux de saucisse | (3) Lubrifiant | (3) 5 % conformément à l’alinéa B.01.047e) (les résidus d’huile minérale dans les saucisses crues préparées avec ces boyaux ne doivent pas dépasser 200 p.p.m.; dans les saucisses cuites, 30 p.p.m.) | ||
| (4) Succédané de sel | (4) Agent liant et enrobage protecteur | (4) 0,6 %, conformément à l’alinéa B.01.047h) | ||
| M.8 | Monoacétine | Produits de boulangerie non normalisés | Agent plastifiant | Bonnes pratiques industrielles |
| M.9 | Mono- et diglycérides | (1) Confiture de pommes (ou de rhubarde) et de (nom du fruit); huiles et graisses; marmelade de figues; marmelade de figues avec pectine; confiture de (nom du fruit); confiture de (nom du fruit) avec pectine; gelée de (nom du fruit); gelée de (nom du fruit) avec pectine; marmelade de (nom de l’agrume); marmelade de (nom de l’agrume) avec pectine; marmelade d’ananas; marmelade d’ananas avec pectine | (1) Agent antimousse | (1) Bonnes pratiques industrielles |
| (2) Aliments non normalisés | (2) Agent antimousse; humidifiant; agent de démoulage | (2) Bonnes pratiques industrielles | ||
| M.10 | Mono-glycérides | Aliments non normalisés | Agent antimousse; humidifiant; agent de démoulage | Bonnes pratiques industrielles |
| N.1 | Azote | (1) Fromage à la crème; fromage à la crème (avec indication des ingrédients ajoutés); fromage à la crème à tartiner; fromage à la crème à tartiner (avec indication des ingrédients ajoutés) | (1) Pour améliorer la tartinabilité | (1) Bonnes pratiques industrielles |
| (2) Margarine | (2) Pour améliorer la tartinabilité | (2) Bonnes pratiques industrielles | ||
| (3) Aliments non normalisés | (3) Agent pulseur | (3) Bonnes pratiques industrielles | ||
| N.2 | Oxyde d’azote | Aliments non normalisés | Agent pulseur | Bonnes pratiques industrielles |
| O.1 | Octafluoro-cyclobutane | Aliments non normalisés | Agent pulseur et agent d’aération | Bonnes pratiques industrielles |
| O.2 | Oxystéarine | Huile de graines de cotonnier; huile d’arachides; huile de soja | Empêcher la formation de cristaux | 0,125 % |
| O.3 | Ozone | (1) Cidre | (1) Agent de maturation | (1) Bonnes pratiques industrielles |
| (2) Eau dite eau minérale ou eau de source | (2) Stérilisant chimique | (2) Bonnes pratiques industrielles | ||
| (3) Vin | (3) Agent de maturation | (3) Bonnes pratiques industrielles | ||
| P.1 | Extrait de pancréas | Cultures bactériennes productrices d’acides | Pour enrayer les bactériophages | Bonnes pratiques industrielles |
| P.1A | Paraffine | (1) Fruits et légumes frais | (1) Enrober | (1) 0,3 % conformément à l’article B.01.047 |
| (2) Fromage et navets | (2) Enrober | (2) Bonnes pratiques industrielles conformément à l’article B.01.047 | ||
| P.2 | Vaseline | (1) Produits de boulangerie | (1) Agent de démoulage | (1) 0,15 %, conformément à l’article B.01.047. Si on utilise également une huile minérale comme agent de démoulage, la quantité totale de toute combinaison de vaseline et d’huile minérale ne doit pas dépasser 0,15 % |
| (2) Fruits et légumes frais | (2) Enrober | (2) 0,3 %, conformément à l’article B.01.047 | ||
| P.2A | Polyéthylèneglycol (gamme de poids moléculaires de 3 000 à 9 000) | (1) Boissons gazeuses | (1) Agent antimousse | (1) 10 p.p.m. |
| (2) Édulcorant de table sous forme de comprimé contenant de l’aspartame | (2) Lubrifiant | (2) 1,0 % | ||
| (3) Comprimés de L-lysine | (3) Agent liant pour comprimés | (3) 7,0 % | ||
| P.2B | Polydextrose | Aliments non normalisés | Agent texturant et épaississant | Bonnes pratiques industrielles |
| P.3 | Polyvinyl-pyrrolidone | (1) Ale; bière; bière légère; cidre; liqueur de malt; porter; stout; vin | (1) Agent de collage | (1) 2 p.p.m. dans le produit fini |
| (2) Édulcorant de table sous forme de comprimé contenant de l’aspartame | (2) Liant pour comprimés | (2) 0,3 % | ||
| (3) Dispersions de pigment laqué de colorant pour utilisation dans les confiseries non normalisées sous forme de comprimé | (3) Agent réducteur de la viscosité et stabilisant dans les dispersions de pigment laqué de colorant | (3) Bonnes pratiques industrielles (les résidus de polyvinylpyrrolidone ne doivent pas dépasser 100 p.p.m. dans le produit fini) | ||
| P.4 | Sulfate double d’aluminium et de potassium | Farine; farine de blé entier | Véhicule du peroxyde de benzoyle | 900 p.p.m., conformément aux sous-alinéas B.13.001e)(vi) et B.13.005d)(vi) |
| P.4.1 | Ferrocyanure de potassium | Vin | Agent de collage | Bonnes pratiques industrielles |
| P.5 | Stéarate de potassium | (1) Gomme à mâcher | (1) Agent plastifiant | (1) Bonnes pratiques industrielles |
| (2) Préparations émulsifiantes contenant des mono-esters de propylèneglycol | (2) Agent stabilisant | (2) 2 % | ||
| P.6 | Propane | Aliments non normalisés | Agent pulseur et agent d’aération | Bonnes pratiques industrielles |
| P.7 | Propylène-glycol | (1) Rocou soluble dans l’huile | (1) Solvant | (1) Bonnes pratiques industrielles |
| (2) Aliments non normalisés | (2) Humidifiant | (2) Bonnes pratiques industrielles | ||
| Q.1 | Essence de quillaja | Bases de boissons; mélanges pour boissons; liqueurs douces | Faire mousser | Bonnes pratiques industrielles |
| S.1 | Saponine | Bases de boissons; mélanges pour boissons; liqueurs douces | Faire mousser | Bonnes pratiques industrielles |
| S.1.01 | Dioxyde de silicium | Émulsions à base d’huiles végétales comestibles servant d’enduits pour batterie de cuisine | Agent de suspension | 2,0 % de la préparation |
| S.1.1 | Pyrophosphate acide de sodium | Filets de poisson congelés; poisson haché congelé; homard congelé; crabe congelé; clams congelés; crevettes congelées | Réduire les pertes dues au traitement et la formation d’exsudat lors de la décongélation | Si employé en association avec le tripolyphosphate de sodium et le pyrophosphate tétrasodique, la quantité totale de phosphate ajouté, calculé en phosphate dibasique de sodium, ne doit pas dépasser 0,5 % |
| S.2 | Sulfate d’aluminium et de sodium | Farine; farine de blé entier | Véhicule du peroxyde de benzoyle | 900 p.p.m. conformément aux sous-alinéas B.13.001e)(vi) et B.13.005d)(vi) |
| S.3 | Bicarbonate de sodium | (1) Confiseries non normalisées | (1) Agent d’aération | (1) Bonnes pratiques industrielles |
| (2) Sel ordinaire | (2) Stabilisant de l’iodure de potassium | (2) Bonnes pratiques industrielles | ||
| S.3A | Carbonate de sodium | Mélangé avec l’hexamétaphosphate de sodium, filets de poisson congelés, homard congelé, crabe congelé, clams congelés et crevettes congelées | Pour empêcher de suinter en dégelant | 15 % du mélange de carbonate de sodium et d’hexamétaphosphate de sodium |
| S.3B | Carboxyméthyl cellulose de sodium | Boyaux de saucisse | Enrobage pour faciliter l’épluchage | 0,25 % de boyaux |
| S.4 | Citrate de sodium | (1) Sang de boeuf | (1) Anticoagulant | (1) 0,5 % |
| (2) Crème sure | (2) Précurseur de saveur | (2) 0,1 % | ||
| (3) Mélange de poisson et de viande préparés visé à l’alinéa B.21.006n) | (3) Modifier la texture | (3) Bonnes pratiques industrielles | ||
| S.5 | Décahydrate de ferrocyanure de sodium | Sel dendritique | Adjuvant dans la production de cristaux de sel dendritique | 13 p.p.m. calculé en ferrocyanure anhydre de sodium |
| S.6 | Hexamétaphosphate de sodium | (1) Sang de boeuf | (1) Anticoagulant | (1) 0,2 % |
| (2) Filets de poisson congelés; homards congelés; crabe congelé; clams congelés et crevettes congelées | (2) Empêcher de suinter en dégelant | (2) 0,5 % de phosphate ajouté total, calculé en phosphate dibasique de sodium | ||
| (3) Gélatine qui entre dans la composition des guimauves | (3) Agent de fouettage | (3) 2 % | ||
| S.6A | Hydroxyde de sodium | Crustacés et mollusques congelés | Faciliter l’enlèvement des matières étrangères et réduire la déperdition d’humidité pendant la cuisson | Lorsque employé en combinaison avec le chlorure de sodium (sel) et l’oxyde de calcium en solution, l’hydroxyde de sodium ne doit pas dépasser 70 p.p.m. |
| S.6.1 | Lauryl-sulfate de sodium | (1) Poudre de blanc d’oeuf (poudre d’albumen) | (1) Faire monter en neige | (1) 0,1 % |
| (2) Blanc d’oeuf congelé (albumen congelé); blanc d’oeuf liquide (albumen liquide) | (2) Faire monter en neige | (2) 0,0125 % | ||
| (3) Gélatine qui entre dans la composition des guimauves | (3) Agent de fouettage | (3) 0,5 % | ||
| S.6.2 | Chlorophylline de sodium, potassium et cuivre | Rafraîchisseurs d’haleine | Caractéristique du produit | 700 p.p.m. |
| S.7 | Phosphate dibasique de sodium | (1) Poisson congelé | (1) Empêcher l’éclatement de la glace | (1) Bonnes pratiques industrielles |
| (2) Champignons congelés | (2) Empêcher la décoloration | (2) Bonnes pratiques industrielles | ||
| S.7.1 | Pyrophosphate tétrasodique | Filets de poisson congelés; poisson haché congelé; homard congelé; crabe congelé; clams congelés; crevettes congelées | Réduire les pertes dues au traitement et la formation d’exsudat lors de la décongélation | Si employé en association avec le tripolyphosphate de sodium et le pyrophosphate acide de sodium, la quantité totale de phosphate ajouté, calculé en phosphate dibasique de sodium, ne doit pas dépasser 0,5 % |
| S.8 | Silicate de sodium | Eau potable en boîtes | Anticorrosif | Bonnes pratiques industrielles |
| S.9 | Stéarate de sodium | Gomme à mâcher | Agent plastifiant | Bonnes pratiques industrielles |
| S.9A | Stéaroyl-2-lactylate de sodium | (1) Blanc d’oeuf congelé (albumen congelé); blanc d’oeuf liquide (albumen liquide) | (1) Faire monter en neige | (1) 0,05 % |
| (2) Poudre de blanc d’oeuf (poudre d’albumen) | (2) Faire monter en neige | (2) 0,5 % | ||
| (3) Garnitures à l’huile ou mélanges pour garnitures | (3) Faire mousser | (3) 0,3 % | ||
| (4) Pommes de terre déshydratées | (4) Agent de conditionnement | (4) 0,2 % du poids à l’état sec | ||
| S.9B | Sulfate de sodium | Champignons congelés | Empêcher la décoloration | Bonnes pratiques industrielles |
| S.9C | Sulfite de sodium | Miettes de thon en conserve | Empêcher la décoloration | 300 p.p.m. |
| S.10 | Thiosulfate de sodium | Sel | Stabilisant de l’iodure de potassium | Bonnes pratiques industrielles |
| S.11 | Tripolyphosphate de sodium | Clams congelés; crabe congelé; crevettes congelées; filets de poisson congelés; homard congelé; poisson haché congelé et poisson haché menu congelé | Réduire les pertes dues au traitement et la formation d’exsudat lors de la décongélation | Si employé seul ou en association avec le pyrophosphate acide de sodium et le pyrophosphate tétrasodique, la quantité totale de phosphate ajouté, calculé en phosphate dibasique de sodium, ne doit pas dépasser 0,5 % |
| S.12 | [Abrogé, DORS/93-276, art. 8] | |||
| S.13 | Chlorure stanneux | (1) Asperges conservées dans des contenants en verre ou des contenants métalliques vernis sur toute leur surface intérieure | (1) Stabiliser la couleur et la saveur | (1) 25 p.p.m. calculé en étain |
| (2) Boissons gazeuses en boîtes; jus de citron; jus de fruit concentré sauf le jus d’orange concentré congelé; jus de lime | (2) Stabiliser la couleur et la saveur | (2) Bonnes pratiques industrielles | ||
| S.14 | Acide stéarique | (1) Confiseries non normalisées | (1) Agent de démoulage | (1) Bonnes pratiques industrielles |
| (2) Gomme à mâcher | (2) Agent plastifiant | (2) Bonnes pratiques industrielles | ||
| (3) Aliments vendus sous forme de comprimés | (3) Agent de démoulage et lubrifiant | (3) Bonnes pratiques industrielles | ||
| S.15 | Sulfate de méthyle et de sodium | Pectine | Aider au conditionnement, comme résultat de la méthylation de la pectine par l’action de l’acide sulfurique et de l’alcool méthylique, le bicarbonate de sodium agissant comme neutralisant | 0,1 % de pectine |
| S.15A | [Abrogé, DORS/93-276, art. 9] | |||
| S.16 | Acétate isobutyrate de sucrose | Préparation aromatisante de (nom de l’arôme) pour utilisation dans les boissons contenant des huiles d’agrumes ou d’épinette | Agent modificateur de la densité | 300 p.p.m. dans les boissons contenant des huiles d’agrumes ou d’épinette sous leur forme consommable |
| S.17 | Acide sulfurique | Grains de café | Améliorer le rendement de l’extraction des solides de café | Bonnes pratiques industrielles |
| T.1 | Talc | (1) Légumineuses sèches et cassées; riz | (1) Enrobage | (1) Bonnes pratiques industrielles |
| (2) Base de gomme à mâcher | (2) Remplissage | (2) Bonnes pratiques industrielles | ||
| (3) Gomme à mâcher | (3) Agent de saupoudrage | (3) Bonnes pratiques industrielles | ||
| T.2 | Acide tannique | (1) Gomme à mâcher | (1) Pour diminuer l’adhérence | (1) Bonnes pratiques industrielles |
| (2) Cidre; vin; vin de miel | (2) Agent de collage | (2) 200 p.p.m. | ||
| T.2A | [Abrogé, DORS/93-276, art. 10] | |||
| T.3 | Triacétine | Mélanges à gâteau | Agent humidifiant | Bonnes pratiques indrustrielles |
| T.4 | Triéthylcitrate | Blanc d’oeuf congelé (albumen congelé); blanc d’oeuf liquide (albumen liquide); poudre de blanc d’oeuf (poudre d’albumen) | Faire monter en neige | 0,25 % |
| X.1 | [Abrogé, DORS/93-276, art. 11] | |||
- DORS/78-401, art. 3
- DORS/78-403, art. 23 à 25
- DORS/78-876, art. 4
- DORS/79-660, art. 13
- DORS/79-752, art. 8
- DORS/80-632, art. 6 à 13
- DORS/81-83, art. 4
- DORS/81-617, art. 3
- DORS/81-934, art. 11 et 12
- DORS/82-566, art. 3 et 4
- DORS/82-1071, art. 18 à 20
- DORS/83-410, art. 3
- DORS/83-584, art. 1
- DORS/83-932, art. 5 et 6
- DORS/84-17, art. 6
- DORS/84-441, art. 1
- DORS/84-602, art. 3
- DORS/84-762, art. 10
- DORS/84-801, art. 5 et 6
- DORS/86-1112, art. 5
- DORS/86-1125, art. 2
- DORS/87-469, art. 1
- DORS/87-640, art. 8
- DORS/88-419, art. 4
- DORS/88-534, art. 5 et 6
- DORS/89-175, art. 2
- DORS/89-197, art. 1
- DORS/89-198, art. 11
- DORS/89-555, art. 2 et 3
- DORS/91-90, art. 2
- DORS/91-124, art. 6 à 9
- DORS/91-149, art. 3
- DORS/91-186, art. 1
- DORS/91-409, art. 7
- DORS/91-527, art. 4
- DORS/92-229, art. 1
- DORS/92-344, art. 2 à 4
- DORS/93-276, art. 4 à 11
- DORS/94-416, art. 1
- DORS/94-227, art. 5 à 10
- DORS/94-689, art. 2(F)
- DORS/94-723, art. 1
- DORS/96-260, art. 1
- DORS/96-378, art. 1
- DORS/97-509, art. 1
- DORS/98-580, art. 1(F)
- DORS/99-97, art. 1
- DORS/99-420, art. 11(F)
- DORS/2000-353, art. 8(F)
- DORS/2001-94, art. 3
- DORS/2005-316, art. 2(F) et 3
- DORS/2006-91, art. 6 à 12
- DORS/2007-75, art. 7
- DORS/2010-41, art. 9(A)
- DORS/2010-94, art. 8(A)
- DORS/2010-142, art. 30(F), 31 à 39, 40(F), 41 à 45, 46(F), 47 à 51 et 59(F)
- DORS/2010-143, art. 27 à 31
- DORS/2011-235, art. 16(F)
- DORS/2011-279, art. 1
- DORS/2011-282, art. 2
- DORS/2012-43, art. 31(F)
- DORS/2012-44, art. 1 et 2
- DORS/2012-105, art. 1
- DORS/2012-111, art. 2 et 3
- DORS/2016-143, art. 1
TABLEAU IX
Additifs alimentaires qui peuvent être utilisés comme édulcorants
| Article | Colonne I | Colonne II | Colonne III |
|---|---|---|---|
| Additifs | Permis dans ou sur | Limites de tolérance | |
| A.01 | Acésulfame-potassium | (1) Édulcorants de table | (1) Bonnes pratiques industrielles |
| (2) Boissons gazéifiées | (2) 0,025 % dans les boissons, sous leur forme consommable | ||
| (3) Boissons laitières non normalisées; boissons non normalisées; concentrés de boissons non normalisés; mélanges pour boissons non normalisés | (3) 0,05 % dans les boissons, sous leur forme consommable | ||
| (4) Desserts non normalisés; garnitures; glaçages; mélanges pour desserts non normalisés; mélanges pour garnitures; mélanges pour glaçages; yogourt | (4) 0,1 % dans les produits, sous leur forme consommable | ||
| (5) Gomme à mâcher; rafraîchisseurs d’haleine | (5) 0,35 % | ||
| (6) Tartinades de fruits non normalisées | (6) 0,1 % | ||
| (7) Sauces à salade non normalisées | (7) 0,05 % | ||
| (8) Confiseries non normalisées | (8) 0,25 % | ||
| (9) Mélanges pour pâtisseries; produits de boulangerie non normalisés | (9) 0,1 % dans les produits, sous leur forme consommable | ||
| (10) Fruits en conserve non normalisés; (nom du fruit) en conserve | (10) 0,007 % | ||
| A.1 | Aspartame | (1) Édulcorants de table | (1) Bonnes pratiques industrielles |
| (2) Céréales à déjeuner | (2) 0,5 % | ||
| (3) Boissons non normalisées; concentrés de boissons non normalisés; mélanges pour boissons non normalisés | (3) 0,1 % dans les boissons, sous leur forme consommable | ||
| (4) Desserts non normalisés; garnitures; glaçages; mélanges pour desserts non normalisés; mélanges pour garnitures; mélanges pour glaçages; yogourt | (4) 0,3 % dans les produits, sous leur forme consommable | ||
| (5) Gomme à mâcher; rafraîchisseurs d’haleine | (5) 1,0 % | ||
| (6) Purées non normalisées; sauces non normalisées; sirops de table non normalisés; tartinades de fruits non normalisées | (6) 0,2 % | ||
| (7) Sauces à salade non normalisées; tartinades d’arachides; tartinades de fruits à écale | (7) 0,05 % | ||
| (8) Condiments non normalisés | (8) 0,2 % | ||
| (9) Assaisonnements sucrés ou mélanges pour enrobage des grignotines; glaçages à confiserie pour grignotines | (9) 0,1 % | ||
| (10) Confiseries non normalisées; enrobages de confiserie non normalisés | (10) 0,3 % | ||
| A.2 | Aspartame, en capsules, pour prévenir sa dégradation pendant la cuisson | Mélanges pour pâtisseries; produits de boulangerie non normalisés | 0,4 % dans les produits, sous leur forme consommable |
| E.1 | Érythritol | (1) Édulcorants de table | (1) Bonnes pratiques industrielles |
| (2) Boissons diététiques | (2) 3,5 % | ||
| (3) Garnitures et glaçages à la crème faits à base de gras | (3) 60 % | ||
| (4) Biscuits et gaufrettes diététiques | (4) 7 % | ||
| (5) Bonbons mous | (5) 40 % | ||
| (6) Bonbons durs | (6) 50 % | ||
| (7) Gomme à mâcher | (7) 60 % | ||
| H.1 | Hydrolysat d’amidon hydrogéné | Aliments non normalisés | Bonnes pratiques industrielles |
| I.1 | Isomalt | Aliments non normalisés | Bonnes pratiques industrielles |
| L.1 | Lactitol | Aliments non normalisés | Bonnes pratiques industrielles |
| M.1 | Maltitol | Aliments non normalisés | Bonnes pratiques industrielles |
| M.2 | Sirop de maltitol | Aliments non normalisés | Bonnes pratiques industrielles |
| M.3 | Mannitol | Aliments non normalisés | Bonnes pratiques industrielles |
| N.1 | Néotame | (1) Édulcorants de table | (1) Bonnes pratiques industrielles |
| (2) Céréales à déjeuner | (2) 0,016 % | ||
| (3) Boissons non normalisées; concentrés de boissons non normalisés; mélanges pour boissons non normalisés | (3) 0,003 % dans les boissons, sous leur forme consommable | ||
| (4) Desserts non normalisés; garnitures; glaçages; mélanges pour desserts non normalisés; mélanges pour garnitures; mélanges pour glaçages; yogourt | (4) 0,01 % dans les produits, sous leur forme consommable | ||
| (5) Gomme à mâcher; rafraîchisseurs d’haleine | (5) 0,032 % | ||
| (6) Purées non normalisées; sauces non normalisées; sirops de table non normalisés; tartinades de fruits non normalisées | (6) 0,007 % | ||
| (7) Sauces à salade non normalisées; tartinades d’arachides; tartinades de fruits à écale | (7) 0,002 % | ||
| (8) Condiments non normalisés | (8) 0,007 % | ||
| (9) Assaisonnements sucrés ou mélanges pour enrobage des grignotines; glaçages à confiserie pour grignotines | (9) 0,0032 % | ||
| (10) Confiseries non normalisées; enrobages de confiserie non normalisés | (10) 0,01 % | ||
| (11) Mélanges pour pâtisseries; produits de boulangerie non normalisés | (11) 0,013 % dans les produits, sous leur forme consommable | ||
| S.1 | Sorbitol | (1) Mélange de poisson et de viande préparés visé à l’alinéa B.21.006n) | (1) 6,0 % |
| (2) Aliments non normalisés | (2) Bonnes pratiques industrielles | ||
| S.1.1 | Sirop de sorbitol | Aliments non normalisés | Bonnes pratiques industrielles |
| S.2 | Sucralose | (1) Édulcorants de table | (1) Bonnes pratiques industrielles |
| (2) Céréales à déjeuner | (2) 0,1 % | ||
| (3) Boissons laitières non normalisées; boissons non normalisées; concentrés de boissons non normalisés; mélanges pour boissons non normalisés | (3) 0,025 % dans les boissons, sous leur forme consommable | ||
| (4) Desserts non normalisés; garnitures; glaçages; mélanges pour desserts non normalisés; mélanges pour garnitures; mélanges pour glaçages; yogourt | (4) 0,025 % dans les produits, sous leur forme consommable | ||
| (5) Gomme à mâcher; rafraîchisseurs d’haleine | (5) 0,15 % | ||
| (6) Tartinades de fruits non normalisées | (6) 0,045 % | ||
| (7) Condiments non normalisés; sauces à salade non normalisées | (7) 0,04 % | ||
| (8) Assaisonnements sucrés ou mélanges pour enrobage des grignotines; confiseries non normalisées; enrobages de confiserie non normalisés; glaçages à confiserie pour grignotines | (8) 0,07 % | ||
| (9) Mélanges pour pâtisseries; produits de boulangerie non normalisés | (9) 0,065 % dans les produits, sous leur forme consommable | ||
| (10) Produits de fruits et de légumes transformés non normalisés, sauf les fruits en conserve non normalisés | (10) 0,015 % | ||
| (11) Boissons alcooliques non normalisées | (11) 0,07 % | ||
| (12) Poudings; mélanges pour poudings | (12) 0,04 % dans les produits, sous leur forme consommable | ||
| (13) Sirops de table non normalisés | (13) 0,15 % | ||
| (14) Fruits en conserve non normalisés; (nom du fruit) en conserve | (14) 0,025 % | ||
| (15) Achards (relish); cornichons | (15) 0,015 % | ||
| T.1 | Thaumatin | (1) Gommes à mâcher; rafraîchisseurs d’haleine | (1) 500 p.p.m. |
| (2) Succédanés du sel | (2) 400 p.p.m. | ||
| (3) Une préparation aromatisante de (nom de l’arôme) visée à l’article B.10.005; préparations aromatisantes non normalisées | (3) 100 p.p.m. | ||
| X.1 | Xylitol | Aliments non normalisés | Bonnes pratiques industrielles |
- DORS/93-276, art. 12
- DORS/94-625, art. 5
- DORS/94-689, art. 2(F)
- DORS/94-779, art. 3
- DORS/97-512, art. 3 et 4
- DORS/2004-261, art. 2
- DORS/2007-76, art. 3
- DORS/2007-176, art. 7
- DORS/2010-142, art. 52 à 55
- DORS/2012-104, art. 11 à 15
TABLEAU X
Additifs alimentaires autorisés comme rajusteurs du pH, substances à réaction acide et agents correcteurs de l’eau
| Article | Colonne I | Colonne II | Colonne III |
|---|---|---|---|
| Additifs | Permis dans ou sur | Limites de tolérance | |
| A.1 | Acide acétique | (1) Fromage à la crème à tartiner; fromage à la crème à tartiner (avec indication des ingrédients ajoutés); fromage fondu (indication de la variété); fromage fondu (indication de la variété) (avec indication des ingrédients ajoutés); préparation de fromage fondu; préparation de fromage fondu (avec indication des ingrédients ajoutés); fromage fondu à tartiner; fromage fondu à tartiner (avec indication des ingrédients ajoutés); fromage conditionné à froid (indication de la variété); fromage conditionné à froid (indication de la variété) (avec indication des ingrédients ajoutés); préparation de fromage conditionné à froid; préparation de fromage conditionné à froid (avec indication des ingrédients ajoutés); fromage de petit-lait (indication de la variété) | (1) Bonnes pratiques industrielles |
| (2) Asperges en conserve | (2) Bonnes pratiques industrielles | ||
| (3) Gélatine | (3) Bonnes pratiques industrielles | ||
| (4) Aliments non normalisés | (4) Bonnes pratiques industrielles | ||
| A.2 | Acide adipique | Aliments non normalisés | Bonnes pratiques industrielles |
| A.3 | Sulfate double d’aluminium et d’ammonium | (1) Poudre à pâte | (1) Bonnes pratiques industrielles |
| (2) Aliments non normalisés | (2) Bonnes pratiques industrielles | ||
| A.4 | Bicarbonate d’ammonium | (1) Produits du cacao | (1) En quantité suffisante pour traiter les produits du cacao conformément à l’article B.04.005 |
| (2) Aliments non normalisés | (2) Bonnes pratiques industrielles | ||
| A.5 | Carbonate d’ammonium | (1) Produits du cacao | (1) En quantité suffisante pour traiter les produits du cacao conformément à l’article B.04.005 |
| (2) Aliments non normalisés | (2) Bonnes pratiques industrielles | ||
| A.6 | Citrate d’ammonium dibasique | Aliments non normalisés | Bonnes pratiques industrielles |
| A.7 | Citrate d’ammonium monobasique | Aliments non normalisés | Bonnes pratiques industrielles |
| A.8 | Hydroxyde d’ammonium | (1) Produits du cacao | (1) En quantité suffisante pour traiter les produits du cacao conformément à l’article B.04.005 |
| (2) Gélatine | (2) Bonnes pratiques industrielles | ||
| (3) Aliments non normalisés | (3) Bonnes pratiques industrielles | ||
| A.9 | Phosphate d’ammonium dibasique | (1) Ale; cultures bactériennes; poudre à pâte; bière; bière légère; liqueur de malt; porter; stout | (1) Bonnes pratiques industrielles |
| (2) Produits de boulangerie non normalisés | (2) Bonnes pratiques industrielles | ||
| A.10 | Phosphate d’ammonium monobasique | (1) Ale; cultures bactériennes; poudre à pâte; bière; bière légère; liqueur de malt; porter; stout | (1) Bonnes pratiques industrielles |
| (2) Produits de boulangerie non normalisés | (2) Bonnes pratiques industrielles | ||
| (3) Lait de beurre sans culture | (3) 0,1 % | ||
| C.1 | Acétate de calcium | (1) Ale; bière; bière légère; liqueur de malt; porter; stout | (1) Bonnes pratiques industrielles |
| (2) Aliments non normalisés | (2) Bonnes pratiques industrielles | ||
| C.1A | Pyrophosphate acide de calcium | (1) Poudre à pâte | (1) Bonnes pratiques industrielles |
| (2) Aliments non normalisés | (2) Bonnes pratiques industrielles | ||
| C.2 | Carbonate de calcium | (1) Mélange pour crème glacée; mélange pour lait glacé; vin | (1) Bonnes pratiques industrielles |
| (2) Fromage à la crème à tartiner; fromage à la crème à tartiner (avec indication des ingrédients ajoutés); fromage fondu (indication de la variété); fromage fondu (indication de la variété) (avec indication des ingrédients ajoutés); préparation de fromage fondu; préparation de fromage fondu (avec indication des ingrédients ajoutés); fromage fondu à tartiner; fromage fondu à tartiner (avec indication des ingrédients ajoutés); fromage conditionné à froid (indication de la variété); fromage conditionné à froid (indication de la variété) (avec indication des ingrédients ajoutés); préparation de fromage conditionné à froid; préparation de fromage conditionné à froid (avec indication des ingrédients ajoutés); fromage de petit-lait (indication de la variété) | (2) Bonnes pratiques industrielles | ||
| (3) Jus de raisin | (3) Bonnes pratiques industrielles | ||
| (4) Aliments non normalisés | (4) Bonnes pratiques industrielles | ||
| (5) Produits du cacao | (5) En quantité suffisante pour traiter les produits du cacao conformément à l’article B.04.005 | ||
| C.3 | Chlorure de calcium | (1) Ale; bière; bière légère; liqueur de malt; porter; stout | (1) Bonnes pratiques industrielles |
| (2) Aliments non normalisés | (2) Bonnes pratiques industrielles | ||
| C.4 | Citrate de calcium | (1) Préparations pour nourrissons | (1) Bonnes pratiques industrielles |
| (2) Aliments non normalisés | (2) Bonnes pratiques industrielles | ||
| C.5 | Fumarate de calcium | Aliments non normalisés | Bonnes pratiques industrielles |
| C.6 | Gluconate de calcium | Aliments non normalisés | Bonnes pratiques industrielles |
| C.7 | Hydroxyde de calcium | (1) Ale; bière; mélange pour crème glacée; mélange pour lait glacé; bière légère; liqueur de malt; porter; stout | (1) Bonnes pratiques industrielles |
| (2) Pois en conserve | (2) 0,01 % | ||
| (3) Préparations pour nourrissons | (3) Bonnes pratiques industrielles | ||
| (4) Jus de raisin | (4) Bonnes pratiques industrielles | ||
| (5) Aliments non normalisés | (5) Bonnes pratiques industrielles | ||
| C.8 | Lactate de calcium | (1) Poudre à pâte | (1) Bonnes pratiques industrielles |
| (2) Aliments non normalisés | (2) Bonnes pratiques industrielles | ||
| C.9 | Oxyde de calcium | (1) Ale; bière; mélange pour crème glacée; mélange pour lait glacé; bière légère; liqueur de malt; porter; stout | (1) Bonnes pratiques industrielles |
| (2) Aliments non normalisés | (2) Bonnes pratiques industrielles | ||
| C.10 | Phosphate bicalcique | Aliments non normalisés | Bonnes pratiques industrielles |
| C.11 | Phosphate monocalcique | (1) Ale; poudre à pâte; bière; bière légère; liqueur de malt; porter; stout | (1) Bonnes pratiques industrielles |
| (2) Aliments non normalisés | (2) Bonnes pratiques industrielles | ||
| C.12 | Phosphate tricalcique | Aliments non normalisés | Bonnes pratiques industrielles |
| C.13 | Sulfate de calcium | Ale; bière; bière légère; liqueur de malt; porter; stout; vin | Bonnes pratiques industrielles |
| C.13A | Dioxyde de carbone | Fromage (indication de la variété) | Bonnes pratiques industrielles |
| C.14 | Acide citrique | (1) Ale; bière; cidre; liqueur de malt; porter; stout; vin; vin de miel | (1) Bonnes pratiques industrielles |
| (2) Achards (relish); champignons congelés; champignons en conserve; confiture de (nom du fruit); confiture de (nom du fruit) avec pectine; confiture de pommes (ou de rhubarbe) et de (nom du fruit); cornichons; fèves au lard; gelée de (nom du fruit); gelée de (nom du fruit) avec pectine; haricots; jus de raisin; jus de tomates; marmelade d’ananas; marmelade d’ananas avec pectine; marmelade de figues; marmelade de figues avec pectine; marmelade de (nom de l’agrume); marmelade de (nom de l’agrume) avec pectine; mincemeat; nectar d’abricot; nectar de pêche; nectar de poire; (nom du fruit) congelé; (nom du fruit) en conserve; (nom du légume) congelé; (nom du légume) en conserve; olives; pâte de tomates; pâte de tomates concentrée; pulpe de tomates; purée de tomates; tomates en conserve | (2) Bonnes pratiques industrielles | ||
| (3) Blanc d’oeuf congelé (albumen congelé); blanc d’oeuf liquide (albumen liquide); crevettes cuites congelées; crustacés et mollusques en conserve; gélatine; jaune d’oeuf congelé; jaune d’oeuf liquide; maquereau de printemps en conserve; oeuf entier congelé; oeuf entier liquide; poudre de blanc d’oeuf (poudre d’albumen); poudre de jaune d’œuf; poudre d’oeuf entier | (3) Bonnes pratiques industrielles | ||
| (4) Produits du cacao | (4) 1,0 %, seul ou en association avec de l’acide tartrique, calculé sans matières grasses | ||
| (5) Fromage à la crème à tartiner; fromage à la crème à tartiner (avec indication des ingrédients ajoutés); fromage conditionné à froid (indication de la variété); fromage conditionné à froid (indication de la variété) (avec indication des ingrédients ajoutés); fromage cottage; fromage cottage en crème; fromage de petit-lait (indication de la variété); fromage fondu à tartiner; fromage fondu à tartiner (avec indication des ingrédients ajoutés); fromage fondu (indication de la variété); fromage fondu (indication de la variété) (avec indication des ingrédients ajoutés); mélange pour crème glacée; mélange pour lait glacé; préparation de fromage conditionné à froid; préparation de fromage conditionné à froid (avec indication des ingrédients ajoutés); préparation de fromage fondu; préparation de fromage fondu (avec indication des ingrédients ajoutés); sorbet laitier | (5) Bonnes pratiques industrielles | ||
| (6) Margarine; mayonnaise; sauce à salade; sauce vinaigrette | (6) Bonnes pratiques industrielles | ||
| (7) Préparations pour nourrissons | (7) Bonnes pratiques industrielles | ||
| (8) Aliments non normalisés | (8) Bonnes pratiques industrielles | ||
| C.15 | Crème de tartre | Mêmes aliments que pour le tartrate acide de potassium | Mêmes limites de tolérance que pour le tartrate acide de potassium |
| F.1 | Acide fumarique | (1) Gélatine | (1) Bonnes pratiques industrielles |
| (2) Aliments non normalisés | (2) Bonnes pratiques industrielles | ||
| (3) Vin | (3) Bonnes pratiques industrielles | ||
| G.1 | Acide gluconique | Aliments non normalisés | Bonnes pratiques industrielles |
| G.2 | Glucono-delta-lactone | Aliments non normalisés | Bonnes pratiques industrielles |
| H.1 | Acide chlorhydrique | (1) Ale; bière; gélatine; bière légère; liqueur de malt; porter; stout | (1) Bonnes pratiques industrielles |
| (2) Préparations pour nourrissons | (2) Bonnes pratiques industrielles | ||
| L.1 | Acide lactique | (1) Ale; achards (relish); bière; blanc d’oeuf congelé (albumen congelé); blanc d’oeuf liquide (albumen liquide); cidre; cornichons; fromage cottage; fromage cottage en crème; jaune d’oeuf congelé; jaune d’oeuf liquide; liqueur de malt; mayonnaise; mélange pour crème glacée; mélange pour lait glacé; oeuf entier congelé; oeuf entier liquide; olives; pain; porter; poudre à pâte; poudre de blanc d’oeuf (poudre d’albumen); poudre de jaune d’oeuf; poudre d’oeuf entier; sauce à salade; sauce vinaigrette; sorbet laitier; stout | (1) Bonnes pratiques industrielles |
| (2) Poires en conserve; fraises en conserve | (2) Bonnes pratiques industrielles | ||
| (3) Margarine | (3) Bonnes pratiques industrielles | ||
| (4) Fromage à la crème à tartiner; fromage à la crème à tartiner (avec indication des ingrédients ajoutés); fromage fondu (indication de la variété); fromage fondu (indication de la variété) (avec indication des ingrédients ajoutés); préparation de fromage fondu; préparation de fromage fondu (avec indication des ingrédients ajoutés); fromage fondu à tartiner; fromage fondu à tartiner (avec indication des ingrédients ajoutés); fromage conditionné à froid (indication de la variété); fromage conditionné à froid (indication de la variété) (avec indication des ingrédients ajoutés); préparation de fromage conditionné à froid; préparation de fromage conditionné à froid (avec indication des ingrédients ajoutés); fromage de petit-lait (indication de la variété) | (4) Bonnes pratiques industrielles | ||
| (5) Aliments non normalisés | (5) Bonnes pratiques industrielles | ||
| (6) Vin | (6) Bonnes pratiques industrielles | ||
| M.2 | Carbonate de magnésium | (1) Produits du cacao | (1) En quantité suffisante pour traiter les produits du cacao conformément à l’article B.04.005 |
| (2) Mélange pour crème glacée; mélange pour lait glacé | (2) Bonnes pratiques industrielles | ||
| (3) Aliments normalisés | (3) Bonnes pratiques industrielles | ||
| M.3 | Citrate de magnésium | Liqueurs douces | Bonnes pratiques industrielles |
| M.4 | Fumarate de magnésium | Aliments non normalisés | Bonnes pratiques industrielles |
| M.5 | Hydroxyde de magnésium | (1) Pois en conserve | (1) 0,05 % |
| (2) Produits du cacao | (2) En quantité suffisante pour traiter les produits du cacao conformément à l’article B.04.005 | ||
| (3) Gélatine; mélange pour crème glacée; mélange pour lait glacé | (3) Bonnes pratiques industrielles | ||
| (4) Cultures bactériennes | (4) Bonnes pratiques industrielles | ||
| M.6 | Oxyde de magnésium | Mélange pour crème glacée; mélange pour lait glacé | Bonnes pratiques industrielles |
| M.6A | Phosphate de magnésium | Cultures bactériennes | Bonnes pratiques industrielles |
| M.7 | Sulfate de magnésium | (1) Ale; bière; bière légère; liqueur de malt; porter; stout | (1) Bonnes pratiques industrielles |
| (2) Cultures bactériennes | (2) Bonnes pratiques industrielles | ||
| M.8 | Acide malique | (1) Asperges en conserve; confiture de (nom du fruit); confiture de (nom du fruit) avec pectine; confiture de pommes (ou de rhubarbe) et de (nom du fruit); gelée de (nom du fruit); gelée de (nom du fruit) avec pectine; marmelade d’ananas; marmelade d’ananas avec pectine; marmelade de (nom de l’agrume); marmelade de (nom de l’agrume) avec pectine; marmelade de figues; marmelade de figues avec pectine; nectar d’abricot; nectar de pêche; nectar de poire; (nom du fruit) congelé | (1) Bonnes pratiques industrielles |
| (2) Compote de pommes en conserve; poires en conserve; fraises en conserve | (2) Bonnes pratiques industrielles | ||
| (3) Fromage à la crème à tartiner; fromage à la crème à tartiner (avec indication des ingrédients ajoutés); fromage fondu (indication de la variété); fromage fondu (indication de la variété) (avec indication des ingrédients ajoutés); préparation de fromage fondu; préparation de fromage fondu (avec indication des ingrédients ajoutés); fromage fondu à tartiner; fromage fondu à tartiner (avec indication des ingrédients ajoutés); fromage conditionné à froid (indication de la variété); fromage conditionné à froid (indication de la variété) (avec indication des ingrédients ajoutés); préparation de fromage conditionné à froid; préparation de fromage conditionné à froid (avec indication des ingrédients ajoutés); fromage de petit-lait (indication de la variété) | (3) Bonnes pratiques industrielles | ||
| (4) Aliments non normalisés | (4) Bonnes pratiques industrielles | ||
| (5) Vin | (5) Bonnes pratiques industrielles | ||
| M.8A | Sulfate de manganèse | Cultures bactériennes | Bonnes pratiques industrielles |
| M.9 | Acide métatartrique | Vin | 0,01 % |
| P.1 | Acide phosphorique | (1) Ale; bière; bière légère; fromage cottage; fromage cottage en crème; gélatine; liqueur de malt; monoglycérides et mono- et diglycérides; porter; stout | (1) Bonnes pratiques industrielles |
| (2) Fromage à la crème à tartiner; fromage à la crème à tartiner (avec indication des ingrédients ajoutés); fromage fondu (indication de la variété); fromage fondu (indication de la variété) (avec indication des ingrédients ajoutés); préparation de fromage fondu; préparation de fromage fondu (avec indication des ingrédients ajoutés); fromage fondu à tartiner; fromage fondu à tartiner (avec indication des ingrédients ajoutés); fromage conditionné à froid (indication de la variété); fromage conditionné à froid (indication de la variété) (avec indication des ingrédients ajoutés); préparation de fromage conditionné à froid; préparation de fromage conditionné à froid (avec indication des ingrédients ajoutés); fromage de petit-lait (indication de la variété) | (2) Bonnes pratiques industrielles | ||
| (3) Protéines de poisson | (3) Bonnes pratiques industrielles | ||
| (4) Aliments non normalisés | (4) Bonnes pratiques industrielles | ||
| (5) Produits du cacao | (5) 0,5 %, exprimé en P2O5, calculé sans matières grasses | ||
| P.2 | Tartrate acide de potassium | (1) Poudre à pâte; hydromel vineux | (1) Bonnes pratiques industrielles |
| (2) Aliments non normalisés | (2) Bonnes pratiques industrielles | ||
| (3) Vin | (3) 0,42 % | ||
| P.3 | Sulfate double d’aluminium et de potassium | (1) Ale; poudre à pâte; bière; bière légère; liqueur de malt; rocou soluble dans l’huile; porter; stout | (1) Bonnes pratiques industrielles |
| (2) Aliments non normalisés | (2) Bonnes pratiques industrielles | ||
| P.4 | Bicarbonate de potassium | (1) Lait malté; poudre à pâte; poudre de lait malté; | (1) Bonnes pratiques industrielles |
| (2) Produits du cacao | (2) En quantité suffisante pour traiter les produits du cacao conformément à l’article B.04.005 | ||
| (3) Fromage à la crème à tartiner; fromage à la crème à tartiner (avec indication des ingrédients ajoutés); fromage fondu (indication de la variété); fromage fondu (indication de la variété) (avec indication des ingrédients ajoutés); préparation de fromage fondu; préparation de fromage fondu (avec indication des ingrédients ajoutés); fromage fondu à tartiner; fromage fondu à tartiner (avec indication des ingrédients ajoutés); fromage conditionné à froid (indication de la variété); fromage conditionné à froid (indication de la variété) (avec indication des ingrédients ajoutés); préparation de fromage conditionné à froid; préparation de fromage conditionné à froid (avec indication des ingrédients ajoutés); fromage de petit-lait (indication de la variété) | (3) Bonnes pratiques industrielles | ||
| (4) Préparations pour nourrissons | (4) Bonnes pratiques industrielles | ||
| (5) Margarine | (5) Bonnes pratiques industrielles | ||
| (6) Aliments non normalisés | (6) Bonnes pratiques industrielles | ||
| (7) Vin | (7) Bonnes pratiques industrielles | ||
| P.5 | Carbonate de potassium | (1) Produits du cacao | (1) En quantité suffisante pour traiter les produits du cacao conformément à l’article B.04.005 |
| (2) Fromage à la crème à tartiner; fromage à la crème à tartiner (avec indication des ingrédients ajoutés); fromage fondu (indication de la variété); fromage fondu (indication de la variété) (avec indication des ingrédients ajoutés); préparation de fromage fondu; préparation de fromage fondu (avec indication des ingrédients ajoutés); fromage fondu à tartiner; fromage fondu à tartiner (avec indication des ingrédients ajoutés); fromage conditionné à froid (indication de la variété); fromage conditionné à froid (indication de la variété) (avec indication des ingrédients ajoutés); préparation de fromage conditionné à froid; préparation de fromage conditionné à froid (avec indication des ingrédients ajoutés); fromage de petit-lait (indication de la variété) | (2) Bonnes pratiques industrielles | ||
| (3) Margarine | (3) Bonnes pratiques industrielles | ||
| (4) Aliments non normalisés | (4) Bonnes pratiques industrielles | ||
| (5) Mélange de poisson et de viande préparés visé à l’alinéa B.21.006n) | (5) Bonnes pratiques industrielles | ||
| (6) Vin | (6) Bonnes pratiques industrielles | ||
| P.6 | Chlorure de potassium | Ale; bière; bière légère; liqueur de malt; porter; stout | Bonnes pratiques industrielles |
| P.7 | Citrate de potassium | (1) Préparations pour nourrissons | (1) Bonnes pratiques industrielles |
| (2) Margarine | (2) Bonnes pratiques industrielles | ||
| (3) Aliments non normalisés | (3) Bonnes pratiques industrielles | ||
| (4) Vin | (4) Bonnes pratiques industrielles | ||
| P.8 | Fumarate de potassium | Aliments non normalisés | Bonnes pratiques industrielles |
| P.9 | Hydroxyde de potassium | (1) Rocou soluble dans l’huile | (1) 1,0 % |
| (2) Produits du cacao | (2) En quantité suffisante pour traiter les produits du cacao conformément à l’article B.04.005 | ||
| (3) Marinade, saumure et mélange de salaison à sec employés dans le marinage des viandes conditionnées ou conservées et des sous-produits de viande conditionnés ou conservés; mélange pour crème glacée; mélange pour lait glacé | (3) Bonnes pratiques industrielles | ||
| (4) Préparation pour nourrissons | (4) Bonnes pratiques industrielles | ||
| (5) Margarine | (5) Bonnes pratiques industrielles | ||
| (6) Jus de raisin | (6) Bonnes pratiques industrielles | ||
| (7) Aliments non normalisés | (7) Bonnes pratiques industrielles | ||
| P.9A | Lactate de potassium | Margarine | Bonnes pratiques industrielles |
| P.10 | Phosphate bipotassique | Aliments non normalisés | Bonnes pratiques industrielles |
| P.11 | Sulfate de potassium | Ale; bière; bière légère; liqueur de malt; porter; boissons non alcoolisées; stout | Bonnes pratiques industrielles |
| P.12 | Tartrate de potassium | Cidre | Bonnes pratiques industrielles |
| S.1 | Acétate de sodium | Aliments non normalisés | Bonnes pratiques industrielles |
| S.2 | Pyrophosphate acide de sodium | (1) Poudre à pâte | (1) Bonnes pratiques industrielles |
| (2) Aliments non normalisés | (2) Bonnes pratiques industrielles | ||
| S.3 | Tartrate acide de sodium | Poudre à pâte | Bonnes pratiques industrielles |
| S.4 | Phosphate d’aluminium et de sodium | Aliments non normalisés | Bonnes pratiques industrielles |
| S.5 | Sulfate double d’aluminium et de sodium | (1) Poudre à pâte | (1) Bonnes pratiques industrielles |
| (2) Aliments non normalisés | (2) Bonnes pratiques industrielles | ||
| S.6 | Bicarbonate de sodium | (1) Blanc d’oeuf congelé (albumen congelé); blanc d’oeuf liquide (albumen liquide); confiture de (nom du fruit); confiture de (nom du fruit) avec pectine; confiture de pommes (ou de rhubarbe) et de (nom du fruit); gelée de (nom du fruit); gelée de (nom du fruit) avec pectine; jaune d’oeuf congelé; jaune d’oeuf liquide; marinade, saumure et mélange de salaison à sec employés dans le marinage des viandes conditionnées ou conservées et des sous-produits de viande conditionnés ou conservés; marmelade d’ananas; marmelade d’ananas avec pectine; marmalade de figues; marmelade de figues avec pectine; marmelade de (nom de l’agrume); marmelade de (nom de l’agrume) avec pectine; mélange pour crème glacée; mélange pour lait glacé; oeuf entier congelé; oeuf entier liquide; poudre à pâte; poudre de blanc d’oeuf (poudre d’albumen); poudre de jaune d’oeuf; poudre de lait malté; poudre d’oeuf entier; rocou soluble dans l’huile | (1) Bonnes pratiques industrielles |
| (2) Produits du cacao | (2) En quantité suffisante pour traiter les produits du cacao conformément à l’alinéa B.04.005 | ||
| (3) Fromage à la crème à tartiner; fromage à la crème à tartiner (avec indication des ingrédients ajoutés); fromage fondu (indication de la variété); fromage fondu (indication de la variété) (avec indication des ingrédients ajoutés); préparation de fromage fondu; préparation de fromage fondu (avec indication des ingrédients ajoutés); fromage fondu à tartiner; fromage fondu à tartiner (avec indication des ingrédients ajoutés); fromage conditionné à froid (indication de la variété); fromage conditionné à froid (indication de la variété) (avec indication des ingrédients ajoutés); préparation de fromage conditionné à froid; préparation de fromage conditionné à froid (avec indication des ingrédients ajoutés); fromage de petit-lait (indication de la variété) | (3) Bonnes pratiques industrielles | ||
| (4) Préparations pour nourrissons | (4) Bonnes pratiques industrielles | ||
| (5) Margarine | (5) Bonnes pratiques industrielles | ||
| (6) Aliments non normalisés | (6) Bonnes pratiques industrielles | ||
| S.7 | Bisulfate de sodium | (1) Ale; bière; bière légère; liqueur de malt; porter; stout | (1) Bonnes pratiques industrielles |
| (2) Produits de boulangerie non normalisés | (2) Bonnes pratiques industrielles | ||
| S.8 | Carbonate de sodium | (1) Blanc d’oeuf congelé (albumen congelé); blanc d’oeuf liquide (albumen liquide); confiture de (nom du fruit); confiture de (nom du fruit) avec pectine; confiture de pommes (ou de rhubarbe) et de (nom du fruit); gélatine; gelée de (nom du fruit); gelée de (nom du fruit) avec pectine; jaune d’oeuf congelé; jaune d’oeuf liquide; liant à viande ou liant à (désignation du produit de viande) lorsqu’il est vendu pour servir dans les viandes conditionnées ou conservées et dans les sous-produits de viande conditionnés ou conservés; marmelade d’ananas; marmelade d’ananas avec pectine; marmelade de figues; marmelade de figues avec pectine; marmelade de (nom de l’agrume); marmelade de (nom de l’agrume) avec pectine; mélange pour crème glacée; mélange pour lait glacé; oeuf entier congelé; oeuf entier liquide; poudre de blanc d’oeuf (poudre d’albumen); poudre de jaune d’oeuf; poudre d’oeuf entier | (1) Bonnes pratiques industrielles |
| (2) Produits du cacao | (2) En quantité suffisante pour traiter les produits du cacao conformément à l’article B.04.005 | ||
| (3) Fromage à la crème à tartiner; fromage à la crème à tartiner (avec indication des ingrédients ajoutés); fromage fondu (indication de la variété); fromage fondu (indication de la variété) (avec indication des ingrédients ajoutés); préparation de fromage fondu; préparation de fromage fondu (avec indication des ingrédients ajoutés); fromage fondu à tartiner; fromage fondu à tartiner (avec indication des ingrédients ajoutés); fromage conditionné à froid (indication de la variété); fromage conditionné à froid (indication de la variété) (avec indication des ingrédients ajoutés); préparation de fromage conditionné à froid; préparation de fromage conditionné à froid (avec indication des ingrédients ajoutés); fromage de petit-lait (indication de la variété) | (3) Bonnes pratiques industrielles | ||
| (4) Margarine | (4) Bonnes pratiques industrielles | ||
| (5) Aliments non normalisés | (5) Bonnes pratiques industrielles | ||
| S.9 | Citrate de sodium | (1) Confitures de (nom du fruit); confitures de (nom du fruit) avec pectine; confitures de pommes (ou de rhubarbe) et de (nom du fruit); crème; fromage cottage; fromage cottage à la crème; gelée de (nom du fruit); gelée de (nom du fruit) avec pectine; marmelade d’ananas ou de figues; marmelade d’ananas ou de figues avec pectine; marmelade de (nom des agrumes); marmelade de (nom des agrumes) avec pectine; mélange pour crème glacée; mélange pour lait glacé; sorbet laitier | (1) Bonnes pratiques industrielles |
| (2) Préparations pour nourrissons | (2) Bonnes pratiques industrielles | ||
| (3) Aliments non normalisés | (3) Bonnes pratiques industrielles | ||
| (4) Margarine | (4) Bonnes pratiques industrielles | ||
| S.12 | Fumarate de sodium | Aliments non normalisés | Bonnes pratiques industrielles |
| S.13 | Gluconate de sodium | Aliments non normalisés | Bonnes pratiques industrielles |
| S.14 | Hexamétaphosphate de sodium | Aliments non normalisés | Bonnes pratiques industrielles |
| S.15 | Hydroxyde de sodium | (1) Produits du cacao | (1) En quantité suffisante pour traiter les produits du cacao conformément à l’article B.04.005 |
| (2) Gélatine; lait écrémé (indication de l’arôme); lait partiellement écrémé (indication de l’arôme); marinade, saumure et mélange de salaison à sec employés dans le marinage des viandes conditionnées ou conservées et des sous-produits de viande conditionnés ou conservés; mélange pour crème glacée; mélange pour lait glacé | (2) Bonnes pratiques industrielles | ||
| (3) Préparations pour nourrissons | (3) Bonnes pratiques industrielles | ||
| (4) Margarine | (4) Bonnes pratiques industrielles | ||
| (5) Aliments non normalisés | (5) Bonnes pratiques industrielles | ||
| (6) Fromage de petit-lait; fromage de petit-lait (indication de la variété) | (6) Bonnes pratiques industrielles | ||
| S.16 | Lactate de sodium | (1) Margarine | (1) Bonnes pratiques industrielles |
| (2) Aliments non normalisés | (2) Bonnes pratiques industrielles | ||
| S.17 | Phosphate bisodique | (1) Ale; culture bactérienne; bière; crème; bière légère; liqueur de malt; porter; stout | (1) Bonnes pratiques industrielles |
| (2) Aliments non normalisés | (2) Bonnes pratiques industrielles | ||
| S.18 | Phosphate monosodique | (1) Ale; bière; bière légère; liqueur de malt; porter; stout | (1) Bonnes pratiques industrielles |
| (2) Aliments non normalisés | (2) Bonnes pratiques industrielles | ||
| S.19 | Phosphate trisodique | (1) Ale; bière; bière légère; liqueur de malt; porter; stout | (1) Bonnes pratiques industrielles |
| (2) Aliments non normalisés | (2) Bonnes pratiques industrielles | ||
| S.20 | Tartrate double de sodium et de potassium | (1) Confitures de pommes (ou de rhubarbe) et de (nom du fruit); confitures de (nom du fruit) avec pectine; gelée de (nom du fruit); gelée de (nom du fruit) avec pectine; marmelade de (nom des agrumes); marmelade de (nom des agrumes) avec pectine; marmelade d’ananas ou de figues; marmelade d’ananas ou de figues avec pectine | (1) Bonnes pratiques industrielles |
| (2) Aliments non normalisés | (2) Bonnes pratiques industrielles | ||
| (3) Margarine | (3) Bonnes pratiques industrielles | ||
| S.21 | Pyrophosphate tétrasodique | Aliments non normalisés | Bonnes pratiques industrielles |
| S.22 | Polyphosphate trisodique | Aliments non normalisés | Bonnes pratiques industrielles |
| S.23 | Acide sulfurique | Ale; bière; bière légère; liqueur de malt; porter; stout | Bonnes pratiques industrielles |
| S.24 | Acide sulfureux | Gélatine | Bonnes pratiques industrielles, pourvu que le produit fini contienne au plus 500 p.p.m. exprimées en anhydride sulfureux |
| T.1 | Acide tartrique | (1) Ale; asperges en conserve; bière; bière légère; cidre; confiture de (nom du fruit); confiture de (nom du fruit) avec pectine; confitures de pommes (ou de rhubarbe) et de (nom de fruit); gelée de (nom du fruit); gelée de (nom du fruit) avec pectine; liqueur de malt; marmelade d’ananas; marmelade d’ananas avec pectine; marmelade de (nom de l’agrume); marmelade de (nom de l’agrume) avec pectine; marmelade de figues; marmelade de figues avec pectine; mayonnaise; mélange pour crème glacée; mélange pour lait glacé; porter; poudre à pâte; sauce à salade; sauce vinaigrette; sorbet laitier; stout; vin; vin de miel; | (1) Bonnes pratiques industrielles |
| (2) Poires en conserve; fraises en conserve | (2) Bonnes pratiques industrielles | ||
| (3) Fromage à la crème à tartiner; fromage à la crème à tartiner (avec indication des ingrédients ajoutés); fromage fondu (indication de la variété); fromage fondu (indication de la variété) (avec indication des ingrédients ajoutés); préparation de fromage fondu; préparation de fromage fondu (avec indication des ingrédients ajoutés); fromage fondu à tartiner; fromage fondu à tartiner (avec indication des ingrédients ajoutés); fromage conditionné à froid (indication de la variété); fromage conditionné à froid (indication de la variété) (avec indication des ingrédients ajoutés); préparation de fromage conditionné à froid; préparation de fromage conditionné à froid (avec indication des ingrédients ajoutés); fromage de petit-lait (indication de la variété) | (3) Bonnes pratiques industrielles | ||
| (4) Margarine | (4) Bonnes pratiques industrielles | ||
| (5) Aliments non normalisés | (5) Bonnes pratiques industrielles | ||
| (6) Produits du cacao | (6) 1,0 %, seul ou en association avec de l’acide citrique, calculé sans matières grasses |
- DORS/78-874, art. 4
- DORS/79-660, art. 14 à 17
- DORS/79-664, art. 3 à 13
- DORS/79-752, art. 9
- DORS/80-501, art. 4
- DORS/86-1112, art. 6 à 8
- DORS/92-106, art. 1
- DORS/92-344, art. 5
- DORS/94-689, art. 2(F)
- DORS/95-281, art. 2 à 5
- DORS/95-436, art. 2 et 3
- DORS/97-263, art. 11 à 25
- DORS/97-561, art. 3
- DORS/98-580, art. 1(F)
- DORS/2001-94, art. 3
- DORS/2006-91, art. 13 à 20
- DORS/2007-75, art. 8
- DORS/2010-41, art. 9(A)
- DORS/2010-94, art. 8(A)
- DORS/2010-142, art. 56
- DORS/2010-143, art. 32 à 36
- DORS/2012-43, art. 32 à 34, 35(F) et 36
- DORS/2012-103, art. 1(F) et 2
TABLEAU XI
PARTIE I
Additifs alimentaires autorisés comme agents de conservation de la catégorie I
| Article | Colonne I | Colonne II | Colonne III |
|---|---|---|---|
| Additifs | Permis dans ou sur | Limites de tolérance | |
| A.1 | Acide acétique | (1) Poisson de salaison; viandes de salaison; sous-produits de viande de salaison; viande de volaille de salaison; sous-produits de viande de volaille de salaison; marinade; saumure et mélange de salaison à sec, employés dans l’apprêt des viandes de salaison ou des sous-produits de viande de salaison | (1) Bonnes pratiques industrielles |
| (2) Aliments non normalisés | (2) Bonnes pratiques industrielles | ||
| A.2 | Acide ascorbique | (1) Ale; asperges blanches en conserve; bière; bière légère; champignons en conserve; cidre; fruits congelés; glaçage pour poisson congelé; tête en fromage ou tête fromagée; liant à viande pour viandes conservées et sous-produits de viande conservée (titre 14 seulement); liqueur de malt; marinade injectable; poisson déchiqueté congelé; poisson conservé; poisson haché congelé; porter; saumure et mélange de salaison à sec employés dans le conditionnement des viandes ou des sous-produits de viande; sous-produits de viande conservés; sous-produits de viande de volaille conservés; stout; thon en conserve; viande conservée; viande de volaille conservée; vin | (1) Bonnes pratiques industrielles |
| (2) Compote de pommes en conserve | (2) S’il est utilisé seul ou en combinaison avec l’acide isoascorbique, la quantité totale n’excède pas 150 p.p.m. | ||
| (3) Pêches en conserve | (3) 550 p.p.m. | ||
| (4) Aliments non normalisés | (4) Bonnes pratiques industrielles | ||
| (5) Mandarines en conserve | (5) 400 p.p.m. | ||
| C.1 | Ascorbate de calcium | Mêmes aliments que pour l’acide ascorbique | Mêmes limites de tolérance que pour l’acide ascorbique |
| E.1 | Acide érythorbique | (1) Ale; bière; cidre; fruits congelés; tête en fromage ou tête fromagée; bière légère; liqueur de malt; liant à viande pour viandes de salaison et sous-produits de la viande de salaison (Titre 14 seulement); porter; poisson de salaison; poisson haché congelé; poisson déchiqueté congelé; glaçage pour poisson congelé; viande de salaison; sous-produits de la viande de salaison; viande de volaille de salaison; sous-produits de la viande de volaille de salaison; marinade; saumure et mélange de salaison à sec employés dans le conditionnement des viandes ou des sous-produits de la viande de salaison; stout; vin | (1) Bonnes pratiques industrielles |
| (2) Compote de pommes en conserve | (2) S’il est utilisé seul ou en combinaison avec l’acide ascorbique, la quantité totale n’excède pas 150 p.p.m. | ||
| (3) Aliments non normalisés | (3) Bonnes pratiques industrielles | ||
| I.1 | Acide isoascorbique | Mêmes aliments que pour l’acide érythorbique | Mêmes limites de tolérance que pour l’acide érythorbique |
| P.1 | Nitrate de potassium | (1) Liant à viande pour saucisse séchée; saucisse semi-séchée; viande conservée et sous-produits de viande conservée, préparés selon des méthodes de salaison lente (Titre 14) | (1) Si le liant à viande est utilisé selon le mode d’emploi donné sur l’étiquette, que le nitrate de potassium soit ajouté seul ou avec du nitrate de sodium, la quantité totale de tels nitrates ainsi ajoutée à chaque lot de saucisse séchée, de saucisse semi-séchée, de viande conservée, ou de sous-produits de viande conservée ne doit pas excéder 0,32 once par 100 livres ou 200 parties par million, calculée avant que le produit ne soit fumé, cuit ou fermenté. |
| (2) Saumure et mélange de salaison à sec employés dans le marinage des viandes conservées et des sous-produits de viande conservée, préparés selon des méthodes de salaison lente (Titre 14) | (2) Si la saumure ou le mélange de salaison à sec est utilisé selon le mode d’emploi donné sur l’étiquette, que le nitrate de potassium soit ajouté seul ou avec du nitrate de sodium, la quantité totale de tels nitrates ainsi ajouté à chaque lot de viande conservée ou de sous-produits de viande conservée ne doit pas excéder 0,32 once par 100 livres ou 200 parties par million, calculée avant que le produit ne soit fumé, cuit ou fermenté. | ||
| (3) Saucisse séchée; saucisse semi-séchée; viande conservée et sous-produits de viande conservée, préparés selon des méthodes de salaison lente (Titre 14) | (3) Si le nitrate de potassium est ajouté seul ou avec du nitrate de sodium, la quantité totale de tels nitrates ajoutée à chaque lot de saucisse séchée, de saucisse semi-séchée, de viande conservée, ou de sous-produits de viande conservée ne doit pas excéder 0,32 once par 100 livres ou 200 parties par million, calculée avant que le produit ne soit fumé, cuit ou fermenté. | ||
| (4) Fromage mûri, ne contenant pas plus de 68 % d’humidité calculée sur la matière non-grasse, et dans la fabrication duquel la fermentation de l’acide lactique et le salage sont complétés plus de 12 heures après la coagulation de la caillebotte par des enzymes alimentaires, et à l’extérieur duquel on applique du sel, soit à l’état sec ou sous forme de saumure | (4) S’il est utilisé seul ou avec du nitrate de sodium, le produit contiendra une quantité maximale de 200 p.p.m. (basée sur le lait). Le résidu dans le fromage fini ne devra pas excéder 50 p.p.m. | ||
| (5) Fromage mûri; moulé; empaqueté à vide | (5) S’il est utilisé seul ou avec du nitrate de sodium, le produit contiendra une quantité maximale de 200 p.p.m. (basée sur le lait). Le résidu dans le fromage fini ne devra pas excéder 50 p.p.m. | ||
| P.2 | Nitrite de potassium | (1) Liant à viande; marinade; saumure et mélange de salaison à sec, utilisés dans le marinage de la viande conservée et des sous-produits de viande conservée (Titre 14) | (1) Si le liant à viande, la saumure ou le mélange de salaison à sec est utilisé selon le mode d’emploi donné sur l’étiquette, que le nitrite de potassium soit ajouté seul ou avec du nitrite de sodium, la quantité totale de tels nitrites ajoutée à chaque lot de viande conservée ou de sous-produits de viande conservée ne doit pas excéder 0,32 once par 100 livres ou 200 parties par million, calculée avant que le produit ne soit fumé, cuit ou fermenté. |
| (2) Viande conservée, sauf le bacon de flanc, et sous-produits de viande conservée (Titre 14) | (2) Si le nitrite de potassium est ajouté seul ou avec du nitrite de sodium, la quantité totale de tels nitrites ajoutée à chaque lot de viande conservée, sauf le bacon de flanc, ou de sous-produits de viande conservée ne doit pas excéder 0,32 once par 100 livres ou 200 parties par million, calculée avant que le produit ne soit fumé, cuit ou fermenté. | ||
| (3) Bacon de flanc | (3) Si le nitrite de potassium est ajouté seul ou avec du nitrite de sodium, la quantité totale de tels nitrites ajoutée à chaque lot de bacon de flanc ne doit pas excéder 0,19 once par 100 livres ou 120 parties par million, calculée avant que le produit ne soit fumé, cuit ou fermenté. | ||
| (4) Viande de volaille conservée et sous-produits de viande de volaille conservée (Titre 22) | (4) Si le nitrite de potassium est ajouté seul ou avec du nitrite de sodium, la quantité totale de tels nitrites ajouté à chaque lot de viande de volaille conservée et de sous-produits de viande de volaille conservée ne doit pas excéder 0,32 once par 100 livres ou 200 parties par million, calculée avant que le produit ne soit fumé, cuit ou fermenté. | ||
| S.1 | Ascorbate de sodium | Mêmes aliments que pour l’acide ascorbique | Mêmes limites de tolérance que pour l’acide ascorbique |
| S.2 | Erythorbate de sodium | (1) Mêmes aliments que pour l’acide érythorbique | (1) Mêmes limites de tolérance que pour l’acide érythorbique |
| (2) Clams en conserve | (2) 350 p.p.m. | ||
| S.3 | Iso-ascorbate de sodium | Mêmes aliments que pour l’acide érythorbique | Mêmes limites de tolérance que pour l’acide érythorbique |
| S.4 | Nitrate de sodium | (1) Liant à viande pour saucisse séchée; saucisse semi-séchée; viande conservée et sous-produits de viande conservée, préparés selon des méthodes de salaison lente (Titre 14) | (1) Si le liant à viande est utilisé selon le mode d’emploi donné sur l’étiquette, que le nitrate de sodium soit ajouté seul ou avec du nitrate de potassium, la quantité totale de tels nitrates ainsi ajoutée à chaque lot de saucisse séchée, de saucisse semi-séchée, de viande conservée ou de sous-produits de viande conservée, ne doit pas excéder 0,32 once par 100 livres ou 200 parties par million, calculée avant que le produit ne soit fumé, cuit ou fermenté. |
| (2) Saumure et mélange de salaison à sec utilisés dans le marinage de viande conservée et de sous-produits de viande conservée, préparés selon des méthodes de salaison lente (Titre 14) | (2) Si la saumure ou le mélange de salaison à sec est utilisé selon le mode d’emploi donné sur l’étiquette, que le nitrate de sodium soit ajouté seul ou avec du nitrate de potassium, la quantité totale de tels nitrates ainsi ajoutée à chaque lot de viande conservée ou de sous-produits de viande conservée ne doit pas excéder 0,32 once par 100 livres ou 200 parties par million, calculée avant que le produit ne soit fumé, cuit ou fermenté. | ||
| (3) Saucisse séchée; saucisse semi-séchée; viande conservée et sous-produits de viande conservée, préparés selon des méthodes de salaison lente (Titre 14) | (3) Si le nitrate de sodium est ajouté seul ou avec du nitrate de potassium, la quantité totale de tels nitrates ajoutée à chaque lot de saucisse séchée, de saucisse semi-séchée, de viande conservée ou de sous-produits de viande conservée ne doit pas excéder 0,32 once par 100 livres ou 200 parties par million, calculée avant que le produit ne soit fumé, cuit ou fermenté. | ||
| (4) Fromage mûri, ne contenant pas plus de 68 % d’humidité calculée sur la matière non-grasse, et dans la fabrication duquel la fermentation de l’acide lactique et le salage sont complétés plus de 12 heures après la coagulation de la caillebotte par des enzymes alimentaires et à l’exception duquel on applique du sel, soit à l’état sec ou sous forme de saumure | (4) S’il est utilisé seul ou avec du nitrate de potassium, le produit contiendra une quantité maximale de 200 p.p.m. (basée sur le lait). Le résidu dans le fromage fini ne devra pas excéder 50 p.p.m. | ||
| (5) Fromage mûri; moulé; empaqueté à vide | (5) S’il est utilisé seul ou avec du nitrate de potassium, le produit contiendra une quantité maximale de 200 p.p.m. (basée sur le lait). Le résidu dans le fromage fini ne devra pas excéder 50 p.p.m. | ||
| S.5 | Nitrite de sodium | (1) Liant à viande; marinade; saumure et mélange de salaison à sec utilisés pour le marinage de viande conservée et de sous-produits de viande conservée (Titre 14) | (1) Si le liant à viande, la marinade, la saumure ou le mélange de salaison à sec est utilisé selon le mode d’emploi donné sur l’étiquette, que le nitrite de sodium soit ajouté seul ou avec du nitrite de potassium, la quantité totale de tels nitrites ainsi ajoutée à chaque lot de viande conservée ou de sous-produits de viande conservée ne doit pas excéder 0,32 once par 100 livres ou 200 parties par million, calculée avant que le produit ne soit fumé, cuit ou fermenté. |
| (2) Viande conservée, sauf le bacon, et sous-produits de viande conservée (Titre 14) | (2) Si le nitrite de sodium est ajouté seul ou avec du nitrite de potassium, la quantité totale de tels nitrites ajoutée à chaque lot de viande conservée, sauf le bacon de flanc, ou de sous-produits de viande conservée, ne doit pas excéder 0,32 once par 100 livres ou 200 parties par million, calculée avant que le produit ne soit fumé, cuit ou fermenté. | ||
| (3) Bacon de flanc | (3) Si le nitrite de sodium est ajouté seul ou avec du nitrite de potassium, la quantité totale de tels nitrites ajoutée à chaque lot de bacon de flanc ne doit pas excéder 0,19 once par 100 livres ou 120 parties par million, calculée avant que le produit ne soit fumé, cuit ou fermenté. | ||
| (4) Viande de volaille conservée et sous-produits de viande de volaille conservée (Titre 22) | (4) Si le nitrite de sodium est ajouté seul ou avec du nitrite de potassium, la quantité totale de tels nitrites ajoutée à chaque lot de viande de volaille conservée ou de sous-produits de viande de volaille conservée ne doit pas excéder 0,32 once par 100 livres ou 200 parties par million, calculée avant que le produit ne soit fumé, cuit ou fermenté. | ||
| W.1 | Fumée de bois | (1) Fromage (indication de la variété); fromage fondu (indication de la variété); fromage fondu (indication de la variété) (avec indication des ingrédients ajoutés); préparation de fromage fondu; préparation de fromage fondu (avec indication des ingrédients ajoutés); fromage fondu à tartiner; fromage fondu à tartiner (avec indication des ingrédients ajoutés); fromage conditionné à froid (indication de la variété); fromage conditionné à froid (indication de la variété) (avec indication des ingrédients ajoutés); préparation de fromage conditionné à froid; préparation de fromage conditionné à froid (avec indication des ingrédients ajoutés) | (1) Bonnes pratiques industrielles |
| (2) Poisson conservé; viande conservée (titres 14 et 21); sous-produits de viande conservés (titres 14 et 21); viande de volaille conservée; sous-produits de viande de volaille conservés; saucisses | (2) Bonnes pratiques industrielles | ||
| (3) Aliments non normalisés | (3) Bonnes pratiques industrielles |
PARTIE II
Additifs alimentaires autorisés comme agents de conservation de la catégorie II
| Article | Colonne I | Colonne II | Colonne III |
|---|---|---|---|
| Additifs | Permis dans ou sur | Limites de tolérance | |
| B.1 | Acide benzoïque | (1) Achards (relish); catsup de tomates; confiture de (nom du fruit); confiture de (nom du fruit) avec pectine; confiture de pommes (ou de rhubarbe) et de (nom du fruit); cornichons; gelée de (nom du fruit) avec pectine; jus de (nom du fruit); jus de (nom du fruit) concentré sauf le jus d’orange concentré congelé; jus de (noms des fruits); marmelade d’ananas avec pectine; marmelade de figues avec pectine; marmelade de (nom de l’agrume) avec pectine; mincemeat; pâte de tomates; produits de poisson ou de chair de poisson emballés, marinés ou conditionnés à froid par une autre méthode (Titre 21); pulpe de tomates; purée de tomates | (1) 1 000 p.p.m. |
| (2) 1 000 p.p.m. | ||
| (3) Margarine | (3) Si utilisé seul ou en association avec de l’acide sorbique; la quantité totale ne doit pas excéder 1 000 p.p.m. | ||
| C.1 | Sorbate de calcium | Mêmes aliments que pour l’acide sorbique | Mêmes limites de tolérance que pour l’acide sorbique |
| C.2 | Carnobacterium maltaromaticum CB1 | (1) Saucisse fumée emballée sous vide | (1) Bonnes pratiques industrielles |
| (2) Rôti de boeuf tranché emballé sous vide conformément à l’article B.14.005 | (2) Bonnes pratiques industrielles | ||
| (3) Jambon cuit tranché emballé sous vide conformément à l’article B.14.005 ou B.14.031 | (3) Bonnes pratiques industrielles | ||
| (4) Dinde cuite tranchée emballée sous vide conformément à l’article B.22.006 ou B.22.021 | (4) Bonnes pratiques industrielles | ||
| H.1 | 4-Hexylrésorcine | Crustacés | Bonnes pratiques industrielles. Les résidus dans la partie comestible du produit non cuit ne doivent pas dépasser 1,0 p.p.m. |
| M.1 | Benzoate de p-hydroxyméthyle | (1) Achards (relish); catsup de tomates; confiture de (nom du fruit); confiture de (nom du fruit) avec pectine; confiture de pommes (ou de rhubarbe) et de (nom du fruit); cornichons; gelée de (nom du fruit) avec pectine; jus de (nom du fruit); jus de (nom du fruit) concentré sauf le jus d’orange concentré congelé; jus de (noms des fruits); marmelade d’ananas avec pectine; marmelade de figues avec pectine; marmelade de (nom de l’agrume) avec pectine; mincemeat; pâte de tomates; produits de poisson ou de chair de poisson emballés, marinés ou conditionnés à froid par une autre méthode (Titre 21); pulpe de tomates; purée de tomates | (1) 1 000 p.p.m. |
| (2) 1 000 p.p.m. | ||
| M.2 | Méthylparabène | Mêmes aliments que pour le benzoate de p-hydroxyméthyle | Mêmes limites de tolérance que pour le benzoate de p-hydroxyméthyle |
| P.1 | Benzoate de potassium | Mêmes aliments que pour l’acide benzoïque | 1 000 p.p.m., calculé en acide benzoïque |
| P.2 | Bisulfite de potassium | Mêmes aliments que pour l’anhydride sulfureux | Mêmes limites de tolérance que pour l’anhydride sulfureux |
| P.3 | Métabisulfite de potassium | Mêmes aliments que pour l’anhydride sulfureux | Mêmes limites de tolérance que pour l’anhydride sulfureux |
| P.4 | Sorbate de potassium | Mêmes aliments que pour l’acide sorbique | Mêmes limites de tolérance que pour l’acide sorbique |
| P.5 | Benzoate de p-hydroxypropyle | (1) Achards (relish); catsup de tomates; confiture de (nom du fruit); confiture de (nom du fruit) avec pectine; confiture de pommes (ou de rhubarbe) et de (nom du fruit); cornichons; gelée de (nom du fruit) avec pectine; jus de (nom du fruit); jus de (nom du fruit) concentré sauf le jus d’orange concentré congelé; jus de (noms des fruits); marmelade d’ananas avec pectine; marmelade de figues avec pectine; marmelade de (nom de l’agrume) avec pectine; mincemeat; pâte de tomates; produits de poisson ou de chair de poisson emballés, marinés ou conditionnés à froid par une autre méthode (Titre 21); pulpe de tomates; purée de tomates | (1) 1 000 p.p.m. |
| (2) 1 000 p.p.m. | ||
| P.6 | Propylparabène | Mêmes aliments que pour le benzoate de p-hydroxypropyle | Mêmes limites de tolérance que pour le benzoate de p-hydroxypropyle |
| S.01 | Acétate de sodium | (1) Fromage de porc; pain de viande; saucisse; sous-produits de viande conditionnés ou conservés; sous-produits de viande de volaille conditionnés ou conservés; sous-produits de viande en pain; sous-produits de viande en pot; sous-produits de viande préparés; sous-produits de viande de volaille préparés; tête fromagée; viande conditionnée ou conservée; viande de volaille conditionnée ou conservée; viande de volaille préparée; viande en pot; viande préparée | (1) Bonnes pratiques industrielles |
| (2) Bonnes pratiques industrielles | ||
| S.1 | Benzoate de sodium | Mêmes aliments que pour l’acide benzoïque | 1 000 p.p.m., calculé en acide benzoïque |
| S.2 | Bisulfite de sodium | Mêmes aliments que pour l’anhydride sulfureux | Mêmes limites de tolérance que pour l’anhydride sulfureux |
| S.21 | Diacétate de sodium | (1) Fromage de porc; pain de viande; poisson et viande préparés (Titre 21); poisson de salaison et chair de poisson de salaison (Titre 21); saucisse; sous-produits de viande conditionnés ou conservés; sous-produits de viande de volaille conditionnés ou conservés; sous-produits de viande en pain; sous-produits de viande en pot; sous-produits de viande préparés; sous-produits de viande de volaille préparés; tête fromagée; viande conditionnée ou conservée; viande de volaille conditionnée ou conservée; viande de volaille préparée; viande en pot; viande préparée | (1) 0,25 % du poids final du produit |
| (2) 0,25 % du poids final du produit | ||
| S.3 | Métabisulfite de sodium | Mêmes aliments que pour l’anhydride sulfureux | Mêmes limites de tolérance que pour l’anhydride sulfureux |
| S.4 | Sel sodique de l’acide p-hydroxyméthyl benzoïque | Mêmes aliments que pour le benzoate de p-hydroxyméthyle | 1 000 p.p.m., calculé en benzoate de p-hydroxyméthyle |
| S.5 | Sel sodique de l’acide p-hydroxypropyl | Mêmes aliments que pour le benzoate de p-hydroxypropyle | 1 000 p.p.m., calculé en benzoate de p-hydroxypropyle |
| S.6 | Sorbate de sodium | Mêmes aliments que pour l’acide sorbique | Mêmes limites de tolérance que pour l’acide sorbique |
| S.7 | Sulfite de sodium | Mêmes aliments que pour l’anhydride sulfureux | Mêmes limites de tolérance que pour l’anhydride sulfureux |
| S.8 | Dithionite de sodium | Mêmes aliments que pour l’anhydride sulfureux | Mêmes limites de tolérance que pour l’anhydride sulfureux |
| S.9 | Acide sorbique | (1) Achards (relish); catsup de tomates; confiture de (nom du fruit); confiture de (nom du fruit) avec pectine; confiture de pommes (ou de rhubarbe) et de (nom du fruit); cornichons; gelée de (nom du fruit) avec pectine; jus de (nom du fruit); jus de (nom du fruit) concentré sauf le jus d’orange concentré congelé; jus de (noms des fruits); marmelade d’ananas avec pectine; marmelade de figues avec pectine; marmelade de (nom de l’agrume) avec pectine; mincemeat; pâte de poisson fumé et salé conditionnée à froid; pâte de tomates; poisson desséché, fumé ou salé; pulpe de tomates; purée de tomates; sirop (nom de la source de glucose) | (1) 1 000 p.p.m. |
| (2) 1 000 p.p.m. | ||
| (3) Saumure d’olive | (3) 300 p.p.m. | ||
| (4) Margarine | (4) Si utilisé seul ou en association avec de l’acide benzoïque, la quantité totale ne doit pas excéder 1 000 p.p.m. | ||
| (5) Sauces à salade non normalisées | (5) 3 350 p.p.m. | ||
| S.10 | Anhydride sulfureux | (1) Cidre; vin de miel; vin | (1) 70 p.p.m. à l’état libre, ou 350 p.p.m. en combinaison, calculé en anhydride sulfureux |
| (2) Ale; bière; bière légère; liqueur de malt; porter; stout | (2) 15 p.p.m., calculé en anhydride sulfureux | ||
| (3) Achards (relish); catsup de tomates; confiture de (nom du fruit); confiture de (nom du fruit) avec pectine; confiture de pommes (ou de rhubarbe) et de (nom du fruit); cornichons; gélatine; gelée de (nom du fruit) avec pectine; jus de (nom du fruit); jus de (nom du fruit) concentré sauf le jus d’orange concentré congelé; jus de (noms des fruits); marmelade d’ananas avec pectine; marmelade de figues avec pectine; marmelade de (nom de l’agrume) avec pectine; mélasse de raffineur; mélasse de table; mélasse qualité fantaisie; mincemeat; pâte de tomates; pommes tranchées, congelées; pulpe de tomates; purée de tomates; sirop (nom de la source de glucose) | (3) 500 p.p.m., calculé en anhydride sulfureux | ||
| (4) Boissons non normalisées | (4) 100 p.p.m., calculé en anhydride sulfureux | ||
| (5) Fruits et légumes desséchés | (5) 2 500 p.p.m., calculé en anhydride sulfureux | ||
| (6) 500 p.p.m., calculé en anhydride sulfureux | ||
| (7) Champignons congelés | (7) 90 p.p.m, calculé en anhydride sulfureux | ||
| (8) Dextrose anhydre; monohydrate de dextrose | (8) 20 p.p.m., calculé en anhydride sulfureux | ||
| (9) Glucose ou sirop de glucose | (9) 40 p.p.m., sauf pour le glucose ou le sirop de glucose utilisés pour la fabrication des confiseries, pas plus de 400 p.p.m. calculé en anhydride sulfureux | ||
| (10) Solides de glucose ou sirop de glucose déshydraté | (10) 40 p.p.m., sauf pour les solides de glucose ou le sirop de glucose déshydraté utilisés pour la fabrication des confiseries, pas plus de 150 p.p.m. calculé en anhydride sulfureux | ||
| (11) Crustacés | (11) Bonnes pratiques industrielles. Les résidus dans la partie comestible du produit non cuit ne doivent pas dépasser 100 p.p.m., calculé en anhydride sulfureux. |
PARTIE III
Additifs alimentaires autorisés comme agents de conservation de la catégorie III
| Article | Colonne I | Colonne II | Colonne III |
|---|---|---|---|
| Additifs | Permis dans ou sur | Limites de tolérance | |
| C.1 | Propionate de calcium | (1) Mêmes aliments que pour l’acide propionique | (1) 2 000 p.p.m., calculé sous forme d’acide propionique |
| (2) Tortillas molles | (2) 4 000 p.p.m. | ||
| C.2 | Sorbate de calcium | Mêmes aliments que pour l’acide sorbique | Mêmes limites de tolérance que pour l’acide sorbique |
| N.1 | Natamycine | (1) La surface du fromage (indication de la variété) et du fromage cheddar | (1) 20 p.p.m., conformément aux exigences des articles B.08.033 et B.08.034 |
| (2) La surface du fromage râpé fin ou en filaments (indication de la variété) et du fromage cheddar râpé fin ou en filaments | (2) 10 p.p.m., conformément aux exigences des articles B.08.033 et B.08.034 | ||
| P.1 | Sorbate de potassium | (1) Mêmes aliments que pour l’acide sorbique | (1) Mêmes limites de tolérance que pour l’acide sorbique |
| (2) Tortillas molles | (2) 5 000 p.p.m. | ||
| P.2 | Acide propionique | (1) Pain | (1) 2 000 p.p.m. |
| (2) Fromage (indication de la variété); fromage cheddar; fromage à la crème; fromage à la crème (avec indication des ingrédients ajoutés); fromage à la crème à tartiner; fromage à la crème à tartiner (avec indication des ingrédients ajoutés); fromage fondu (indication de la variété); fromage fondu (indication de la variété) (avec indication des ingrédients ajoutés); préparation de fromage fondu; préparation de fromage fondu (avec indication des ingrédients ajoutés); fromage fondu à tartiner; fromage fondu à tartiner (avec indication des ingrédients ajoutés); fromage conditionné à froid (indication de la variété); fromage conditionné à froid (indication de la variété) (avec indication des ingrédients ajoutés); préparation de fromage conditionné à froid; préparation de fromage conditionné à froid (avec indication des ingrédients ajoutés) | (2) 2 000 p.p.m. ou 3 000 p.p.m., suivant le cas, conformément aux exigences des articles B.08.033, B.08.034, B.08.035, B.08.037, B.08.038, B.08.039, B.08.040, B.08.041, B.08.041.1, B.08.041.2, B.08.041.3, B.08.041.4, B.08.041.5, B.08.041.6, B.08.041.7 et B.08.041.8 | ||
| (3) 2 000 p.p.m. | ||
| S.1 | Diacétate de sodium | (1) Pain; | (1) 3 000 p.p.m. |
| (2) 3 000 p.p.m. | ||
| S.2 | Propionate de sodium | Mêmes aliments que pour l’acide propionique | 2 000 p.p.m., calculé en acide propionique |
| S.3 | Sorbate de sodium | Mêmes aliments que pour l’acide sorbique | Mêmes limites de tolérance que pour l’acide sorbique |
| S.4 | Acide sorbique | (1) Pain | (1) 1 000 p.p.m. |
| (2) Fromage (indication de la variété); fromage cheddar; fromage à la crème; fromage à la crème (avec indication des ingrédients ajoutés); fromage à la crème à tartiner; fromage à la crème à tartiner (avec indication des ingrédients ajoutés); fromage fondu (indication de la variété); fromage fondu (indication de la variété) (avec indication des ingrédients ajoutés); préparation de fromage fondu; préparation de fromage fondu (avec indication des ingrédients ajoutés); fromage fondu à tartiner; fromage fondu à tartiner (avec indication des ingrédients ajoutés); fromage conditionné à froid (indication de la variété); fromage conditionné à froid (indication de la variété) (avec indication des ingrédients ajoutés); préparation de fromage conditionné à froid; préparation de fromage conditionné à froid (avec indication des ingrédients ajoutés) | (2) 3 000 p.p.m., conformément aux exigences des articles B.08.033, B.08.034, B.08.035, B.08.037, B.08.038, B.08.039, B.08.040, B.08.041, B.08.041.1, B.08.041.2, B.08.041.3, B.08.041.4, B.08.041.5, B.08.041.6, B.08.041.7 et B.08.041.8 | ||
| (3) Cidre; vin; vin de miel | (3) 500 p.p.m. | ||
| (4) 1 000 p.p.m. |
PARTIE IV
Additifs alimentaires autorisés comme agents de conservation de la catégorie IV
| Article | Colonne I | Colonne II | Colonne III |
|---|---|---|---|
| Additifs | Permis dans ou sur | Limites de tolérance | |
| A.1 | Acide ascorbique | (1) Huiles et graisses; saindoux; monoglycérides et diglycérides; shortening | (1) Bonnes pratiques industrielles |
| (2) Aliments non normalisés | (2) Bonnes pratiques industrielles | ||
| A.2 | Palmitate d’ascorbyle | (1) Huiles et graisses; saindoux; monoglycérides et diglycérides; shortening | (1) Bonnes pratiques industrielles |
| (2) Bonnes pratiques industrielles | ||
| (3) Margarine | (3) 0,02 % de la teneur en gras. Si on emploie aussi le stéarate d’ascorbyle, la quantité totale ne doit pas excéder 0,02 % de la teneur en gras | ||
| (4) Préparations pour nourrissons | (4) 0,001% de la préparation pour nourrissons prête à consommer | ||
| A.3 | Stéarate d’ascorbyle | (1) Graisses et huiles; saindoux; monoglycérides et diglycérides; shortening | (1) Bonnes pratiques industrielles |
| (2) Margarine | (2) 0,02 % de la teneur en gras. Si on emploie aussi le palmitate d’ascorbyle, la quantité totale ne doit pas excéder 0,02 % de la teneur en gras | ||
| B.1 | Hydroxyanisole butylé (mélange de 2-tertiobutyl-4-hydroxyanisole et de 3-tertiobutyl-4-hydroxyanisole) | (1) Graisses et huiles, saindoux, shortening | (1) 0,02 %. Si on emploie aussi l’hydroxytoluène butylé, l’hydroquinone de butyle tertiaire ou le gallate de propyle, seul ou en association, la quantité totale ne doit pas dépasser 0,02 % |
| (2) Céréales à déjeuner sèches; produits déshydratés de pommes de terre | (2) 0,005 %. Si on emploie aussi l’hydroxytoluène butylé ou le gallate de propyle, ou les deux, la quantité totale ne doit pas dépasser 0,005 % | ||
| (3) Gomme à mâcher | (3) 0,02 %. Si on emploie aussi l’hydroxytoluène butylé ou le gallate de propyle, ou les deux, la quantité totale ne doit pas dépasser 0,02 % | ||
| (4) Huiles essentielles; essences à base d’huile d’agrumes; substances aromatiques sèches | (4) 0,125 %. Si on emploie aussi l’hydroxytoluène butylé ou le gallate de propyle, ou les deux, la quantité totale ne doit pas dépasser 0,125 % | ||
| (5) Huiles d’agrumes | (5) 0,5 %. Si on emploie aussi l’hydroxytoluène butylé ou le gallate de propyle, ou les deux, la quantité totale ne doit pas dépasser 0,5 % | ||
| (6) Tissus gras de porc ou de boeuf partiellement dégraissés | (6) 0,0065 %. Si on emploie aussi l’hydroxytoluène butylé, la quantité ne doit pas en dépasser 0,0065 % | ||
| (7) Liquides renfermant de la vitamine A et devant servir d’additifs alimentaires | (7) 5 mg/1 000 000 unités internationales | ||
| (8) Mélanges secs pour boissons; mélanges secs pour desserts et confiseries | (8) 0,009 % | ||
| (9) Levure active séchée | (9) 0,1 % | ||
| (10) 0,02 % de la teneur de l’aliment en gras ou en huile. Si on emploie aussi l’hydroxytoluène butylé ou le gallate de propyle, ou les deux, la quantité totale ne doit pas dépasser 0,02 % de la teneur de l’aliment en gras ou en huile | ||
| (11) Préparations sèches de vitamine D devant être ajoutées aux aliments | (11) 10 mg/1 000 000 unités internationales | ||
| (12) Margarine | (12) 0,01 % de la teneur en gras. Si on emploie aussi l’hydroxytoluène butylé ou le gallate de propyle ou les deux, la quantité totale ne doit pas excéder 0,01 % de la teneur en gras | ||
| (13) Viande de volaille cuite et séchée | (13) 0,015 % de la teneur en gras. Si on emploie aussi le gallate de propyle ou l’acide citrique, ou les deux, la quantité totale ne doit pas excéder 0,015 % de la teneur en gras. | ||
| B.2 | Hydroxytoluène butylé (3,5-ditertiobutyl-4-hydroxytoluène) | (1) Graisses et huiles, saindoux, shortening | (1) 0,02 %. Si on emploie aussi l’hydroxyanisole butylé, l’hydroquinone de butyle tertiaire ou le gallate de propyle, seul ou en association, la quantité totale ne doit pas dépasser 0,02 % |
| (2) Céréales à déjeuner sèches; produits de pommes de terre déshydratés | (2) 0,005 %. Si on emploie aussi l’hydroxyanisole butylé ou le gallate de propyle, ou les deux, la quantité totale ne doit pas dépasser 0,005 % | ||
| (3) Gomme à mâcher | (3) 0,02 %. Si on emploie aussi l’hydroxyanisole butylé ou le gallate de propyle, ou les deux, la quantité totale ne doit pas dépasser 0,02 % | ||
| (4) Huiles essentielles; essences à base d’huiles d’agrumes; substances aromatiques sèches | (4) 0,125 %. Si on emploie aussi l’hydroxyanisole butylé ou le gallate de propyle, ou les deux, la quantité totale ne doit pas dépasser 0,125 % | ||
| (5) Huiles d’agrumes | (5) 0,5 %. Si on emploie aussi l’hydroxyanisole butylé ou le gallate de propyle, ou les deux, la quantité totale ne doit pas dépasser 0,5 % | ||
| (6) Tissus gras de porc ou de boeuf, partiellement dégraissés | (6) 0,0065 %. Si on emploie aussi l’hydroxyanisole butylé, la quantité ne doit pas en dépasser 0,0065 % | ||
| (7) Liquides renfermant de la vitamine A et devant servir d’additifs alimentaires | (7) 5 mg/1 000 000 unités internationales | ||
| (8) Riz à demi cuit | (8) 0,0035 % | ||
| (9) 0,02 % de la teneur de l’aliment en gras ou en huile. Si on emploie aussi l’hydroxyanisole butylé ou le gallate de propyle, ou les deux, la quantité totale ne doit pas dépasser 0,02 % de la teneur de l’aliment en gras ou en huile | ||
| (10) Préparations sèches de vitamine D à ajouter aux aliments | (10) 10 mg/1 000 000 unités internationales | ||
| (11) Margarine | (11) 0,01 % de la teneur en gras. Si on emploie aussi l’hydroxyanisole butylé ou le gallate de propyle ou les deux, la quantité totale ne doit pas excéder 0,01 % de la teneur en gras | ||
| C.1 | Acide citrique | (1) Graisses et huiles; saindoux; monoglycérides et diglycérides; shortening | (1) Bonnes pratiques industrielles |
| (2) Bonnes pratiques industrielles | ||
| (3) Viande de volaille cuite et séchée | (3) 0,015 % de la teneur en gras. Si on emploie aussi l’hydroxyanisole butylé ou le gallate de propyle, ou les deux, la quantité totale ne doit pas excéder 0,015 % de la teneur en gras. | ||
| C.1.01 | Esters citriques des mono- et diglycérides | (1) Graisses et huiles; monoglycérides et diglycérides; saindoux; shortening | (1) Bonnes pratiques industrielles |
| (2) Bonnes pratiques industrielles | ||
| (3) Margarine | (3) 0,01 % de la teneur en gras. Si on emploie aussi le citrate de monoglycéride, le citrate de monoisopropyle ou le citrate de stéaryle, seul ou en association, la quantité totale ne doit pas dépasser 0,01 % de la teneur en gras | ||
| C.1.1 | L-cystéine | Suppléments nutritifs conformes à l’article B.24.201 | Bonnes pratiques industrielles |
| C.2 | Chlorhydrate de L-cystéine | Formules de remplacement des sulfites pour les fruits et les légumes préparés | Bonnes pratiques industrielles |
| G.1 | Résine de gaïac | (1) Graisses et huiles; saindoux; monoglycérides et diglycérides; shortening | (1) Bonnes pratiques industrielles |
| (2) Bonnes pratiques industrielles | ||
| L.1 | Lécithine | (1) Graisses et huiles; saindoux; monoglycérides et diglycérides; shortening | (1) Bonnes pratiques industrielles |
| (2) Bonnes pratiques industrielles | ||
| L.2 | Citrate de lécithine | (1) Graisses et huiles; saindoux; monoglycérides et diglycérides; shortening | (1) Bonnes pratiques industrielles |
| (2) Bonnes pratiques industrielles | ||
| M.1 | Citrate de monoglycéride | (1) Graisses et huiles; saindoux; monoglycérides et diglycérides; shortening | (1) Bonnes pratiques industrielles |
| (2) Bonnes pratiques industrielles | ||
| (3) Margarine | (3) 0,01 % de la teneur en gras. Si on emploie aussi le citrate de monoisopropyle, le citrate de stéaryle ou les esters citriques des mono- et diglycérides, seuls ou en association, la quantité totale ne doit pas dépasser 0,01 % de la teneur en gras | ||
| M.2 | Citrate de monoisopropyle | (1) Graisses et huiles; saindoux; monoglycérides et diglycérides; shortening | (1) Bonnes pratiques industrielles |
| (2) Bonnes pratiques industrielles | ||
| (3) Margarine | (3) 0,01 % de la teneur en gras. Si on emploie aussi le citrate de monoglycéride, le citrate de stéaryle ou les esters citriques des mono- et diglycérides, seuls ou en association, la quantité totale ne doit pas dépasser 0,01 % de la teneur en gras | ||
| P.1 | Gallate de propyle | (1) Graisses et huiles, saindoux, shortening | (1) 0,02 %. Si on emploie aussi l’hydroxyanisole butylé, l’hydroxytoluène butylé ou l’hydroquinone de butyle tertiaire, seul ou en association, la quantité totale ne doit pas dépasser 0,02 % |
| (2) Céréales à déjeuner sèches; produits déshydratés de pommes de terre | (2) 0,005 %. Si on emploie aussi l’hydroxyanisole butylé ou l’hydroxytoluène butylé, ou les deux, la quantité totale ne doit pas dépasser 0,005 % | ||
| (3) Gomme à mâcher | (3) 0,02 %. Si on emploie aussi l’hydroxyanisole butylé ou l’hydroxytoluène butylé, ou les deux, la quantité totale ne doit pas dépasser 0,02 % | ||
| (4) Huiles essentielles; substances aromatiques sèches | (4) 0,125 %. Si on emploie aussi l’hydroxyanisole butylé ou l’hydroxytoluène butylé, ou les deux, la quantité totale ne doit pas dépasser 0,125 % | ||
| (5) Huiles d’agrumes | (5) 0,5 %. Si on emploie aussi l’hydroxyanisole butylé ou l’hydroxytoluène butylé, ou les deux, la quantité totale ne doit pas dépasser 0,5 % | ||
| (6) 0,02 % de la teneur de l’aliment en gras ou en huile. Si on emploie aussi l’hydroxyanisole butylé ou l’hydroxytoluène butylé, ou les deux, la quantité totale ne doit pas dépasser 0,02 % de la teneur de l’aliment en gras ou en huile | ||
| (7) Margarine | (7) 0,01 % de la teneur en gras. Si on emploie aussi l’hydroxyanisole butylé ou l’hydroxytoluène butylé ou les deux, la quantité totale ne doit pas excéder 0,01 % de la teneur en gras | ||
| (8) Viande de volaille cuite et séchée | (8) 0,015 % de la teneur en gras. Si on emploie aussi l’hydroxyanisole butylé ou l’acide citrique, ou les deux, la quantité totale ne doit pas excéder 0,015 % de la teneur en gras. | ||
| T.1 | Acide tartrique | (1) Graisses et huiles; saindoux; monoglycérides et diglycérides; shortening | (1) Bonnes pratiques industrielles |
| (2) Bonnes pratiques industrielles | ||
| T.1A | Hydroquinone de butyle tertiaire | Graisses et huiles, saindoux, shortening | 0,02 %. Si on emploie aussi l’hydroxyanisole butylé, l’hydroxytoluène butylé ou le gallate de propyle, seul ou en association, la quantité totale ne doit pas dépasser 0,02 % |
| T.2 | Tocophérols (alphatocophérol; concentré de tocophérols mixtes) | (1) Graisses et huiles; saindoux; monoglycérides et diglycérides; shortening | (1) Bonnes pratiques industrielles |
| (2) Bonnes pratiques industrielles | ||
| (3) Préparations pour nourrissons | (3) 0,001% de la préparation pour nourrissons prête à consommer |
- DORS/79-285, art. 1 à 4
- DORS/79-660, art. 18
- DORS/79-752, art. 10
- DORS/80-500, art. 7
- DORS/81-565, art. 6
- DORS/81-934, art. 13 à 15
- DORS/82-383, art. 11
- DORS/86-89, art. 7
- DORS/86-1020, art. 1
- DORS/87-138, art. 1 et 2
- DORS/87-469, art. 2
- DORS/89-198, art. 12 à 16
- DORS/91-124, art. 10 à 12
- DORS/92-226, art. 1
- DORS/92-591, art. 2(F)
- DORS/94-689, art. 2(F)
- DORS/95-592, art. 1
- DORS/96-241, art. 2
- DORS/97-148, art. 7
- DORS/97-191, art. 4
- DORS/98-459, art. 1
- DORS/99-289, art. 1 à 4
- DORS/2003-156, art. 1
- DORS/2005-316, art. 4 à 6
- DORS/2010-94, art. 8(A)
- DORS/2010-141, art. 1 et 2
- DORS/2010-264, art. 4
- DORS/2011-235, art. 7 à 13 et 16(F)
- DORS/2011-280, art. 7 et 8
- DORS/2012-43, art. 37 à 42
- DORS/2012-104, art. 16(F), 17 et 18
TABLEAU XII
Additifs alimentaires autorisés comme chélateurs ou agents séquestrants
| Article | Colonne I | Colonne II | Colonne III |
|---|---|---|---|
| Additifs | Permis dans ou sur | Limites de tolérance | |
| A.1 | Citrate diammonique | Aliments non normalisés | Bonnes pratiques industrielles |
| A.2 | Citrate monoammonique | Aliments non normalisés | Bonnes pratiques industrielles |
| C.1 | Citrate de calcium | Aliments non normalisés | Bonnes pratiques industrielles |
| C.2 | Éthylènediaminetétraacétate de calcium disodique (EDTA de calcium disodique) | (1) Ale; bière; liqueur de malt; porter; stout | (1) 25 p.p.m., calculé sous forme anhydre |
| (2) Mayonnaise; sauce à salade; sauces d’assaisonnement non normalisées; sauces non normalisées; sauce vinaigrette | (2) 75 p.p.m., calculé sous forme anhydre | ||
| (3) Salade de pommes de terre; tartinades à sandwich non normalisées | (3) 100 p.p.m., calculé sous forme anhydre | ||
| (4) Crevettes en conserve; thon en conserve | (4) 250 p.p.m., calculé sous forme anhydre | ||
| (5) Crabe en conserve; homard en conserve; saumon en conserve | (5) 275 p.p.m., calculé sous forme anhydre | ||
| (6) Margarine | (6) 75 p.p.m., calculé sous forme anhydre | ||
| (7) Clams en conserve | (7) 340 p.p.m., calculé sous forme anhydre | ||
| (8) Fèves; fèves au lard; légumineuses en conserve, à l’exception des haricots jaunes en conserve, des haricots verts en conserve et des pois en conserve | (8) 365 p.p.m., calculé sous forme anhydre | ||
| (9) Escargots en conserve; limaces de mer en conserve | (9) 300 p.p.m., calculé sous forme anhydre | ||
| (10) Boissons gazeuses; thés prêts à boire | (10) 33 p.p.m., calculé sous forme anhydre | ||
| (11) Pommes de terre pasteurisées sous-vide | (11) 100 p.p.m., seul ou en association avec de l’EDTA disodique, calculé sous forme d’EDTA disodique anhydre | ||
| C.3 | [Abrogé, DORS/2012-43, art. 43] | ||
| C.4 | Phosphate monocalcique | (1) Mélange pour crème glacée; mélange pour lait glacé; sorbet laitier | (1) Bonnes pratiques industrielles |
| (2) Produits laitiers non normalisés | (2) Bonnes pratiques industrielles | ||
| C.5 | Phosphate tricalcique | Mélange pour crème glacée; mélange pour lait glacé | Bonnes pratiques industrielles |
| C.6 | Phytate de calcium | Fruits glacés ou confits | Bonnes pratiques industrielles |
| C.7 | Acide citrique | (1) Marinade, saumure et mélange de salaison à sec employés dans le marinage des viandes conditionnées ou conservées et des sous-produits de viande conditionnés ou conservés | (1) Bonnes pratiques industrielles |
| (2) Aliments non normalisés | (2) Bonnes pratiques industrielles | ||
| (3) Filets de poisson congelés; poisson haché congelé; poisson haché menu congelé | (3) 0,1 % | ||
| D.1 | Éthylènediaminetétraacétate disodique (EDTA disodique) | (1) Sauces et condiments | (1) 70 p.p.m. |
| (2) Tartinades à sandwich non normalisées | (2) 90 p.p.m. | ||
| (3) Fèves; fèves au lard; légumineuses en conserve, à l’exception des haricots jaunes en conserve, des haricots verts en conserve et des pois en conserve | (3) 165 p.p.m. | ||
| (4) Produits à base de bananes séchées | (4) 265 p.p.m. | ||
| (5) Préparation de colorant laque en suspension aqueuse pour utilisation dans l’enrobage de tablettes de confiseries | (5) 1 % de la préparation de colorant | ||
| (6) Pommes de terre pasteurisées sous-vide | (6) 100 p.p.m., seul ou en association avec l’EDTA de calcium disodique, calculé sous forme d’EDTA disodique anhydre | ||
| (7) Enrobage comestible pour les saucisses | (7) 80 p.p.m. dans l’enrobage comestible, calculé en fonction de la saucisse entière | ||
| D.2 | [Abrogé, DORS/2012-43, art. 45] | ||
| G.1 | Glycine | Mono- et diglycérides | 0,02 % |
| P.1 | Acide phosphorique | Mono- et diglycérides | 0,02 % |
| P.2 | Phosphate mono-potassique | (1) Mélange pour crème glacée; mélange pour lait glacé; sorbet laitier | (1) Bonnes pratiques industrielles |
| (2) Aliments non normalisés | (2) Bonnes pratiques industrielles | ||
| (3) Viande coupée solide; viande préparée; sous-produit de viande préparée; viande de volaille coupée solide; viande de volaille préparée; sous-produit de viande de volaille préparée | (3) 0,5 % en phosphates totaux ajoutés, calculés en phosphate disodique | ||
| P.3 | Pyrophosphate tétrapotassique | (1) Produits pour attendrir la viande | (1) Bonnes pratiques industrielles |
| (2) Viande coupée solide; viande préparée; sous-produit de viande préparée; viande de volaille coupée solide; viande de volaille préparée; sous-produit de viande de volaille préparée | (2) 0,5 % en phosphates totaux ajoutés, calculés en phosphate disodique | ||
| P.4 | Phosphate dipotassique | (1) Viande coupée solide; viande préparée; sous-produit de viande préparée; viande de volaille coupée solide; viande de volaille préparée; sous-produit de viande de volaille préparée | (1) 0,5 % en phosphates totaux ajoutés, calculés en phosphate disodique |
| S.1 | Pyrophosphate acide de sodium | (1) Fruits de mer en conserve | (1) Si employé seul ou en association avec le hexamétaphosphate de sodium ou le tripolyphosphate de sodium, ou les deux, la quantité totale de phosphate ajouté, calculé sous forme de phosphate dibasique de sodium, ne doit pas dépasser 0,5 % |
| (2) Mélange pour crème glacée; mélange pour lait glacé | (2) Bonnes pratiques industrielles | ||
| (3) Solution d’injection ou d’immersion servant à la salaison de la volaille ou de la viande de volaille | (3) Bonnes pratiques industrielles et conformément à B.22.021e) | ||
| (4) Marinade servant à la salaison de coupes de porc, de boeuf ou d’agneau | (4) Bonnes pratiques industrielles et conformément à B.14.009f) et B.14.031h) | ||
| (5) Aliments non normalisés | (5) Bonnes pratiques industrielles | ||
| (6) Viande coupée solide; viande préparée; sous-produit de viande préparée; viande de volaille coupée solide; viande de volaille préparée; sous-produit de viande de volaille préparée | (6) 0,5 % en phosphates totaux ajoutés, calculés en phosphate disodique | ||
| S.2 | Citrate de sodium | (1) Marinade, saumure et mélange de salaison à sec employés dans le marinage des viandes conditionnées ou conservées et des sous-produits de viande conditionnés ou conservés; mélange pour crème glacée; mélange pour lait glacé; sorbet laitier | (1) Bonnes pratiques industrielles |
| (2) Aliments non normalisés | (2) Bonnes pratiques industrielles | ||
| S.3 | Hexamétaphosphate de sodium | (1) Fruits de mer en conserve | (1) Si employé seul ou en association avec le pyrophosphate acide de sodium ou le tripolyphosphate de sodium, ou les deux, la quantité totale de phosphate ajouté, calculé sous forme de phosphate dibasique de sodium, ne doit pas dépasser 0,5 % |
| (2) Mélange pour crème glacée; mélange pour lait glacé | (2) Bonnes pratiques industrielles | ||
| (3) Solution d’injection ou d’immersion servant à la salaison de la volaille ou de la viande de volaille | (3) Bonnes pratiques industrielles et conformément à B.22.021e) | ||
| (4) Marinade servant à la salaison de coupes de porc, de boeuf ou d’agneau | (4) Bonnes pratiques industrielles et conformément à B.14.009f) et B.14.031h) | ||
| (5) Aliments non normalisés | (5) Bonnes pratiques industrielles | ||
| (6) Viande coupée solide; viande préparée; sous-produit de viande préparée; viande de volaille coupée solide; viande de volaille préparée; sous-produit de viande de volaille préparée | (6) 0,5 % en phosphates totaux ajoutés, calculés en phosphate disodique | ||
| (7) Petit-lait liquide destiné à la fabrication de produits de petit-lait concentré ou séché | (7) 800 p.p.m. dans les produits de petit-lait concentré ou séché | ||
| S.4 | Phosphate disodique | (1) Mélange pour crème glacée; mélange pour lait glacé; sorbet laitier | (1) Bonnes pratiques industrielles |
| (2) Solution d’injection ou d’immersion servant à la salaison de la volaille ou de la viande de volaille | (2) Bonnes pratiques industrielles et conformément à B.22.021e) | ||
| (3) Marinade servant à la salaison de coupes de porc, de boeuf ou d’agneau | (3) Bonnes pratiques industrielles et conformément à B.14.009f) et B.14.031h) | ||
| (4) Aliments non normalisés | (4) Bonnes pratiques industrielles | ||
| (5) Viande coupée solide; viande préparée; sous-produit de viande préparée; viande de volaille coupée solide; viande de volaille préparée; sous-produit de viande de volaille préparée | (5) 0,5 % en phosphates totaux ajoutés, calculés en phosphate disodique | ||
| S.5 | Phosphate monosodique | (1) Mélange pour crème glacée; mélange pour lait glacé; sorbet laitier | (1) Bonnes pratiques industrielles |
| (2) Solution d’injection ou d’immersion servant à la salaison de la volaille ou de la viande de volaille | (2) Bonnes pratiques industrielles et conformément à B.22.021e) | ||
| (3) Marinade servant à la salaison de coupes de porc, de boeuf ou d’agneau | (3) Bonnes pratiques industrielles et conformément à B.14.009f) et B.14.031h) | ||
| (4) Aliments non normalisés | (4) Bonnes pratiques industrielles | ||
| (5) Viande coupée solide; viande préparée; sous-produit de viande préparée; viande de volaille coupée solide; viande de volaille préparée; sous-produit de viande de volaille préparée | (5) 0,5 % en phosphates totaux ajoutés, calculés en phosphate disodique | ||
| S.6 | Pyrophosphate tétrasodique | (1) Mélange pour crème glacée; mélange pour lait glacé; sorbet laitier | (1) Bonnes pratiques industrielles |
| (2) Produits pour attendrir la viande | (2) Bonnes pratiques industrielles | ||
| (3) Solution d’injection ou d’immersion servant à la salaison de la volaille ou de la viande de volaille | (3) Bonnes pratiques industrielles et conformément à B.22.021e) | ||
| (4) Marinade servant à la salaison de coupes de porc, de boeuf ou d’agneau | (4) Bonnes pratiques industrielles et conformément à B.14.009f) et B.14.031h) | ||
| (5) Aliments non normalisés | (5) Bonnes pratiques industrielles | ||
| (6) Viande coupée solide; viande préparée; sous-produit de viande préparée; viande de volaille coupée solide; viande de volaille préparée; sous-produit de viande de volaille préparée | (6) 0,5 % en phosphates totaux ajoutés, calculés en phosphate disodique | ||
| S.7 | Tripolyphosphate de sodium | (1) Solution d’injection ou d’immersion servant à la salaison de la volaille ou de la viande de volaille | (1) Bonnes pratiques industrielles et conformément à B.22.021e) |
| (2) Produits pour attendrir la viande | (2) Bonnes pratiques industrielles | ||
| (3) Marinade servant à la salaison de coupes de porc, de boeuf ou d’agneau | (3) Bonnes pratiques industrielles et conformément à B.14.009f) et B.14.031h) | ||
| (4) Aliments non normalisés | (4) Bonnes pratiques industrielles | ||
| (5) Viande coupée solide; viande préparée; sous-produit de viande préparée; viande de volaille coupée solide; viande de volaille préparée; sous-produit de viande de volaille préparée | (5) 0,5 % en phosphates totaux ajoutés, calculés en phosphate disodique | ||
| (6) Fruits de mer en conserve | (6) Si employé seul ou en association avec le pyrophosphate acide de sodium ou le hexamétaphosphate de sodium, ou les deux, la quantité totale de phosphate ajouté, calculé sous forme de phosphate dibasique de sodium, ne doit pas dépasser 0,5 % | ||
| S.8 | Citrate de stéaryle | Margarine | 0,01 % de la teneur en gras. Si on emploie aussi le citrate de monoglycéride, le citrate de monoisopropyle ou les esters citriques des mono- et diglycérides, seuls ou en association, la quantité totale ne doit pas dépasser 0,01 % de la teneur en gras |
- DORS/79-660, art. 19 et 20
- DORS/80-501, art. 4
- DORS/82-596, art. 4 à 9
- DORS/94-141, art. 1
- DORS/94-262, art. 4 à 12
- DORS/94-689, art. 2
- DORS/95-435, art. 2
- DORS/97-30, art. 1
- DORS/97-562, art. 1
- DORS/98-580, art. 1(F)
- DORS/2005-316, art. 7 à 11
- DORS/2010-40, art. 2
- DORS/2010-142, art. 57 et 58
- DORS/2010-143, art. 37(F) et 38
- DORS/2011-235, art. 14
- DORS/2012-43, art. 43 à 45
- DORS/2012-104, art. 19(F)
- DORS/2012-112, art. 1
TABLEAU XIII
Additifs alimentaires autorisés comme agents modifiants de l’amidon
| Article | Colonne I | Colonne II | Colonne III |
|---|---|---|---|
| Additifs | Permis dans ou sur | Limites de tolérance | |
| A.1 | Anhydride acétique | Amidon | Bonnes pratiques industrielles |
| A.2 | Acide adipique | Amidon | Bonnes pratiques industrielles |
| A.3 | Sulfate d’aluminium | Amidon | Bonnes pratiques industrielles |
| E.1 | [Abrogé, DORS/2016-143, art. 2] | ||
| H.1 | Acide chlorhydrique | Amidon | Bonnes pratiques industrielles |
| H.2 | Peroxyde d’hydrogène | Amidon | Bonnes pratiques industrielles |
| M.1 | Sulfate de magnésium | Amidon | 0,4 % |
| N.1 | Acide nitrique | Amidon | Bonnes pratiques industrielles |
| O.1 | Anhydride octénylsuccinique (AOS) | Amidon | Bonnes pratiques industrielles |
| P.1 | Peracide acétique | Amidon | Bonnes pratiques industrielles |
| P.2 | Oxychlorure de phosphore | Amidon | Bonnes pratiques industrielles |
| P.3 | Permanganate de potassium | Amidon | 50 p.p.m. de sulfate de manganèse calculé en manganèse |
| P.4 | Oxyde de propylène | Amidon | 25 % |
| S.1 | Acétate de sodium | Amidon | Bonnes pratiques industrielles |
| S.2 | Bicarbonate de sodium | Amidon | Bonnes pratiques industrielles |
| S.3 | Carbonate de sodium | Amidon | Bonnes pratiques industrielles |
| S.4 | Chlorite de sodium | Amidon | Bonnes pratiques industrielles |
| S.5 | Hydroxyde de sodium | Amidon | Bonnes pratiques industrielles |
| S.6 | Hypochlorite de sodium | Amidon | Bonnes pratiques industrielles |
| S.7 | Trimétaphosphate de sodium | Amidon | 400 p.p.m., calculé en phosphore |
| S.7A | Tripolyphosphate de sodium | Amidon | Phosphate résiduel total ne devant pas dépasser 0,4 % (calculé en phosphore) |
| S.8 | Anhydride succinique | Amidon | Bonnes pratiques industrielles |
| S.9 | Acide sulfurique | Amidon | Bonnes pratiques industrielles |
- DORS/94-689, art. 2(F)
- DORS/2012-106, art. 2
- DORS/2016-143, art. 2
TABLEAU XIV
Additifs alimentaires autorisés comme nourriture des levures
| Article | Colonne I | Colonne II | Colonne III |
|---|---|---|---|
| Additifs | Permis dans ou sur | Limites de tolérance | |
| A.1 | Chlorure d’ammonium | (1) Farine; farine de blé entier | (1) 2 000 p.p.m. de farine |
| (2) Pain | (2) 2 500 p.p.m. de farine. Pour les mélanges, voir l’alinéa B.13.021m) | ||
| (3) Aliments non normalisés | (3) Bonnes pratiques industrielles | ||
| A.2 | Phosphate diammonique | (1) Pain | (1) 2 500 p.p.m. de farine. Pour les mélanges, voir l’alinéa B.13.021m) |
| (2) Cidre; vin de miel; vin | (2) Bonnes pratiques industrielles | ||
| (3) Produits de boulangerie non normalisés | (3) Bonnes pratiques industrielles | ||
| A.3 | Phosphate monoammonique | (1) Pain | (1) 2 500 p.p.m. de farine. Pour les mélanges, voir l’alinéa B.13.021m) |
| (2) Ale; bière; cidre; vin de miel; bière légère; liqueur de malt; porter; stout; vin | (2) Bonnes pratiques industrielles | ||
| (3) Produits de boulangerie non normalisés | (3) Bonnes pratiques industrielles | ||
| A.4 | Sulfate d’ammonium | (1) Pain | (1) 2 500 p.p.m. de farine. Pour les mélanges, voir l’alinéa B.13.021m) |
| (2) Cidre; vin de miel; vin | (2) Bonnes pratiques industrielles | ||
| (3) Produits de boulangerie non normalisés | (3) Bonnes pratiques industrielles | ||
| C.1 | Carbonate de calcium | (1) Pain | (1) 2 500 p.p.m. de farine. Pour les mélanges, voir l’alinéa B.13.021m) |
| (2) Produits de boulangerie non normalisés | (2) Bonnes pratiques industrielles | ||
| C.2 | Chlorure de calcium | Produits de boulangerie non normalisés | Bonnes pratiques industrielles |
| C.3 | Citrate de calcium | Produits de boulangerie non normalisés | Bonnes pratiques industrielles |
| C.4 | Lactate de calcium | (1) Pain | (1) 2 500 p.p.m. de farine. Pour les mélanges, voir l’alinéa B.13.021m) |
| (2) Produits de boulangerie non normalisés | (2) Bonnes pratiques industrielles | ||
| C.5 | Phosphate bicalcique | (1) Pain | (1) 2 500 p.p.m. de farine. Pour les mélanges, voir l’alinéa B.13.021m) |
| (2) Produits de boulangerie non normalisés | (2) Bonnes pratiques industrielles | ||
| C.6 | Phosphate monocalcique | (1) Pain | (1) 7 500 p.p.m. de farine. Pour les mélanges, voir l’alinéa B.13.021m) |
| (2) Farine | (2) 7 500 p.p.m. de farine | ||
| (3) Produits de boulangerie non normalisés | (3) Bonnes pratiques industrielles | ||
| C.7 | Phosphate tricalcique | Produits de boulangerie non normalisés | Bonnes pratiques industrielles |
| C.8 | Sulfate de calcium | (1) Pain | (1) 5 000 p.p.m. de farine |
| (2) Produits de boulangerie non normalisés | (2) Bonnes pratiques industrielles | ||
| F.1 | Sulfate ferreux | Cultures bactériennes | Bonnes pratiques industrielles |
| M.1 | Sulfate de manganèse | Ale; bière; bière légère; liqueur de malt; porter; stout | Bonnes pratiques industrielles |
| P.1 | Acide phosphorique | Ale; bière; bière légère; liqueur de malt; porter; stout | Bonnes pratiques industrielles |
| P.2 | Chlorure de potassium | (1) Ale; bière; bière légère; liqueur de malt; porter; stout | (1) Bonnes pratiques industrielles |
| (2) Produits de boulangerie non normalisés | (2) Bonnes pratiques industrielles | ||
| P.4 | Phosphate bipotassique | (1) Ale; bière; cidre; vin de miel; bière légère; liqueur de malt; porter; stout; vin | (1) Bonnes pratiques industrielles |
| (2) Produits de boulangerie non normalisés | (2) Bonnes pratiques industrielles | ||
| P.5 | Phosphate monopotassique | Ale; bière; cidre; vin de miel; bière légère; liqueur de malt; porter; stout; vin | Bonnes pratiques industrielles |
| S.1 | Sulfate de sodium | Produits de boulangerie non normalisés | Bonnes pratiques industrielles |
| U.1 | [Abrogé, DORS/87-5, art. 1] | ||
| Z.1 | Sulfate de zinc | (1) Ale; bière; bière légère; liqueur de malt; porter; stout | (1) Bonnes pratiques industrielles |
| (2) Cultures bactériennes | (2) Bonnes pratiques industrielles | ||
- DORS/87-5, art. 1
- DORS/94-689, art. 2(F)
- DORS/95-281, art. 6 et 7
- DORS/2010-41, art. 7(A) et 9(A)
TABLEAU XV
Additifs alimentaires autorisés comme solvants de support ou d’extraction
| Article | Colonne I | Colonne II | Colonne III | Colonne IV |
|---|---|---|---|---|
| Additifs | Permis dans ou sur | Résidu maximal | Limites de tolérance | |
| 1 | Acétone | (1) Extraits d’épices; extractifs naturels | (1) 30 p.p.m. | |
| (2) Encres à marquer la viande et les oeufs | (2) Bonnes pratiques industrielles | |||
| 2 | Alcool benzylique | (1) Préparation aromatisante de (nom de l’arôme) (Titre 10) | (1) Bonnes pratiques industrielles | |
| (2) Préparations aromatisantes non normalisées | (2) Bonnes pratiques industrielles | |||
| 3 | 1,3-Butylène- glycol | (1) Préparation aromatisante de (nom de l’arôme) (Titre 10) | (1) Bonnes pratiques industrielles | |
| (2) Préparations aromatisantes non normalisées | (2) Bonnes pratiques industrielles | |||
| 3.1 | Dioxyde de carbone | (1) Graines de café vertes et feuilles de thé destinées à la décaféination | (1) Bonnes pratiques industrielles | |
| (2) Extraits d’épices; extractifs naturels; préparation aromatisante de (nom de l’arôme) (titre 10); extrait de houblon, conformément au sous-alinéa B.02.130b)(v) et à l’alinéa B.02.133b); extrait de houblon pré-isomérisé, conformément au sous-alinéa B.02.134(1)a)(ii) | (2) Bonnes pratiques industrielles | |||
| (3) Produits des oeufs | (3) Bonnes pratiques industrielles | |||
| (4) Poudre de cacao | (4) Bonnes pratiques industrielles | |||
| 4 | Huile de ricin | Rocou soluble dans l’huile; rocou, colorant pour le beurre; rocou, colorant pour la margarine | Bonnes pratiques industrielles | |
| 4.1 | Esters citriques des mono- et diglycérides | (1) Extractifs naturels; extraits d’épices | (1) Bonnes pratiques industrielles | |
| (2) Préparations aromatisantes non normalisées | (2) Bonnes pratiques industrielles | |||
| 5 | Acétate d’éthyle | (1) Extraits d’épices; extractifs naturels; préparation aromatisante de (nom de l’arôme) (Titre 10) | (1) Bonnes pratiques industrielles | |
| (2) Préparations aromatisantes non normalisées | (2) Bonnes pratiques industrielles | |||
| (3) Graines de café vertes destinées à la décaféination | (3) 10 p.p.m. dans les cafés faits de graines rôties et les cafés décaféinés solubles (instantanés) | |||
| (4) Feuilles de thé destinées à la décaféination | (4) 50 p.p.m. | |||
| 6 | Alcool éthylique (éthanol) | (1) Extraits d’épices; extractifs naturels; préparation aromatisante de (nom de l’arôme) (Titre 10) | (1) Bonnes pratiques industrielles | |
| (2) Préparations aromatisantes non normalisées | (2) Bonnes pratiques industrielles | |||
| (3) Mélanges colorants et préparations colorantes (Titre 6) | (3) Bonnes pratiques industrielles | |||
| (4) Encres à marquer la viande et les oeufs | (4) Bonnes pratiques industrielles | |||
| (5) Préparations d’additifs alimentaires | (5) Bonnes pratiques industrielles | |||
| (6) Extrait de houblon, conformément au sous-alinéa B.02.130b)(v) et à l’alinéa B.02.133b); extrait de houblon pré-isomérisé, conformément au sous-alinéa B.02.134(1)a)(iii) | (6) Bonnes pratiques industrielles | |||
| 6.A | Alcool éthylique dénaturé avec méthanol | Farine de graines végétales oléagineuses | 10 p.p.m. de methanol | |
| 7 | [Abrogé, DORS/82-406, art. 1] | |||
| 8 | Glycérol (glycérine) | (1) Extrait de (nom de l’arôme); essence de (nom de l’arôme); préparation aromatisante de (nom de l’arôme) (Titre 10) | (1) Bonnes pratiques industrielles | |
| (2) Préparations aromatisantes non normalisées | (2) Bonnes pratiques industrielles | |||
| (3) Mélanges colorants et préparations colorantes (Titre 6) | (3) Bonnes pratiques industrielles | |||
| (4) Préparations d’additifs alimentaires | (4) Bonnes pratiques industrielles | |||
| 9 | Diacétate de glycéryle | (1) Préparation aromatisante de (nom de l’arôme) (Titre 10) | (1) Bonnes pratiques industrielles | |
| (2) Préparations aromatisantes non normalisées | (2) Bonnes pratiques industrielles | |||
| 10 | Triacétate de glycéryle (triacétine) | (1) Préparation aromatisante de (nom de l’arôme) (Titre 10) | (1) Bonnes pratiques industrielles | |
| (2) Préparations aromatisantes non normalisées | (2) Bonnes pratiques industrielles | |||
| 11 | Tributyrate de glycéryle (tributyrine) | (1) Préparation aromatisante de (nom de l’arôme) (Titre 10) | (1) Bonnes pratiques industrielles | |
| (2) Préparations aromatisantes non normalisées | (2) Bonnes pratiques industrielles | |||
| 12 | Hexane | (1) Extraits d’épices; extractifs naturels | (1) 25 p.p.m. | |
| (2) Extrait de houblon, conformément au sous-alinéa B.02.130b)(v) et à l’alinéa B.02.133a) | (2) 2,2 % | |||
| (3) Graisses et huiles végétales | (3) 10 p.p.m. | |||
| (4) Farine de graines végétales oléagineuses | (4) 10 p.p.m. | |||
| (5) Extrait de houblon pré-isomérisé, conformément au sous-alinéa B.02.134(1)a)(i) et au paragraphe B.02.134(2) | (5) 1,5 p.p.m., par rapport à la teneur, exprimée en pourcentage, d’acide iso-alpha dans l’extrait de houblon pré-isomérisé. | |||
| 13 | Alcool isopropylique) (Isopropanol) | (1) Extraits d’épices; extractifs naturels | (1) 50 p.p.m. | |
| (2) Protéines de poisson | (2) 0,15 % | |||
| (3) Préparation aromatisante de (nom de l’arôme) (Titre 10) | (3) Bonnes pratiques industrielles | |||
| (4) Préparations aromatisantes non normalisées | (4) Bonnes pratiques industrielles | |||
| (5) Encres à marquer la viande et les oeufs | (5) Bonnes pratiques industrielles | |||
| 14 | Alcool méthylique (méthanol) | (1) Extraits d’épices; extractifs naturels | (1) 50 p.p.m. | |
| (2) Extrait de houblon, conformément au sous-alinéa B.02.130b)(v) et à l’alinéa B.02.133a) | (2) 2,2 % | |||
| (3) Encres à marquer la viande et les oeufs | (3) Bonnes pratiques industrielles | |||
| 14.1 | Méthyléthyl-cétone (2-Butanone) | Extraits d’épices; extractifs naturels | 50 p.p.m. | |
| 15 | Chlorure de méthylène (Dichloro-méthane) | (1) Extraits d’épices; extractifs naturels | (1) 30 p.p.m. | |
| (2) Extrait de houblon, conformément au sous-alinéa B.02.130b)(v) et à l’alinéa B.02.133a) | (2) 2,2 % dans l’extrait de houblon | |||
| (3) Grains de café vert et feuilles de thé devant être décaféinés | (3) 10 p.p.m. dans le café décaféiné torréfié, le café soluble instantané décaféiné, les feuilles de thé décaféiné et le thé instantané décaféiné. | |||
| 16 | Monoglycérides et diglycérides | (1) Préparation aromatisante de (nom de l’arôme) (Titre 10) | (1) Bonnes pratiques industrielles | |
| (2) Rocou soluble dans l’huile; rocou, colorant pour le beurre; rocou, colorant pour la margarine | (2) Bonnes pratiques industrielles | |||
| (3) Préparations aromatisantes non normalisées | (3) Bonnes pratiques industrielles | |||
| (4) Préparations d’additifs alimentaires | (4) Bonnes pratiques industrielles | |||
| 17 | Citrate de monoglycérides | (1) Extraits d’épices; extractifs naturels | (1) Bonnes pratiques industrielles | |
| (2) Préparations aromatisantes non normalisées | (2) Bonnes pratiques industrielles | |||
| 18 | [Abrogé, DORS/2016-143, art. 3] | |||
| 19 | 1,2-Propylène-glycol (1,2-propanédiol) | (1) Extrait de (nom de l’arôme); essence de (nom de l’arôme); préparation aromatisante de (nom de l’arôme) (Titre 10) | (1) Bonnes pratiques industrielles | |
| (2) Rocou soluble dans l’huile; rocou, colorant pour le beurre; rocou, colorant pour la margarine | (2) Bonnes pratiques industrielles | |||
| (3) Préparations aromatisantes non normalisées | (3) Bonnes pratiques industrielles | |||
| (4) Mélanges colorants et préparations colorantes (Titre 6) | (4) Bonnes pratiques industrielles | |||
| (5) Préparations d’additifs alimentaires | (5) Bonnes pratiques industrielles | |||
| 20 | Mono et diesters de propylène-glycol et d’acides gras lipogènes | Rocou soluble dans l’huile; rocou, colorant pour le beurre; rocou, colorant pour la margarine | Bonnes pratiques industrielles | |
| 21 | Citrate de triéthyle | (1) Préparation aromatisante de (nom de l’arôme) (Titre 10) | (1) Bonnes pratiques industrielles | |
| (2) Préparations aromatisantes non normalisées | (2) Bonnes pratiques industrielles | |||
- DORS/78-403, art. 26 et 27
- DORS/82-383, art. 12
- DORS/82-406, art. 1
- DORS/82-913, art. 5
- DORS/82-1071, art. 21 et 22
- DORS/84-541, art. 1
- DORS/86-89, art. 8 et 9
- DORS/86-178, art. 4 à 7
- DORS/86-1112, art. 9
- DORS/90-667, art. 1
- DORS/94-689, art. 2
- DORS/96-259, art. 1
- DORS/96-377, art. 1
- DORS/2011-235, art. 15
- DORS/2016-143, art. 3
TITRE 17Sel
B.17.001 (1) [N]. Le sel, autre que le sel gemme à l’état brut, doit être du chlorure de sodium cristallisé et peut renfermer
a) un ou plusieurs des agents anti-agglomérants suivants :
(i) silicate double d’aluminium et de calcium, phosphate tricalcique, silicate de calcium, stéarate de calcium, carbonate de magnésium, silicate de magnésium, stéarate de magnésium, bioxyde de silicium et silicate double d’aluminium et de sodium, le total ne devant pas dépasser un pour cent et, dans le cas du sel à grains fins, ne devant pas dépasser deux pour cent,
(ii) propylèneglycol en une quantité n’excédant pas 0,035 pour cent, et
(iii) décahydrate de ferrocyanure de sodium, en une quantité n’excédant pas 13 parties par million, calculée en ferrocyanure de sodium anhydre;
b) au plus
(i) 1,4 pour cent, séparément ou ensemble, de sulfate de calcium ou de chlorure de potassium,
(ii) 13 parties par million de ferrocyanure de sodium anhydre lorsqu’il est ajouté comme décahydrate de ferrocyanure de sodium dans la fabrication de cristaux dendritiques de sel;
(iii) 10 parties par million de monooléate polyoxyéthylénique (2) de sorbitan lorsqu’il est employé dans la fabrication de gros cristaux de sel,
(iv) 15 parties par million d’alginate de sodium lorsqu’il est employé dans la production de gros cristaux de sel, et
(v) 0,1 pour cent d’autres ingrédients; et
c) nonobstant les alinéas a) et b), la quantité totale de décahydrate de ferrocyanure de sodium, qu’il soit ajouté à titre d’agent anti-agglomérant ou d’adjuvant dans la production de sel dendritique, ne doit pas dépasser 13 parties par million, calculée en ferrocyanure de sodium anhydre.
(2) [Abrogé, DORS/97-151, art. 26]
- DORS/79-662, art. 18
- DORS/86-1125, art. 3
- DORS/97-151, art. 26
B.17.002 [Abrogé, DORS/79-662, art. 18]
B.17.003 Nonobstant l’article B.17.001, le sel de table ou à usage domestique général doit contenir 0,01 pour cent d’iodure de potassium, avec ou sans dextrose, du thiosulphate de sodium ou du bicarbonate de sodium comme stabilisant de l’iodure, la présence de l’iodure devant être indiquée sur l’espace principal de l’étiquette.
TITRE 18
Agents édulcorants
B.18.001 [N]. Le sucre
a) doit être le produit alimentaire connu en chimie sous le nom de sucrose ou saccharose; et
b) doit renfermer au moins 99,8 pour cent de saccharose.
B.18.002 [N]. Le sucre liquide doit être le produit alimentaire obtenu par la dissolution du sucre dans de l’eau.
B.18.003 [N]. Le sucre inverti doit être le produit alimentaire obtenu par l’hydrolyse complète ou partielle du sucre.
B.18.004 [N]. Le sucre inverti liquide doit être le produit alimentaire obtenu par une solution de sucre inverti dans de l’eau.
B.18.005 [N]. Est interdite la vente de sucre liquide ou de sucre inverti liquide à moins que l’étiquette ne déclare le pourcentage de sa teneur en sucre ou en sucre inverti.
B.18.006 [N]. Le sucre à glacer
a) doit être du sucre en poudre; et
b) peut renfermer
(i) un colorant pour aliments, et
(ii) soit au plus cinq pour cent d’amidon, ou un agent anti-agglomérant.
B.18.007 [N]. La cassonade, le sucre brun ou sucre doré
a) doit être le produit alimentaire obtenu des sirops provenant du raffinage du sucre;
b) peut renfermer au plus
(i) 4,5 pour cent d’humidité, et
(ii) 3,5 pour cent de cendres sulfatées; et
c) doit renfermer au moins 90 pour cent de sucre et de sucre inverti.
B.18.008 [N]. Le sirop de sucre raffiné, le sirop de raffineur ou le sirop doré
a) doit être le produit alimentaire fait du sirop obtenu au cours du raffinage du sucre;
b) peut être hydrolysé; et
c) doit renfermer au plus
(i) 35 pour cent d’humidité, et
(ii) 2,5 pour cent de cendres sulfatées.
B.18.009 [N]. La mélasse qualité fantaisie
a) doit être le produit alimentaire sirupeux obtenu par évaporation et inversion partielle du jus de la canne à sucre, clarifié ou non, et dont aucun sucre n’a été extrait auparavant;
b) peut renfermer de l’acide sulfureux ou ses sels;
c) doit contenir au plus
(i) 25 pour cent d’humidité, et
(ii) trois pour cent de cendres sulfatées.
B.18.010 [N]. la mélasse de table
a) doit être le produit alimentaire liquide obtenu dans la fabrication du sucre brut ou raffiné;
b) peut renfermer de l’acide sulfureux ou ses sels;
c) doit contenir au plus
(i) 25 pour cent d’humidité, et
(ii) trois pour cent de cendres sulfatées.
B.18.011 [N]. La mélasse de raffineur, la mélasse verte ou la mélasse de cuisine ou la mélasse pour cuisson
a) doit être le liquide résiduaire obtenu dans la fabrication du sucre brut ou raffiné;
b) peut renfermer de l’acide sulfureux ou ses sels;
c) doit contenir au plus
(i) 25 pour cent d’humidité, et
(ii) 12 pour cent de cendres sulfatées.
B.18.015 [N]. (1) Le dextrose anhydre, aux fins de la partie B du présent règlement
a) doit être l’aliment connu en chimie sous le nom de dextrose;
b) doit contenir au moins 99,5 pour cent de D-glucose sous sa forme déshydratée;
c) doit contenir au plus 0,25 pour cent de cendres sulfatées, calculées sur la matière desséchée;
d) doit renfermer au moins 98 pour cent, au total, de solides; et
e) peut contenir de l’acide sulfureux ou ses sels.
(2) Le monohydrate de dextrose, au fins de la partie B du présent règlement,
a) doit être l’aliment connu en chimie sous le nom de dextrose;
b) doit contenir au moins 99,5 pour cent de D-glucose sous sa forme déshydratée;
c) doit renfermer au plus 0,25 pour cent de cendres sulfatées, calculées sur la matière desséchée;
d) doit renfermer au moins 90 pour cent, au total, de solides; et
e) peut contenir de l’acide sulfureux ou ses sels.
- DORS/84-300, art. 51
B.18.016 [N]. Le glucose ou sirop de glucose
a) doit être la solution concentrée purifiée de saccharides nutritifs obtenus par l’hydrolyse incomplète, au moyen d’un acide ou d’enzymes, de l’amidon ou d’une substance amylacée;
b) doit contenir au moins 70 pour cent, au total, de solides;
c) doit contenir au plus 1,0 pour cent de cendres sulfatées, calculées sur la matière desséchée;
d) doit contenir au moins 20 pour cent de sucres réducteurs (équivalent du dextrose) calculés en D-glucose sur la matière desséchée; et
e) peut contenir de l’acide sulfureux ou ses sels.
- DORS/78-402, art. 8
B.18.017 [N]. Les solides de glucose ou sirop de glucose déshydraté
a) doivent être le glucose ou le sirop de glucose dont on a partiellement retiré l’eau;
b) doivent contenir au moins 93 pour cent, au total, de solides;
c) doivent contenir au plus 1,0 pour cent de cendres sulfatées, calculées sur la matière desséchée;
d) doivent contenir au moins 20 pour cent de sucres réducteurs (équivalent au dextrose) calculés en D-glucose sur la matière desséchée; et
e) peuvent contenir de l’acide sulfureux ou ses sels.
B.18.018 [N]. Le sirop (nom de la source de glucose)
a) doit être du glucose;
b) peut renfermer
(i) un agent édulcorant,
(ii) une préparation aromatisante,
(iii) de l’acide sorbique,
(iv) de l’acide sulfureux ou ses sels,
(v) du sel,
(vi) de l’eau;
c) doit renfermer au plus
(i) 35 pour cent d’humidité, et
(ii) trois pour cent de cendres.
- DORS/94-83, art. 1
B.18.019 [N]. Le lactose
a) doit être l’hydrate de carbone normalement obtenu à partir du petit-lait et il peut
(i) être anhydre,
(ii) contenir une molécule d’eau de cristallisation, ou
(iii) être un mélange des deux types mentionnés aux sous-alinéas (i) et (ii);
b) doit contenir au moins 99,0 pour cent de lactose anhydre, sans aucune trace d’humidité;
c) ne doit pas contenir plus de 0,3 pour cent de cendres sulfatées sans aucune trace d’humidité;
d) ne doit pas subir une perte de poids de plus de 6,0 pour cent à la dessiccation; et
e) doit avoir, dans une solution à 10 pour cent, un pH d’au moins 4,5 et d’au plus 7,0.
Miel
B.18.025 [N]. Le miel est l’aliment produit par l’abeille et provenant
a) du nectar de fleurs,
b) de sécrétions produites par des plantes vivantes, ou
c) de sécrétions présentes sur des plantes vivantes,
il doit présenter les caractéristiques suivantes :
d) une consistance fluide, visqueuse, soit partiellement soit entièrement cristallisée;
e) une activité diastasique, déterminée après conditionnement et mélange, exprimée par un indice d’au moins huit sur l’échelle de Gothe, si sa teneur en hydroxyméthylfurfural ne dépasse pas 0,004 pour cent; ou
f) une activité diastasique, déterminée après conditionnement et mélange, exprimée par un indice d’au moins trois sur l’échelle de Gothe, si sa teneur en hydroxyméthylfurfural ne dépasse pas 0,0015 pour cent.
B.18.026 (1) Sous réserve des dispositions du paragraphe (2), le miel obtenu principalement du nectar de fleurs doit
a) avoir une teneur apparente en sucres réducteurs, exprimée en sucre inverti, d’au moins 65 pour cent;
b) avoir une teneur en eau d’au plus 20 pour cent;
c) avoir une teneur apparente en saccharose d’au plus cinq pour cent;
d) contenir au plus 0,1 pour cent d’extrait sec insoluble dans l’eau, sauf pour le miel de presse, qui ne doit pas en contenir plus de 0,5 pour cent;
e) contenir au plus 0,6 pour cent de cendres; et
f) contenir au plus 40 milliéquivalents d’acide par 1 000 grammes.
(2) Le miel obtenu principalement du nectar de lavande, de robinier, de luzerne ou de Banksia menziesii, doit satisfaire aux exigences des alinéas (1)a), b) et d) à f); sa teneur apparente en saccharose ne doit pas dépasser 10 pour cent.
B.18.027 Le miel produit à partir de sécrétions provenant des plantes ou se trouvant sur les plantes doit
a) avoir une teneur apparente en sucres réducteurs, exprimée en sucre inverti, d’au moins 60 pour cent;
b) avoir une teneur en eau d’au plus 20 pour cent;
c) avoir une teneur apparente en saccharose d’au plus 10 pour cent;
d) contenir au plus 0,1 pour cent d’extrait sec insoluble dans l’eau, sauf pour le miel de presse, qui ne doit pas en contenir plus de 0,5 pour cent;
e) contenir au plus 1,0 pour cent de cendres; et
f) contenir au plus 40 milliéquivalents d’acide par 1 000 grammes.
- DORS/84-300, art. 52
TITRE 19Vinaigre
B.19.001 Le vinaigre doit être le liquide obtenu par la fermentation acétique d’un liquide alcoolique et contenir au moins 4,1 pour cent et au plus 12,3 pour cent d’acide acétique.
- DORS/92-626, art. 16
- DORS/93-243, art. 2
B.19.002 Le pourcentage du volume d’acide acétique contenu dans tout vinaigre mentionné au Titre 19 doit figurer sur l’espace principal de l’étiquette suivi de l’expression « acide acétique ».
B.19.003 [N]. Le vinaigre de vin doit être du vinaigre obtenu du vin, et il peut renfermer du caramel.
B.19.004 [N]. Le vinaigre d’alcool, vinaigre blanc ou vinaigre de grain, doit être du vinaigre obtenu d’alcool distillé et dilué.
B.19.005 [N]. Le vinaigre de malt doit être du vinaigre obtenu d’une infusion de malt, non distillé avant la fermentation acétique, il peut renfermer d’autres céréales ou du caramel, il doit être dextrogyre et renfermer, dans 100 millilitres mesurés à la température de 20 °C, au moins
a) 1,8 gramme de solides; et
b) 0,2 gramme de cendres.
B.19.006 [N]. Le vinaigre de cidre ou vinaigre de pommes doit être du vinaigre obtenu du liquide exprimé de pommes entières, de morceaux de pommes ou de rebuts de pommes, et il peut renfermer du caramel.
B.19.007 [N]. Le vinaigre mélangé doit être un mélange de deux ou plusieurs variétés de vinaigre, et dans ce mélange, le vinaigre d’alcool ne doit pas fournir plus de 55 pour cent de l’acide acétique total.
B.19.008 Il est interdit de nommer une des variétés de vinaigre entrant dans la composition d’un vinaigre mélangé, à moins que l’étiquette dudit mélange de vinaigres ne porte une liste complète des variétés de vinaigre présentes, par ordre décroissant de leurs proportions respectives, basées sur leur teneur en acide acétique.
B.19.009 La limite maximale de la teneur en acide acétique d’un vinaigre visé à l’article B.19.001 ne s’applique pas au vinaigre vendu uniquement à des fins de fabrication si la mention « Réservé à la fabrication » ou « Aux fins de fabrication seulement » figure sur l’espace principal de l’étiquette et sur tous les documents relatifs à ce vinaigre.
TITRE 20Thé
B.20.001 [N]. Le thé doit être les feuilles et les bourgeons desséchés de Thea sinensis (L.) Sims, préparés selon les procédés ordinaires du commerce.
B.20.002 [N]. Le thé noir doit être du thé noir ou un mélange de deux ou plusieurs thés noirs, et doit renfermer, sur la matière desséchée, au moins 30 pour cent d’extrait soluble dans l’eau, déterminé selon la méthode officielle FO-37, Détermination d’extraits solubles dans l’eau dans le thé, 15 octobre 1981, et au moins quatre pour cent et au plus sept pour cent de cendres totales.
- DORS/82-768, art. 61
B.20.003 Les dispositions de l’article B.20.002 ne s’appliquent pas au thé noir nature non mélangé, emballé selon une bonne pratique commerciale dans le pays d’origine, et qui contient, sur la matière desséchée, au moins 25 pour cent d’extrait soluble dans l’eau, déterminé selon la méthode officielle FO-37, Détermination d’extraits solubles dans l’eau dans le thé, 15 octobre 1981, et au moins quatre pour cent et au plus sept pour cent de cendres totales.
- DORS/82-768, art. 61
B.20.004 [N]. Le thé vert doit renfermer, sur la matière desséchée, au moins 33 pour cent d’extrait soluble dans l’eau, déterminé selon la méthode officielle FO-37, Détermination d’extraits solubles dans l’eau dans le thé, 15 octobre 1981, et au moins quatre pour cent et au plus sept pour cent de cendres totales.
- DORS/82-768, art. 61
B.20.005 [N]. Le (indication du type de thé) décaféiné :
a) est le thé de ce type duquel a été extraite de la caféine et qui, par suite d’une telle extraction, contient au plus 0,4 pour cent de caféine;
b) peut avoir été décaféiné au moyen des solvants d’extraction mentionnés au tableau XV du titre 16.
- DORS/90-429, art. 2
TITRE 21Produits d’animaux marins et d’animaux d’eau douce
B.21.001 Les aliments mentionnés dans le présent titre sont compris dans le terme produits d’animaux marins et d’animaux d’eau douce.
B.21.002 Dans le présent titre,
- remplissage
remplissage désigne
a) de la farine ou une semoule de céréales ou de pommes de terre, mais non de légumineuses,
b) de la farine de blé conditionnée, qui renferme au moins l’équivalent de 80 pour cent de dextrose, déterminé selon la méthode officielle FO-32, Détermination des remplissages, des liants et de l’équivalent de dextrose, 15 octobre 1981,
c) du pain, des biscuits ou autre produit de boulangerie, mais non des produits qui renferment une légumineuse ou sont fabriqués à base de légumineuses,
d) du lait en poudre, du lait écrémé en poudre, du babeurre en poudre et du petit-lait en poudre; et
e) de l’amidon; (filler)
- animaux marins et animaux d’eau douce
animaux marins et animaux d’eau douce comprend
a) le poisson,
b) les mollusques et crustacés, et autres invertébrés marins,
c) les mammifères marins, et
d) les grenouilles. (marine and fresh water animal)
- DORS/82-768, art. 62
B.21.003 [N]. Le poisson doit consister en sa partie comestible, propre et habillée, avec ou sans sel ou condiment, et peut
a) dans le cas de filets congelés, contenir de l’acide ascorbique ou son sel de sodium, de l’acide citrique ou de l’acide érythorbique ou son sel de sodium, ainsi que :
(i) du tripolyphosphate de sodium, de l’hexamétaphosphate de sodium ou une combinaison de tripolyphosphate de sodium, de pyrophosphate acide de sodium et de pyrophosphate tétrasodique, ou
(ii) un mélange d’hexamétaphosphate de sodium et de carbonate de sodium;
b) s’il est congelé, être enrobé d’une glaçure se composant d’eau, de monoglycérides acétyles, de chlorure de calcium, d’alginate de sodium, de carboxyméthycellulose de sodium, de phosphate disodique, de sirop de maïs, de dextrose, de glucose, de solides du glucose, d’acide ascorbique ou de son sel de sodium, ou d’acide érythorbique ou de son sel de sodium;
c) s’il est haché et congelé, contenir du tripolyphosphate de sodium, de l’hexamétaphosphate de sodium, de l’acide ascorbique ou son sel de sodium, de l’acide citrique, de l’acide érythorbique ou son sel de sodium, ou une combinaison de tripolyphosphate de sodium, de pyrophosphate acide de sodium et de pyrophosphate trétrasodique.
- DORS/84-300, art. 53
- DORS/88-534, art. 7
- DORS/91-149, art. 4
- DORS/97-562, art. 2
- DORS/2000-353, art. 9(F)
- DORS/2017-18, art. 6(F)
B.21.004 [N]. Dans le présent titre, la « chair » doit être la chair propre et habillée des crustacés, des mollusques, des autres invertébrés marins ou des mammifères marins, hachés ou non, avec ou sans sel ou d’autres condiments, et, dans le cas du homard congelé, du crabe congelé, des crevettes congelées et des clams congelés, peut contenir du tripolyphosphate de sodium ou de l’hexamétaphosphate de sodium ou une combinaison d’hexamétaphosphate de sodium et de carbonate de sodium ou une combinaison de tripolyphosphate de sodium, de pyrophosphate acide de sodium et de pyrophosphate tétrasodique.
- DORS/88-534, art. 8
- DORS/91-149, art. 5
B.21.005 Le poisson, à l’exception des protéines de poisson, les produits de chair ou leurs préparations sont falsifiées si l’une des substances ci-après ou une substance de l’une des catégories ci-après s’y trouve ou y a été ajoutée :
a) muqueuses, tout organe ou toute partie de l’appareil génital, ou tout organe ou toute partie d’un animal marin ou d’un animal d’eau douce qui ne se vend par d’ordinaire comme article d’alimentation;
b) un agent de conservation autre que ceux qui sont prévus au présent titre, sauf
(i) l’acide sorbique ou ses sels, dans le poisson desséché qui a été salé ou fumé et dans la pâte de poisson fumé et salé conditionnée à froid, et
(ii) l’acide benzoïque ou ses sels, le benzoate de p-hydroxyméthyle et le benzoate de p-hydroxypropyle, dans les produits de poisson ou de chair empaquetés, marinés ou conditionnés à froid par une autre méthode; et
c) un colorant pour aliments autre que ceux qui sont prévus au présent titre.
- DORS/2017-18, art. 7(F) et 20(F)
B.21.006 [N]. Le poisson et la chair préparés doivent être l’aliment entier ou haché préparé à partir du poisson ou de la chair, selon le cas, frais ou conservé; ils peuvent être cuits ou en conserve et peuvent :
a) dans le cas de pâte de homard et d’oeufs de poisson (caviar), contenir un colorant pour aliments;
b) dans le cas des crevettes cuites congelées, des crustacés en conserve, des maquereaux en conserve et des mollusques en conserve, contenir de l’acide citrique ou du jus de citron;
c) dans le cas de pâte de poisson, contenir un remplissage, un liant à poisson, des monoglycérides ou des mono et diglycérides;
d) dans le cas des conserves de chair de crabe, de crevettes, de homard, de saumon et de thon, contenir de l’éthylènediaminetétraacétate de calcium disodique et du sulfate d’aluminium;
e) dans le cas du thon en conserve, contenir de l’acide ascorbique;
f) dans le cas des fruits de mer en conserve, contenir de l’hexamétaphosphate de sodium, du pyrophosphate acide de sodium ou du tripolyphosphate de sodium, seul ou en association, la quantité totale de phosphate ajouté, calculé sous forme de phosphate dibasique de sodium, ne devant pas dépasser 0,5 %;
g) contenir un arôme de fumée liquide ou un arôme de fumée liquide concentré;
h) contenir de l’huile comestible, un bouillon végétal, de la sauce tomate ou de la purée de tomates;
i) contenir un gélifiant (agent gélatinisant), si l’expression « en gelée » figure, comme partie intégrante du nom usuel, sur l’espace principal de l’étiquette;
j) contenir du sel;
k) dans le cas des clams en conserve, des escargots en conserve et des limaces de mer en conserve, contenir de l’éthylènediaminetétraacétate de calcium disodique;
l) dans le cas de miettes de thon en conserve, contenir du sulfite de sodium;
m) dans le cas du caviar de lompe, contenir de la gomme adragante;
n) dans le cas d’un mélange de poisson et de chair préparés qui a l’apparence et le goût de la chair d’animaux marins ou d’animaux d’eau douce, contenir du remplissage, un liant à poisson, de l’oeuf entier, du blanc d’oeuf, du jaune d’oeuf, un colorant alimentaire, des agents gélatinisants ou stabilisants, des agents modifiant la texture, des préparations aromatisantes naturelles, des préparations aromatisantes artificielles, des agents rajusteurs du pH, de l’édulcorant et, dans une proportion ne dépassant pas deux pour cent du mélange, des légumineuses;
o) dans le cas des crustacés, contenir du bisulfite de potassium, du bisulfite de sodium, du dithionite de sodium, du métabisulfite de potassium, du métabisulfite de sodium, du sulfite de sodium ou de l’anhydride sulfureux;
p) dans le cas des crustacés et mollusques congelés, contenir de l’oxyde de calcium et de l’hydroxyde de sodium;
q) dans le cas de produits congelés de poisson pré-cuit pané, contenir de l’acide citrique en une quantité n’excédant pas la limite de tolérance de 0,1 pour cent;
r) dans le cas des clams en conserve, contenir de l’érythorbate de sodium en une quantité n’excédant pas la limite de tolérance de 350 parties par million;
s) dans le cas des produits hachés, sauf le caviar de lompe, contenir de la gomme adragante en une quantité n’excédant pas la limite de tolérance de 0,75 pour cent;
t) contenir un agent de conservation de la catégorie II.
- DORS/80-13, art. 9
- DORS/81-60, art. 12
- DORS/84-602, art. 4
- DORS/86-1020, art. 2
- DORS/89-197, art. 2
- DORS/92-344, art. 6
- DORS/93-276, art. 13
- DORS/94-141, art. 2
- DORS/94-567, art. 3
- DORS/94-689, art. 2(A)
- DORS/97-151, art. 27
- DORS/97-562, art. 3
- DORS/2005-316, art. 12
- DORS/2007-76, art. 4
- DORS/2011-280, art. 9
- DORS/2012-43, art. 46
- DORS/2017-18, art. 8, 9(F) et 17
- DORS/2018-69, art. 6
B.21.007 [N]. Le liant à poisson devant servir dans ou sur le poisson ou la chair préparés est du remplissage auquel on a ajouté n’importe quel mélange de sel, de sucre, de dextrose, de glucose, d’épices ou d’autres condiments.
- DORS/2017-18, art. 10(F)
- DORS/2018-69, art. 7(F)
B.21.008 Est interdite la vente de remplissage ou de liant à poisson représenté, sur l’étiquette ou dans une réclame, comme devant servir dans les produits de poisson, à moins que l’étiquette ne porte des instructions appropriées pour que l’emploi du produit soit conforme aux dispositions de l’article B.21.020.
B.21.009 L’huile de coton entièrement hydrogénée en poudre peut être appliquée comme agent de démoulage sur la surface des produits d’animaux marins et d’animaux d’eau douce en une quantité n’excédant pas 0,25 % du produit.
- DORS/2010-142, art. 59(F)
- DORS/2022-168, art. 43
Poisson préparé
B.21.020 Est interdite la vente de poisson préparé ou de chair préparée qui renferme
a) plus que la quantité de remplissage, de liant à poisson, ou d’autres ingrédients, que représente quatre pour cent de sucres réducteurs, calculés en dextrose selon la méthode officielle FO-32, Détermination des remplissages, des liants et de l’équivalent de dextrose, 15 octobre 1981; et
b) plus de 70 pour cent d’humidité, lorsque ledit poisson préparé contient du remplissage.
- DORS/82-768, art. 63
- DORS/2017-18, art. 20(F)
B.21.021 [N]. Le poisson conservé et la chair conservée sont du poisson ou de la chair, à l’état cru ou cuit, qui ont été desséchés, salés, marinés, saumurés ou fumés, et peuvent renfermer un agent de conservation de la catégorie I, un agent de conservation de la catégorie II, du dextrose, du glucose, des épices, du sucre et du vinaigre, et :
a) le poisson desséché qui a été salé ou fumé et la pâte de poisson fumé et salé conditionnée à froid peuvent renfermer de l’acide sorbique et ses sels;
b) le poisson fumé peut renfermer un colorant pour aliments;
c) les produits de poisson ou de chair emballés, marinés ou conditionnés à froid par une autre méthode peuvent renfermer du bois de santal, de l’acide benzoïque ou ses sels, du méthyl-p-hydroxy-bensoate et du propyl-p-hydroxy-bensoate;
d) l’anchois salé, le chinchard salé et la crevette salée peuvent contenir de l’érythrosine en telle quantité que le produit fini renferme au plus 125 parties par million d’érythrosine;
e) les produits hachés peuvent contenir de la gomme adragante en une quantité n’excédant pas la limite de tolérance de 0,75 pour cent.
- DORS/95-493, art. 2
- DORS/97-562, art. 4(F)
- DORS/2007-76, art. 5
- DORS/2011-280, art. 10
- DORS/2017-18, art. 11(F), 17 et 20(F)
- DORS/2018-69, art. 8(F)
B.21.022 et B.21.023 [Abrogés, DORS/79-252, art. 1]
B.21.024 Nonobstant l’article B.21.020, la pâte de homard doit renfermer au plus deux pour cent de remplissage ou de liant à poisson.
B.21.025 Il est interdit de vendre des animaux marins et des animaux d’eau douce et des produits de ces animaux, qui sont fumés ou qui renferment un arôme de fumée liquide ou un arôme de fumée liquide concentré et qui sont emballés dans un contenant hermétiquement scellé, à moins que l’une ou l’autre des conditions suivantes ne soit remplie :
a) le contenant a été traité, après son scellement, par chaleur à une température et pendant un temps suffisants pour détruire toutes les spores de Clostridium botulinum;
b) le contenu contient au moins neuf pour cent de sel, déterminé selon la méthode officielle FO-38 intitulée Détermination de sel dans le poisson fumé du 15 mars 1985;
c) le contenu est habituellement cuit avant la consommation;
d) le contenu est congelé et l’espace principal de l’étiquette du contenant porte, en caractères identiques à ceux du nom usuel du contenu, l’inscription « Garder congelé jusqu’à utilisation ».
- DORS/80-13, art. 10
- DORS/82-566, art. 5
- DORS/82-768, art. 64
- DORS/89-198, art. 17
- DORS/94-567, art. 4
B.21.027 [N]. Les protéines de poisson
a) constituent l’aliment préparé,
(i) en extrayant, à l’aide d’alcool isopropylique, l’eau, la graisse et les autres éléments solubles des poissons comestibles, entiers et frais, de l’ordre des clupéiformes, familles des clupéidés et des osméridés, et de l’ordre des gadiformes, famille des gadidés, ou des parures qui restent après avoir enlevé les filets de ces poissons éviscérés, et
(ii) en séchant et broyant le concentré de protéines résultant de l’opération décrite au sous-alinéa (i);
b) peuvent contenir un agent rectificateur du pH; et
c) ne doivent pas contenir
(i) moins de 75 pour cent de protéines d’une qualité non inférieure à celle de la caséine, après analyse selon la méthode officielle FO-1, Détermination de cote protéique, 15 octobre 1981.
(ii) et (iii) [Abrogés, DORS/97-148, art. 8]
- DORS/82-768, art. 65
- DORS/97-148, art. 8
Cuisses de grenouille
B.21.031 Est interdite la vente de cuisses de grenouille, fraîches ou congelées, à moins qu’elles ne soient trouvées exemptes de bactéries du genre Salmonella selon la méthode officielle MFO-10, Examen microbiologique de cuisses de grenouille, 30 novembre 1981.
- DORS/82-768, art. 66
TITRE 22Volaille, viande de volaille, leurs préparations et leurs produits
B.22.001 [N]. Le terme volaille désigne tout oiseau communément utilisé dans la consommation humaine.
B.22.002 [N]. La viande de volaille est la chair propre et apprêtée, coeur et gésier compris, d’une volaille éviscérée qui était saine au moment de l’abattage.
- DORS/80-13, art. 11
B.22.003 [N]. Les sous-produits de volaille sont les parties propres de la volaille, à l’exclusion de la viande ordinairement utilisée comme aliment, et comprennent le foie et la peau mais non l’oesophage, les pattes et la tête.
- DORS/80-13, art. 12
B.22.004 [N]. Les abats doivent être le coeur, le foie et le gésier de la volaille.
B.22.005 La viande de volaille, les sous-produits de viande de volaille ou leurs préparations sont falsifiés, s’ils renferment ou si l’on y a ajouté l’une des substances ci-dessous ou une substance de l’une des catégories suivantes :
a) tout organe ou toute partie de volaille qui ne se vend pas d’ordinaire comme partie comestible;
b) un agent de conservation autre que ceux qui sont prévus au présent titre; ou
c) un colorant autre que le caramel.
B.22.006 [N]. La viande de volaille préparée et les sous-produits de viande de volaille préparée doivent être, respectivement, de la viande de volaille ou des sous-produits de viande de volaille, hachés ou non, auxquels a été ajouté tout ingrédient permis par le présent règlement, ou qui ont subi un procédé de conservation, qui ont été placés dans un contenant hermétiquement fermé ou qui ont été cuits, et peuvent renfermer :
a) lorsque le présent titre prescrit une teneur totale minimale en protéines ou une teneur minimale en protéines de viande, un ou plusieurs des sels de phosphate suivants, en une proportion n’excédant pas la limite de tolérance calculée en phosphate disodique conformément au tableau XII de l’article B.16.100 :
(i) du pyrophosphate acide de sodium,
(ii) de l’hexamétaphosphate de sodium,
(iii) du phosphate disodique,
(iv) du phosphate monosodique,
(v) du pyrophosphate tétrasodique,
(vi) du tripolyphosphate de sodium,
(vii) du phosphate monopotassique,
(viii) du phosphate dipotassique,
(ix) du pyrophosphate tétrapotassique;
a.1) un agent de conservation de la catégorie II;
b) s’il s’agit de viande de volaille cuite et séchée, un agent de conservation de la catégorie IV;
c) s’il s’agit de dinde cuite tranchée emballée sous vide, du Carnobacterium maltaromaticum CB1.
- DORS/81-934, art. 16
- DORS/94-262, art. 13
- DORS/2010-264, art. 5
- DORS/2011-280, art. 11
B.22.008 Dans le présent titre, agent de remplissage désigne toute matière végétale, (à l’exclusion de la tomate et de la pulpe de betterave), le lait, les oeufs, la levure, ou tout dérivé ou combinaison de ces produits qui serait acceptable comme aliment.
- DORS/82-768, art. 67
- DORS/84-300, art. 54(A)
- DORS/86-875, art. 6
B.22.009 Est interdite la vente
a) de la volaille qui est destinée à être consommée comme aliment et à laquelle a été administré un produit ayant un pouvoir oestrogène; ou
b) de viande de volaille ou de sous-produits de viande de volaille, renfermant quelque résidu que ce soit de substances exogènes à action oestrogène.
- DORS/87-626, art. 2
B.22.010 L’huile de coton entièrement hydrogénée en poudre peut être appliquée comme agent de démoulage sur la surface de la viande de volaille, des sous-produits de viande de volaille, de la viande de volaille préparée, des sous-produits de viande de volaille préparés, des produits de volaille avec allongeur et des simili-produits de volaille en une quantité n’excédant pas 0,25 % du produit.
- DORS/2010-142, art. 59(F)
- DORS/2022-168, art. 44
B.22.011 [N]. La viande de volaille coupée solide doit consister :
a) soit en une pièce de viande de volaille entière;
b) soit en un produit constitué de morceaux de viande de volaille, dont au moins 80 pour cent pèsent au moins 25 g chacun.
- DORS/94-262, art. 14
B.22.012 (1) Est interdite la vente de viande de volaille coupée solide à laquelle ont été ajoutés des sels de phosphate ou de l’eau, à moins que les conditions suivantes ne soient réunies :
a) la viande a :
(i) si elle est cuite, une teneur minimale en protéines de viande de 12 pour cent,
(ii) si elle n’est pas cuite, une teneur minimale en protéines de viande de 10 pour cent;
b) la viande contient un ou plusieurs des sels de phosphate suivants, en une proportion n’excédant pas la limite de tolérance calculée en phosphate disodique conformément au tableau XII de l’article B.16.100 :
(i) du pyrophosphate acide de sodium,
(ii) de l’hexamétaphosphate de sodium,
(iii) du phosphate disodique,
(iv) du phosphate monosodique,
(v) du pyrophosphate tétrasodique,
(vi) du tripolyphosphate de sodium,
(vii) du phosphate monopotassique,
(viii) du phosphate dipotassique,
(ix) du pyrophosphate tétrapotassique.
(2) Aux fins du calcul de la teneur en protéines de viande visée à l’alinéa (1)a), les os et les couches de gras visible ne doivent pas être pris en compte.
- DORS/94-262, art. 14
B.22.013 Est interdite la vente de la volaille habillée, entière ou en morceaux, qui a été refroidie dans un réservoir refroidisseur contenant un liquide additionné de sels de phosphate.
- DORS/94-262, art. 14
Ragoûts de poulet
B.22.016 Aux fins des articles B.22.017 à B.22.019, viande de volaille pour ragoût s’entend de la viande de volaille cuite ou crue contenant au plus 15 % de gras, calculés d’après le poids de la viande crue.
- DORS/78-874, art. 3
- DORS/2018-69, art. 9(F)
B.22.017 [N]. Le ragoût de légumes avec (nom de la viande de volaille)
a) doit contenir des légumes et (le nom de la viande de volaille) dans les quantités suivantes :
(i) si de la viande crue est utilisée, au moins 12 % de viande de volaille pour ragoût,
(ii) si de la viande cuite est utilisée, au moins 6 % de viande de volaille pour ragoût,
(iii) au moins 38 % de légumes et
b) peut contenir de la sauce, du sel, des assaisonnements et des épices.
- DORS/78-874, art. 3
B.22.018 [N]. Le ragoût de (nom de la viande de volaille)
a) doit contenir des légumes et de la viande de volaille pour ragoût, dans les quantités suivantes :
(i) si de la viande crue est utilisée, au moins 20 % de viande de volaille pour ragoût,
(ii) si de la viande cuite est utilisée, au moins 10 % de viande de volaille pour ragoût,
(iii) au moins 30 % de légumes et
b) peut contenir de la sauce, du sel, des assaisonnements et des épices.
- DORS/78-874, art. 3
B.22.019 [N]. Le ragoût spécial de viande de volaille
a) doit contenir de la viande de volaille et des légumes dans les quantités suivantes :
(i) si de la viande crue est utilisée, au moins 25 % de viande de volaille pour ragoût,
(ii) si de la viande cuite est utilisée, au moins 15 % de viande de volaille pour ragoût,
(iii) au moins 30 % de légumes et
b) peut contenir de la sauce, du sel, des assaisonnements et des épices.
- DORS/78-874, art. 3
Viandes de volaille préparées, sous-produits de viande de volaille préparés
B.22.020 [Abrogé, DORS/86-875, art. 7]
B.22.021 [N]. La viande de volaille conservée et les sous-produits de viande de volaille conservés sont de la viande de volaille ou des sous-produits de viande de volaille crus ou cuits, qui ont été salés ou fumés et qui peuvent renfermer :
a) un agent de conservation de la catégorie I;
a.1) un agent de conservation de la catégorie II;
b) un arôme de fumée liquide, un arôme de fumée liquide concentré ou des épices;
c) des agents édulcorants;
d) du vinaigre;
e) dans le cas de la volaille et de la viande de volaille de salaison préparées à l’aide d’une solution d’injection ou d’immersion, du phosphate disodique, du phosphate monosodique, de l’hexamétaphosphate de sodium, du tripolyphosphate de sodium, du pyrophosphate tétrasodique et du pyrophosphate acide de sodium, en telle quantité calculée en phosphate disodique, que le produit fini renferme au plus 0,5 pour cent de phosphate ajouté;
f) dans le cas de la dinde cuite tranchée emballée sous vide, du Carnobacterium maltaromaticum CB1.
- DORS/80-13, art. 13
- DORS/82-596, art. 10
- DORS/94-567, art. 5
- DORS/2010-264, art. 6
- DORS/2011-280, art. 12
- DORS/2017-18, art. 12(F)
- DORS/2018-69, art. 10(F)
B.22.022 [N]. La (nom de la volaille) en conserve doit être préparée avec de la viande de volaille et peut renfermer
a) les os ou parties d’os adhérant aux morceaux de viande de la volaille mise en conserve;
b) du bouillon;
c) du sel;
d) des assaisonnements;
e) des agents gélatinisants; et
f) de petites quantités de gras.
- DORS/84-300, art. 55
B.22.023 [N]. Le bouillon utilisé dans la (nom de la volaille) en conserve doit être le liquide dans lequel on a fait cuire la viande de volaille.
B.22.024 [Abrogé, DORS/2022-143, art. 27]
B.22.025 [N]. La (nom de la volaille) désossée doit être de la viande de volaille en conserve, débarrassée des os et de la peau; elle doit renfermer au moins 50 pour cent de viande de la volaille nommée, déterminé selon la méthode officielle FO-39, Détermination de viande dans la volaille désossée, 15 octobre 1981, et elle peut renfermer du bouillon dont la densité est d’au moins 1,000 à la température de 50 °C.
- DORS/82-768, art. 69
B.22.026 Est interdite la vente de volaille, de viande de volaille ou de sous-produits de viande de volaille cuits à la broche, rôtis ou grillés et prêts à la consommation à moins que la volaille, la viande de volaille ou le sous-produit de viande de volaille cuits
a) n’aient constamment
(i) indiqué une température de 40 °F (4,4 °C) ou moins, ou de 140 °F (60 °C) ou plus, ou
(ii) été conservés à une température ambiante de 40 °F (4,4 °C) ou moins, ou de 140 °F (60 °C) ou plus; et
b) ne portent, sur l’espace principal de l’étiquette, mention qu’ils doivent être conservés à une température de 40 °F (4,4 °C) ou moins, ou de 140 °F (60 °C) ou plus.
- DORS/78-403, art. 28(F)
- DORS/88-336, art. 3
Allongeur de produits de volaille
B.22.027 Est interdite la vente d’un allongeur de produits de volaille, à moins que cet allongeur
a) n’ait, à l’état réhydraté,
(i) une teneur totale en protéines d’au moins 16 pour cent, et
(ii) une cote protéique d’au moins 40, déterminée selon la méthode officielle FO-1, Détermination de cote protéique, 15 octobre 1981;
b) par dérogation aux articles D.01.009 et D.02.009, ne contienne toutes les vitamines et tous les minéraux nutritifs figurant au tableau du titre 14, à la colonne I, en quantité au moins égale à celle indiquée audit tableau, à la colonne II, au regard de chacune de ces vitamines et de chacun de ces minéraux nutritifs; et que
c) lorsque des acides aminés essentiels isolés ont été ajoutés, il ne contienne ces acides en quantités non supérieures aux quantités qui améliorent la qualité nutritive de la protéine.
- DORS/82-768, art. 70
Produits de volaille avec allongeur
B.22.028 Est interdite la vente d’un aliment qui consiste en un mélange de produit de volaille et d’allongeur de produits de volaille, à moins que cet aliment
a) n’ait une teneur totale en protéines d’au moins 16 pour cent, et
b) n’ait une teneur en matières grasses d’au plus 15 pour cent, et que
l’allongeur de produits de volaille ne satisfasse aux exigences des alinéas B.22.027a) à c).
Simili-produits de volaille
B.22.029 Est interdite la vente d’un simili-produit de volaille, à moins que ce produit
a) n’ait une teneur totale en protéines d’au moins 16 pour cent;
b) n’ait une cote protéique d’au moins 40, déterminée selon la méthode officielle FO-1, Détermination de cote protéique, 15 octobre 1981;
c) n’ait une teneur en matières grasses d’au plus 15 pour cent;
d) par dérogation aux articles D.01.009 et D.02.009, ne contienne toutes les vitamines et tous les minéraux nutritifs figurant au tableau du titre 14, à la colonne I, en quantité au moins égale à celle indiquée audit tableau, à la colonne II, au regard de chacune de ces vitamines et de ces minéraux nutritifs; et que
e) lorsque des acides aminés essentiels isolés ont été ajoutés, il ne contienne ces acides en quantités non supérieures aux quantités qui améliorent la qualité nutritive de la protéine.
- DORS/82-768, art. 71
Produits des oeufs
B.22.032 Est interdite la vente d’un produit imitant l’oeuf, sauf si ce produit
a) provient d’albumine d’oeuf, en poudre, à l’état liquide ou congelé, ou d’un mélange quelconque de ces produits;
b) a une cote protéique d’au moins 40, déterminée selon la méthode officielle FO-1, Détermination de cote protéique, 15 octobre 1981;
c) nonobstant les articles D.01.009 et D.02.009, contient par 100 grammes de produits prêt à utiliser
(i) au moins
(A) 50 milligrammes de calcium,
(B) 2,3 milligrammes de fer,
(C) 1,5 milligramme de zinc,
(D) 130 milligrammes de potassium,
(E) 1 000 unités internationales de vitamine A,
(F) 0,10 milligramme de thiamine,
(G) 0,30 milligramme de riboflavine,
(H) 3,60 milligrammes de niacine,
(I) 1,60 milligramme d’acide pantothénique,
(J) 0,20 milligramme de vitamine B6′
(K) 0,50 microgramme de vitamine B12′
(L) 0,02 milligramme d’acide folique, et
(M) 2,0 unités internationales d’alpha tocophérol, et
(ii) au plus trois milligrammes de cholestérol;
d) contient du calcium et du phosphore dans une proportion d’au moins une partie de calcium pour quatre parties de phosphore; et
e) contient, dans le gras total de toute graisse ou huile utilisée, au moins 40 pour cent d’acides gras polyinsaturés à groupe cis-cis méthylène et au plus 20 pour cent d’acides gras saturés.
- DORS/82-768, art. 72
- DORS/84-300, art. 56
B.22.033 Est interdite la vente de produits des oeufs visés aux articles B.22.032, B.22.034, B.22.035, B.22.036 et B.22.037, destinés à la consommation humaine, sauf s’ils sont trouvés exempts de bactéries de l’espèce Salmonella selon la méthode officielle MFO-6, Examen microbiologique des produits des oeufs et des oeufs à l’état liquide, 30 novembre 1981.
- DORS/82-768, art. 73
B.22.034 [N]. L’oeuf entier liquide, la poudre d’oeuf ou l’oeuf entier congelé
a) est le produit obtenu en débarrassant de leur coquille des oeufs frais sains ou des oeufs entreposés sains, et
(i) dans le cas de la poudre d’oeuf entier, en la séchant, ou
(ii) dans le cas de l’oeuf entier congelé, en le congelant; et
b) peut renfermer
(i) du sulfate d’aluminium, des agents rajusteurs de pH ou du colorant bêta-carotène,
(ii) dans le cas de l’oeuf entier liquide destiné au séchage, de l’autolysat de levure et peut être traité avec du peroxyde d’hydrogène et de la catalase, de la glucose-oxydase et de la catalase, de la levure ou une culture bactérienne appropriée fermentant le glucose, et
(iii) dans le cas de la poudre d’oeuf entier, des agents anti-agglomérants.
B.22.035 [N]. Le jaune d’oeuf liquide, la poudre de jaune d’oeuf ou le jaune d’oeuf congelé
a) est le produit obtenu en débarrassant de leur coquille et de leur blanc des oeufs frais sains ou des oeufs entreposés sains, et
(i) dans le cas de la poudre de jaune d’oeuf, en la séchant, ou
(ii) dans le cas du jaune d’oeuf congelé, en le congelant; et
b) peut renfermer
(i) du sulfate d’aluminium, des agents rajusteurs du Ph ou du colorant bêta-carotène,
(ii) dans le cas du jaune d’oeuf liquide destiné au séchage, de l’autolysat de levure et peut être traité avec du peroxyde d’hydrogène et de la catalase, de la glucose-oxydase et de la catalase, de la levure ou une culture bactérienne appropriée fermentant le glucose, et
(iii) dans le cas de la poudre de jaune d’oeuf, des agents anti-agglomérants.
B.22.036 [N]. Le blanc d’oeuf liquide (albumen liquide), la poudre de blanc d’oeuf (poudre d’albumen) ou le blanc d’oeuf congelé (albumen congelé)
a) est le produit obtenu en débarrassant de leur coquille et de leur jaune des oeufs frais sains ou des oeufs entreposés sains, et
(i) dans le cas de la poudre de blanc d’oeuf, en la séchant, ou
(ii) dans le cas du blanc d’oeuf congelé, en le congelant; et
b) peut renfermer
(i) des agents favorisant la montée en neige, du sulfate d’aluminium et des agents rajusteurs du Ph,
(ii) dans le cas du blanc d’oeuf liquide destiné au séchage de l’autolysat de levure et peut être traité avec du peroxyde d’hydrogène et de la catalase, de la glucose-oxydase et de la catalase, de la levure ou une culture bactérienne appropriée fermentant le glucose,
(iii) dans le cas du blanc d’oeuf liquide et de la poudre de blanc d’oeuf, de la lipase ou de la pancréatine, et
(iv) dans le cas de la poudre de blanc d’oeuf, des agents anti-agglomérants.
B.22.037 [N]. Le mélange liquide d’oeufs entier, le mélange de poudre d’oeufs entiers, le mélange congelé d’oeufs entiers, le mélange liquide de jaunes d’oeufs, le mélange de poudre de jaunes d’oeufs ou le mélange congelé de jaunes d’oeufs
a) est le produit obtenu en ajoutant du sel, des agents édulcorants, ou les deux, aux oeufs entiers liquides, à la poudre d’oeuf entier, aux oeufs entiers congelés, aux jaunes d’oeufs liquides, à la poudre de jaune d’oeuf ou aux jaunes d’oeufs congelés; et
b) dans le cas du mélange de poudre d’oeufs entiers ou du mélange de poudre de jaunes d’oeufs, peut renfermer des agents anti-agglomérants.
B.22.038 (1) Il est interdit d’utiliser un nom usuel mentionné aux articles B.22.034 à B.22.037 à l’égard d’un produit des oeufs qui a fait l’objet d’un traitement non mentionné à l’un de ces articles si celui-ci a entraîné une réduction de la quantité d’une vitamine ou d’un minéral nutritif présent dans le produit en une concentration représentant, par 100 g du produit, 10 pour cent ou plus de l’apport nutritionnel recommandé pondéré, à moins que la quantité ainsi réduite n’ait été ramenée à ce qu’elle était avant le traitement.
(2) Malgré les articles D.01.009, D.01.011 et D.02.009, il est permis d’ajouter une vitamine ou un minéral nutritif mentionné à la colonne II de l’article 27 du tableau de l’article D.03.002 à un produit des oeufs visé aux articles B.22.034 à B.22.037 afin de ramener la concentration de cette vitamine ou de ce minéral à ce qu’elle était avant le traitement.
(3) Pour l’application du présent article, apport nutritionnel recommandé pondéré s’entend au sens du paragraphe D.01.001(1).
- DORS/96-259, art. 2
TITRE 23Matériaux à emballer les denrées alimentaires
B.23.001 Est interdite la vente d’un aliment dont l’emballage peut transmettre à son contenu une substance pouvant être nuisible à la santé d’un consommateur de l’aliment.
B.23.002 Sous réserve de l’article B.23.003, est interdite la vente d’un aliment dont l’emballage a été fabriqué à l’aide d’un chlorure de polyvinyle renfermant un produit chimique à base d’étain octylique.
B.23.003 Est permise, sauf dans le cas du lait, du lait écrémé, du lait partiellement écrémé, du lait stérilisé, des boissons maltées et des boissons gazeuses non alcoolisées, la vente d’un aliment dont l’emballage a été fabriqué à partir de polychlorure de vinyle contenant l’un ou plusieurs des produits chimiques suivants à base d’étain octylique, soit le S,S;-bis(isooctylmercaptoacétate) de di(n-octyl)étain, le polymère maltéate de di(n-octyl)étain ou le S,S;, S :-tris(isooctylmercaptoacétate) de (n-octyl) étain, si la quantité de ce produit ou de la combinaison de ces produits ne dépasse pas trois pour cent de la quantité de résine et si l’aliment en contact avec l’emballage ne contient pas plus de une partie par million d’étain octylique total.
- DORS/81-60, art. 13
- DORS/86-1125, art. 4
B.23.004 (1) Le S,S;-bis(isooctylmercaptoacétate) de di(n-octyl)étain est l’étain octylique obtenu à partir du bichlorure de di(n-octyl)étain et contenant au moins 15,1 et au plus 16,4 pour cent d’étain et au moins 8,1 et au plus 8,9 pour cent de soufre thiolique.
(2) Aux fins du présent titre, le bichlorure de di(n-octyl)étain est un organo-étain contenant au moins 95 pour cent de bichlorure de di(n-octyl)étain et au plus :
a) cinq pour cent de trichlorure de (n-octyl)étain ou de chlorure de tri(n-octyl)étain ou de la combinaison des deux;
b) 0,2 pour cent de toute combinaison d’autres alkyl-étains isomères à groupement alkyl renfermant huit atomes de carbone;
c) 0,1 pour cent de toute combinaison d’alkyl-étains homologues supérieurs et inférieurs.
- DORS/86-1125, art. 5
B.23.005 Le polymère maléate de di(n-octyl)étain est l’étain octylique obtenu à partir du bichlorure de di(n-octyl)étain, dont la formule est ((C8H17)2 SnC4H2O4)n (dans laquelle n est d’au moins 2 et d’au plus 4), dont l’indice de saponification est d’au moins 225 et d’au plus 255, et qui contient au moins 25,2 et au plus 26,6 pour cent d’étain.
- DORS/86-1125, art. 6(F)
B.23.006 (1) Le S,S;,S :-tris(isooctylmercaptoacétate) de (n-octyl)étain est l’étain octylique possédant la formule n-C8HSn(SCH2CO2 C8H17)3, qui est obtenu à partir du trichlorure de (n-octyl)étain et qui contient au moins 13,4 et au plus 14,8 pour cent d’étain et au moins 10,9 et au plus 11,9 pour cent de soufre thiolique.
(2) Aux fins du présent titre, le trichlorure de (n-octyl)étain est un organo-étain contenant au moins 95 pour cent de trichlorure de (n-octyl)étain et au plus :
a) cinq pour cent de bichlorure de di(n-octyl)étain, de chlorure de tri(n-octyl)étain ou de chlorures d’alkyl-étains supérieurs (à groupement alkyl renfermant plus de huit atomes de carbone) ou de toute combinaison de ceux-ci;
b) 0,2 pour cent de toute combinaison d’alkyl-étains;
c) 0,1 pour cent de toute combinaison d’alkyl-étains homologues inférieurs (à groupement alkyl renfermant moins de huit atomes de carbone).
- DORS/86-1125, art. 7
B.23.007 Est interdite la vente d’un aliment dont l’emballage peut transmettre à son contenu une quantité de chlorure de vinyle, déterminée selon la méthode officielle FO-40, Détermination de chlorure de vinyle dans les aliments, 15 octobre 1981, pour cet aliment.
- DORS/82-768, art. 74
B.23.008 Est interdite la vente d’un aliment dont l’emballage peut transmettre à son contenu une quantité quelconque d’acrylonitrile, telle que déterminée selon la méthode officielle FO-41, Détermination d’acrylonitrile dans les aliments (16 février 1982).
- DORS/82-541, art. 1
TITRE 24
Aliments à usage diététique spécial
B.24.001 Dans ce titre,
- aliment à usage diététique spécial
aliment à usage diététique spécial désigne un aliment qui a été spécialement transformé ou formulé pour satisfaire les besoins alimentaires particuliers d’une personne
a) manifestant un état physique ou physiologique particulier suite à une maladie, une blessure ou un désordre fonctionnel, ou
b) chez qui l’on cherche à obtenir un résultat particulier, y compris, sans s’y limiter, une perte de poids, grâce au contrôle de sa ration alimentaire; (food for special dietary use)
- changement majeur
changement majeur S’entend, dans le cas d’un aliment présenté comme étant conçu pour un régime à très faible teneur en énergie, de tout changement d’un des éléments suivants qui pourrait, selon l’expérience du fabricant ou la théorie généralement admise, avoir un effet indésirable sur les concentrations ou la disponibilité des éléments nutritifs de l’aliment ou sur l’innocuité microbiologique ou chimique de celui-ci :
a) un ingrédient ou la quantité d’un ingrédient dans l’aliment;
b) le procédé de fabrication ou l’emballage de l’aliment;
c) le mode de préparation et le mode d’emploi de l’aliment. (major change)
- date limite d’utilisation
date limite d’utilisation Relativement à une préparation pour régime liquide, un aliment présenté comme étant conçu pour un régime à très faible teneur en énergie, un substitut de repas ou un supplément nutritif, la date :
a) après laquelle le fabricant n’en recommande plus la consommation;
b) jusqu’à laquelle le produit conserve sa stabilité microbiologique et physique de même que la valeur nutritive indiquée sur l’étiquette. (expiration date)
- hôpital
hôpital
a) Établissement qui fait l’objet d’un permis délivré par une province ou qui a été approuvé ou désigné par elle à ce titre en conformité avec ses lois en vue d’assurer des soins ou des traitements aux personnes atteintes de toute forme de maladie ou d’affection;
b) établissement qui assure des soins de santé et qui appartient au gouvernement du Canada ou d’une province ou qui est exploité par lui. (hospital)
- médecin
médecin Personne qui, en vertu des lois d’une province, est inscrite à titre de médecin et est autorisée à pratiquer la médecine et qui exerce cette profession en vertu de ces lois dans cette province. (physician)
- pharmacien
pharmacien Personne qui, en vertu des lois d’une province, est inscrite à titre de pharmacien et est autorisée à exercer cette profession et qui l’exerce en vertu de ces lois dans cette province. (pharmacist)
- poids corporel cible
poids corporel cible Poids corporel visé à la fin d’un régime amaigrissant que fixe le médecin avant le début du régime. (target body weight)
- préparation pour régime liquide
préparation pour régime liquide désigne un aliment qui
a) est vendu pour consommation sous forme liquide, et
b) est vendu ou présenté comme régime alimentaire complet pris par voie orale ou administré à la sonde stomacale à une personne visée à l’alinéa a) de la définition d’aliment à usage diététique spécial; (formulated liquid diet)
- régime à très faible teneur en énergie
régime à très faible teneur en énergie Régime amaigrissant qui, lorsqu’il est suivi selon les indications, fournit moins de 900 kilocalories par jour. (very low energy diet)
- repas préemballé
repas préemballé[Abrogée, DORS/95-474, art. 3]
- substitut de repas
substitut de repas[Abrogée, DORS/95-474, art. 3]
- DORS/78-64, art. 1
- DORS/78-698, art. 4
- DORS/94-35, art. 1
- DORS/95-474, art. 3
B.24.003 (1) Il est interdit d’étiqueter, d’emballer, de vendre ou d’annoncer un aliment de manière à donner l’impression qu’il est à usage diététique spécial, à moins que cet aliment ne soit
a) à e) [Abrogés, DORS/2003-11, art. 21]
f) une préparation pour régime liquide qui répond aux exigences des articles B.24.101 et B.24.102;
f.1) un substitut de repas à usage diététique spécial qui répond aux exigences de l’article B.24.200;
f.2) un supplément nutritif qui répond aux exigences de l’article B.24.201;
g) un aliment sans gluten répondant aux exigences de l’article B.24.018;
h) un aliment présenté comme étant destiné aux régimes à teneur réduite en protéines;
i) un aliment présenté comme étant destiné aux régimes à faible teneur en (nom de l’acide aminé);
j) un aliment présenté comme étant conçu pour un régime à très faible teneur en énergie qui répond aux exigences mentionnées à l’article B.24.303.
(1.1) Malgré le paragraphe (1), il est permis d’étiqueter, d’emballer, de vendre ou d’annoncer un aliment de manière à donner l’impression qu’il est à usage diététique spécial si son étiquette comporte une mention ou une allégation figurant à la colonne 4 du Tableau des mentions et des allégations autorisées concernant la teneur nutritive, conformément à l’article B.01.503, en regard de l’un des sujets ci-après visé à la colonne 1 :
a) « sans énergie », visé à l’article 1;
b) « peu d’énergie », visé à l’article 2;
c) « sans sodium ou sans sel », visé à l’article 31;
d) « faible teneur en sodium ou en sel », visé à l’article 32;
e) « sans sucres », visé à l’article 37.
(2) Le paragraphe (1) ne s’applique pas au fortifiant pour lait humain et au succédané de lait humain au sens de l’article B.25.001.
(3) Il est interdit d’étiqueter, d’emballer, de vendre ou d’annoncer un aliment de manière à donner l’impression qu’il est conçu pour les régimes amaigrissants, à moins que cet aliment ne soit
a) un substitut de repas dont la composition répond aux exigences de l’article B.24.200;
b) un repas préemballé;
c) un aliment vendu par une clinique d’amaigrissement à ses clients pour être consommé dans le cadre d’un programme d’amaigrissement supervisé par le personnel de la clinique;
d) un aliment présenté comme étant conçu pour un régime à très faible teneur en énergie et dont la composition répond aux exigences de l’article B.24.303.
(4) Sauf disposition contraire du présent règlement, il est interdit d’étiqueter, d’emballer, de vendre ou d’annoncer un aliment, en le présentant comme étant « diététique » ou « diète » ou d’inclure l’un ou l’autre de ces mots dans sa marque à moins que son étiquette comporte une mention ou une allégation figurant à la colonne 4 du Tableau des mentions et des allégations autorisées concernant la teneur nutritive, conformément à l’article B.01.503, en regard de l’un des sujets ci-après visé à la colonne 1 :
a) « sans énergie », visé à l’article 1;
b) « peu d’énergie », visé à l’article 2;
c) « énergie réduite », visé à l’article 3;
d) « moins d’énergie », visé à l’article 4;
e) « sans sucres », visé à l’article 37.
- DORS/78-64, art. 2
- DORS/78-698, art. 5
- DORS/84-334, art. 1
- DORS/86-178, art. 8(A)
- DORS/94-35, art. 2
- DORS/95-444, art. 1
- DORS/95-474, art. 4
- DORS/2003-11, art. 21
- DORS/2021-57, art. 11
- DORS/2022-168, art. 52
B.24.004 à B.24.014 [Abrogés, DORS/2003-11, art. 22]
B.24.015 et B.24.016 [Abrogés, DORS/88-559, art. 26]
B.24.017 (1) Lorsque le ministre demande par écrit au fabricant d’une préparation pour régime liquide, d’un substitut de repas ou d’un aliment présenté comme étant conçu pour un régime à très faible teneur en énergie de soumettre, à une date précise ou avant celle-ci, des preuves relatives à ce produit, le fabricant doit cesser de vendre ce produit le lendemain de cette date à moins d’avoir déposé les preuves demandées.
(2) Si le ministre conclut que les preuves présentées par le fabricant en application du paragraphe (1) sont insuffisantes, il en avise le fabricant par écrit.
(3) Lorsque, aux termes du paragraphe (2), un fabricant est informé que les preuves relatives à la préparation pour régime liquide, au substitut de repas ou à l’aliment présenté comme étant conçu pour un régime à très faible teneur en énergie sont insuffisantes, il doit cesser de vendre ce produit à moins qu’il ne présente des preuves supplémentaires et que le ministre ne l’informe par écrit qu’elles sont suffisantes.
(4) Dans le présent article, les preuves relatives à une préparation pour régime liquide, à un substitut de repas ou à un aliment présenté comme étant conçu pour un régime à très faible teneur en énergie s’entendent des preuves permettant d’établir que l’aliment possède les qualités nutritives voulues pour être utilisé comme source nutritive unique qui répond aux besoins nutritifs des personnes à qui il est destiné lorsqu’il est consommé suivant le mode d’emploi.
- DORS/78-698, art. 6
- DORS/94-35, art. 3
- DORS/2018-69, art. 11 et 27
B.24.018 Il est interdit d’étiqueter, d’emballer ou de vendre un aliment qui contient une protéine de gluten ou une protéine de gluten modifiée, y compris toute fraction protéique de gluten, visée à la définition de gluten au paragraphe B.01.010.1(1), ou d’en faire la publicité, de manière qui puisse donner l’impression qu’il est sans gluten.
- DORS/95-444, art. 2
- DORS/2011-28, art. 6
B.24.019 [Abrogé, DORS/2003-11, art. 23]
Préparations pour régime liquide
B.24.100 Est interdite la publicité au grand public d’une préparation pour régime liquide.
- DORS/78-64, art. 7
- DORS/78-698, art. 7
B.24.101 Il est interdit de vendre une préparation pour régime liquide à moins que l’aliment,
a) s’il est vendu prêt à servir, ou
b) s’il n’est pas vendu prêt à servir, lorsque dilué avec de l’eau, du lait, ou les deux,
ne soit un succédané complet du régime total en ce qu’il satisfait aux besoins nutritionnels d’une personne.
- DORS/78-64, art. 7
B.24.102 (1) Sous réserve du paragraphe (4), une préparation pour régime liquide doit, lorsqu’elle est prête à servir :
a) contenir :
(i) soit au moins 20 g de protéines d’une qualité nutritive équivalente à la caséine, après analyse selon la méthode officielle FO-1, Détermination de cote protéique, du 15 octobre 1981,
(ii) soit une quantité et une qualité de protéines, y compris les protéines additionnées d’acides aminés, dont, lorsque la qualité des protéines est exprimée comme une fraction de la qualité de la caséine :
(A) la fraction ne sera pas inférieure à 85/100,
(B) le résultat de la multiplication de la fraction et du poids en grammes de la protéine ne sera pas inférieur à 20;
b) contenir au moins l g d’acide linoléique sous forme de glycéride.
(2) Par dérogation aux articles D.01.009, D.01.011 et D.02.009, une préparation pour régime liquide doit contenir, lorsqu’elle est prête à servir, les vitamines et les minéraux mentionnés dans la colonne I du tableau du présent article :
a) lorsque l’apport recommandé est de 2 500 kcal par jour ou moins, en quantités non inférieures à celles visées à la colonne II et non supérieures à celles visées à la colonne III;
b) lorsque l’apport recommandé est supérieur à 2 500 kcal par jour, en quantités non inférieures à celles visées à la colonne IV et non supérieures à celles visées à la colonne V.
(3) Les quantités d’éléments nutritifs visées aux alinéas (1)a) et b) et au paragraphe (2) doivent être calculées :
a) par 1 000 kcal disponibles, lorsque l’apport recommandé est de 2 500 kcal par jour ou moins;
b) par 1 500 kcal disponibles, lorsque l’apport recommandé est supérieur à 2 500 kcal par jour.
(4) L’alinéa (1)a) ne s’applique pas à une préparation pour régime liquide recommandée pour un régime à teneur réduite en protéines ou à faible teneur en (nom de l’acide aminé).
TABLEAU
Colonne I Par 1 000 kcal disponibles Par 1 500 kcal disponibles Colonne II Colonne III Colonne IV Colonne V Vitamines Quantité minimale Quantité maximale Quantité minimale Quantité maximale Vitamine A 2 000 U.I. 5 000 U.I 2 000 U.I. 3 000 U.I. Vitamine D 100 U.I. 400 U.I. 100 U.I. 200 U.I. Vitamine E (a-tocophérol) 5 U.I. 5 U.I. Acide ascorbique 20 mg 20 mg Thiamine 0,5 mg 0,6 mg Riboflavine 0,7 mg 0,84 mg Niacine 6,6 mg 7,9 mg Vitamine B6 0,9 mg 0,9 mg Vitamine B12 1,5 µg 1,5 µg Acide folique 100 µg 100 µg Acide d-pantothénique 2,5 mg 2,5 mg Minéraux Calcium 400 mg 400 mg Phosphore 400 mg 400 mg Fer 8 mg 8 mg Iode 50 µg 50 µg Magnésium 150 mg 150 mg Cuivre 1 mg 1 mg Zinc 7 mg 7 mg
- DORS/78-64, art. 7
- DORS/78-698, art. 8
- DORS/82-768, art. 75
- DORS/87-640, art. 9(F)
- DORS/90-830, art. 6(F)
- DORS/2022-197, art. 5(A)
B.24.103 L’étiquette d’une préparation pour régime liquide doit porter les renseignements suivants :
a) une mention indiquant que l’aliment est destiné à être consommé par voie orale ou administré à la sonde stomacale;
b) une mention de la valeur énergétique de l’aliment, exprimée en Calories :
(i) par 100 grammes ou par 100 millilitres de l’aliment sous sa forme commerciale,
(ii) par unité de l’aliment prêt à servir;
c) une mention de la teneur de l’aliment en protéines ou en équivalent de protéines, en matières grasses, en acide linoléique, en glucides disponibles et, s’il y a lieu, en fibres brutes, exprimée en grammes :
(i) par 100 grammes ou par 100 millilitres de l’aliment sous sa forme commerciale,
(ii) par unité de l’aliment prêt à servir;
d) une mention de la teneur en vitamines et en minéraux nutritifs énumérés au tableau de l’article B.24.102, exprimée en unités internationales, en milligrammes ou en microgrammes :
(i) par 100 grammes ou par 100 millilitres de l’aliment sous sa forme commerciale,
(ii) par unité de l’aliment prêt à servir;
e) une mention de la teneur en une vitamine ou un minéral nutritif autres que ceux énumérés au tableau de l’article B.24.102, exprimée en milligrammes ou en microgrammes :
(i) par 100 grammes ou par 100 millilitres de l’aliment sous sa forme commerciale,
(ii) par unité de l’aliment prêt à servir;
f) un mode complet de préparation et d’emploi, ainsi que les indications nécessaires à sa conservation après l’ouverture du contenant et
g) la date limite de son utilisation.
- DORS/78-64, art. 7
- DORS/88-559, art 27
- DORS/2022-197, art. 6
Substituts de repas, suppléments nutritifs, repas préemballés et aliments vendus par les cliniques d’amaigrissement
B.24.200 (1) Il est interdit de vendre ou d’annoncer un substitut de repas à moins que, dans son état prêt à servir ou une fois préparé, selon le mode d’emploi, avec de l’eau, du lait, du lait partiellement écrémé, du lait écrémé ou une combinaison de ces produits, il ne réponde aux exigences suivantes :
a) il procure au moins 225 Kcal ou 945 kJ par portion;
b) au moins 15 pour cent et au plus 40 pour cent de l’énergie utilisable provient de sa teneur en protéines, sauf dans le cas d’un substitut de repas pour régimes amaigrissants, où au moins 20 pour cent de l’énergie utilisable provient de sa teneur en protéines;
c) sous réserve du paragraphe (2), au plus 35 pour cent de l’énergie utilisable provient de sa teneur en lipides;
d) au moins 3,0 pour cent de l’énergie utilisable provient de l’acide linoléique sous forme de glycéride et au moins 0,5 pour cent de l’énergie utilisable provient de l’acide linolénique n-3 sous forme de glycéride, et le rapport entre l’acide linoléique et l’acide linolénique n-3 est d’au moins 4 à 1 et d’au plus 10 à 1;
e) les protéines qu’il contient sont :
(i) soit d’une qualité nutritive équivalente à celle de la caséine,
(ii) soit de qualité nutritive et en quantité suffisantes pour donner un résultat d’au moins 15 pour cent, ou d’au moins 20 pour cent dans le cas d’un substitut de repas pour régimes amaigrissants, lorsque la qualité nutritive de ces protéines est divisée par la qualité nutritive de la caséine et ensuite multipliée par le pourcentage de l’énergie utilisable provenant de la teneur en protéines;
f) toute portion de celui-ci contient chacune des vitamines et chacun des minéraux nutritifs énumérés dans la colonne I du tableau du présent article, en une quantité :
(i) sous réserve du paragraphe (3), non inférieure à la quantité minimale indiquée à la colonne II,
(ii) sous réserve des paragraphes (4) et (5), non supérieure, compte tenu du surtitrage, à la quantité maximale indiquée à la colonne III.
(2) Il est interdit de vendre ou d’annoncer un substitut de repas présenté comme étant le substitut de tous les repas de la journée, à moins que, dans son état prêt à servir ou une fois préparé, selon le mode d’emploi, avec de l’eau, du lait, du lait partiellement écrémé, du lait écrémé ou une combinaison de ces produits, il ne réponde aux exigences suivantes :
a) au plus 30 pour cent de l’énergie utilisable provient de sa teneur en lipides;
b) au plus 10 pour cent de l’énergie utilisable provient de sa teneur en acides gras saturés.
(3) Le substitut de repas qui n’est pas présenté comme étant le substitut de tous les repas de la journée est soustrait à l’application du sous-alinéa (1)f)(i) quant à la quantité minimale de sélénium, de chrome ou de molybdène, s’il ne contient aucune quantité ajoutée de ce minéral nutritif.
(4) Il est fait abstraction, pour l’application du sous-alinéa (1)f)(ii), des vitamines et des minéraux nutritifs qui ne sont pas des ingrédients ajoutés dans le substitut de repas.
(5) La quantité maximale de vitamine C indiquée à la colonne III du tableau du présent article n’inclut pas le surtitrage.
TABLEAU
Colonne I Colonne II Colonne III Éléments nutritifs Quantité minimale par portion Quantité maximale par portion VITAMINES Vitamine A 250 ER 630 ER Vitamine D 1,25 µg 2,50 µg Vitamine E 2,5 mg 5,0 mg Vitamine C 10 mg 20 mg Thiamine 300 µg 750 µg Riboflavine 400 µg 800 µg Niacine 6 EN 12 EN Vitamine B6 400 µg 750 µg Vitamine B12 0,25 µg 0,75 µg Folacine 60 µg 120 µg Acide pantothénique 1,25 mg 2,50 mg Biotine 25 µg 75 µg MINÉRAUX NUTRITIFS Calcium 200 mg 400 mg Phosphore 250 mg 500 mg Fer 2,5 mg 5,0 mg Iode 40 µg 120 µg Magnésium 60 mg 120 mg Cuivre 0,5 mg 1,0 mg Zinc 3 mg 6 mg Potassium 375 mg Sodium 250 mg Manganèse 1 mg 2 mg Sélénium 10 µg 20 µg Chrome 10 µg 20 µg Molybdène 20 µg 40 µg
- DORS/78-698, art. 9
- DORS/80-13, art. 14
- DORS/95-474, art. 5
B.24.201 (1) Il est interdit de vendre ou d’annoncer un supplément nutritif qui contient moins de 225 Kcal ou 945 kJ par portion, à moins qu’il ne réponde aux exigences suivantes :
a) il contient au moins 150 Kcal ou 630 kJ par portion;
b) au moins 15 pour cent et au plus 40 pour cent de l’énergie utilisable provient de sa teneur en protéines;
c) les protéines qu’il contient sont :
(i) soit d’une qualité nutritive équivalente à celle de la caséine,
(ii) soit de qualité nutritive et en quantité suffisantes pour donner un résultat d’au moins 15 pour cent lorsque la qualité nutritive de ces protéines est divisée par la qualité nutritive de la caséine et ensuite multipliée par le pourcentage de l’énergie utilisable provenant de sa teneur en protéines;
d) il contient, par 100 Kcal ou 420 kJ, chacune des vitamines et chacun des minéraux nutritifs énumérés dans la colonne I du tableau du présent article, en une quantité :
(i) sous réserve du paragraphe (3), non inférieure à la quantité minimale indiquée à la colonne II,
(ii) sous réserve des paragraphes (4) et (5), non supérieure, compte tenu du surtitrage, à la quantité maximale indiquée à la colonne III.
(2) Il est interdit de vendre ou d’annoncer un supplément nutritif qui procure 225 Kcal ou 945 kJ ou plus par portion, à moins que, dans son état prêt à servir ou une fois préparé, selon le mode d’emploi, avec de l’eau, du lait, du lait partiellement écrémé, du lait écrémé ou une combinaison de ces produits, il ne réponde aux exigences suivantes :
a) il procure au moins 225 Kcal ou 945 kJ par portion;
b) au plus 35 pour cent de l’énergie utilisable provient de sa teneur en lipides;
c) au moins 3,0 pour cent de l’énergie utilisable provient de l’acide linoléique sous forme de glycéride et au moins 0,5 pour cent de l’énergie utilisable provient de l’acide linolénique n-3 sous forme de glycéride, et le rapport entre l’acide linoléique et l’acide linolénique n-3 est d’au moins 4 à 1 et d’au plus 10 à 1;
d) au moins 15 pour cent et au plus 40 pour cent de l’énergie utilisable provient de sa teneur en protéines;
e) les protéines qu’il contient sont :
(i) soit d’une qualité nutritive équivalente à celle de la caséine,
(ii) soit de qualité nutritive et en quantité suffisantes pour donner un résultat d’au moins 15 pour cent lorsque la qualité nutritive de ces protéines est divisée par la qualité nutritive de la caséine et ensuite multipliée par le pourcentage de l’énergie utilisable provenant de sa teneur en protéines;
f) il contient, par 100 Kcal ou 420 kJ, chacune des vitamines et chacun des minéraux nutritifs énumérés dans la colonne I du tableau du présent article, en une quantité :
(i) sous réserve du paragraphe (3), non inférieure à la quantité minimale indiquée à la colonne II,
(ii) sous réserve des paragraphes (4) et (5), non supérieure, compte tenu du surtitrage, à la quantité maximale indiquée à la colonne III.
(3) Est soustrait à l’application des sous-alinéas (1)d)(i) et (2)f)(i) quant à la quantité minimale de sélénium, de chrome ou de molybdène, le supplément nutritif qui ne contient aucune quantité ajoutée de ce minéral nutritif.
(4) Il est fait abstraction, pour l’application des sous-alinéas (1)d)(ii) et (2)f)(ii), des vitamines et des minéraux nutritifs qui ne sont pas des ingrédients ajoutés dans le supplément nutritif.
(5) La quantité maximale de vitamine C indiquée à la colonne III du tableau du présent article n’inclut pas le surtitrage.
TABLEAU
Colonne I Colonne II Colonne III Éléments nutritifs Quantité minimale par 100 Kcal ou 420 kJ utilisables Quantité maximale par 100 Kcal ou 420 kJ utilisables VITAMINES Vitamine A 100 ER 250 ER Vitamine D 0,25 µg 1 µg Vitamine E 1,0 mg 2,0 mg Vitamine C 5 mg 10 mg Thiamine 140 µg 350 µg Riboflavine 180 µg 360 µg Niacine 3 EN 6 EN Vitamine B6 180 µg 350 µg Vitamine B12 0,1 µg 0,3 µg Folacine 30 µg 60 µg Acide pantothénique 0,6 mg 1,2 mg Biotine 12 µg 35 µg MINÉRAUX NUTRITIFS Calcium 100 mg 175 mg Phosphore 100 mg 175 mg Fer 1,0 mg 2,0 mg Iode 15 µg 45 µg Magnésium 20 mg 40 mg Cuivre 0,15 mg 0,30 mg Zinc 1,4 mg 2,0 mg Potassium 175 mg Manganèse 0,45 mg 0,90 mg Sélénium 4 µg 8 µg Chrome 4 µg 8 µg Molybdène 8 µg 15 µg
- DORS/78-698, art. 9
- DORS/95-474, art. 5
B.24.202 L’étiquette d’un substitut de repas ou d’un supplément nutritif doit porter :
a) les renseignements suivants, par portion indiquée et par quantité spécifiée de l’aliment lorsque celui-ci est préparé selon le mode d’emploi :
(i) la valeur énergétique de l’aliment, exprimée en Calories (Calories ou Cal) et en kilojoules (kilojoules ou kJ),
(ii) sa teneur en protéines, en matières grasses, en acide linoléique, en acide linolénique n-3, en acides gras saturés et en glucides, exprimée en grammes,
(iii) sa teneur en vitamine A, en vitamine D, en vitamine E, en vitamine C, en thiamine ou vitamine B1, en riboflavine ou vitamine B2, en niacine, en vitamine B6, en vitamine B12, en folate et en acide pantothénique ou pantothénate, exprimée de la façon suivante :
(A) dans le cas du substitut de repas, en pourcentage de la valeur quotidienne qui est indiquée à la colonne 4 de la partie 2 du Tableau des valeurs quotidiennes pour ces vitamines,
(B) dans le cas du supplément nutritif, en l’unité applicable indiquée au paragraphe D.01.003(1),
(iv) sa teneur en calcium, en phosphore, en fer, en iode, en magnésium et en zinc, exprimée de la façon suivante :
(A) dans le cas du substitut de repas, en pourcentage de la valeur quotidienne qui est indiquée à la colonne 4 de la partie 2 du Tableau des valeurs quotidiennes,
(B) dans le cas du supplément nutritif, en milligrammes pour le calcium, le phosphore, le fer, le magnésium et le zinc et en microgrammes pour l’iode,
(v) sa teneur en cuivre, en potassium, en sodium et en manganèse exprimée en milligrammes,
(vi) sa teneur en biotine, en sélénium, en chrome et en molybdène exprimée en microgrammes;
b) dans le cas du substitut de repas ou du supplément nutritif auquel il faut ajouter du lait, du lait partiellement écrémé ou du lait écrémé, une mention indiquant que la teneur nutritive de l’aliment a été établie compte tenu du lait, du lait partiellement écrémé ou du lait écrémé qui sera ajouté selon le mode d’emploi;
c) dans le cas du substitut de repas vendu ou annoncé comme étant le substitut de tous les repas de la journée dans un régime amaigrissant, le mode d’emploi qui assurera au consommateur un apport énergétique quotidien d’au moins 900 Kcal ou 3 780 kJ;
d) la date limite d’utilisation du substitut de repas ou du supplément nutritif;
e) dans le cas du substitut de repas pour régimes amaigrissants, la mention « UTILE POUR PERDRE DU POIDS SEULEMENT DANS LE CADRE D’UN RÉGIME À TENEUR RÉDUITE EN ÉNERGIE / USEFUL IN WEIGHT REDUCTION ONLY AS PART OF AN ENERGY-REDUCED DIET », inscrite bien en évidence dans l’espace principal de l’étiquette;
f) dans le cas du substitut de repas pour régimes amaigrissants qui n’est pas présenté comme étant le substitut de tous les repas de la journée, les renseignements requis à l’article B.24.204.
- DORS/78-698, art. 9
- DORS/88-559, art. 28
- DORS/95-474, art. 5
- DORS/2016-305, art. 59 et 75(F)
B.24.203 L’étiquette d’un repas préemballé pour régimes amaigrissants ou d’un aliment destiné à être vendu dans une clinique d’amaigrissement doit porter :
a) [Abrogé, DORS/2003-11, art. 24]
b) la mention « UTILE POUR PERDRE DU POIDS SEULEMENT DANS LE CADRE D’UN RÉGIME À TENEUR RÉDUITE EN ÉNERGIE / USEFUL IN WEIGHT REDUCTION ONLY AS PART OF AN ENERGY-REDUCED DIET », inscrite bien en évidence dans l’espace principal de l’étiquette;
c) les renseignements requis à l’article B.24.204.
- DORS/78-698, art. 9
- DORS/88-559, art. 29
- DORS/95-474, art. 5
- DORS/2003-11, art. 24
B.24.204 L’étiquette du repas préemballé ou du substitut de repas, autre que le substitut de repas présenté comme étant le substitut de tous les repas de la journée, qui sont emballés, vendus ou annoncés comme étant pour des régimes amaigrissants, ou l’étiquette d’un aliment destiné à être vendu dans une clinique d’amaigrissement, doit comprendre dans le mode d’emploi un menu type de sept jours dans lequel figure le repas préemballé, le substitut de repas ou l’aliment et qui répond aux exigences suivantes :
a) chaque repas quotidien comprend au moins une portion, selon la description qui en est donnée dans la publication intitulée Guide alimentaire canadien pour manger sainement, autorisée par le ministre de la Santé nationale et du Bien-être social et publiée en 1992 par le ministère des Approvisionnements et Services, d’un aliment de chacun des groupes suivants :
(i) lait, produits du lait ou leurs substituts,
(ii) viande et substituts de viande,
(iii) pain et produits céréaliers,
(iv) légumes et fruits;
b) l’apport énergétique quotidien n’est pas inférieur à 1 200 Kcal ou 5 040 kJ;
c) au plus 30 pour cent de l’apport énergétique quotidien total provient de sa teneur en lipides et au plus 10 pour cent de l’apport énergétique quotidien total provient de sa teneur en acides gras saturés;
d) l’apport quotidien moyen de chacun des éléments nutritifs énumérés dans la colonne I du tableau du présent article n’est pas inférieur à la quantité indiquée à la colonne II, dans le cas d’un menu recommandé pour les hommes, ou à celle indiquée à la colonne III, dans le cas d’un menu recommandé pour les femmes;
e) le menu ne mentionne aucun supplément de vitamines ou de minéraux nutritifs.
TABLEAU
| Colonne I | Colonne II | Colonne III |
|---|---|---|
| Éléments nutritifs | Ingestion quotidienne moyenne | |
| Hommes | Femmes | |
| Protéines | 65 g | 55 g |
| VITAMINES | ||
| Vitamine A | 1000 ER | 800 ER |
| Vitamine D | 5 µg | 5 µg |
| Vitamine E | 10 mg | 7 mg |
| Vitamine C | 40 mg | 30 mg |
| Thiamine | 1 mg | 1 mg |
| Riboflavine | 1 mg | 1 mg |
| Niacine | 14 EN | 14 EN |
| Vitamine B6 | 1,5 mg | 1,5 mg |
| Vitamine B12 | 1 µg | 1 µg |
| Folacine | 230 µg | 200 µg |
| Acide pantothénique | 5 mg | 5 mg |
| MINÉRAUX NUTRITIFS | ||
| Calcium | 800 mg | 800 mg |
| Phosphore | 1000 mg | 850 mg |
| Fer | 9 mg | 13 mg |
| Iode | 160 µg | 160 µg |
| Magnésium | 250 mg | 210 mg |
| Cuivre | 2 mg | 2 mg |
| Zinc | 12 mg | 9 mg |
- DORS/78-698, art. 9
- DORS/95-474, art. 5
B.24.205 (1) Il est interdit d’étiqueter, d’emballer, de vendre ou d’annoncer un repas préemballé ou un substitut de repas pour régimes amaigrissants ou un aliment destiné à être vendu dans une clinique d’amaigrissement, de manière à donner l’impression que la consommation d’un supplément de vitamines ou de minéraux nutritifs doit faire partie des régimes amaigrissants.
(2) Il est interdit de mentionner, directement ou indirectement, un supplément de vitamines ou de minéraux nutritifs sur l’étiquette ou dans la publicité d’un repas préemballé ou d’un substitut de repas pour régimes amaigrissants ou d’un aliment destiné à être vendu dans une clinique d’amaigrissement.
(3) Quiconque annonce un repas préemballé ou un substitut de repas pour régimes amaigrissants ou un aliment destiné à être vendu dans une clinique d’amaigrissement doit inclure dans la publicité la mention « UTILE POUR PERDRE DU POIDS SEULEMENT DANS LE CADRE D’UN RÉGIME À TENEUR RÉDUITE EN ÉNERGIE / USEFUL IN WEIGHT REDUCTION ONLY AS PART OF AN ENERGY-REDUCED DIET ».
- DORS/78-698, art. 9
- DORS/95-474, art. 5
Aliments présentés comme étant conçus pour régimes à très faible teneur en énergie
B.24.300 Il est interdit d’annoncer au grand public un aliment présenté comme étant conçu pour un régime à très faible teneur en énergie.
- DORS/94-35, art. 4
B.24.301 (1) Il est interdit de vendre un aliment présenté comme étant conçu pour un régime à très faible teneur en énergie sans ordre écrit du médecin.
(2) Malgré le paragraphe (1), un aliment présenté comme étant conçu pour un régime à très faible teneur en énergie peut être vendu, sans ordre écrit du médecin :
a) aux médecins;
b) aux grossistes en médicaments;
c) aux pharmaciens;
d) aux hôpitaux.
(3) Seuls les pharmaciens peuvent vendre au grand public un aliment présenté comme étant conçu pour un régime à très faible teneur en énergie.
- DORS/94-35, art. 4
B.24.302 Le pharmacien doit conserver pendant au moins deux ans après la date d’exécution l’ordre écrit d’un médecin visant un aliment présenté comme étant conçu pour un régime à très faible teneur en énergie.
- DORS/94-35, art. 4
B.24.303 (1) Un aliment présenté comme étant conçu pour un régime à très faible teneur en énergie, qu’il soit prêt à servir ou dilué avec de l’eau selon les indications du fabricant, doit, par ration quotidienne recommandée par le fabricant :
a) fournir :
(i) soit au moins 60 g de protéines d’une qualité nutritive équivalente à celle de la caséine,
(ii) soit des protéines en une quantité et d’une qualité telles que, lorsque cette qualité est exprimée en fraction de la qualité de la caséine :
(A) cette fraction ne soit pas inférieure à 85/100,
(B) le produit de la fraction par le poids en grammes de la protéine ne soit pas inférieur à 60;
b) renfermer les vitamines et les minéraux nutritifs mentionnés dans la colonne I du tableau du présent paragraphe, en une quantité au moins égale à la quantité minimale par jour indiquée à la colonne II;
c) contenir toute substance nutritive, sauf celles mentionnées aux alinéas a) et b), en une quantité suffisante pour l’usage préconisé de la substance dans l’aliment, selon des essais cliniques.
TABLEAU
Colonne I Colonne II Article Vitamines et minéraux nutritifs Quantité minimale par jour 1 Thiamine 1,3 mg 2 Riboflavine 1,6 mg 3 Niacine 23 mg 4 Folacine 0,22 mg 5 Biotine 0,15 mg 6 Acide pantothénique 7,0 mg 7 Vitamine B6 1,5 mg 8 Vitamine B12 0,001 mg 9 Vitamine A 1000 ER 10 Vitamine D 0,005 mg 11 Vitamine E 10 mg 12 Vitamine C 40 mg 13 Calcium 800 mg 14 Phosphore 1000 mg 15 Magnésium 250 mg 16 Fer 13 mg 17 Iode 0,16 mg 18 Zinc 12 mg 19 Cuivre 2 mg 20 Manganèse 3,5 mg 21 Sélénium 0,07 mg 22 Chrome 0,05 mg 23 Molybdène 0,1 mg 24 Sodium 2000 mg 25 Potassium 3000 mg 26 Chlorure 1500 mg
(2) Malgré l’alinéa (1)a), tout aliment présenté comme étant conçu pour un régime à très faible teneur en énergie doit être accompagné d’un mode d’emploi qui, s’il est respecté, donnera un apport quotidien d’au moins 1,2 g de protéines par kilogramme de poids corporel cible.
- DORS/94-35, art. 4
B.24.304 L’étiquette d’un aliment présenté comme étant conçu pour un régime à très faible teneur en énergie doit porter les renseignements suivants :
a) une mention de la valeur énergétique de l’aliment exprimée en Calories (Calories ou Cal) et en kilojoules (kilojoules ou kJ) par 100 g ou par 100 mL de l’aliment sous sa forme commerciale et par unité de l’aliment prêt à servir;
b) une mention de la teneur de l’aliment en protéines, en matières grasses, en glucides et, s’il y a lieu, en fibres, exprimée en grammes par 100 g ou par 100 mL de l’aliment sous sa forme commerciale et par unité de l’aliment prêt à servir;
c) une mention de la teneur de l’aliment en vitamines et en minéraux nutritifs mentionnés au tableau du paragraphe B.24.303(1) exprimée en milligrammes ou, dans le cas de la vitamine A, en équivalents de rétinol (ER), par 100 g ou par 100 mL de l’aliment sous sa forme commerciale et par unité de l’aliment prêt à servir;
d) une mention de la teneur de l’aliment en toute autre substance nutritive qui y est ajoutée selon la quantité prévue à l’alinéa B.24.303(1)c), exprimée en milligrammes ou en grammes par 100 g ou par 100 mL de l’aliment sous sa forme commerciale et par unité de l’aliment prêt à servir;
e) la mention « À UTILISER SEULEMENT SOUS SURVEILLANCE MÉDICALE » apposée bien en vue sur l’espace principal;
f) le mode d’emploi de l’aliment, y compris :
(i) un énoncé justificatif de l’emploi de l’aliment,
(ii) les critères de sélection des personnes auxquelles prescrire l’aliment,
(iii) les instructions pour la consultation, l’évaluation du patient et son suivi,
(iv) une mention concernant les précautions et les contre-indications voulues;
g) le mode de préparation de l’aliment, ainsi que les indications pour sa conservation avant et après l’ouverture du contenant;
h) la date limite d’utilisation de l’aliment.
- DORS/94-35, art. 4
B.24.305 (1) Il est interdit de vendre ou d’annoncer en vue de la vente un aliment présenté comme étant conçu pour un régime à très faible teneur en énergie à moins que le fabricant n’ait donné au ministre, au moins 90 jours avant la vente ou l’annonce, un avis écrit de son intention de vendre l’aliment ou de l’annoncer en vue de la vente.
(2) L’avis visé au paragraphe (1) est signé par le fabricant et contient, à l’égard de l’aliment présenté comme conçu pour un régime à très faible teneur en énergie, les renseignements suivants :
a) le nom sous lequel l’aliment sera vendu ou annoncé pour la vente;
b) les nom et adresse du principal établissement du fabricant;
c) les nom et adresse de chaque établissement où l’aliment est fabriqué;
d) la liste des ingrédients de l’aliment et la quantité de chacun d’eux;
e) les caractéristiques relatives à la qualité nutritive, microbiologique et physique des ingrédients et de l’aliment;
f) le détail des techniques de contrôle de la qualité appliquées aux essais des ingrédients et de l’aliment;
g) le détail du procédé de fabrication et des techniques de contrôle de la qualité appliquées au cours de la fabrication;
h) les résultats des essais effectués pour déterminer la date limite d’utilisation de l’aliment;
i) les preuves invoquées pour établir que l’aliment répond aux besoins nutritifs, autres que les besoins énergétiques, des personnes à qui il est destiné, lorsqu’il est consommé suivant le mode d’emploi;
j) une description du type d’emballage qui sera utilisé;
k) le mode d’emploi;
l) le texte des étiquettes, y compris les notices d’accompagnement, qui seront utilisées avec l’aliment;
m) les nom et titre du signataire de l’avis et la date de la signature.
(3) Malgré le paragraphe (1), il est permis de vendre ou d’annoncer en vue de la vente un aliment présenté comme étant conçu pour un régime à très faible teneur en énergie si le ministre, après avoir été avisé par le fabricant conformément à ce paragraphe, informe celui-ci par écrit que l’avis satisfait aux exigences visées au paragraphe (2).
- DORS/94-35, art. 4
- DORS/2018-69, art. 27 et 29(F)
B.24.306 (1) Il est interdit de vendre ou d’annoncer en vue de la vente un aliment présenté comme étant conçu pour un régime à très faible teneur en énergie qui a subi un changement majeur, à moins que le fabricant n’ait donné au ministre, au moins 90 jours avant la vente ou l’annonce, un avis écrit de son intention de vendre cet aliment ou de l’annoncer en vue de la vente.
(2) L’avis visé au paragraphe (1) est signé par le fabricant et contient, à l’égard de l’aliment présenté comme étant conçu pour un régime à très faible teneur en énergie qui a subi un changement majeur, les renseignements suivants :
a) le nom sous lequel l’aliment sera vendu ou annoncé en vue de la vente;
b) les nom et adresse du principal établissement du fabricant;
c) la description du changement majeur;
d) les preuves invoquées pour établir que l’aliment répond aux besoins nutritifs, autres que les besoins énergétiques, des personnes à qui il est destiné, lorsqu’il est consommé suivant le mode d’emploi;
e) les preuves invoquées pour établir que le changement majeur n’a pas d’effet indésirable sur l’aliment ou son utilisation;
f) le texte des étiquettes, y compris les notices d’accompagnement, qui seront utilisées avec l’aliment;
g) les nom et titre du signataire de l’avis et la date de la signature.
(3) Malgré le paragraphe (1), il est permis de vendre ou d’annoncer en vue de la vente un aliment présenté comme étant conçu pour un régime à très faible teneur en énergie qui a subi un changement majeur si le ministre, après avoir été avisé par le fabricant conformément à ce paragraphe, a informé celui-ci par écrit que l’avis satisfait aux exigences visées au paragraphe (2).
- DORS/94-35, art. 4
- DORS/2018-69, art. 27 et 29(F)
TITRE 25
Définitions
B.25.001 Dans le présent titre,
- aliment pour bébés
aliment pour bébés Tout aliment étiqueté ou annoncé comme pouvant être consommé par des bébés; (infant food)
- bébé
bébé Individu de moins d’un an; (infant)
- changement majeur
changement majeur Relativement à un fortifiant pour lait humain ou à un succédané de lait humain, un changement d’ingrédient ou de la quantité d’un ingrédient, ou la modification du traitement ou de l’emballage du fortifiant pour lait humain ou du succédané de lait humain, qui pourrait, selon l’expérience du fabricant ou la théorie généralement admise, altérer les concentrations ou compromettre la disponibilité des éléments nutritifs du fortifiant pour lait humain ou du succédané de lait humain, ou l’innocuité microbiologique ou chimique de ceux-ci; (major change)
- date limite d’utilisation
date limite d’utilisation Relativement à un fortifiant pour lait humain ou à un succédané de lait humain, la date, à la fois :
a) après laquelle le fabricant recommande de ne pas le consommer,
b) jusqu’à laquelle il conserve la stabilité physique et microbiologique et la valeur nutritive indiquée sur son étiquette; (expiration date)
- fortifiant pour lait humain
fortifiant pour lait humain Aliment qui, à la fois :
a) comprend au moins une vitamine, un minéral nutritif ou un acide aminé ajouté,
b) est étiqueté ou annoncé comme devant être ajouté au lait humain pour en augmenter la valeur nutritive afin de satisfaire aux besoins alimentaires particuliers d’un bébé manifestant un état physique ou physiologique particulier en raison d’une maladie, d’un désordre ou d’un état physique anormal; (human milk fortifier)
- (nom d’un aliment) en purée ou tamisé
(nom d’un aliment) en purée ou tamisé désigne l’aliment nommé qui est composé de particules d’une grosseur généralement uniforme et qui n’exige ni n’encourage la mastication avant d’être avalé par des bébés; (strained (naming a food))
- (nom d’un aliment) pour enfants en bas âge
(nom d’un aliment) pour enfants en bas âge désigne l’aliment nommé qui contient normalement des particules d’une grosseur encourageant la mastication, mais qui peut être facilement avalé par des bébés sans être mastiqué; (junior (naming a food))
- succédané de lait humain
succédané de lait humain Tout aliment étiqueté ou annoncé comme pouvant être :
a) soit utilisé comme un remplacement partiel ou total du lait humain et destiné à être consommé par des bébés,
b) soit utilisé comme un ingrédient d’un aliment visé à l’alinéa a); (human milk substitute)
- succédané de lait humain nouveau
succédané de lait humain nouveau désigne un succédané de lait humain :
a) soit qui est fabriqué pour la première fois,
b) soit qui est vendu au Canada pour la première fois,
c) soit qu’une personne fabrique pour la première fois. (new human milk substitute)
- DORS/78-637, art. 5
- DORS/83-933, art. 1
- DORS/90-174, art. 1
- DORS/2021-57, art. 12
Aliments pour bébés
B.25.002 Est interdite la vente ou la publicité en vue de la vente d’un aliment pour bébés visé à la colonne I du tableau I du présent titre, si cet aliment contient plus que la quantité de sodium indiquée à la colonne II du tableau.
- DORS/83-933, art. 1
B.25.003 (1) Sous réserve du paragraphe (2), est interdite la vente des aliments pour bébés qui contiennent,
a) des fruits en purée,
b) des jus de fruit,
c) des boissons aux fruits, ou
d) des céréales
auxquels du chlorure de sodium a été ajouté.
(2) Le paragraphe (1) ne s’applique pas aux desserts en purée contenant un aliment visé aux alinéas (1)a) à d).
- DORS/83-933, art. 1
Fortifiants pour lait humain
B.25.010 Sous réserve de l’article B.25.013, il est interdit de vendre ou d’annoncer en vue de sa vente un fortifiant pour lait humain, à moins que le ministre n’ait informé le fabricant, au titre des alinéas B.25.012(1)a) ou (3)a), qu’il y est autorisé.
B.25.011 La demande d’autorisation de vendre ou d’annoncer en vue de sa vente un fortifiant pour lait humain est présentée par le fabricant et signée par celui-ci, ou par un individu autorisé à signer en son nom, et contient les renseignements suivants :
a) la marque et le nom du produit sous lesquels le fortifiant pour lait humain sera vendu ou annoncé en vue de sa vente;
b) le nom et l’adresse du fabricant;
c) les nom et adresse de chaque établissement où le fortifiant pour lait humain est fabriqué;
d) la liste des ingrédients du fortifiant pour lait humain et la quantité de chacun d’eux;
e) la justification scientifique de la formulation du fortifiant pour lait humain;
f) les caractéristiques relatives à la qualité nutritionnelle, microbiologique et physique du fortifiant pour lait humain et de ses ingrédients;
g) le détail des procédures de contrôle de la qualité appliquées à l’examen du fortifiant pour lait humain et de ses ingrédients;
h) le détail du procédé de fabrication et des procédures de contrôle de la qualité appliquées au cours de la fabrication du fortifiant pour lait humain;
i) les résultats des examens effectués pour déterminer la date limite d’utilisation du fortifiant pour lait humain;
j) les preuves établissant que le fortifiant pour lait humain a une valeur nutritive suffisante pour favoriser une croissance et un développement acceptables chez les bébés s’il est consommé conformément au mode d’emploi;
k) la description du type d’emballage qui sera utilisé pour le fortifiant pour lait humain;
l) le mode d’emploi du fortifiant pour lait humain;
m) le texte écrit des étiquettes, y compris les notices d’accompagnement, qui seront utilisées pour le fortifiant pour lait humain;
n) le nom et le titre du signataire de la demande d’autorisation et la date de la signature.
B.25.012 (1) Après avoir fait l’examen des renseignements fournis en application de l’article B.25.011 ainsi que de tout autre renseignement relatif à l’examen de la demande, le ministre informe le fabricant, par écrit, que la vente ou l’annonce en vue de la vente du fortifiant pour lait humain visé par cette demande, selon le cas :
a) est autorisée si, à la fois :
(i) la demande satisfait aux exigences prévues à l’article B.25.011,
(ii) les renseignements sont suffisants pour établir l’innocuité du fortifiant pour lait humain;
b) n’est pas autorisée dans tout autre cas.
(2) Si les conditions prévues à l’alinéa (1)a) ne sont pas remplies, le ministre peut demander au fabricant de fournir, par écrit, les renseignements supplémentaires qui sont nécessaires pour les remplir.
(3) Après avoir fait l’examen des renseignements supplémentaires fournis par le fabricant, le ministre informe ce dernier, par écrit, que la vente ou l’annonce en vue de la vente du fortifiant pour lait humain, selon le cas :
a) est autorisée, si les conditions prévues à l’alinéa (1)a) sont remplies;
b) n’est pas autorisée dans tout autre cas.
(4) Malgré les alinéas (1)a) et (3)a), le ministre n’autorise pas la vente ou l’annonce en vue de la vente de ce fortifiant pour lait humain s’il a des motifs raisonnables de croire que les renseignements fournis par le fabricant sont faux, trompeurs ou mensongers.
B.25.013 L’interdiction prévue à l’article B.25.010 ne s’applique pas à un fortifiant pour lait humain figurant sur la Liste des fortifiants pour lait humain vendus au Canada au 25 mars 2021 qui est publiée sur un site Web du gouvernement du Canada si, au plus tard le 30 avril 2022, les exigences ci-après sont remplies :
a) le fabricant du fortifiant pour lait humain fournit au ministre les renseignements ci-après :
(i) une attestation signée et datée par lui-même, ou un individu autorisé à signer en son nom, portant que le fortifiant pour lait humain n’a pas subi de changement majeur depuis la date indiquée sur la liste en lien avec ce fortifiant pour lait humain,
(ii) le texte écrit des étiquettes, y compris des notices d’accompagnement, qui devront être utilisées pour le fortifiant pour lait humain après le deuxième anniversaire de l’entrée en vigueur de l’article B.25.020.
b) le ministre informe le fabricant, au titre du paragraphe B.25.014(1) ou de l’alinéa B.25.014(3)a), qu’il est autorisé à continuer à vendre ou à annoncer en vue de la vente son fortifiant pour lait humain.
B.25.014 (1) Le ministre informe le fabricant, par écrit, qu’il est autorisé à continuer à vendre ou à annoncer en vue de la vente son fortifiant pour lait humain si, à la fois :
a) le fabricant a fourni les renseignements visés à l’alinéa B.25.013a) dans un délai suffisant pour permettre au ministre d’en faire l’examen avant le 30 avril 2022;
b) le texte écrit des étiquettes présenté en vertu du sous-alinéa B.25.013a)(ii) satisfait les exigences applicables du présent règlement.
(2) Si les renseignements fournis sont insuffisants pour remplir les conditions prévues au paragraphe (1), le ministre peut demander au fabricant de fournir, par écrit, les renseignements supplémentaires qui sont nécessaires pour les remplir.
(3) Après avoir fait l’examen des renseignements supplémentaires fournis par le fabricant, le ministre informe ce dernier, par écrit, selon le cas :
a) que celui-ci est autorisé à continuer à vendre ou à annoncer en vue de la vente son fortifiant pour lait humain si les conditions prévues au paragraphe (1) sont remplies;
b) que celui-ci n’est pas autorisé à continuer à vendre ou à annoncer en vue de la vente son fortifiant pour lait humain dans tout autre cas.
B.25.015 (1) Il est interdit de vendre ou d’annoncer en vue de sa vente un fortifiant pour lait humain qui a subi un changement majeur, à moins que les conditions ci-après ne soient remplies :
a) le fabricant du fortifiant pour lait humain présente au ministre une demande reflétant le changement majeur conformément au paragraphe (2);
b) le ministre informe le fabricant, au titre des alinéas B.25.016(1)a) ou (3)a), que la vente ou l’annonce en vue de la vente du fortifiant pour lait humain visé par cette demande est autorisée.
(2) La demande est signée par le fabricant, ou un individu autorisé à signer en son nom, et contient les renseignements suivants :
a) la marque et le nom du produit sous lesquels le fortifiant pour lait humain sera vendu ou annoncé en vue de sa vente;
b) le nom et l’adresse du fabricant;
c) la description et la justification du changement majeur apporté au fortifiant pour lait humain;
d) les preuves établissant que le fortifiant pour lait humain a une valeur nutritive suffisante pour favoriser une croissance et un développement acceptables chez les bébés s’il est consommé conformément au mode d’emploi;
e) les preuves établissant que le changement majeur n’a pas eu d’effet préjudiciable sur le fortifiant pour lait humain;
f) le texte écrit des étiquettes, y compris les notices d’accompagnement, qui seront utilisées pour le fortifiant pour lait humain;
g) le nom et le titre du signataire de la demande et la date de la signature.
B.25.016 (1) Après avoir fait l’examen des renseignements fournis en application du paragraphe B.25.015(2) ainsi que de tout autre renseignement relatif à l’examen de la demande, le ministre informe le fabricant, par écrit, que la vente ou l’annonce en vue de la vente du fortifiant pour lait humain visé par cette demande, selon le cas :
a) est autorisée si, à la fois :
(i) la demande satisfait aux exigences prévues au paragraphe B.25.015(2),
(ii) les renseignements sont suffisants pour établir l’innocuité du fortifiant pour lait humain;
b) n’est pas autorisée dans tout autre cas.
(2) Si les conditions prévues à l’alinéa (1)a) ne sont pas remplies, le ministre peut demander au fabricant de fournir, par écrit, les renseignements supplémentaires qui sont nécessaires pour les remplir.
(3) Après avoir fait l’examen des renseignements supplémentaires fournis par le fabricant, le ministre informe ce dernier, par écrit, que la vente ou l’annonce en vue de la vente du fortifiant pour lait humain, selon le cas :
a) est autorisée si les conditions prévues à l’alinéa (1)a) sont remplies;
b) n’est pas autorisée dans tout autre cas.
(4) Malgré les alinéas (1)a) et (3)a), le ministre n’autorise pas la vente ou l’annonce en vue de la vente de ce fortifiant pour lait humain s’il a des motifs raisonnables de croire que les renseignements fournis par le fabricant sont faux, trompeurs ou mensongers.
B.25.017 Le fabricant dont le nom figure sur la Liste des fortifiants pour lait humain vendus au Canada au 25 mars 2021 prévue à l’article B.25.013 n’est pas autorisé à présenter une demande prévue à l’alinéa B.25.015(1)a) concernant son fortifiant pour lait humain figurant sur cette liste à moins d’avoir été informé par le ministre :
a) soit, au titre des alinéas B.25.012(1)a) ou (3)a), que la vente ou l’annonce en vue de sa vente est autorisée;
b) soit, au titre du paragraphe B.25.014(1) ou de l’alinéa B.25.014(3)a), qu’il est autorisé à continuer à le vendre ou à l’annoncer en vue de sa vente.
B.25.018 (1) Si le ministre demande, par écrit, au fabricant du fortifiant pour lait humain de fournir des preuves concernant le fortifiant pour lait humain, le fabricant, s’il n’a pas fourni ces preuves dans le délai fixé par le ministre, doit cesser, après l’expiration de ce délai, de le vendre et de l’annoncer en vue de sa vente.
(2) Le délai ne peut être inférieur à vingt-quatre heures à compter du moment où la demande est faite à moins que le ministre n’ait des motifs raisonnables de croire qu’il y a un risque grave et imminent de préjudice à la santé humaine.
(3) Si le ministre conclut que les preuves présentées par le fabricant sont insuffisantes, il en informe le fabricant par écrit.
(4) Si le fabricant reçoit un avis portant que les preuves concernant le fortifiant pour lait humain sont insuffisantes, il doit en cesser la vente et l’annonce en vue de sa vente jusqu’à ce qu’il présente des preuves supplémentaires et que le ministre l’avise par écrit que ces preuves sont suffisantes.
(5) Pour l’application du présent article, preuves concernant le fortifiant pour lait humain désigne :
a) d’une part, des preuves établissant que le fortifiant pour lait humain a une valeur nutritive suffisante pour favoriser une croissance et un développement acceptables chez les bébés s’il est consommé conformément au mode d’emploi;
b) d’autre part, des résultats des examens effectués pour déterminer la date limite d’utilisation du fortifiant pour lait humain.
B.25.019 (1) Malgré le fait que le ministre ait informé le fabricant que la vente ou l’annonce en vue de la vente de son fortifiant pour lait humain est autorisée, celui-ci ne peut être vendu que dans les cas suivants :
a) il est vendu par le fabricant, selon le cas :
(i) à un hôpital,
(ii) à un individu si, à la fois :
(A) cet individu a reçu un ordre écrit pour un fortifiant pour lait humain d’un médecin, ou d’un infirmier praticien ou d’un diététiste qui est autorisé à l’écrire en vertu des lois d’une province,
(B) le fabricant a reçu une demande écrite d’un hôpital précisant le nom du produit et la quantité de fortifiant pour lait humain qui doit être fournie à cet individu;
b) il est vendu par un hôpital à un individu qui a reçu un ordre écrit pour un fortifiant pour lait humain soit d’un médecin, soit d’un infirmier praticien ou d’un diététiste qui est autorisé à l’écrire en vertu des lois de la province.
(2) Les définitions qui suivent s’appliquent au présent article.
- diététiste
diététiste Personne qui, d’une part, est inscrite à titre de diététiste et est autorisée à exercer cette profession en vertu des lois d’une province et, d’autre part, qui l’exerce en vertu de ces lois dans cette province; (dietitian)
- hôpital
hôpital S’entend au sens de l’article B.24.001; (hospital)
- infirmier praticien
infirmier praticien S’entend au sens de l’article 1 du Règlement sur les nouvelles catégories de praticiens; (nurse practitioner)
- médecin
médecin S’entend au sens de l’article B.24.001. (physician)
B.25.020 (1) L’étiquette extérieure d’un fortifiant pour lait humain porte les renseignements suivants :
a) une déclaration de la quantité, exprimée en grammes, de protéines, de matières grasses, de glucides disponibles et, s’il y a lieu, de fibres, pour une quantité de fortifiant pour lait humain spécifiée dans le mode d’emploi;
b) une déclaration de la valeur énergétique exprimée en Calories pour une quantité de fortifiant pour lait humain spécifiée dans le mode d’emploi;
c) une déclaration de la quantité, exprimée en milligrammes, en microgrammes ou en unités internationales, de toutes les vitamines, de tous les minéraux nutritifs et de tous les acides aminés figurant à l’article 6 du tableau de l’article D.03.002, dans la colonne II, qui sont contenus dans une quantité de fortifiant pour lait humain spécifiée dans le mode d’emploi;
d) une déclaration de la quantité, exprimée en grammes, en milligrammes, en microgrammes ou en unités internationales, de toute autre substance nutritive qui est contenue dans une quantité de fortifiant pour lait humain spécifiée dans le mode d’emploi;
e) les instructions pour la conservation du fortifiant pour lait humain avant et après l’ouverture de l’emballage;
f) le mode d’emploi du fortifiant pour lait humain, y compris les instructions pour la préparation, l’utilisation et la conservation du mélange du fortifiant pour lait humain et du lait humain;
g) une déclaration indiquant que le fortifiant pour lait humain doit être utilisé seulement sous surveillance médicale;
h) la date limite d’utilisation du fortifiant pour lait humain;
i) le numéro de lot du fortifiant pour lait humain.
(2) Si le fortifiant pour lait humain n’a pas d’étiquette extérieure :
a) son étiquette intérieure porte les renseignements exigés au paragraphe (1), sauf indication contraire à l’alinéa b);
b) malgré l’article A.01.016, les renseignements exigés aux alinéas (1)e) et f) peuvent figurer dans un dépliant apposé ou attaché au récipient qui est en contact direct avec le fortifiant pour lait humain.
(3) Si le fortifiant pour lait humain a une étiquette extérieure, son étiquette intérieure porte également les renseignements exigés aux alinéas (1)h) et i).
B.25.021 Est interdite, sur l’étiquette ou dans l’annonce d’un fortifiant pour lait humain, toute mention ou allégation relative à son contenu portant :
a) soit sur le pourcentage de la valeur quotidienne :
(i) de lipides,
(ii) d’acides gras saturés et d’acides gras trans,
(iii) de sodium,
(iv) de potassium,
(v) de sucres,
(vi) de fibres,
(vii) de cholestérol;
b) soit sur le nombre de Calories provenant :
(i) des lipides,
(ii) des acides gras saturés et des acides gras trans.
Succédanés de lait humain et aliments renfermant un succédané de lait humain
B.25.045 Le nom usuel d’un succédané de lait humain ou d’un succédané de lait humain nouveau est préparation pour nourrissons. (infant formula)
- DORS/90-174, art. 2
B.25.046 (1) Il est interdit de vendre ou d’annoncer pour la vente un succédané de lait humain nouveau, à moins que le fabricant n’ait donné au ministre, au moins 90 jours avant la vente ou l’annonce de cet aliment, un avis écrit de son intention de vendre ou d’annoncer pour la vente le succédané de lait humain nouveau.
(2) L’avis visé au paragraphe (1) est signé et contient les renseignements suivants :
a) le nom sous lequel le succédané de lait humain nouveau sera vendu ou annoncé pour la vente;
b) le nom et l’adresse du principal établissement du fabricant;
c) les nom et adresse de chaque établissement où le succédané de lait humain nouveau est fabriqué;
d) la liste des ingrédients du succédané de lait humain nouveau et de la quantité de chacun d’eux;
e) les caractéristiques relatives à la qualité nutritionnelle, microbiologique et physique des ingrédients et du succédané de lait humain nouveau;
f) le détail des techniques de contrôle de la qualité appliquées à l’examen des ingrédients et du succédané de lait humain nouveau;
g) le détail du procédé de fabrication et des techniques de contrôle de la qualité appliquées au cours de la fabrication du succédané de lait humain nouveau;
h) les résultats des examens effectués pour déterminer la date limite d’utilisation du succédané de lait humain nouveau;
i) les preuves établissant que le succédané de lait humain nouveau a une valeur nutritive suffisante pour favoriser une croissance et un développement acceptables chez les bébés s’il est consommé conformément au mode d’emploi;
j) une description du type d’emballage qui sera utilisé pour le succédané de lait humain nouveau;
k) le mode d’emploi du succédané de lait humain nouveau;
l) le texte écrit des étiquettes, y compris les notices d’accompagnement, qui seront utilisées pour le succédané de lait humain nouveau;
m) le nom et le titre du signataire de l’avis et la date de la signature.
(3) Nonobstant le paragraphe (1), il est permis de vendre ou d’annoncer pour la vente un succédané de lait humain nouveau si le fabricant en a avisé le ministre conformément au paragraphe (1) et que celui-ci l’a informé par écrit que l’avis est satisfaisant.
- DORS/90-174, art. 2
- DORS/2018-69, art. 27 et 30(F)
B.25.047 Les succédanés de lait humain nouveaux sont assujettis aux exigences des articles B.25.051 à B.25.059.
- DORS/90-174, art. 2
- DORS/2003-11, art. 25
B.25.048 (1) Il est interdit de vendre ou d’annoncer pour la vente un succédané de lait humain qui a fait l’objet d’un changement majeur, à moins que le fabricant n’ait donné au ministre, au moins 90 jours avant la vente ou l’annonce de cet aliment, un avis écrit de son intention de vendre ou d’annoncer pour la vente le succédané de lait humain.
(2) L’avis visé au paragraphe (1) est signé et contient les renseignements suivants :
a) le nom sous lequel le succédané de lait humain sera vendu ou annoncé pour la vente;
b) le nom et l’adresse du principal établissement du fabricant;
c) une description du changement majeur;
d) la preuve établissant que le succédané de lait humain a une valeur nutritive suffisante pour favoriser une croissance et un développement acceptables chez les bébés s’il est consommé conformément au mode d’emploi;
e) la preuve établissant que le changement majeur n’a pas eu d’effet préjudiciable sur le succédané de lait humain;
f) le texte écrit des étiquettes, y compris les notices d’accompagnement, qui seront utilisées pour le succédané de lait humain;
g) le nom et le titre du signataire de l’avis et la date de la signature.
(3) Nonobstant le paragraphe (1), il est permis de vendre ou d’annoncer pour la vente un succédané de lait humain qui a fait l’objet d’un changement majeur si le fabricant en a avisé le ministre conformément au paragraphe (1) et que celui-ci l’a informé par écrit que l’avis est satisfaisant.
- DORS/90-174, art. 2
- DORS/2018-69, art. 27 et 30(F)
B.25.050 [Abrogé, DORS/90-174, art. 2]
B.25.051 (1) Est interdite la vente ou la publicité en vue de la vente d’un succédané de lait humain, à moins que celui-ci, préparé selon le mode d’emploi, ne soit conforme aux dispositions du présent titre concernant les succédanés de lait humain.
(2) Est interdite la vente ou la publicité en vue de la vente d’un aliment présenté comme contenant un succédané de lait humain, à moins que la portion de succédané de lait humain contenue dans l’aliment ne respecte les exigences en matière de nutrition établies dans le présent titre pour les succédanés de lait humain.
- DORS/83-933, art. 1
B.25.052 (1) Est interdite la vente ou la publicité en vue de la vente d’un succédané de lait humain, à moins que celui-ci ne réponde aux besoins nutritionnels normaux ou particuliers des bébés et qu’il ne soit d’une consistance telle que, lorsqu’il est prêt à servir, il coule librement à travers la tétine d’un biberon.
(2) Est interdite la vente ou la publicité en vue de la vente d’un aliment présenté comme contenant un succédané de lait humain, à moins que la portion de succédané de lait humain contenue dans l’aliment ne réponde aux besoins nutritionnels normaux ou particuliers des bébés.
- DORS/78-637, art. 6
- DORS/82-768, art. 76
- DORS/83-933, art. 1
B.25.053 (1) Est interdite la vente ou la publicité en vue de la vente d’un succédané de lait humain qui, lorsqu’il est préparé selon le mode d’emploi, exige l’addition d’une substance nutritive autre que de l’eau, ou d’une source de glucides, ou des deux.
(2) Est interdite la vente ou la publicité en vue de la vente d’un aliment présenté comme contenant un succédané de lait humain qui exige, lorsqu’il est préparé selon le mode d’emploi, l’addition d’une substance nutritive autre que l’eau.
- DORS/78-637, art. 7
- DORS/83-933, art. 1
B.25.054 (1) Sauf les exceptions prévues dans le présent titre, est interdite la vente ou la publicité en vue de la vente d’un succédané de lait humain, à moins que celui-ci, préparé selon le mode d’emploi, ne contienne :
a) pour 100 kilocalories utilisables,
(i) au moins 3,3 et au plus 6 grammes de lipides,
(ii) au moins 500 milligrammes d’acide linoléique sous forme de glycéride,
(iii) au plus un kilocalorie provenant d’acides gras monoénoïques en C22,
(iv) au moins 1,8 et au plus 4 grammes de protéines,
(v) au moins 1,8 gramme de protéines d’une qualité nutritive équivalente à celle de la caséine, ou des protéines, y compris les protéines auxquelles des acides aminés sont ajoutés, en quantité et de qualité telles que, lorsque la qualité de la protéine est exprimée en fraction de celle de la caséine,
(A) la fraction n’est pas inférieure à 85/100, et
(B) le produit de la multiplication de la fraction par le poids en gramme de protéine n’est pas inférieur à 1,8,
(vi) nonobstant les articles D.01.010, D.01.011 et D.02.009, les vitamines et minéraux nutritifs visés à la colonne I du tableau II du présent titre, en quantité non inférieure à la quantité indiquée dans la colonne II du tableau et non supérieure à la quantité indiquée dans la colonne III du tableau, et
(vii) au moins 12 milligrammes de choline; et
b) les rapports suivants :
(i) au moins 0,6 unité internationale d’alphatocophérol par gramme d’acide linoléique,
(ii) au moins 1,2 gramme et au plus 2 grammes de calcium par gramme de phosphore, et
(iii) au moins 15 microgrammes de vitamine B6 par gramme de protéines.
(2) Est interdite la vente ou la publicité en vue de la vente d’un aliment présenté comme contenant un succédané de lait humain, à moins que la portion de succédané de lait humain contenue dans l’aliment ne respecte les dispositions du paragraphe (1).
- DORS/78-637, art. 7
- DORS/83-933, art. 1
B.25.055 (1) Le sous-alinéa B.25.054(1)a)(i) ne s’applique pas au succédané de lait humain présenté comme étant utilisable dans un régime à teneur modifiée en lipides.
(2) Le sous-alinéa B.25.054(1)a)(iv), à l’exception de la partie qui prescrit la quantité maximale de protéines, ainsi que le sous-alinéa B.25.054(1)a)(v) ne s’appliquent pas à un succédané de lait humain présenté comme étant destiné à un régime pauvre en (nom de l’acide aminé).
(3) La partie du sous-alinéa B.25.054(1)a)(vi) qui prescrit les quantités minimales de vitamine D, de calcium et de phosphore, ainsi que le sous-alinéa B.25.054(1)b)(ii), ne s’appliquent pas à un succédané de lait humain présenté comme étant destiné à un régime pauvre en (nom du minéral) ou en vitamine D, ou les deux.
- DORS/83-933, art. 1
B.25.056 Est interdite la vente d’un succédané de lait humain ou d’un aliment présenté comme contenant un succédané de lait humain
a) auquel on a ajouté une substance nutritive
(i) que l’on retrouve normalement dans le lait humain, et
(ii) qui n’est pas mentionnée à l’alinéa B.25.054(1)a),
sauf si la quantité de cette substance présente dans 100 kilocalories utilisables du succédané de lait humain ou dans la portion de succédané de lait humain contenue dans l’aliment, préparé selon le mode d’emploi, est égale à la quantité de ladite substance présente dans 100 kilocalories utilisables de lait humain; ou
b) auquel on a ajouté des acides aminés, sauf
(i) si ces acides aminés sont nécessaires pour améliorer la qualité de la fraction protéinique du succédané de lait humain ou de la portion de succédané de lait humain contenue dans l’aliment et n’excèdent pas la quantité requise pour cette amélioration, ou
(ii) si la fraction protéinique du succédané de lait humain ou de la portion de succédané de lait humain contenue dans l’aliment est constituée d’acides aminés isolés ou d’un hydrolysat de protéines ou les deux, et
si seulement des acides aminés de forme L ont été ajoutés.
- DORS/78-637, art. 8
- DORS/83-933, art. 1
B.25.057 (1) L’étiquette d’un succédané de lait humain doit comporter les renseignements suivants :
a) une déclaration de la teneur en protéines, en matières grasses, en glucides disponibles, en cendres et, s’il y a lieu, en fibres brutes :
(i) en grammes par 100 grammes ou en grammes par 100 millilitres de succédané de lait humain sous sa forme commerciale, et
(ii) en grammes pour une quantité spécifiée de succédané de lait humain, prêt à servir;
b) une déclaration de la valeur énergétique
(i) en calories par 100 grammes ou en calories par 100 millilitres de succédané de lait humain sous sa forme commerciale, et
(ii) en calories pour une quantité spécifiée de succédané de lait humain, prêt à servir;
c) une déclaration de la quantité de toutes les vitamines et de tous les minéraux nutritifs énumérés au tableau II du présent titre
(i) en unités internationales ou en milligrammes par 100 grammes, ou en unités internationales ou en milligrammes par 100 millilitres de succédané de lait humain sous sa forme commerciale, et
(ii) en unités internationales ou en milligrammes pour une quantité spécifiée de succédané de lait humain, prêt à servir;
d) une déclaration de la quantité de choline et de la quantité de toute substance nutritive ajoutée et normalement contenue dans le lait humain mais non visée à l’alinéa B.25.054(1)a),
(i) en milligrammes ou en grammes par 100 grammes, ou en milligrammes ou en grammes par 100 millilitres du succédané de lait humain sous sa forme commerciale, et
(ii) en milligrammes ou en grammes pour une quantité spécifiée de succédané de lait humain, prêt à servir;
e) les instructions appropriées pour la préparation, l’utilisation et la conservation du succédané de lait humain une fois le contenant ouvert; et
f) la date limite d’utilisation du succédané de lait humain.
(2) L’étiquette d’un aliment présenté comme contenant un succédané de lait humain doit fournir les renseignements suivants :
a) une déclaration, dans l’espace principal, de la proportion de succédané de lait humain contenue dans l’aliment sous sa forme commerciale, inscrite le plus près possible de toute déclaration concernant la présence d’un succédané de lait humain dans l’aliment, et d’une manière aussi évidente que cette déclaration;
b) dans la liste d’ingrédients du produit le nom usuel du succédané de lait humain, suivi d’une liste de tous les ingrédients contenus dans le succédané de lait humain;
c) une déclaration
(i) de la teneur en protéines, en matières grasses, en glucides disponibles, en cendres et, s’il y a lieu, en fibres brutes de la portion de succédané de lait humain que contient l’aliment, exprimée en grammes par 100 grammes ou par 100 millilitres de la portion de succédané de lait humain contenue dans l’aliment sous sa forme commerciale,
(ii) de la valeur énergétique de la portion de succédané de lait humain contenue dans l’aliment, exprimée en calories par 100 grammes ou en calories par 100 millilitres de la portion de succédané de lait humain contenue dans l’aliment sous sa forme commerciale,
(iii) de la quantité de toutes les vitamines et de tous les minéraux nutritifs indiqués au tableau II du présent titre et contenue dans la portion de succédané de lait humain que renferme l’aliment, exprimée en unités internationales ou en milligrammes par 100 grammes, ou en unités internationales ou en milligrammes par 100 millilitres de la portion de succédané de lait humain contenue dans l’aliment sous sa forme commerciales, et
(iv) de la quantité de choline et de la quantité de toute substance nutritive ajoutée et normalement contenue dans le lait humain mais non visée à l’alinéa B.25.054(1)a) contenues dans la portion de succédané de lait humain que renferme l’aliment, exprimées en milligrammes ou en grammes par 100 grammes, ou en milligrammes ou en grammes par 100 millilitres de la portion de succédané de lait humain contenue dans l’aliment sous sa forme commerciale;
d) une déclaration
(i) de la teneur en protéines, en matières grasses, en glucides disponibles, en cendres et, s’il y a lieu, en fibres brutes, exprimée en grammes par 100 grammes ou par 100 millilitres d’aliment sous sa forme commerciale et en grammes par quantité spécifiée de l’aliment prêt à servir,
(ii) de la valeur énergétique, exprimée en calories par 100 grammes ou en calories par 100 millilitres d’aliment sous sa forme commerciale et en grammes pour une quantité spécifiée de l’aliment prêt à servir,
(iii) de la quantité de toutes les vitamines et de tous les minéraux nutritifs indiqués au tableau II du présent titre, exprimée en unités internationales ou en milligrammes par 100 grammes, ou en unités internationales ou en milligrammes par 100 millilitres d’aliment sous sa forme commerciale, et en unités internationales ou en milligrammes pour une quantité spécifiée de l’aliment prêt à servir, et
(iv) de la quantité de choline et de la quantité de toute substance nutritive ajoutée et normalement contenue dans le lait humain mais non visée à l’alinéa B.25.054(1)a), exprimées en milligrammes ou en grammes par 100 grammes, ou en milligrammes ou en grammes par 100 millilitres d’aliment sous sa forme commerciale, et en milligrammes ou en grammes pour une quantité spécifiée de l’aliment prêt à servir;
e) les instructions appropriées pour la préparation, l’utilisation et la conservation de l’aliment une fois le contenant ouvert; et
f) la date limite d’utilisation de l’aliment.
- DORS/83-933, art. 1
- DORS/88-559, art. 30
B.25.058 Nonobstant l’article D.02.005, est interdite toute allégation relative à la teneur en fer d’un succédané de lait humain, sauf de la façon prescrite à l’alinéa B.25.057(1)c), à moins que le succédané de lait humain ne contienne au moins un milligramme de fer par 100 kilocalories utilisables.
- DORS/78-637, art. 9(F)
- DORS/83-933, art. 1
B.25.059 Est interdite, sur l’étiquette ou dans l’annonce d’un succédané de lait humain ou d’un aliment présenté comme contenant un succédané de lait humain, toute mention ou allégation relative à son contenu portant :
a) soit sur le pourcentage de la valeur quotidienne :
(i) de lipides,
(ii) d’acides gras saturés et d’acides gras trans,
(iii) de sodium,
(iv) de potassium,
(v) de sucres,
(vi) de fibres,
(vii) de cholestérol;
b) soit sur le nombre de Calories provenant :
(i) des lipides,
(ii) des acides gras saturés et des acides gras trans.
- DORS/2003-11, art. 26
- DORS/2016-305, art. 60
B.25.060 (1) Lorsque le ministre demande par écrit au fabricant de succédané de lait humain ou d’aliment présenté comme contenant ce succédané de fournir dans un délai précis des preuves concernant le succédané de lait humain, le fabricant, s’il n’a pas répondu à la demande dans le délai fixé, doit cesser, après l’expiration du délai, de vendre ce succédané ou cet aliment.
(2) Si le ministre conclut que les preuves présentées par le fabricant en application du paragraphe (1) sont insuffisantes, il en avise le fabricant par écrit.
(3) Lorsque le fabricant reçoit, en application du paragraphe (2), un avis portant que les preuves concernant le succédané de lait humain sont insuffisantes, il doit cesser la vente de ce succédané de lait humain ou des aliments présentés comme contenant ce succédané de lait humain jusqu’à ce qu’il ait présenté des preuves supplémentaires et que le ministre l’ait avisé que ces preuves sont suffisantes.
(4) Pour l’application du présent article, preuves concernant le succédané de lait humain désigne :
a) d’une part, la preuve établissant que le succédané de lait humain a une valeur nutritive suffisante pour favoriser une croissance et un développement acceptables chez les bébés s’il est consommé conformément au mode d’emploi;
b) d’autre part, les résultats des examens effectués pour déterminer la date limite d’utilisation du succédané de lait humain.
- DORS/83-933, art. 1
- DORS/88-424, art. 2
- DORS/90-174, art. 3
- DORS/2018-69, art. 12 et 27
Règles additionnelles
- DORS/2021-57, art. 14
B.25.061 (1) Sous réserve du paragraphe (2), est interdite l’inscription, sur l’étiquette d’un aliment, de toute indication concernant la consommation de l’aliment par un bébé âgé de moins de six mois.
(2) Le paragraphe (1) ne s’applique pas aux fortifiants pour lait humain, aux succédanés de lait humain ou aux succédanés de lait humain nouveaux.
- DORS/83-933, art. 1
- DORS/90-174, art. 4
- DORS/2021-57, art. 15
B.25.062 (1) Sous réserve du paragraphe (2), est interdite la vente d’un aliment pour bébés si l’aliment contient un additif alimentaire.
(2) Le paragraphe (1) ne s’applique pas
a) aux produits de boulangerie étiquetés ou annoncés comme pouvant être consommés par des bébés;
b) aux aliments ci-après qui sont étiquetés ou annoncés comme pouvant être consommés par des bébés et qui contiennent de l’acide ascorbique :
(i) fruits en purée,
(ii) céréales contenant des bananes;
c) aux produits céréaliers pour bébés qui contiennent de la lécithine;
d) aux aliments qui sont étiquetés ou annoncés comme pouvant être consommés par des bébés et qui contiennent de l’acide citrique;
e) aux préparations pour nourrissons qui contiennent les additifs alimentaires figurant aux tableaux IV et X de l’article B.16.100 pour utilisation dans les préparations pour nourrissons;
f) aux préparations pour nourrissons qui contiennent des ingrédients fabriqués avec des additifs alimentaires figurant au tableau V de l’article B.16.100;
g) aux préparations pour nourrissons qui contiennent des produits de petit-lait concentré ou séché fabriqués avec du petit-lait liquide auquel de l’hexamétaphosphate de sodium a été ajouté;
h) aux produits céréaliers pour bébés qui contiennent de l’amylase conformément au tableau V de l’article B.16.100;
i) aux préparations pour nourrissons qui contiennent du palmitate d’ascorbyle ou des tocophérols;
j) aux préparations pour nourrissons qui contiennent des huiles dans lesquelles du palmitate d’ascorbyle ou des tocophérols ont été ajoutés.
- DORS/83-933, art. 1
- DORS/90-24, art. 4
- DORS/91-149, art. 6
- DORS/97-559, art. 1
- DORS/2010-40, art. 3
- DORS/2010-41, art. 8
- DORS/2010-94, art. 6
- DORS/2010-141, art. 3
- DORS/2012-105, art. 2
- DORS/2021-57, art. 16
TABLEAU I
Teneur en sodium des aliments pour bébés
Colonne I Colonne II Aliments Sodium total en grammes par 100 g de l’aliment 1 Desserts pour enfants en bas âge 
0,10 2 Viandes pour enfants en bas âge, repas de viande pour enfants en bas âge, repas pour enfants en bas âge, petits déjeuners pour enfants en bas âge 
0,25 3 Légumes pour enfants en bas âge, soupes pour enfants en bas âge 
0,20 4 Desserts en purée 
0,05 5 Viandes en purée, repas de viande en purée, repas en purée, petits déjeuners en purée 
0,15 6 Légumes en purée, soupes tamisées 
0,10 - DORS/78-637, art. 10
- DORS/83-933, art. 1
TABLEAU II
Article Colonne I Colonne II Colonne III Vitamine ou minéral nutritif Quantité minimale par 100 kilocalories utilisables Quantité maximale par 100 kilocalories utilisables B.1 Biotine 2 µg — F.1 Acide folique 4 µg — N.1 Niacine 250 µg — P.1 Acide d-pantothénique 300 µg — R.1 Riboflavine 60 µg — T.1 Thiamine 40 µg — T.2 Alpha-tocophérol 0,6 U.I — V.1 Vitamine A 250 U.I. 500 U.I. V.2 Vitamine B6 35 µg — V.3 Vitamine B12 0,15 µg — V.4 Vitamine C 8 mg — V.5 Vitamine D 40 U.I. 80 U.I. V.6 Vitamine K1 8 µg — C.1 Calcium 50 mg — C.2 Chlorure 55 mg 150 mg C.3 Cuivre 60 µg — L.1 Iode 5 µg — L.2 Fer 0,15 mg — M.1 Magnésium 6 mg — M.2 Manganèse 5 µg — P.2 Phosphore 25 mg — P.3 Potassium 80 mg 200 mg S.1 Sodium 20 mg 60 mg Z.1 Zinc 0,5 mg — - DORS/83-933, art. 1
- DORS/98-458, art. 7(F)
- DORS/2022-197, art. 7
TITRE 26Irradiation des aliments
Interprétation
- DORS/2017-16, art. 2(F)
B.26.001 Au présent titre, irradiation s’entend du traitement au moyen d’un rayonnement ionisant.
- DORS/89-175, art. 3
- DORS/2017-16, art. 3
Application
B.26.002 Le présent titre ne s’applique pas aux aliments exposés à un rayonnement ionisant émis par un instrument de mesure utilisé pour déterminer le poids, évaluer la quantité des solides en vrac ou mesurer la teneur en solides d’un liquide, ou à d’autres fins d’inspection.
- DORS/89-175, art. 3
Dispositions générales
B.26.003 (1) Sous réserve du paragraphe (2), il est interdit de vendre un aliment qui a été irradié.
(2) Il est permis de vendre un aliment qui a été irradié et qui est visé à la colonne 1 du tableau du présent titre si les exigences ci-après sont remplies :
a) le rayonnement ionisant est d’un type et d’une source mentionnés à la colonne 2 et a été fait pour atteindre le but de l’irradiation visé à la colonne 3;
b) le rayonnement ionisant absorbé par l’aliment est conforme aux doses prévues aux colonnes 4 et 5 ou, dans le cas où la colonne 4 ne prévoit aucune dose absorbée minimale, n’excède pas la dose absorbée maximale prévue à la colonne 5.
- DORS/89-175, art. 3
- DORS/2017-16, art. 4
Registres
B.26.004 (1) Le fabricant qui vend un aliment qui a été irradié doit conserver à son établissement, pendant au moins deux ans après la date d’irradiation, un registre contenant les renseignements suivants :
a) le nom de l’aliment irradié ainsi que la quantité et les numéros de lot de l’aliment;
b) le but de l’irradiation;
c) la date de l’irradiation;
d) la dose de rayonnement ionisant absorbée par l’aliment;
e) le type et la source du rayonnement ionisant;
f) une mention indiquant si l’aliment a déjà été irradié et, dans l’affirmative, les renseignements visés aux alinéas a) à e) à l’égard de cette irradiation précédente.
(2) Quiconque importe, pour la vente au Canada, un aliment qui a été irradié doit conserver à son établissement, pendant au moins deux ans après la date d’importation, le registre prévu au paragraphe (1).
- DORS/89-175, art. 3
- DORS/2017-16, art. 5
Modification du tableau
B.26.005 Toute demande visant la modification du tableau du présent titre ou l’adjonction d’un aliment à celui-ci doit être accompagnée d’une présentation au ministre contenant les renseignements suivants :
a) le but et le détail de l’irradiation proposée, notamment le type et la source du rayonnement ionisant, le nombre proposé de traitements et les doses minimale et maximale absorbées du rayonnement ionisant;
b) les données indiquant que la dose minimale du rayonnement ionisant proposé permettra d’atteindre le but visé par l’irradiation et que la dose maximale du rayonnement ionisant proposé n’excédera pas le niveau approprié à cette fin;
c) les renseignements sur la nature du dosimètre utilisé, la fréquence de la dosimétrie de l’aliment ainsi que des données relatives à la dosimétrie et aux fantômes utilisés afin de garantir que les relevés dosimétriques correspondent activement à la dose absorbée par l’aliment durant l’irradiation;
d) les données relatives aux effets, le cas échéant, dans les conditions envisagées, de l’irradiation et de tout autre traitement qui y est combiné sur la qualité nutritive de l’aliment, cru et prêt à servir;
e) les données établissant que les caractéristiques chimiques, physiques ou microbiologiques de l’aliment irradié n’ont pas été modifiées de façon à le rendre impropre à la consommation humaine;
f) si le ministre le demande, les données établissant que l’irradiation proposée est sans danger dans les conditions envisagées;
g) les conditions recommandées pour l’emmagasinage et l’expédition de l’aliment irradié, notamment la durée, la température ainsi que l’emballage, et une comparaison avec les conditions recommandées pour le même aliment non irradié;
h) le détail de tout autre traitement que l’aliment doit subir avant ou après l’irradiation proposée;
i) toute autre donnée exigée par le ministre qui établit que le consommateur ou l’acheteur de l’aliment irradié n’est pas déçu ou trompé quant à la nature, la valeur, la composition, les avantages et la sûreté de l’aliment irradié.
TABLEAU
| Article | Colonne 1 | Colonne 2 | Colonne 3 | Colonne 4 | Colonne 5 |
|---|---|---|---|---|---|
| Aliment | Type et source de rayonnement ionisant | But de l’irradiation | Dose absorbée minimale (kGy) | Dose absorbée maximale (kGy) | |
| 1 | Pommes de terre (Solanum tuberosum L.) | Rayons gamma provenant du cobalt 60 | Inhibition de la germination durant l’emmagasinage | 0,15 | |
| 2 | Oignons (Allium cepa) | Rayons gamma provenant du cobalt 60 | Inhibition de la germination durant l’emmagasinage | 0,15 | |
| 3 | Blé, farine, farine de blé entier (Triticum spp.) | Rayons gamma provenant du cobalt 60 | Prévention de l’infestation par des insectes dans l’aliment emmagasiné | 0,75 | |
| 4 | Épices entières ou moulues et assaisonnements déshydratés |
|
|
| |
|
|
| |||
|
|
| |||
| 5 | Boeuf haché cru frais |
|
|
|
|
|
|
|
| ||
|
|
|
| ||
| |||||
|
|
|
| ||
|
|
|
| ||
| 6 | Boeuf haché cru congelé |
|
|
|
|
|
|
|
| ||
|
|
|
| ||
| |||||
|
|
|
| ||
|
|
|
|
- DORS/89-175, art. 3
- DORS/98-458, art. 7(F)
- DORS/2017-16, art. 6 et 7
- DORS/2018-69, art. 27
TITRE 27Aliments peu acides emballés dans des récipients hermétiquement fermés
B.27.001 Les définitions qui suivent s’appliquent au présent titre.
- activité de l’eau
activité de l’eau Rapport de la pression de vapeur d’eau de l’aliment à la pression de vapeur de l’eau pure à la même température et à la même pression. (water activity)
- aliment peu acide
aliment peu acide Aliment, à l’exception des boissons alcooliques, dont l’un des constituants a un pH supérieur à 4,6 et une activité de l’eau supérieure à 0,85. (low-acid food)
- contenant d’expédition
contenant d’expédition Récipient, emballage ou enveloppe dans lequel les contenants d’aliments sont placés aux fins de transport. (shipping container)
- récipient hermétiquement fermé
récipient hermétiquement fermé Contenant conçu pour protéger son contenu contre les microorganismes, y compris les spores. (hermetically sealed container)
- réfrigéré
réfrigéré Le fait d’être soumis à une température de 4 °C ou moins sans qu’il y ait congélation. (refrigeration)
- stérilité commerciale
stérilité commerciale État de l’aliment qui a subi un traitement thermique, seul ou en combinaison avec d’autres procédés, pour le rendre exempt de toute forme viable de microorganismes, y compris les spores, susceptibles de se développer dans l’aliment aux températures auxquelles il est destiné à être normalement soumis durant la distribution et l’entreposage. (commercially sterile)
- DORS/89-309, art. 1
B.27.002 (1) Il est interdit de vendre un aliment peu acide emballé dans un récipient hermétiquement fermé à moins que cet aliment ne soit dans un état de stérilité commerciale.
(2) Le paragraphe (1) ne s’applique pas aux aliments peu acides emballés dans des récipients hermétiquement fermés lorsque, selon le cas :
a) ces aliments sont gardés réfrigérés et l’espace principal de l’étiquette du récipient et l’étiquette du contenant d’expédition portent la mention « Garder réfrigéré » et « Keep Refrigerated »;
b) ces aliments sont gardés congelés et l’espace principal de l’étiquette du récipient et l’étiquette du contenant d’expédition portent la mention « Garder congelé » et « Keep Frozen ».
(3) Le paragraphe (1) ne s’applique pas aux tomates et aux produits de tomates dont le pH est égal ou inférieur à 4,7 après le traitement thermique, qui sont emballés dans des récipients hermétiquement fermés.
- DORS/89-309, art. 1
- DORS/91-149, art. 7
- DORS/2018-108, art. 399
B.27.003 Il est interdit de vendre un aliment peu acide emballé dans un récipient hermétiquement fermé qui, selon le cas :
a) est bombé;
b) n’est pas bien fermé;
c) comporte d’autres défauts susceptibles de compromettre l’herméticité du récipient.
- DORS/89-309, art. 1
B.27.004 (1) Lorsque le ministre juge que la vente d’un aliment peu acide emballé dans un récipient hermétiquement fermé risque d’être en contravention avec les articles B.27.002 ou B.27.003, il peut, par avis écrit, demander au fabricant ou à l’importateur de l’aliment de lui présenter, au plus tard à la date précisée dans l’avis, la preuve que les procédés de fabrication, de transformation et d’emballage de l’aliment permettent d’atteindre et de maintenir la stérilité commerciale.
(2) Le fabricant ou l’importateur qui reçoit un avis émis en application du paragraphe (1) doit cesser la vente de l’aliment à compter de la date précisée dans l’avis jusqu’à ce qu’il ait présenté la preuve demandée.
(3) Si le ministre juge insuffisante la preuve présentée par le fabricant ou l’importateur en application du paragraphe (1), il lui envoie un avis à cet effet.
(4) Le fabricant ou l’importateur qui reçoit l’avis mentionné au paragraphe (3) doit cesser immédiatement la vente de l’aliment et ce, jusqu’à ce qu’il ait présenté une autre preuve et que le ministre l’ait avisé par écrit que cette preuve est suffisante.
- DORS/89-309, art. 1
- DORS/2018-69, art. 27
B.27.005 Il est interdit de vendre un aliment peu acide qui est dans un état de stérilité commerciale et qui est emballé dans un récipient hermétiquement fermé, à moins que les conditions suivantes ne soient réunies :
a) l’étiquette ou le récipient de l’aliment porte un code ou un numéro de lot qui indique de façon permanente et lisible :
(i) l’établissement dans lequel le produit a atteint la stérilité commerciale,
(ii) le jour, le mois et l’année où l’aliment a atteint la stérilité commerciale;
b) un inspecteur peut obtenir à l’établissement, ou de l’importateur s’il s’agit d’un aliment importé, la signification exacte de chaque élément du code ou du numéro de lot mentionné à l’alinéa a).
- DORS/89-309, art. 1
TITRE 28Aliments nouveaux
Définitions
B.28.001 Les définitions qui suivent s’appliquent au présent titre.
- aliment nouveau
aliment nouveau L’une des substances ou l’un des aliments ci-après, autre qu’un ingrédient supplémentaire ou un aliment supplémenté :
a) substance, y compris un micro-organisme, qui ne présente pas d’antécédents d’innocuité comme aliment;
b) aliment qui a été fabriqué, préparé, conservé ou emballé au moyen d’un procédé qui :
(i) n’a pas été appliqué auparavant à l’aliment,
(ii) fait subir à l’aliment un changement majeur;
c) aliment dérivé d’un végétal, d’un animal ou d’un micro-organisme qui, ayant été modifié génétiquement, selon le cas :
(i) présente des caractères qui n’avaient pas été observés auparavant,
(ii) ne présente plus des caractères qui avaient été observés auparavant,
(iii) présente un ou plusieurs caractères qui ne se trouvent plus dans les limites prévues pour ce végétal, cet animal ou ce micro-organisme. (novel food)
- changement majeur
changement majeur Changement apporté à un aliment à la suite duquel, selon l’expérience du fabricant ou la théorie généralement admise dans le domaine des sciences de la nutrition et de l’alimentation, les propriétés de celui-ci se situent en dehors des variations naturelles acceptables de l’aliment en ce qui a trait à l’un ou l’autre des éléments suivants :
a) la composition, la structure, la qualité nutritive ou les effets physiologiques généralement reconnus de l’aliment;
b) la manière dont l’aliment est métabolisé par le corps humain;
c) l’innocuité générale, microbiologique ou chimique de l’aliment. (major change)
- modifier génétiquement
modifier génétiquement Manipuler intentionnellement les caractères héréditaires d’un végétal, d’un animal ou d’un micro-organisme. (genetically modify)
- DORS/99-392, art. 1
- DORS/2022-169, art. 20
Avis avant la vente
B.28.002 (1) Il est interdit de vendre ou d’annoncer en vue de la vente un aliment nouveau à moins que le fabricant ou l’importateur :
a) n’ait donné au ministre un avis écrit de son intention de vendre l’aliment nouveau ou de l’annoncer en vue de la vente;
b) n’ait reçu du ministre l’avis visé à l’alinéa B.28.003(1)a) ou au paragraphe B.28.003(2), selon le cas.
(2) L’avis visé à l’alinéa (1)a) est signé par le fabricant ou l’importateur, ou une personne autorisée à signer en son nom, et contient les renseignements suivants :
a) le nom commun sous lequel l’aliment nouveau sera vendu;
b) les nom et adresse du principal établissement du fabricant et, si l’adresse est à l’étranger, les nom et adresse du principal établissement de l’importateur;
c) la description de l’aliment nouveau, accompagnée :
(i) des renseignements sur son élaboration,
(ii) des renseignements détaillés sur son mode de fabrication, de préparation, de conservation, d’emballage et d’emmagasinage,
(iii) de la description du changement majeur, le cas échéant,
(iv) des renseignements sur son utilisation proposée et son mode de préparation,
(v) le cas échéant, des renseignements sur l’historique de son utilisation comme aliment dans un pays autre que le Canada,
(vi) de renseignements permettant d’établir son innocuité;
d) des renseignements sur les niveaux de consommation estimatifs chez les consommateurs de l’aliment nouveau;
e) le texte des étiquettes qui seront utilisées avec l’aliment nouveau;
f) les nom et titre du signataire de l’avis et la date de la signature.
- DORS/99-392, art. 1
- DORS/2018-69, art. 27
B.28.003 (1) Dans les quarante-cinq jours suivant la réception de l’avis visé à l’alinéa B.28.002(1)a), le ministre examine les renseignements contenus dans l’avis et :
a) si les renseignements établissent l’innocuité de l’aliment nouveau, il avise par écrit le fabricant ou l’importateur que ces renseignements sont suffisants;
b) si d’autres renseignements sont nécessaires sur le plan scientifique afin d’évaluer l’innocuité de l’aliment nouveau, il demande par écrit au fabricant ou à l’importateur de les lui fournir.
(2) Dans les quatre-vingt-dix jours suivant la réception des renseignements additionnels visés à l’alinéa (1)b), le ministre les évalue et, s’ils établissent l’innocuité de l’aliment nouveau, il avise par écrit le fabricant ou l’importateur que ces renseignements sont suffisants.
- DORS/99-392, art. 1
- DORS/2018-69, art. 27
TITRE 29Aliments supplémentés
Définitions et interprétation
B.29.001 (1) Les définitions qui suivent s’appliquent au présent titre.
- lipides
lipides S’entend de tous les acides gras exprimés sous forme de triglycérides. (fat)
- Répertoire des modèles de TRAS
Répertoire des modèles de TRAS Le document intitulé Répertoire des modèles de tableaux des renseignements sur les aliments supplémentés, publié par le gouvernement du Canada sur son site Web, avec ses modifications successives. (Directory of SFFT Formats)
- Répertoire des spécifications sur l’identifiant des aliments supplémentés avec mise en garde
Répertoire des spécifications sur l’identifiant des aliments supplémentés avec mise en garde Le document intitulé Répertoire des spécifications sur l’identifiant des aliments supplémentés avec garde, publié par le gouvernement du Canada sur son site Web, avec ses modifications successives. (Directory of Supplemented Food Caution Identifier Specifications)
(2) Pour l’application du présent titre et sous réserve du paragraphe (3), la teneur en vitamines est déterminée conformément à l’article D.01.003.
(3) Pour l’application du présent titre, la teneur, en unités métriques, des vitamines ci-après est déterminée en fonction de leur teneur en l’aliment supplémenté et, le cas échéant, conformément à la colonne 5 de la Liste des ingrédients supplémentaires autorisés, et est exprimée selon l’unité applicable prévue à la colonne 3 de cette liste :
a) la bêta-carotène qui est une forme de vitamine A ou le rétinol, y compris ses dérivés, qui est une forme de vitamine A, ou les deux, si un de ceux-ci est un ingrédient supplémentaire;
b) la niacine qui est un ingrédient supplémentaire.
Étiquetage nutritionnel
Renseignements principaux
B.29.002 (1) Sauf disposition contraire du présent article et des articles B.29.003 à B.29.005, B.29.018 et B.29.019, l’étiquette de tout aliment supplémenté porte un tableau des renseignements sur les aliments supplémentés indiquant exclusivement les renseignements visés à la colonne 1 du tableau du présent article, exprimés au moyen de la nomenclature indiquée dans la colonne 2, de l’unité indiquée dans la colonne 3 et des règles d’écriture indiquées dans la colonne 4.
(2) Pour l’application du paragraphe (1), la portion indiquée qui est exprimée en unité métrique dans le tableau des renseignements sur les aliments supplémentés sert de fondement pour établir les renseignements relatifs à la valeur énergétique de l’aliment supplémenté et à la teneur en éléments nutritifs et en ingrédients supplémentaires qui figurent dans ce tableau.
(3) Sous réserve du paragraphe (8), le pourcentage de la valeur quotidienne d’une vitamine ou d’un minéral nutritif qui, aux termes du paragraphe (1), figure dans le tableau des renseignements sur les aliments supplémentés, est établi sur la base de la teneur, en poids, de l’aliment supplémenté en la vitamine ou le minéral nutritif, par portion indiquée, une fois la teneur arrondie selon les règles d’écriture applicables prévues à la colonne 4 du tableau du présent article.
(4) Si au moins six des renseignements relatifs à la valeur énergétique et aux éléments nutritifs visés à la colonne 1 des articles 2 à 5 et 7 à 15 du tableau du présent article peuvent être exprimés, conformément au présent article, par « 0 » dans le tableau des renseignements sur les aliments supplémentés, le tableau peut ne contenir que les renseignements suivants :
a) la portion indiquée;
b) la valeur énergétique;
c) la teneur en lipides;
d) la teneur en glucides;
e) la teneur en protéines;
f) la teneur en tout élément nutritif qui fait l’objet d’une déclaration sur l’étiquette de l’aliment supplémenté ou encore dans l’annonce faite par le fabricant de l’aliment ou sous ses ordres, si la déclaration indique expressément ou implicitement que l’aliment a des propriétés particulières liées à la nutrition ou à la santé, notamment une mention ou une allégation figurant à la colonne 4 du Tableau des mentions et des allégations autorisées concernant la teneur nutritive, à la colonne 1 du tableau suivant l’article B.01.603 ou aux articles B.01.311, D.01.006 ou D.02.004;
g) la teneur en tout polyalcool ajouté;
h) la teneur en tout ingrédient supplémentaire;
i) la teneur en toute vitamine ou tout minéral nutritif déclaré comme constituant d’un ingrédient — autre que la farine — de l’aliment supplémenté, ;
j) la teneur en tout élément nutritif visé à la colonne 1 de l’un ou l’autre des articles 4, 5, 7, 8, 10, 11 et 13 à 15 du tableau du présent article qui ne peut être exprimée par « 0 » au tableau des renseignements sur les aliments supplémentés;
k) la mention « Source négligeable de (désignation de tout élément nutritif omis du tableau des renseignements sur les aliments supplémentés conformément au présent paragraphe) » ou, si l’aliment supplémenté remplit la condition prévue au paragraphe B.29.010(3), la mention « Source négligeable d’autres éléments nutritifs »;
l) l’énoncé interprétatif du % de la valeur quotidienne;
m) l’énoncé interprétatif du sous-titre « Supplémenté en ».
(5) Le tableau des renseignements sur les aliments supplémentés d’un aliment supplémenté qui est un produit préemballé à portion individuelle peut ne contenir que les renseignements suivants :
a) la portion indiquée;
b) la valeur énergétique;
c) la teneur en lipides;
d) la teneur en glucides;
e) la teneur en protéines;
f) la teneur en tout élément nutritif qui fait l’objet d’une déclaration sur l’étiquette de l’aliment supplémenté ou encore dans l’annonce faite par le fabricant de l’aliment ou sous ses ordres, si la déclaration indique expressément ou implicitement que l’aliment a des propriétés particulières liées à la nutrition ou à la santé, notamment une mention ou une allégation figurant à la colonne 4 du Tableau des mentions et des allégations autorisées concernant la teneur nutritive, à la colonne 1 du tableau suivant l’article B.01.603 ou aux articles B.01.311, D.01.006 ou D.02.004;
g) la teneur en tout polyalcool ajouté;
h) la teneur en tout ingrédient supplémentaire;
i) les teneurs en acides gras saturés et en acides gras trans, ainsi que la somme des acides gras saturés et des acides gras trans, si l’une de ces teneurs ou cette somme ne peut être exprimée par « 0 » dans le tableau des renseignements sur les aliments supplémentés;
j) la teneur en tout élément nutritif visé à la colonne 1 des articles 8 ou 11 du tableau du présent article qui ne peut être exprimée par « 0 » au tableau des renseignements sur les aliments supplémentés;
k) l’énoncé interprétatif du % de la valeur quotidienne;
l) l’énoncé interprétatif du sous-titre « Supplémenté en ».
(6) Le paragraphe (1) ne s’applique pas aux aliments supplémentés qui sont destinés uniquement à être utilisés comme ingrédients dans la fabrication d’autres aliments supplémentés destinés à être vendus au consommateur au niveau du commerce de détail.
(7) Le tableau des renseignements sur les aliments supplémentés figurant sur l’étiquette d’un aliment supplémenté, s’il correspond à l’une des figures 6.5(B), 6.6(B), 6.5.1(B), 6.6.1(B), 7.3(B), 7.4(B), 7.3.1(B), 7.4.1(B), 17.2(F) et (A) ou 17.2.1(F) et (A) du Répertoire des modèles de TRAS, n’a à indiquer ni l’énoncé interprétatif du % de la valeur quotidienne ni l’énoncé interprétatif du sous-titre « Supplémenté en ».
(8) Sous réserve du paragraphe (10), lorsqu’une substance a été ajoutée à un aliment supplémenté à titre d’ingrédient supplémentaire, la teneur de l’ingrédient supplémentaire indiquée à l’article 18 du tableau du présent article comprend la teneur totale de l’aliment en la substance, sauf selon ce que prévoient les colonnes 3 ou 5 de la Liste des ingrédients supplémentaires autorisés.
(9) La teneur en un élément nutritif visé à la colonne 1 du tableau du présent article dont une quantité a été ajoutée à un aliment supplémenté à titre d’ingrédient supplémentaire ne peut être exprimée dans le tableau des renseignements sur les aliments supplémentés que selon ce que prévoit l’article 18 du tableau du présent article.
(10) Lorsqu’une substance — autre qu’un élément nutritif — a été ajoutée à un aliment supplémenté à titre d’ingrédient supplémentaire et qu’elle a un ou plusieurs composants pour lesquels la colonne 3 de la Liste des ingrédients supplémentaires autorisés prévoit des teneurs maximales, la teneur de chacun de ces composants qui figure dans le tableau des renseignements sur les aliments supplémentés comprend la teneur totale de l’aliment en le composant, sauf selon ce que prévoient les colonnes 3 ou 5 de cette liste.
TABLEAU
Renseignements principaux
Article Colonne 1 Colonne 2 Colonne 3 Colonne 4 Renseignements Nomenclature Unité Règles d’écriture 1 Portion indiquée « Portion (portion indiquée) », « pour (portion indiquée) » ou « par (portion indiquée) » La portion est exprimée :
a) s’agissant d’un aliment supplémenté qui est un produit préemballé à portion individuelle :
(i) par emballage,
(ii) en grammes ou en millilitres tel qu’il est prévu aux sous-alinéas B.01.002A(2)a)(i) et (ii);
b) s’agissant d’un aliment supplémenté qui est un produit préemballé à portions multiples, selon les unités ci-après indiquées à la colonne 3B du Tableau des quantités de référence :
(i) la mesure domestique applicable à l’aliment,
(ii) la mesure métrique applicable à l’aliment.
(1) La portion exprimée en unité métrique est arrondie :
a) lorsqu’elle est inférieure à 10 g ou 10 ml : au plus proche multiple de 0,1 g ou 0,1 ml;
b) lorsqu’elle est égale ou supérieure à 10 g ou 10 ml : au plus proche multiple de 1 g ou 1 ml.
(2) La portion exprimée en fraction est représentée par un numérateur et un dénominateur séparés d’une barre.
(3) La portion comprend le terme « assortis » lorsque le tableau des renseignements sur les aliments supplémentés d’un produit préemballé contenant un assortiment d’aliments supplémentés indique les renseignements qui correspondent à une valeur composée.
2 Valeur énergétique « Calories » ou « Calories totales » La valeur est exprimée en Calories par portion indiquée. La valeur est arrondie :
a) lorsqu’elle est inférieure à 5 Calories :
(i) si l’aliment supplémenté répond aux critères mentionnés à la colonne 2 de l’article 1 du Tableau des mentions et des allégations autorisées concernant la teneur nutritive en regard du sujet « sans énergie » visé à la colonne 1 : à 0 Calorie,
(ii) dans les autres cas : au plus proche multiple de 1 Calorie;
b) lorsqu’elle est égale ou supérieure à 5 Calories sans dépasser 50 Calories : au plus proche multiple de 5 Calories;
c) lorsqu’elle est supérieure à 50 Calories : au plus proche multiple de 10 Calories.
3 Teneur en lipides « Lipides » ou « Total des lipides » La teneur est exprimée :
a) en grammes par portion indiquée;
b) en pourcentage de la valeur quotidienne par portion indiquée.
(1) La teneur est arrondie :
a) lorsqu’elle est inférieure à 0,5 g :
(i) si l’aliment supplémenté répond aux critères mentionnés à la colonne 2 de l’article 11 du Tableau des mentions et des allégations autorisées concernant la teneur nutritive en regard du sujet « sans lipides » visé à la colonne 1 et si les teneurs en acides gras saturés et en acides gras trans sont exprimées par « 0 g » au tableau des renseignements sur les aliments supplémentés, ou sont omises de ce tableau conformément au paragraphe B.29.002(4), et qu’aucun autre acide gras n’est exprimé par une valeur supérieure à 0 g : à 0 g,
(ii) dans les autres cas : au plus proche multiple de 0,1 g;
b) lorsqu’elle est égale ou supérieure à 0,5 g sans dépasser 5 g : au plus proche multiple de 0,5 g;
c) lorsqu’elle est supérieure à 5 g : au plus proche multiple de 1 g.
(2) Le pourcentage est arrondi :
a) lorsque la teneur déclarée est « 0 g » : à 0 %;
b) dans les autres cas : au plus proche multiple de 1 %.
4 Teneur en acides gras saturés « Acides gras saturés », « Lipides saturés » ou « saturés » La teneur est exprimée en grammes par portion indiquée. La teneur est arrondie :
a) lorsqu’elle est inférieure à 0,5 g :
(i) si l’aliment supplémenté répond aux critères mentionnés à la colonne 2 de l’article 18 du Tableau des mentions et des allégations autorisées concernant la teneur nutritive en regard du sujet « sans acides gras saturés » visé à la colonne 1 : à 0 g,
(ii) dans les autres cas : au plus proche multiple de 0,1 g;
b) lorsqu’elle est égale ou supérieure à 0,5 g sans dépasser 5 g : au plus proche multiple de 0,5 g;
c) lorsqu’elle est supérieure à 5 g : au plus proche multiple de 1 g.
5 Teneur en acides gras trans « Acides gras trans », « Lipides trans » ou « trans » La teneur est exprimée en grammes par portion indiquée. La teneur est arrondie :
a) lorsqu’elle est inférieure à 0,5 g :
(i) si l’aliment supplémenté répond aux critères mentionnés à la colonne 2 de l’article 22 du Tableau des mentions et des allégations autorisées concernant la teneur nutritive en regard du sujet « sans acides gras trans » visé à la colonne 1 : à 0 g,
(ii) dans les autres cas : au plus proche multiple de 0,1 g;
b) lorsqu’elle est égale ou supérieure à 0,5 g sans dépasser 5 g : au plus proche multiple de 0,5 g;
c) lorsqu’elle est supérieure à 5 g : au plus proche multiple de 1 g.
6 Somme des acides gras saturés et des acides gras trans « Acides gras saturés + acides gras trans », « Lipides saturés + lipides trans » ou « saturés + trans » La somme est exprimée en pourcentage de la valeur quotidienne par portion indiquée. Le pourcentage est arrondi :
a) lorsque les teneurs en acides gras saturés et en acides gras trans déclarées sont « 0 g » : à 0 %;
b) dans les autres cas : au plus proche multiple de 1 %.
7 Teneur en cholestérol « Cholestérol » La teneur :
a) est exprimée en milligrammes par portion indiquée;
b) peut aussi être exprimée en pourcentage de la valeur quotidienne par portion indiquée.
(1) La teneur est arrondie :
a) si l’aliment supplémenté répond aux critères mentionnés à la colonne 2 de l’article 27 du Tableau des mentions et des allégations autorisées concernant la teneur nutritive en regard du sujet « sans cholestérol » visé à la colonne 1 : à 0 mg;
b) dans les autres cas : au plus proche multiple de 5 mg.
(2) Le pourcentage est arrondi :
a) lorsque la teneur déclarée est « 0 mg » : à 0 %;
b) dans les autres cas : au plus proche multiple de 1 %.
8 Teneur en sodium « Sodium » La teneur est exprimée :
a) en milligrammes par portion indiquée;
b) en pourcentage de la valeur quotidienne par portion indiquée.
(1) La teneur est arrondie :
a) lorsqu’elle est inférieure à 5 mg :
(i) si l’aliment supplémenté répond aux critères mentionnés à la colonne 2 de l’article 31 du Tableau des mentions et des allégations autorisées concernant la teneur nutritive en regard du sujet « sans sodium ou sans sel » visé à la colonne 1 : à 0 mg,
(ii) dans les autres cas : au plus proche multiple de 1 mg;
b) lorsqu’elle est égale ou supérieure à 5 mg sans dépasser 140 mg : au plus proche multiple de 5 mg;
c) lorsqu’elle est supérieure à 140 mg : au plus proche multiple de 10 mg.
(2) Le pourcentage est arrondi :
a) lorsque la teneur déclarée est « 0 mg » : à 0 %;
b) dans les autres cas : au plus proche multiple de 1 %.
9 Teneur en glucides « Glucides » ou « Total des glucides » La teneur est exprimée en grammes par portion indiquée. La teneur est arrondie :
a) lorsqu’elle est inférieure à 0,5 g : à 0 g;
b) lorsqu’elle est égale ou supérieure à 0,5 g : au plus proche multiple de 1 g.
10 Teneur en fibres « Fibres » ou « Fibres alimentaires » La teneur est exprimée :
a) en grammes par portion indiquée;
b) en pourcentage de la valeur quotidienne par portion indiquée.
(1) La teneur est arrondie :
a) lorsqu’elle est inférieure à 0,5 g : à 0 g;
b) lorsqu’elle est égale ou supérieure à 0,5 g : au plus proche multiple de 1 g.
(2) Le pourcentage est arrondi :
a) lorsque la teneur déclarée est « 0 g » : à 0 %;
b) dans les autres cas : au plus proche multiple de 1 %.
11 Teneur en sucres « Sucres » La teneur est exprimée :
a) en grammes par portion indiquée;
b) en pourcentage de la valeur quotidienne par portion indiquée.
(1) La teneur est arrondie :
a) lorsqu’elle est inférieure à 0,5 g : à 0 g;
b) lorsqu’elle est égale ou supérieure à 0,5 g : au plus proche multiple de 1 g.
(2) Le pourcentage est arrondi :
a) lorsque la teneur déclarée est « 0 g » : à 0 %;
b) dans les autres cas : au plus proche multiple de 1 %.
12 Teneur en protéines « Protéines » La teneur est exprimée en grammes par portion indiquée. La teneur est arrondie :
a) lorsqu’elle est inférieure à 0,5 g : au plus proche multiple de 0,1 g;
b) lorsqu’elle est égale ou supérieure à 0,5 g : au plus proche multiple de 1 g.
13 Teneur en potassium « Potassium » La teneur est exprimée :
a) en milligrammes par portion indiquée;
b) en pourcentage de la valeur quotidienne par portion indiquée.
(1) La teneur est arrondie :
a) lorsqu’elle est inférieure à 5 mg : à 0 mg;
b) lorsqu’elle est égale ou supérieure à 5 mg mais moins de 50 mg : au plus proche multiple de 10 mg;
c) lorsqu’elle est égale ou supérieure à 50 mg mais moins de 250 mg : au plus proche multiple de 25 mg;
d) lorsqu’elle est égale ou supérieure à 250 mg : au plus proche multiple de 50 mg.
(2) Le pourcentage est arrondi :
a) lorsque la teneur déclarée est « 0 mg » : à 0 %;
b) dans les autres cas : au plus proche multiple de 1 %.
14 Teneur en calcium « Calcium » La teneur est exprimée :
a) en milligrammes par portion indiquée;
b) en pourcentage de la valeur quotidienne par portion indiquée.
(1) La teneur est arrondie :
a) lorsqu’elle est inférieure à 5 mg : à 0 mg;
b) lorsqu’elle est égale ou supérieure à 5 mg mais moins de 50 mg : au plus proche multiple de 10 mg;
c) lorsqu’elle est égale ou supérieure à 50 mg mais moins de 250 mg : au plus proche multiple de 25 mg;
d) lorsqu’elle est égale ou supérieure à 250 mg : au plus proche multiple de 50 mg.
(2) Le pourcentage est arrondi :
a) lorsque la teneur déclarée est « 0 mg » : à 0 %;
b) dans les autres cas : au plus proche multiple de 1 %.
15 Teneur en fer « Fer » La teneur est exprimée :
a) en milligrammes par portion indiquée;
b) en pourcentage de la valeur quotidienne par portion indiquée.
(1) La teneur est arrondie :
a) lorsqu’elle est inférieure à 0,05 mg : à 0 mg;
b) lorsqu’elle est égale ou supérieure à 0,05 mg mais moins de 0,5 mg : au plus proche multiple de 0,1 mg;
c) lorsqu’elle est égale ou supérieure à 0,5 mg mais moins de 2,5 mg : au plus proche multiple de 0,25 mg;
d) lorsqu’elle est égale ou supérieure à 2,5 mg : au plus proche multiple de 0,5 mg.
(2) Le pourcentage est arrondi :
a) lorsque la teneur déclarée est « 0 mg » : à 0 %;
b) dans les autres cas : au plus proche multiple de 1 %.
16 Énoncé interprétatif du % de la valeur quotidienne « *5 % ou moins c’est peu, 15 % ou plus c’est beaucoup » [non-applicable] Le sous-titre « % valeur quotidienne » ou « % VQ » est suivi d’un astérisque qui signale l’énoncé interprétatif du % de la valeur quotidienne figurant dans le tableau des renseignements sur les aliments supplémentés. 17 Énoncé interprétatif du sous-titre « Supplémenté en » « † Comprend les quantités naturelles et supplémentées » [non-applicable] Le sous-titre « Supplémenté en » est suivi d’une croix qui signale l’énoncé interprétatif du sous-titre « Supplémenté en » figurant dans le tableau des renseignements sur les aliments supplémentés. 18 Teneur en ingrédient supplémentaire La nomenclature de l’ingrédient supplémentaire est décrite conformément à la colonne 1 de la Liste des ingrédients supplémentaires autorisés. La teneur est exprimée : a) selon l’unité applicable prévue à la colonne 3 de la Liste des ingrédients supplémentaires autorisés par portion indiquée;
b) s’il s’agit d’un élément nutritif ayant une valeur quotidienne, en pourcentage de la valeur quotidienne par portion indiquée.
(1) La teneur est arrondie au nombre entier le plus près et est exprimée de la manière visée à la colonne 3 et, le cas échéant, à la colonne 5, de la Liste des ingrédients supplémentaires autorisés.
(2) Sauf selon ce que prévoit la colonne 5 de la Liste des ingrédients supplémentaires autorisés, le pourcentage est arrondi :
a) lorsque la teneur déclarée selon l’unité applicable prévue à la colonne 3 de la Liste des ingrédients supplémentaires autorisés est « 0 » : à 0 %;
b) dans les autres cas : au plus proche multiple de 1 %.
Renseignements complémentaires
B.29.003 (1) Sous réserve du paragraphe (2), le tableau des renseignements sur les aliments supplémentés peut également indiquer les renseignements visés à la colonne 1 du tableau du présent article.
(2) Le présent article ne s’applique pas aux vitamines et aux minéraux nutritifs qui figurent dans le tableau des renseignements sur les aliments supplémentés conformément au paragraphe B.29.002(1) et dont toute partie a été ajoutée à un aliment supplémenté à titre d’ingrédient supplémentaire.
(3) Les renseignements visés à la colonne 1 du tableau du présent article qui sont présentés dans le tableau des renseignements sur les aliments supplémentés sont exprimés au moyen de la nomenclature indiquée dans la colonne 2, de l’unité indiquée dans la colonne 3 et des règles d’écriture indiquées dans la colonne 4.
(4) Pour l’application du paragraphe (3), la portion indiquée qui est exprimée en unité métrique dans le tableau des renseignements sur les aliments supplémentés sert de fondement pour établir les renseignements relatifs à la valeur énergétique de l’aliment supplémenté et à la teneur en éléments nutritifs qui figurent dans ce tableau.
(5) Le pourcentage de la valeur quotidienne d’une vitamine ou d’un minéral nutritif qui, aux termes du paragraphe (3), figure dans le tableau des renseignements sur les aliments supplémentés, est établi sur la base de la teneur, en poids, de l’aliment supplémenté en la vitamine ou en le minéral nutritif, par portion indiquée, une fois la teneur arrondie selon les règles d’écriture applicables prévues à la colonne 4 du tableau du présent article.
(6) Le tableau des renseignements sur les aliments supplémentés indique la teneur en acides gras polyinsaturés oméga-6, en polyinsaturés oméga-3 et en monoinsaturés dans l’un des cas suivants :
a) la teneur en un de ces groupes d’acides gras ou la teneur en acides gras polyinsaturés est indiquée dans le tableau ou sur l’étiquette de l’aliment supplémenté ou encore dans l’annonce d’un tel aliment faite par son fabricant ou sous ses ordres;
b) la teneur en un acide gras est indiquée sur l’étiquette de l’aliment supplémenté ou encore dans l’annonce d’un tel aliment faite par son fabricant ou sous ses ordres.
(7) Lorsqu’une déclaration expresse ou implicite incluant des renseignements visés à la colonne 1 du tableau du présent article est faite sur l’étiquette de l’aliment supplémenté ou encore dans l’annonce d’un tel aliment faite par son fabricant ou sous ses ordres, ces renseignements sont aussi indiqués dans le tableau des renseignements sur les aliments supplémentés.
(8) Le tableau des renseignements sur les aliments supplémentés indique la teneur en tout polyalcool ajouté.
(9) Le tableau des renseignements sur les aliments supplémentés indique la teneur en toute vitamine ou en tout minéral nutritif déclaré comme constituant d’un ingrédient autre que la farine.
(10) Si les renseignements visés à la colonne 1 du tableau du présent article paraissent dans le tableau des renseignements sur les aliments supplémentés, ils figurent :
a) soit en français et en anglais;
b) soit dans l’une de ces langues, si, conformément au paragraphe B.01.012(3), les renseignements devant être indiqués sur l’étiquette aux termes du présent règlement peuvent l’être uniquement dans la langue en cause et qu’ils y figurent dans celle-ci.
TABLEAU
Renseignements complémentaires
Article Colonne 1 Colonne 2 Colonne 3 Colonne 4 Renseignements Nomenclature Unité Règles d’écriture 1 Portions par emballage « Portions par contenant », « (nombre d’unités) par contenant », « Portions par emballage », « (nombre d’unités) par emballage », « portions par (type d’emballage) » ou « (nombre d’unités) par (type d’emballage) » La quantité est exprimée en nombre de portions. (1) La quantité est arrondie :
a) lorsqu’elle est inférieure à 2, au plus proche multiple de 1;
b) lorsqu’elle est égale ou supérieure à 2 sans dépasser 5 : au plus proche multiple de 0,5;
c) lorsqu’elle est supérieure à 5 : au plus proche multiple de 1.
(2) Si la quantité est arrondie, elle est précédée du mot « environ ».
(3) Si le poids du produit varie, la quantité peut être déclarée « variable ».
2 Valeur énergétique « kilojoules » ou « kJ » La valeur est exprimée en kilojoules par portion indiquée. La valeur est arrondie au plus proche multiple de 10 kilojoules. 3 Teneur en acides gras polyinsaturés « Acides gras polyinsaturés », « Lipides polyinsaturés » ou « polyinsaturés » La teneur est exprimée en grammes par portion indiquée. La teneur est arrondie :
a) lorsqu’elle est inférieure à 1 g : au plus proche multiple de 0,1 g;
b) lorsqu’elle est égale ou supérieure à 1 g sans dépasser 5 g : au plus proche multiple de 0,5 g;
c) lorsqu’elle est supérieure à 5 g : au plus proche multiple de 1 g.
4 Teneur en acides gras polyinsaturés oméga-6 (1) Si le tableau des renseignements sur les aliments supplémentés indique la teneur en acides gras polyinsaturés : « oméga-6 », « Acides gras polyinsaturés oméga-6 », « Lipides polyinsaturés oméga-6 » ou « polyinsaturés oméga-6 »
(2) Dans les autres cas : « Acides gras polyinsaturés oméga-6 », « Lipides polyinsaturés oméga-6 » ou « polyinsaturés oméga-6 »
La teneur est exprimée en grammes par portion indiquée. La teneur est arrondie :
a) lorsqu’elle est inférieure à 1 g : au plus proche multiple de 0,1 g;
b) lorsqu’elle est égale ou supérieure à 1 g sans dépasser 5 g : au plus proche multiple de 0,5 g;
c) lorsqu’elle est supérieure à 5 g : au plus proche multiple de 1 g.
5 Teneur en acides gras polyinsaturés oméga-3 (1) Si le tableau des renseignements sur les aliments supplémentés indique la teneur en acides gras polyinsaturés : « oméga-3 », « Acides gras polyinsaturés oméga-3 », « Lipides polyinsaturés oméga-3 » ou « polyinsaturés oméga-3 »
(2) Dans les autres cas : « Acides gras polyinsaturés oméga-3 », « Lipides polyinsaturés oméga-3 » ou « polyinsaturés oméga-3 »
La teneur est exprimée en grammes par portion indiquée. La teneur est arrondie :
a) lorsqu’elle est inférieure à 1 g : au plus proche multiple de 0,1 g;
b) lorsqu’elle est égale ou supérieure à 1 g sans dépasser 5 g : au plus proche multiple de 0,5 g;
c) lorsqu’elle est supérieure à 5 g : au plus proche multiple de 1 g.
6 Teneur en acides gras monoinsaturés « Acides gras monoinsaturés », « Lipides monoinsaturés » ou « monoinsaturés » La teneur est exprimée en grammes par portion indiquée. La teneur est arrondie :
a) lorsqu’elle est inférieure à 1 g : au plus proche multiple de 0,1 g;
b) lorsqu’elle est égale ou supérieure à 1 g, sans dépasser 5 g : au plus proche multiple de 0,5 g;
c) lorsqu’elle est supérieure à 5 g : au plus proche multiple de 1 g.
7 Teneur en fibres solubles « Fibres solubles » La teneur est exprimée en grammes par portion indiquée. La teneur est arrondie :
a) lorsqu’elle est inférieure à 0,5 g : à 0 g;
b) lorsqu’elle est égale ou supérieure à 0,5 g : au plus proche multiple de 1 g.
8 Teneur en fibres insolubles « Fibres insolubles » La teneur est exprimée en grammes par portion indiquée. La teneur est arrondie :
a) lorsqu’elle est inférieure à 0,5 g : à 0 g;
b) lorsqu’elle est égale ou supérieure à 0,5 g : au plus proche multiple de 1 g.
9 Teneur en polyalcools (1) Si l’aliment supplémenté ne contient qu’un polyalcool : « Polyalcool », « Polyol » ou « (Nom du polyalcool) »;
(2) Dans les autres cas : « Polyalcools » ou « Polyols »
La teneur est exprimée en grammes par portion indiquée. La teneur est arrondie :
a) lorsqu’elle est inférieure à 0,5 g : à 0 g;
b) lorsqu’elle est égale ou supérieure à 0,5 g : au plus proche multiple de 1 g.
10 Teneur en amidon « Amidon » La teneur est exprimée en grammes par portion indiquée. La teneur est arrondie :
a) lorsqu’elle est inférieure à 0,5 g : à 0 g;
b) lorsqu’elle est égale ou supérieure à 0,5 g : au plus proche multiple de 1 g.
11 Teneur en vitamine A « Vitamine A » ou « Vit A » La teneur est exprimée :
a) en microgrammes par portion indiquée;
b) en pourcentage de la valeur quotidienne par portion indiquée.
(1) La teneur est arrondie :
a) lorsqu’elle est inférieure à 5 µg : à 0 µg;
b) lorsqu’elle est égale ou supérieure à 5 µg mais moins de 50 µg : au plus proche multiple de 10 µg;
c) lorsqu’elle est égale ou supérieure à 50 µg mais moins de 250 µg : au plus proche multiple de 50 µg;
d) lorsqu’elle est égale ou supérieure à 250 µg : au plus proche multiple de 100 µg.
(2) Le pourcentage est arrondi :
a) lorsque la teneur déclarée est « 0 µg » : à 0 %;
b) dans les autres cas : au plus proche multiple de 1 %.
12 Teneur en vitamine C « Vitamine C » ou « Vit C » La teneur est exprimée :
a) en milligrammes par portion indiquée;
b) en pourcentage de la valeur quotidienne par portion indiquée.
(1) La teneur est arrondie :
a) lorsqu’elle est inférieure à 0,1 mg : à 0 mg;
b) lorsqu’elle est égale ou supérieure à 0,1 mg mais moins de 1 mg : au plus proche multiple de 0,2 mg;
c) lorsqu’elle est égale ou supérieure à 1 mg mais moins de 5 mg : au plus proche multiple de 0,5 mg;
d) lorsqu’elle est égale ou supérieure à 5 mg : au plus proche multiple de 1 mg.
(2) Le pourcentage est arrondi :
a) lorsque la teneur déclarée est « 0 mg » : à 0 %;
b) dans les autres cas : au plus proche multiple de 1 %.
13 Teneur en vitamine D « Vitamine D » ou « Vit D » La teneur est exprimée :
a) en microgrammes par portion indiquée;
b) en pourcentage de la valeur quotidienne par portion indiquée.
(1) La teneur est arrondie :
a) lorsqu’elle est inférieure à 0,1 µg : à 0 µg;
b) lorsqu’elle est égale ou supérieure à 0,1 µg mais moins de 1 µg : au plus proche multiple de 0,2 µg;
c) lorsqu’elle est égale ou supérieure à 1 µg mais moins de 5 µg : au plus proche multiple de 0,5 µg;
d) lorsqu’elle est égale ou supérieure à 5 µg : au plus proche multiple de 1 µg.
(2) Le pourcentage est arrondi :
a) lorsque la teneur déclarée est « 0 µg » : à 0 %;
b) dans les autres cas : au plus proche multiple de 1 %.
14 Teneur en vitamine E « Vitamine E » ou « Vit E » La teneur est exprimée :
a) en milligrammes par portion indiquée;
b) en pourcentage de la valeur quotidienne par portion indiquée.
(1) La teneur est arrondie :
a) lorsqu’elle est inférieure à 0,05 mg : à 0 mg;
b) lorsqu’elle est égale ou supérieure à 0,05 mg mais moins de 0,5 mg : au plus proche multiple de 0,1 mg;
c) lorsqu’elle est égale ou supérieure à 0,5 mg mais moins de 2,5 mg : au plus proche multiple de 0,25 mg;
d) lorsqu’elle est égale ou supérieure à 2,5 mg : au plus proche multiple de 0,5 mg.
(2) Le pourcentage est arrondi :
a) lorsque la teneur déclarée est « 0 mg » : à 0 %;
b) dans les autres cas : au plus proche multiple de 1 %.
15 Teneur en vitamine K « Vitamine K » ou « Vit K » La teneur est exprimée :
a) en microgrammes par portion indiquée;
b) en pourcentage de la valeur quotidienne par portion indiquée.
(1) La teneur est arrondie :
a) lorsqu’elle est inférieure à 0,05 µg : à 0 µg;
b) lorsqu’elle est égale ou supérieure à 0,05 µg mais moins de 0,5 µg : au plus proche multiple de 0,1 µg;
c) lorsqu’elle est égale ou supérieure à 0,5 µg mais moins de 2,5 µg : au plus proche multiple de 0,25 µg;
d) lorsqu’elle est égale ou supérieure à 2,5 µg : au plus proche multiple de 0,5 µg.
(2) Le pourcentage est arrondi :
a) lorsque la teneur déclarée est « 0 µg » : à 0 %;
b) dans les autres cas : au plus proche multiple de 1 %.
16 Teneur en thiamine « Thiamine », « Thiamine (vitamine B1) » ou « Thiamine (vit B1) » La teneur est exprimée :
a) en milligrammes par portion indiquée;
b) en pourcentage de la valeur quotidienne par portion indiquée.
(1) La teneur est arrondie :
a) lorsqu’elle est inférieure à 0,005 mg : à 0 mg;
b) lorsqu’elle est égale ou supérieure à 0,005 mg mais moins de 0,05 mg : au plus proche multiple de 0,01 mg;
c) lorsqu’elle est égale ou supérieure à 0,05 mg mais moins de 0,25 mg : au plus proche multiple de 0,025 mg;
d) lorsqu’elle est égale ou supérieure à 0,25 mg : au plus proche multiple de 0,05 mg.
(2) Le pourcentage est arrondi :
a) lorsque la teneur déclarée est « 0 mg » : à 0 %;
b) dans les autres cas : au plus proche multiple de 1 %.
17 Teneur en riboflavine « Riboflavine », « Riboflavine (vitamine B2) » ou « Riboflavine (vit B2) » La teneur est exprimée :
a) en milligrammes par portion indiquée;
b) en pourcentage de la valeur quotidienne par portion indiquée.
(1) La teneur est arrondie :
a) lorsqu’elle est inférieure à 0,005 mg : à 0 mg;
b) lorsqu’elle est égale ou supérieure à 0,005 mg mais moins de 0,05 mg : au plus proche multiple de 0,01 mg;
c) lorsqu’elle est égale ou supérieure à 0,05 mg mais moins de 0,25 mg : au plus proche multiple de 0,025 mg;
d) lorsqu’elle est égale ou supérieure à 0,25 mg : au plus proche multiple de 0,05 mg.
(2) Le pourcentage est arrondi :
a) lorsque la teneur déclarée est « 0 mg » : à 0 %;
b) dans les autres cas : au plus proche multiple de 1 %.
18 Teneur en niacine « Niacine » La teneur est exprimée :
a) en milligrammes par portion indiquée;
b) en pourcentage de la valeur quotidienne par portion indiquée.
(1) La teneur est arrondie :
a) lorsqu’elle est inférieure à 0,05 mg : à 0 mg;
b) lorsqu’elle est égale ou supérieure à 0,05 mg mais moins de 0,5 mg : au plus proche multiple de 0,1 mg;
c) lorsqu’elle est égale ou supérieure à 0,5 mg mais moins de 2,5 mg : au plus proche multiple de 0,25 mg;
d) lorsqu’elle est égale ou supérieure à 2,5 mg : au plus proche multiple de 0,5 mg.
(2) Le pourcentage est arrondi :
a) lorsque la teneur déclarée est « 0 mg » : à 0 %;
b) dans les autres cas : au plus proche multiple de 1 %.
19 Teneur en vitamine B6 « Vitamine B6 » ou « Vit B6 » La teneur est exprimée :
a) en milligrammes par portion indiquée;
b) en pourcentage de la valeur quotidienne par portion indiquée.
(1) La teneur est arrondie :
a) lorsqu’elle est inférieure à 0,005 mg : à 0 mg;
b) lorsqu’elle est égale ou supérieure à 0,005 mg mais moins de 0,05 mg : au plus proche multiple de 0,01 mg;
c) lorsqu’elle est égale ou supérieure à 0,05 mg mais moins de 0,25 mg : au plus proche multiple de 0,025 mg;
d) lorsqu’elle est égale ou supérieure à 0,25 mg : au plus proche multiple de 0,05 mg.
(2) Le pourcentage est arrondi :
a) lorsque la teneur déclarée est « 0 mg » : à 0 %;
b) dans les autres cas : au plus proche multiple de 1 %.
20 Teneur en folate « Folate » La teneur est exprimée :
a) en microgrammes d’équivalents de folate alimentaire (ÉFA) par portion indiquée;
b) en pourcentage de la valeur quotidienne par portion indiquée.
(1) La teneur est arrondie :
a) lorsqu’elle est inférieure à 1 µg ÉFA : à 0 µg ÉFA;
b) lorsqu’elle est égale ou supérieure à 1 µg ÉFA mais moins de 10 µg ÉFA : au plus proche multiple de 2 µg ÉFA;
c) lorsqu’elle est égale ou supérieure à 10 µg ÉFA mais moins de 50 µg ÉFA : au plus proche multiple de 5 µg ÉFA;
d) lorsqu’elle est égale ou supérieure à 50 µg ÉFA : au plus proche multiple de 10 µg ÉFA.
(2) Le pourcentage est arrondi :
a) lorsque la teneur déclarée est « 0 µg ÉFA » : à 0 %;
b) dans les autres cas : au plus proche multiple de 1 %.
21 Teneur en vitamine B12 « Vitamine B12 » ou « Vit B12 » La teneur est exprimée :
a) en microgrammes par portion indiquée;
b) en pourcentage de la valeur quotidienne par portion indiquée.
(1) La teneur est arrondie :
a) lorsqu’elle est inférieure à 0,005 µg : à 0 µg;
b) lorsqu’elle est égale ou supérieure à 0,005 µg mais moins de 0,05 µg : au plus proche multiple de 0,01 µg;
c) lorsqu’elle est égale ou supérieure à 0,05 µg mais moins de 0,25 µg : au plus proche multiple de 0,025 µg;
d) lorsqu’elle est égale ou supérieure à 0,25 µg : au plus proche multiple de 0,05 µg.
(2) Le pourcentage est arrondi :
a) lorsque la teneur déclarée est « 0 µg » : à 0 %;
b) dans les autres cas : au plus proche multiple de 1 %.
22 Teneur en biotine « Biotine » La teneur est exprimée :
a) en microgrammes par portion indiquée;
b) en pourcentage de la valeur quotidienne par portion indiquée.
(1) La teneur est arrondie :
a) lorsqu’elle est inférieure à 0,05 µg : à 0 µg;
b) lorsqu’elle est égale ou supérieure à 0,05 µg mais moins de 0,5 µg : au plus proche multiple de 0,1 µg;
c) lorsqu’elle est égale ou supérieure à 0,5 µg mais moins de 2,5 µg : au plus proche multiple de 0,25 µg;
d) lorsqu’elle est égale ou supérieure à 2,5 µg : au plus proche multiple de 0,5 µg.
(2) Le pourcentage est arrondi :
a) lorsque la teneur déclarée est « 0 µg » : à 0 %;
b) dans les autres cas : au plus proche multiple de 1 %.
23 Teneur en acide pantothénique « Acide pantothénique » ou « Pantothénate » La teneur est exprimée :
a) en milligrammes par portion indiquée;
b) en pourcentage de la valeur quotidienne par portion indiquée.
(1) La teneur est arrondie :
a) lorsqu’elle est inférieure à 0,01 mg : à 0 mg;
b) lorsqu’elle est égale ou supérieure à 0,01 mg mais moins de 0,1 mg : au plus proche multiple de 0,02 mg;
c) lorsqu’elle est égale ou supérieure à 0,1 mg mais moins de 0,5 mg : au plus proche multiple de 0,05 mg;
d) lorsqu’elle est égale ou supérieure à 0,5 mg : au plus proche multiple de 0,1 mg.
(2) Le pourcentage est arrondi :
a) lorsque la teneur déclarée est « 0 mg » : à 0 %;
b) dans les autres cas : au plus proche multiple de 1 %.
24 Teneur en choline « Choline » La teneur est exprimée :
a) en milligrammes par portion indiquée;
b) en pourcentage de la valeur quotidienne par portion indiquée.
(1) La teneur est arrondie :
a) lorsqu’elle est inférieure à 1 mg : à 0 mg;
b) lorsqu’elle est égale ou supérieure à 1 mg mais moins de 10 mg : au plus proche multiple de 2 mg;
c) lorsqu’elle est égale ou supérieure à 10 mg mais moins de 50 mg : au plus proche multiple de 5 mg;
d) lorsqu’elle est égale ou supérieure à 50 mg : au plus proche multiple de 10 mg.
(2) Le pourcentage est arrondi :
a) lorsque la teneur déclarée est « 0 mg » : à 0 %;
b) dans les autres cas : au plus proche multiple de 1 %.
25 Teneur en phosphore « Phosphore » La teneur est exprimée :
a) en milligrammes par portion indiquée;
b) en pourcentage de la valeur quotidienne par portion indiquée.
(1) La teneur est arrondie :
a) lorsqu’elle est inférieure à 5 mg : à 0 mg;
b) lorsqu’elle est égale ou supérieure à 5 mg mais moins de 50 mg : au plus proche multiple de 10 mg;
c) lorsqu’elle est égale ou supérieure à 50 mg mais moins de 250 mg : au plus proche multiple de 25 mg;
d) lorsqu’elle est égale ou supérieure à 250 mg : au plus proche multiple de 50 mg.
(2) Le pourcentage est arrondi :
a) lorsque la teneur déclarée est « 0 mg » : à 0 %;
b) dans les autres cas : au plus proche multiple de 1 %.
26 Teneur en iode « Iodure » ou « Iode » La teneur est exprimée :
a) en microgrammes par portion indiquée;
b) en pourcentage de la valeur quotidienne par portion indiquée.
(1) La teneur est arrondie :
a) lorsqu’elle est inférieure à 1 µg : à 0 µg;
b) lorsqu’elle est égale ou supérieure à 1 µg mais moins de 10 µg : au plus proche multiple de 2 µg;
c) lorsqu’elle est égale ou supérieure à 10 µg mais moins de 50 µg : au plus proche multiple de 5 µg;
d) lorsqu’elle est égale ou supérieure à 50 µg : au plus proche multiple de 10 µg.
(2) Le pourcentage est arrondi :
a) lorsque la teneur déclarée est « 0 µg » : à 0 %;
b) dans les autres cas : au plus proche multiple de 1 %.
27 Teneur en magnésium « Magnésium » La teneur est exprimée :
a) en milligrammes par portion indiquée;
b) en pourcentage de la valeur quotidienne par portion indiquée.
(1) La teneur est arrondie :
a) lorsqu’elle est inférieure à 1 mg : à 0 mg;
b) lorsqu’elle est égale ou supérieure à 1 mg mais moins de 10 mg : au plus proche multiple de 2 mg;
c) lorsqu’elle est égale ou supérieure à 10 mg mais moins de 50 mg : au plus proche multiple de 5 mg;
d) lorsqu’elle est égale ou supérieure à 50 mg : au plus proche multiple de 10 mg.
(2) Le pourcentage est arrondi :
a) lorsque la teneur déclarée est « 0 mg » : à 0 %;
b) dans les autres cas : au plus proche multiple de 1 %.
28 Teneur en zinc « Zinc » La teneur est exprimée :
a) en milligrammes par portion indiquée;
b) en pourcentage de la valeur quotidienne par portion indiquée.
(1) La teneur est arrondie :
a) lorsqu’elle est inférieure à 0,05 mg : à 0 mg;
b) lorsqu’elle est égale ou supérieure à 0,05 mg mais moins de 0,5 mg : au plus proche multiple de 0,1 mg;
c) lorsqu’elle est égale ou supérieure à 0,5 mg mais moins de 2,5 mg : au plus proche multiple de 0,25 mg;
d) lorsqu’elle est égale ou supérieure à 2,5 mg : au plus proche multiple de 0,5 mg.
(2) Le pourcentage est arrondi :
a) lorsque la teneur déclarée est « 0 mg » : à 0 %;
b) dans les autres cas : au plus proche multiple de 1 %.
29 Teneur en sélénium « Sélénium » La teneur est exprimée :
a) en microgrammes par portion indiquée;
b) en pourcentage de la valeur quotidienne par portion indiquée.
(1) La teneur est arrondie :
a) lorsqu’elle est inférieure à 0,1 µg : à 0 µg;
b) lorsqu’elle est égale ou supérieure à 0,1 µg mais moins de 1 µg : au plus proche multiple de 0,2 µg;
c) lorsqu’elle est égale ou supérieure à 1 µg mais moins de 5 µg : au plus proche multiple de 0,5 µg;
d) lorsqu’elle est égale ou supérieure à 5 µg : au plus proche multiple de 1 µg.
(2) Le pourcentage est arrondi :
a) lorsque la teneur déclarée est « 0 µg » : à 0 %;
b) dans les autres cas : au plus proche multiple de 1 %.
30 Teneur en cuivre « Cuivre » La teneur est exprimée :
a) en milligrammes par portion indiquée;
b) en pourcentage de la valeur quotidienne par portion indiquée.
(1) La teneur est arrondie :
a) lorsqu’elle est inférieure à 0,0015 mg : à 0 mg;
b) lorsqu’elle est égale ou supérieure à 0,0015 mg mais moins de 0,025 mg : au plus proche multiple de 0,002 mg;
c) lorsqu’elle est égale ou supérieure à 0,025 mg mais moins de 0,05 mg : au plus proche multiple de 0,005 mg;
d) lorsqu’elle est égale ou supérieure à 0,05 mg : au plus proche multiple de 0,01 mg.
(2) Le pourcentage est arrondi :
a) lorsque la teneur déclarée est « 0 mg » : à 0 %;
b) dans les autres cas : au plus proche multiple de 1 %.
31 Teneur en manganèse « Manganèse » La teneur est exprimée :
a) en milligrammes par portion indiquée;
b) en pourcentage de la valeur quotidienne par portion indiquée.
(1) La teneur est arrondie :
a) lorsqu’elle est inférieure à 0,005 mg : à 0 mg;
b) lorsqu’elle est égale ou supérieure à 0,005 mg mais moins de 0,05 mg : au plus proche multiple de 0,01 mg;
c) lorsqu’elle est égale ou supérieure à 0,05 mg mais moins de 0,25 mg : au plus proche multiple de 0,025 mg;
d) lorsqu’elle est égale ou supérieure à 0,25 mg : au plus proche multiple de 0,05 mg.
(2) Le pourcentage est arrondi :
a) lorsque la teneur déclarée est « 0 mg » : à 0 %;
b) dans les autres cas : au plus proche multiple de 1 %.
32 Teneur en chrome « Chrome » La teneur est exprimée :
a) en microgrammes par portion indiquée;
b) en pourcentage de la valeur quotidienne par portion indiquée.
(1) La teneur est arrondie :
a) lorsqu’elle est inférieure à 0,05 µg : à 0 µg;
b) lorsqu’elle est égale ou supérieure à 0,05 µg mais moins de 0,5 µg : au plus proche multiple de 0,1 µg;
c) lorsqu’elle est égale ou supérieure à 0,5 µg mais moins de 2,5 µg : au plus proche multiple de 0,25 µg;
d) lorsqu’elle est égale ou supérieure à 2,5 µg : au plus proche multiple de 0,5 µg.
(2) Le pourcentage est arrondi :
a) lorsque la teneur déclarée est « 0 µg » : à 0 %;
b) dans les autres cas : au plus proche multiple de 1 %.
33 Teneur en molybdène « Molybdène » La teneur est exprimée :
a) en microgrammes par portion indiquée;
b) en pourcentage de la valeur quotidienne par portion indiquée.
(1) La teneur est arrondie :
a) lorsqu’elle est inférieure à 0,05 µg : à 0 µg;
b) lorsqu’elle est égale ou supérieure à 0,05 µg mais moins de 0,5 µg : au plus proche multiple de 0,1 µg;
c) lorsqu’elle est égale ou supérieure à 0,5 µg mais moins de 2,5 µg : au plus proche multiple de 0,25 µg;
d) lorsqu’elle est égale ou supérieure à 2,5 µg : au plus proche multiple de 0,5 µg.
(2) Le pourcentage est arrondi :
a) lorsque la teneur déclarée est « 0 µg » : à 0 %;
b) dans les autres cas : au plus proche multiple de 1 %.
34 Teneur en chlorure « Chlorure » La teneur est exprimée :
a) en milligrammes par portion indiquée;
b) en pourcentage de la valeur quotidienne par portion indiquée.
(1) La teneur est arrondie :
a) lorsqu’elle est inférieure à 5 mg : à 0 mg;
b) lorsqu’elle est égale ou supérieure à 5 mg mais moins de 50 mg : au plus proche multiple de 10 mg;
c) lorsqu’elle est égale ou supérieure à 50 mg mais moins de 250 mg : au plus proche multiple de 25 mg;
d) lorsqu’elle est égale ou supérieure à 250 mg : au plus proche multiple de 50 mg.
(2) Le pourcentage est arrondi :
a) lorsque la teneur déclarée est « 0 mg » : à 0 %;
b) dans les autres cas : au plus proche multiple de 1 %.
Aliments supplémentés utilisés dans la fabrication d’autres aliments supplémentés
B.29.004 (1) Le présent article s’applique à l’aliment supplémenté qui est destiné uniquement à être utilisé comme ingrédient dans la fabrication d’autres aliments supplémentés destinés à être vendus au consommateur au niveau du commerce de détail.
(2) Il est interdit de vendre l’aliment supplémenté à moins que les renseignements visés au paragraphe (3) le concernant l’accompagnent sous forme écrite lors de sa livraison à l’acheteur.
(3) Les renseignements :
a) comprennent ceux que le tableau des renseignements sur les aliments supplémentés indiquerait, n’eût été le paragraphe B.29.002(6), aux termes des articles B.29.002 et B.29.003;
b) peuvent comprendre ceux que le tableau des renseignements sur les aliments supplémentés peut indiquer aux termes de l’article B.29.003;
c) sont présentés conformément aux articles B.29.002 et B.29.003, sous réserve des modifications suivantes :
(i) les renseignements concernant les ingrédients supplémentaires sont exprimés au moyen de l’unité applicable prévue à la colonne 3 de la Liste des ingrédients supplémentaires autorisés,
(A) par gramme ou 100 g de l’aliment supplémenté, dans le cas où la quantité nette de l’aliment est mentionnée en poids ou en nombre sur l’étiquette,
(B) par millilitre ou 100 ml de l’aliment supplémenté, dans le cas où la quantité nette de l’aliment est mentionnée en volume sur l’étiquette,
ii) sauf s’ils portent sur des ingrédients supplémentaires, les renseignements concernant les vitamines mentionnées au paragraphe D.01.002(1) sont exprimés au moyen de l’unité applicable indiquée au paragraphe D.01.003(1) et ceux concernant les minéraux nutritifs figurant aux alinéas D.02.001(1)a) à j), l) à n) et p) sont exprimés en milligrammes pour le sodium, le potassium, le calcium, le phosphore, le magnésium, le fer, le zinc, le chlore, le cuivre et le manganèse et en microgrammes pour l’iode, le chrome, le sélénium et le molybdène,
(A) par gramme ou 100 g de l’aliment supplémenté, dans le cas où la quantité nette de l’aliment est mentionnée en poids ou en nombre sur l’étiquette,
(B) par millilitre ou 100 ml de l’aliment supplémenté, dans le cas où la quantité nette de l’aliment est mentionnée en volume sur l’étiquette,
(iii) les renseignements concernant les autres éléments nutritifs ainsi que la valeur énergétique, figurant à la colonne 1 des tableaux des articles B.29.002 ou B.29.003, sont exprimés au moyen d’une unité visée à la colonne 3 :
(A) par gramme ou 100 g de l’aliment supplémenté, dans le cas où la quantité nette de l’aliment est mentionnée en poids ou en nombre sur l’étiquette,
(B) par millilitre ou 100 ml de l’aliment supplémenté, dans le cas où la quantité nette de l’aliment est mentionnée en volume sur l’étiquette,
(iv) le pourcentage de la valeur quotidienne et les renseignements concernant la portion indiquée peuvent être omis,
(v) les renseignements sont indiqués avec un degré de précision qui correspond à la précision des méthodes analytiques utilisées pour produire ces renseignements.
Objet des renseignements
B.29.005 (1) Sous réserve des paragraphes (2) à (5), le tableau des renseignements sur les aliments supplémentés indique les renseignements uniquement en fonction de l’aliment supplémenté tel qu’il est vendu.
(2) Le tableau des renseignements sur les aliments supplémentés de tout produit préemballé contenant un assortiment d’aliments supplémentés du même type et dont la portion typique ne comprend qu’un de ces aliments indique les renseignements en fonction :
a) de chaque aliment supplémenté dans le produit préemballé, lorsque les renseignements figurant à la colonne 1 du tableau de l’article B.29.002 sont différents pour chaque aliment supplémenté;
b) d’un aliment supplémenté dans le produit préemballé, lorsque les renseignements figurant à la colonne 1 du tableau de l’article B.29.002 sont les mêmes pour chaque aliment supplémenté.
(3) Le tableau des renseignements sur les aliments supplémentés de tout produit préemballé contenant un assortiment d’aliments supplémentés du même type et dont la portion typique comprend plus d’un de ces aliments indique les renseignements qui correspondent soit à la valeur de chaque aliment supplémenté, soit à une valeur composée.
(4) Le tableau des renseignements sur les aliments supplémentés de tout aliment supplémenté à préparer selon des instructions fournies dans ou sur l’emballage, ou qui est normalement combiné avec d’autres ingrédients ou d’autres aliments ou cuit avant d’être consommé, peut également indiquer les renseignements en fonction de l’aliment supplémenté une fois préparé, auquel cas :
a) le tableau indique les renseignements ci-après en fonction de l’aliment supplémenté préparé :
(i) sauf dans le cas visé au sous-alinéa (ii), la quantité de l’aliment supplémenté exprimée en l’unité visée à la colonne 3 du sous-alinéa 1b)(i) du tableau de l’article B.29.002, soit « environ (la portion indiquée) » ou « environ (la portion indiquée) préparé », et, s’il y a lieu, au moyen des règles d’écriture indiquées dans la colonne 4 des paragraphes 1(1) et (2),
(ii) si l’aliment supplémenté est normalement combiné avec un autre aliment, la quantité de l’autre aliment exprimée en l’unité visée à la colonne 3 du sous-alinéa 1b)(i) du tableau de l’article B.29.002,
(iii) la valeur énergétique, exprimée au moyen de la nomenclature indiquée dans la colonne 2 de l’article 2 du tableau de l’article B.29.002, de l’unité indiquée dans la colonne 3 et des règles d’écriture indiquées dans la colonne 4,
(iv) les renseignements visés à la colonne 1 des articles 3, 6 à 8, 10, 11 et 13 à 15 du tableau de l’article B.29.002 et à la colonne 1 des articles 11 à 34 du tableau de l’article B.29.003 et qui sont indiqués en pourcentage de la valeur quotidienne dans le tableau des renseignements sur les aliments supplémentés en fonction de l’aliment supplémenté tel qu’il est vendu, exprimés au moyen de la nomenclature indiquée dans la colonne 2 de ces tableaux en pourcentage de la valeur quotidienne par portion indiquée et au moyen des règles d’écriture indiquées dans la colonne 4 de ceux-ci,
(v) les renseignements visés à la colonne 1 de l’article 18 du tableau de l’article B.29.002, exprimés au moyen de la nomenclature visée à la colonne 2, de l’unité visée à la colonne 3 et des règles d’écriture visées à la colonne 4;
b) le tableau peut également indiquer les renseignements ci-après en fonction des ingrédients ajoutés ou de l’autre aliment, s’ils sont déclarés dans le tableau des renseignements sur les aliments supplémentés de l’aliment supplémenté tel qu’il est vendu :
(i) les renseignements visés à la colonne 1 des articles 3 à 5 et 7 à 12 du tableau de l’article B.29.002, exprimés au moyen de la nomenclature indiquée dans la colonne 2, en milligrammes pour ceux visés à la colonne 1 des articles 7 et 8 et en grammes pour ceux visés à la colonne 1 des articles 3 à 5 et 9 à 12 et au moyen des règles d’écriture indiquées dans la colonne 4,
(ii) les renseignements visés à la colonne 1 des articles 3 à 10 du tableau de l’article B.29.003, exprimés au moyen de la nomenclature indiquée dans la colonne 2, en grammes et au moyen des règles d’écriture indiquées dans la colonne 4,
(iii) les renseignements visés à la colonne 1 de l’article 2 du tableau de l’article B.29.002, exprimés au moyen de la nomenclature indiquée dans la colonne 2, de l’unité indiquée dans la colonne 3, par portion indiquée de l’aliment supplémenté préparé et au moyen des règles d’écriture indiquées dans la colonne 4.
(5) Le tableau des renseignements sur les aliments supplémentés peut également indiquer les renseignements en fonction d’autres quantités de l’aliment supplémenté qui correspondent à différents usages ou unités de mesure de l’aliment supplémenté, auquel cas :
a) le tableau indique les renseignements ci-après pour chacune des autres quantités de l’aliment supplémenté :
(i) la quantité exprimée selon une mesure domestique et une mesure métrique et au moyen des règles d’écriture indiquées dans la colonne 4 du tableau de l’article B.29.002, aux paragraphes 1(1) et (2),
(ii) la valeur énergétique, exprimée au moyen de la nomenclature indiquée dans la colonne 2 de l’article 2 du tableau de l’article B.29.002, de l’unité indiquée dans la colonne 3 et des règles d’écriture indiquées dans la colonne 4,
(iii) les renseignements visés à la colonne 1 des articles 3, 6 à 8, 10, 11 et 13 à 15 du tableau de l’article B.29.002 et à la colonne 1 des articles 11 à 34 du tableau de l’article B.29.003 et qui sont indiqués en pourcentage de la valeur quotidienne dans le tableau des renseignements sur les aliments supplémentés à l’égard de la première quantité de l’aliment supplémenté pour laquelle des renseignements sont déclarés, exprimés au moyen de la nomenclature indiquée dans la colonne 2 de ces tableaux, en pourcentage de la valeur quotidienne par portion indiquée et au moyen des règles d’écriture indiquées dans la colonne 4 de ceux-ci,
(iv) les renseignements visés à la colonne 1 de l’article 18 du tableau de l’article B.29.002, exprimés au moyen de la nomenclature visée à la colonne 2, de l’unité visée à la colonne 3 et des règles d’écriture visées à la colonne 4;
b) si le tableau est présenté selon l’une des versions du modèle composé prévu à l’article B.29.015, il indique également les renseignements ci-après pour chacune des autres quantités de l’aliment supplémenté, s’ils sont déclarés dans le tableau des renseignements sur les aliments supplémentés à l’égard de la première quantité de l’aliment supplémenté pour laquelle des renseignements sont déclarés :
(i) les renseignements visés à la colonne 1 des articles 3 à 5 et 7 à 15 du tableau de l’article B.29.002, exprimés au moyen de la nomenclature indiquée dans la colonne 2, en milligrammes pour ceux visés à la colonne 1 des articles 7, 8 et 13 à 15 et en grammes pour ceux visés à la colonne 1 des articles 3 à 5 et 9 à 12 et au moyen des règles d’écriture indiquées dans la colonne 4,
(ii) les renseignements visés à la colonne 1 des articles 3 à 34 du tableau de l’article B.29.003, exprimés au moyen de la nomenclature indiquée dans la colonne 2, en microgrammes pour ceux visés à la colonne 1 des articles 11, 13, 15, 21, 22, 26, 29, 32 et 33, en microgrammes d’équivalents de folate alimentaire pour ceux visés à la colonne 1 de l’article 20, en milligrammes pour ceux visés à la colonne 1 des articles 12, 14, 16 à 19, 23 à 25, 27, 28, 30, 31 et 34, et en grammes pour ceux visés à la colonne 1 des articles 3 à 10 et au moyen des règles d’écriture indiquées dans la colonne 4.
Présentation du tableau des renseignements sur les aliments supplémentés
B.29.006 (1) Sous réserve des paragraphes (2) à (7), le tableau des renseignements sur les aliments supplémentés est présenté selon le modèle de la figure applicable du Répertoire des modèles de TRAS, compte tenu notamment de l’ordre de présentation, des dimensions, des espacements et de l’emploi des majuscules, des minuscules et des caractères gras.
(2) Les caractères et les filets du tableau des renseignements sur les aliments supplémentés sont monochromes et équivalent visuellement à de l’imprimerie noire en aplat de 100 % sur un fond blanc ou de couleur de teinte neutre et uniforme d’au plus 5 %.
(3) Les caractères dans le tableau des renseignements sur les aliments supplémentés :
a) figurent dans la même police, sans empattement et décoration, et sont inscrits de manière à ce qu’ils ne se touchent pas et ne touchent pas les filets;
b) peuvent être de dimensions plus grandes que celles indiquées dans la figure applicable du Répertoire des modèles de TRAS si tous les caractères sont agrandis de façon uniforme.
(4) La taille des caractères qui est indiquée entre parenthèses pour une version prévue à un tableau des articles B.29.009 à B.29.015 représente la taille minimale des caractères à utiliser, dans le tableau des renseignements sur les aliments supplémentés, pour indiquer les éléments nutritifs et les ingrédients supplémentaires figurant aux tableaux des articles B.29.002 et B.29.003 conformément à cette version.
(5) Un filet de un ou deux points visé à la figure applicable du Répertoire des modèles de TRAS peut avoir une force de corps plus grande dans le tableau des renseignements sur les aliments supplémentés.
(6) Le tableau des renseignements sur les aliments supplémentés indique les renseignements conformément aux paragraphes B.29.001(2) et (3) et aux articles B.29.002, B.29.003 et B.29.005.
(7) L’ordre de la langue indiqué dans la figure applicable du Répertoire des modèles de TRAS peut être inversé lorsque le tableau des renseignements sur les aliments supplémentés est composé d’un tableau en français et en anglais.
Emplacement du tableau des renseignements sur les aliments supplémentés
B.29.007 (1) Sous réserve du paragraphe (2), le tableau des renseignements sur les aliments supplémentés est présenté :
a) dans un tableau en français et un tableau en anglais sur le même espace continu de la surface exposée disponible;
b) dans un tableau en français et en anglais sur tout espace continu de la surface exposée disponible;
c) dans un tableau en français sur tout espace continu de la surface exposée disponible et un tableau en anglais sur tout autre espace continu de cette surface de même grandeur et de même importance que le premier espace.
(2) Si, conformément au paragraphe B.01.012(3), les renseignements devant être indiqués aux termes du présent règlement sur l’étiquette d’un aliment supplémenté peuvent l’être uniquement en français ou uniquement en anglais et qu’ils y figurent dans la langue en cause, le tableau des renseignements sur les aliments supplémentés peut être présenté sur l’étiquette dans cette langue sur tout espace continu de la surface exposée disponible.
Orientation du tableau des renseignements sur les aliments supplémentés
B.29.008 (1) Sous réserve du paragraphe (2), le tableau des renseignements sur les aliments supplémentés est orienté dans le même sens que les autres renseignements figurant sur l’étiquette de l’aliment supplémenté.
(2) Dans le cas où une version du tableau des renseignements sur les aliments supplémentés ne peut être orientée dans le même sens que les autres renseignements figurant sur l’étiquette, elle est orientée dans un autre sens s’il y a suffisamment d’espace et si l’aliment contenu dans l’emballage ne fuit pas et n’est pas endommagé lorsque l’emballage est retourné.
(3) Le paragraphe (1) ne s’applique pas au tableau des renseignements sur les aliments supplémentés qui est présenté sur le dessus ou le dessous de l’emballage.
Modèles standard et horizontal
B.29.009 (1) Le présent article s’applique à tout aliment supplémenté à moins que l’un des articles B.29.010 à B.29.015 ne s’y applique.
(2) Sous réserve du paragraphe (3), le tableau des renseignements sur les aliments supplémentés est présenté selon l’une des versions figurant à la colonne 1 du tableau du présent article, si la condition prévue à la colonne 2 est remplie.
(3) Si le tableau des renseignements sur les aliments supplémentés ne peut être présenté conformément au présent règlement sur 15 % ou moins de la surface exposée disponible de l’aliment supplémenté selon l’une des versions figurant à la colonne 1 du tableau du présent article, il est présenté de l’une des façons suivantes :
a) selon le modèle standard bilingue prévu aux figures 3.5(B), 3.6(B) ou 3.7(B) du Répertoire des modèles de TRAS;
b) selon le modèle horizontal bilingue prévu aux figures 4.3(B), 4.4(B) ou 4.5(B) du Répertoire des modèles de TRAS;
c) selon le modèle linéaire prévu aux figures 16.1(F) et (A) ou 16.2(F) et (A) du Répertoire des modèles de TRAS;
d) selon l’une des versions figurant à la colonne 1 du tableau du présent article, même si le tableau des renseignements sur les aliments supplémentés devrait être présenté sur plus de 15 % de la surface exposée disponible;
e) d’une façon prévue à l’article B.29.017.
(4) Pour l’application du présent article, afin d’établir si une version du tableau des renseignements sur les aliments supplémentés ne peut être présentée conformément au présent règlement sur 15 % ou moins de la surface exposée disponible de l’aliment supplémenté, il n’est tenu compte, dans le tableau, que des renseignements exigés par le présent règlement.
(5) Malgré les paragraphes (2) et (3), si le tableau des renseignements sur les aliments supplémentés est placé sur une étiquette mobile attachée à un emballage décoratif ou sur une étiquette mobile attachée à un emballage sur lequel aucune étiquette ne peut être apposée ou sur lequel les renseignements ne peuvent être indiqués lisiblement et de façon que l’acheteur ou le consommateur puisse les voir aisément dans les conditions habituelles d’achat, il est présenté selon l’une des versions prévues aux alinéas (3)a) à c) ou selon l’une des versions figurant à la colonne 1 du tableau du présent article, sans égard à toute condition prévue à la colonne 2.
TABLEAU
PARTIE 1
Modèle standard
Article Colonne 1 Colonne 2 Figure du Répertoire des modèles de TRAS (version) Condition d’utilisation 1 1.1(F) et (A) (éléments nutritifs et ingrédients supplémentaires figurant en caractères d’au moins 8 points)
2 1.2(F) et (A) (éléments nutritifs et ingrédients supplémentaires figurant en caractères d’au moins 7 points)
La version de l’article 1 ne peut être présentée conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. 3 1.3(F) et (A) (éléments nutritifs et ingrédients supplémentaires figurant en caractères étroits d’au moins 7 points)
Les versions des articles 1 et 2 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. 4 1.4(F) et (A) (éléments nutritifs et ingrédients supplémentaires figurant en caractères étroits d’au moins 7 points)
Les versions des articles 1 à 3 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. 5 1.5(F) et (A) (éléments nutritifs et ingrédients supplémentaires figurant en caractères étroits d’au moins 6 points)
Les versions des articles 1 à 4 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. 6 1.6(F) et (A) (éléments nutritifs et ingrédients supplémentaires figurant en caractères étroits d’au moins 6 points)
Les versions des articles 1 à 5 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. PARTIE 2
Modèle standard étroit
Article Colonne 1 Colonne 2 Figure du Répertoire des modèles de TRAS (version) Condition d’utilisation 1 2.1(F) et (A) (éléments nutritifs et ingrédients supplémentaires figurant en caractères d’au moins 8 points)
2 2.2(F) et (A) (éléments nutritifs et ingrédients supplémentaires figurant en caractères d’au moins 7 points)
La version de l’article 1 ne peut être présentée conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. 3 2.3(F) et (A) (éléments nutritifs et ingrédients supplémentaires figurant en caractères étroits d’au moins 7 points)
Les versions des articles 1 et 2 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. 4 2.4(F) et (A) (éléments nutritifs et ingrédients supplémentaires figurant en caractères étroits d’au moins 6 points)
Les versions des articles 1 à 3 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. PARTIE 3
Modèle standard bilingue
Article Colonne 1 Colonne 2 Figure du Répertoire des modèles de TRAS (version) Condition d’utilisation 1 3.1(B) (éléments nutritifs et ingrédients supplémentaires figurant en caractères d’au moins 8 points)
2 3.2(B) (éléments nutritifs et ingrédients supplémentaires figurant en caractères d’au moins 7 points)
La version de l’article 1 ne peut être présentée conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. 3 3.3(B) (éléments nutritifs et ingrédients supplémentaires figurant en caractères étroits d’au moins 7 points)
Les versions des articles 1 et 2 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. 4 3.4(B) (éléments nutritifs et ingrédients supplémentaires figurant en caractères étroits d’au moins 6 points)
Les versions des articles 1 à 3 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. PARTIE 4
Modèle horizontal bilingue
Article Colonne 1 Colonne 2 Figure du Répertoire des modèles de TRAS (version) Condition d’utilisation 1 4.1(B) (éléments nutritifs et ingrédients supplémentaires figurant en caractères étroits d’au moins 7 points)
Les versions des parties 1 à 3 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. 2 4.2(B) (éléments nutritifs et ingrédients supplémentaires figurant en caractères étroits d’au moins 6 points)
Les versions des parties 1 à 3 et de l’article 1 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible.
Modèles simplifiés
B.29.010 (1) Le présent article s’applique à tout aliment supplémenté qui remplit la condition prévue au paragraphe B.29.002(4) et dont le tableau des renseignements sur les aliments supplémentés ne contient que les renseignements visés aux alinéas B.29.002(4)a) à m).
(2) Sous réserve du paragraphe (3), le tableau des renseignements sur les aliments supplémentés est présenté selon l’une des versions figurant à la colonne 1 du tableau du présent article, si la condition prévue à la colonne 2 est remplie.
(3) Si le tableau des renseignements sur les aliments supplémentés qui ne contient que les renseignements visés aux alinéas B.29.002(4)a) à m) ne peut être présenté conformément au présent règlement sur 15 % ou moins de la surface exposée disponible de l’aliment supplémenté selon l’une des versions figurant à la colonne 1 du tableau du présent article, il est présenté de l’une des façons suivantes :
a) selon le modèle standard simplifié bilingue prévu aux figures 6.5(B) ou 6.6(B) du Répertoire des modèles de TRAS;
b) selon le modèle horizontal simplifié bilingue prévu aux figures 7.3(B) ou 7.4(B) du Répertoire des modèles de TRAS;
c) selon le modèle linéaire simplifié prévu aux figures 17.1(F) et (A) ou 17.2(F) et (A) du Répertoire des modèles de TRAS;
d) selon l’une des versions figurant à la colonne 1 du tableau du présent article, même si le tableau des renseignements sur les aliments supplémentés devrait être présenté sur plus de 15 % de la surface exposée disponible;
e) d’une façon prévue à l’article B.29.017.
(4) Malgré les paragraphes (2) et (3), si le tableau des renseignements sur les aliments supplémentés est placé sur une étiquette mobile attachée à un emballage décoratif ou sur une étiquette mobile attachée à un emballage sur lequel aucune étiquette ne peut être apposée ou sur lequel les renseignements ne peuvent être indiqués lisiblement et de façon que l’acheteur ou le consommateur puisse les voir aisément dans les conditions habituelles d’achat, il est présenté selon l’une des versions prévues aux alinéas (3)a) à c) ou selon l’une des versions figurant à la colonne 1 du tableau du présent article, sans égard à toute condition prévue à la colonne 2.
TABLEAU
PARTIE 1
Modèle standard simplifié
Colonne 1 Colonne 2 Article Figure du Répertoire des modèles de TRAS (version) Condition d’utilisation 1 5.1(F) et (A) (éléments nutritifs et ingrédients supplémentaires figurant en caractères d’au moins 8 points)
2 5.2(F) et (A) (éléments nutritifs et ingrédients supplémentaires figurant en caractères d’au moins 7 points)
La version de l’article 1 ne peut être présentée conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. 3 5.3(F) et (A) (éléments nutritifs et ingrédients supplémentaires figurant en caractères étroits d’au moins 7 points)
Les versions des articles 1 et 2 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. 4 5.4(F) et (A) (éléments nutritifs et ingrédients supplémentaires figurant en caractères étroits d’au moins 7 points)
Les versions des articles 1 à 3 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. 5 5.5(F) et (A) (éléments nutritifs et ingrédients supplémentaires figurant en caractères étroits d’au moins 6 points)
Les versions des articles 1 à 4 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. 6 5.6(F) et (A) (éléments nutritifs et ingrédients supplémentaires figurant en caractères étroits d’au moins 6 points)
Les versions des articles 1 à 5 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. PARTIE 2
Modèle standard simplifié bilingue
Colonne 1 Colonne 2 Article Figure du Répertoire des modèles de TRAS (version) Condition d’utilisation 1 6.1(B) (éléments nutritifs et ingrédients supplémentaires figurant en caractères d’au moins 8 points)
2 6.2(B) (éléments nutritifs et ingrédients supplémentaires figurant en caractères d’au moins 7 points)
La version de l’article 1 ne peut être présentée conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. 3 6.3(B) (éléments nutritifs et ingrédients supplémentaires figurant en caractères étroits d’au moins 7 points)
Les versions des articles 1 et 2 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. 4 6.4(B) (éléments nutritifs et ingrédients supplémentaires figurant en caractères étroits d’au moins 6 points)
Les versions des articles 1 à 3 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. PARTIE 3
Modèle horizontal simplifié bilingue
Colonne 1 Colonne 2 Article Figure du Répertoire des modèles de TRAS (version) Condition d’utilisation 1 7.1(B) (éléments nutritifs et ingrédients supplémentaires figurant en caractères étroits d’au moins 7 points)
Les versions des parties 1 et 2 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. 2 7.2(B) (éléments nutritifs et ingrédients supplémentaires figurant en caractères étroits d’au moins 6 points)
Les versions des parties 1 et 2 et de l’article 1 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible.
Modèles simplifiés — aliments supplémentés étant des produits préemballés à portion individuelle
B.29.011 (1) Le présent article s’applique à tout aliment supplémenté qui est un produit préemballé à portion individuelle et dont le tableau des renseignements sur les aliments supplémentés ne contient que les renseignements visés aux alinéas B.29.002(5)a) à l).
(2) Sous réserve du paragraphe (3), le tableau des renseignements sur les aliments supplémentés de l’aliment supplémenté qui est un produit préemballé à portion individuelle est présenté selon l’une des versions figurant à la colonne 1 du tableau du présent article, si la condition prévue à la colonne 2 est remplie.
(3) Si le tableau des renseignements sur les aliments supplémentés qui ne contient que les renseignements visés aux alinéas B.29.002(5)a) à l) ne peut être présenté conformément au présent règlement sur 15 % ou moins de la surface exposée disponible de l’aliment supplémenté qui est un produit préemballé à portion individuelle selon l’une des versions figurant à la colonne 1 du tableau du présent article, il est présenté de l’une des façons suivantes :
a) selon le modèle standard simplifié bilingue prévu aux figures 6.5.1(B) ou 6.6.1(B) du Répertoire des modèles de TRAS;
b) selon le modèle horizontal simplifié bilingue prévu aux figures 7.3.1(B) ou 7.4.1(B) du Répertoire des modèles de TRAS;
c) selon le modèle linéaire simplifié prévu aux figures 17.1.1(F) et (A) ou 17.2.1(F) et (A) du Répertoire des modèles de TRAS;
d) selon l’une des versions figurant à la colonne 1 du tableau du présent article, même si le tableau des renseignements sur les aliments supplémentés devrait être présenté sur plus de 15 % de la surface exposée disponible;
e) d’une façon prévue à l’article B.29.017.
(4) Malgré les paragraphes (2) et (3), si le tableau des renseignements sur les aliments supplémentés de l’aliment supplémenté qui est un produit préemballé à portion individuelle est placé sur une étiquette mobile attachée à un emballage décoratif ou sur une étiquette mobile attachée à un emballage sur lequel aucune étiquette ne peut être apposée ou sur lequel les renseignements ne peuvent être indiqués lisiblement et de façon que l’acheteur ou le consommateur puisse les voir aisément dans les conditions habituelles d’achat, il est présenté selon l’une des versions prévues aux alinéas (3)a) à c) ou selon l’une des versions figurant à la colonne 1 du tableau du présent article, sans égard à toute condition prévue à la colonne 2.
TABLEAU
PARTIE 1
Modèle standard simplifié bilingue — aliments supplémentés étant des produits préemballés à portion individuelle
Article Colonne 1 Colonne 2 Figure du Répertoire des modèles de TRAS (version) Condition d’utilisation 1 6.1.1(B) (éléments nutritifs et ingrédients supplémentaires figurant en caractères d’au moins 8 points)
2 6.2.1(B) (éléments nutritifs et ingrédients supplémentaires figurant en caractères d’au moins 7 points)
La version de l’article 1 ne peut être présentée conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. 3 6.3.1(B) (éléments nutritifs et ingrédients supplémentaires figurant en caractères étroits d’au moins 7 points)
Les versions des articles 1 et 2 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. 4 6.4.1(B) (éléments nutritifs et ingrédients supplémentaires figurant en caractères étroits d’au moins 6 points)
Les versions des articles 1 à 3 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. PARTIE 2
Modèle horizontal simplifié bilingue — aliments supplémentés étant des produits préemballés à portion individuelle
Article Colonne 1 Colonne 2 Figure du Répertoire des modèles de TRAS (version) Condition d’utilisation 1 7.1.1(B) (éléments nutritifs et ingrédients supplémentaires figurant en caractères étroits d’au moins 7 points)
Les versions de la partie 1 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. 2 7.2.1(B) (éléments nutritifs et ingrédients supplémentaires figurant en caractères étroits d’au moins 6 points)
Les versions de la partie 1 et de l’article 1 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible.
Modèle double — aliments supplémentés à préparer
B.29.012 (1) Sous réserve du paragraphe (2), le tableau des renseignements sur les aliments supplémentés qui indique les renseignements visés au paragraphe B.29.005(4) est présenté selon l’une des versions figurant à la colonne 1 du tableau du présent article, si la condition prévue à la colonne 2 est remplie.
(2) Si le tableau des renseignements sur les aliments supplémentés ne peut être présenté conformément au présent règlement sur 15 % ou moins de la surface exposée disponible de l’aliment supplémenté selon l’une des versions figurant à la colonne 1 du tableau du présent article, il est présenté :
a) soit selon le modèle double bilingue prévu aux figures 9.5(B) ou 9.6(B) du Répertoire des modèles de TRAS;
b) soit selon l’une des versions figurant à la colonne 1 du tableau du présent article, même si le tableau des renseignements sur les aliments supplémentés devrait être présenté sur plus de 15 % de la surface exposée disponible.
(3) Pour l’application du présent article, afin d’établir si une version du tableau des renseignements sur les aliments supplémentés ne peut être présentée conformément au présent règlement sur 15 % ou moins de la surface exposée disponible de l’aliment supplémenté, il n’est tenu compte, dans le tableau, que des renseignements exigés par le présent règlement ainsi que des renseignements visés au paragraphe B.29.005(4).
(4) Malgré les paragraphes (1) et (2), si le tableau des renseignements sur les aliments supplémentés est placé sur une étiquette mobile attachée à un emballage décoratif ou sur une étiquette mobile attachée à un emballage sur lequel aucune étiquette ne peut être apposée ou sur lequel les renseignements ne peuvent être indiqués lisiblement et de façon que l’acheteur ou le consommateur puisse les voir aisément dans les conditions habituelles d’achat, il est présenté selon l’une des versions prévues à l’alinéa (2)a) ou selon l’une des versions figurant à la colonne 1 du tableau du présent article, sans égard à toute condition prévue à la colonne 2.
TABLEAU
PARTIE 1
Modèle double — aliments supplémentés à préparer
Article Colonne 1 Colonne 2 Figure du Répertoire des modèles de TRAS (version) Condition d’utilisation 1 8.1(F) et (A) (éléments nutritifs et ingrédients supplémentaires figurant en caractères d’au moins 8 points)
2 8.2(F) et (A) (éléments nutritifs et ingrédients supplémentaires figurant en caractères d’au moins 7 points)
La version de l’article 1 ne peut être présentée conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. 3 8.3(F) et (A) (éléments nutritifs et ingrédients supplémentaires figurant en caractères étroits d’au moins 7 points)
Les versions des articles 1 et 2 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. 4 8.4(F) et (A) (éléments nutritifs et ingrédients supplémentaires figurant en caractères étroits d’au moins 7 points)
Les versions des articles 1 à 3 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. 5 8.5(F) et (A) (éléments nutritifs et ingrédients supplémentaires figurant en caractères étroits d’au moins 6 points)
Les versions des articles 1 à 4 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. 6 8.6(F) et (A) (éléments nutritifs et ingrédients supplémentaires figurant en caractères étroits d’au moins 6 points)
Les versions des articles 1 à 5 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. PARTIE 2
Modèle double bilingue — aliments supplémentés à préparer
Article Colonne 1 Colonne 2 Figure du Répertoire des modèles de TRAS (version) Condition d’utilisation 1 9.1(B) (éléments nutritifs et ingrédients supplémentaires figurant en caractères d’au moins 8 points)
2 9.2(B) (éléments nutritifs et ingrédients supplémentaires figurant en caractères d’au moins 7 points)
La version de l’article 1 ne peut être présentée conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. 3 9.3(B) (éléments nutritifs et ingrédients supplémentaires figurant en caractères étroits d’au moins 7 points)
Les versions des articles 1 et 2 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. 4 9.4(B) (éléments nutritifs et ingrédients supplémentaires figurant en caractères étroits d’au moins 6 points)
Les versions des articles 1 à 3 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible.
Modèle composé — différents types d’aliments supplémentés
B.29.013 (1) Sous réserve du paragraphe (2), le tableau des renseignements sur les aliments supplémentés de tout produit préemballé contenant un assortiment d’aliments supplémentés qui indique des renseignements distincts en fonction de chaque aliment supplémenté, tel qu’il est prévu à l’alinéa B.29.005(2)a) ou au paragraphe B.29.005(3), est présenté selon l’une des versions figurant à la colonne 1 du tableau du présent article, si la condition prévue à la colonne 2 est remplie.
(2) Si le tableau des renseignements sur les aliments supplémentés ne peut être présenté conformément au présent règlement sur 15 % ou moins de la surface exposée disponible du produit préemballé selon l’une des versions figurant à la colonne 1 du tableau du présent article, il est présenté :
a) dans le cas de tout produit préemballé visé à l’alinéa B.29.005(2)a) :
(i) soit selon le modèle composé bilingue prévu aux figures 11.5(B) ou 11.6(B) du Répertoire des modèles de TRAS,
(ii) soit selon l’une des versions figurant à la colonne 1 du tableau du présent article, même si le tableau des renseignements sur les aliments supplémentés devrait être présenté sur plus de 15 % de la surface exposée disponible,
(iii) soit d’une façon prévue à l’article B.29.017;
b) dans le cas de tout produit préemballé visé au paragraphe B.29.005(3) :
(i) soit selon le modèle composé bilingue prévu aux figures 11.5(B) ou 11.6(B) du Répertoire des modèles de TRAS,
(ii) soit selon l’une des versions figurant à la colonne 1 du tableau du présent article, même si le tableau des renseignements sur les aliments supplémentés devrait être présenté sur plus de 15 % de la surface exposée disponible.
(3) Pour l’application du présent article, afin d’établir si une version du tableau des renseignements sur les aliments supplémentés ne peut être présentée conformément au présent règlement sur 15 % ou moins de la surface exposée disponible du produit préemballé, il n’est tenu compte, dans le tableau, que des renseignements exigés par le présent règlement pour chaque aliment supplémenté pour lequel des renseignements distincts y sont indiqués.
(4) Malgré les paragraphes (1) et (2), si le tableau des renseignements sur les aliments supplémentés du produit préemballé est placé sur une étiquette mobile attachée à un emballage décoratif ou sur une étiquette mobile attachée à un emballage sur lequel aucune étiquette ne peut être apposée ou sur lequel les renseignements ne peuvent être indiqués lisiblement et de façon que l’acheteur ou le consommateur puisse les voir aisément dans les conditions habituelles d’achat, il est présenté selon l’une des versions prévues au sous-alinéa (2)b)(i) ou selon l’une des versions figurant à la colonne 1 du tableau du présent article, sans égard à toute condition prévue à la colonne 2.
TABLEAU
PARTIE 1
Modèle composé — différents types d’aliments supplémentés
Article Colonne 1 Colonne 2 Figure du Répertoire des modèles de TRAS (version) Condition d’utilisation 1 10.1(F) et (A) (éléments nutritifs et ingrédients supplémentaires figurant en caractères d’au moins 8 points)
2 10.2(F) et (A) (éléments nutritifs et ingrédients supplémentaires figurant en caractères d’au moins 7 points)
La version de l’article 1 ne peut être présentée conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. 3 10.3(F) et (A) (éléments nutritifs et ingrédients supplémentaires figurant en caractères étroits d’au moins 7 points)
Les versions des articles 1 et 2 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. 4 10.4(F) et (A) (éléments nutritifs et ingrédients supplémentaires figurant en caractères étroits d’au moins 7 points)
Les versions des articles 1 à 3 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. 5 10.5(F) et (A) (éléments nutritifs et ingrédients supplémentaires figurant en caractères étroits d’au moins 6 points)
Les versions des articles 1 à 4 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. 6 10.6(F) et (A) (éléments nutritifs et ingrédients supplémentaires figurant en caractères étroits d’au moins 6 points)
Les versions des articles 1 à 5 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. PARTIE 2
Modèle composé bilingue — différents types d’aliments supplémentés
Article Colonne 1 Colonne 2 Figure du Répertoire des modèles de TRAS (version) Condition d’utilisation 1 11.1(B) (éléments nutritifs et ingrédients supplémentaires figurant en caractères d’au moins 8 points)
2 11.2(B) (éléments nutritifs et ingrédients supplémentaires figurant en caractères d’au moins de 7 points)
La version de l’article 1 ne peut être présentée conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. 3 11.3(B) (éléments nutritifs et ingrédients supplémentaires figurant en caractères étroits d’au moins 7 points)
Les versions des articles 1 et 2 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. 4 11.4(B) (éléments nutritifs et ingrédients supplémentaires figurant en caractères étroits d’au moins 6 points)
Les versions des articles 1 à 3 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible.
Modèle double — différentes quantités d’aliments supplémentés
B.29.014 (1) Sous réserve du paragraphe (2), le tableau des renseignements sur les aliments supplémentés qui indique des renseignements distincts en fonction de différentes quantités de l’aliment supplémenté, tel qu’il est prévu à l’alinéa B.29.005(5)a), sans indiquer les renseignements visés à l’alinéa B.29.005(5)b), est présenté selon l’une des versions figurant à la colonne 1 du tableau du présent article, si la condition prévue à la colonne 2 est remplie.
(2) Si le tableau des renseignements sur les aliments supplémentés ne peut être présenté conformément au présent règlement sur 15 % ou moins de la surface exposée disponible de l’aliment supplémenté selon l’une des versions figurant à la colonne 1 du tableau du présent article, il est présenté :
a) soit selon le modèle double bilingue prévu aux figures 13.5(B) ou 13.6(B) du Répertoire des modèles de TRAS;
b) soit selon l’une des versions figurant à la colonne 1 du tableau du présent article, même si le tableau des renseignements sur les aliments supplémentés devrait être présenté sur plus de 15 % de la surface exposée disponible.
(3) Pour l’application du présent article, afin d’établir si une version du tableau des renseignements sur les aliments supplémentés ne peut être présentée conformément au présent règlement sur 15 % ou moins de la surface exposée disponible de l’aliment supplémenté, il n’est tenu compte, dans le tableau, que des renseignements exigés par le présent règlement pour chaque quantité d’aliment supplémenté pour laquelle des renseignements distincts y sont indiqués.
(4) Malgré les paragraphes (1) et (2), si le tableau des renseignements sur les aliments supplémentés est placé sur une étiquette mobile attachée à un emballage décoratif ou sur une étiquette mobile attachée à un emballage sur lequel aucune étiquette ne peut être apposée ou sur lequel les renseignements ne peuvent être indiqués lisiblement et de façon que l’acheteur ou le consommateur puisse les voir aisément dans les conditions habituelles d’achat, il est présenté selon l’une des versions prévues à l’alinéa (2)a) ou selon l’une des versions figurant à la colonne 1 du tableau du présent article, sans égard à toute condition prévue à la colonne 2.
TABLEAU
PARTIE 1
Modèle double — différentes quantités d’aliments supplémentés
Article Colonne 1 Colonne 2 Figure du Répertoire des modèles de TRAS (version) Condition d’utilisation 1 12.1(F) et (A) (éléments nutritifs et ingrédients supplémentaires figurant en caractères d’au moins 8 points)
2 12.2(F) et (A) (éléments nutritifs et ingrédients supplémentaires figurant en caractères d’au moins 7 points)
La version de l’article 1 ne peut être présentée conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. 3 12.3(F) et (A) (éléments nutritifs et ingrédients supplémentaires figurant en caractères étroits d’au moins 7 points)
Les versions des articles 1 et 2 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. 4 12.4(F) et (A) (éléments nutritifs et ingrédients supplémentaires figurant en caractères étroits d’au moins 7 points)
Les versions des articles 1 à 3 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. 5 12.5(F) et (A) (éléments nutritifs et ingrédients supplémentaires figurant en caractères étroits d’au moins 6 points)
Les versions des articles 1 à 4 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. 6 12.6(F) et (A) (éléments nutritifs et ingrédients supplémentaires figurant en caractères étroits d’au moins 6 points)
Les versions des articles 1 à 5 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. PARTIE 2
Modèle double bilingue — différentes quantités d’aliments supplémentés
Article Colonne 1 Colonne 2 Figure du Répertoire des modèles de TRAS (version) Condition d’utilisation 1 13.1(B) (éléments nutritifs et ingrédients supplémentaires figurant en caractères d’au moins 8 points)
2 13.2(B) (éléments nutritifs et ingrédients supplémentaires figurant en caractères d’au moins 7 points)
La version de l’article 1 ne peut être présentée conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. 3 13.3(B) (éléments nutritifs et ingrédients supplémentaires figurant en caractères étroits d’au moins 7 points)
Les versions des articles 1 et 2 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. 4 13.4(B) (éléments nutritifs et ingrédients supplémentaires figurant en caractères étroits d’au moins 6 points)
Les versions des articles 1 à 3 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible.
Modèle composé — différentes quantités d’aliments supplémentés
B.29.015 (1) Sous réserve du paragraphe (2), le tableau des renseignements sur les aliments supplémentés qui indique des renseignements distincts en fonction de différentes quantités de l’aliment supplémenté, tel qu’il est prévu aux alinéas B.29.005(5)a) et b), est présenté selon l’une des versions figurant à la colonne 1 du tableau du présent article, si la condition prévue à la colonne 2 est remplie.
(2) Si le tableau des renseignements sur les aliments supplémentés ne peut être présenté conformément au présent règlement sur 15 % ou moins de la surface exposée disponible de l’aliment supplémenté selon l’une des versions figurant à la colonne 1 du tableau du présent article, il est présenté :
a) soit selon le modèle composé bilingue prévu aux figures 15.5(B) ou 15.6(B) du Répertoire des modèles de TRAS;
b) soit selon l’une des versions figurant à la colonne 1 du tableau du présent article, même si le tableau des renseignements sur les aliments supplémentés devrait être présenté sur plus de 15 % de la surface exposée disponible.
(3) Pour l’application du présent article, afin d’établir si une version du tableau des renseignements sur les aliments supplémentés ne peut être présentée conformément au présent règlement sur 15 % ou moins de la surface exposée disponible de l’aliment supplémenté, il n’est tenu compte, dans le tableau, que des renseignements exigés par le présent règlement pour chaque quantité d’aliment supplémenté pour laquelle des renseignements distincts y sont indiqués.
(4) Malgré les paragraphes (1) et (2), si le tableau des renseignements sur les aliments supplémentés est placé sur une étiquette mobile attachée à un emballage décoratif ou sur une étiquette mobile attachée à un emballage sur lequel aucune étiquette ne peut être apposée ou sur lequel les renseignements ne peuvent être indiqués lisiblement et de façon que l’acheteur ou le consommateur puisse les voir aisément dans les conditions habituelles d’achat, il est présenté selon l’une des versions prévues à l’alinéa (2)a) ou selon l’une des versions figurant à la colonne 1 du tableau du présent article, sans égard à toute condition prévue à la colonne 2.
TABLEAU
PARTIE 1
Modèle composé — différentes quantités d’aliments supplémentés
Article Colonne 1 Colonne 2 Figure du Répertoire des modèles de TRAS (version) Condition d’utilisation 1 14.1(F) et (A) (éléments nutritifs et ingrédients supplémentaires figurant en caractères d’au moins 8 points)
2 14.2(F) et (A) (éléments nutritifs et ingrédients supplémentaires figurant en caractères d’au moins 7 points)
La version de l’article 1 ne peut être présentée conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. 3 14.3(F) et (A) (éléments nutritifs et ingrédients supplémentaires figurant en caractères étroits d’au moins 7 points)
Les versions des articles 1 et 2 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. 4 14.4(F) et (A) (éléments nutritifs et ingrédients supplémentaires figurant en caractères étroits d’au moins 7 points)
Les versions des articles 1 à 3 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. 5 14.5(F) et (A) (éléments nutritifs et ingrédients supplémentaires figurant en caractères étroits d’au moins 6 points)
Les versions des articles 1 à 4 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. 6 14.6(F) et (A) (éléments nutritifs et ingrédients supplémentaires figurant en caractères étroits d’au moins 6 points)
Les versions des articles 1 à 5 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. PARTIE 2
Modèle composé bilingue — différentes quantités d’aliments supplémentés
Article Colonne 1 Colonne 2 Figure du Répertoire des modèles de TRAS (version) Condition d’utilisation 1 15.1(B) (éléments nutritifs et ingrédients supplémentaires figurant en caractères d’au moins 8 points)
2 15.2(B) (éléments nutritifs et ingrédients supplémentaires figurant en caractères d’au moins 7 points)
La version de l’article 1 ne peut être présentée conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. 3 15.3(B) (éléments nutritifs et ingrédients supplémentaires figurant en caractères étroits d’au moins 7 points)
Les versions des articles 1 et 2 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible. 4 15.4(B) (éléments nutritifs et ingrédients supplémentaires figurant en caractères étroits d’au moins 6 points)
Les versions des articles 1 à 3 ne peuvent être présentées conformément au présent règlement sur 15 % ou moins de la surface exposée disponible.
Présentation des renseignements complémentaires
B.29.016 (1) Les renseignements visés à la colonne 1 du tableau de l’article B.29.003 qui sont indiqués dans la version du tableau des renseignements sur les aliments supplémentés se composant d’un tableau en anglais et d’un tableau en français ou d’un tableau en anglais ou en français sont présentés :
a) selon l’ordre, les retraits et les notes complémentaires indiqués aux figures 18.1(F) et (A) du Répertoire des modèles de TRAS;
b) quant aux autres caractéristiques de présentation, selon le modèle prévu à la figure applicable du Répertoire des modèles de TRAS.
(2) Les renseignements visés à la colonne 1 du tableau de l’article B.29.003 indiqués dans la version du tableau des renseignements sur les aliments supplémentés se composant d’un tableau en anglais et en français sont présentés :
a) selon l’ordre, les retraits et les notes complémentaires indiqués à la figure 19.1(B) du Répertoire des modèles de TRAS;
b) quant aux autres caractéristiques de présentation, selon le modèle prévu à la figure applicable du Répertoire des modèles de TRAS.
(3) Malgré l’alinéa (1)a), les retraits indiqués aux figures 18.1(F) et (A) du Répertoire des modèles de TRAS ne s’appliquent pas si les renseignements visés à la colonne 1 du tableau de l’article sont présentés selon le modèle linéaire visé à l’alinéa B.29.009(3)c) ou le modèle linéaire simplifié visé à l’alinéa B.29.010(3)c).
Autres modes de présentation
B.29.017 (1) Malgré l’article A.01.016 et sous réserve du paragraphe (2), le tableau des renseignements sur les aliments supplémentés qui répond aux critères mentionnés aux paragraphes B.29.009(3), B.29.010(3) ou B.29.011(3) ou à l’alinéa B.29.013(2)a) peut être placé sur, selon le cas :
a) une étiquette mobile attachée à l’emballage;
b) une notice d’accompagnement;
c) le verso d’une étiquette;
d) une étiquette dépliante;
e) un manchon, une surenveloppe ou un collier.
(2) Le tableau des renseignements sur les aliments supplémentés ne peut être placé conformément aux alinéas (1)b) ou c) si une liste des mises en garde doit figurer sur l’étiquette de l’aliment supplémenté.
(3) Si le tableau des renseignements sur les aliments supplémentés est placé conformément aux alinéas (1)b) ou c), le recto de l’étiquette en indique l’endroit en caractères d’au moins 8 points.
(4) Si le tableau des renseignements sur les aliments supplémentés est placé conformément au paragraphe (1), il est présenté :
a) dans le cas de tout aliment supplémenté visé au paragraphe B.29.009(3), selon l’une des versions prévues aux alinéas B.29.009(3)a) à c) ou selon l’une des versions figurant à la colonne 1 du tableau de l’article B.29.009;
b) dans le cas de tout aliment supplémenté visé au paragraphe B.29.010(3), selon l’une des versions prévues aux alinéas B.29.010(3)a) à c) ou selon l’une des versions figurant à la colonne 1 du tableau de l’article B.29.010;
c) dans le cas de tout aliment supplémenté visé au paragraphe B.29.011(3), selon l’une des versions prévues aux alinéas B.29.011(3)a) à c) ou selon l’une des versions figurant à la colonne 1 du tableau de l’article B.29.011;
d) dans le cas de tout produit préemballé contenant un assortiment d’aliments supplémentés visé à l’alinéa B.29.013(2)a), selon l’une des versions prévues au sous-alinéa B.29.013(2)a)(i) ou selon l’une des versions figurant à la colonne 1 du tableau de l’article B.29.013.
Petits emballages
B.29.018 (1) Malgré l’article A.01.016 et sous réserve du paragraphe (2), l’étiquette de tout aliment supplémenté dont la surface exposée disponible est de moins de 100 cm2 peut ne pas porter le tableau des renseignements sur les aliments supplémentés si son recto comporte des indications sur la manière dont l’acheteur ou le consommateur peut obtenir les renseignements qui devraient figurer dans le tableau.
(2) Le paragraphe (1) ne s’applique pas :
a) à l’aliment supplémenté lorsqu’une liste des mises en garde doit figurer sur son étiquette;
b) à l’aliment supplémenté faisant l’objet de l’une des déclarations ci-après sur son étiquette ou encore dans l’annonce faite par le fabricant de l’aliment ou sous ses ordres :
(i) toute indication de la valeur énergétique de l’aliment ou de sa teneur en un élément nutritif ou en un ingrédient supplémentaire,
(ii) toute déclaration indiquant expressément ou implicitement que l’aliment ou toute substance y étant contenue a des propriétés particulières liées à la nutrition ou à la santé, notamment une mention ou une allégation figurant à la colonne 4 du Tableau des mentions et des allégations autorisées concernant la teneur nutritive, à la colonne 1 du tableau suivant l’article B.01.603 ou aux articles B.01.311, D.01.006 ou D.02.004,
(iii) toute mention, tout nom, logo, symbole ou sceau d’approbation ou toute marque concernant la santé.
(3) Malgré l’alinéa (2)b), le paragraphe (1) s’applique à l’aliment supplémenté qui répond aux critères mentionnés à la colonne 2 de l’article 37 du Tableau des mentions et des allégations autorisées concernant la teneur nutritive en regard du sujet « Sans sucres » figurant à la colonne 1 si les conditions ci-après sont réunies :
a) l’aliment supplémenté ne fait l’objet d’aucune déclaration visée à l’alinéa (2)b), autre que :
(i) les mentions ou les allégations figurant à la colonne 4 de l’article 37 du Tableau des mentions et des allégations autorisées concernant la teneur nutritive en regard du sujet « Sans sucres » visé à la colonne 1,
(ii) la valeur énergétique de l’aliment exprimée en Calories par portion indiquée,
(iii) la teneur en polyalcools exprimée en grammes par portion indiquée;
b) toute mention ou toute allégation figurant à la colonne 4 de l’article 37 du Tableau des mentions et des allégations autorisées concernant la teneur nutritive en regard du sujet « Sans sucres » visé à la colonne 1 et figurant sur l’étiquette, à la fois :
(i) est lisible sur l’espace principal,
(ii) est en minuscules, à l’exception de la première lettre de chaque mot de la mention ou de l’allégation qui peut être majuscule,
(iii) est en caractères de dimensions au moins égales et aussi bien en vue que les caractères utilisés dans la portion numérique de la déclaration de la quantité nette, comme l’exigent l’alinéa 229(1)a) et les paragraphes 229(2) et (3) du Règlement sur la salubrité des aliments au Canada,
(iv) est d’une couleur faisant contraste avec le fond de l’étiquette;
c) la valeur énergétique exprimée en Calories par portion indiquée et la teneur en polyalcools exprimée en grammes par portion indiquée figurent immédiatement après celui des éléments suivants qui figure en dernier sur l’étiquette :
(i) la liste des ingrédients,
(ii) la mention des sources d’allergènes alimentaires ou de gluten et des sulfites ajoutés au sens du paragraphe B.01.010.1(1),
(iii) l’énoncé visé au paragraphe B.01.010.4(1),
(iv) toute mention visée au paragraphe B.01.014(1);
d) l’aliment supplémenté n’en est pas un pour lequel une liste des mises en garde doit figurer sur son étiquette.
(4) Les indications visées au paragraphe (1) répondent aux critères suivants :
a) elles sont présentées en caractères d’au moins 8 points;
b) elles comportent une adresse postale, une adresse de site Web ou un numéro de téléphone sans frais;
c) elles figurent :
(i) soit en français et en anglais,
(ii) soit dans l’une de ces langues, si, conformément au paragraphe B.01.012(3), les renseignements devant être indiqués sur l’étiquette de l’aliment supplémenté aux termes du présent règlement peuvent l’être uniquement dans la langue en cause et qu’ils y figurent dans celle-ci.
(5) Le fabricant de l’aliment supplémenté fournit les renseignements visés au paragraphe (1) à l’acheteur ou au consommateur sur demande :
a) sans frais;
b) de la façon suivante :
(i) soit dans la langue officielle dans laquelle les renseignements sont demandés ou, à la demande de l’acheteur ou du consommateur, dans les deux langues officielles,
(ii) soit dans l’une de ces langues, si, conformément au paragraphe B.01.012(3), les renseignements devant être indiqués sur l’étiquette de l’aliment aux termes du présent règlement peuvent l’être uniquement dans la langue en cause et qu’ils y figurent dans celle-ci;
c) sous forme d’un tableau des renseignements sur les aliments supplémentés qui est présenté, à la fois :
(i) selon un modèle — autre qu’un modèle horizontal — qui est prévu à l’un des articles B.29.009 à B.29.015 et qui, autrement, figurerait sur l’étiquette de l’aliment supplémenté conformément au présent règlement,
(ii) selon l’une des versions de ce modèle figurant à la colonne 1 de l’article 1 de toute partie du tableau de l’article applicable visé au sous-alinéa (i).
B.29.019 Si un aliment supplémenté a une surface exposée disponible de moins de 100 cm2 et porte un tableau des renseignements sur les aliments supplémentés sur son étiquette, ce tableau peut ne contenir que les seuls renseignements suivants :
a) la portion indiquée;
b) les renseignements visés à la colonne 1 des tableaux des articles B.29.002 ou B.29.003 relativement à la valeur énergétique de l’aliment supplémenté et à la teneur en tout élément nutritif ou ingrédient supplémentaire faisant l’objet d’une déclaration sur l’étiquette de l’aliment ou encore dans l’annonce d’un tel aliment faite par le fabricant de l’aliment ou sous ses ordres, si la déclaration indique expressément ou implicitement que l’aliment a des propriétés particulières liées à la nutrition ou à la santé, notamment une mention ou une allégation figurant à la colonne 4 du Tableau des mentions et des allégations autorisées concernant la teneur nutritive, à la colonne 1 du tableau suivant l’article B.01.603 ou aux articles B.01.311, D.01.006 ou D.02.004;
c) la teneur en tout polyalcool ajouté;
d) la teneur en gras saturés, en sucres ou en sodium si elle est égale ou supérieure au seuil applicable visé aux colonnes 2, 3, 5 ou 6 du tableau de l’article B.01.350;
e) la teneur en tout ingrédient supplémentaire pour lequel une mise en garde figurant sur la liste des mises en garde est applicable.
Mises en garde
B.29.020 (1) Toutes les mises en garde qui figurent à la colonne 4 de la Liste des ingrédients supplémentaires autorisés et qui s’appliquent aux ingrédients supplémentaires contenus dans un aliment supplémenté doivent satisfaire aux exigences suivantes :
a) elles figurent dans une liste figurant sur l’étiquette de l’aliment supplémenté;
b) elles sont regroupées et précédées du titre ci-après en caractères gras :
(i) « Attention », « Attention : » ou « Attention : », pour ce qui est de la version française,
(ii) « Caution », « Caution: » ou « Caution : » pour ce qui est de la version anglaise;
c) elles figurent sans qu’aucun texte imprimé ou écrit, ni aucun autre signe graphique ne soit intercalé entre le titre et la première mise en garde;
d) elles figurent en caractères ordinaires ou gras;
e) elles figurent en lettres minuscules, sauf pour ce qui est de la première lettre de chacune des mises en garde;
f) elles sont séparées entre elles par une puce ou une virgule.
(2) La liste des mises en garde est présentée de l’une des manières ci-après, ou des deux, de façon à ce qu’elle se démarque nettement sur l’étiquette :
a) elle est encadrée par une bordure ou délimitée par une ou plusieurs lignes continues tracées immédiatement au-dessus, au-dessous ou aux extrémités de la liste, qui sont de la même couleur que celle des caractères utilisés pour indiquer les renseignements visés au paragraphe B.01.008.1(1);
b) il y a un contraste entre la couleur de fond de la liste et la couleur de fond de la partie adjacente de l’étiquette, exception faite de la partie où figurent l’un ou l’autre des renseignements suivants :
(i) la liste des ingrédients,
(ii) la mention des sources d’allergènes alimentaires ou de gluten et des sulfites ajoutés au sens du paragraphe B.01.010.1(1),
(iii) l’énoncé visé au paragraphe B.01.010.4(1),
(iv) toute mention visée au paragraphe B.01.014(1),
(v) le tableau de la valeur nutritive,
(vi) le tableau des renseignements sur les aliments supplémentés.
(3) La liste des mises en garde précède ou suit, sans qu’aucun texte imprimé ou écrit ni aucun signe graphique ne soit intercalé :
a) en français et en anglais celle des versions française ou anglaise du tableau des renseignements sur les aliments supplémentés auquel elle est associée, dans le cas où le tableau apparaît de façon distincte dans ces deux langues;
b) en français et anglais le tableau des renseignements sur les aliments supplémentés apparaissant sous forme bilingue, les versions française et anglaise de la liste des mises en garde se suivant;
c) en français ou en anglais le tableau pouvant être fourni dans l’une de ces langues conformément au paragraphe B.01.012(3), comme les renseignements devant être indiqués sur l’étiquette aux termes du présent règlement peuvent l’être uniquement dans la langue en cause et qu’ils y figurent dans l’étiquette.
(4) Lorsque les versions française et anglaise de la liste des mises en garde figurent sur l’étiquette, elles sont présentées sur un espace continu de la surface exposée disponible de l’étiquette mais n’ont pas à être présentées sur le même.
(5) Lorsque les versions française et anglaise de la liste des mises en garde sont présentées sur un même espace continu de l’étiquette, celle des versions qui suit l’autre ne doit pas débuter sur la même ligne que celle où se termine cette autre version, sauf si la surface exposée disponible est de moins de 100 cm2.
Identifiant des aliments supplémentés avec mise en garde
Présentation
B.29.021 (1) L’espace principal d’un aliment supplémenté porte l’identifiant des aliments supplémentés avec mise en garde figurant à l’annexe K.2 si une liste des mises en garde figure sur son étiquette.
(2) L’identifiant des aliments supplémentés avec mise en garde est présenté en noir et blanc et conformément à l’identifiant figurant à l’annexe K.2.
(3) Sous réserve du paragraphe (4), l’identifiant des aliments supplémentés avec mise en garde est présenté selon l’un des modèles suivants :
a) le modèle standard unilingue, où figurent deux versions distinctes de l’identifiant, l’une en français (FS) et l’autre en anglais (AS);
b) le modèle standard bilingue (SB), où figure l’identifiant dans les deux langues officielles.
(4) Si la principale surface exposée est de 450 cm2 ou moins et que la largeur de chaque version du modèle standard unilingue de l’identifiant des aliments supplémentés avec mise en garde ou la largeur du modèle standard bilingue de l’identifant est supérieure à celle de l’espace principal, l’identifiant est présenté selon le modèle compact bilingue (CB), où figure l’identifiant dans les deux langues officielles.
(5) L’identifiant des aliments supplémentés avec mise en garde doit être présenté conformément aux spécifications applicables prévues dans le Répertoire des spécifications sur l’identifiant des aliments supplémentés avec mise en garde.
(6) Malgré le paragraphe (5), l’identifiant des aliments supplémentés avec mise en garde peut être de dimensions plus grandes que celles indiquées à la colonne 3 du tableau applicable du Répertoire des spécifications sur l’identifiant des aliments supplémentés avec mise en garde s’il est agrandi proportionnellement sur les plans vertical et horizontal.
(7) Si, conformément au paragraphe B.01.012(3), les renseignements devant être indiqués aux termes du présent règlement sur l’étiquette d’un aliment supplémenté peuvent l’être uniquement en français ou uniquement en anglais et qu’ils y figurent dans la langue en cause, l’identifiant des aliments supplémentés avec mise en garde peut être présenté dans l’espace principal de l’aliment dans cette langue sur tout espace continu de la surface exposée disponible.
(8) Lorsque l’identifiant des aliments supplémentés avec mise en garde est présenté selon le modèle bilingue, l’ordre de présentation des langues indiqué dans l’identifiant applicable figurant à l’annexe K.2 peut être inversé.
(9) Les caractères et les autres éléments de l’identifiant des aliments supplémentés avec mise en garde sont présentés de manière à ce qu’ils ne se touchent pas.
Emplacement
B.29.022 (1) L’identifiant des aliments supplémentés avec mise en garde est présenté :
a) dans le cas d’un aliment supplémenté dont l’espace principal est moins haut que large, dans la moitié droite de l’espace principal;
b) dans le cas de tout autre aliment supplémenté, dans la moitié supérieure de l’espace principal.
(2) L’identifiant des aliments supplémentés avec mise en garde est entouré d’un espace de dégagement qui satisfait aux exigences suivantes :
a) il a une largeur égale ou supérieure à celle prévue à la colonne 4 du tableau applicable du Répertoire des spécifications sur l’identifiant des aliments supplémentés avec mise en garde;
b) il ne contient aucun texte ni aucun autre signe graphique.
(3) Si un aliment supplémenté est de forme cylindrique, le bord extérieur de l’espace de dégagement est présenté à une distance qui représente au moins 10 % de la largeur de la principale surface exposée de l’emballage, à partir du bord des côtés gauche ou droit de cette surface.
(4) Dans le cas où il est impossible de se conformer à la fois aux règles prévues à l’alinéa (1)a) et au paragraphe (3), l’identifiant des aliments supplémentés avec mise en garde peut être présenté en partie dans la moitié gauche de l’espace principal dans la mesure où cela est nécessaire pour permettre l’application de ce paragraphe.
Orientation
B.29.023 L’identifiant des aliments supplémentés avec mise en garde est orienté dans le même sens que la plupart des autres renseignements figurant dans l’espace principal, sauf si l’espace principal figure sur le plan vertical et que la plupart des autres renseignements ne figurent pas parallèlement à la base de l’emballage, auquel cas il est orienté de manière à ce que les mots qui y figurent soient parallèles à la base.
Interdictions
B.29.024 Il est interdit d’étiqueter un produit préemballé au moyen d’un identifiant des aliments supplémentés avec mise en garde ou de vendre un produit ainsi étiqueté à moins qu’une liste des mises en garde ne figure sur son étiquette.
B.29.025 (1) Il est interdit d’étiqueter un produit préemballé au moyen d’une déclaration, y compris un mot, une expression, une illustration, un signe, une marque, un symbole ou un dessin, qui est susceptible d’être confondue avec l’identifiant des aliments supplémentés avec mise en garde ou de vendre un produit ainsi étiqueté.
(2) Pour l’application du paragraphe (1), la déclaration ne comprend pas le symbole nutritionnel.
Déclarations
B.29.026 (1) Malgré toute disposition du présent règlement, sont interdites, sur l’étiquette ou dans l’annonce de tout aliment supplémenté, les mentions ou les allégations indiquant qu’un ingrédient supplémentaire qui est un élément nutritif contenu dans l’aliment supplémenté est généralement reconnu comme aidant à entretenir les fonctions de l’organisme nécessaires au maintien de la santé, si l’ingrédient supplémentaire en est un pour lequel une mise en garde figurant dans la liste des mises en garde est applicable.
(2) Toutefois, de telles mentions ou de telles allégations sont permises sur l’étiquette ou dans l’annonce de tout aliment supplémenté si elles sont accompagnées d’une mention ou d’une allégation indiquant l’action ou les effets particuliers de l’ingrédient supplémentaire dans l’entretien des fonctions de l’organisme nécessaires au maintien de la santé.
(3) Lorsque les mentions ou les allégations visées au paragraphe (1) figurent sur l’étiquette ou dans l’annonce de l’aliment supplémenté, ces mentions ou allégations ainsi que celles visées au paragraphe (2) :
a) dans le cas où elles sont faites sur l’étiquette ou dans l’annonce, autre qu’une annonce radiophonique ou télévisée, de l’aliment supplémenté :
(i) se précèdent ou se suivent, sans qu’aucun texte imprimé ou écrit ni aucun signe graphique ne soient intercalés entre elles,
(ii) figurent en caractères de même taille et aussi bien en vue;
b) dans le cas où elles sont faites dans une annonce radiophonique ou dans la composante audio d’une annonce télévisée de l’aliment supplémenté, se précèdent ou se suivent immédiatement;
c) dans le cas où elles sont faites dans la composante visuelle de l’annonce télévisée de l’aliment supplémenté :
(i) paraissent en même temps et pendant la même durée,
(ii) se précèdent ou se suivent, sans qu’aucun texte imprimé ou écrit ni aucun signe graphique ne soient intercalés,
(iii) figurent en caractères de même taille et aussi bien en vue.
B.29.027 Malgré toute disposition du présent règlement, sont interdites, sur l’étiquette ou dans l’annonce de tout aliment supplémenté, les mentions ou les allégations indiquant qu’un élément nutritif qui y est contenu est généralement reconnu comme aidant à entretenir les fonctions de l’organisme nécessaires à la croissance et au développement normaux, si l’aliment supplémenté fait l’objet d’une mise en garde qui figure dans la liste des mises en garde et qui déconseille sa consommation par tout individu de moins de dix-huit ans appartenant à un groupe mentionné dans la mise en garde.
B.29.028 (1) Malgré toute disposition du présent règlement, sont interdites, sur l’étiquette ou dans l’annonce d’un aliment supplémenté, les déclarations, expresses ou implicites, relativement à toute vitamine ou à tout minéral nutritif qui sont contenus dans l’aliment, si la mention « teneur élevée en caféine » doit figurer sur l’étiquette de l’aliment conformément à la colonne 5 de la Liste des ingrédients supplémentaires autorisés.
(2) Le paragraphe (1) ne s’applique pas aux indications à l’égard des vitamines figurant dans la liste des ingrédients ou dans le tableau des renseignements sur les aliments supplémentés ou aux indications à l’égard des minéraux nutritifs figurant dans la liste des ingrédients, dans les symboles nutritionnels ou dans le tableau des renseignements sur les aliments supplémentés.
B.29.029 (1) Lorsqu’une liste des mises en garde figure sur l’étiquette d’un aliment supplémenté, les déclarations visées au paragraphe (2) doivent satisfaire aux exigences suivantes :
a) si la déclaration figure sur l’espace principal :
(i) la hauteur des lettres majuscules de la déclaration ne dépasse pas le double de la hauteur des lettres majuscules, sauf tout accent, paraissant dans l’identifiant des aliments supplémentés avec mise en garde, à l’exception des lettres des mots « Santé Canada » et « Health Canada »,
(ii) la hauteur de la hampe ascendante la plus élevée des lettres minuscules de la déclaration ne dépasse pas le double de la hauteur des lettres majuscules paraissant dans l’identifiant des aliments supplémentés avec mise en garde, à l’exception des lettres des mots « Santé Canada » et « Health Canada »;
b) si la déclaration figure sur une surface continue qui n’est pas l’espace principal :
(i) la hauteur des lettres majuscules de la déclaration ne dépasse pas le double de la hauteur des lettres majuscules, sauf tout accent, paraissant dans les mises en garde,
(ii) la hauteur de la hampe ascendante la plus élevée des lettres minuscules de la déclaration ne dépasse pas le double de la hauteur des lettres majuscules paraissant dans les mises en garde.
(2) Pour l’application du paragraphe (1), les déclarations sont les suivantes :
a) toute indication visée aux paragraphes B.01.301(1) ou (2);
b) toute déclaration indiquant expressément ou implicitement que l’aliment supplémenté ou toute substance y étant contenue a des propriétés particulières liées à la nutrition ou à la santé, notamment une mention ou une allégation figurant à la colonne 4 du Tableau des mentions et des allégations autorisées concernant la teneur nutritive, à la colonne 1 du tableau suivant l’article B.01.603 ou aux articles B.01.311, D.01.006 ou D.02.004;
c) toute mention, tout logo, symbole, sceau d’approbation ou toute marque concernant la santé.
(3) Le présent article ne s’applique pas à la marque ou au nom de produit de l’aliment supplémenté.
Falsification et exemptions
B.29.030 Un produit préemballé, autre qu’un aliment supplémenté, est falsifié s’il contient un aliment supplémenté à titre d’ingrédient.
B.29.031 Un produit préemballé, autre qu’un aliment supplémenté, est falsifié si une substance figurant à la colonne 1 de la Liste des ingrédients supplémentaires autorisés y a été ajoutée autrement que conformément au présent règlement.
B.29.032 Un aliment supplémenté ne contient pas de substance toxique ou délétère, ou n’en est pas recouvert, pour l’application de l’alinéa 4(1)a) de la Loi ou n’est pas falsifié, pour l’application de l’alinéa 4(1)d) de cette dernière, pour la seule raison qu’un ingrédient supplémentaire y a été ajouté.
PARTIE CDrogues
TITRE 1
Dispositions générales
C.01.001 (1) Dans la présente partie,
- antibiotique
antibiotique désigne toute drogue ou tout mélange de drogues, tels que ceux qui figurent aux articles C.01.410 à C.01.592, lesquels sont préparés à partir de certains microorganismes, ou l’ont été antérieurement, mais sont maintenant fabriqués par synthèse, et sont doués de propriétés inhibitrices de la croissance d’autres microorganismes; (antibiotic)
- arrêté d’urgence IVPD
arrêté d’urgence IVPD L’Arrêté d’urgence concernant l’importation, la vente et la publicité de drogues à utiliser relativement à la COVID-19, pris le 16 septembre 2020 par la ministre et publié le 3 octobre 2020 dans la Gazette du Canada, Partie I; (ISAD Interim Order)
- cesser
cesser S’entend, à l’égard de la vente d’une drogue par le fabricant à qui a été délivré le document prévu au paragraphe C.01.014.2(1) qui indique l’identification numérique attribuée à la drogue, du fait d’abandonner définitivement la vente de la drogue; (discontinue)
- COVID-19
COVID-19 La maladie à coronavirus 2019; (COVID-19)
- cuillerée à thé
cuillerée à thé désigne, aux fins du calcul d’une dose, un volume de cinq centimètres cubes; (teaspoon)
- date limite d’utilisation
date limite d’utilisation :
a) S’agissant d’une drogue sous forme posologique, celles des dates ci-après qui est antérieure à l’autre, indiquée au moins par l’année et le mois :
(i) la date jusqu’à laquelle la drogue conserve l’activité, la pureté et les propriétés physiques précisées sur l’étiquette,
(ii) la date après laquelle le fabricant recommande de ne plus utiliser la drogue;
b) s’agissant d’un ingrédient actif, celle des dates ci-après qui s’applique, indiquée au moins par l’année et le mois :
(i) la date de nouvelle analyse,
(ii) la date après laquelle le fabricant recommande de ne plus utiliser l’ingrédient actif; (expiration date)
- délai d’attente
délai d’attente Intervalle entre le moment de la dernière administration d’une drogue à un animal et le moment où la concentration de tout résidu de la drogue présent dans les tissus ou les produits prélevés chez l’animal pour servir d’aliment ne présente vraisemblablement plus de risques pour la santé de l’être humain; (withdrawal period)
- dose normale pour adultes
dose normale pour adultes désigne, dans le cas d’une drogue, la dose prescrite au titre 9; (adult standard dosage unit)
- dose normale pour enfants
dose normale pour enfants désigne, dans le cas d’une drogue, la dose prescrite au titre 9; (children’s standard dosage unit)
- drogue contre la COVID-19
drogue contre la COVID-19 Drogue, à l’exception d’un produit de santé animale, fabriquée ou vendue en vue d’être utilisée relativement à la COVID-19 ou présentée comme pouvant l’être; (COVID-19 drug)
- drogue officielle
drogue officielle désigne toute drogue
a) pour laquelle une norme est fixée dans le présent règlement, ou
b) pour laquelle une norme est fixée dans l’une des publications mentionnées à l’annexe B de la Loi, et non dans le présent règlement; (official drug)
- emballage protège-enfants
emballage protège-enfants désigne un emballage qui répond aux exigences du paragraphe (2); (child resistant package)
- encre pharmaceutique
encre pharmaceutique Ingrédient non médicinal ou mélange d’ingrédients non médicinaux utilisé pour imprimer des marques ou des symboles sur la drogue; (pharmaceutical ink)
- fiche d’observation
fiche d’observation Rapport détaillé renfermant les données pertinentes concernant l’utilisation d’une drogue chez un sujet; (case report)
- groupe d’essai
groupe d’essai désigne un groupe qui répond aux exigences du paragraphe (3); (test group)
- ingrédient non médicinal
ingrédient non médicinal Substance, autre qu’une drogue pharmacologiquement active, ajoutée à la drogue au cours de la fabrication et présente dans le produit fini; (non-medicinal ingredient)
- Liste A
Liste A Document intitulé Liste de certains ingrédients actifs pharmaceutiques antimicrobiens publié par le gouvernement du Canada sur son site Web, avec ses modifications successives; (List A)
- Liste B
Liste B Document intitulé Liste de certaines drogues pour usage vétérinaire qui peuvent être importées mais non vendues publié par le gouvernement du Canada sur son site Web, avec ses modifications successives; (List B)
- Liste C
Liste C Document intitulé Liste des produits de santé animale publié par le gouvernement du Canada sur son site Web, avec ses modifications successives; (List C)
- Liste D
Liste D Document intitulé Liste de certaines drogues sans ordonnance pouvant être distribuées à titre d’échantillons publié par le gouvernement du Canada sur son site Web, avec ses modifications successives; (List D)
- marque nominative
marque nominative Dans le cas d’une drogue, le nom en français ou en anglais, avec ou sans le nom d’un fabricant, d’une personne morale, d’une société de personnes ou d’un particulier :
a) qui lui a été attribué par le fabricant;
b) sous lequel elle est vendue ou fait l’objet de publicité;
c) qui sert à l’identifier; (brand name)
- nom propre
nom propre désigne, à l’égard d’une drogue, le nom en anglais ou en français
a) attribué à ladite drogue à l’article C.01.002,
b) figurant en caractères gras dans le présent règlement lorsqu’il est question de ladite drogue et, lorsque la drogue est distribuée sous une forme autre que celle qui est décrite dans la présente partie, le nom de la forme sous laquelle ladite drogue est distribuée,
c) spécifié dans la licence canadienne, dans le cas des drogues comprises à l’annexe C ou à l’annexe D de la Loi, ou
d) attribué, dans l’une des publications mentionnées à l’annexe B de la Loi, dans le cas des drogues non comprises aux alinéas a), b) ou c); (proper name)
- nom usuel
nom usuel Dans le cas d’une drogue, le nom en français ou en anglais sous lequel elle est :
a) généralement connue;
b) désignée dans des revues scientifiques ou techniques autres que les publications dont le nom figure à l’annexe B de la Loi; (common name)
- ordonnance
ordonnance désigne un ordre délivré par un praticien, spécifiant une quantité donnée de quelque drogue ou mélange de drogues à dispenser à la personne nommée dans ladite ordonnance; (prescription)
- parfum
parfum Ingrédient non médicinal ou mélange d’ingrédients non médicinaux ajouté à la drogue pour produire ou masquer une odeur; (fragrance)
- pharmacien
pharmacien Personne qui :
a) d’une part, est autorisée, notamment par un permis d’exercice, en vertu des lois d’une province à exercer la profession de pharmacien;
b) d’autre part, exerce la profession de pharmacien dans cette province; (pharmacist)
- pour cent
pour cent désigne le pourcentage en poids, à moins de précision contraire; (per cent)
- praticien
praticien Personne qui :
a) d’une part, est autorisée en vertu des lois d’une province à traiter les patients au moyen d’une drogue sur ordonnance;
b) d’autre part, exerce sa profession dans cette province; (practitioner)
- produit d’acétaminophène
produit d’acétaminophène s’entend au sens du titre 9; (acetaminophen product)
- produit de salicylate
produit de salicylate s’entend au sens du titre 9; (salicylate product)
- produit de santé animale
produit de santé animale L’une des drogues ci-après qui est sous forme posologique et qui n’est pas fabriquée, vendue ou présentée comme pouvant servir au diagnostic, au traitement, à l’atténuation ou à la prévention d’une maladie, d’un désordre, d’un état physique anormal ou de leurs symptômes :
a) une substance visée à la colonne I de la partie 1 de la Liste C qui correspond aux renseignements descriptifs visés aux colonnes II à V ou une combinaison de substances dont tous les ingrédients médicinaux sont des substances visées à la colonne I de la partie 1 de cette liste, si la combinaison correspond, pour chacune de ces substances, à la fois aux renseignements descriptifs visés aux colonnes II et III, et d’autre part à ceux visés aux colonnes IV et V, lesquels sont, au sein de chacune de ces colonnes, communs à ces substances;
b) un remède homéopathique visé à la colonne I de la partie 2 de la Liste C qui correspond aux renseignements descriptifs visés aux colonnes II à V ou une combinaison de remèdes homéopathiques visés à la colonne I de la partie 2 de cette liste, si la combinaison correspond, pour chacun de ces remèdes, à la fois aux renseignements descriptifs visés aux colonnes II et III, et d’autre part à ceux visés aux colonnes IV et V, lesquels sont, au sein de chacune de ces colonnes, communs à ces remèdes;
c) un remède traditionnel visé à la colonne I de la partie 3 de la Liste C qui correspond aux renseignements descriptifs visés aux colonnes II à V ou une combinaison de remèdes traditionnels visés à la colonne I de la partie 3 de cette liste, si la combinaison correspond, pour chacun de ces remèdes, à la fois aux renseignements descriptifs visés aux colonnes II et III, et d’autre part à ceux visés aux colonnes IV et V, lesquels sont, au sein de chacune de ces colonnes, communs à ces remèdes; (veterinary health product)
- réaction indésirable à une drogue
réaction indésirable à une drogue Réaction nocive et non intentionnelle à une drogue qui survient lorsque la drogue est utilisée selon les doses normales ou selon des doses expérimentales, aux fins du diagnostic, du traitement ou de la prévention d’une maladie ou de la modification d’une fonction organique; (adverse drug reaction)
- réaction indésirable grave à une drogue
réaction indésirable grave à une drogue Réaction nocive et non intentionnelle à une drogue qui est provoquée par toute dose de celle-ci et qui nécessite ou prolonge l’hospitalisation, entraîne une malformation congénitale ou une invalidité ou incapacité persistante ou importante, met la vie en danger ou entraîne la mort; (serious adverse drug reaction)
- réaction indésirable grave et imprévue à une drogue
réaction indésirable grave et imprévue à une drogue Réaction indésirable grave à une drogue, dont la nature, la gravité ou la fréquence n’est pas indiquée dans les mentions de risque figurant sur l’étiquette de la drogue; (serious unexpected adverse drug reaction)
- récipient immédiat
récipient immédiat Récipient qui est en contact direct avec la drogue; (immediate container)
- saveur
saveur Ingrédient non médicinal ou mélange d’ingrédients non médicinaux ajouté à la drogue pour produire ou masquer une saveur, à l’exclusion de ceux qui lui confèrent uniquement un goût sucré; (flavour)
- technicien en pharmacie
technicien en pharmacie Personne qui :
a) d’une part, est autorisée, notamment par un permis d’exercice, en vertu des lois d’une province à exercer la profession de technicien en pharmacie;
b) d’autre part, exerce la profession de technicien en pharmacie dans cette province; (pharmacy technician)
- titulaire de l’autorisation
titulaire de l’autorisation[Abrogée, DORS/2017-259, art. 1]
- usage interne
usage interne signifie l’absorption par la bouche ou l’application, en vue d’une action fonctionnelle, à toute partie du corps dans laquelle ladite drogue vient en contact avec une muqueuse; (internal use)
- usage parentéral
usage parentéral signifie l’administration d’une drogue au moyen d’une seringue hypodermique, d’une aiguille ou de quelque autre instrument, à travers ou dans la peau ou une muqueuse. (parenteral use)
(1.1) Pour l’application de la Loi, réaction indésirable grave à une drogue s’entend au sens du paragraphe (1).
(2) L’emballage protège-enfants est un emballage qui :
a) soit, lorsqu’il est soumis à un essai selon une méthode acceptable, répond aux exigences suivantes :
(i) dans le cas d’un groupe d’essai formé d’enfants, ne peut être ouvert :
(A) d’une part, par au moins 85 pour cent de ces enfants, sans démonstration préalable de la méthode d’ouverture,
(B) d’autre part, par au moins 80 pour cent de ces enfants, après démonstration de la méthode d’ouverture,
(ii) dans le cas d’un groupe d’essai formé d’adultes :
(A) peut être ouvert par au moins 90 pour cent de ces adultes,
(B) s’il s’agit d’un emballage conçu pour être refermé de façon à répondre aux exigences du sous-alinéa (i), peut être ainsi refermé par au moins 90 pour cent de ces adultes;
b) soit est conforme à l’une des normes suivantes :
(i) la norme CAN/CSA-Z76.1-M90 de l’Association canadienne de normalisation intitulée Emballages de sécurité réutilisables pour enfants, publiée en janvier 1990, compte tenu de ses modifications successives,
(ii) la norme européenne EN 28317 : 1992 intitulée Emballages à l’épreuve des enfants — Exigences et méthodes d’essai pour emballages refermables, adoptée par le Comité européen de normalisation le 30 octobre 1992 et homologuée par l’Association française de normalisation le 20 décembre 1992 et par la British Standards Institution le 15 février 1993, qui reproduit intégralement la norme internationale ISO 8317 : 1989, compte tenu de ses modifications successives,
(iii) l’article 1700.15 intitulé Poison prevention packaging standards, titre 16, du Code of Federal Regulations des États-Unis, compte tenu de ses modifications successives.
(3) Pour l’application du présent article, le groupe d’essai est constitué :
a) dans le cas des enfants, d’au moins 200 enfants qui :
(i) sont en santé et ne souffrent d’aucun handicap physique ou mental apparent,
(ii) sont âgés de 42 à 51 mois,
(iii) représentent dans une égale proportion, avec une marge de plus ou moins 10 pour cent, les divers âges, exprimés en mois, de 42 à 51 mois, calculés au mois près;
b) dans le cas des adultes, d’au moins 100 adultes qui :
(i) sont en santé et ne souffrent d’aucun handicap physique ou mental apparent,
(ii) sont âgés de 18 à 45 ans,
(iii) représentent dans une égale proportion, avec une marge de plus ou moins 10 pour cent, les divers âges, exprimés en années, de 18 à 45 ans, calculés à l’année près.
(4) Pour l’application du présent article, les modifications successives des normes visées à l’alinéa (2)b) entrent en vigueur à l’expiration du délai de 18 mois suivant la date désignée par l’autorité compétente comme étant celle de leur entrée en vigueur.
- DORS/80-543, art. 1
- DORS/85-966, art. 1
- DORS/86-93, art. 1
- DORS/87-484, art. 1
- DORS/92-654, art. 1
- DORS/93-202, art. 1
- DORS/95-411, art. 1
- DORS/95-521, art. 1
- DORS/96-399, art. 1
- DORS/96-240, art. 1
- DORS/97-543, art. 5
- DORS/2010-105, art. 1
- DORS/2013-74, art. 1
- DORS/2013-122, art. 3
- DORS/2016-139, art. 1
- DORS/2017-76, art. 1
- DORS/2017-133, art. 1
- DORS/2017-259, art. 1
- DORS/2020-74, art. 1
- DORS/2021-45, art. 1
- DORS/2021-46, art. 11(A)
- DORS/2022-197, art. 8
- DORS/2023-247, art. 1(F)
C.01.001A [Abrogé, DORS/98-423, art. 1]
C.01.002 Le nom propre d’une drogue qui figure vis-à-vis d’un numéro de poste dans le tableau suivant, dans la colonne intitulée « Noms chimiques et synonymes » doit être le nom qui figure vis-à-vis dudit poste, dans la colonne intitulé « Noms Propres ».
TABLEAU
| Poste no | Noms propres | Noms chimiques et synonymes |
|---|---|---|
| A.1 | Acépromazine  | 2-acétyl-10-(3-diméthylaminopropyl) phénothiazine |
| A.2 | Acétyminophène  | p-acétaminophénol, paracétamol, p-hydroxyacétanilide : N-acétyl-p aminophénol |
| A.3 | Acétanilide  | Acétylaminobenzone : antifébrine : phénylacétamide |
| A.4 | Acide acétylsalicylique  | Acide acétylsalicylique |
| A.5 | Allopurinol  | 1-H-Pyrazolo[3,4-d] pyrimidin-4-ol : 4-Hydroxypyrazolo(3,4-d) pyrimidine |
| A.6 | Amantadine  | 1-Adamantanamine |
| A.7 | Acide aminocaproïque  | 6-acide aminohexanoïque |
| A.8 | Aminoptérine  | N-4-(2,4-diamino-6-ptéridyl méthyl) amino-benzoyl-L-acide glutamique |
| A.9 | Aminopyrine : amidopyrine  | 1,5-diméthyl-2-phényl-4-diméthylamino-3-pyrazolone : diméthylaminophénazone |
| A.10 | Amitriptyline  | 3-(3-diméthylaminopropylidène)-1,2: 4,5-dibenzocyclohepta-1,4-diène |
| A.11 | Azacyclonol  | α,α-diphényl-4-pipéridine carbinol |
| B.1 | Bémégride  | 3-éthyl-3-méthylglutarimide |
| B.2 | Bénactyzine  | Diméthylaminoéthyl-1,1-diphénylglycolate |
| B.3 | Bendrofluméthiazide  | 3-benzyl-3,4-dihydro-6-(trifluorométhyl)-2H-1,2,4-benzothiadiazine-7-sulfonamide-1,1-dioxide : Bendrofluazide (B.A.N.) |
| B.4 | Bétahistine  | 2-[2-(Méthylamino)éthyl]pyridine |
| B.5 | Béthanidine  | N-Benzyl-N′N″-diméthylguanidine : 1-Benzyl-2,3-diméthylguanidine |
| B.6 | Brétylium (Tosylate de)  | Tosylate de N-2-bromobenzyl-N-éthyl-N,N-diméthylammonium (acide tosylique est le nom vulgaire de l’acide p-toluénesulphonique) |
| B.7 | Bromisoval  | 2-monobromo-isovalérylurée : bromisovalum : bromévalitone |
| C.1 | Calcium, carbimide de  | Cyanamide de calcium |
| C.2 | Captodiamine  | Sulfure de 4-butylthio-α-phénylbenzyl-2-diméthylaminoéthyl |
| C.3 | Carisoprodol  | Dicarbamate de N-isopropyl-2-méthyl-2-propyl-1,3-propanediol |
| C.4 | Carphénazine  | 1-[10-(3[4-(2-hydroxyéthyl)-1-piperazinyl] propyl) phénothiazine-2yl]-1-propapone |
| C.5 | Céphaloridine  | 7-[2-Thiényl)acétamido]-3-(1-pyridylméthyl)-3-céphem-4-carboxylique acide betaïne |
| C.6 | Chlormézanone  | 1-bioxyde de 2-(4-chlorophényl)-3-méthyl-4-métathiazanone-1: chlorméthazanone : chorméthazone |
| C.7 | Chlorométhapyrilène  | N,N-diméthyl-N′-(2-pyridyl)-N′-(5-chloro-2-thényl)-éthylénédiamine : chlorothène |
| C.8 | Chlorphènetermine  | 4-chloro-α,α-diméthylphénéthylamine |
| C.9 | Cinchocaïne  | 2-butoxy-N-(2-diéthylaminoéthyl) cinchoninamide : dibucaïne |
| C.10 | Cinchophène  | Acide carboxylique de 2-phénylquinoléine-4-quinophane |
| C.11 | Clofibrate  | Éthyl 2-(p-Chlorophénoxy)-2-méthylpropionate |
| C.12 | Clomiphène  | 1-Chloro-2-[4(2-diéthylaminoéthoxy)phényl]-1,2-diphényléthylène : 2-[p-(2-Chloro-1,2-diphénylvinyl) phenoxy]triéthylamine |
| D.1 | Désipramine  | 5-(3-méthylaminopropyl)-10,11-dihydro-5H-dibenz[b,f]azépine |
| D.2 | Diazépame  | 7-chloro-1,3-dihydro-1-méthyl-5-phényl-2H-1,4-benzodiazépin-2-one |
| D.3 | Diéthylpropion  | 1-phényl-2-diéthylaminopropanone-1 |
| D.4 | Diphénidol  | 1,1-Diphényl-4-piperidinobutan-1-ol |
| D.5 | Disulfiram  | Bisulfure de tétraéthylthiurame |
| E.1 | Ectylurée  | 2-éthyl-cis-crotonylurée |
| E.2 | Émylcamate  | Carbamate de 1-éthyl-1-méthylpropyl |
| E.3 | Éthacrynique (Acide)  | [2,3-Dichloro-4-(2-méthylènebutyryl) phénoxy]acetique acide : 2,3-Dichloro-4-(2-éthylacryloyl)phénoxyacetique acide |
| E.4 | Ethchlorvynol  | 3-(2-chlorovynil)-1-pentyne-3-ol |
| E.5 | Éthinamate  | Carbamate de 1-éthynylcyclohexyl |
| E.6 | Éthionamide  | 2-éthylisonicotinthioamide |
| E.7 | Éthomoxane  | 2-n-butylaminoéthyl-8-éthoxybenzo-1,4-dioxane |
| E.8 | Éthyl (Trichloramate d’)  | Carbamate d’éthyl n-[1-(2,2,2-trichloro-1-hydroxyéthyl)] |
| E.9 | Étryptamine  | 3-(2-aminobutyl) indole |
| E.10 | Étymémazine  | 10-(3-diméthylamino-2-méthylpropyl)-2-éthylphénothiazine |
| F.1 | Fluphénazine  | 10-[3-[4-(2-hydroxyéthyl)pipérazine-1-yl]propyl]-2-trifluorométhylphénothiazine |
| F.2 | Furosémide  | 4-Chloro-N-furfuryl-5-sulphamoylanthranilique acide : frusemide (B.A.N.) |
| G.1 | Glyburide  | [[(chloro-5 méthoxy-2 benzamido)-2 éthyl]-4 phénylsulfonyl]-1 cyclohexyl-3 urée : Glibenclamide |
| H.1 | Halopéridol  | 4-(4-Chlorophényl)-1-[3-(4-fluorobenzoyl) propyl]-pipéridine-4-ol :4-[4-(p-Chlorophényl)-4-hydroxypipéridino]-4’-fluorobutyrophénone |
| H.2 | Hydroxychloroquine  | 7-chloro-4[4-(N-éthyl-N-2-hydroxyéthylamino)-1-méthylbutyl-amino] quinoline |
| H.3 | Hydroxyzine  | 1-(p-chloro-α-phénylbenzyl)-4-(2-hydroxy éthoxyéthyl) pipérazine |
| I.1 | Idoxuridine  | 5-iodo-2′-déoxyuridine |
| I.2 | Imipramine  | 5-(3-diméthylaminopropyl)-10,11-dihydro-5H-dibenz[b,f]azépine |
| I.3 | Indométhacine  | Acide acétique de 1-(p-chlorobenzoyl)-5-méthoxy-2-méthylindole-3 |
| I.4 | Iproniazide  | 1-isonicotinoyl-2-isopropylhydrazine |
| I.5 | Isocarboxazide  | 3-N-benzylhydrazinocarbonyl-5-méthylisoxazole |
| I.6 | Isoprotérénol  | Alcool benzylique de 3,4-dihydroxy-α-[(isopropylamino)méthyl]:isoprénaline |
| L.1 | Liothyronine  | Acide propionique de L-α-amino-3-[(4-hydroxy-3-iodophénoxy)-3,5-di-iodophényl] |
| M.1 | Méfénamique (Acide)  | Acide anthranilique de N-(2,3-xylyl) |
| M.2 | Melphalan  | 4-di-(2-chloréthyl)amino-L-phénylalanine |
| M.3 | Mépazine  | 10-[(1-méthyl-3-pipéridyl)méthyl] phénothiazine |
| M.4 | Méphénésine  | 3-o-toloxy-1,2-propanediol |
| M.5 | Méphénoxalone  | 5-(o-méthoxyphénoxyméthyl)-2-oxazolidinone |
| M.6 | Méprobamate  | 2,2-di(carbamoylméthyl) pentane |
| M.7 | Méthaqualone  | 2-méthyl-3-o-tolyquinazoline-4-one : 2-méthyl-3-o-tolyl-4-quinazolone |
| M.8 | Méthisazone  | 1-Méthylindoline-2,3-dione-3-thiosémicarbazone : N-Méthylisatin-ß-thiosémicarbazone |
| M.9 | Méthotriméprazine  | 10-[3-(2-méthyl)diméthylamino propyl]-2-méthoxyphénothiazine : lévomépromazine |
| M.10 | Méthyldopa  | 1-3-(3,4-dihydroxyphényl)-2-méthylalanine |
| M.11 | Méthylparafynol  | 3-méthyl-1-pentyne-3-ol : méthyl-pentynol |
| M.12 | Méthylphénidate  | Acétate de méthyl-1-phényl-1-(2-pipéridyl) |
| M.13 | Méthyprylon  | 3,3-diéthyl-5-méthyl-2,4-pipéridinedione |
| M.14 | Méthysergide  | Acide 1-méthyl-d-lysergique de 1-(hydroxyméthyl) propylamide |
| M.15 | Métyrapone  | 2-méthyl-1,2-di(3-pyridyl)propane-1-one |
| N.1 | Nalidixique (Acide)  | Acide carboxylique de 1-éthyl-7-méthyl-4-oxo-1,8-naphthyridine-3 |
| N.2 | Nialamide  | 1-[2-(benzylcarbamyl) éthyl]-2-isonicotinoylhydrazine |
| N.3 | Nortriptyline  | 3-(3-méthylaminopropylidène)-1,2:4,5-dibenzocyclohepta-1,4-diène |
| O.1 | Oxanimide  | 2-éthyl-3-propyl-glycidamide |
| O.2 | Oxazépam  | 7-chloro-1,3-dihydro-3-hydroxy-5-phényl-1,4-benzodiazépine-2-one |
| O.3 | Oxyphenbutazone  | 4-n-butyl-2(4-hydroxyphényl)-1-phénylpyrazolidine-3,5-dione |
| P.1 | Paraméthadione  | 3,5-diméthyl-5-éthyl-2,4-oxazolidinedione |
| P.2 | Pargyline  | N-benzyl-N-méthylprop-2-ynylamine |
| P.3 | Pémoline  | 2-imino-5-phényloxazolidine-4-one |
| P.4 | Pentazocine  | 1,2,3,4,5,6-Hexahydro-8-hydroxy-6,11-diméthyl-3-(3-méthylbut-2-ényl)-2,6-méthano-3-benzazocine : 1,2,3,4,5,6-Hexahydro-6,11-diméthyl-3-(3-méthyl-2-butényl)-2,6-méthano-3-benzazocine-8-ol |
| P.5 | Pentolinium (Tartrate de)  | NN′-pentaméthylènedi-(tartrate d’hydrogène de méthylpyrrolidinium) |
| P.6 | Perphénazine  | 2-chloro-10-[3-[1-(2-hydroxyéthyl)-4-pipérazinyl]propyl] phénothiazine |
| P.7 | Phacétopérane  | l-1-phényl-1-(2′-pipéridyl)-1-acétoxyméthane |
| P.8 | Phénacémide  | Phénylacétylurée |
| P.9 | Phénacétine  | p-acétphénétidine :acétphénétidine : acétophénétidine :p-éthoxy-acétanilide |
| P.10 | Phènaglycodol  | 2-p-chlorophényl-3-méthyl-2,3-butanediol |
| P.11 | Phènedimétrazine  | 3,4-diméthyl-2 phénylmorpholine |
| P.12 | Phénelzine  | 2-phényléthylhydrazine |
| P.13 | Phèneformine  | N′-ß-phénéthylformamidinyliminourée |
| P.14 | Phéniprazine  | α-méthylphénéthylhydrazine |
| P.15 | Phénemétrazine  | Tétrahydro-3-méthyl-2-phényl-1,4-oxazine : 3-méthyl-2-phénylmorpholine |
| P.16 | Phènetermine  | α,α-diméthylphénéthylamine : phényl-tert-butylamine |
| P.17 | Phénylindanédione  | 2-phénylindane-1,3-dione |
| P.18 | Phényltoloxamine  | N,N-diméthyl-2-(α-phényl-o-tolyloxy) éthylamine |
| P.19 | Pholédrine  | p-(4-hydroxyphényl)-isopropylméthylamine |
| P.20 | Piperliate  | Benzilate de 1-pipéridine-éthanol |
| P.21 | Pipradrol  | Diphényl-2-pipéridylméthanol |
| P.22 | Prochlorpérazine  | 2-chloro-10-[3-(1-méthyl-4-pipérazinyl)propyl]phénothiazine |
| P.23 | Prodilidine  | Propionate de 1,2-diméthyl-3-phényl-3-pyrrolidinyl |
| P.24 | Propranolol  | 1-(Isopropylamino)-3-(1-naphthyloxy)-2-propanol |
| P.25 | Prothipènedyl  | 9-(3-diméthylaminopropyl)-10-thia-1,9-diaza-anthracène |
| P.26 | Protriptyline  | 7-(3-Méthylaminopropyl)-1,2:5,6-dibenzocycloheptatrien :N-Méthyl-5H-dibenzo [a,d] cycloheptène-5-propylamine |
| P.27 | Pyrazinamide  | Amide acido-pyrazinoïque |
| R.1 | Rifampin  | 3-{[(4-méthyl-1-pipérazinyl)imino]méthyl} rifamycine SV :Rifampicine (I.N.N.) (Rifamycine SV, antibiotique produit par le streptomyces mediterranei) |
| S.01 | Cromoglicate sodique  | Sel disodique de l’acide [(hydroxy-2 propanediyl-1,3) bis(oxy)]-5,5′ bis[oxo-4(4H) α-benzopyranne-carboxylique-2]: |
| (Hydroxy-2 triméthylènedioxy)-5,5′ bis[oxo-4(4H) α-benzopyranne-carboxylate-2] disodique : Dioxo-4,4′ (hydroxy-2 triméthylènedioxy)-5,5′ bis(chromène-carboxylate-2) disodique : Cromolyn sodium (USP) : Cromoglicate disodique : bis(carboxylate-2 de sodium oxo-4 chroményl-5 oxy)-1,3 propanol-2: | ||
| S.1 | Sulfameter  | 2-(4-Aminobenzènesulphonamido)-5-méthoxypyrimidine :N′-(5-méthoxy-2-pyrimidinyl) sulfanilamide : Sulfaméthoxydiazine (B.A.N.) |
| S.2 | Sulfaméthazine  | N′-(4,6-diméthyl-2-pyrimidyl) sulfanilamide : 2-(p-aminobenzènesulfonamide)-4,6-diméthylpyrimidine :sulfadimédine |
| S.3 | Sulfinpyrazone  | 1,2-diphényl-4-(2-phénylsufiniléthyl)-3,5-pyrazolidinedione |
| S.4 | Sulfisoxazole  | 3,4-diméthyl-5-sulfanilamidoisoxazole : sulfafurazole |
| T.1 | Tétracaïne  | 2-diméthylaminoéthyl-p-n-butylaminobenzoate :améthocaïne |
| T.2 | Thiéthylpérazine  | 2-éthylthio-10-[3-(4-méthylpipérazine-1-yl)propyl] phénothiazine |
| T.3 | Thiopropazate  | 2-chloro-10-[3-[1-(2-acétoxyéthyl)-4-pipérazinyl]propyl] phénothiazine |
| T.4 | Thiopropérazine  | 2-diméthylsulphamoyl-10-[3-(4-méthylpipérazine-1-yl)-propyl]phénothiazine |
| T.5 | Thioridazine  | 10-[2-[2-(1-méthylpipéridyl)] éthyl]-2-méthylthiophénothiazine |
| T.6 | Tranylcypromine  | Trans d, 1-2-phénylcyclopropylamine |
| T.7 | Triamtérène  | 2,4,7-triamino-6-phénylptéridine |
| T.8 | Triflupromazine  | 10-(3-diméthylaminopropyl)-2-trifluorométhylphénothiazine : fluopromazine |
| T.9 | Triméprazine  | 10-(3-diméthylamino-2-méthylpropyl)phénothiazine |
| T.10 | Triméthadione  | 3,5,5-triméthyl-2,4-oxazolidinedione :troxidone |
| T.11 | Trimipramine  | 5-(3-diméthylamino-2-méthylpropyl)-10,11-dihydro-5H-dibenz [b,f]azépine : 5-(3′-diméthylamino-2′-méthylpropyl)iminodibenzyl |
| T.12 | Tybamate  | 2-méthyl-2-propyltriméthylène butylcarbamate :2-(hydroxyméthyl)-2-méthylpentyl butylcarbamate carbamate |
| V.1 | Vinblastine  | Alcaloïde dérivé du Vinca rosea |
| V.2 | Vincristine  | Alcaloïde dérivé du Vinca rosea |
- DORS/87-565, art. 1
- DORS/88-182, art. 1(F)
- DORS/88-482, art. 1
- DORS/90-173, art. 1(F)
C.01.003 Il est interdit de vendre une drogue qui n’est pas étiquetée selon le présent règlement.
- DORS/80-544, art. 1
C.01.004 (1) Les étiquettes intérieure et extérieure d’une drogue doivent porter
a) sur l’espace principal :
(i) le nom propre, s’il y a lieu, de la drogue inscrit immédiatement avant ou après la marque nominative de celle-ci, le cas échéant, en caractères d’une taille au moins égale à la moitié de celle des caractères de la marque nominative,
(ii) le nom usuel de la drogue à défaut d’un nom propre,
(iii) si une norme est prescrite pour la drogue au titre 6 de la présente partie, une déclaration attestant que la drogue est conforme à la norme canadienne, pour laquelle l’abréviation D.N.C. peut être utilisée,
(iv) si une norme n’est pas prescrite pour la drogue au titre 6 de la présente partie mais figure dans une publication mentionnée à l’annexe B de la Loi, le nom de la publication qui contient cette norme, ou son abréviation donnée à l’annexe B de la Loi, ou, s’il s’agit d’une norme du fabricant, une déclaration en ce sens,
(v) en français et en anglais, la mention « stérile » « sterile » s’il s’agit d’une drogue dont l’état stérile est exigé par le présent règlement;
b) sur le quart supérieur gauche de l’espace principal :
(i) le symbole « Pr », s’il s’agit d’une drogue sur ordonnance, lequel symbole ne peut figurer sur l’étiquette d’aucune autre drogue,
(ii) le symbole «
 » inscrit clairement, d’une couleur et de dimensions bien visibles, s’il s’agit d’une drogue contrôlée autre qu’une drogue contrôlée contenue dans un implant agricole et mentionnée à la partie III de l’annexe de la partie G,
» inscrit clairement, d’une couleur et de dimensions bien visibles, s’il s’agit d’une drogue contrôlée autre qu’une drogue contrôlée contenue dans un implant agricole et mentionnée à la partie III de l’annexe de la partie G,(iii) le symbole « N » d’une couleur faisant contraste avec le reste de l’étiquette ou en caractères d’au moins la moitié de la taille de toute autre lettre utilisée sur l’étiquette, s’il s’agit d’un stupéfiant au sens du Règlement sur les stupéfiants,
(iv) s’il s’agit d’une substance ciblée au sens de l’article 1 du Règlement sur les benzodiazépines et autres substances ciblées, le symbole suivant, d’une couleur contrastant avec le reste de l’étiquette et en caractères d’au moins la moitié de la taille de toute autre lettre utilisée sur l’espace principal :

c) sur une partie quelconque :
(i) le nom et l’adresse du fabricant de la drogue,
(ii) le numéro de lot de la drogue,
(iii) le mode d’emploi approprié de la drogue, sauf s’il s’agit d’une drogue à laquelle s’applique l’article C.01.004.02,
(iv) une liste quantitative des ingrédients médicinaux de la drogue, désignés par leurs noms propres ou, à défaut, par leurs noms usuels, sauf s’il s’agit d’une drogue à laquelle s’applique l’article C.01.004.02,
(v) la date limite d’utilisation de la drogue,
(vi) dans le cas d’une drogue nouvelle pour usage exceptionnel à l’égard de laquelle un avis de conformité a été délivré en application de l’article C.08.004.01, la mention suivante, inscrite en majuscules et de façon lisible :
« SANTÉ CANADA A AUTORISÉ LA VENTE DE CETTE DROGUE NOUVELLE POUR USAGE EXCEPTIONNEL AUX FINS DE [indication de la fin] EN SE FONDANT SUR DES ESSAIS CLINIQUES RESTREINTS CHEZ L’ÊTRE HUMAIN.
HEALTH CANADA HAS AUTHORIZED THE SALE OF THIS EXTRAORDINARY USE NEW DRUG FOR [naming purpose] BASED ON LIMITED CLINICAL TESTING IN HUMANS. ».
(1.1) à (1.5) [Abrogés, DORS/2014-158, art. 3]
(2) Outre les exigences du paragraphe (1), les renseignements ci-après figurent sur l’étiquette extérieure d’une drogue :
a) le contenu net du contenant de la drogue, en termes de poids, de volume ou de nombre;
b) dans le cas d’une drogue à usage parentéral, une liste quantitative de tous les agents de conservation incorporés à la drogue, désignés par leur nom propre ou, à défaut, par leur nom usuel; et
c) dans le cas d’une drogue pour usage humain qui contient du mercure ou l’un de ses sels ou dérivés utilisé comme agent de conservation, une liste quantitative de tous les agents de conservation mercuriels incorporés à la drogue, désignés par leur nom propre ou, à défaut, par leur nom usuel.
(3) Lorsque le contenant d’une drogue est trop petit pour avoir une étiquette intérieure conforme aux exigences du présent règlement, la drogue est soustraite à ces exigences d’étiquetage :
a) s’il y a une étiquette extérieure conforme aux dispositions d’étiquetage du présent règlement; et
b) si l’étiquette intérieure indique
(i) le nom propre de la drogue ou, à défaut, son nom usuel, ou la marque nominative s’il s’agit d’une drogue renfermant plus d’un ingrédient médicinal,
(ii) l’activité de la drogue, sauf si, dans le cas d’une drogue renfermant plus d’un ingrédient médicinal, le nom utilisé conformément au sous-alinéa (i) est unique en ce qui a trait à une activité particulière de la drogue,
(iii) le contenu net du récipient de la drogue, s’il ne s’agit pas d’une drogue sous une forme posologique déterminée,
(iv) la voie d’administration s’il ne s’agit pas de la voie orale,
(v) le numéro de lot de la drogue,
(vi) le nom du fabricant de la drogue,
(vii) la date limite d’utilisation de la drogue,
(viii) l’indication de caractéristiques spéciales de la forme posologique si elles ne sont pas manifestes d’après le nom de la drogue visé au sous-alinéa (i) ou (ii).
(4) [Abrogé, DORS/92-654, art. 2]
(5) Le présent article ne s’applique pas
a) à une drogue vendue à un fabricant de drogues; ni
b) à une drogue vendue sur ordonnance si l’étiquette de la drogue porte le mode d’emploi approprié de la drogue et est conforme à l’article C.01.005.
- DORS/80-543, art. 2
- DORS/81-334, art. 1(A)
- DORS/85-715, art. 2
- DORS/89-229, art. 1
- DORS/90-216, art. 1
- DORS/90-586, art. 1
- DORS/92-654, art. 2
- DORS/93-202, art. 2
- DORS/97-228, art. 1
- DORS/97-515, art. 1
- DORS/2000-219, art. 1
- DORS/2001-181, art. 4
- DORS/2010-105, art. 2
- DORS/2011-88, art. 1
- DORS/2013-122, art. 4 et 5
- DORS/2014-158, art. 3
- DORS/2019-170, art. 18
- DORS/2023-247, art. 2
C.01.004.01 (1) Toute étiquette d’une drogue pour usage humain sous forme posologique porte ce qui suit :
a) le numéro de téléphone, l’adresse électronique, l’adresse du site Web ou l’adresse postale d’une personne-ressource au Canada, ou tout autre renseignement permettant de contacter cette dernière;
b) une mention que tout préjudice à l’égard de la santé d’une personne soupçonné d’être lié à l’utilisation de la drogue peut être porté à l’attention de cette personne-ressource.
(2) Le paragraphe (1) ne s’applique pas :
a) aux étiquettes d’une drogue mentionnée aux annexes C ou D de la Loi et qui est sous forme posologique;
b) aux étiquettes intérieure et extérieure d’une drogue à laquelle s’applique l’article C.01.004.02.
- DORS/2014-158, art. 4
C.01.004.02 (1) Outre les exigences de l’article C.01.004, l’étiquette extérieure d’une drogue pour usage humain sous forme posologique porte soit un tableau bilingue, placé sur un espace quelconque, qui ne présente que les renseignements ci-après en français et en anglais, soit un tableau en français et un tableau en anglais — chaque tableau étant placé sur un espace quelconque —, qui ne présentent que ces renseignements :
a) le mode d’emploi approprié de la drogue;
b) une liste quantitative des ingrédients médicinaux de la drogue, désignés par leurs noms propres ou, à défaut, par leurs noms usuels;
c) la liste des ingrédients non médicinaux de la drogue, par ordre alphabétique ou par ordre décroissant de leur proportion respective dans celle-ci, précédée d’une mention qui les distingue clairement des ingrédients médicinaux;
d) les renseignements visés au paragraphe C.01.004.01(1).
(2) Dans le cas où l’emballage est trop petit pour avoir une étiquette extérieure où figurent soit un tableau bilingue qui donne la liste des ingrédients non médicinaux, soit deux tableaux unilingues qui donnent cette liste, celle-ci est présentée en français et en anglais sur une étiquette mobile, un ruban ou une carte attachés à l’emballage.
(3) Dans le cas où une encre pharmaceutique, un parfum ou une saveur sont ajoutés à la drogue, les mentions ci-après peuvent remplacer, sur la liste des ingrédients non médicinaux, l’énumération de chacun des ingrédients en question, pour en indiquer l’ajout :
a) s’agissant du tableau bilingue visé au paragraphe (1), les mentions « encre pharmaceutique/pharmaceutical ink », « parfum/fragrance » ou « saveur/flavour »;
b) s’agissant des tableaux unilingues visés au paragraphe (1) :
(i) pour ce qui est du tableau en français, les mentions « encre pharmaceutique », « parfum » ou « saveur »,
(ii) pour ce qui est du tableau en anglais, les mentions « flavour », « fragrance » ou « pharmaceutical ink ».
(4) Dans le cas où la composition de la drogue varie de lot en lot relativement à ses ingrédients non médicinaux :
a) s’agissant du tableau bilingue visé au paragraphe (1), ce tableau porte une mention de tout substitut d’ingrédient non médicinal susceptible de se trouver dans la drogue, précédée du symbole « +/– » ou « ± » ou de la mention « ou/or » ou « peut contenir/may contain »;
b) s’agissant des tableaux unilingues visés au paragraphe (1) :
(i) pour ce qui est du tableau en français, ce tableau porte une mention de tout substitut d’ingrédient non médicinal susceptible de se trouver dans la drogue, précédée du symbole « +/– » ou « ± » ou de la mention « ou » ou « peut contenir »,
(ii) pour ce qui est du tableau en anglais, ce tableau porte une mention de tout substitut d’ingrédient non médicinal susceptible de se trouver dans la drogue, précédée du symbole « +/– » ou « ± » ou de la mention « or » ou « may contain ».
(5) Pour l’application des alinéas (3)a) et (4)a), les termes anglais des mentions qui y sont prévues peuvent paraître en premier.
(6) Les paragraphes (1) à (5) ne s’appliquent pas :
a) aux drogues sur ordonnance;
b) aux drogues qui peuvent être vendues sans ordonnance mais à administrer uniquement sous la surveillance d’un praticien;
c) aux drogues qui sont présentées comme étant destinées exclusivement à la désinfection de surfaces dures non poreuses.
- DORS/2014-158, art. 5
- DORS/2017-18, art. 23
- DORS/2018-69, art. 13
- DORS/2021-46, art. 5
C.01.004.03 Outre les exigences de l’article C.01.004, l’étiquette intérieure d’une drogue à laquelle s’applique l’article C.01.004.02 porte, sur un espace quelconque :
a) le mode d’emploi approprié de la drogue;
b) une liste quantitative des ingrédients médicinaux de la drogue, désignés par leurs noms propres ou, à défaut, par leurs noms usuels;
c) les renseignements visés au paragraphe C.01.004.01(1).
- DORS/2014-158, art. 5
C.01.004.1 (1) Il est interdit d’importer une drogue sous forme posologique en vue de la vente à moins qu’une personne ne soit responsable au Canada de la vente de cette drogue.
(2) Il est interdit à toute personne qui importe une drogue sous forme posologique de vendre un lot ou un lot de fabrication de cette drogue, à moins que son nom et l’adresse du principal établissement au Canada de la personne responsable de la vente de cette drogue ne figurent sur l’étiquette intérieure et sur l’étiquette extérieure de la drogue.
- DORS/82-524, art. 1
- DORS/93-475, art. 1
- DORS/97-12, art. 2
C.01.005 (1) L’espace principal de l’étiquette intérieure et de l’étiquette extérieure d’une drogue sous forme posologique indique l’identification numérique attribuée à la drogue, précédée de la mention « Drogue : identification numérique » ou de la mention « Drug Identification Number », ou des deux, ou de l’abréviation « DIN ».
(2) Le paragraphe (1) ne s’applique pas :
a) à la drogue sous forme posologique préparée par un pharmacien, conformément à une ordonnance, ou par un praticien;
b) à la drogue sous forme posologique vendue conformément à une ordonnance si les renseignements ci-après figurent sur l’étiquette de la drogue :
(i) le nom propre, le nom usuel ou la marque nominative de la drogue,
(ii) l’activité de la drogue,
(iii) le nom du fabricant de la drogue.
(3) Au présent article et aux articles C.01.005.1 et C.01.014, drogue sous forme posologique s’entend d’une drogue prête à être utilisée par le consommateur sans devoir faire l’objet d’aucun autre processus de fabrication.
(4) et (5) [Abrogés, DORS/81-248, art. 1]
- DORS/81-248, art. 1
- DORS/93-202, art. 3
- DORS/98-423, art. 2
- DORS/2001-181, art. 4
- DORS/2017-259, art. 2
- DORS/2018-69, art. 27
- DORS/2018-77, art. 1
C.01.005.1 (1) Il est interdit au pharmacien et au praticien de vendre tout opioïde de catégorie A, notamment tout opioïde de catégorie A préparé par un pharmacien, conformément à une ordonnance, ou par un praticien, sauf si les conditions suivantes sont réunies :
a) un autocollant d’avertissement conforme aux spécifications prévues dans le document source est apposé sur l’emballage de la drogue;
b) la drogue est accompagnée d’une fiche de renseignements à l’intention du patient conforme aux spécifications prévues dans le document source.
(2) Le paragraphe (1) ne s’applique pas à l’égard de la vente d’un opioïde de catégorie A par un pharmacien ou un praticien dans les cas suivants :
a) l’opioïde sera ou est administré sous la surveillance d’un praticien;
b) l’opioïde est vendu à un pharmacien ou à un praticien.
(3) Les définitions ci-après s’appliquent au présent article.
- document source
document source Document intitulé Information pour les patients concernant les opioïdes, publié par le gouvernement du Canada sur son site Web, avec ses modifications successives. (source document)
- opioïde de catégorie A
opioïde de catégorie A Drogue sous forme posologique figurant dans la partie A de la Liste des opioïdes, publiée par le gouvernement du Canada sur son site Web, avec ses modifications successives. (Class A opioid)
- DORS/2018-77, art. 2
C.01.006 Lorsqu’un emballage d’une drogue ne porte qu’une seule étiquette, ladite étiquette doit montrer tous les renseignements que le présent règlement exige sur les étiquettes intérieure et extérieure.
C.01.007 Aucune mention, directe ou indirecte, de la Loi ou du présent règlement ne doit figurer sur une étiquette ou dans la publicité d’une drogue, à moins que ladite mention ne soit précisément requise par la Loi ou par le présent règlement.
C.01.008 [Abrogé, DORS/80-544, art. 2]
C.01.009 Lorsqu’une loi fédérale ou un de ses règlements fixe une norme de composition ou de qualité pour une drogue et y donne un nom ou une désignation, il est interdit de faire figurer ce nom ou cette désignation sur l’étiquette ou dans la publicité de la drogue, à moins que celle-ci ne soit conforme à la norme de composition ou de qualité.
- DORS/2017-18, art. 13
C.01.010 S’il y a lieu de fournir le mode d’emploi approprié et sûr d’une drogue à usage parentéral ou d’une drogue sur ordonnance qui sert au traitement ou à la prophylaxie d’une maladie, d’un désordre ou d’un état physique anormal mentionnés à l’annexe A.1 de la Loi, les étiquettes de la drogue, notamment toute notice d’accompagnement et toute documentation supplémentaire sur l’emploi de la drogue qui est fournie sur demande, peuvent faire mention de cette maladie, de ce désordre ou de cet état, et la drogue est exemptée à cet égard de l’application des paragraphes 3(1) et (2) de la Loi.
- DORS/2013-122, art. 6
- DORS/2014-158, art. 6
- DORS/2017-18, art. 21(F)
- DORS/2018-69, art. 14(F)
- DORS/2021-46, art. 10
C.01.011 (1) Une drogue à laquelle s’applique le paragraphe 10(2) de la Loi doit être exemptée de la norme de toute drogue mentionnée dans toute publication de l’annexe B de la Loi, dans la mesure où cette drogue diffère de la norme quant à la couleur, à la saveur, à la forme et à la dimension, si ces différences ne perturbent pas toute méthode de dosage indiquée par l’une desdites publications.
(2) [Abrogé, DORS/93-243, art. 2]
(3) Lorsqu’une norme de fabricant est utilisée pour une drogue, le fabricant devra tenir à la disposition du ministre, à la demande de ce dernier, les détails relatifs à cette norme et à une méthode d’analyse de cette drogue qui soit acceptable au ministre.
(4) Il est interdit d’utiliser pour une drogue une norme de fabricant qui prévoit,
a) un degré de pureté inférieur au degré maximal de pureté,
b) un écart d’activité supérieur à l’écart minimal,
indiqués pour cette drogue dans les publications mentionnées à l’annexe B de la Loi.
- DORS/93-243, art. 2
- DORS/2018-69, art. 31(A) et 32(F)
C.01.012 Le fabricant qui fait une déclaration sur l’étiquette d’une drogue sous forme de posologie orale, ou dans sa publicité, relativement au siège, à la vitesse ou à l’étendue de libération d’un ingrédient médicinal de la drogue dans l’organisme, ou à la disponibilité d’un ingrédient médicinal de la drogue dans l’organisme, doit :
a) avant de faire la déclaration, effectuer, par une méthode acceptable, les investigations qui se révèlent nécessaires pour démontrer que le siège, la vitesse ou l’étendue de libération de l’ingrédient médicinal de la drogue dans l’organisme et la disponibilité de l’ingrédient médicinal de la drogue dans l’organisme correspondent à la déclaration;
b) soumettre, sur demande, le dossier de telles investigations au ministre.
- DORS/89-455, art. 2
- DORS/94-36, art. 1
- DORS/2018-69, art. 27
C.01.013 (1) Lorsque le ministre demande par écrit au fabricant d’une drogue de lui fournir, à ou avant une date donnée, des preuves concernant une drogue, le fabricant doit suspendre la vente de cette drogue après cette date, à moins qu’il n’ait fourni les preuves demandées.
(2) Si le ministre conclut que les preuves fournies par le fabricant en application du paragraphe (1) sont insuffisantes, il en avise le fabricant par écrit.
(3) Lorsque, conformément au paragraphe (2), un fabricant est avisé que les preuves concernant une drogue donnée sont insuffisantes, il doit susprendre la vente de ladite drogue, à moins qu’il ne fournisse d’autres preuves et qu’il ne soit avisé par écrit par le ministre que ces autres preuves sont suffisantes.
(4) Dans cet article preuves concernant une drogue signifie des preuves servant à établir l’innocuité de la drogue lorsqu’elle est utilisée dans les conditions d’emploi recommandées et son efficacité pour les indications recommandées.
- DORS/2018-69, art. 15 et 27
C.01.013.1 L’article C.01.013 ne s’applique pas à l’égard des produits de santé animale.
- DORS/2017-76, art. 2
Attribution et annulation de l’identification numérique des drogues
C.01.014 (1) Il est interdit à tout fabricant de vendre une drogue sous forme posologique à laquelle une identification numérique n’a pas été attribuée ou dont l’identification numérique a été annulée en application de l’article C.01.014.6.
(2) Le paragraphe (1) ne s’applique pas au produit de santé animale, à la drogue destinée à l’étude au sens de l’article C.03.301, ou à l’aliment médicamenté au sens du paragraphe 1(1) du Règlement de 2024 sur les aliments du bétail.
- DORS/81-248, art. 2
- DORS/97-12, art. 3
- DORS/2013-179, art. 1
- DORS/2017-259, art. 3
- DORS/2018-77, art. 3
- DORS/2024-132, art. 85
C.01.014.1 (1) Le fabricant d’une drogue peut présenter une demande d’identification numérique pour cette drogue.
(2) La demande d’identification numérique est présentée au ministre par écrit et contient les renseignements et le matériel suivants :
a) le nom du fabricant de la drogue, tel qu’il figurera sur l’étiquette;
b) la forme pharmaceutique sous laquelle la drogue doit être vendue;
c) dans le cas d’une drogue non visée à l’alinéa d), la voie d’administration recommandée;
d) dans le cas d’une drogue destinée à désinfecter des locaux, le genre de locaux où il est recommandé de l’utiliser;
e) une liste quantitative des ingrédients médicinaux contenus dans la drogue, désignés par leur nom propre ou, à défaut de celui-ci par leur nom usuel;
f) la marque nominative sous laquelle la drogue doit être vendue;
g) une indication portant qu’il s’agit d’une drogue pour usage humain ou pour usage vétérinaire;
h) le nom de la quantité de chaque colorant de nature non médicinale;
i) l’usage ou les fins pour lesquels la drogue est recommandée;
j) la posologie recommandée;
k) l’adresse du fabricant visé à l’alinéa a) et, si cette adresse est à l’extérieur du pays, le nom et l’adresse de l’importateur de la drogue;
l) les nom et adresse du particulier, de l’entreprise ou de la société ou de la corporation, autres que les noms et adresses indiqués aux alinéas a) et k), qui paraîtront sur l’étiquette de la drogue;
m) dans le cas d’une drogue pour usage vétérinaire, le libellé de toute étiquette à utiliser relativement à la drogue, y compris toute notice d’accompagnement et toute documentation supplémentaire sur l’emploi de la drogue qui est fournie sur demande;
m.1) dans le cas d’une drogue pour usage humain, des maquettes de toute étiquette à utiliser relativement à la drogue — y compris toute notice d’accompagnement et toute documentation supplémentaire sur l’emploi de la drogue qui est fournie sur demande — ainsi que des maquettes des emballages de la drogue;
n) les nom et titre de la personne ayant signé la demande, ainsi que la date de signature;
o) dans le cas d’une drogue pour usage humain, une appréciation de la question de savoir si la drogue est susceptible d’être confondue avec une autre drogue à laquelle une identification numérique a été attribuée en raison de la ressemblance de la marque nominative dont l’utilisation est proposée pour la drogue avec la marque nominative, le nom usuel ou le nom propre de l’autre drogue.
(3) Dans le cas d’une drogue nouvelle, la présentation de drogue nouvelle, la présentation de drogue nouvelle pour usage exceptionnel, la présentation abrégée de drogue nouvelle ou la présentation abrégée de drogue nouvelle pour usage exceptionnel déposée en vertu des articles C.08.002, C.08.002.01 ou C.08.002.1 tient lieu de demande d’identification numérique.
- DORS/81-248, art. 2
- DORS/93-202, art. 4
- DORS/98-423, art. 3
- DORS/2011-88, art. 2
- DORS/2014-158, art. 7
- DORS/2017-259, art. 4
- DORS/2018-69, art. 27 et 33(F)
C.01.014.2 (1) Sous réserve du paragraphe (2), sur réception des renseignements et du matériel visés au paragraphe C.01.014.1(2) ou aux articles C.08.002, C.08.002.01 ou C.08.002.1, selon le cas, fournis par le fabricant à l’égard d’une drogue, le ministre délivre à ce dernier un document qui :
a) indique :
(i) soit l’identification numérique attribuée à la drogue, précédée de l’abréviation « DIN »,
(ii) soit, si la drogue a deux marques nominatives ou plus, les identifications numériques attribuées à celle-ci par le ministre, dont chacune correspond à une marque nominative et est précédée de l’abréviation « DIN »;
b) comporte les renseignements visés aux alinéas C.01.014.1(2)a) à f).
(2) Le ministre peut refuser de délivrer le document prévu au paragraphe (1) s’il a des motifs raisonnables de croire que le produit faisant l’objet d’une demande visée à l’article C.01.014.1 :
a) n’est pas une drogue;
b) est une drogue dont la vente causerait un préjudice à la santé de l’acheteur ou du consommateur ou contreviendrait à la Loi ou au présent règlement.
(3) Lorsque le ministre refuse, en vertu du paragraphe (2), de délivrer le document, le fabricant peut fournir des renseignements et du matériel supplémentaires et lui demander de reconsidérer sa décision.
(4) Le ministre reconsidère sa décision de refuser de délivrer le document en fonction des renseignements et du matériel supplémentaires fournis en vertu du paragraphe (3).
- DORS/81-248, art. 2
- DORS/92-230, art. 1
- DORS/98-423, art. 4
- DORS/2011-88, art. 3
- DORS/2017-259, art. 5
- DORS/2018-69, art. 16, 27 et 37
C.01.014.21 (1) Le ministre peut, en tout temps, assortir de conditions l’identification numérique attribuée à un opioïde de catégorie B ou modifier de telles conditions.
(1.1) Le ministre peut, en tout temps, assortir de conditions l’identification numérique attribuée à une drogue désignée contre la COVID-19, ou modifier ces conditions dans l’un ou l’autre des cas suivants :
a) un avis de conformité a été délivré en vertu de l’article C.08.004 à l’égard :
(i) soit d’une présentation de drogue nouvelle qui a été déposée aux termes de l’article C.08.002 à l’égard de la drogue désignée contre la COVID-19 et qui contient la mention prévue à l’alinéa C.08.002(2.1)a),
(ii) soit d’un supplément à une telle présentation de drogue nouvelle qui a été déposé aux termes de l’article C.08.003 à l’égard de la drogue désignée contre la COVID-19;
b) un avis de conformité a été délivré en vertu de l’article C.08.004 à l’égard de l’un des documents ci-après si le document a été déposé à l’égard de la drogue désignée contre la COVID-19, sur la base d’une comparaison directe ou indirecte entre celle-ci et une autre drogue désignée contre la COVID-19 visée à l’alinéa a) :
(i) une présentation de drogue nouvelle visée à l’article C.08.002,
(ii) une présentation abrégée de drogue nouvelle visée à l’article C.08.002.1,
(iii) un supplément à une présentation de drogue nouvelle ou à une présentation abrégée de drogue nouvelle qui est déposé aux termes de l’article C.08.003.
(2) Il informe par écrit le fabricant à qui a été remis le document prévu au paragraphe C.01.014.2(1) qui indique l’identification numérique attribuée à la drogue de toute condition dont il assortit l’identification numérique et de toute modification qu’il apporte à une telle condition.
(3) Les définitions ci-après s’appliquent au présent article.
- drogue désignée contre la COVID-19
drogue désignée contre la COVID-19 S’entend au sens de l’article C.08.001.1. (designated COVID-19 drug)
- opioïde de catégorie B
opioïde de catégorie B Toute drogue figurant dans la partie B de la Liste des opioïdes, publiée par le gouvernement du Canada sur son site Web, avec ses modifications successives. (Class B opioid)
- DORS/2018-77, art. 4
- DORS/2021-45, art. 2
C.01.014.3 Dans les trente jours suivant la date de la première vente de la drogue après que le ministre a délivré au fabricant le document prévu au paragraphe C.01.014.2(1) qui indique l’identification numérique attribuée à la drogue, le fabricant date et signe le document, l’annote en y incluant une déclaration portant que les renseignements qu’il contient sont exacts ainsi qu’une mention de la date de cette première vente, et le renvoie au ministre.
- DORS/81-248, art. 2
- DORS/98-423, art. 5
- DORS/2014-158, art. 8
- DORS/2017-259, art. 6
- DORS/2018-69, art. 38
C.01.014.4 Dans le cas où les renseignements visés au paragraphe C.01.014.1(2) ne sont plus exacts :
a) en raison de la modification des renseignements visés aux alinéas C.01.014.1(2)a) à f) :
(i) qui se produit avant la mise en marché de la drogue, une nouvelle demande doit être présentée, ou
(ii) qui se produit après la mise en marché de la drogue, la vente doit être interrompue jusqu’à ce qu’une nouvelle demande d’identification numérique soit présentée et qu’une nouvelle identification numérique soit attribuée à l’égard de la drogue;
b) en raison de la modification des renseignements visés aux alinéas C.01.014.1(2)g) à k) :
(i) qui se produit avant la mise en marché de la drogue, tous les détails de la modification doivent être présentés en même temps que le document visé à l’article C.01.014.3, ou
(ii) qui se produit après la mise en marché de la drogue, la personne à qui l’identification numérique de la drogue a été attribuée doit en informer le ministre dans les 30 jours suivant la modification.
- DORS/81-248, art. 2
- DORS/92-230, art. 2
- DORS/98-423, art. 6
- DORS/2016-139, art. 2(F)
- DORS/2018-69, art. 27
C.01.014.5 (1) Le fabricant à qui a été délivré le document prévu au paragraphe C.01.014.2(1) qui indique l’identification numérique attribuée à une drogue fournit au ministre, avant le 1er octobre de chaque année et en la forme établie par ce dernier, un avis qu’il signe et dans lequel :
a) il indique si l’une des circonstances ci-après s’applique à l’égard de la drogue :
(i) à la date d’envoi de l’avis :
(A) soit il vend la drogue au Canada,
(B) soit il a cessé la vente de la drogue au Canada,
(ii) il n’a pas vendu la drogue au Canada durant une période de plus de douze mois et une partie de cette période est visée par l’avis;
b) sous réserve du paragraphe (2), il confirme que les renseignements qu’il a présentés jusqu’alors au sujet de la drogue en application du paragraphe C.01.014.1(2), de l’alinéa C.01.014.4b) ou des articles C.08.002, C.08.002.01, C.08.002.1 ou C.08.003, selon le cas, sont exacts à la date d’envoi de l’avis.
(2) Si l’un des renseignements qu’il a présentés en application d’une disposition visée à l’alinéa (1)b) n’est pas exact à la date d’envoi de l’avis, le fabricant met le renseignement à jour dans cet avis.
- DORS/81-248, art. 2
- DORS/2017-259, art. 7
- DORS/2018-69, art. 27 et 39
C.01.014.6 (1) Le ministre annule l’identification numérique attribuée à une drogue dans les cas suivants :
a) le fabricant à qui a été délivré le document prévu au paragraphe C.01.014.2(1) qui indique l’identification numérique signale, en application de l’article C.01.014.7, qu’il a cessé la vente de la drogue;
c) le ministre conclut que le produit auquel l’identification numérique a été attribuée n’est pas une drogue.
(2) Le ministre peut annuler l’identification numérique attribuée à une drogue dans les cas suivants :
a) le fabricant à qui a été délivré le document prévu au paragraphe C.01.014.2(1) qui indique l’identification numérique contrevient à l’article C.01.014.5;
b) le fabricant à qui a été délivré le document prévu au paragraphe C.01.014.2(1) qui indique l’identification numérique a été avisé, en application de l’article C.01.013, que les preuves qu’il a fournies concernant la drogue sont insuffisantes;
c) la drogue est une drogue nouvelle pour laquelle l’avis de conformité a été suspendu en vertu de l’article C.08.006.
(3) Le ministre peut annuler l’identification numérique attribuée à une drogue si, après qu’il a ordonné en vertu de l’article 21.31 de la Loi au titulaire d’une autorisation relative à un produit thérapeutique visée aux sous-alinéas C.01.052(1)a)(i) ou (iii) d’effectuer une évaluation de la drogue en vue de fournir des preuves établissant que les bénéfices liés à la drogue l’emportent sur les risques de préjudice à la santé :
a) le titulaire ne se conforme pas à l’ordre;
b) le titulaire se conforme à l’ordre, mais le ministre conclut que les résultats de l’évaluation sont insuffisants pour établir que les bénéfices liés à la drogue l’emportent sur les risques de préjudice à la santé.
(4) Il est entendu que le pouvoir du ministre d’annuler l’identification numérique attribuée à une drogue :
a) en vertu de l’alinéa (2)b) n’a pas d’incidence sur son pouvoir d’annuler une telle identification en vertu du paragraphe (3);
b) en vertu du paragraphe (3) n’a pas d’incidence sur son pouvoir d’annuler une telle identification en vertu de l’alinéa (2)b).
- DORS/81-248, art. 2
- DORS/2016-139, art. 3
- DORS/2017-259, art. 7
- DORS/2018-69, art. 27 et 39
- DORS/2018-84, art. 1 et 13
- DORS/2020-262, art. 1
Pénuries de drogues et interruption et cessation de la vente de drogues
C.01.014.7 Le fabricant à qui a été délivré le document prévu au paragraphe C.01.014.2(1) qui indique l’identification numérique attribuée à une drogue fournit au ministre, dans les trente jours suivant la cessation de la vente de cette drogue, les renseignements suivants :
a) l’identification numérique attribuée à la drogue;
b) la date à laquelle il a cessé la vente de la drogue;
c) la date limite d’utilisation la plus tardive attribuée à la drogue qu’il a vendue et le numéro de lot de celle-ci.
- DORS/81-248, art. 2
- DORS/2016-139, art. 5
- DORS/2017-259, art. 8
C.01.014.71 Si douze mois se sont écoulés depuis le jour où il a procédé à la dernière vente d’une drogue au sens de l’article C.01.014.8, le fabricant à qui a été délivré le document prévu au paragraphe C.01.014.2(1) qui indique l’identification numérique attribuée à la drogue en avise le ministre par écrit dans les trente jours suivant la fin de cette période.
- DORS/2017-259, art. 8
C.01.014.72 S’il recommence à vendre la drogue après que douze mois se sont écoulés depuis le jour où il a procédé à la dernière vente de la drogue, le fabricant à qui a été délivré le document prévu au paragraphe C.01.014.2(1) qui indique l’identification numérique attribuée à la drogue en avise le ministre par écrit dans les trente jours suivant la date à laquelle il recommence à vendre la drogue.
- DORS/2017-259, art. 8
C.01.014.8 Les définitions qui suivent s’appliquent au présent article et aux articles C.01.014.9 à C.01.014.14.
- drogue
drogue S’entend de l’une des drogues pour usage humain ci-après auxquelles une identification numérique a été attribuée :
a) les drogues inscrites aux annexes I, II, III, IV ou V de la Loi réglementant certaines drogues et autres substances;
b) les drogues sur ordonnance;
c) les drogues visées aux annexes C ou D de la Loi;
d) les drogues qui peuvent être vendues sans ordonnance mais à administrer uniquement sous la surveillance d’un praticien. (drug)
- pénurie
pénurie S’entend, à l’égard d’une drogue, d’une situation où le fabricant à qui a été délivré le document prévu au paragraphe C.01.014.2(1) qui indique l’identification numérique attribuée à la drogue est incapable de répondre à la demande pour cette drogue au Canada. (shortage)
- DORS/2016-139, art. 5
- DORS/2017-259, art. 8
- DORS/2018-69, art. 17 et 40
- DORS/2021-199, art. 1
C.01.014.9 (1) S’il y a pénurie ou probabilité de pénurie d’une drogue, le fabricant à qui a été délivré le document prévu au paragraphe C.01.014.2(1) qui indique l’identification numérique attribuée à la drogue affiche les renseignements ci-après, en français et en anglais, sur un site Web exploité à cette fin par un contractant avec lequel Sa Majesté du chef du Canada a conclu un contrat pour rendre cette information disponible au public :
a) son nom, ainsi que ses numéro de téléphone, adresse électronique, adresse de site Web ou adresse postale ou tout autre renseignement permettant de communiquer avec lui;
b) l’identification numérique attribuée à la drogue;
c) la marque nominative de la drogue et son nom propre ou, à défaut, son nom usuel;
d) le nom propre des ingrédients médicinaux de la drogue ou, à défaut, leur nom usuel;
e) la classification thérapeutique de la drogue dans le système de classification anatomique, thérapeutique et chimique (ATC), établi par le Centre collaborateur de l’Organisation mondiale de la Santé pour la méthodologie sur l’établissement des statistiques concernant les produits médicamenteux, à savoir sa description de niveau 3 et son code de niveau 4;
f) la concentration de la drogue;
g) la forme posologique de la drogue;
h) la quantité de drogue contenue dans l’emballage;
i) la voie d’administration de la drogue;
j) la date réelle ou prévue du début de la pénurie;
k) la date à laquelle il est prévu que le fabricant sera capable de répondre à la demande pour la drogue, dans la mesure où ce dernier peut prévoir une telle date;
l) la raison réelle ou prévue de la pénurie.
(2) Le fabricant affiche les renseignements :
a) s’il prévoit que la pénurie débutera dans plus de six mois, au moins six mois avant la date à laquelle il prévoit que la pénurie débutera;
b) s’il prévoit que la pénurie débutera dans six mois ou moins, dans les cinq jours qui suivent la date où il établit cette prévision;
c) s’il n’a pas prévu la pénurie, dans les cinq jours qui suivent la date où il en constate l’existence.
(3) Si les renseignements affichés changent, le fabricant les met à jour sur le site Web dans les deux jours suivant la date à laquelle il fait ou constate le changement.
(4) Dans les deux jours suivant la date à laquelle il est capable de répondre à la demande pour la drogue, le fabricant le signale sur le site Web.
(5) Le présent article ne s’applique pas à l’égard de la pénurie d’une drogue qui résulte de la décision du fabricant d’en cesser la vente.
- DORS/2016-139, art. 5
- DORS/2017-259, art. 9
- DORS/2021-199, art. 2
C.01.014.10 (1) Si le fabricant à qui a été délivré le document prévu au paragraphe C.01.014.2(1) qui indique l’identification numérique attribuée à une drogue décide de cesser la vente de la drogue, il affiche les renseignements ci-après, en français et en anglais, sur le site Web visé au paragraphe C.01.014.9(1) :
a) son nom, ainsi que ses numéro de téléphone, adresse électronique, adresse de site Web ou adresse postale ou tout autre renseignement permettant de communiquer avec lui;
b) l’identification numérique attribuée à la drogue;
c) la marque nominative de la drogue et son nom propre ou, à défaut, son nom usuel;
d) le nom propre des ingrédients médicinaux de la drogue ou, à défaut, leur nom usuel;
e) la classification thérapeutique de la drogue dans le système de classification anatomique, thérapeutique et chimique (ATC), établi par le Centre collaborateur de l’Organisation mondiale de la Santé pour la méthodologie sur l’établissement des statistiques concernant les produits médicamenteux, à savoir sa description de niveau 3 et son code de niveau 4;
f) la concentration de la drogue;
g) la forme posologique de la drogue;
h) la quantité de drogue contenue dans l’emballage;
i) la voie d’administration de la drogue;
j) la date à laquelle le fabricant cessera la vente de la drogue;
k) la raison de la cessation de la vente.
(2) Le fabricant affiche les renseignements :
a) s’il décide de cesser la vente de la drogue dans plus de six mois, au moins six mois avant la date de la cessation;
b) s’il décide de cesser la vente de la drogue dans six mois ou moins, dans les cinq jours qui suivent la date à laquelle il prend cette décision.
(3) Si les renseignements affichés changent, le fabricant les met à jour sur le site Web dans les deux jours suivant la date à laquelle il fait ou constate le changement.
- DORS/2016-139, art. 5
- DORS/2017-259, art. 10
C.01.014.11 Le ministre veille à ce qu’un hyperlien menant au site Web visé au paragraphe C.01.014.9(1) figure sur le site Web du gouvernement du Canada.
- DORS/2016-139, art. 5
- DORS/2017-259, art. 11
C.01.014.12 (1) Le ministre peut demander au fabricant à qui a été délivré le document prévu au paragraphe C.01.014.2(1) qui indique l’identification numérique attribuée à une drogue ou au titulaire d’une licence d’établissement concernant une drogue de lui fournir les renseignements qui relèvent du fabricant ou du titulaire s’il a des motifs raisonnables de croire que les conditions ci-après sont réunies :
a) il y a pénurie ou risque de pénurie de la drogue;
b) les renseignements sont nécessaires afin d’établir ou d’évaluer, selon le cas :
(i) l’existence d’une pénurie ou d’un risque de pénurie de la drogue,
(ii) la raison d’une pénurie ou d’un risque de pénurie de la drogue,
(iii) les effets réels ou potentiels sur la santé humaine d’une pénurie de la drogue,
(iv) les mesures qui pourraient être prises afin de prévenir ou d’atténuer une pénurie de la drogue;
c) le fabricant ou le titulaire ne fournira les renseignements que s’il est légalement tenu de le faire.
(2) Le fabricant ou le titulaire transmet les renseignements au ministre par voie électronique, en la forme précisée ou jugée acceptable par ce dernier et dans le délai que celui-ci fixe.
C.01.014.13 Le titulaire d’une licence d’établissement ne peut distribuer une drogue pour consommation ou usage à l’étranger, à moins qu’il n’ait des motifs raisonnables de croire que la distribution n’aura pas pour effet de causer ou d’aggraver une pénurie de la drogue.
C.01.014.14 (1) Le titulaire d’une licence d’établissement qui distribue une drogue pour consommation ou usage à l’étranger consigne immédiatement dans un dossier, de façon détaillée, les renseignements sur lesquels il s’est fondé pour conclure que la distribution n’est pas interdite par l’article C.01.014.13.
(2) Le titulaire est tenu de conserver le dossier pendant au moins un an à compter de la date limite d’utilisation la plus tardive attribuée à la drogue qu’il a distribuée.
Temps de désagrégation des comprimés
C.01.015 (1) Sous réserve du paragraphe (2), il est interdit de vendre une drogue pour usage humain se présentant sous forme de comprimé destiné à être avalé entier, à moins qu’elle ne présente les caractéristiques de désagrégation suivantes lorsqu’elle est soumise à l’épreuve décrite dans la méthode officielle DO-25 intitulée Détermination du temps de désagrégation des comprimés en date du 5 juillet 1989 :
a) dans le cas d’un comprimé non enrobé, le comprimé soumis à l’épreuve se désagrège en au plus 45 minutes;
b) dans le cas d’un comprimé enrobé ordinaire, le comprimé soumis à l’épreuve se désagrège en au plus 60 minutes;
c) dans le cas d’un comprimé désigné sur l’étiquette comme un comprimé à enrobage entéro-soluble ou à enrobage destiné à une fin semblable, le comprimé immergé pendant 60 minutes dans du suc gastrique simulé ne se désagrège pas et, lorsqu’il est immergé dans du suc intestinal simulé, il se désagrège en au plus 60 minutes.
(2) Le paragraphe (1) ne s’applique pas à la drogue sous forme de comprimé lorsque, selon le cas :
a) un avis de conformité a été délivré à l’égard de la drogue sous forme de comprimé en application des articles C.08.004 ou C.08.004.01;
b) [Abrogé, DORS/98-423, art. 7]
c) une épreuve de dissolution ou de désagrégation est prévue pour la drogue sous forme de comprimé au titre 6 de la présente partie;
d) l’étiquette de la drogue indique que celle-ci satisfait à une norme contenue dans l’une des publications mentionnées à l’annexe B de la Loi;
e) il est démontré, selon une méthode acceptable, que la drogue est libérée dans l’organisme;
f) une déclaration est faite sur l’étiquette, ou dans toute publicité, relativement au siège, à la vitesse ou à l’étendue de libération d’un ingrédient médicinal de la drogue dans l’organisme, ou à la disponibilité de l’ingrédient médicinal de la drogue dans l’organisme.
- DORS/89-429, art. 2
- DORS/89-455, art. 3
- DORS/94-36, art. 2
- DORS/98-423, art. 7
- DORS/2011-88, art. 4
Interdiction
C.01.016 Il est interdit à tout fabricant de vendre une drogue, à moins qu’il se conforme aux conditions énoncées aux articles C.01.017 à C.01.019.
- DORS/95-521, art. 2
- DORS/2011-31, art. 1
Rapports sur les réactions indésirables graves à une drogue — fabricants
- DORS/2019-190, art. 1
C.01.017 Le fabricant, dans les quinze jours après avoir reçu communication de renseignements concernant toute réaction indésirable grave à une drogue, ou après en avoir pris connaissance, selon la première des deux éventualités à survenir, présente un rapport faisant état de ces renseignements au ministre dans les cas suivants :
a) il s’agit d’une réaction indésirable grave à la drogue survenue au Canada;
b) il s’agit d’une réaction indésirable grave et imprévue à la drogue survenue à l’extérieur du Canada.
- DORS/95-521, art. 2
- DORS/2011-31, art. 1
Rapport de synthèse annuel et fiches d’observation
C.01.018 (1) Le fabricant prépare un rapport de synthèse annuel sur les renseignements concernant les réactions indésirables à une drogue et les réactions indésirables graves à une drogue dont il a reçu communication ou a eu connaissance au cours des douze derniers mois.
(2) Le rapport de synthèse annuel comprend une analyse critique et concise des réactions indésirables à une drogue et des réactions indésirables graves à une drogue.
(3) Dans le cadre de la préparation du rapport de synthèse annuel, le fabricant évalue, en se fondant sur l’analyse visée au paragraphe (2), si ce qui est connu à propos des risques et avantages associés à la drogue a changé de façon importante durant la période visée par le rapport et fait état de ses conclusions à cet égard dans son rapport.
(4) Lorsque, dans le cadre de la préparation du rapport de synthèse annuel, le fabricant conclut à un changement important, il en informe sans tarder le ministre par écrit, si ce n’est déjà fait.
(5) Afin d’évaluer l’innocuité de la drogue et son efficacité, le ministre peut demander par écrit au fabricant de lui présenter l’un ou l’autre des documents suivants, ou les deux :
a) les rapports de synthèse annuels;
b) les fiches d’observation relatives aux réactions indésirables à la drogue et aux réactions indésirables graves à la drogue qui sont connues du fabricant.
(6) Après avoir donné au fabricant la possibilité de se faire entendre, le ministre précise un délai raisonnable, selon les circonstances, pour la présentation des rapports de synthèse annuels ou des fiches d’observation, ou des deux. Le fabricant présente les documents dans le délai imparti.
- DORS/2011-31, art. 1
C.01.018.1 L’article C.01.018 ne s’applique pas à l’égard des produits de santé animale.
- DORS/2017-76, art. 4
Rapport de synthèse relatif à un sujet de préoccupation
C.01.019 (1) Le ministre peut, aux fins d’évaluation de l’innocuité et de l’efficacité de la drogue, demander par écrit au fabricant de lui présenter un rapport de synthèse relatif à un sujet de préoccupation.
(2) Le rapport comprend une analyse critique et concise des réactions indésirables à la drogue et des réactions indésirables graves à la drogue, ainsi que les fiches d’observation portant sur toutes les réactions indésirables à la drogue et les réactions indésirables graves à la drogue — ou celles qui sont précisées par le ministre — qui sont connues du fabricant et qui sont associées au sujet de préoccupation que le ministre a demandé à celui-ci d’analyser dans le rapport.
(3) Après avoir donné au fabricant la possibilité de se faire entendre, le ministre précise un délai raisonnable, selon les circonstances, pour la présentation du rapport. Ce délai ne peut être de moins de trente jours que si le ministre a besoin des renseignements contenus dans le rapport pour établir si la drogue présente un risque grave et imminent pour la santé humaine.
(4) Le fabricant présente le rapport dans le délai imparti.
- DORS/2011-31, art. 1
- DORS/2017-18, art. 14
C.01.019.1 L’article C.01.019 ne s’applique pas à l’égard des produits de santé animale.
- DORS/2017-76, art. 5
Tenue de dossiers
C.01.020 (1) Le fabricant tient les dossiers des rapports et fiches d’observations visés aux articles C.01.017 à C.01.019.
(2) Il conserve les dossiers pendant vingt-cinq ans après la date de leur création.
- DORS/2011-31, art. 1
Fourniture de renseignements en application de l’article 21.8 de la Loi
C.01.020.1 (1) Pour l’application de l’article 21.8 de la Loi, les hôpitaux sont les établissements de soins de santé tenus de fournir au ministre les renseignements qui relèvent d’eux concernant les réactions indésirables graves à une drogue.
(2) Les renseignements ci-après qui relèvent d’un hôpital concernant toute réaction indésirable grave à une drogue sont fournis au ministre par écrit dans les trente jours suivant le jour où la réaction indésirable grave à une drogue est consignée pour la première fois dans l’hôpital :
a) le nom de l’hôpital et les coordonnées d’une personne représentant celui-ci;
b) la marque nominative, le nom propre ou le nom usuel de la drogue;
c) s’agissant d’une drogue importée en vertu du paragraphe C.10.001(2) ou de l’article C.10.006, tout code ou numéro d’identification qui lui est attribué dans le pays où sa vente a été autorisée;
c.1) s’agissant d’une drogue dont la vente est autorisée en vertu du paragraphe C.11.003(1), son nom, son code, son numéro ou sa marque d’identification;
d) l’identification numérique qui a été attribuée à la drogue, le cas échéant;
e) l’âge et le sexe du patient;
f) une description de la réaction indésirable grave à une drogue;
g) la date de la première consignation de la réaction indésirable grave à une drogue;
h) la date à laquelle le patient a utilisé la drogue pour la première fois et, le cas échéant, celle à laquelle il a cessé de l’utiliser;
i) la date à laquelle la réaction indésirable grave à une drogue s’est produite pour la première fois et, le cas échéant, celle à laquelle l’état de santé du patient antérieur à la réaction a été rétabli;
j) tout état pathologique du patient directement rattaché à la réaction indésirable grave à une drogue;
k) tout produit thérapeutique utilisé de façon concomitante par le patient;
l) l’effet de la réaction indésirable grave à une drogue sur la santé du patient.
(3) L’hôpital est exempté de l’application de l’article 21.8 de la Loi à l’égard des renseignements visés au paragraphe (2) dans les cas suivants :
a) les renseignements visés aux alinéas (2)b), c), e) et f) concernant la réaction indésirable grave à une drogue ne relèvent pas tous de l’hôpital;
b) la réaction indésirable grave à une drogue met en cause seulement l’une des drogues suivantes :
(i) le vaccin administré dans le cadre d’un programme provincial de vaccination systématique,
(ii) la drogue dont la vente est autorisée sous le régime du titre 5 de la présente partie,
(iii) la drogue vendue en vertu du paragraphe C.08.011(1).
(4) Au présent article, hôpital s’entend de l’établissement qui, selon le cas :
a) fait l’objet d’un permis délivré par une province ou a été approuvé ou désigné par elle à ce titre, en conformité avec ses lois, en vue d’assurer des soins ou des traitements aux personnes atteintes de toute forme de maladie ou d’affection;
b) est exploité par le gouvernement du Canada et assure des soins de santé à des patients hospitalisés.
Doses limites des drogues
C.01.021 Sauf disposition contraire du présent règlement, il est interdit de vendre pour administration humaine une drogue mentionnée au tableau ci-après, à moins qu’il ne soit indiqué sur les étiquettes intérieure et extérieure (sauf l’étiquette intérieure d’un récipient à dose simple),
a) la composition quantitative de ladite drogue; et
b) la dose simple et la dose quotidienne recommandées pour adultes et désignées comme telles, exception faite
(i) des préparations destinées uniquement à l’usage externe, et
(ii) des préparations destinées uniquement aux enfants; et
c) des directives convenables d’emploi, lorsque la drogue est recommandée pour les enfants, directives qui doivent soit
(i) consister en la déclaration : « POUR ENFANTS : selon les instructions du médecin », ou
(ii) fixer des doses maximums simple et quotidienne qui ne doivent pas dépasser les valeurs données ci-dessous :
Années d’âge Proportion de la dose adulte 

10 à 14 la moitié 5 à 9 le quart 2 à 4 le sixième Moins de 2 ans Selon les instructions du médecins TABLEAU
Tableau des doses limites des drogues pour adultes
Drogue Usage externe Usage interne — — Dose maximum Dose maximum en milligrammes, sauf indication contraire pour cent Dose simple Dose quotidienne Acétaminophène 
— 650 4,0 g Acétanilide et dérivés (exception faite de N-acétyl-ρ-aminophénol 
— 65 195 Acide acétylsalicylique 
— 650 4,0 g Acide cyanhydrique (prussique) solution à 2 pour cent 
— 0,062 ml 0,31 ml Acide tannique 
— 150 1 000 Aconitine, ses préparations et dérivés 
0,2 0,1 0,1 Adonis vernalis 
— 65 195 Amylocaïne, ses sels et dérivés, lorsqu’ils sont vendus ou recommandés pour usage ophtalmique 
0,0 0,0 0,0 Antimoine (composés d’) 
— 3,3 13 Atropine, méthylatropine, et leurs sels 
1,0 0,13 0,44 Belladone et ses préparations, en alcaloïdes de la belladone 
0,375 0,13 0,44 Benzène (benzol) 
— — — Benzocaïne 
8,0 195 585 Bêta-naphtol 
— 195 585 Bleu de méthylène 
— 130 390 Bromure d’aminoxyde d’hyoscine 
0,5 0,325 0,975 Butacaïne, ses sels et dérivés, lorsqu’ils sont vendus ou recommandés pour usage ophtalmique 
0,0 0,0 0,0 Cadexomer Iode 
0,0 0,0 0,0 Cantharides, cantharidine et leurs préparations, basées sur la cantharidine, à l’exception des vésicatoires 
0,03 0,0 0,0 Cantharides, vésicatoires seulement 
0,2 0,0 0,0 Chlorate de potassium 
— 325 975 Chlorate de potassium (gargarisme) 
2,5 — — Chlorate de sodium 
— 325 975 Chlorhydrate d’amylocaïne, sauf lorsque vendu ou recommandé pour usage ophtalmique 
1,0 0,0 0,0 Chlorhydrate de cinchocaïne, à l’exception des suppositoires 
1,0 0,0 0,0 Chlorhydrate de cinchocaïne (suppositoires seulement) 
— 11 11 Chlorobutanol (à toutes les 4 heures au plus) 
— 325 975 Colchicine et ses sels 
— 0,55 1,65 Colchique et ses préparations, en colchicine 
— 0,27 0,81 Cyproheptadine et ses sels, lorsqu’ils sont vendus ou recommandés pour augmenter le poids 
— 0,0 0,0 Éphédrine et ses sels 
— 11 32,5 Éphédrine et ses sels (vaporisations) 
1,0 — — Épinéphrine et ses sels (vaporisations) 
1,0 — — Gelséminine (gelsémine) et ses sels (à toutes les 4 heures au plus) 
— 0,55 1,65 Gelsémium et ses préparations, en drogue brute 
— 16,2 48,6 Huile de cèdre 
25,0 0,0 0,0 Huile de croton 
10,0 0,0 0,0 Hydroquinone 
2,0 — — Hyoscine (scopolamine) et ses sels 
0,5 0,325 0,975 Hyoscyamine et ses sels 
— 0,325 0,975 Jusquiame et ses préparations, en alcaloïdes de jusquiame 
— 0,073 0,22 Lobélie et ses préparations, en drogue brute 
— 130 390 Lobéline et ses sels 
— 2,0 6,0 Phénacétine 
— 650 1,95 g Phénazone et ses composés 
— 325 975 Phénol 
2,0 32,5 260 Phénylpropanolamine, lorsqu’elle est vendue ou recommandée comme déprimant de l’appétit 
— 0,0 0,0 Phosphore 
— 0,0 0,0 Podophylline 
0,0 0,0 0,0 Procaïne et ses sels 
— — — Proxymétacaïne, ses sels et dérivés, lorsqu’ils sont vendus ou recommandés pour usage ophtalmique 
0,0 0,0 0,0 Salicylamide 
— 975 2,925 g Santonine 
— 65 130 Scille et ses préparations, en drogue brute 
— 32,5 97,5 Sélénium et ses composés 
2,5 0,0 0,0 Sodium (fluorure de) 
— 0,1 0,1 Stramoïne et ses préparations, en alcaloïdes de stramoïne 
— 0,16 0,65 Strychnine et ses sels 
— 0,0 0,0 Sulfate de butacaïne, sauf lorsque vendu ou recommandé pour usage ophtalmique 
1,0 0,0 0,0 Tétracaïne, ses sels et dérivés lorsqu’ils sont vendus ou recommandés pour usage ophtalmique 
0,0 0,0 0,0 Thiocyanates 
0,0 0,0 0,0 Uréthane 
0,0 0,0 0,0 Quand des drogues douées de propriétés physiologiques semblables sont en mélange, la dose de chacune doit être réduite proportionnellement.
Les doses exactes peuvent être exprimées en unités métriques ou en unités impériales. Si la dose est exprimée en unités des deux systèmes, l’une des données peut n’être qu’approximative, mais cette valeur approximative doit précéder ou suivre la donnée exacte d’après laquelle le produit sera jugé, et elle doit être indiquée entre parenthèses.
- DORS/78-422, art. 1
- DORS/80-544, art. 3
- DORS/84-145, art. 1
- DORS/85-715, art. 3
- DORS/85-966, art. 2
- DORS/88-94, art. 1
- DORS/89-229, art. 2
- DORS/89-548, art. 1
C.01.022 Nonobstant l’alinéa C.01.021b), la dose simple et la dose quotidienne recommandées, pour une drogue
a) destinée à être brûlée en vue de l’inhalation des fumées, peuvent être augmentées à 10 fois la dose orale; et
b) présentée en suppositoires, peuvent être augmentées à 33 1/3 pour cent en excédent de la dose orale.
C.01.024 (1) Les articles C.01.021 et C.01.022 ne s’appliquent pas
a) à une drogue vendue à un fabricant de drogues; ni
b) à une drogue vendue sur ordonnance.
(2) L’alinéa C.01.021c) ne s’applique pas
a) à l’acétaminophène;
b) à l’acide acétylsalicylique;
c) au salicylate de magnésium;
d) au salicylate de sodium; ni
e) au salicylate de choline.
(3) Lorsqu’une drogue mentionnée aux alinéas (2)a) à d) est recommandée pour les enfants, il est interdit de vendre cette drogue pour administration humaine à moins qu’il ne soit indiqué sur les étiquettes intérieure et extérieure
a) qu’il est recommandé de prendre cette drogue « selon les instructions du médecin »; ou
b) qu’il est recommandé de ne pas prendre de doses supérieures à celles indiquées dans le tableau ci-après et de ne pas administrer de doses simples à moins de quatre heures d’intervalle.
TABLEAU
Doses maximales
Article Colonne I Colonne II Colonne III Colonne IV Colonne V Colonne VI Colonne VII Âge Dose maximale pour enfants en unités posologiques de 80 mg d’acétaminophène en gouttes Dose maximale pour enfants en unités posologiques de 80 mg Dose maximale pour enfants en unités posologiques de 160 mg d’acétaminophène Dose maximale pour adultes en unités posologiques de 325 mg Dose maximale simple (en mg) Dose maximale quotidienne (en mg) 1 11 ans jusqu’à moins de 12 ans — 6 3 1,5 480 2 400 2 9 ans jusqu’à moins de 11 ans — 5 2,5 1,25 400 2 000 3 6 ans jusqu’à moins de 9 ans — 4 2 1 320 1 600 4 4 ans jusqu’à moins de 6 ans — 3 1,5 — 240 1 200 5 2 ans jusqu’à moins de 4 ans — 2 1 — 160 800 6 1 an jusqu’à moins de 2 ans 1,5 ou selon les instructions du médecin — — — 120 600 7 4 mois jusqu’à moins de 1 an 1 ou selon les instructions du médecin — — — 80 400 8 0 mois jusqu’à moins de 4 mois 0,5 ou selon les instructions du médecin — — — 40 200 (4) Lorsque le salicylate de choline est recommandé pour les enfants, il est interdit de vendre cette drogue pour administration humaine à moins qu’il ne soit indiqué sur les étiquettes intérieure et extérieure
a) qu’il est recommandé de prendre cette drogue « selon les instructions du médecin »; ou
b) qu’il est recommandé de ne pas prendre de doses supérieures à celles indiquées dans le tableau ci-après et de ne pas administrer de doses simples à moins de quatre heures d’intervalle.
TABLEAU
DOSE MAXIMUM Âge (Années) Unités posologiques adultes (435 mg) Dose simple (en mg) Dose maximum quotidienne (en mg) 11 à moins de 12 1 ½ 660 3 300 9 à moins de 11 1 ¼ 550 2 750 6 à moins de 9 1 440 2 200 4 à moins de 6 ¾ 330 1 650 2 à moins de 4 ½ 220 1 100 moins de 2 ans selon les instructions du médecin
- DORS/84-145, art. 2
- DORS/90-587, art. 1
C.01.025 Les étiquettes intérieure et extérieure d’une drogue portant une dose simple ou dose quotidienne recommandée, ou la déclaration d’une concentration dépassant les limites fixées à l’article C.01.021, doivent toutes deux porter une mise en garde signalant que le produit ne doit être employé que sur le conseil d’un médecin.
C.01.026 Les dispositions de l’article C.01.025 ne s’appliquent pas
a) à une drogue vendue sur ordonnance; ni
b) à l’étiquette intérieure d’un récipient à dose unique.
C.01.027 (1) Quiconque fait la publicité auprès du grand public d’une drogue pour administration humaine doit ne faire porter cette publicité que sur la marque nominative, le nom propre, le nom usuel, le prix et la quantité s’il s’agit d’une drogue :
a) qui contient une drogue mentionnée au tableau de l’article C.01.021;
b) dont l’étiquette fait état :
(i) soit d’une dose recommandée pour adultes, simple ou quotidienne, qui entraîne le dépassement de la dose maximum pour adultes, simple ou quotidienne, de la drogue visée à l’alinéa a) que prévoit le tableau de l’article C.01.021,
(ii) soit d’une concentration de la drogue visée à l’alinéa a) qui excède la dose maximum prévue au tableau de l’article C.01.021.
(2) Le paragraphe (1) ne s’applique pas aux produits contenant :
a) de l’acétaminophène;
b) de l’acide acétylsalicylique;
c) du salicylate de choline;
d) du salicylate de magnésium;
e) du salicylate de sodium.
(3) [Abrogé, DORS/94-409, art. 1]
(4) Quiconque fait la publicité auprès du grand public d’une drogue pour administration humaine qui contient de l’acide acétylsalicylique ne doit pas faire porter cette publicité sur son administration aux enfants ou aux adolescents ou sur son utilisation par eux.
- DORS/81-358, art. 1
- DORS/84-145, art. 3
- DORS/85-715, art. 4(F)
- DORS/85-966, art. 3
- DORS/93-202, art. 5
- DORS/93-411, art. 1
- DORS/94-409, art. 1
Mises en garde et emballages protège-enfants
C.01.028 (1) Sous réserve du paragraphe (2), les étiquettes intérieure et extérieure d’une drogue qui contient l’un des ingrédients suivants :
a) de l’acide acétylsalicylique ou un de ses sels ou dérivés, de l’acide salicylique ou un de ses sels, ou de la salicylamide doivent porter, si la drogue est recommandée pour les enfants, une mise en garde spécifiant que la drogue ne doit pas être administrée à un enfant de moins de deux ans sauf sur l’avis d’un médecin;
b) de l’acide borique ou du borate de sodium comme ingrédient médicinal doivent porter une mise en garde spécifiant que la drogue ne doit pas être administrée à un enfant de moins de trois ans;
c) de l’hyoscine (scopolamine) ou un de ses sels, doivent porter une mise en garde spécifiant que la drogue ne doit pas être employée par des personnes atteintes de glaucome, ni si elle provoque une sensation douloureuse de tension dans l’oeil ou embrouille la vue;
d) de la phénacétine, seule ou en combinaison avec d’autres drogues, doivent porter la mise en garde suivante :
« MISE EN GARDE : Peut être dangereux à fortes doses ou pendant un temps prolongé. Ne pas dépasser la dose recommandée sans consulter un médecin. »;
e) de l’acide acétylsalicylique destiné à l’usage interne doivent porter une mise en garde précisant que la drogue ne doit pas être administrée aux enfants ou aux adolescents atteint de la varicelle ou ayant les symptômes de la grippe ni utilisée par eux, sauf après consultation d’un médecin ou d’un pharmacien au sujet du syndrome de Reye; la mise en garde doit également signaler que le syndrome de Reye est une maladie rare et grave.
(2) Le paragraphe (1) ne s’applique pas :
a) à une drogue destinée exclusivement à l’usage parentéral;
b) à une drogue délivrée sur ordonnance;
c) à une drogue sur ordonnance ou à une drogue qui doit être vendue conformément à une ordonnance aux termes de la partie G, du Règlement sur les benzodiazépines et autres substances ciblées ou du Règlement sur les stupéfiants.
- DORS/86-93, art. 2
- DORS/88-323, art. 2(F)
- DORS/93-411, art. 2
- DORS/2013-122, art. 7
C.01.029 (1) Sous réserve des paragraphes C.01.031.2(1) et (2), une mise en garde spécifiant qu’il faut conserver la drogue hors de la portée des enfants doit figurer sur les étiquettes intérieure et extérieure d’une drogue :
a) qui contient l’un des ingrédients suivants :
(i) de l’acide salicylique, un de ses sels ou de la salicylamide,
(ii) de l’acide acétylsalicylique, un de ses sels ou dérivés,
(iii) de l’acétaminophène,
(iv) plus de cinq pour cent de salicylate d’alkyle;
a.1) qui contient de la nicotine ou l’un de ses sels et est un produit de vapotage au sens de l’article 2 de la Loi sur le tabac et les produits de vapotage, mais n’est pas visée aux alinéas 2b) ou c) ou à l’article 3 du Règlement soustrayant certains produits de vapotage régis par la Loi sur les aliments et drogues à l’application de la Loi sur le tabac et les produits de vapotage;
b) qui est dans un emballage qui renferme :
(i) soit plus que l’équivalent de 250 mg de fer élément,
(ii) soit plus que l’équivalent de 120 mg d’ion fluorure, à moins que la drogue ne soit réservée à l’usage des cabinets de dentiste.
(2) Sous réserve des paragraphes C.01.031.2(1) et (2), doit figurer sur l’étiquette intérieure et l’étiquette extérieure une mise en garde spécifiant que la quantité de drogue contenue dans l’emballage est suffisante pour causer un préjudice sérieux à un enfant lorsque l’emballage renferme, selon le cas :
a) plus de 1,5 g d’acide salicylique ou d’une quantité équivalente de l’un de ses sels ou de la salicylamide;
b) plus de 2,0 g d’acide acétylsalicylique ou d’une quantité équivalente de l’un de ses sels ou dérivés;
c) plus de 3,2 g d’acétaminophène;
d) plus de l’équivalent de 250 mg de fer élément;
e) plus que l’équivalent de 120 mg d’ion fluorure, à moins que la drogue ne soit réservée à l’usage des cabinets de dentiste;
f) dans le cas où la drogue est un produit de vapotage au sens de l’article 2 de la Loi sur le tabac et les produits de vapotage mais n’est pas visée aux alinéas 2b) ou c) ou à l’article 3 du Règlement soustrayant certains produits de vapotage régis par la Loi sur les aliments et drogues à l’application de la Loi sur le tabac et les produits de vapotage, 0,1 mg/ml de nicotine, ou une quantité équivalente de l’un de ses sels, ou plus.
(3) Les mises en garde exigées aux paragraphes (1) et (2) doivent être précédées d’un symbole bien en évidence de forme octogonale et de couleur frappante sur fond de couleur contrastante.
- DORS/86-93, art. 2
- DORS/87-484, art. 2
- DORS/88-323, art. 3(F)
- DORS/90-587, art. 2
- DORS/93-468, art. 1
- DORS/2018-132, art. 1
C.01.030 [Abrogé, DORS/2003-196, art. 104]
C.01.031 (1) Sous réserve de l’article C.01.031.2,
a) est interdite la vente d’une drogue mentionnée au paragraphe C.01.029(1) à moins
(i) qu’elle ne soit emballée dans un emballage protège-enfants lorsque la drogue est recommandée exclusivement pour les enfants,
(ii) qu’elle ne soit offerte dans au moins un format d’emballage protège-enfants lorsque la drogue n’est pas recommandée exclusivement pour les enfants, sauf s’il s’agit d’une drogue qui est visée au sous-alinéa (iii),
(iii) qu’elle ne soit emballée dans un emballage protège-enfants lorsque la drogue est un produit de vapotage visé à l’alinéa C.01.029(1)a.1);
b) lorsqu’une drogue mentionnée au paragraphe C.01.029(1) est emballée dans un emballage qui n’est pas un emballage protège-enfants, l’étiquette extérieure doit indiquer que la drogue est disponible dans un emballage protège-enfants.
(2) Le paragraphe C.01.031.2(2) et l’alinéa C.01.031.2(3)a) ne s’appliquent pas à une drogue visée à l’alinéa C.01.029(1)a.1).
- DORS/86-93, art. 2
- DORS/87-16, art. 1
- DORS/93-468, art. 2
- DORS/2018-132, art. 2
C.01.031.1 [Abrogé, DORS/87-484, art. 3]
C.01.031.2 (1) Les articles C.01.029 à C.01.031 ne s’appliquent pas à :
a) une drogue sur ordonnance ou une drogue qui doit être vendue conformément à une ordonnance aux termes de la partie G, du Règlement sur les benzodiazépines et autres substances ciblées ou du Règlement sur les stupéfiants;
b) une drogue destinée exclusivement à l’usage parentéral;
c) une drogue sous forme de préparation effervescente ou de poudre;
d) une drogue sous forme de suppositoire;
e) une drogue destinée à l’usage topique, sauf s’il s’agit d’une préparation liquide contenant plus de cinq pour cent de salicylate d’alkyle;
f) une drogue emballée dans un emballage non refermable contenant au plus deux doses normales pour un adulte;
g) une drogue sous forme de pâte dentifrice.
(2) Les articles C.01.029 à C.01.031 ne s’appliquent pas à une drogue qui est remballée par un pharmacien ou un praticien au moment de la vente.
(3) L’article C.01.031 ne s’applique pas à :
a) une drogue vendue seulement dans un contenant muni d’un applicateur à bille ou d’un vaporisateur ou d’un applicateur à mèche fixé en permanence;
b) une drogue vendue exclusivement à l’intention des animaux autres que les animaux familiers;
c) une drogue réservée à l’usage des cabinets de dentiste ou présentée dans un emballage destiné uniquement aux hôpitaux.
- DORS/86-93, art. 2
- DORS/87-484, art. 4
- DORS/88-323, art. 5(F)
- DORS/93-468, art. 3
- DORS/2013-122, art. 8
C.01.032 Est interdite la vente de toute drogue corticostéroïde pour usage ophtalmique, à moins
a) que l’étiquette extérieure ou la notice d’accompagnement ne porte, comme partie du mode d’emploi, les déclarations ci-dessous :
« Contre-indications
Affections virales de la cornée et des conjonctives
Tuberculose des yeux
Affections fongiques des yeux
Infections purulentes aiguës et non traitées des yeux, qui, à l’instar des autres affections causées par des micro-organismes, peuvent être masquées ou stimulées par la présence du stéroïde.
Effets secondaires
L’usage ophtalmique prolongé des drogues corticostéroïdes peut causer un accroissement de la pression intra-oculaire chez certains sujets et, dans les affections causant l’amincissement de la cornée, on a vu des perforations se produire; »
et
b) que l’étiquette intérieure ne porte les déclarations requises par l’alinéa a) ou les instructions de lire l’étiquette extérieure ou la notice d’accompagnement pour se renseigner sur les contre-indications et les effets secondaires.
- DORS/2018-69, art. 18(F)
C.01.033 L’article C.01.032 ne s’applique pas à une drogue corticostéroïde vendue par un pharmacien conformément à une ordonnance.
- DORS/2013-122, art. 9
C.01.034 Est interdit l’envoi, à un praticien de, matières publicitaires relatives aux drogues corticostéroïdes pour usage ophtalmique à moins que les déclarations requises par l’alinéa C.01.032a) ne soient incluses dans ces matières.
C.01.035 Les articles C.01.032 et C.01.034 ne s’appliquent pas à une drogue vendue pour l’usage vétérinaire seulement.
Divers
C.01.036 (1) Il est interdit à un fabricant ou importateur de vendre
a) une drogue qui contient de la phénacétine associée à un sel ou à un dérivé de l’acide salicylique;
b) une drogue pour usage humain qui contient de l’oxyphénisatine, de l’acétate d’oxyphénisatine ou de la phénisatine; ou
c) une drogue pour usage humain qui contient du mercure ou l’un de ses sels ou dérivés, sauf s’il s’agit de l’une des drogues suivantes dans laquelle le mercure ou l’un de ses sels ou dérivés est utilisé comme agent de conservation et pour laquelle le fabricant ou l’importateur a soumis au ministre des preuves démontrant que l’utilisation de cet agent de conservation est le seul moyen satisfaisant d’assurer la stérilité ou la stabilité de la drogue :
(i) une drogue mentionnée aux annexes C ou D de la Loi,
(ii) l’une des drogues suivantes :
(A) une drogue ophtalmique ou une drogue pour usage dans la région oculaire,
(B) une drogue pour administration par voie nasale,
(C) une drogue pour administration par voie otique,
(D) une drogue à usage parentéral emballée dans un contenant à doses multiples.
(2) Pour l’application de la division (1)c)(ii)(A), région oculaire désigne la région délimitée par les crêtes supraorbitale et infraorbitale et comprend les sourcils, la peau située sous les sourcils, les paupières, les cils, le sac conjonctival de l’oeil, le globe oculaire et le tissu mou situé sous l’oeil et à l’intérieur de la crête infraorbitale.
- DORS/78-423, art. 2
- DORS/86-93, art. 3
- DORS/89-229, art. 3
- DORS/2018-69, art. 27
C.01.036.1 Est interdite la vente au grand public de l’oxyde nitreux ainsi que la publicité le concernant.
- DORS/78-875, art. 1
C.01.037 (1) Il est interdit de vendre au grand public une drogue recommandée exclusivement pour les enfants si l’emballage qui la contient renferme :
a) soit plus de 1,92 g de salicylamide ou d’acide salicylique ou de la quantité équivalente de l’un des sels d’acide salicylique;
b) soit plus de 1,92 g d’acide acétylsalicylique ou de la quantité équivalente de l’un de ses sels ou dérivés;
c) soit plus de 3,2 g en unités posologiques de 160 mg d’acétaminophène;
d) soit plus de 1,92 g en unités posologiques de 80 mg d’acétaminophène.
(2) Le paragraphe (1) ne s’applique pas à une drogue délivrée sur ordonnance.
- DORS/86-93, art. 4
- DORS/87-484, art. 5
- DORS/88-323, art. 6
- DORS/90-587, art. 3
C.01.038 Une drogue destinée à l’usage des humains est adultérée si elle contient
a) de la strychnine ou l’un de ses sels;
b) des extraits ou des teintures de
(i) Strychnos nux vomica,
(ii) Strychnos Ignatti, ou
(iii) une espèce de Strychnos qui contient de la strychnine, autre que les espèces mentionnées aux sous-alinéas (i) et (ii),
c) du méthapyrilène ou l’un de ses sels;
d) de l’échimidine ou l’un de ses sels; ou
e) des plantes des espèces suivantes ou des extraits ou des teintures de :
(i) Symphytum asperum,
(ii) Symphytum x uplandicum, ou
(iii) toute autre espèce de plante qui contient de l’échimidine.
- DORS/79-512, art. 1
- DORS/88-173, art. 1
C.01.039 Sont soustraits de l’application de la présente partie, les produits de diagnostic in vitro qui sont des drogues ou qui contiennent des drogues autres que celles visées à l’annexe E de la Loi ainsi que toute drogue visée à l’annexe D de la Loi dont l’étiquette porte qu’elle ne doit servir qu’en médecine vétérinaire.
- DORS/97-12, art. 4
C.01.040 Il est interdit à tout fabricant ou importateur de vendre une drogue pour usage humain qui contient l’un des ingrédients suivants :
a) du chloroforme;
b) de l’arsenic ou l’un de ses sels ou dérivés, sauf le trioxyde d’arsenic.
- DORS/89-229, art. 4
- DORS/2013-113, art. 1
C.01.040.1 Il est interdit à tout fabricant d’utiliser du salicylate de méthyle comme ingrédient médicinal dans une drogue pour usage interne destinée aux humains.
- DORS/78-422, art. 2
- DORS/78-801, art. 1
- DORS/81-334, art. 2(F)
- DORS/89-176, art. 1
- DORS/92-662, art. 1
Colorants
C.01.040.2 (1) Il est interdit à un fabricant d’employer dans une drogue un colorant qui n’est pas prévu aux paragraphes (3) et (4).
(2) Il est interdit à quiconque d’importer à des fins de vente une drogue qui contient un colorant non prévu aux paragraphes (3) et (4).
(2.1) Les définitions qui suivent s’appliquent aux paragraphes (3) à (4.1) :
- C.I. (indication du numéro)
C.I. (indication du numéro) Désignation servant à identifier un colorant selon la publication intitulée Colour Index, publiée par The Society of Dyers and Colourists, avec ses modifications successives. (C.I. (indication of the number))
- D&C (indication de la couleur et du numéro)
D&C (indication de la couleur et du numéro) Désignation servant à identifier un colorant pouvant être utilisé aux États-Unis dans les drogues et les cosmétiques, selon le Code of Federal Regulations des États-Unis. (D & C (indication of the colour and the number))
- FD&C (indication de la couleur et du numéro)
FD&C (indication de la couleur et du numéro) Désignation servant à identifier un colorant pouvant être utilisé aux États-Unis dans les aliments, les drogues et les cosmétiques, selon le Code of Federal Regulations des États-Unis. (FD & C (indication of the colour and the number))
(3) Les colorants qui peuvent être employés dans les drogues à usage interne ou externe sont les suivants :
a) AMARANTE (FD&C, Rouge no 2, radié; C.I. no 16185),
- ANTHOCYANINE PROVENANT DE JUS EXPRIMÉ DE FRUITS OU DE LÉGUMES COMESTIBLES FRAIS,
- ß-APO-8′-CAROTÉNAL (C.I. no 40820),
- BLEU BRILLANT FCF, SEL D’AMMONIUM (D&C Bleu no 4, C.I. no 42090),
- BLEU BRILLANT FCF, SEL SODIQUE (FD&C Bleu no 1, C.I. no 42090),
- CANTHAXANTHINE (C.I. no 40850),
- CARAMEL,
- CARMINE (C.I. no 75470),
- CARMOISINE (Ext. D&C Rouge no 10, radié : C.I. no 14720),
- ß-CAROTÈNE (C.I. no 40800),
- CHLOROPHYLLE (C.I. no 75810),
- DIOXYDE DE TITANE (C.I. no 77891),
- ÉOSINE YS, FORME ACIDE (D&C Rouge no 21; C.I. no 45380:2),
- ÉOSINE YS, SEL SODIQUE (D&C Rouge no 22; C.I. no 45380),
- ÉRYTHROSINE (FD&C Rouge no 3; C.I. no 45430),
- FUSCHINE ACIDE D (D&C Rouge no 33 C.I. no 17200),
- INDIGO (D&C Bleu no 6; C.I. no 73000),
- INDIGOTINE (FD&C Bleu no 2; C.I. no 73015),
- JAUNE DE QUINOLÉINE WS (D&C Jaune no 10; C.I. no 47005),
- JAUNE SOLEIL FCF (FD&C Jaune no 6; C.I. no 15985),
- LITHOL RUBINE B, SEL DE CALCIUM (D&C Rouge no 7, C.I. no 15850:1),
- LITHOL RUBINE B, SEL SODIQUE (D&C Rouge no 6; C.I. no 15850),
- NOIR DE FUMÉE (C.I. no 77266),
- OXYDES DE FER (C.I. nos 77489, 77491, 77492 et 77499),
- PHLOXINE B, FORME ACIDE (D&C Rouge no 27; C.I. no 45410:1),
- PHLOXINE B, SEL SODIQUE (D&C Rouge no 28; C.I. no 45410),
- PONCEAU SX (FD&C Rouge no 4; C.I. no 14700),
- PONCEAU 4R (C.I. no 16255),
- RIBOFLAVINE,
- ROSE HÉLINDONE CN (D&C Rouge no 30; C.I. no 73360),
- ROUGE ALLURA AC (FD&C Rouge no 40; C.I., no 16035),
- ROUGE FEU (D&C Rouge no 36; C.I. no 12085),
- TARTRAZINE (FD&C Jaune no 5; C.I. no 19140),
- VERT D’ALIZARINE CYANINE F (D&C Vert no 5; C.I. no 61570),
- VERT SOLIDE FCF (FD&C Vert no 3; C.I. no 42053);
b) les préparations effectuées par l’addition d’un des colorants énumérés à l’alinéa a) à un substrat
(i) d’alumine,
(ii) de blanc fixe,
(iii) de blanc lustré,
(iv) d’argile,
(v) d’oxyde de zinc,
(vi) de talc,
(vii) de colophane,
(viii) de benzoate d’aluminium,
(ix) de carbonate de calcium, ou
(x) d’une combinaison des substances visées aux sous-alinéas (i) à (ix); et
c) les préparations effectuées par l’addition d’un sel de sodium, de potassium, d’aluminium, de baryum, de calcium, de strontium ou de zirconium d’un des colorants énumérés à l’alinéa a) à un substrat
(i) d’alumine,
(ii) de blanc fixe,
(iii) de blanc lustré,
(iv) d’argile,
(v) d’oxyde de zinc,
(vi) de talc,
(vii) de colophane,
(viii) de benzoate d’aluminium,
(ix) de carbonate de calcium, ou
(x) d’une combinaison des substances visées aux sous-alinéas (i) à (ix).
(4) Les colorants suivants peuvent être employés uniquement dans les drogues à usage externe :
a) DIBROMOFLUORESCÉINE (ROUGE SOLVANT 72 (C.I. no 45370:1) ORANGE no 5 (D&C Orange no 5)),
- FERROCYANURE FERRIQUE (C.I. no 77510),
- GUANINE (C.I. no 75170),
- MARRON FONCÉ (D&C Rouge no 34; C.I. no 15880:1),
- MICA (C.I. no 77019),
- ORANGE II (D&C Orange no 4; C.I. no 15510),
- OXYCHLORURE DE BISMUTH (C.I. no 77163),
- OXYDE DE ZINC (C.I. no 77947),
- POURPRE D’ALIZUROL SS (D&C Violet no 2; C.I. no 60725),
- PYRANINE CONCENTRÉE (D&C Vert no 8; C.I. no 59040),
- ROCOU (C.I. no 75120),
- ROUGE TONEY (D&C Rouge no 17; C.I. no 26100),
- URANINE, FORME ACIDE (D&C Jaune no 7; C.I. no 45350:1),
- URANINE, SEL SODIQUE (D&C Jaune no 8; C.I. no 45350),
- VERT DE QUINIZARINE SS (D&C Vert no 6; C.I. no 61565),
- VERT D’HYDROXYDE DE CHROME (PIGMENT VERT 18 (C.I. no 77289)),
- VIOLET ACIDE 43 (Ext. D&C Violet no 2; C.I. no 60730),
- VIOLET DE MANGANÈSE (C.I. no 77742);
b) les préparations effectuées par l’addition d’un des colorants énumérés à l’alinéa a) à un substrat
(i) d’alumine,
(ii) de blanc fixe,
(iii) de blanc lustré,
(iv) d’argile,
(v) d’oxyde de zinc,
(vi) de talc,
(vii) de colophane,
(viii) de benzoate d’aluminium,
(ix) de carbonate de calcium, ou
(x) d’une combinaison des substances visées aux sous-alinéas (i) à (ix); et
c) les préparations effectuées par l’addition d’un sel de sodium, de potassium, d’aluminium, de baryum, de calcium, de strontium ou de zirconium d’un des colorants énumérés à l’alinéa a) à un substrat
(i) d’alumine,
(ii) de blanc fixe,
(iii) de blanc lustré,
(iv) d’argile,
(v) d’oxyde de zinc,
(vi) de talc,
(vii) de colophane,
(viii) de benzoate d’aluminium,
(ix) de carbonate de calcium, ou
(x) d’une combinaison des substances visées aux sous-alinéas (i) à (ix).
(4.1) Malgré le paragraphe (1), aucun fabricant ne peut employer dans une drogue une préparation effectuée par l’addition d’une des substances suivantes à un substrat de mica, sauf si les conditions prévues au paragraphe (4.3) sont réunies :
a) dioxyde de titane (C.I. no 77891);
b) oxydes de fer (C.I. nos 77489, 77491, 77492, 77499);
c) un oxyde mixte effectué avec des substances mentionnées à la fois aux alinéas a) et b).
(4.2) Malgré le paragraphe (2), il est interdit d’importer en vue de la vente d’une drogue contenant une préparation effectuée par l’addition à un substrat de mica d’une des substances mentionnées aux alinéas (4.1) a) à c), sauf si les conditions prévues au paragraphe (4.3) sont réunies.
(4.3) Les conditions visées aux paragraphes (4.1) et (4.2) sont les suivantes :
a) la drogue est à usage externe ou se présente sous forme posologique solide destinée à l’administration orale ou sous forme posologique liquide destinée à l’administration orale;
b) s’agissant d’une drogue se présentant sous forme posologique solide destinée à l’administration orale, elle contient au plus 3 % de la préparation;
c) s’agissant d’une préparation effectuée avec des oxydes de fer, elle contient au plus 55 % d’oxydes de fer.
(5) Les paragraphes (1), (2), (4.1) et (4.2) ne s’appliquent pas à la drogue qui est présentée comme étant destinée exclusivement, aux fins de prévention des maladies, à la désinfection :
a) des instruments médicaux;
b) des établissements de soins de santé;
c) des locaux où sont fabriqués, préparés ou gardés des aliments.
- DORS/84-949, art. 1
- DORS/86-590, art. 1(A)
- DORS/94-460, art. 1
- DORS/95-431, art. 1
- DORS/2002-369, art. 1
- DORS/2005-95, art. 1
- DORS/2018-248, art. 1
Drogues sur ordonnance
C.01.040.3 Pour décider s’il convient de modifier la Liste des drogues sur ordonnance en ce qui concerne une drogue, notamment par l’ajout ou le retrait de celle-ci, le ministre vérifie si l’un des critères ci-après s’applique à la drogue :
a) la surveillance d’un praticien est nécessaire :
(i) pour diagnostiquer, traiter, atténuer ou prévenir une maladie, un désordre ou un état physique anormal, ou leurs symptômes, à l’égard desquels l’utilisation de la drogue est recommandée,
(ii) pour faire le suivi d’une maladie, d’un désordre ou d’un état physique anormal, ou de leurs symptômes, à l’égard desquels l’utilisation de la drogue est recommandée, ou faire le suivi de l’utilisation de la drogue;
b) le degré d’incertitude que suscite la drogue, son utilisation ou ses effets justifie une telle surveillance;
c) l’utilisation de la drogue peut causer un préjudice pour la santé humaine ou animale, ou poser un risque pour la santé publique, que la surveillance d’un praticien peut atténuer.
- DORS/2013-122, art. 10
- DORS/2017-18, art. 21(F)
C.01.040.4 Dans le cas où il se propose de retirer une drogue de la Liste des drogues sur ordonnance, le ministre consulte le grand public à ce sujet.
- DORS/2013-122, art. 10
C.01.040.5 Les articles C.01.040.3 et C.01.040.4 s’appliquent, avec les adaptations nécessaires, à l’égard des catégories de drogues.
- DORS/2013-122, art. 10
C.01.041 (1) Il est interdit à quiconque de vendre une drogue sur ordonnance sauf dans les cas suivants :
a) la personne est autorisée en vertu des lois d’une province à délivrer une telle drogue, et elle la vend dans cette province conformément à une ordonnance écrite ou verbale qu’elle a reçue;
b) elle le fait en vertu de l’article C.01.043.
(2) Dans le cas d’une ordonnance verbale, la personne visée à l’alinéa (1)a) ou un technicien en pharmacie la consigne dans un document en précisant les renseignements suivants :
a) la date de réception de l’ordonnance et, le cas échéant, le numéro de celle-ci;
b) le nom et l’adresse de la personne visée par l’ordonnance;
c) le nom propre, le nom usuel ou la marque nominative de la drogue et sa quantité;
d) son nom et celui du praticien qui a délivré l’ordonnance;
e) le mode d’emploi fourni avec l’ordonnance, le fait que le praticien en autorise ou non le renouvellement et, s’il le fait, le nombre de renouvellements qu’il autorise.
(3) La personne visée à l’alinéa (1)a) conserve l’ordonnance écrite ou le document mentionné au paragraphe (2), selon le cas, durant une période d’au moins deux ans suivant la date d’exécution de l’ordonnance.
- DORS/78-424, art. 2
- DORS/80-543, art. 3
- DORS/93-202, art. 6
- DORS/93-407, art. 2
- DORS/2013-122, art. 11
C.01.041.1 Sous réserve de l’alinéa C.01.041.3(2)b), le pharmacien ou le technicien en pharmacie peut transférer à un autre pharmacien ou technicien en pharmacie toute ordonnance relative à une drogue sur ordonnance.
- DORS/78-424, art. 3
- DORS/2013-122, art. 11
C.01.041.2 (1) Avant que le pharmacien ne vende une drogue conformément à une ordonnance transférée en vertu de l’article C.01.041.1, lui-même ou le technicien en pharmacie prend les mesures suivantes :
a) il consigne dans un document les nom et adresse du pharmacien ou du technicien en pharmacie qui a transféré l’ordonnance ainsi que, le cas échéant, le nombre restant de renouvellements autorisés et la date du dernier renouvellement;
b) il obtient une copie de l’ordonnance écrite ou du document mentionné au paragraphe C.01.041(2), selon le cas, ou, en cas de transfert verbal, il établit un tel document.
(2) Le pharmacien conserve les documents visés au paragraphe (1) durant une période d’au moins deux ans suivant la date d’exécution de l’ordonnance.
- DORS/78-424, art. 3
- DORS/2013-122, art. 11
C.01.041.3 (1) Le pharmacien ou le technicien en pharmacie qui transfère une ordonnance en vertu de l’article C.01.041.1 inscrit la date du transfert sur l’original de l’ordonnance écrite ou du document mentionné au paragraphe C.01.041(2), ou dans un dossier sur le patient en question, selon le cas.
(2) Une fois que le pharmacien ou le technicien en pharmacie a transféré l’ordonnance :
a) le pharmacien ne peut faire aucune autre vente au titre de cette dernière;
b) le pharmacien ou le technicien en pharmacie ne peut la transférer à un autre pharmacien ou technicien en pharmacie.
- DORS/78-424, art. 3
- DORS/2013-122, art. 11
C.01.041.4 [Abrogé, DORS/2013-122, art. 11]
C.01.042 La personne visée à l’alinéa C.01.041(1)a) ne peut renouveler une ordonnance relative à une drogue sur ordonnance à moins d’obtenir du praticien une autorisation à cet effet, auquel cas elle ne peut le faire pour un nombre de fois supérieur à celui fixé par ce dernier.
- DORS/78-424, art. 4
- DORS/2013-122, art. 11
C.01.042.1 La personne visée à l’alinéa C.01.041(1)a) inscrit sur l’original ou une copie de l’ordonnance écrite ou du document mentionné au paragraphe C.01.041(2), ou dans un dossier sur le patient en question, selon le cas :
a) la date d’exécution de l’ordonnance;
b) la date d’exécution de chaque renouvellement, le cas échéant;
c) la quantité de drogue vendue lors de l’exécution de l’ordonnance et, le cas échéant, lors de l’exécution de chaque renouvellement;
d) le nom de la personne qui vend la drogue.
- DORS/2013-122, art. 11
C.01.043 (1) Est permise la vente de drogues sur ordonnance aux personnes et entités suivantes :
a) les fabricants de drogues;
b) les praticiens;
c) les pharmaciens en gros;
d) les pharmaciens;
e) le gouvernement du Canada ou d’une province, à l’usage d’un de ses ministères ou organismes, sur réception d’une commande écrite signée par le ministre en cause ou le responsable de l’organisme, ou leur représentant dûment autorisé.
(2) Quiconque vend une drogue sur ordonnance en vertu de l’alinéa (1)e) doit conserver la commande écrite relative à la drogue durant une période d’au moins deux ans suivant la date de la vente.
- DORS/2013-122, art. 11
C.01.044 Quiconque fait la publicité auprès du grand public d’une drogue sur ordonnance ne peut faire porter la publicité que sur la marque nominative, le nom propre, le nom usuel, le prix et la quantité de la drogue.
- DORS/78-424, art. 5
- DORS/93-202, art. 7
- DORS/93-407, art. 3
- DORS/2013-122, art. 11
C.01.045 Est interdite l’importation de drogues sur ordonnance par les personnes autres que les personnes suivantes :
a) les praticiens;
b) les fabricants de drogues;
c) les pharmaciens en gros;
d) les pharmaciens;
e) les résidents d’un pays étranger, durant leur séjour au Canada.
- DORS/93-407, art. 4
- DORS/2013-122, art. 11
C.01.046 [Abrogé, DORS/2013-122, art. 11]
C.01.047 [Abrogé, DORS/80-543, art. 4]
Distribution de drogues à titre d’échantillons
- DORS/2020-74, art. 2
C.01.048 (1) La personne qui reçoit une commande signée par un praticien ou un pharmacien peut distribuer ou faire distribuer à celui-ci, à titre d’échantillon, une drogue sous forme posologique, autre que celles mentionnées ci-après, dont le nom propre ou le nom usuel, la marque nominative et la quantité sont précisés dans la commande, si la drogue est conforme aux exigences du présent règlement :
a) un stupéfiant au sens du Règlement sur les stupéfiants;
b) une drogue contrôlée au sens de l’article G.01.001;
c) [Abrogé, DORS/2020-74, art. 3]
d) une drogue sur ordonnance au sens du paragraphe 1(2) du Règlement sur le cannabis.
(1.1) Il n’est permis, en vertu du paragraphe (1), de distribuer ou de faire distribuer une drogue sur ordonnance, à titre d’échantillon, à un praticien ou à un pharmacien que si celui-ci est autorisé à prescrire ou à dispenser la drogue en vertu des lois de la province où il exerce.
(2) Une commande dont il est question au paragraphe (1) peut spécifier que ladite commande sera renouvelée à intervalles y indiqués pendant une période d’au plus six mois.
(3) Malgré le paragraphe (1), il est permis de distribuer ou de faire distribuer à un praticien ou à un pharmacien, à titre d’échantillon, une drogue sous forme posologique qui n’est pas une drogue sur ordonnance et qui appartient à une catégorie de drogues figurant à la colonne 1 de la Liste D, sans avoir reçu au préalable une commande signée à cet égard, si les conditions suivantes sont réunies :
a) la drogue contient comme seuls ingrédients médicinaux un ou plusieurs de ceux visés à la colonne 2 dont la quantité figure à la colonne 3 et elle correspond aux renseignements descriptifs visés aux colonnes 4 à 6;
b) la date limite d’utilisation de la drogue est, selon le cas :
(i) si elle est indiquée par le jour, le mois et l’année, au moins trente jours après la date à laquelle la drogue a été distribuée,
(ii) si elle est indiquée uniquement par le mois et l’année, un mois quelconque suivant celui de la date à laquelle la drogue a été distribuée;
c) la drogue est conforme aux exigences du présent règlement.
- DORS/93-202, art. 9
- DORS/97-228, art. 2
- DORS/2018-144, art. 366
- DORS/2019-171, art. 24
- DORS/2020-74, art. 3
C.01.049 La personne qui, au titre du paragraphe C.01.048(1), reçoit une commande à l’égard d’une drogue et la distribue ou la fait distribuer, à titre d’échantillon, doit :
a) tenir des dossiers indiquant
(i) le nom, l’adresse et les titres professionnels de toute personne à qui la drogue est distribuée,
(ii) la marque nominative, la quantité et la forme de présentation de cette drogue,
(iii) la date de distribution de ladite drogue; et
b) conserver lesdits dossiers, ainsi que toutes les commandes reçues en vertu de l’article C.01.048, pendant au moins deux ans, à compter de la date à laquelle la distribution inscrite aux dossiers a eu lieu.
- DORS/93-202, art. 10
- DORS/2020-74, art. 4
C.01.049.1 Il est permis de distribuer ou de faire distribuer aux consommateurs agés de 18 ans ou plus, à titre d’échantillon, une drogue sous forme posologique qui n’est pas une drogue sur ordonnance et qui appartient à une catégorie de drogues figurant à la colonne 1 de la Liste D, si les conditions suivantes sont réunies :
a) la drogue contient comme seuls ingrédients médicinaux un ou plusieurs de ceux visés à la colonne 2 dont la quantité figure à la colonne 3 et elle correspond aux renseignements descriptifs visés aux colonnes 4 à 6;
b) la date limite d’utilisation de la drogue est, selon le cas :
(i) si elle est indiquée par le jour, le mois et l’année, au moins trente jours après la date à laquelle la drogue a été distribuée,
(ii) si elle est indiquée uniquement par le mois et l’année, un mois quelconque suivant celui de la date à laquelle la drogue a été distribuée;
c) la drogue est conforme aux exigences du présent règlement.
Renseignements — risque grave de préjudice à la santé humaine
C.01.050 (1) Le présent article s’applique au titulaire de l’une des autorisations relatives à un produit thérapeutique suivantes :
a) l’identification numérique attribuée en application du paragraphe C.01.014.2(1);
b) l’avis de conformité délivré en application des articles C.08.004 ou C.08.004.01.
(2) Le titulaire d’une autorisation relative à un produit thérapeutique délivrée à l’égard d’une drogue appartenant à l’une des catégories mentionnées au paragraphe (4) fournit au ministre les renseignements dont il a reçu communication ou a connaissance concernant tout risque grave de préjudice à la santé humaine et se rapportant à la sécurité de la drogue en ce qui concerne :
a) les risques communiqués, et la façon dont ils l’ont été, par toute autorité réglementaire étrangère mentionnée dans la partie A de la Liste des autorités réglementaires étrangères pour l’application de l’article C.01.050 du Règlement sur les aliments et drogues, publiée par le gouvernement du Canada sur son site Web, avec ses modifications successives, ou par toute personne autorisée à fabriquer ou à vendre une drogue sur le territoire relevant de la compétence d’une telle autorité;
b) les changements apportés à l’étiquetage de toute drogue à la demande de toute autorité réglementaire étrangère mentionnée dans la partie B de la liste visée à l’alinéa a) ou communiqués à une telle autorité;
c) les rappels, les réévaluations et les suspensions ou révocations d’autorisations, notamment de licences, relativement à toute drogue, sur le territoire relevant de la compétence de toute autorité réglementaire étrangère mentionnée dans la partie C de la liste visée à l’alinéa a).
(3) Il fournit ces renseignements au ministre au plus tard soixante-douze heures après en avoir reçu communication ou en avoir eu connaissance, selon la première des deux éventualités à survenir.
(4) Les catégories de drogues sont les suivantes :
a) les drogues sur ordonnance;
b) les drogues qui doivent être vendues conformément à une ordonnance aux termes de la partie G, du Règlement sur les benzodiazépines et autres substances ciblées ou du Règlement sur les stupéfiants;
c) les drogues qui peuvent être vendues sans ordonnance, mais à administrer uniquement sous la surveillance d’un praticien.
(5) Malgré le paragraphe (2), le titulaire d’une autorisation relative à un produit thérapeutique qui a fourni des renseignements en application :
a) de l’alinéa (2)a) n’est pas tenu de fournir les mêmes renseignements de nouveau, en application de cet alinéa, dans le cas où il en a reçu communication ou en a connaissance relativement à une autorité réglementaire étrangère ou à une personne visées par cet alinéa;
b) des alinéas (2)b) ou c) n’est pas tenu de fournir les mêmes renseignements de nouveau, en application de ces alinéas, dans le cas où il en a reçu communication ou en a connaissance relativement à une autorité réglementaire étrangère visée par cet alinéa.
(6) Au présent article, autorité réglementaire étrangère s’entend de tout organisme gouvernemental ou de toute autre entité, ailleurs qu’au Canada, qui est habilité à contrôler la fabrication, l’utilisation ou la vente de drogues sur le territoire relevant de sa compétence et qui peut prendre des mesures d’exécution pour veiller à ce que les drogues qui y sont commercialisées satisfassent aux exigences légales qui s’appliquent.
- DORS/2018-84, art. 2
- DORS/2020-262, art. 2(F)
Retrait du marché
C.01.051 Un fabricant qui vend une drogue sous une forme posologique ou une personne qui importe et vend au Canada une drogue sous une forme posologique doivent, s’ils décident de retirer la drogue du marché, fournir au ministre les renseignements suivants dès le début du retrait :
a) le nom propre de la drogue ou, à défaut, son nom usuel, ainsi que la marque nominative de la drogue et le numéro du lot;
b) dans le cas d’une drogue importée, le nom du fabricant et de l’importateur;
c) la quantité de la drogue fabriquée ou importée;
d) la quantité de la drogue distribuée;
e) la quantité de la drogue qui reste dans les locaux du fabricant ou de l’importateur;
f) les raisons qui ont motivé le retrait; et
g) toute autre mesure prise par le fabricant ou l’importateur relativement au retrait.
- DORS/82-524, art. 2
- DORS/93-202, art. 11
- DORS/2018-69, art. 27
Évaluations ordonnées en vertu de l’article 21.31 de la Loi
C.01.052 (1) Le pouvoir du ministre de donner un ordre visant une drogue en vertu de l’article 21.31 de la Loi est assujetti aux conditions suivantes :
a) la personne à qui l’ordre est donné est titulaire de l’une des autorisations relatives à un produit thérapeutique ci-après à l’égard de la drogue :
(i) l’identification numérique attribuée en application du paragraphe C.01.014.2(1),
(ii) la licence d’établissement délivrée en application du paragraphe C.01A.008(1),
(iii) l’avis de conformité délivré en application des articles C.08.004 ou C.08.004.01;
b) le ministre a des motifs raisonnables de croire :
(i) s’agissant du titulaire de l’une des autorisations relatives à un produit thérapeutique visées aux sous-alinéas a)(i) ou (iii), que les bénéfices ou les risques de préjudice à la santé liés à la drogue sont considérablement différents de ce qu’ils étaient au moment où l’autorisation a été délivrée,
(ii) s’agissant du titulaire de l’autorisation relative à un produit thérapeutique visée au sous-alinéa a)(ii) qui est un importateur, que la façon dont l’une ou plusieurs des activités ci-après sont menées est susceptible de présenter un risque de préjudice à la santé lié à la drogue :
(A) importer la drogue, au sens du paragraphe C.01A.001(1),
(B) manufacturer ou emballer-étiqueter la drogue à l’étranger, au sens du paragraphe C.01A.001(1),
(C) analyser la drogue à l’étranger,
(iii) s’agissant du titulaire de l’autorisation relative à un produit thérapeutique visée au sous-alinéa a)(ii) qui n’est pas un importateur, que la façon dont est menée une activité autorisée par l’autorisation est susceptible de présenter un risque de préjudice à la santé lié à la drogue.
(2) Au terme de son examen des résultats d’une évaluation visant une drogue qu’il a ordonnée en vertu de l’article 21.31 de la Loi, le ministre :
a) communique au titulaire de l’autorisation relative à un produit thérapeutique les résultats de l’examen;
b) veille à ce qu’un résumé des résultats de l’examen ainsi que la description, le cas échéant, des mesures que le ministre a prises ou peut prendre à la suite de cet examen soient publiés sur le site Web du gouvernement du Canada.
- DORS/2018-84, art. 3
- DORS/2020-262, art. 3
Activités ordonnées en vertu de l’article 21.32 de la Loi
C.01.053 Le pouvoir du ministre de donner un ordre visant une drogue en vertu de l’article 21.32 de la Loi est assujetti aux conditions suivantes :
a) la personne à qui l’ordre est donné est titulaire de l’une des autorisations relatives à un produit thérapeutique ci-après à l’égard de la drogue :
(i) l’identification numérique attribuée en application du paragraphe C.01.014.2(1),
(ii) la licence d’établissement délivrée en application du paragraphe C.01A.008(1),
(iii) l’avis de conformité délivré en application des articles C.08.004 ou C.08.004.01;
b) le ministre a des motifs raisonnables de croire, à la fois :
(i) s’agissant du titulaire de l’une des autorisations relatives à un produit thérapeutique visées aux sous-alinéas a)(i) ou (iii), que les bénéfices ou les effets nocifs liés à la drogue font l’objet d’incertitudes importantes,
(ii) s’agissant du titulaire de l’autorisation relative à un produit thérapeutique visée au sous-alinéa a)(ii) qui est un importateur, que la façon dont l’une ou plusieurs des activités ci-après sont menées a créé des incertitudes importantes en ce qui concerne les bénéfices ou les effets nocifs liés à la drogue :
(A) importer la drogue, au sens du paragraphe C.01A.001(1),
(B) manufacturer ou emballer-étiqueter la drogue à l’étranger, au sens du paragraphe C.01A.001(1),
(C) analyser la drogue à l’étranger,
(iii) s’agissant du titulaire de l’autorisation relative à un produit thérapeutique visée au sous-alinéa a)(ii) qui n’est pas un importateur, que la façon dont est menée une activité autorisée par l’autorisation a créé des incertitudes importantes en ce qui concerne les bénéfices ou les effets nocifs liés à la drogue,
(iv) que le titulaire de l’autorisation relative à un produit thérapeutique n’est pas en mesure de fournir au ministre des renseignements suffisants pour gérer ces incertitudes,
(v) que les exigences applicables du présent règlement ainsi que toute condition dont l’autorisation est assortie ne permettent pas de recueillir des renseignements suffisants pour gérer ces incertitudes;
c) le ministre tient compte des éléments suivants :
(i) la faisabilité des activités qu’il ordonnera au titulaire de l’autorisation relative à un produit thérapeutique de mener,
(ii) l’existence de moyens moins exigeants de recueillir des renseignements supplémentaires quant aux effets de la drogue sur la santé ou la sécurité.
- DORS/2018-84, art. 3
- DORS/2020-262, art. 4
C.01.055 et C.01.056 [Abrogés, DORS/82-524, art. 2]
Limites de variabilité
C.01.061 (1) Dans le cas d’une drogue dont la quantité nette contenue dans l’emballage est indiquée sur l’étiquette autrement qu’en nombre d’unités posologiques, la quantité nette moyenne, déterminée conformément à la méthode officielle DO-31 intitulée Détermination du contenu net en date du 7 décembre 1988, pour tout groupe de 10 emballages de cette drogue choisis selon cette méthode, ne peut être inférieure à la quantité nette indiquée sur l’étiquette.
(2) Dans le cas d’une drogue dont la quantité nette contenue dans l’emballage est indiquée sur l’étiquette en nombre d’unités posologiques, pour tout groupe de 10 emballages de cette drogue choisis conformément à la méthode officielle DO-31 intitulée Détermination du contenu net en date du 7 décembre 1988, lorsque le nombre d’unités posologiques de ce groupe est déterminé selon cette méthode :
a) le nombre moyen d’unités posologiques pour les 10 emballages ne peut être inférieur au nombre d’unités posologiques indiqué sur l’étiquette;
b) aucun emballage ne peut contenir un nombre d’unités posologiques inférieur à celui indiqué sur l’étiquette, sous réserve des écarts prévus au tableau du présent article;
c) dans le cas d’une drogue contrôlée au sens de l’article G.01.001 ou d’un stupéfiant au sens du Règlement sur les stupéfiants, aucun emballage ne peut contenir un nombre d’unités posologiques supérieur à celui indiqué sur l’étiquette, sous réserve des écarts prévus au tableau du présent article.
TABLEAU
Article Colonne I Colonne II Nombre d’unités posologiques indiqué sur l’étiquette, par emballage Écart admissible par rapport au nombre indiqué sur l’étiquette 1 50 ou moins 0 2 Plus de 50, mais moins de 101 1 3 101 ou plus le plus élevé des nombres suivants : une unité ou 0,75 % du nombre indiqué sur l’étiquette, arrondi au nombre entier supérieur
- DORS/82-429, art. 4
- DORS/89-455, art. 4
- DORS/97-228, art. 3
- DORS/2019-171, art. 24
C.01.062 (1) Sous réserve des paragraphes (2) à (5), le fabricant ne peut vendre une drogue sous forme posologique lorsque la quantité de tout ingrédient médicinal qu’elle contient, déterminée selon une méthode acceptable, représente :
a) moins de 90,0 pour cent de la quantité indiquée sur l’étiquette;
b) plus de 110,0 pour cent de la quantité indiquée sur l’étiquette.
(2) Sous réserve du paragraphe (5), lorsqu’une drogue sous forme posologique renferme un ingrédient médicinal qui est une substance volatile d’origine végétale ou son équivalent de synthèse, aucun écart par rapport à la quantité de l’ingrédient indiquée sur l’étiquette, déterminée selon une méthode acceptable, n’est permis en dehors de l’écart suivant :
a) au moins 85,0 pour cent de la quantité indiquée sur l’étiquette;
b) au plus 120,0 pour cent de la quantité indiquée sur l’étiquette.
(3) Sous réserve du paragraphe (5), lorsqu’une drogue sous forme de capsule renferme un ingrédient médicinal qui est une vitamine contenue dans une huile de foie de poisson, aucun écart par rapport à la quantité de l’ingrédient médicinal indiquée sur l’étiquette, déterminée selon une méthode acceptable, n’est permis, autre que l’écart précisé pour cette huile de foie de poisson dans une publication dont le nom figure à l’annexe B de la Loi.
(4) Sous réserve du paragraphe (5), lorsqu’une drogue sous forme posologique renferme un ingrédient médicinal qui est une vitamine, aucun écart par rapport à la quantité de l’ingrédient médicinal indiquée sur l’étiquette, déterminée selon une méthode acceptable, n’est permis, autre que l’écart précisé aux colonnes III ou IV du tableau du présent article en regard d’une vitamine figurant à la colonne I en la quantité indiquée à la colonne II.
(5) Les paragraphes de (1) à (4) ne s’appliquent pas à :
a) une drogue pour laquelle un avis de conformité a été délivré en application des articles C.08.004 ou C.08.004.01;
b) [Abrogé, DORS/98-423, art. 8]
c) une drogue pour laquelle une norme est contenue dans une publication dont le nom figure à l’annexe B de la Loi;
d) une drogue mentionnée aux annexes C ou D de la Loi ou au titre 6 de la partie C du présent règlement;
e) une drogue à laquelle une identification numérique a été attribuée aux termes du paragraphe C.01.014.2(1) et :
(i) dont les conditions de fabrication et de contrôle de la qualité permettent le contrôle de son identité, de sa qualité, de sa pureté, de sa stabilité, de son innocuité, de sa teneur et de son activité,
(ii) qui possède bien les propriétés que les étiquettes, notamment toute notice d’accompagnement et toute documentation supplémentaire sur l’emploi de la drogue qui est fournie sur demande, s’y rapportant lui attribuent,
(iii) qui peut, sans risque prévisible excessif pour l’être humain, être utilisée aux fins et dans les conditions d’emploi recommandées par le fabricant,
(iv) qui est efficace aux fins et dans les conditions d’emploi recommandées par le fabricant.
TABLEAU
Article Colonne I Colonne II Colonne III Colonne IV Vitamine Dose quotidienne recommandée Écart admissible lorsque la dose quotidienne recommandée indiquée sur l’étiquette est égale ou inférieure à celle de la colonne II Écart admissible lorsque la dose quotidienne recommandée indiquée sur l’étiquette est supérieure à celle de la colonne II 1 vitamine A (ou comme B-carotène) 10 000 U.I. 90,0 - 165,0 % 90,0 - 115,0 % 2 thiamine 4,5 mg 90,0 - 145,0 % 90,0 - 125,0 % 3 riboflavine 7,5 mg 90,0 - 125,0 % 90,0 - 125,0 % 4 niacine ou niacinamide 45 mg 90,0 - 125,0 % 90,0 - 125,0 % 5 pyridoxine 3 mg 90,0 - 125,0 % 90,0 - 125,0 % 6 acide d-pantothénique 15 mg 90,0 - 135,0 % 90,0 - 125,0 % 7 acide folique 0,4 mg 90,0 - 135,0 % 90,0 - 115,0 % 8 vitamine B12 14 µg 90,0 - 135,0 % 90,0 - 125,0 % 9 vitamine C 150 mg 90,0 - 145,0 % 90,0 - 125,0 % 10 vitamine D 400 U.I. 90,0 - 145,0 % 90,0 - 115,0 % 11 vitamine E 25 U.I. 90,0 - 125,0 % 90,0 - 125,0 % 12 vitamine K 0,0 mg 90,0 - 115,0 % 13 biotine 0,0 mg 90,0 - 135,0 %
- DORS/92-131, art. 1
- DORS/92-591, art. 2
- DORS/94-689, art. 2(A)
- DORS/95-530, art. 2
- DORS/98-423, art. 8
- DORS/2011-88, art. 5
- DORS/2014-158, art. 9
- DORS/2018-69, art. 19(F)
C.01.063 [Abrogé, DORS/96-399, art. 2]
C.01.064 Si une drogue est préparée pour usage ophtalmique ou usage parentéral et que l’un de ses ingrédients est un agent de conservation, cet ingrédient :
a) doit être limité à la quantité nécessaire pour produire l’effet prévu sans entraîner de risques indus pour les personnes ou les animaux;
b) ne doit pas nuire aux propriétés thérapeutiques de la drogue.
- DORS/90-586, art. 2
C.01.065 Il est interdit de vendre une drogue préparée pour usage ophtalmique ou usage parentéral, sauf si un échantillon représentatif de chaque lot de la drogue, dans son récipient immédiat :
a) est soumis, selon une méthode acceptable, à une épreuve d’identité qui démontre que la drogue correspond à son nom propre, ou à défaut, à son nom usuel;
b) est soumis, par une méthode acceptable, à une épreuve de stérilité qui démontre que la drogue est stérile, laquelle épreuve n’est pas effectuée :
(i) dans le cas des vaccins vivants, ou
(ii) dans le cas où le fabricant présente une preuve que le ministre juge satisfaisante démontrant que les contrôles employés dans la transformation de la drogue en assurent la stérilité dans son récipient immédiat;
c) est soumis aux autres épreuves que le ministre juge satisfaisantes pour démontrer que la drogue est sûre à l’usage suivant le mode d’emploi.
- DORS/86-552, art. 1
- DORS/90-586, art. 3
- DORS/93-202, art. 12
- DORS/96-399, art. 3
- DORS/2018-69, art. 27
C.01.066 Est interdite la vente des drogues en solution aqueuse, préparée pour usage parentéral, à moins qu’elles n’aient été préparées avec de l’eau apyrogène produite par distillation ou par osmose enverse.
C.01.067 (1) Sous réserve du paragraphe (2), il est interdit de vendre une drogue préparée pour usage parentéral, sauf si un échantillon représentatif de chaque lot de la drogue :
a) a été soumis, dans son récipient immédiat, à une épreuve de pyrogénicité selon une méthode acceptable;
b) a été trouvé apyrogène lors de l’épreuve visée à l’alinéa a).
(2) Le paragraphe (1) ne s’applique pas aux drogues qui ne se prêtent pas à une épreuve de pyrogénicité ni aux drogues de nature pyrogène.
- DORS/81-335, art. 1
- DORS/96-399, art. 4
C.01.068 Le fabricant doit conserver des dossiers détaillés des épreuves exigées aux articles C.01.065 et C.01.067 pendant au moins un an après la date limite d’utilisation indiquée sur l’étiquette de la drogue.
- DORS/85-715, art. 5
- DORS/92-654, art. 3
C.01.069 L’emballage d’une drogue préparée pour usage parentéral doit satisfaire aux exigences suivantes :
a) le récipient immédiat doit être fait d’un tel matériau et de telle façon :
(i) qu’il ne cède à son contenu aucune substance délétère,
(ii) qu’il ne présente aucune réaction au contact de la drogue,
(iii) qu’il permette l’inspection visuelle ou électronique de la drogue,
(iv) qu’il assure une protection contre les facteurs environnementaux causant la dégradation ou la contamination ou que, s’il ne peut assurer cette protection, celle-ci soit assurée par l’emballage secondaire,
(v) qu’il contienne une quantité suffisante de drogue pour permettre le retrait de la quantité indiquée sur l’étiquette;
b) le dispositif de fermeture immédiat et tout matériau qui entre en contact avec la drogue dans son récipient immédiat doivent répondre aux exigences des sous-alinéas a)(i) et (ii).
- DORS/96-399, art. 5
C.01.070 Est interdite la vente d’une drogue sous forme de comprimé hypodermique qui ne se dissout pas complètement dans l’eau pour y former une solution limpide.
Comprimés de bichlorure de mercure
C.01.071 Est interdite la vente de comprimés de bichlorure de mercure pour usage domestique, en emballages de 200 ou moins, à moins que
a) lesdits comprimés ne soient
(i) de forme irrégulière ou angulaire,
(ii) de couleur bleue, et
(iii) emballés dans un récipient immédiat facilement reconnaissable au toucher; et que
b) l’espace principal des étiquettes intérieure et extérieure ne porte, imprimés en caractères bien reconnaissables et d’une couleur faisant contraste avec celle desdites étiquettes,
(i) le dessin d’une tête de mort et de tibias croisés, et
(ii) le mot « Poison ».
- DORS/2001-181, art. 2
C.01.081 [Abrogé, DORS/80-544, art. 4]
C.01.085 [Abrogé, DORS/80-544, art. 5]
Édulcorants synthétiques
C.01.101 (1) [Abrogé, DORS/78-422, art. 3]
(2) [Abrogé, DORS/78-800, art. 1]
(3) [Abrogé, DORS/78-422, art. 3]
C.01.121 et C.01.122 [Abrogés, DORS/80-544, art. 6]
Aminopyrine et dipyrone
C.01.131 Est interdite la vente de l’aminopyrine ou de la dipyrone (dérivé de l’aminopyrine) pour usage oral ou parentéral, à moins que
a) l’étiquette intérieure ne porte la déclaration suivante :
« MISE EN GARDE : L’agranulocytose fatale peut être associée à l’emploi de l’aminopyrine et de la dipyrone. Des congrès sanguins appropriés sont essentiels. (Voir mises en garde et précautions à l’intérieur) »; et que
b) l’étiquette extérieure ou la notice d’accompagnement ne portent les déclarations suivantes :
« MISE EN GARDE : Il est établi qu’une agranulocytose grave et même fatale peut survenir après l’administration de l’aminopyrine ou de la dipyrone. Une agranulocytose fatale est apparue après qu’on eut employé ces drogues pour une thérapie de courte durée, une thérapie intermittente ou une thérapie prolongée. Par conséquent, l’emploi de ces drogues devrait être d’une durée aussi brève que possible. Étant donné la possibilité de telles réactions, l’aminopyrine et la dipyrone ne devraient s’employer que lorsque des agents moins virtuellement dangereux sont inefficaces.
PRÉCAUTIONS : Il est essentiel que se fassent fréquemment des numérations de leucocytes avec formule leucocytaire durant tout traitement avec ces drogues. Toutefois, il faut remarquer que l’agranulocytose peut se produire d’une façon subite sans aucun signe avant coureur. L’emploi de la drogue devrait être interrompu au premier signe d’un changement de la formule sanguine ou d’un symptôme d’agranulocytose, et il faudrait avertir le malade d’interrompre l’emploi de la drogue au premier signe du mal de gorge ou d’une autre infection de la bouche ou de la gorge (douleur, enflure, hyperesthésie, ulcération). »
- DORS/2018-69, art. 34(F)
C.01.132 Est interdit l’envoi, à un médecin praticien, de la documentation publicitaire sur l’aminopyrine ou la dipyrone à moins que les déclarations figurant à l’article C.01.131 ne soient comprises dans cette documentation.
C.01.133 Les dispositions des articles C.01.131 et C.01.132 ne s’appliquent pas aux préparations renfermant de l’aminopyrine ou de la dipyrone et qui sont
a) dispensées par un pharmacien d’après une ordonnance; ou
b) vendues pour usage vétérinaire seulement.
Sels de potassium enrobés
C.01.134 Est interdite la vente de comprimés enrobés contenant des sels de potassium, avec ou sans diurétiques de thiazide, à moins que l’étiquette intérieure ou la notice d’accompagnement ne portent la déclaration suivante :
« MISE EN GARDE : Il existe un lien probable entre l’emploi de comprimés enrobés contenant des sels de potassium avec ou sans diurétiques de thiazide et l’incidence de l’ulcération grave de l’intestin grêle. Ces préparations ne sont à utiliser que s’il n’est pas possible de suppléer convenablement au régime alimentaire; il faut en cesser l’emploi dès qu’apparaissent des douleurs abdominales, une distension abdominale, des nausées, des vomissements ou des hémorragies gastrointestinales. »
- DORS/2018-69, art. 34(F)
C.01.135 Est interdit l’envoi, à un médecin praticien, de la documentation publicitaire sur les dragées contenant des sels de potassium avec ou sans diurétiques de thiazide, à moins que la déclaration figurant à l’article C.01.134 ne soit comprise dans cette documentation.
C.01.136 Les dispositions des articles C.01.134 et C.01.135 ne s’appliquent pas aux dragées renfermant des sels de potassium avec ou sans diurétiques de thiazide et qui
a) sont vendues pour usage vétérinaire seulement;
b) sont dispensées par un pharmacien d’après une ordonnance; ou
c) renferment 100 milligrammes ou moins de potassium élémentaire par dragée.
Antibiotiques
C.01.401 Sauf disposition contraire du présent règlement, l’antibiotique qui n’est pas destiné à l’usage parentéral doit, en plus de satisfaire aux exigences de l’article C.01.004, porter sur l’étiquette intérieure et l’étiquette extérieure une indication de l’activité de la drogue exprimée en unités internationales si de telles unités existent ou, à défaut, en unités, milligrammes, microgrammes ou fractions de grammes :
a) par gramme, dans le cas des solides ou des liquides visqueux;
b) par millilitre, dans le cas des autres liquides;
c) par dose individuelle ou forme posologique, dans le cas de préparations antibiotiques présentées en doses individuelles ou sous forme posologique.
- DORS/80-544, art. 7
- DORS/92-654, art. 4
C.01.402 [Abrogé, DORS/92-654, art. 4]
C.01.410 à C.01.412 [Abrogés, DORS/80-544, art. 8]
C.01.420 à C.01.422 [Abrogés, DORS/80-544, art. 8]
Chloramphénicol
C.01.430 à C.01.432 [Abrogés, DORS/80-544, art. 8]
C.01.433 Est interdite la vente du chloramphénicol, de ses sels et dérivés, pour usage oral ou parentéral, à moins que
a) l’étiquette intérieure ne porte un avertissement pour faire savoir
(i) qu’une diminution de l’activité de la moëlle osseuse a été associée à l’emploi de chloramphénicol, et
(ii) qu’il y a lieu de lire attentivement les avertissements et les précautions jointes; et
b) l’étiquette extérieure ou la notice d’accompagnement ne portent
(i) un avertissement pour faire savoir que le chloramphénicol ne devrait pas être employé dans le traitement ou la prévention des infections bénignes ou lorsqu’il n’est pas indiqué, comme pour les rhumes, la grippe, ou les infections des voies respiratoires supérieures; que deux types de diminution de l’activité de la moëlle osseuse sont associés à l’emploi de chloramphénicol; qu’une certaine diminution de l’activité de la moëlle osseuse est communément constatée durant le traitement, et qu’elle est fonction de la dose et potentiellement réversible; que des analyses de sang permettent de déceler les changements précoces; que l’autre forme de diminution de l’activité de la moëlle osseuse est très rare, se traduisant par une hypoplasie de la moëlle osseuse brutale, tardive et généralement fatale qui peut survenir sans avertissement, et
(ii) une déclaration des précautions à prendre précisant qu’il est indispensable de faire des analyses de sang appropriées au cours du traitement par le chloramphénicol et que, bien que les analyses de sang permettent de déceler les modifications sanguines périphériques précoces, il ne faut pas s’y fier pour déceler la forme rare et généralement irréversible de diminution de l’activité de la moëlle osseuse avant l’apparition d’une anémie aplastique.
- DORS/2018-69, art. 35(F)
C.01.434 L’article C.01.433 ne s’applique pas au chloramphénicol, à ses sels ou à ses dérivés vendus par un pharmacien conformément à une ordonnance.
- DORS/2013-122, art. 12
C.01.435 Est interdit l’envoi, à un médecin praticien, de la documentation publicitaire sur le chloramphénicol, ses sels ou dérivés, pour usage oral ou parentéral, à moins que les déclarations stipulées à l’alinéa C.01.433b) ne soient comprises dans cette documentation.
C.01.436 Les dispositions des articles C.01.433 et C.01.435 ne s’appliquent pas à un médicament vendu pour usage vétérinaire seulement.
C.01.440 à C.01.442 [Abrogés, DORS/80-544, art. 8]
C.01.450 à C.01.452 [Abrogés, DORS/80-544, art. 8]
C.01.460 à C.01.462 [Abrogés, DORS/80-544, art. 8]
C.01.470 à C.01.472 [Abrogés, DORS/80-544, art. 8]
C.01.480 [Abrogé, DORS/80-544, art. 8]
C.01.490 à C.01.497 [Abrogés, DORS/80-544, art. 8]
C.01.510 à C.01.513 [Abrogés, DORS/80-544, art. 8]
C.01.520 à C.01.522 [Abrogés, DORS/80-544, art. 8]
C.01.530 à C.01.532 [Abrogés, DORS/80-544, art. 8]
C.01.540 à C.01.542 [Abrogés, DORS/80-544, art. 8]
C.01.550 à C.01.552 [Abrogés, DORS/80-544, art. 8]
C.01.560 à C.01.563 [Abrogés, DORS/80-544, art. 8]
C.01.570 à C.01.572 [Abrogés, DORS/80-544, art. 8]
C.01.580 [Abrogé, DORS/80-544, art. 8]
C.01.590 à C.01.592 [Abrogés, DORS/80-544, art. 8]
Drogues d’application vétérinaire
C.01.600 Il est interdit de vendre pour usage vétérinaire une drogue énumérée au tableau des doses limites des drogues pour adultes, sauf une drogue présentée sous une forme impropre à l’usage humain, si les étiquettes intérieure et extérieure de cette drogue ne portent pas toutes deux la mention « Pour usage vétérinaire seulement » ou « Usage vétérinaire seulement ».
- DORS/80-543, art. 5
C.01.601 [Abrogé, DORS/93-407, art. 6]
C.01.602 Les dispositions des articles C.01.401 et de C.01.402 ne s’appliquent pas à un antibiotique présent dans un article d’alimentation animale en quantité inférieure à 50 parties par million.
C.01.603 Les dispositions des alinéas C.01.401b) et c), et de l’article C.01.402 ne s’appliquent pas à un antibiotique présent dans un article d’alimentation animale en quantité supérieure à 50 parties par million.
C.01.604 Les étiquettes intérieure et extérieure d’une drogue d’application vétérinaire représentée comme contenant une vitamine doivent toutes deux porter
a) la déclaration de la quantité de chaque vitamine présente dans la drogue, uniquement sous le nom propre de chaque vitamine
(i) en unités internationales par gramme ou par millilitre, dans le cas de la vitamine A, de la provitamine A, de la vitamine D et de la vitamine E,
(ii) en milligrammes par gramme, dans le cas des solides ou des liquides visqueux, ou par millilitre, dans le cas des autres liquides, lorsqu’il s’agit de la thiamine, de la riboflavine, de la niacine, de la niacinamide, de la pyridoxine, de l’acide d-pantothénique, du d-panthénol, de l’acide folique, de l’acide ascorbique et de la vitamine K,
(iii) en microgrammes par gramme, dans le cas des solides ou des liquides visqueux, ou par millilitre, dans le cas des autres liquides, lorsqu’il s’agit de la biotine et de la vitamine B12,
(iv) en unités orales, dans le cas de la vitamine B12 avec concentré de facteur intrinsèque, ou,
(v) dans le cas des produits vitaminiques présentés sous forme posologique ou forme de distribution individuelle, en unités spécifiées par dose ou autre forme posologique individuelle;
b) sauf dans le cas des drogues présentées sous une forme qui ne convient pas à l’usage humain, la déclaration « Pour usage vétérinaire seulement » ou « Usage vétérinaire seulement ».
- DORS/80-543, art. 6
C.01.605 Un antibiotique d’administration parentérale, qui est recommandé uniquement pour usage vétérinaire, doit porter sur ses étiquettes intérieure et extérieure
a) l’activité de la drogue exprimée en unités internationales, lorsqu’il y a de telles unités établies, ou, si aucune unité internationale n’a été établie, en termes d’unités, de milligrammes ou de fractions de gramme, par gramme dans le cas des solides ou des liquides visqueux, par millilitre dans le cas des autres liquides, ou par dose individuelle ou forme posologique dans le cas de préparations antibiotiques présentées sous forme posologique ou forme de distribution individuelle;
b) [Abrogé, DORS/92-654, art. 5]
c) la déclaration « Pour usage vétérinaire seulement » ou « Usage vétérinaire seulement ».
- DORS/80-543, art. 7
- DORS/92-654, art. 5
C.01.606 Il est interdit de vendre pour le traitement des animaux une préparation d’antibiotique, autre qu’une préparation d’antibiotique qui est une drogue nouvelle vendue conformément à l’article C.08.013, à moins que les conditions suivantes ne soient remplies :
a) dans le cas où la préparation ne peut être administrée aux animaux en période de lactation dont le lait est destiné à être consommé comme aliment, une mention à cet effet figure sur les étiquettes intérieure et extérieure de la préparation;
b) dans le cas où la préparation peut être administrée aux animaux en période de lactation dont le lait est destiné à être consommé comme aliment :
(i) il a été soumis au ministre, sur demande, des preuves acceptables du délai ne dépassant pas 96 heures qui doit s’écouler après l’administration de la dernière dose de cette préparation pour que le lait des animaux traités ne contienne aucun résidu d’antibiotique qui soit dommageable à la santé de l’homme,
(ii) l’espace principal de l’étiquette extérieure de la préparation, l’étiquette intérieure et, le cas échéant, la notice jointe à l’emballage qui décrit la préparation d’antibiotique portent la mise en garde suivante : « MISE EN GARDE : LE LAIT PROVENANT DES ANIMAUX TRAITÉS QUI EST EXTRAIT PENDANT LE TRAITEMENT ET DANS LES ... HEURES APRÈS ADMINISTRATION DE LA DERNIÈRE DOSE NE DOIT PAS ÊTRE UTILISÉ COMME ALIMENT. », le nombre d’heures à indiquer étant celui du délai déterminé selon les preuves soumises aux termes du sous-alinéa (i).
- DORS/88-378, art. 1
- DORS/92-664, art. 2
- DORS/93-467, art. 1
- DORS/2018-69, art. 27
C.01.606.1 Il est interdit de vendre tout produit contenant du dihydroiodure d’éthylènediamine (DIED) qui est destiné à la prévention ou au traitement du panaris interdigité (piétin) chez les bovins.
- DORS/90-327, art. 1
C.01.607 Nonobstant le sous-alinéa C.01.004(1)c)(ii), la déclaration du numéro de lot n’est pas requise sur l’étiquette d’un aliment contenant une drogue et destiné aux animaux.
- DORS/80-543, art. 8
C.01.608 Les dispositions de l’article C.01.604 ne s’appliquent pas aux aliments médicamentés du bétail, enregistrés en vertu de la Loi relative aux aliments du bétail.
C.01.609 Malgré l’alinéa C.01.401a), l’activité d’un antibiotique en quantités dépassant 50 parties par million contenu dans un aliment médicamenté du bétail, enregistré en vertu de la Loi relative aux aliments du bétail, peut être déclarée en grammes par tonne métrique.
- DORS/2018-69, art. 20
- DORS/2021-46, art. 6(F)
C.01.610 Est interdite la vente de toute substance qui possède une action oestrogène, pour administration aux volailles pouvant être consommées comme aliment.
C.01.610.1 Il est interdit de vendre une drogue pour administration aux animaux qui produisent des aliments ou qui sont destinés à être consommés comme aliments si elle contient :
a) soit du chloramphénicol ou l’un de ses sels ou dérivés;
b) soit un composé de 5-nitrofurane;
c) soit du clenbutérol ou l’un de ses sels ou dérivés;
d) soit un composé de 5-nitro-imidazole;
e) soit du diéthylstilbestrol ou d’autres composés de stilbène.
- DORS/85-539, art. 1
- DORS/85-685, art. 2
- DORS/91-546, art. 1
- DORS/94-568, art. 2
- DORS/97-510, art. 2
- DORS/2003-292, art. 3
C.01.610.2 Il est interdit de vendre toute préparation d’antibiotique contenant du chloramphénicol, ou l’un de ses sels ou dérivés, pour administration aux animaux qui ne produisent pas d’aliments et qui ne sont pas destinés à être consommés comme aliments, à moins que les conditions suivantes ne soient remplies :
a) l’étiquette intérieure et l’étiquette extérieure de cette préparation portent la mise en garde suivante : « MISE EN GARDE : EN VERTU DES LOIS FÉDÉRALES, IL EST INTERDIT D’ADMINISTRER CETTE PRÉPARATION AUX ANIMAUX QUI PRODUISENT DES ALIMENTS OU AUX ANIMAUX DESTINÉS À ÊTRE CONSOMMÉS COMME ALIMENTS / WARNING : FEDERAL LAW PROHIBITS THE ADMINISTRATION OF THIS PREPARATION TO ANIMALS THAT PRODUCE FOOD OR ANIMALS THAT ARE INTENDED FOR CONSUMPTION AS FOOD »;
b) s’il s’agit d’une préparation à usage parentéral, celle-ci contient au plus un gramme de chloramphénicol par ampoule sous forme de succinate sodique de chloramphénicol;
c) s’il s’agit d’une préparation pour usage ophtalmique, celle-ci contient au plus 1 pour cent de chloramphénicol;
d) s’il s’agit d’une préparation pour administration par voie orale, celle-ci, selon le cas :
(i) est sous forme de comprimé ou de capsule et contient au plus un gramme de chloramphénicol par comprimé ou capsule,
(ii) est sous forme de suspension de palmitate de chloramphénicol et contient au plus trois grammes de chloramphénicol par récipient.
- DORS/91-546, art. 1
C.01.611 (1) Le ministre peut, par écrit, exiger de temps à autre du fabricant d’une drogue recommandée pour administration aux animaux qui peuvent servir d’aliment
a) une présentation relative à la drogue décrivant en détail les épreuves conduites pour vérifier qu’aucune substance mentionnée à la colonne II de la Liste visée par l’Autorisation de mise en marché – limites maximales de résidus de drogues pour usage vétérinaire dans les aliments ne demeure dans un aliment mentionné à la colonne III, sauf dans la limite maximale de résidu prévue à la colonne IV pour cet aliment et cette substance;
b) l’impression, dans l’espace principal de l’étiquette extérieure, sur l’étiquette intérieure et, le cas échéant, sur la notice jointe à l’emballage qui décrit la drogue, d’une mise en garde indiquant que les aliments provenant d’animaux auxquels a été administrée cette drogue ne peuvent être vendus pour consommation humaine que s’il s’est écoulé depuis cette administration le délai que fixe le ministre en se fondant sur une étude des données connues sur les résidus de la drogue.
(2) Il est interdit à tout fabricant de vendre une drogue au sujet de laquelle le ministre a exigé la mise en garde mentionnée à l’alinéa (1)b) si ledit fabricant n’a pas fait droit à ladite exigence.
- DORS/93-467, art. 2
- DORS/2016-74, art. 10
- DORS/2018-69, art. 27
C.01.612 (1) Le fabricant ou l’importateur qui vend une drogue vétérinaire sous forme posologique qui contient un ingrédient actif pharmaceutique figurant dans la Liste A ou toute personne qui prépare une telle drogue présente au ministre un rapport annuel, en la forme établie par celui-ci, indiquant, pour chaque drogue, la quantité totale vendue ou préparée, et une estimation de la quantité vendue ou préparée pour chacune des espèces animales auxquelles la drogue est destinée.
(2) Le rapport visé au paragraphe (1) porte sur toute année civile — à commencer par la première année civile complète suivant l’entrée en vigueur du présent article — et est présenté au plus tard le 31 mars de l’année qui suit l’année civile visée par le rapport.
- DORS/2017-76, art. 6
C.01.613 (1) Il est interdit d’importer des drogues dans le but de les administrer à des animaux qui produisent des aliments ou qui sont destinés à être consommés comme aliments, si la vente de telles drogues au Canada enfreindrait la Loi ou le présent règlement.
(2) Le paragraphe (1) ne s’applique pas aux drogues décrites dans la Liste B.
- DORS/2017-76, art. 6
C.01.614 (1) Les articles 43 à 58 du Règlement sur les produits de santé naturels s’appliquent à l’égard des produits de santé animale comme s’ils étaient des produits de santé naturels au sens du paragraphe 1(1) de ce règlement.
(2) Tout produit de santé animale doit porter une étiquette sur laquelle figure, dans l’espace principal de l’étiquette intérieure et de l’étiquette extérieure, la mention « Produit de santé animale / Veterinary Health Product » ou « Veterinary Health Product / Produit de santé animale ».
(3) L’article C.01.600 et l’alinéa C.01.604b) ne s’appliquent pas à l’égard des produits de santé animale.
- DORS/2017-76, art. 6
C.01.615 (1) Le fabricant ou l’importateur d’un produit de santé animale avise le ministre de la vente du produit au Canada au moins trente jours avant le début de la vente.
(2) L’avis doit être présenté en la forme établie par le ministre et contenir les renseignements suivants :
a) les nom, adresse postale, numéro de téléphone et adresse de courriel du fabricant ou de l’importateur;
b) la marque nominative sous laquelle le produit de santé animale est vendu;
c) la forme pharmaceutique sous laquelle le produit est vendu;
d) la concentration du produit dans chaque unité posologique;
e) la voie d’administration du produit;
f) la liste quantitative des ingrédients médicinaux et la liste qualitative des ingrédients non médicinaux contenus dans le produit;
g) les espèces d’animaux auxquelles il est recommandé d’administrer le produit;
h) l’usage ou les fins pour lesquels le produit est recommandé.
(3) Le fabricant ou l’importateur qui a fourni au ministre un avis aux termes du paragraphe (1) fournit au ministre, en la forme établie par celui-ci, toute modification aux renseignements exigés au titre du paragraphe (2) au moins trente jours avant la vente du produit visé par le changement.
- DORS/2017-76, art. 6
C.01.616 Lorsque le ministre a des motifs raisonnables de croire qu’un produit de santé animale peut ne plus être sûr, il peut demander au fabricant ou à l’importateur de lui fournir, dans les quinze jours suivant la réception de la demande, des renseignements et documents montrant l’innocuité du produit.
- DORS/2017-76, art. 6
C.01.617 (1) Le ministre peut ordonner au fabricant ou à l’importateur d’un produit de santé animale d’en cesser la vente dans l’un ou l’autre des cas suivants :
a) le fabricant ou l’importateur n’obtempère pas à la demande visée à l’article C.01.616 dans le délai imparti;
b) les renseignements et documents fournis par le fabricant ou l’importateur aux termes de l’article C.01.616 ne sont pas suffisants pour démontrerl’innocuité du produit;
c) il a des motifs raisonnables de croire que la vente du produit enfreindrait la Loi ou le présent règlement.
(2) Le ministre lève l’ordre de cessation de vente lorsque le fabricant ou l’importateur lui fournit les renseignements et documents établissant, selon le cas :
a) que le produit est sûr, dans le cas d’un ordre de cessation de vente fondé sur les alinéas (1)a) ou b);
b) que la vente du produit n’enfreindrait plus la Loi ou le présent règlement, dans le cas d’un ordre de cessation de vente fondé sur l’alinéa (1)c);
c) que la situation donnant lieu à l’ordre de cessation de vente n’a pas existé.
- DORS/2017-76, art. 6
Drogues anticonceptionnelles
C.01.625 Les drogues anticonceptionnelles qui sont fabriquées, vendues ou présentées pour la prévention de la conception et qui ne sont pas des drogues sur ordonnance peuvent faire l’objet de publicité auprès du grand public.
- DORS/2013-122, art. 13
TITRE 1ALicence d’établissement
Définitions et interprétation
C.01A.001 (1) Les définitions qui suivent s’appliquent au présent titre et aux titres 2 à 4.
- accord de reconnaissance mutuelle
accord de reconnaissance mutuelle Accord international portant sur le reconnaissance mutuelle en matière de certification de la conformité aux bonnes pratiques de fabrication des drogues. (mutual recognition agreement)
- agent antimicrobien
agent antimicrobien Drogue pouvant détruire les micro-organismes pathogènes et dont l’étiquette indique qu’elle est destinée à être utilisée dans la désinfection des surfaces de l’environnement ou des instruments médicaux, au sens du Règlement sur les instruments médicaux, qui :
a) ne sont pas des instruments effractifs au sens de ce règlement;
b) sont destinés à entrer en contact uniquement avec une peau intacte. (antimicrobial agent)
- autorité réglementaire
autorité réglementaire Organisme public ou autre entité, dans un pays participant, qui est habilité à contrôler l’utilisation ou la vente de drogues dans ce pays et qui peut prendre des mesures d’exécution pour veiller à ce que les drogues commercialisées sur le territoire relevant de sa compétence satisfassent aux exigences légales. (regulatory authority)
- bâtiment reconnu
bâtiment reconnu À l’égard de la manufacture, de l’emballage-étiquetage ou de l’analyse d’une drogue, bâtiment qu’une autorité réglementaire, désignée aux termes du paragraphe C.01A.019(1) à l’égard de cette activité pour cette drogue, a reconnu comme satisfaisant à ses normes de bonnes pratiques de fabrication à l’égard de cette activité pour cette drogue. (recognized building)
- certificat de lot
certificat de lot Certificat délivré par le manufacturier d’un lot d’une drogue ou d’un lot de fabrication de celle-ci qui est, soit importée dans le cadre d’un accord de reconnaissance mutuelle, soit visée à la liste de drogues vendues sans ordonnance et non soumises à certaines analyses, et dans lequel le manufacturier :
a) identifie le document-type de production pour la drogue et atteste que le lot ou le lot de fabrication a été manufacturé, emballé-étiqueté et analysé conformément aux méthodes énoncées dans le document-type;
b) fournit une description détaillée de la drogue, y compris :
(i) la liste des propriétés et des qualités de la drogue, y compris l’identité, l’activité et la pureté de la drogue,
(ii) une indication des tolérances relatives aux propriétés et aux qualités de la drogue;
c) indique les méthodes d’analyse du lot ou lot de fabrication ainsi que les résultats analytiques détaillés obtenus;
d) indique les adresses des bâtiments où le lot ou le lot de fabrication a été manufacturé, emballé-étiqueté et analysé;
e) atteste que le lot ou le lot de fabrication a été manufacturé, emballé-étiqueté et analysé, selon le cas :
(i) s’agissant de la drogue importée dans le cadre d’un accord de reconnaissance mutuelle, conformément aux bonnes pratiques de fabrication de l’autorité réglementaire qui a reconnu les bâtiments comme satisfaisant à ses normes de bonnes pratiques de fabrication,
(ii) s’agissant de la drogue qui n’est pas importée dans le cadre d’un accord de reconnaissance mutuelle et qui est visée à la liste de drogues vendues sans ordonnance et non soumises à certaines analyses, conformément aux exigences prévues au titre 2. (batch certificate)
- classe de forme posologique
classe de forme posologique S’entend des parentérales, comprimés, capsules, solutions, suspensions, aérosols, poudres, suppositoires, gaz médicaux, prémélanges médicamenteux ou de toute autre classe de forme posologique désignée par le ministre. (dosage form class)
- emballer-étiqueter
emballer-étiqueter Emballer une drogue dans son récipient immédiat ou apposer l’étiquette intérieure ou extérieure sur la drogue. (package/label)
- grossiste
grossiste Personne, autre qu’un distributeur visé à l’article C.01A.003, qui vend une ou plusieurs des drogues ci-après autrement qu’au détail :
a) toute drogue sous forme posologique visée aux annexes C ou D de la Loi, toute drogue qui est une drogue sur ordonnance ou toute drogue contrôlée au sens de l’article G.01.001;
b) un ingrédient actif;
c) un stupéfiant au sens du Règlement sur les stupéfiants;
d) une drogue contenant du cannabis au sens du paragraphe 2(1) de la Loi sur le cannabis.
L’expression « vendre en gros » a un sens correspondant. (wholesaler)
- importer
importer Importer une drogue au Canada en vue de la vente. (import)
- ingrédient actif
ingrédient actif Drogue qui, lorsqu’elle est utilisée comme matière première dans la manufacture d’une drogue sous forme posologique, lui confère les effets recherchés. (active ingredient)
- ingrédient actif pharmaceutique
ingrédient actif pharmaceutique Ingrédient actif utilisé dans la manufacture d’un produit pharmaceutique. (active pharmaceutical ingredient)
- Liste de drogues vendues sans ordonnance et non soumises à certaines analyses
Liste de drogues vendues sans ordonnance et non soumises à certaines analyses Liste de drogues figurant dans le document intitulé Liste de drogues vendues sans ordonnance pour lesquelles les analyses requises en vertu des paragraphes C.02.019(1) et (2) du Règlement sur les aliments et drogues ne s’appliquent pas, publié par le gouvernement du Canada sur son site Web, avec ses modifications successives. (List of Non-prescription Drugs Not Subject to Certain Testing Requirements)
- manufacturer
manufacturer Préparer et conserver une drogue en vue de la vente. (fabricate)
- monographie de classe
monographie de classe Document établi par le ministère de la Santé qui :
a) présente la liste des types et concentrations d’ingrédients médicinaux qui peuvent être contenus dans les drogues d’une classe donnée;
b) énonce les exigences, notamment en matière d’étiquetage, applicables à ces drogues. (class monograph)
- pays ou régions reconnus
pays ou régions reconnus Pays ou région figurant dans le document intitulé Liste des pays ou régions étrangers et de leurs organismes de réglementation pour l’application du paragraphe C.02.019(5) du Règlement sur les aliments et drogues, publié par le gouvernement du Canada sur son site Web, avec ses modifications successives. (recognized country or region)
- pays participant
pays participant Pays participant à un accord de reconnaissance mutuelle avec le Canada. (MRA country)
- pays signataire
pays signataire[Abrogée, DORS/2002-368, art. 1]
- prémélange médicamenteux
prémélange médicamenteux Drogue à usage vétérinaire qui a fait l’objet d’une identification numérique et dont l’étiquette porte qu’elle doit être combinée à un aliment au sens de l’article 2 de la Loi relative aux aliments du bétail. (drug premix)
- prémélange médicamenteux dilué
prémélange médicamenteux dilué Drogue à usage vétérinaire résultant de la combinaison d’un prémélange médicamenteux à un aliment , au sens de l’article 2 de la Loi relative aux aliments du bétail, de sorte qu’au taux le plus bas des posologies approuvées pour cette drogue, au moins 10 kg de la combinaison soit nécessaire pour médicamenter une tonne métrique d’un aliment complet, au sens du paragraphe 1(1) du Règlement de 2024 sur les aliments du bétail. (dilute drug premix)
- produit intermédiaire en vrac
produit intermédiaire en vrac Ingrédient actif utilisé dans la manufacture d’une drogue d’origine biologique visée à l’annexe C de la Loi ou d’une drogue visée à l’annexe D de la Loi. (bulk process intermediate)
- produit pharmaceutique
produit pharmaceutique Toute drogue non visée aux annexes C ou D de la Loi. (pharmaceutical)
- site
site[Abrogée, DORS/2002-368, art. 1]
- vendre en gros
vendre en gros[Abrogée, DORS/2013-74, art. 2]
(2) Au présent titre et au titre 2, le terme drogue ne vise pas :
a) le prémélange médicamenteux dilué;
b) l’aliment médicamenté au sens du paragraphe 1(1) du Règlement de 2024 sur les aliments du bétail;
c) l’ingrédient actif pour usage vétérinaire qui n’est pas un ingrédient actif pharmaceutique;
d) l’ingrédient actif pharmaceutique pour usage vétérinaire qui peut être vendu sans ordonnance et qui est également un produit de santé naturel au sens du paragraphe 1(1) du Règlement sur les produits de santé naturels;
e) la drogue utilisée uniquement pour une étude expérimentale menée conformément au certificat délivré en vertu de l’article C.08.015.
(3) Lorsque le ministre désigne d’autres classes de formes posologiques, il met la liste de ces classes à la disposition de quiconque en fait la demande.
- DORS/97-12, art. 5
- DORS/98-7, art. 1
- DORS/2000-120, art. 1
- DORS/2002-368, art. 1
- DORS/2004-282, art. 1
- DORS/2013-74, art. 2
- DORS/2013-122, art. 14
- DORS/2017-76, art. 7
- DORS/2018-144, art. 367
- DORS/2019-171, art. 24
- DORS/2020-73, art. 1
- DORS/2024-132, art. 86
- DORS/2024-132, art. 87
Application
C.01A.002 (1) Le présent titre ne s’applique pas dans les cas suivants :
a) la vente en gros d’un prémélange médicamenteux;
b) sous réserve du paragraphe (3), l’importation ou la préparation, conformément à une ordonnance, d’une drogue qui n’est pas disponible sur le marché canadien par les personnes suivantes :
(i) le pharmacien,
(ii) le praticien,
(iii) la personne qui prépare une drogue sous la supervision d’un praticien;
b.1) toute activité à l’égard d’un produit pharmaceutique radioactif émetteur de positrons destiné exclusivement à l’étude de recherche clinique fondamentale visée à l’article C.03.304;
c) toute activité à l’égard d’une drogue destinée exclusivement aux essais cliniques visée au paragraphe C.05.006(1) ou à l’article C.08.005;
d) les activités visant à manufacturer, emballer-étiqueter, analyser conformément au titre 2, distribuer à titre de distributeur visé à l’article C.01A.003, vendre en gros ou importer l’une ou l’autre des drogues suivantes vendues sans ordonnance et qui sont sous forme posologique et pour usage humain mais qui ne sont pas présentées comme traitement ou mesure préventive d’une maladie, d’un désordre ou d’un état physique anormal visés à l’annexe A.1 de la Loi ou comme moyen de guérison :
(i) les drogues homéopathiques,
(ii) les drogues conformes aux exigences de la monographie de classe intitulée, selon le cas, « Suppléments vitaminiques », « Suppléments minéraux », « Suppléments vitaminiques alimentaires » ou « Suppléments minéraux alimentaires »,
(iii) toute drogue qui :
(A) d’une part, contient une substance végétale, minérale ou animale dont les propriétés sont présentées comme étant thérapeutiques ou préventives, notamment les herbes médicinales traditionnelles, les médicaments traditionnels chinois, ayurvédiques (Indiens d’Asie) et autochtones (Amérique du Nord),
(B) d’autre part, dont l’utilisation à des fins médicales est appuyée seulement de preuves historiques et ethnologiques tirées d’ouvrages de références relatifs à un système de médecine autre que celui fondé sur des normes scientifiques conventionnelles;
e) les activités visant à manufacturer, emballer-étiqueter, analyser, distribuer ou importer un agent antimicrobien.
(1.1) Le présent titre et le titre 2 ne s’appliquent pas au produit de santé animale ou à l’ingrédient actif pharmaceutique qui est utilisé dans la manufacture d’un produit de santé animale.
(2) Le présent titre et les titres 2 à 4 ne s’appliquent pas dans le cas de l’activité visant à apposer une étiquette sur un récipient déjà étiqueté.
(3) Le présent titre s’applique à l’importation, par un pharmacien, un vétérinaire ou une personne qui prépare une drogue sous la supervision d’un vétérinaire, d’un ingrédient actif pharmaceutique, pour usage vétérinaire, qui figure dans la Liste A à des fins de préparation d’une drogue sous forme posologique conformément à une ordonnance et qui n’est pas disponible sur le marché canadien.
- DORS/97-12, art. 5
- DORS/98-7, art. 2
- DORS/2001-203, art. 1
- DORS/2004-282, art. 2
- DORS/2012-129, art. 1
- DORS/2017-76, art. 8
- DORS/2021-46, art. 10
C.01A.003 Le présent titre et les titres 2 à 4 s’appliquent aux distributeurs suivants :
a) le distributeur d’un ingrédient actif;
b) celui d’une drogue dont il a obtenu l’identification numérique.
- DORS/97-12, art. 5
- DORS/2002-368, art. 2
- DORS/2013-74, art. 3
- DORS/2017-259, art. 12
C.01A.003.1 Pour l’application du présent titre et des dispositions des titres 2 à 4 qui sont prévues aux alinéas A.01.048b) à d) :
a) toute mention du distributeur visé à l’article C.01A.003 ou à l’alinéa C.01A.003a) comprend celle du distributeur d’un ingrédient actif qui est destiné à l’usage à l’extérieur du Canada;
b) toute mention du distributeur visé à l’article C.01A.003 ou à l’alinéa C.01A.003b) comprend celle du distributeur d’une drogue sous forme posologique qui est destinée à l’usage ou à la consommation à l’extérieur du Canada.
Interdiction
C.01A.004 (1) Sous réserve du paragraphe (2), il est interdit, sauf conformément à une licence d’établissement :
a) de manufacturer, d’emballer-étiqueter et d’importer une drogue;
b) d’effectuer les analyses, y compris les examens, exigées au titre 2;
c) de distribuer à titre de distributeur visé à l’article C.01A.003 une drogue autre que :
(i) l’ingrédient actif pharmaceutique,
(ii) l’ingrédient actif utilisé dans la manufacture d’une drogue d’origine non biologique visée à l’annexe C de la Loi;
d) de vendre en gros une drogue autre que :
(i) l’ingrédient actif pharmaceutique,
(ii) l’ingrédient actif utilisé dans la manufacture d’une drogue d’origine non biologique visée à l’annexe C de la Loi.
(2) Une personne n’est pas tenue d’être titulaire d’une licence d’établissement pour effectuer les analyses exigées au titre 2 si elle est autorisée par une licence d’établissement à manufacturer, emballer-étiqueter, distribuer à titre de distributeur visé à l’alinéa C.01A.003b) ou importer une drogue.
(3) Il est interdit d’exercer une activité visée au paragraphe (1), à moins d’être titulaire de l’une ou l’autre des licences suivantes :
a) s’agissant d’un stupéfiant au sens du Règlement sur les stupéfiants, la licence prévue pour ce stupéfiant dans ce même règlement;
b) s’agissant d’une drogue contrôlée au sens de l’article G.01.001, la licence prévue pour cette drogue à la partie G;
c) s’agissant d’une drogue contenant du cannabis au sens du paragraphe 2(1) de la Loi sur le cannabis, la licence prévue pour cette drogue afin d’exercer cette activité au titre du Règlement sur le cannabis.
- DORS/97-12, art. 5
- DORS/2002-368, art. 3
- DORS/2013-74, art. 4
- DORS/2017-259, art. 13
- DORS/2018-144, art. 368
- DORS/2019-171, art. 24
- DORS/2022-100, art. 3
Demande
- DORS/2011-81, art. 1(A)
C.01A.005 (1) Toute demande de licence d’établissement est présentée au ministre, en la forme établie par celui-ci, et contient les renseignements et documents suivants :
a) les nom, adresse et numéro de téléphone du demandeur ainsi que, le cas échéant, son numéro de télécopieur et son adresse électronique;
b) les nom et numéro de téléphone d’une personne qu’il est possible de joindre en cas d’urgence ainsi que, le cas échéant, son numéro de télécopieur et son adresse électronique;
c) chaque activité visée par la demande et figurant au tableau I de l’article C.01A.008;
d) chaque catégorie de drogues visée par la demande et figurant au tableau II de l’article C.01A.008;
e) chaque classe de forme posologique à l’égard de laquelle le demandeur se propose d’exercer une activité visée par sa licence et une mention indiquant s’il s’agit d’une drogue sous forme posologique stérile;
f) une mention indiquant si le demandeur se propose d’exercer une activité visée par sa licence à l’égard d’un ingrédient actif;
g) l’adresse de chacun des bâtiments au Canada où le demandeur se propose de manufacturer, d’emballer-étiqueter, d’effectuer les analyses exigées au titre 2 ou d’entreposer des drogues, avec indication, pour chaque bâtiment, des activités et des catégories de drogues ainsi que, pour chaque catégorie de drogues, la classe de forme posologique, le cas échéant, et une mention indiquant s’il s’agit d’une drogue stérile;
h) l’adresse de chacun des bâtiments au Canada où seront conservés les dossiers;
i) pour tout bâtiment visé aux alinéas g) ou h), une mention indiquant s’il s’agit d’une maison d’habitation;
j) l’identification numérique, le cas échéant, ou le nom qui identifie clairement la drogue s’il s’agit :
(i) d’un stupéfiant au sens du Règlement sur les stupéfiants, d’une drogue contrôlée au sens de l’article G.01.001 ou d’une drogue contenant du cannabis au sens du paragraphe 2(1) de la Loi sur le cannabis, pour lequel la licence est demandée,
(ii) de toute autre drogue d’une catégorie visée par la demande, à moins que la licence ne vise les analyses effectuées conformément au titre 2, la distribution à titre de distributeur visé à l’alinéa C.01A.003a) ou la vente en gros;
k) la date de la dernière inspection des bâtiments visés à l’alinéa g), le cas échéant, effectuée aux termes de la Loi ou du présent règlement;
l) la preuve que les bâtiments, l’équipement et les méthodes et pratiques que le demandeur propose satisfont aux exigences applicables des titres 2 à 4;
m) dans le cas de l’importateur d’une drogue qui, dans un pays participant, est manufacturée, emballée-étiquetée ou analysée dans un bâtiment reconnu :
(i) les nom et adresse de chaque manufacturier, emballeur-étiqueteur et analyste ainsi que l’adresse de chaque bâtiment où la drogue est manufacturée, emballée-étiquetée ou analysée, avec indication, pour chaque bâtiment, de l’activité et de la catégorie de drogues ainsi que, pour chaque catégorie de drogues, la classe de forme posologique, le cas échéant, et une mention indiquant s’il s’agit d’une drogue stérile,
(ii) à l’égard de chaque activité qui, dans un pays participant, est effectuée dans un bâtiment reconnu, le nom de l’autorité réglementaire désignée aux termes du paragraphe C.01A.019(1) à l’égard de cette activité pour cette drogue, qui reconnaît ce bâtiment comme satisfaisant à ses normes de bonnes pratiques de fabrication qui ont trait à cette activité pour cette drogue,
(iii) à l’égard des autres activités, selon le cas :
(A) le certificat d’un inspecteur canadien indiquant que les bâtiments, l’équipement et les méthodes et pratiques du manufacturier, de l’emballeur-étiqueteur ou de l’analyste satisfont aux exigences applicables des titres 2 à 4,
(B) toute autre preuve établissant que les bâtiments, l’équipement et les méthodes et pratiques du manufacturier, de l’emballeur-étiqueteur ou de l’analyste satisfont aux exigences applicables des titres 2 à 4;
n) dans le cas de tout autre importateur, les nom et adresse du manufacturier, de l’emballeur-étiqueteur et de l’analyste de qui il se propose d’importer la drogue, l’adresse de chaque bâtiment où elle sera manufacturée, emballée-étiquetée et analysée, avec indication, pour chaque bâtiment, de l’activité et de la catégorie de drogues ainsi que, pour chaque catégorie de drogues, la classe de forme posologique, le cas échéant, et une mention indiquant s’il s’agit d’une drogue stérile;
o) dans le cas de l’importateur visé à l’alinéa n), selon le cas :
(i) le certificat d’un inspecteur canadien indiquant que les bâtiments, l’équipement et les méthodes et pratiques du manufacturier, de l’emballeur-étiqueteur et de l’analyste satisfont aux exigences applicables des titres 2 à 4,
(ii) une autre preuve établissant que les bâtiments, l’équipement et les méthodes et pratiques du manufacturier, de l’emballeur-étiqueteur et de l’analyste satisfont aux exigences applicables des titres 2 à 4.
(2) En plus des renseignements et du matériel visés au paragraphe (1), la personne qui présente une demande de licence d’établissement qui vise l’une ou plusieurs des activités figurant au tableau I de l’article C.01A.008 et exercées à l’égard d’une catégorie de drogues figurant au tableau II de cet article qui inclut une drogue contre la COVID-19 peut inclure dans la demande une mention à cet égard.
- DORS/97-12, art. 5
- DORS/2000-120, art. 2
- DORS/2002-368, art. 4
- DORS/2011-81, art. 2
- DORS/2013-74, art. 5
- DORS/2018-144, art. 369
- DORS/2019-171, art. 24
- DORS/2021-45, art. 3
C.01A.006 (1) Toute demande de modification d’une licence d’établissement est présentée au ministre, en la forme établie par celui-ci, et contient les renseignements et documents visés à l’article C.01A.005 relativement à la modification demandée.
(1.1) En plus des renseignements et du matériel visés au paragraphe (1), la personne qui présente une demande de modification d’une licence d’établissement qui vise l’une ou plusieurs des activités figurant au tableau I de l’article C.01A.008 et exercées à l’égard d’une catégorie de drogues figurant au tableau II de cet article qui inclut une drogue contre la COVID-19 peut inclure dans la demande une mention à cet égard.
(2) Une licence d’établissement doit faire l’objet d’une modification lorsque le titulaire se propose :
a) d’ajouter une ou plusieurs activités ou une catégorie de drogues visées aux tableaux de l’article C.01A.008;
b) à l’égard d’une catégorie de drogues et d’une activité visées par la licence, d’autoriser des formes posologiques stériles;
c) d’ajouter un ou plusieurs bâtiments au Canada où il est autorisé de manufacturer, d’emballer-étiqueter, d’analyser conformément au titre 2 ou d’entreposer une drogue ou, pour un bâtiment existant, d’ajouter l’autorisation de manufacturer, d’emballer-étiqueter, d’analyser ou d’entreposer une catégorie de drogues ou des formes posologiques stériles de celle-ci;
d) dans le cas de tout importateur, en plus des éléments visés aux alinéas a) à c) :
(i) d’ajouter le nom d’un manufacturier, emballeur-étiqueteur ou analyste,
(ii) de modifier le nom ou l’adresse d’un manufacturier, emballeur-étiqueteur ou analyste indiqué dans la licence,
(iii) lorsque l’adresse des bâtiments où il est autorisé de manufacturer, d’emballer-étiqueter ou d’analyser une drogue est indiquée sur la licence, d’ajouter un ou plusieurs bâtiments ou, pour un bâtiment existant, d’ajouter l’autorisation de manufacturer, d’emballer-étiqueter ou d’analyser une catégorie de drogues ou des formes posologiques stériles de celle-ci.
- DORS/97-12, art. 5
- DORS/2011-81, art. 3
- DORS/2021-45, art. 4
C.01A.007 (1) Sur réception de la demande de licence d’établissement ou de modification ou d’examen d’une telle licence, le ministre peut, en vue de prendre une décision, exiger des précisions quant aux renseignements contenus dans la demande.
(2) Au cours de l’examen d’une demande, le ministre peut exiger :
a) qu’une inspection soit effectuée aux heures normales de bureau de tout bâtiment visé aux alinéas C.01A.005(1)g) ou h);
b) que le demandeur, s’il s’agit du manufacturier, de l’emballeur-étiqueteur, de la personne qui effectue les analyses conformément au titre 2, du distributeur visé à l’alinéa C.01A.003b) ou de l’importateur, fournisse des échantillons de tout matériau servant à manufacturer, emballer-étiqueter ou analyser une drogue.
- DORS/97-12, art. 5
- DORS/2011-81, art. 4
- DORS/2021-45, art. 5(F)
Délivrance
C.01A.008 (1) Sous réserve du paragraphe (1.1) et de l’article C.01A.010, le ministre délivre ou modifie une licence d’établissement sur réception des renseignements et du matériel visés aux articles C.01A.005 à C.01A.007.
(1.1) Lorsqu’il évalue s’il a reçu les renseignements et le matériel visés aux articles C.01A.005 à C.01A.007 à l’égard de la demande visée aux paragraphes C.01A.005(2) ou C.01A.006(1.1) qui contient la mention visée à celui de ces paragraphes qui s’applique, le ministre prend également en considération le besoin en matière de santé publique relatif à la COVID-19.
(2) La licence indique à la fois :
a) chacune des activités autorisées et la catégorie de drogues pour chacune d’entre elles, figurant aux tableaux I et II du présent article, respectivement, et précise pour chaque activité et catégorie de drogues, si des formes posologiques stériles sont autorisées;
b) l’adresse de chacun des bâtiments au Canada où il est autorisé à manufacturer, à emballer-étiqueter, à analyser conformément au titre 2 ou à entreposer une catégorie de drogues figurant au tableau II du présent article et pour chacun d’eux, l’activité et la catégorie de drogues, et si des formes posologiques stériles sont autorisées;
c) dans le cas de tout importateur, en plus des indications visées aux alinéas a) et b) :
(i) les nom et adresse de chaque manufacturier, emballeur-étiqueteur et analyste auprès de qui il est autorisé à obtenir la drogue pour l’importation,
(ii) l’adresse de chaque bâtiment où est autorisé la manufacture, l’emballage-étiquetage ou l’analyse de la drogue avec indication, pour chacun d’eux, des activités et de la catégorie de drogues autorisées figurant au tableau II du présent article, et si des formes posologiques stériles sont autorisées.
d) [Abrogé, DORS/2002-368, art. 5]
(3) Le ministre peut indiquer dans la licence d’établissement toute période pendant laquelle les dossiers doivent être conservés sous le régime du titre 2 et qui, selon le profil de sûreté de la drogue ou des matériaux, est suffisante pour assurer la protection du consommateur.
(4) Lorsqu’il délivre une licence d’établissement, le ministre peut l’assortir de conditions portant sur :
a) les analyses à effectuer à l’égard de la drogue et l’équipement à utiliser afin que la drogue puisse être utilisée sans danger;
b) tout autre élément nécessaire pour prévenir le risque pour la santé des consommateurs, notamment les conditions dans lesquelles la drogue est manufacturée, emballée-étiquettée ou analysée.
TABLEAU I
Article Activité 1 Manufacturer 2 Emballer-étiqueter 3 Analyser, y compris examiner, conformément au titre 2 4 Distribuer à titre de distributeur visé à l’alinéa C.01A.003a) un ingrédient actif autre que : a) l’ingrédient actif pharmaceutique
b) l’ingrédient actif utilisé dans la manufacture d’une drogue d’origine non biologique visée à l’annexe C de la Loi
5 Distribuer à titre de distributeur visé à l’alinéa C.01A.003b) 6 Importer 7 Vendre en gros une drogue autre que : a) l’ingrédient actif pharmaceutique
b) l’ingrédient actif utilisé dans la manufacture d’une drogue d’origine non biologique visée à l’annexe C de la Loi
TABLEAU II
Article Catégorie de drogues 1 Produit pharmaceutique 1.1 Ingrédient actif 2 Vaccin 3 [Abrogé, DORS/2013-179, art. 2] 4 Drogue, autre qu’un vaccin, visée à l’annexe D de la Loi 5 Drogue visée à l’annexe C de la Loi 6 Drogue qui est une drogue sur ordonnance, drogue contrôlée au sens de l’article G.01.001, stupéfiant au sens du Règlement sur les stupéfiants, et drogue contenant du cannabis au sens du paragraphe 2(1) de la Loi sur le cannabis
7 Ingrédient actif pharmaceutique figurant dans la Liste A qui est destiné à un usage vétérinaire
- DORS/97-12, art. 5
- DORS/2000-120, art. 3
- DORS/2002-368, art. 5
- DORS/2013-74, art. 6
- DORS/2013-122, art. 15
- DORS/2013-179, art. 2
- DORS/2017-76, art. 9
- DORS/2017-259, art. 14
- DORS/2018-144, art. 370
- DORS/2019-171, art. 24
- DORS/2021-45, art. 6
- DORS/2021-46, art. 11(A)
- DORS/2022-100, art. 4
Examen annuel de la licence
C.01A.009 (1) Le titulaire d’une licence d’établissement qui n’est pas suspendue doit, avant le 1er avril de chaque année, présenter au ministre la demande d’examen de sa licence accompagnée des renseignements et documents visés à l’article C.01A.005.
(2) Le ministre fait un examen annuel de la licence en se fondant sur les renseignements et documents fournis par le titulaire et sur toute autre information utile qu’il a en sa possession.
- DORS/97-12, art. 5
- DORS/97-298, art. 1
- DORS/2011-81, art. 5
Refus
C.01A.010 (1) Le ministre peut refuser de délivrer ou de modifier une licence d’établissement à l’égard de toute indication visée au paragraphe C.01A.008(2) dans les cas suivants :
a) le demandeur a fait une déclaration fausse ou trompeuse au sujet de sa demande de licence d’établissement;
b) sa licence d’établissement a été suspendue au même égard.
(2) Le ministre refuse de délivrer ou de modifier une licence d’établissement à l’égard de toute indication visée au paragraphe C.01A.008(2) s’il a des motifs raisonnables de croire que la délivrance ou la modification d’une telle licence constituerait un risque pour la santé des consommateurs.
(3) Lorsqu’il refuse de délivrer ou de modifier la licence d’établissement, le ministre :
a) en avise le demandeur par écrit, motifs à l’appui;
b) donne au demandeur la possibilité de se faire entendre.
- DORS/97-12, art. 5
Conditions
C.01A.011 (1) Le titulaire d’une licence d’établissement est tenu de se conformer :
a) aux exigences qui y sont énoncées;
b) aux exigences applicables des titres 2 à 4.
(2) [Abrogé, DORS/2000-120, art. 4]
- DORS/97-12, art. 5
- DORS/2000-120, art. 4
- DORS/2021-45, art. 7
C.01A.012 (1) Le ministre peut modifier les conditions dont il a assorti une licence d’établissement en vertu du paragraphe C.01A.008(4) s’il a des motifs raisonnables de croire que la modification est nécessaire pour prévenir des risques pour la santé des consommateurs.
(2) Le ministre donne au titulaire de la licence d’établissement un préavis écrit, d’au moins quinze jours indiquant la modification envisagée, les motifs de celle-ci et sa date d’entrée en vigueur.
- DORS/97-12, art. 5
- DORS/2021-45, art. 8
- DORS/2021-46, art. 11(A)
C.01A.012.1 (1) Malgré le paragraphe C.01A.008(4), le ministre peut, à tout moment, notamment celui de la délivrance, assortir de conditions la licence d’établissement qu’il délivre ou modifie en vertu de l’article C.01A.008 en réponse à la demande visée aux paragraphes C.01A.005(2) ou C.01A.006(1.1) qui contient la mention visée à celui de ces paragraphes qui s’applique.
(2) Il est entendu que les conditions dont le ministre peut assortir la licence d’établissement en vertu du paragraphe (1) ne se limitent pas à celles visées au paragraphe C.01A.008(4).
C.01A.012.2 Le ministre peut, à tout moment, modifier les conditions dont il a assorti une licence d’établissement en vertu du paragraphe C.01A.012.1(1).
Avis de modification
C.01A.013 Le titulaire d’une licence d’établissement doit aviser, par écrit, le ministre au plus tard le 15e jour suivant, selon le cas :
a) la modification des renseignements visés aux alinéas C.01A.005(1)a), b) et e) à i);
b) la survenance d’un fait susceptible d’avoir un effet sur la qualité, l’innocuité ou l’efficacité d’une drogue manufacturée, emballée-étiquetée, analysée conformément au titre 2 ou entreposée par lui qui entraîne le non-respect des exigences visées aux titres 2 à 4.
- DORS/97-12, art. 5
- DORS/2017-18, art. 15
- DORS/2021-45, art. 10
C.01A.014 (1) Il est interdit au titulaire d’une licence d’établissement d’exercer une activité visée par sa licence à l’égard d’une catégorie de drogues, si une modification visée au paragraphe (2) est apportée, sauf :
a) s’il a déposé auprès du ministre un avis contenant les renseignements nécessaires pour permettre à celui-ci d’évaluer l’innocuité de la drogue nouvelle compte tenu de la modification;
b) si le ministre lui a fait parvenir une lettre indiquant que les renseignements feront l’objet d’un examen, et qu’il ne lui a pas, dans les 90 jours suivant la date de cette lettre, fait parvenir un avis indiquant que la modification n’est pas acceptable.
(2) L’avis est exigé à l’égard des modifications suivantes susceptibles d’avoir pour effet que la drogue ne soit plus manufacturée, emballée-étiquetée, analysée ou entreposée conformément aux exigences applicables des titres 2 à 4 :
a) toute modification des plans et des devis du bâtiment où la drogue est manufacturée, emballée-étiquetée, analysée ou entreposée;
b) tout changement apporté à l’équipement servant à manufacturer, emballer-étiqueter ou analyser la drogue;
c) toute modification des méthodes ou pratiques;
d) dans le cas d’un importateur autre que celui d’une drogue qui, dans un pays participant, est manufacturée, emballée-étiquetée ou analysée dans un bâtiment reconnu, tout changement visé à l’un des alinéas a) à c) ayant trait au manufacturier, à l’emballeur-étiqueteur ou à l’analyste de la drogue importée.
- DORS/97-12, art. 5
- DORS/2000-120, art. 5
- DORS/2002-368, art. 6
C.01A.015 (1) L’importateur d’une drogue qui, dans un pays participant, est manufacturée, emballée-étiquetée ou analysée dans un bâtiment reconnu doit, sans délai, aviser le ministre si le manufacturier, l’emballeur-étiqueteur ou l’analyste indiqué dans la licence d’établissement de l’importateur n’est plus titulaire du permis, de la licence ou de toute autre autorisation valide délivré par l’autorité réglementaire qui reconnaissait le bâtiment.
(2) Sur réception de l’avis, le ministre modifie la licence d’établissement de l’importateur en radiant les nom et adresse du manufacturier, de l’emballeur-étiqueteur ou de l’analyste visé.
- DORS/97-12, art. 5
- DORS/2000-120, art. 6
- DORS/2002-368, art. 7
Suspension
C.01A.016 (1) Le ministre peut suspendre une licence d’établissement à l’égard de toute indication visée au paragraphe C.01A.008(2) lorsqu’il a des motifs raisonnables de croire que :
a) soit le titulaire de la licence a contrevenu à toute disposition de la Loi ou du présent règlement;
b) soit le titulaire de la licence a fait une déclaration fausse ou trompeuse dans sa demande de licence.
(2) Avant de suspendre une licence d’établissement, le ministre prend en compte les faits suivants :
a) les antécédents du titulaire pour ce qui est de la conformité aux dispositions de la Loi ou du présent règlement;
b) le risque que présenterait le maintien de la licence pour la santé des consommateurs.
(3) Le ministre ne peut suspendre la licence d’établissement que si, à la fois :
a) il a envoyé au titulaire un avis écrit précisant les motifs de la suspension, et, le cas échéant, les mesures correctives qui s’imposent ainsi que le délai accordé pour les prendre;
b) lorsque l’avis prévoit des mesures correctives, le titulaire ne les a pas prises dans le délai prévu;
c) le titulaire a eu la possibilité de se faire entendre à l’égard de la suspension.
- DORS/97-12, art. 5
- DORS/2018-84, art. 4
- DORS/2021-46, art. 7
C.01A.017 (1) Le ministre peut, lorsque cela est nécessaire pour prévenir des risques pour la santé des consommateurs, suspendre une licence d’établissement à l’égard de toute indication visée au paragraphe C.01A.008(2) sans que le titulaire de la licence ait la possibilité de se faire entendre, en lui faisant parvenir un avis motivé.
(2) Le titulaire d’une licence d’établissement peut demander, par écrit, au ministre que la suspension soit revisée.
(3) Le ministre doit, dans les 45 jours suivant la date de réception de la demande, donner au titulaire la possibilité de se faire entendre.
- DORS/97-12, art. 5
- DORS/2018-84, art. 5
C.01A.017.1 Le ministre peut suspendre une licence d’établissement à l’égard de toute indication visée au paragraphe C.01A.008(2) si, après qu’il a ordonné en vertu de l’article 21.31 de la Loi au titulaire de la licence d’effectuer une évaluation en vue de fournir des preuves établissant que ses bâtiments, son équipement ou ses méthodes et pratiques, selon le cas, remplissent toujours les exigences prévues à l’alinéa C.01A.005(1)l), aux sous-alinéas C.01A.005(1)m)(ii) ou (iii) ou à l’alinéa C.01A.005(1)o) :
a) le titulaire ne se conforme pas à l’ordre;
b) le titulaire se conforme à l’ordre, mais le ministre conclut que les résultats de l’évaluation sont insuffisants pour établir que ces exigences sont toujours remplies.
- DORS/2018-84, art. 6
- DORS/2021-45, art. 11
C.01A.018 Le ministre rétablit la licence d’établissement à l’égard de toute indication visée au paragraphe C.01A.008(2) qui fait l’objet de la suspension si, dans les douze mois suivant la date de prise d’effet de la suspension, le titulaire de la licence lui fournit des preuves suffisantes démontrant :
a) soit que le titulaire de la licence a remédié à la situation sur laquelle la suspension était fondée;
b) soit que la situation sur laquelle la suspension était fondée n’a pas existé.
- DORS/97-12, art. 5
- DORS/2018-84, art. 6
Annulation
C.01A.018.1 Le ministre annule la licence d’établissement dont le titulaire omet de présenter une demande d’examen conformément au paragraphe C.01A.009(1).
- DORS/2011-81, art. 6
- DORS/2018-84, art. 7
C.01A.018.2 (1) S’il a suspendu une licence d’établissement à l’égard de toutes les indications visées au paragraphe C.01A.008(2) et que la suspension est toujours en vigueur douze mois après la date de sa prise d’effet, le ministre annule la licence.
(2) S’il a suspendu une licence d’établissement à l’égard de l’une ou de plusieurs des indications visées au paragraphe C.01A.008(2) et que la suspension est toujours en vigueur douze mois après la date de sa prise d’effet, le ministre annule la licence seulement à l’égard des indications qui font l’objet de la suspension.
- DORS/2018-84, art. 7
Désignation
C.01A.019 (1) Pour l’application du présent titre et des titres 2 à 4, les autorités réglementaires mentionnées à la colonne 1 de la Liste des autorités réglementaires pour l’application de l’article C.01A.019 du Règlement sur les aliments et drogues, publiée par le gouvernement du Canada sur son site Web, avec ses modifications successives, sont désignées à l’égard des activités visées à la colonne 3 pour les drogues et les catégories de drogues visées à la colonne 2.
(2) Le sang entier et ses composants sont exclus des drogues et des catégories de drogues visées à la colonne 2 de cette liste.
(3) La mise en circulation de lots de drogues visées à l’annexe D de la Loi est exclue de l’activité d’analyse visée à la colonne 3 de cette liste.
- DORS/97-12, art. 5
- DORS/2000-120, art. 7
- DORS/2002-368, art. 8
- DORS/2024-136, art. 2
TITRE 2Bonnes pratiques de fabrication
C.02.001 [Abrogé, DORS/97-12, art. 5.1]
C.02.002 Dans le présent titre,
- drogue
drogue[Abrogée, DORS/97-12, art. 6]
- gaz médical
gaz médical désigne tout gaz ou mélange de gaz fabriqué ou vendu pour servir de drogue ou présenté comme pouvant servir de drogue; (medical gas)
- importateur
importateur[Abrogée, DORS/97-12, art. 6]
- matériel de conditionnement
matériel de conditionnement[Abrogée, DORS/89-174, art. 1]
- matériel d’emballage
matériel d’emballage comprend une étiquette; (packaging material);
- produire
produire[Abrogée, DORS/97-12, art. 6]
- service du contrôle de la qualité
service du contrôle de la qualité[Abrogée, DORS/2010-95, art. 1]
- spécifications
spécifications s’entend de la description détaillée d’une drogue, de la matière première utilisée dans cette drogue ou du matériel d’emballage de la drogue, y compris :
a) la liste des propriétés et des qualités de la drogue, de la matière première ou du matériel d’emballage qui ont trait à la fabrication, à l’emballage et à l’emploi de la drogue, y compris l’identité, l’activité et la pureté de la drogue, de la matière première ou du matériel d’emballage,
b) une description détaillée des méthodes d’analyse et d’examen de la drogue, de la matière première ou du matériel d’emballage,
c) une indication des tolérances relatives aux propriétés et aux qualités de la drogue, de la matière première ou du matériel d’emballage. (specifications)
- DORS/82-524, art. 3
- DORS/85-754, art. 1
- DORS/89-174, art. 1
- DORS/97-12, art. 6
- DORS/2010-95, art. 1
C.02.002.1 Le présent titre ne s’applique pas aux activités visant à manufacturer, à emballer-étiqueter, à analyser, à entreposer ou à importer un agent antimicrobien.
- DORS/2004-282, art. 3
C.02.002.2 Dans le présent titre :
a) toute mention des spécifications d’une drogue destinée à la consommation ou à l’usage à l’extérieur du Canada, de la matière première utilisée dans cette drogue ou du matériel d’emballage de la drogue constitue un renvoi aux spécifications auxquelles la drogue, la matière première ou le matériel d’emballage est tenu de se conformer dans le pays dans lequel la drogue est destinée à être consommée ou utilisée;
b) la définition de date limite d’utilisation au paragraphe C.01.001(1) ne s’applique pas à l’égard d’une drogue destinée à la consommation ou à l’usage à l’extérieur du Canada.
Vente
C.02.003 Il est interdit au distributeur visé à l’alinéa C.01A.003b) et à l’importateur de vendre une drogue qui n’a pas été manufacturée, emballée-étiquetée, analysée et entreposée conformément aux exigences du présent titre.
- DORS/82-524, art. 3
- DORS/97-12, art. 7
- DORS/2000-120, art. 8
- DORS/2010-95, art. 2(F)
C.02.003.1 Il est interdit à la personne qui manufacture, emballe-étiquette, analyse ou entrepose une drogue de la vendre à moins d’avoir effectué l’activité conformément aux exigences du présent titre.
- DORS/2013-74, art. 7
C.02.003.2 (1) Il est interdit d’importer un ingrédient actif en vue de le vendre à moins qu’une personne ne soit responsable au Canada de sa vente.
(2) Il est interdit à toute personne qui importe un ingrédient actif d’en vendre un lot ou un lot de fabrication, à moins que les renseignements suivants ne figurent sur l’étiquette :
a) les nom et adresse municipale de cette personne;
b) les nom et adresse du principal établissement au Canada de la personne responsable de la vente.
- DORS/2013-74, art. 7
Utilisation pour la manufacture
C.02.003.3 Il est interdit d’utiliser dans la manufacture d’une drogue tout ingrédient actif qui n’a pas été manufacturé, emballé-étiqueté, analysé et entreposé conformément aux exigences du présent titre.
- DORS/2013-74, art. 7
Locaux
C.02.004 Les locaux dans lesquels un lot ou un lot de fabrication d’une drogue est manufacturé, emballé-étiqueté ou entreposé sont conçus, construits et entretenus de manière :
a) à permettre l’exécution des opérations d’une façon propre, hygiénique et ordonnée;
b) à permettre le nettoyage efficace de toutes les surfaces qui s’y trouvent; et
c) à empêcher la contamination de la drogue et l’introduction de toute matière étrangère à la drogue.
- DORS/82-524, art. 3
- DORS/97-12, art. 8
- DORS/2010-95, art. 3
Équipement
C.02.005 L’équipement servant à manufacturer, emballer-étiqueter ou analyser un lot ou un lot de fabrication d’une drogue doit être conçu, fabriqué, entretenu, utilisé et disposé de façon :
a) à permettre le nettoyage efficace de toutes les surfaces qui s’y trouvent;
b) à empêcher la contamination de la drogue et l’introduction de toute matière étrangère à la drogue; et
c) à fonctionner selon son usage voulu.
- DORS/82-524, art. 3
- DORS/97-12, art. 9
Personnel
C.02.006 Chaque lot ou lot de fabrication d’une drogue doit être manufacturé, emballé-étiqueté, analysé et entreposé sous la surveillance d’un personnel qui, sur le plan des fonctions et responsabilités en cause, a reçu une formation technique, une formation théorique de même qu’un autre type de formation que le ministre juge satisfaisantes dans l’intérêt de la santé du consommateur ou de l’acheteur.
- DORS/82-524, art. 3
- DORS/85-754, art. 2
- DORS/97-12, art. 52
- DORS/2018-69, art. 27
Hygiène
C.02.007 (1) La personne qui manufacture ou emballe-étiquette une drogue doit avoir un programme d’hygiène, par écrit, qui est appliqué sous la surveillance d’un personnel compétent.
(2) Le programme d’hygiène visé au paragraphe (1) doit comprendre :
a) les méthodes de nettoyage des locaux où la drogue est manufacturée ou emballée-étiquetée et de l’équipement servant à ces fins;
b) des instructions pour manufacturer et emballer-étiqueter les drogues dans des conditions hygiéniques et pour manutentionner le matériel utilisé à ces fins.
- DORS/82-524, art. 3
- DORS/97-12, art. 10 et 53
C.02.008 (1) Le manufacturier et l’emballeur-étiqueteur d’une drogue doivent avoir, par écrit, les exigences minimales relatives à la santé ainsi qu’au comportement et aux vêtements du personnel afin que la drogue soit manufacturée et emballée-étiquetée dans des conditions hygiéniques.
(2) L’accès à une zone où est exposée une drogue à l’étape où elle est manufacturée ou emballée-étiquetée est interdite à la personne :
a) qui est atteinte ou porteuse d’une maladie transmissible, ou
b) qui présente une plaie ouverte sur une surface exposée de son corps.
- DORS/82-524, art. 3
- DORS/97-12, art. 11
Analyse des matières premières
C.02.009 (1) Un lot ou un lot de fabrication d’une matière première doit être analysé en fonction des spécifications de cette matière première, avant d’être utilisé pour manufacturer une drogue.
(2) Un lot ou un lot de fabrication d’une matière première ne peut être utilisé pour manufacturer une drogue que s’il est conforme aux spécifications de cette matière première.
(3) Nonobstant le paragraphe (1), l’eau peut, avant la fin de l’analyse visée à ce paragraphe, être utilisée pour manufacturer une drogue.
(4) Si une propriété d’une matière première est susceptible de s’altérer au cours de l’entreposage, aucun lot ni lot de fabrication de cette matière ne peut être utilisé, après avoir été entreposé, pour manufacturer une drogue, à moins que la propriété n’ait été à nouveau analysée après un intervalle approprié et trouvée conforme aux spécifications établies à son égard.
(5) Si les spécifications visées aux paragraphes (1), (2) et (4) ne sont pas prescrites, elles doivent
a) être par écrit;
b) être jugées acceptables par le ministre, qui tiendra compte des spécifications énoncées dans les publications visées à l’annexe B de la Loi; et
c) être approuvées par le responsable du service du contrôle de la qualité.
- DORS/82-524, art. 3
- DORS/97-12, art. 59
- DORS/2018-69, art. 27
C.02.010 (1) Les analyses visées à l’article C.02.009 doivent être effectuées sur un échantillon prélevé
a) après la réception de chaque lot ou chaque lot de fabrication de matières premières dans les locaux du manufacturier; ou
b) sous réserve du paragraphe (2), avant la réception de chaque lot ou chaque lot de fabrication de matières premières dans les locaux du manufacturier,
(i) si ce manufacturier :
(A) prouve, à la satisfaction du ministre, que les matières premières qui lui ont été vendues par le vendeur du lot ou du lot de fabrication sont fabriquées d’une façon constante selon les spécifications établies pour ces matières et qu’elles s’y conforment de manière constante, et
(B) effectue des analyses de vérification complètes à une fréquence satisfaisant le ministre, et
(ii) si les matières premières n’ont pas été transportées ni entreposées dans des conditions pouvant modifier leur conformité aux spécifications établies à leur égard.
(2) Chaque lot ou chaque lot de fabrication de matières premières reçu dans les locaux du manufacturier, doit être soumis à une analyse d’identité.
- DORS/82-524, art. 3
- DORS/97-12, art. 12 et 60
- DORS/2018-69, art. 27
Contrôle de la fabrication
C.02.011 (1) Le manufacturier, l’emballeur-étiqueteur, le distributeur visé à l’alinéa C.01A.003b) et l’importateur doivent avoir, par écrit, les méthodes établies par un personnel compétent qui garantissent que la drogue est conforme à ses spécifications.
(2) Toute personne tenue d’avoir par écrit les méthodes visées au paragraphe (1) doit veiller à ce que chaque lot ou lot de fabrication soit manufacturé, emballé-étiqueté et analysé selon ces méthodes.
- DORS/82-524, art. 3
- DORS/97-12, art. 13
C.02.012 (1) Le manufacturier, l’emballeur-étiqueteur, le distributeur visé à l’article C.01A.003, l’importateur et le grossiste doivent tenir :
a) un système de contrôle qui permet le retrait rapide et complet de tout lot ou tout lot de fabrication de la drogue se trouvant sur le marché;
b) un programme d’auto-inspection.
(2) Le manufacturier, l’emballeur-étiqueteur et, sous réserve des paragraphes (3) et (4), le distributeur visé à l’alinéa C.01A.003b) et l’importateur d’une drogue tiennent un système garantissant que tout lot ou tout lot de fabrication de la drogue manufacturé et emballé-étiqueté ailleurs que dans leurs locaux l’est conformément aux exigences du présent titre.
(3) Le paragraphe (2) ne s’applique pas au distributeur si la drogue est manufacturée, emballée-étiquetée et analysée au Canada par le titulaire d’une licence d’établissement autorisant ces activités à l’égard de celle-ci.
(4) Le paragraphe (2) ne s’applique pas au distributeur ou à l’importateur si la drogue est manufacturée ou emballée-étiquetée dans un bâtiment reconnu d’un pays participant et si les conditions ci-après sont réunies :
a) l’adresse du bâtiment est indiquée dans la licence d’établissement du distributeur ou de l’importateur;
b) pour chaque lot ou lot de fabrication de la drogue qu’il reçoit, le distributeur ou l’importateur conserve une copie du certificat de lot.
- DORS/82-524, art. 3
- DORS/97-12, art. 13
- DORS/2000-120, art. 9
- DORS/2002-368, art. 9
- DORS/2013-74, art. 8
Service du contrôle de la qualité
C.02.013 (1) Le manufacturier, l’emballeur-étiqueteur, le grossiste, le distributeur visé à l’article C.01A.003 et l’importateur d’une drogue ont dans leurs locaux au Canada un service du contrôle de la qualité qui est sous la surveillance du personnel visé à l’article C.02.006.
(2) Sauf dans le cas du grossiste et du distributeur visé à l’alinéa C.01A.003a), le service du contrôle de la qualité est un service organisationnel distinct qui relève de la direction et fonctionne indépendamment des autres services fonctionnels, y compris les services de fabrication, de traitement, d’emballage ou des ventes.
- DORS/82-524, art. 3
- DORS/89-174, art. 8(F)
- DORS/97-12, art. 55
- DORS/2000-120, art. 10
- DORS/2010-95, art. 4
- DORS/2013-74, art. 9
C.02.014 (1) Sauf dans le cas du grossiste et du distributeur visé à l’alinéa C.01A.003a), il est interdit de rendre disponible pour utilisation ultérieure, dans le cadre d’un processus de manufacture, tout lot ou lot de fabrication d’une drogue, ou de mettre en vente un tel lot ou lot de fabrication, sans l’approbation du responsable du service de contrôle de la qualité.
(2) Il est interdit au manufacturier, à l’emballeur-étiqueteur, au grossiste, au distributeur visé à l’article C.01A.003 ou à l’importateur de rendre disponible pour utilisation ultérieure, dans le cadre d’un processus de manufacture, toute drogue qui lui est retournée, ou de remettre en vente une telle drogue, sans l’approbation du responsable du service de contrôle de la qualité.
(3) Il est interdit d’utiliser tout lot ou lot de fabrication de matières premières ou de matériaux d’emballage-étiquetage pour manufacturer ou emballer-étiqueter une drogue sans l’approbation du responsable du service de contrôle de la qualité.
(4) Il est interdit de traiter de nouveau tout lot ou lot de fabrication d’une drogue sans l’approbation du responsable du service de contrôle de la qualité.
- DORS/82-524, art. 3
- DORS/89-174, art. 8(F)
- DORS/97-12, art. 14 et 55
- DORS/2010-95, art. 5
- DORS/2013-74, art. 9
C.02.015 (1) Les méthodes et pratiques utilisées pour manufacturer, emballer-étiqueter, analyser, entreposer ou transporter une drogue qui peuvent avoir un effet sur sa qualité doivent être examinées et approuvées par le responsable du service de contrôle de la qualité avant d’être appliquées.
(2) Le responsable du service du contrôle de la qualité veille à ce que la plainte ou le renseignement reçu au sujet de la qualité d’une drogue — ou des défauts ou dangers qu’elle comporte — fasse l’objet d’une enquête et à ce que les mesures correctives nécessaires soient prises, dans le cas où la plainte ou le renseignement concerne une activité sur laquelle le service exerce un contrôle de la qualité.
(2.1) Dans le cas contraire, il l’achemine au responsable du service du contrôle de la qualité qui exerce un contrôle de la qualité sur l’activité en cause.
(3) Le responsable du service du contrôle de la qualité doit s’assurer que les analyses et les examens exigés dans le présent titre sont effectués par un laboratoire compétent.
- DORS/82-524, art. 3
- DORS/97-12, art. 15
- DORS/2010-95, art. 6
Analyse du matériel d’emballage
C.02.016 (1) Un lot ou un lot de fabrication de matériel d’emballage doit, avant d’être utilisé pour l’emballage d’une drogue, faire l’objet d’examens ou d’analyses en fonction des spécifications établies pour ce matériel.
(2) Un lot ou un lot de fabrication de matériel d’emballage ne peut être utilisé pour l’emballage d’une drogue que s’il est conforme aux spécifications établies pour ce matériel.
(3) Les spécifications visées aux paragraphes (1) et (2) doivent
a) être par écrit;
b) être jugées acceptables par le ministre, qui tiendra compte des spécifications prévues dans les publications visées à l’annexe B de la Loi; et
c) être approuvées par le responsable du service du contrôle de la qualité.
- DORS/82-524, art. 3
- DORS/89-174, art. 8(F)
- DORS/2018-69, art. 27
C.02.017 (1) Les examens ou les analyses visés à l’article C.02.016 doivent être effectués sur un échantillon prélevé
a) après la réception de chaque lot ou chaque lot de fabrication de matériel d’emballage dans les locaux de la personne qui emballe-étiquette une drogue; ou
b) sous réserve du paragraphe (2), avant la réception de chaque lot ou lot de fabrication de matériel d’emballage dans les locaux de la personne qui emballe une drogue :
(i) si cette personne
(A) prouve, à la satisfaction du ministre, que le matériel d’emballage qui lui a été vendu par le vendeur du lot ou du lot de fabrication est fabriqué d’une façon constante selon les spécifications établies pour ce matériel et qu’il s’y conforme de manière constante, et
(B) effectue des examens ou des analyses de vérification complets à une fréquence satisfaisant le ministre, et
(ii) si le matériel d’emballage n’a pas été transporté ni entreposé dans des conditions pouvant modifier sa conformité aux spécifications établies à son égard.
(2) Sur réception d’un lot ou d’un lot de fabrication de matériel d’emballage dans les locaux de la personne qui emballe-étiquette la drogue
a) le lot ou le lot de fabrication de matériel d’emballage doit être soumis à un examen ou à une analyse d’identité; et
b) les étiquettes doivent être examinées ou analysées pour assurer leur conformité aux spécifications établies à leur égard.
- DORS/82-524, art. 3
- DORS/89-174, art. 2(F) et 8(F)
- DORS/97-12, art. 56(F)
- DORS/2018-69, art. 27
Analyse du produit fini
C.02.018 (1) Tout lot ou lot de fabrication d’une drogue doit, avant d’être rendu disponible pour utilisation ultérieure dans le cadre d’un processus de manufacture ou mis en vente, être analysé en fonction des spécifications établies pour cette drogue.
(2) Il est interdit de rendre disponible pour utilisation ultérieure dans le cadre d’un processus de manufacture, ou de mettre en vente, tout lot ou lot de fabrication d’une drogue qui n’est pas conforme aux spécifications établies pour cette drogue.
(3) Les spécifications visées aux paragraphes (1) et (2) doivent
a) être par écrit;
b) être approuvées par le responsable du service du contrôle de la qualité; et
c) être conformes à la Loi et au présent règlement.
- DORS/82-524, art. 3
- DORS/2013-74, art. 10
C.02.019 (1) L’emballeur-étiqueteur d’une drogue, le distributeur visé à l’alinéa C.01A.003b) et l’importateur d’une drogue autre qu’un ingrédient actif font l’analyse du produit fini sur un échantillon de la drogue prélevé :
a) soit après la réception au Canada, dans leurs locaux, du lot ou lot de fabrication de la drogue;
b) soit avant la réception du lot ou lot de fabrication dans leurs locaux, si les conditions ci-après sont réunies :
(i) l’emballeur-étiqueteur, le distributeur ou l’importateur :
(A) établit à la satisfaction du ministre que la drogue qui lui a été vendue par le vendeur du lot ou lot de fabrication a été fabriquée d’une façon constante selon les spécifications établies pour celle-ci et qu’elle est invariablement conforme à ces spécifications,
(B) effectue des analyses de vérification complètes à une fréquence acceptable selon le ministre,
(ii) la drogue n’a pas été transportée ou entreposée dans des conditions pouvant faire en sorte qu’elle ne soit plus conforme aux spécifications établies à son égard.
(2) Chaque lot ou lot de fabrication d’une drogue reçu au Canada dans les locaux de l’emballeur-étiqueteur, du distributeur ou de l’importateur doit, lorsque la période de vie utile de cette drogue est de plus de 30 jours, être soumis à une analyse d’identité, celle-ci devant être confirmée par l’emballeur-étiqueteur après l’emballage-étiquetage.
(3) Les paragraphes (1) et (2) ne s’appliquent pas au distributeur si la drogue est manufacturée, emballée-étiquetée et analysée au Canada par le titulaire d’une licence d’établissement autorisant ces activités à l’égard de cette drogue.
(4) Les paragraphes (1) et (2) ne s’appliquent ni au distributeur ni à l’importateur si la drogue est manufacturée, emballée-étiquetée et analysée dans un bâtiment reconnu d’un pays participant et s’il conserve une copie du certificat de lot pour chaque lot de la drogue, ou chaque lot de fabrication de celle-ci qu’il reçoit.
(4.1) Les paragraphes (1) et (2) ne s’appliquent ni au distributeur ni à l’importateur d’une drogue contre la COVID-19 si celle-ci fait l’objet d’une demande écrite au titre de l’article C.04.015.
(4.2) Le paragraphe (1) ne s’applique ni à l’emballeur-étiqueteur, ni au distributeur, ni à l’importateur, si les conditions ci-après sont réunies :
a) la drogue est un produit pharmaceutique radioactif ou un générateur de radionucléide au sens de l’article C.03.001 et elle a une période de vie utile d’au plus trente jours;
b) l’emballeur-étiqueteur, le distributeur ou l’importateur, selon le cas, conserve une preuve que le ministre juge satisfaisante démontrant à la fois que :
(i) la drogue a été analysée en fonction des spécifications établies à son égard,
(ii) elle n’a pas été transportée ni entreposée dans des conditions modifiant sa conformité aux spécifications établies à son égard.
(4.3) Les paragraphes (1) et (2) ne s’appliquent ni à l’emballeur-étiqueteur, ni au distributeur, ni à l’importateur, si les conditions ci-après sont réunies :
a) la drogue satisfait aux exigences suivantes :
(i) elle est destinée à l’usage des humains;
(ii) elle est sous forme posologique;
(iii) elle est visée à l’annexe D de la Loi;
(iv) elle n’est pas un vaccin;
(v) elle est composée de cellules humaines nucléées autologues génétiquement modifiées ou elle atteint les cellules à l’aide d’un vecteur de virus adéno-associé;
b) l’emballeur-étiqueteur, le distributeur ou l’importateur, selon le cas, conserve une preuve que le ministre juge satisfaisante démontrant à la fois que :
(i) la drogue a été analysée en fonction des spécifications établies à son égard,
(ii) elle n’a pas été transportée ni entreposée dans des conditions pouvant modifier sa conformité aux spécifications établies à son égard.
(5) Les paragraphes (1) et (2) ne s’appliquent ni au distributeur ni à l’importateur d’une drogue qui peut être vendue sans ordonnance et qui appartient à une catégorie de drogues figurant à la colonne 1 de la liste de drogues vendues sans ordonnance et non soumises à certaines analyses, si les conditions ci-après sont réunies :
a) la drogue contient comme seuls ingrédients actifs un ou plusieurs de ceux visés à la colonne 2 pour cette catégorie de drogues, chacun en une quantité figurant à la colonne 3, et les éléments descriptifs visés aux colonnes 4 à 6 s’appliquent à la drogue;
b) la drogue satisfait aux exigences suivantes :
(i) elle est manufacturée soit au Canada, soit dans des pays ou régions reconnus,
(ii) elle est emballée-étiquetée soit au Canada, soit dans des pays ou régions reconnus,
(iii) elle fait l’objet de l’analyse dans des pays ou régions reconnus;
c) le distributeur ou l’importateur de la drogue conserve une copie du certificat de lot pour chaque lot de la drogue, ou chaque lot de fabrication de celle-ci, distribuée ou importée, selon le cas.
(6) La drogue qui est visée aux paragraphes (4.2), (4.3) ou (5) et qui est importée peut être expédiée directement à une personne autre que l’importateur si les conditions ci-après sont réunies :
a) l’importateur a reçu, avant d’importer la drogue, un document démontrant que celle-ci est conforme aux spécifications établies pour la drogue;
b) l’importateur et le distributeur ont mis des mesures en place afin de veiller à ce que toute exigence requise par le présent règlement relativement à l’importation de la drogue soit remplie.
- DORS/82-524, art. 3
- DORS/89-174, art. 8(F)
- DORS/97-12, art. 16 et 57
- DORS/2000-120, art. 11
- DORS/2002-368, art. 10
- DORS/2013-74, art. 11
- DORS/2018-69, art. 27
- DORS/2020-73, art. 2
- DORS/2021-45, art. 12
- DORS/2024-136, art. 4
Dossiers
C.02.020 (1) Le manufacturier, l’emballeur-étiqueteur, le distributeur visé à l’alinéa C.01A.003b) et l’importateur conservent dans leurs locaux au Canada, pour chaque drogue qu’ils fabriquent, emballent-étiquettent, distribuent ou importent :
a) sauf dans le cas de l’importateur d’un ingrédient actif pharmaceutique ou d’un ingrédient actif utilisé dans la manufacture d’une drogue d’origine non biologique visée à l’annexe C de la Loi, des documents-types de production de la drogue;
b) une preuve attestant que chaque lot ou chaque lot de fabrication de la drogue a été manufacturé, emballé-étiqueté, analysé et entreposé conformément aux méthodes énoncées dans les documents-types de production;
c) une preuve attestant que les conditions dans lesquelles la drogue a été manufacturée, emballée-étiquetée, analysée et entreposée sont conformes aux exigences du présent titre;
d) une preuve attestant la période pendant laquelle la drogue demeurera conforme aux spécifications établies à son égard dans le contenant dans lequel elle est mise en vente ou rendue disponible pour utilisation ultérieure dans le cadre du processus de manufacture;
e) une preuve attestant que les analyses du produit fini prévues à l’article C.02.018 ont été faites, accompagnée des résultats de celles-ci.
(2) Le distributeur visé à l’alinéa C.01A.003b) et l’importateur fournissent au ministre, sur demande, les résultats des analyses des matières premières et des matériaux d’emballage-étiquetage effectuées pour chaque lot ou lot de fabrication d’une drogue qu’ils distribuent ou importent.
(3) Le manufacturier conserve dans ses locaux les spécifications écrites relatives à ces matières ainsi qu’une preuve satisfaisante des analyses prévues à l’article C.02.009 et les résultats de celles-ci.
(4) La personne qui emballe une drogue conserve dans ses locaux les spécifications écrites relatives au matériel d’emballage ainsi qu’une preuve satisfaisante des examens ou analyses prévus à l’article C.02.016 et les résultats de ceux-ci.
(5) Le manufacturier, l’emballeur-étiqueteur et l’analyste conservent dans leurs locaux au Canada les plans et devis détaillés de chacun des bâtiments au Canada où la drogue est manufacturée, emballée-étiquetée ou analysée ainsi qu’une description de la conception et de la construction de ces bâtiments.
(6) Le manufacturier, l’emballeur-étiqueteur et l’analyste conservent dans leurs locaux au Canada un dossier sur chaque membre de son personnel qui supervise les opérations visant à manufacturer, emballer-étiqueter ou analyser la drogue, notamment son titre, ses responsabilités, ses qualifications, son expérience et sa formation.
- DORS/82-524, art. 3
- DORS/89-174, art. 3(F) et 8(F)
- DORS/97-12, art. 17, 52 et 60
- DORS/2013-74, art. 11
- DORS/2017-259, art. 15
- DORS/2018-69, art. 27
C.02.021 (1) Les dossiers et les preuves exigés par le présent titre qui portent sur les opéra tions visant à manufacturer, emballer-étiqueter, analyser le produit fini aux termes de l’article C.02.018 et entreposer une drogue sous forme posologique doivent être conservés pendant un an après la date limite d’utilisation de la drogue, à moins que la licence d’établissement de l’intéressé ne prévoie une autre période.
(2) Sous réserve du paragraphe (4), les dossiers et les preuves exigés par le présent titre qui portent sur les opérations visant à manufacturer, emballer-étiqueter, analyser le produit fini aux termes de l’article C.02.018 et entreposer un ingrédient actif doivent être conservés, pour chaque lot ou lot de fabrication de l’ingrédient actif, pendant celle des périodes ci-après qui s’applique, à moins que la licence d’établissement de l’intéressé ne prévoie une autre période :
a) dans le cas d’un ingrédient actif ayant une date de nouvelle analyse, trois ans après la distribution complète du lot ou du lot de fabrication;
b) dans les autres cas, un an après la date limite d’utilisation du lot ou du lot de fabrication.
(3) Sous réserve du paragraphe (4), les dossiers et les preuves exigés par le présent titre au sujet de l’analyse des matières premières visée à l’article C.02.009 et des matériaux d’emballage-étiquetage doivent être conservés pendant cinq ans après leur dernière utilisation au cours des opérations visant à manufacturer ou à emballer-étiqueter la drogue à moins que la licence d’établissement de l’intéressé ne prévoie une autre période.
(4) Si le manufacturier doit conserver des dossiers et des preuves à l’égard d’un même ingrédient actif aux termes des paragraphes (2) et (3), il les conserve pour la plus longue période applicable.
- DORS/82-524, art. 3
- DORS/89-174, art. 8(F)
- DORS/92-654, art. 6
- DORS/97-12, art. 18
- DORS/2013-74, art. 11
C.02.022 (1) Le grossiste, le distributeur visé à l’article C.01A.003 et l’importateur d’une drogue sous forme posologique conservent les dossiers sur la vente de chaque lot ou lot de fabrication de la drogue qui leur permettent de retirer du marché le lot ou lot de fabrication, pendant un an après sa date limite d’utilisation, à moins que la licence d’établissement de l’intéressé ne prévoie une autre période.
(2) Le distributeur d’un ingrédient actif visé à l’alinéa C.01A.003a) et le grossiste et l’importateur d’un ingrédient actif conservent les dossiers sur la vente de chaque lot ou lot de fabrication de l’ingrédient actif qui leur permettent de retirer du marché le lot ou lot de fabrication pendant celle des périodes ci-après qui s’applique, à moins que l’intéressé ne détienne une licence d’établissement qui prévoit une autre période :
a) dans le cas d’un ingrédient actif ayant une date de nouvelle analyse, trois ans après la distribution complète du lot ou du lot de fabrication;
b) dans les autres cas, un an après la date limite d’utilisation du lot ou du lot de fabrication.
- DORS/82-524, art. 3
- DORS/92-654, art. 7
- DORS/97-12, art. 18
- DORS/2013-74, art. 11
C.02.023 (1) Sur réception d’une plainte ou de renseignements sur la qualité d’une drogue — ou sur des défauts ou dangers qu’elle comporte —, le manufacturier, l’emballeur-étiqueteur, le grossiste, le distributeur visé à l’article C.01A.003 et l’importateur de la drogue ouvrent un dossier dans lequel ils font état de la plainte ou des renseignements et consignent, selon le cas :
a) les résultats des enquêtes qu’ils ont menées à cet égard aux termes du paragraphe C.02.015(2) et, le cas échéant, les mesures correctives prises;
b) le nom et l’adresse du lieu de travail du responsable du service du contrôle de la qualité à qui la plainte ou le renseignement a été acheminé aux termes du paragraphe C.02.015(2.1) et la date de l’acheminement.
(2) Les dossiers visés au paragraphe (1) sont conservés pendant celle des périodes ci-après qui s’applique, à moins que l’intéressé ne détienne une licence d’établissement qui prévoit une autre période :
a) dans le cas d’une drogue sous forme posologique, un an après la date limite d’utilisation du lot ou du lot de fabrication de la drogue;
b) dans le cas d’un ingrédient actif :
(i) s’il a une date de nouvelle analyse, trois ans après la distribution complète du lot ou du lot de fabrication,
(ii) dans les autres cas, un an après la date limite d’utilisation du lot ou du lot de fabrication de l’ingrédient actif.
- DORS/82-524, art. 3
- DORS/92-654, art. 7
- DORS/97-12, art. 18
- DORS/2010-95, art. 7
- DORS/2013-74, art. 11
C.02.024 (1) Le manufacturier, l’emballeur-étiqueteur, le distributeur visé à l’article C.01A.003, l’importateur et le grossiste doivent :
a) tenir des dossiers sur les résultats du programme d’auto-inspection exigé à l’article C.02.012 et les mesures prises relativement à ce programme; et
b) conserver ces dossiers pendant au moins trois ans.
(2) La personne qui manufacture ou emballe-étiquette une drogue doit
a) tenir des dossiers sur l’application du programme d’hygiène exigé à l’article C.02.007; et
b) conserver ces dossiers pendant au moins trois ans.
- DORS/82-524, art. 3
- DORS/97-12, art. 19 et 53
C.02.024.1 Le distributeur d’un ingrédient actif visé à l’alinéa C.01A.003a) et le manufacturier, l’emballeur-étiqueteur, le grossiste et l’importateur d’un ingrédient actif inscrivent ce qui suit dans la documentation qui accompagne l’ingrédient actif, et ce, immédiatement après les renseignements de cette nature que toute autre personne y a déjà inscrits, le cas échéant :
a) le numéro de sa licence d’établissement, s’il y a lieu, ou ses nom, adresse, numéro de téléphone ainsi que son numéro de télécopieur et son adresse électronique;
b) le fait qu’il a manufacturé, emballé-étiqueté, distribué, vendu en gros ou importé l’ingrédient actif, selon le cas, et la date à laquelle il a accompli cette activité;
c) la date limite d’utilisation;
d) le numéro de lot.
- DORS/2013-74, art. 12
Échantillons
C.02.025 (1) Sauf disposition contraire dans leur licence d’établissement, le distributeur visé à l’alinéa C.01A.003b) et l’importateur d’une drogue sous forme posologique conservent au Canada un échantillon de chaque lot ou lot de fabrication de la drogue emballée-étiquetée, et ce, pendant un an après la date limite d’utilisation de la drogue.
(2) Sous réserve du paragraphe (4), le manufacturier d’une drogue sous forme posologique conserve un échantillon de tout lot ou lot de fabrication des matières premières utilisées pour manufacturer la drogue, et ce, pendant deux ans après la dernière date d’utilisation de ces matières pour manufacturer la drogue, à moins que sa licence d’établissement ne prévoie une autre période.
(3) Sous réserve du paragraphe (4), le manufacturier d’un ingrédient actif conserve les échantillons de chaque lot ou lot de fabrication pendant celle des périodes ci-après qui s’applique, à moins que l’intéressé ne détienne une licence d’établissement qui prévoit une autre période :
a) dans le cas d’un ingrédient actif ayant une date de nouvelle analyse, trois ans après la distribution complète du lot ou du lot de fabrication;
b) dans les autres cas, un an après la date limite d’utilisation du lot ou du lot de fabrication.
(4) Si le manufacturier doit conserver les échantillons à l’égard d’un même ingrédient actif aux termes des paragraphes (2) et (3), il les conserve pour la plus longue période applicable.
- DORS/82-524, art. 3
- DORS/89-174, art. 4
- DORS/92-654, art. 8
- DORS/97-12, art. 20
- DORS/2013-74, art. 13
- DORS/2021-46, art. 8
C.02.026 Les échantillons visés à l’article C.02.025 doivent être en quantité suffisante pour permettre de déterminer si la drogue ou les matières premières sont conformes à leurs spécifications respectives.
- DORS/82-524, art. 3
Stabilité
C.02.027 (1) Le distributeur visé à l’alinéa C.01A.003b) et l’importateur d’une drogue sous forme posologique déterminent la période durant laquelle la drogue demeurera conforme à ses spécifications dans l’emballage dans lequel elle est mise en vente.
(2) Le manufacturier et l’importateur d’un ingrédient actif déterminent la période durant laquelle la drogue demeurera conforme à ses spécifications dans l’emballage dans lequel elle est mise en vente.
- DORS/82-524, art. 3
- DORS/97-12, art. 58
- DORS/2013-74, art. 14
C.02.028 (1) Le distributeur visé à l’alinéa C.01A.003b) et l’importateur d’une drogue sous forme posologique surveillent, dans le cadre d’un programme permanent, la stabilité de la drogue dans l’emballage dans lequel elle est mise en vente.
(2) Le manufacturier et l’importateur d’un ingrédient actif surveillent, dans le cadre d’un programme permanent, la stabilité de la drogue dans l’emballage dans lequel elle est mise en vente.
- DORS/82-524, art. 3
- DORS/97-12, art. 58
- DORS/2013-74, art. 14
Produits stériles
C.02.029 Une drogue devant être stérile doit, outre les exigences énoncées dans le présent titre, être manufacturée et emballée-étiquetée :
a) dans des locaux distincts et clos;
b) sous la surveillance d’un personnel ayant reçu une formation en microbiologie; et
c) selon une méthode scientifiquement reconnue pour en assurer la stérilité.
- DORS/82-524, art. 3
- DORS/97-12, art. 21
Gaz médicaux
C.02.030 Les articles C.02.025, C.02.027 et C.02.028 ne s’appliquent pas aux gaz médicaux.
- DORS/85-754, art. 3
TITRE 3
Drogues de l’annexe C
C.03.001 Dans le présent titre,
- drogue
drogue Toute drogue sous forme posologique visée à l’annexe C de la Loi ou tout ingrédient actif d’origine biologique pouvant être utilisé dans la préparation d’une drogue visée à cette annexe. (drug)
- fabricant
fabricant[Abrogée, DORS/97-12, art. 22]
- générateur de radionucléide
générateur de radionucléide désigne un dispositif contenant un élément mère radioactif et un élément de filiation,
a) absorbés sur une colonne échangeuse d’ions, ou
b) dissous dans un solvant approprié dans un appareil d’extraction liquide-liquide,
où l’élément de filiation est séparé de l’élément mère,
c) par élution sur la colonne échangeuse d’ions, ou
d) par extraction au solvant; (radionuclide generator)
- licence
licence ou licence canadienne[Abrogée, DORS/97-12, art. 22]
- maître-lot
maître-lot désigne une certaine quantité d’une drogue, servant, par dilution ou mélange subséquents, à préparer un lot pour la vente. (master lot)
- DORS/97-12, art. 22
- DORS/2013-74, art. 15
C.03.001.1 Nul distributeur visé à l’alinéa C.01A.003b) ou importateur ne peut vendre une drogue, sauf si elle a été manufacturée, emballée-étiquetée, analysée et entreposée conformément au présent titre.
- DORS/97-12, art. 23
C.03.002 à C.03.005 [Abrogés, DORS/97-12, art. 24]
C.03.006 [Abrogé, DORS/97-12, art. 67]
C.03.007 à C.03.011 [Abrogés, DORS/97-12, art. 26]
C.03.012 À la demande écrite du ministre, le manufacturier, l’emballeur-étiqueteur, l’analyste, le distributeur visé à l’alinéa C.01A.003b) et l’importateur d’une drogue doivent soumettre les protocoles des essais en même temps que des échantillons de tout lot ou maître-lot de drogue avant sa vente, et il est interdit de vendre tout lot dont le protocole ou l’échantillon ne satisfait pas aux exigences du présent règlement.
- DORS/97-12, art. 27
- DORS/2018-69, art. 27
C.03.013 Il est interdit de manufacturer ou d’importer une drogue provenant d’un tissu animal, à moins que celui-ci ne provienne d’un animal sain et exempt de maladies contagieuses.
- DORS/97-12, art. 27
C.03.014 (1) L’article C.01.004 ne s’applique pas à une drogue.
(2) et (3) [Abrogés, DORS/97-12, art. 28]
- DORS/79-236, art. 1
- DORS/93-202, art. 15
- DORS/97-12, art. 28
C.03.015 (1) L’emballage d’une drogue qui est une drogue sur ordonnance doit porter le symbole « Pr » dans le quart supérieur gauche de l’espace principal des étiquettes intérieure et extérieure ou, dans le cas d’un récipient à dose unique, dans le quart supérieur gauche de l’étiquette extérieure.
(2) Le paragraphe (1) ne s’applique pas à ce qui suit :
a) la drogue vendue à un manufacturier de drogues;
b) la drogue vendue conformément à une ordonnance;
c) le produit pharmaceutique radioactif au sens de l’article C.03.201;
d) le constituant ou la trousse au sens de l’article C.03.205.
- DORS/80-543, art. 9
- DORS/97-12, art. 61
- DORS/2001-181, art. 4
- DORS/2013-122, art. 16
C.03.030 à C.03.045 [Abrogés, DORS/81-335, art. 2]
Produits pharmaceutiques radioactifs
C.03.201 Dans le présent règlement, produit pharmaceutique radioactif s’entend d’une drogue qui se caractérise par la désintégration spontanée du noyau instable accompagnée de l’émission de particules nucléaires ou de photons.
- DORS/97-12, art. 29
C.03.202 (1) L’emballage d’un produit pharmaceutique radioactif, sauf s’il s’agit d’un générateur de radionucléide, doit porter,
a) sur les étiquettes intérieure et extérieure,
(i) le nom propre de la drogue, immédiatement avant ou après la marque nominative, le cas échéant,
(ii) le nom du distributeur visé à l’alinéa C.01A.003b),
(iii) le numéro de lot,
(iv) l’identification numérique attribuée au produit pharmaceutique radioactif, précédée de la mention « Drogue : identification numérique » ou de la mention « Drug Identification Number », ou des deux, ou de l’abréviation « DIN »;
b) sur l’étiquette extérieure
(i) l’adresse du distributeur visé à l’alinéa C.01A.003b),
(ii) la norme à laquelle est censée répondre la drogue, s’il est fait mention de cette norme dans une publication mentionnée à l’annexe B de la Loi,
(iii) la mention de la forme pharmaceutique ou de la voie d’administration de la drogue,
(iv) la mention de l’emploi recommandé et de la radioactivité qu’il est recommandé d’administrer pour ledit emploi, ou une indication renvoyant à la notice d’accompagnement où figurent les mêmes renseignements,
(v) [Abrogé, DORS/2017-259, art. 16]
(vi) le symbole de mise en garde contre les rayonnements figurant à l’annexe 3 du Règlement sur la radioprotection et la mention « RAYONNEMENT — DANGER — RADIATION »,
(vii) les noms et les quantités de tout agent de conservation ou agent stabilisant que contient la drogue,
(viii) les noms et les quantités de tous les autres ingrédients non radioactifs de la drogue,
(ix) une déclaration de la teneur totale de la drogue en radioactivité, y compris celle de l’excédent de remplissage,
(x) une déclaration du volume total de la drogue, y compris l’excédent de remplissage, sauf si le contenu est entièrement sous forme gazeuse, sous forme de capsule ou sous forme lyophilisée,
(xi) une déclaration de la concentration de substance radioactive qui contient la drogue exprimée
(A) en unités de radioactivité par capsule, ou
(B) en unités de radioactivité par volume d’unité,
sauf si le contenu est entièrement sous forme gazeuse ou sous forme lyophilisée,
(xii) une déclaration de l’activité spécifique de la drogue, exprimée en unités de radioactivité par poids d’unité d’entraîneur présent ou, selon le cas, la mention « sans entraîneur » ou « carrier-free »,
(xiii) la mention de la période de référence à laquelle les valeurs de la radioactivité précisées aux sous-alinéas (ix), (xi) et (xii) du présent article peuvent s’appliquer (le nom du mois doit être écrit en toutes lettres ou abrégé en lettres),
(xiv) la mention de la vie utile recommandée ou la date après laquelle l’emploi de la drogue est déconseillé (le mois étant inscrit ou indiqué en abrégé), et
(xv) la mention des conditions de conservation particulières à respecter, avec indication de la température et de la lumière.
(2) Le sous-alinéa (1)a)(iv) ne s’applique pas au produit pharmaceutique radioactif qui remplit l’une des conditions suivantes :
a) il est préparé par un pharmacien, conformément à une ordonnance, ou par un praticien;
b) il est vendu conformément à une ordonnance et son étiquette indique :
(i) son nom propre, son nom usuel ou sa marque nominative,
(ii) son activité,
(iii) le nom de son fabricant.
(3) Le sous-alinéa (1)b)(viii) du présent article, ne s’applique pas lorsque les renseignements mentionnés dans ledit sous-alinéa figurent sur la notice d’accompagnement de la drogue.
(4) L’article C.01.005 ne s’applique pas aux produits pharmaceutiques radioactifs.
- DORS/79-236, art. 2
- DORS/93-202, art. 16
- DORS/97-12, art. 54, 58 et 62
- DORS/2001-203, art. 2
- DORS/2012-129, art. 2
- DORS/2017-259, art. 16
- DORS/2018-69, art. 35(F)
C.03.203 (1) Un générateur de radionucléide porte sur son étiquette intérieure, à la fois :
a) le nom propre du générateur de radionucléide, immédiatement avant ou après la marque nominative, le cas échéant;
b) le nom et l’adresse du distributeur visé à l’alinéa C.01A.003b);
c) le numéro du lot;
d) la norme à laquelle le générateur de radionucléide semble se conformer si cette norme est mentionnée dans une publication visée à l’annexe B de la Loi;
e) l’identification numérique attribuée au générateur de radionucléide, précédée de la mention « Drogue : identification numérique » ou de la mention « Drug Identification Number », ou des deux, ou de l’abréviation « DIN »;
f) le symbole de mise en garde contre les rayonnements figurant à l’annexe 3 du Règlement sur la radioprotection et la mention « RAYONNEMENT — DANGER — RADIATION »;
g) la mention de la totalité de la radioactivité mère contenue dans le générateur de radionucléide;
h) la mention de l’heure et la date de validité de la radioactivité visée à l’alinéa g) (le mois étant inscrit ou indiqué en abrégé);
i) la mention de la vie utile recommandée ou de la date après laquelle l’utilisation du générateur de radionucléide est déconseillée (le mois étant inscrit ou indiqué en abrégé);
j) la mention de la vie utile recommandée de la drogue après son extraction du générateur de radionucléide;
k) la mention des exigences particulières de température ou de blindage en entrepôt;
l) le mode d’emploi complet ou le renvoi à une notice d’accompagnement qui indique ces renseignements;
m) une mise en garde contre le démontage du générateur de radionucléide.
(2) Les alinéas (1)i) et j) du présent article ne s’appliquent pas lorsque les renseignements qu’ils exigent apparaissent sur une notice d’accompagnement d’un générateur de radionucléide.
(3) L’article C.01.005 ne s’applique pas aux générateurs de radionucléide.
- DORS/79-236, art. 3
- DORS/93-202, art. 17
- DORS/97-12, art. 54, 58 et 62
- DORS/2012-129, art. 3
- DORS/2017-259, art. 17
- DORS/2018-69, art. 21(F) et 22(F)
C.03.204 (1) Il est interdit de vendre une drogue contenant, à un moment de sa vie utile, du technétium-99m si elle contient aussi une impureté radionucléique figurant dans la monographie sur l’injection de Sodium pertechnétate Tc-99m mentionnée dans la publication visée à l’article 8 de l’annexe B de la Loi, en une quantité plus grande que celle figurant dans cette monographie.
(2) Il est interdit de vendre un générateur de radionucléides dont il est possible d’extraire une drogue contenant, à un moment de sa vie utile, du technétium-99m, si cette drogue contient aussi une impureté radionucléique figurant dans la monographie sur l’injection de Sodium pertechnétate Tc-99m mentionnée dans la publication visée à l’article 8 de l’annexe B de la Loi, en une quantité plus grande que celle figurant dans cette monographie.
- DORS/97-12, art. 30
- DORS/2012-129, art. 4
Drogues, autres que les radionucléides, vendues pour être employées dans la préparation de produits pharmaceutiques radioactifs ou représentées comme pouvant servir à cette fin
- DORS/2017-259, art. 18(F)
C.03.205 Les définitions qui suivent s’appliquent au présent article et aux articles C.03.206 à C.03.209.
- constituant
constituant S’entend :
a) soit d’une unité d’une drogue, autre qu’un radionucléide, emballée séparément dans une trousse;
b) soit d’une fiole vide ou d’un autre article accessoire dans une trousse. (component)
- trousse
trousse Emballage destiné à la préparation de produits pharmaceutiques radioactifs qui :
a) contient une ou plusieurs unités d’une drogue, autre qu’un radionucléide, emballées séparément;
b) peut contenir des fioles vides ou d’autres articles accessoires. (kit)
- DORS/79-236, art. 4
- DORS/2017-259, art. 19
C.03.206 Les articles C.01.005 et C.04.019 ne s’appliquent à aucun constituant ou trousse.
- DORS/79-236, art. 4
C.03.207 (1) L’étiquette devant être apposée sur un constituant doit comprendre
a) son identification adéquate et une description adéquate de sa fonction;
b) le cas échéant, une liste quantitative de ses ingrédients ou un renvoi à l’étiquette de la trousse pour de tels renseignements;
c) le nom du distributeur visé à l’alinéa C.01A.003b);
d) le numéro de lot;
e) une déclaration des exigences spéciales d’entreposage quant à la température et la lumière;
f) la date après laquelle le constituant n’est pas recommandé pour usage, le mois étant inscrit au long ou indiqué en abrégé; et
g) le mode d’emploi approprié ou le renvoi à une notice d’accompagnement.
(2) L’étiquette devant être apposée sur le constituant d’une trousse destiné à contenir le produit pharmaceutique radioactif préparé indique l’identification numérique attribuée à la trousse, précédée de la mention « Drogue : identification numérique » ou de la mention « Drug Identification Number », ou des deux, ou de l’abréviation « DIN ».
- DORS/79-236, art. 4
- DORS/97-12, art. 58
- DORS/2017-259, art. 20
- DORS/2018-69, art. 23(F)
C.03.208 Chaque trousse doit être étiquetée pour montrer :
a) son nom propre;
b) la marque nominative de celle-ci, le cas échéant;
c) une liste de son contenu;
d) le nom et l’adresse de son distributeur visé à l’alinéa C.01A.003b);
e) l’identification numérique attribuée à la trousse, précédée de la mention « Drogue : identification numérique » ou de la mention « Drug Identification Number », ou des deux, ou de l’abréviation « DIN »;
f) son numéro de lot;
g) une déclaration des exigences spéciales d’entreposage quant à la température et la lumière;
h) la date après laquelle la trousse n’est pas recommandée pour usage, le mois étant inscrit au long ou indiqué en abrégé;
i) une liste quantitative des ingrédients d’un constituant lorsque l’étiquette de ce constituant renvoie à l’étiquette d’une trousse qui porte des renseignements concernant ses ingrédients;
j) une déclaration de la stérilité et de l’apyrogénicité des composants;
k) le mode d’emploi approprié pour la préparation de produits pharmaceutiques radioactifs ou le renvoi, pour ces renseignements, à une notice d’accompagnement;
l) une déclaration de la vie utile du produit pharmaceutique radioactif préparé;
m) les conditions de conservation recommandées pour le produit pharmaceutique radioactif préparé;
n) l’usage recommandé pour le produit pharmaceutique radioactif préparé et la dose de radioactivité recommandée pour cet usage ou le renvoi, pour ces renseignements, à une notice d’accompagnement;
o) la voie d’administration prévue pour le produit pharmaceutique radioactif préparé.
p) [Abrogé, DORS/2001-203, art. 3]
- DORS/79-236, art. 4
- DORS/93-202, art. 18
- DORS/97-12, art. 58 et 62
- DORS/2001-203, art. 3
- DORS/2017-259, art. 21
- DORS/2018-69, art. 36(F)
C.03.209 Chaque trousse doit contenir une notice d’accompagnement qui doit indiquer,
a) le nom propre et la marque nominative, le cas échéant, de la trousse et une description de son usage;
b) une liste de son contenu;
c) le nom et l’adresse de son distributeur visé à l’alinéa C.01A.003b);
d) l’identification des sources de radionucléides qui peuvent être utilisées pour préparer le produit pharmaceutique radioactif;
e) le mode de préparation du produit pharmaceutique radioactif et les conditions de sa conservation une fois préparé;
f) une déclaration de la durée de la vie utile du produit pharmaceutique radioactif préparé;
g) une description des effets biologiques du produit pharmaceutique radioactif préparé;
h) les indications et contre-indications du produit pharmaceutique radioactif préparé;
i) les mises en garde et les précautions relatives aux constituants et au produit pharmaceutique radioactif préparé;
j) les effets nocifs, liés, le cas échéant, au produit pharmaceutique radioactif préparé;
k) lorsqu’il y a lieu, la pharmacologie et la toxicologie du produit pharmaceutique radioactif préparé ou une mention indiquant que ces renseignements sont disponibles sur demande;
l) la dosimétrie des rayonnements pour le produit pharmaceutique radioactif préparé;
m) une déclaration de l’usage recommandé pour le produit pharmaceutique radioactif recommandée pour cet usage;
n) une déclaration de la voie d’administration prévue pour le produit pharmaceutique radioactif préparé; et
o) une recommandation selon laquelle la pureté radiochimique et la teneur radioactive du produit pharmaceutique radioactif préparé doivent être vérifiées avant l’administration.
- DORS/79-236, art. 4
- DORS/93-202, art. 19
- DORS/97-12, art. 58
- DORS/2018-69, art. 36(F)
Produits pharmaceutiques radioactifs émetteurs de positrons
Définitions
C.03.301 Les définitions qui suivent s’appliquent au présent article et aux articles C.03.302 à C.03.319.
- autre personne
autre personne Tout individu qui entre en contact physique avec un sujet de l’étude. (other person)
- bonnes pratiques cliniques
bonnes pratiques cliniques Pratiques cliniques généralement reconnues visant à protéger les droits, la sécurité et le bien-être des sujets de l’étude et de toute autre personne. (good clinical practices)
- chercheur qualifié
chercheur qualifié Médecin, membre en règle d’une association médicale canadienne, chargé par le promoteur de veiller au bon déroulement d’une étude dans un lieu d’étude donné et autorisé à exercer sa profession par les lois de la province où se trouve ce lieu. (qualified investigator)
- comité d’éthique de la recherche
comité d’éthique de la recherche S’entend au sens de l’article C.03.306. (research ethics board)
- drogue destinée à l’étude
drogue destinée à l’étude Produit pharmaceutique radioactif émetteur de positrons qui est utilisé dans le cadre d’une étude. (study drug)
- étude
étude Étude de recherche clinique fondamentale portant sur des sujets humains et visée aux articles C.03.304 et C.03.305. (study)
- importer
importer S’agissant d’une drogue destinée à l’étude, l’importer au Canada en vue d’en faire la vente pour une étude. (import)
- lieu d’étude
lieu d’étude Lieu où se déroule, en tout ou en partie, une étude. (study site)
- promoteur
promoteur Personne qui est responsable de la conduite d’une étude. (sponsor)
- protocole
protocole Document qui expose les objectifs, le plan de travail, la méthodologie, les considérations statistiques et l’organisation de l’étude. (protocol)
- réaction indésirable
réaction indésirable Réaction négative et non voulue à une drogue destinée à l’étude par un sujet à l’étude ou autre personne qui est provoquée par l’administration de la drogue, quelle qu’en soit la dose. (adverse reaction)
- réaction indésirable grave
réaction indésirable grave Réaction indésirable qui entraîne l’une des conséquences ci-après pour un sujet de l’étude ou une autre personne :
a) son hospitalisation ou la prolongation de celle-ci;
b) une malformation congénitale;
c) une incapacité importante ou persistante;
d) la mise en danger de sa vie;
e) sa mort. (serious adverse reaction)
- réaction indésirable grave et imprévue
réaction indésirable grave et imprévue Réaction indésirable grave dont la nature, la sévérité ou la fréquence ne sont pas mentionnées dans les renseignements sur les risques qui figurent sur l’étiquette d’une drogue destinée à l’étude. (serious unexpected adverse reaction)
- DORS/2012-129, art. 5
Champ d’application
C.03.302 (1) Les articles C.03.303 à C.03.319 s’appliquent à la vente et à l’importation de drogues destinées à l’étude.
(2) Les articles C.03.001 à C.03.209 et les titres 5 et 8 ne s’appliquent pas aux drogues destinées à l’étude.
(3) Les articles C.03.303 à C.03.319 ne s’appliquent pas aux drogues destinées à l’étude qui sont fabriquées à partir d’un produit intermédiaire en vrac d’origine biologique.
- DORS/2012-129, art. 5
Interdiction
C.03.303 Il est interdit de vendre ou d’importer une drogue destinée à l’étude à moins que les conditions suivantes ne soient réunies :
a) la drogue est destinée exclusivement à une étude;
b) la drogue a déjà fait l’objet d’un essai sur des sujets humains et son profil d’innocuité a été établi à l’égard de l’humain;
c) si la drogue doit être importée, le fabricant de celle-ci a un représentant au Canada qui sera responsable de sa vente;
d) le promoteur est autorisé à le faire en vertu de l’article C.03.309;
e) le promoteur se conforme aux articles C.03.310 à C.03.316.
- DORS/2012-129, art. 5
Objet de l’étude
C.03.304 (1) L’étude a pour objet l’obtention de données, selon le cas :
a) sur la pharmacocinétique ou le métabolisme de la drogue destinée à l’étude;
b) sur la biochimie ou la physiologie normales de l’être humain;
c) sur l’incidence du vieillissement, de la maladie ou de traitements médicaux sur la biochimie ou la physiologie de l’être humain.
(2) Il est entendu que l’étude n’a pas pour objet premier :
a) la découverte, la détermination ou la vérification des effets pharmacodynamiques de la drogue destinée à l’étude;
b) la détermination des réactions indésirables;
c) la réalisation d’un objectif thérapeutique ou diagnostique immédiat;
d) l’établissement de l’innocuité ou de l’efficacité de la drogue destinée à l’étude.
- DORS/2012-129, art. 5
Exigences
C.03.305 (1) L’étude satisfait aux critères suivants :
a) elle est réalisée à partir d’une drogue destinée à l’étude dont l’innocuité a été établie à l’égard de l’humain — sur la base de données suffisantes, obtenues dans le cadre d’essais effectués sur des animaux et des êtres humains — avant son utilisation dans le cadre de l’étude;
b) il a été établi que la quantité ou la combinaison des ingrédients actifs de la drogue destinée à l’étude ne provoquent chez les êtres humains aucun effet pharmacodynamique qui puisse être détecté sur le plan clinique;
c) la dose annuelle totale de rayonnement que recevra chaque sujet, notamment par suite de multiples administrations de la drogue destinée à l’étude, de l’exposition à des impuretés ou à des contaminants importants ou du recours à d’autres procédés pour les besoins de l’étude, ne dépassera pas 50 mSv;
d) le cas échéant, toute drogue utilisée de façon concomitante dans le cadre de l’étude s’est vu attribuer une identification numérique aux termes du paragraphe C.01.014.2(1) ou, s’agissant d’une drogue nouvelle, s’est vu délivrer un avis de conformité aux termes de l’article C.08.004;
e) les sujets de l’étude ont au moins dix-huit ans et possèdent la capacité juridique au moment de l’étude;
f) chaque sujet d’étude féminin :
(i) a passé un test de grossesse confirmant qu’elle n’est pas enceinte au moment où commence l’étude ou a fourni une déclaration écrite confirmant ce fait,
(ii) est avisée, si elle allaite au moment de l’étude, de suspendre l’allaitement pendant vingt-quatre heures après l’administration de la drogue;
g) l’étude porte sur au plus trente sujets.
(2) Malgré l’alinéa (1)g), l’étude peut porter sur plus de trente sujets d’étude si le promoteur fournit au ministre les motifs scientifiques justifiant cette augmentation et que ce dernier l’approuve.
- DORS/2012-129, art. 5
Comité d’éthique de la recherche
C.03.306 Le comité d’éthique de la recherche a les caractéristiques suivantes :
a) son principal mandat est d’approuver la tenue de projets de recherche biomédicale sur des sujets humains et d’en contrôler périodiquement le déroulement afin de veiller à la protection des droits de ces derniers, ainsi qu’à leur sécurité et leur bien-être;
b) il est composé d’au moins cinq membres, hommes et femmes dont la majorité sont des citoyens canadiens ou des résidents permanents au sens de la Loi sur l’immigration et la protection des réfugiés et dont au moins :
(i) deux membres possèdent de l’expertise et de l’expérience principalement dans un domaine scientifique ainsi qu’une vaste expérience des méthodes et champs de recherche à approuver, l’un d’entre eux provenant d’une discipline des soins médicaux,
(ii) un membre possède des connaissances en matière d’éthique,
(iii) un membre connaît la législation canadienne applicable à la recherche à approuver,
(iv) un membre possède de l’expertise et de l’expérience principalement dans un domaine non scientifique,
(v) un membre est issu de la collectivité ou représente un organisme intéressé aux champs de recherche en cause, mais n’est lié ni au promoteur, ni au lieu d’étude;
c) il n’a, avec le promoteur, aucun lien susceptible de compromettre sa capacité de réaliser son principal mandat, ou d’être perçu comme pouvant la compromettre.
- DORS/2012-129, art. 5
Demande d’autorisation
C.03.307 (1) Le promoteur présente au ministre une demande d’autorisation pour la vente ou l’importation d’une drogue destinée à l’étude qui contient les renseignements et documents visés au paragraphe (2) ainsi que ceux nécessaires pour démontrer que les critères suivants sont remplis :
a) l’utilisation de la drogue destinée à l’étude ne mettra pas en danger la santé d’un sujet de l’étude ni celle d’une autre personne;
b) l’étude n’ira pas à l’encontre des intérêts des sujets de l’étude;
c) les objectifs de l’étude sont raisonnablement réalisables.
(2) La demande d’autorisation contient les renseignements et documents suivants :
a) le titre de l’étude et le code ou l’identification du protocole;
b) l’objectif et une brève description de l’étude;
c) le nombre de sujets de l’étude;
d) la marque nominative de la drogue destinée à l’étude, s’il y a lieu;
e) le nom chimique ou générique des ingrédients actifs de la drogue destinée à l’étude;
f) la liste qualitative des ingrédients non actifs de la drogue destinée à l’étude;
g) la masse maximale de la drogue destinée à l’étude qui sera administrée à chaque sujet de l’étude;
h) l’amplitude de la dose radioactive de la drogue destinée à l’étude, exprimée en MBq ou en mCi;
i) la dose efficace ou l’équivalent de dose efficace de la drogue destinée à l’étude, exprimés en mSv/MBq ou en rem/mCi;
j) les nom et adresse municipale du promoteur, son adresse postale si elle est différente, ainsi que ses numéro de téléphone, numéro de télécopieur et adresse électronique;
k) les nom et adresse municipale du fabricant, son adresse postale si elle est différente, ainsi que ses numéro de téléphone, numéro de télécopieur et adresse électronique;
l) dans le cas d’une demande d’importation, les nom et adresse municipale, l’adresse postale si elle est différente, ainsi que les numéro de téléphone, numéro de télécopieur et adresse électronique du représentant du fabricant au Canada qui est responsable de la vente de la drogue destinée à l’étude;
m) les nom et adresse municipale de chaque lieu d’étude;
n) pour chaque lieu d’étude, les nom, adresse municipale, numéro de téléphone, numéro de télécopieur et adresse électronique du chercheur qualifié;
o) la date projetée du début de l’étude dans chaque lieu d’étude, si elle est connue;
p) pour chaque lieu d’étude, les nom, adresse, numéro de téléphone, numéro de télécopieur et adresse électronique du comité d’éthique de la recherche;
q) une attestation, signée et datée par le comité d’éthique de la recherche de chaque lieu d’étude, portant qu’il a examiné et approuvé l’étude, le protocole et l’exposé des risques et des bénéfices escomptés pour la santé des sujets de l’étude résultant de leur participation à celle-ci qui sont indiqués dans la formule de consentement éclairé;
r) une liste des demandes d’autorisation, présentées antérieurement, pour la vente ou l’importation d’une drogue destinée à des études liées à l’étude faisant l’objet de la demande;
s) une attestation, signée et datée par le directeur médical ou scientifique du promoteur au Canada et par le premier dirigeant de celui-ci, portant que :
(i) l’étude sera menée conformément au présent règlement,
(ii) les renseignements et documents contenus dans la demande d’autorisation ou auxquels celle-ci renvoie sont exacts, complets et ne sont ni faux ni trompeurs.
- DORS/2012-129, art. 5
Renseignements et documents complémentaires
C.03.308 Si les renseignements et documents fournis aux termes de l’article C.03.307 ne sont pas suffisants pour lui permettre de décider si la vente ou l’importation de la drogue destinée à l’étude doit être autorisée, le ministre peut, dans un avis écrit, demander au promoteur qu’il lui fournisse, au plus tard à la date qui y est précisée, les renseignements ou documents complémentaires concernant la drogue destinée à l’étude, l’étude elle-même ou le protocole dont il a besoin pour rendre sa décision.
- DORS/2012-129, art. 5
Autorisation
C.03.309 Après avoir examiné la demande et, le cas échéant, tout renseignement ou document complémentaire, le ministre autorise le promoteur à vendre ou à importer la drogue destinée à l’étude s’il conclut que la demande est conforme aux exigences de l’article C.03.307; il lui envoie un avis l’informant de sa décision et précisant les lieux d’étude à l’égard desquels la vente ou l’importation est autorisée.
- DORS/2012-129, art. 5
Avis
C.03.310 Au plus tard quinze jours avant d’entreprendre, à l’égard d’un lieu d’étude donné, la vente ou l’importation de la drogue destinée à l’étude, le promoteur en avise par écrit le ministre.
- DORS/2012-129, art. 5
Bonnes pratiques cliniques
C.03.311 Le promoteur veille à ce que l’étude soit menée conformément aux bonnes pratiques cliniques et à ce que :
a) l’étude soit fondée sur le plan scientifique et clairement décrite dans son protocole;
b) l’étude soit menée et la drogue destinée à l’étude soit utilisée en conformité avec le protocole de l’étude et le présent règlement;
c) des systèmes et des procédures visant à assurer la qualité de tous les aspects de l’étude soient mis en place;
d) il n’y ait qu’un chercheur qualifié par lieu d’étude;
e) dans chaque lieu d’étude, les soins médicaux et les décisions médicales se rapportant à l’étude relèvent du chercheur qualifié;
f) chaque individu collaborant à la conduite de l’étude soit qualifié par ses études, sa formation et son expérience pour accomplir les tâches qui lui sont confiées;
g) avant qu’un sujet d’étude ne participe à l’étude, une copie signée de sa formule de consentement soit mise dans les registres tenus pour l’étude;
h) les exigences relatives aux renseignements et registres prévues à l’article C.03.315 soient respectées;
i) la drogue destinée à l’étude soit fabriquée, manutentionnée et entreposée conformément au titre 2, à l’exception des articles C.02.019, C.02.025 et C.02.026.
- DORS/2012-129, art. 5
Étiquetage
C.03.312 Malgré les autres dispositions du présent règlement relatives à l’étiquetage, le promoteur veille à ce que les renseignements ci-après figurent :
a) sur l’étiquette intérieure de la drogue destinée à l’étude :
(i) son numéro de lot de fabrication unique,
(ii) le symbole de mise en garde contre les rayonnements figurant à l’annexe 3 du Règlement sur la radioprotection et la mention « RAYONNEMENT — DANGER — RADIATION »;
b) dans la notice d’accompagnement de la drogue destinée à l’étude :
(i) une mention indiquant qu’elle ne peut être utilisée que sous la surveillance d’un chercheur qualifié,
(ii) le nom chimique ou générique de ses ingrédients actifs,
(iii) les nom et adresse municipale du fabricant,
(iv) les nom et adresse municipale du promoteur,
(v) le code ou l’identification du protocole,
(vi) les mises en garde et précautions relatives à son utilisation,
(vii) la liste des réactions indésirables possibles liées à son utilisation.
- DORS/2012-129, art. 5
- DORS/2018-69, art. 24(F)
- DORS/2021-46, art. 9(F)
Présentation de renseignements et documents
C.03.313 (1) Le promoteur fournit au ministre, dans le délai précisé, tout renseignement ou document afin d’établir l’innocuité de la drogue destinée à l’étude si ce dernier lui en fait la demande par écrit alors qu’il a des raisons de croire, selon le cas :
a) que l’utilisation de la drogue destinée à l’étude met en danger la santé de tout sujet de l’étude ou celle de toute autre personne;
b) que l’étude va à l’encontre des intérêts de ses sujets;
c) qu’un chercheur qualifié ne respecte pas l’engagement visé à l’alinéa C.03.315(3)f);
d) qu’un renseignement fourni sur la drogue destinée à l’étude ou sur l’étude, selon le cas, est faux ou trompeur.
(2) Le ministre peut, dans un avis écrit, exiger du promoteur qu’il lui fournisse, au plus tard à la date qui y est précisée, tout registre ou renseignement visé au paragraphe C.03.315(3), afin d’évaluer l’innocuité de la drogue destinée à l’étude ou la santé des sujets de l’étude ou celle de toute autre personne.
- DORS/2012-129, art. 5
Rapport sur des réactions indésirables
C.03.314 (1) Au cours de l’étude, le promoteur informe le ministre, dans le délai ci-après, de toute réaction indésirable grave ou de toute réaction indésirable grave et imprévue, que la réaction se soit produite au Canada ou à l’étranger :
a) dans les sept jours suivant le moment où il en prend connaissance, lorsque cette réaction entraîne la mort ou met la vie en danger;
b) dans les quinze jours suivant le moment où il en prend connaissance, lorsque cette réaction n’entraîne pas la mort ni ne met la vie en danger.
(2) Dans les huit jours suivant la communication de tout renseignement au titre du paragraphe (1), le promoteur remet au ministre un rapport exhaustif à ce sujet, qui comprend une analyse de l’importance et des répercussions des constatations.
(3) Les articles C.01.016 à C.01.020 ne s’appliquent pas aux drogues destinées à une étude.
- DORS/2012-129, art. 5
Registres
C.03.315 (1) Le promoteur consigne dans des registres, traite et conserve les renseignements relatifs à l’étude de façon à permettre la présentation de rapports complets et exacts sur ceux-ci ainsi que leur interprétation et leur vérification.
(2) Le promoteur tient des registres complets et précis afin de démontrer que l’étude est menée conformément au présent règlement.
(3) Le promoteur tient, pour chaque étude, des registres sur l’utilisation de la drogue destinée à l’étude qui comprennent :
a) un registre sur toutes les réactions indésirables, qu’elles se soient produites au Canada ou à l’étranger, ainsi que sur les indications d’utilisation et la forme posologique de la drogue destinée à l’étude au moment où ces réactions se sont produites;
b) la procédure écrite à suivre en matière de surveillance des sujets de l’étude ainsi qu’en matière de documentation et de rapports sur les réactions indésirables;
c) les articles de revues scientifiques ou d’autres publications ayant servi à établir le profil d’innocuité de la drogue destinée à l’étude à l’égard de l’humain;
d) les renseignements à l’égard de chaque sujet d’étude y compris son inscription, une copie de sa formule de consentement, signée, ainsi que les renseignements permettant de l’identifier et de le joindre dans le cas où la vente de la drogue destinée à l’étude peut mettre en danger sa santé ou celle d’une autre personne;
e) un registre sur l’expédition, la réception, la vente, le retour et la destruction ou autre forme de disposition de la drogue destinée à l’étude;
f) pour chaque lieu d’étude, un engagement, signé et daté par le chercheur qualifié avant le commencement de l’étude, portant :
(i) qu’il mènera l’étude d’une manière conforme aux bonnes pratiques cliniques,
(ii) qu’en cas de cessation de l’étude par le promoteur pour des motifs de santé ou sécurité, il en informera immédiatement les sujets de l’étude et le comité d’éthique de la recherche, leur en communiquera les motifs et les avisera par écrit des risques possibles pour la santé des sujets de l’étude ou celle de toute autre personne, le cas échéant;
g) pour chaque lieu d’étude, un exemplaire de la formule de consentement éclairé;
h) pour chaque lieu d’étude, une copie de l’attestation visée à l’alinéa C.03.307(2)q), du protocole de l’étude et de l’exposé des risques et des bénéfices escomptés pour la santé des sujets de l’étude résultant de leur participation à celle-ci qui sont indiqués dans la formule de consentement éclairé.
(4) Le promoteur conserve les registres pendant cinq ans suivant la fin de l’étude.
- DORS/2012-129, art. 5
Cessation de l’étude
C.03.316 (1) Dans le cas où le promoteur met fin à l’étude — en totalité ou dans un lieu d’étude donné —, il en avise les chercheurs qualifiés, par écrit, dans les plus brefs délais, et indique dans l’avis les motifs de la cessation et, le cas échéant, les risques que l’étude présente pour la santé des sujets de l’étude ou celle de toute autre personne.
(2) S’il est mis fin à l’étude pour des raisons de santé ou sécurité pouvant affecter des sujets de l’étude ou d’autres personnes, le promoteur en avise le ministre par écrit dans les quinze jours suivant la cessation de l’étude et indique dans l’avis les motifs de la cessation et l’incidence de cette cessation sur ses autres études qui sont prévues ou en cours au Canada relativement à la drogue destinée à l’étude.
- DORS/2012-129, art. 5
Suspension
C.03.317 (1) Le ministre suspend — en totalité ou à l’égard d’un lieu d’étude donné — l’autorisation de vendre ou d’importer la drogue destinée à l’étude dans les cas suivants :
a) l’un des renseignements ou documents fournis en application des articles C.03.307, C.03.308 ou C.03.313 s’avère inexact ou incomplet;
b) le promoteur ne fournit pas, sur demande écrite du ministre en vertu de l’article C.03.313, au plus tard à la date précisée dans celle-ci, de renseignements suffisants pour établir l’innocuité de la drogue destinée à l’étude;
c) le promoteur a omis d’informer le ministre des réactions indésirables visées à l’article C.03.314 ou de lui remettre un rapport à cet effet conformément à cet article;
d) le promoteur a contrevenu à toute disposition du présent règlement ou de la Loi relative à la drogue destinée à l’étude.
(2) Pour décider s’il suspend l’autorisation dans sa totalité ou à l’égard d’un lieu d’étude donné, le ministre vérifie si le motif de la suspension s’applique à l’étude dans sa totalité ou seulement à un lieu d’étude donné.
(3) Avant de suspendre l’autorisation, le ministre envoie au promoteur un préavis qui contient les précisions suivantes :
a) les motifs de la suspension envisagée, si elle vise la totalité de l’autorisation ou uniquement un lieu d’étude donné et sa date de prise d’effet;
b) son obligation de prendre les mesures correctives qui s’imposent, le cas échéant, au plus tard à la date précisée;
c) la possibilité de présenter, dans un délai raisonnable, ses observations écrites à l’égard de la suspension envisagée.
(4) Malgré le paragraphe (3), s’il a des motifs raisonnables de croire que cela est nécessaire pour prévenir un préjudice à l’égard de la santé de tout sujet de l’étude ou celle de toute autre personne, le ministre suspend immédiatement l’autorisation.
(5) Le ministre qui suspend l’autorisation en vertu du paragraphe (4) envoie au promoteur un avis qui contient les précisions suivantes :
a) les motifs de la suspension;
b) son obligation de prendre les mesures correctives qui s’imposent, le cas échéant, au plus tard à la date précisée;
c) la possibilité de présenter, dans un délai raisonnable, ses observations écrites à l’égard de la suspension.
- DORS/2012-129, art. 5
Rétablissement
C.03.318 (1) Sous réserve du paragraphe (2), le ministre rétablit l’autorisation si le promoteur lui fournit, dans le délai ci-après, les éléments de preuve suffisants pour établir que l’étude ne présente pas de risque pour la santé des sujets à l’étude ou celle de toute autre personne :
a) dans le cas de la suspension prévue au paragraphe C.03.317(1), dans les trente jours suivant la date de prise d’effet de la suspension;
b) dans le cas de la suspension prévue au paragraphe C.03.317(4), au plus tard à la date précisée dans l’avis envoyé en vertu du paragraphe C.03.317(5).
(2) Le ministre supprime de l’autorisation toute partie suspendue qu’il ne rétablit pas.
- DORS/2012-129, art. 5
Annulation
C.03.319 (1) Le ministre annule l’autorisation — en totalité ou à l’égard d’un lieu d’étude donné — dans les cas suivants :
a) le promoteur a mis fin à l’étude — en totalité ou à l’égard d’un lieu d’étude donné — en vertu de l’article C.03.316;
b) le promoteur n’a pas fourni au ministre, dans le délai précisé, les preuves exigées aux termes du paragraphe C.03.318(1).
(2) S’il annule l’autorisation en totalité ou à l’égard d’un lieu donné, le ministre envoie au promoteur un avis motivé dans lequel il indique la date de prise d’effet de cette annulation.
- DORS/2012-129, art. 5
TITRE 4
Drogues de l’annexe D
C.04.001 Dans le présent titre,
- date de fabrication
date de fabrication signifie
a) dans le cas d’un produit pour lequel il existe une norme d’activité, la date à laquelle il subit une épreuve satisfaisante d’activité,
b) dans le cas d’un produit animal pour lequel il n’existe pas de norme d’activité, la date de son extraction de l’animal, et
c) dans le cas d’un produit autre qu’un produit animal pour lequel il n’existe pas de norme d’activité, la date de cessation de la croissance; (date of manufacture)
- drogue
drogue Toute drogue sous forme posologique visée à l’annexe D de la Loi ou tout ingrédient actif pouvant être utilisé dans la préparation d’une drogue visée à cette annexe. (drug)
- fabricant
fabricant[Abrogée, DORS/97-12, art. 31]
- licence
licence ou licence canadienne[Abrogée, DORS/97-12, art. 31]
- DORS/97-12, art. 31
- DORS/2013-74, art. 16
C.04.001.1 Nul distributeur visé à l’alinéa C.01A.003b) ou importateur ne peut vendre une drogue, sauf si elle a été manufacturée, emballée-étiquetée, analysée et entreposée conformément au présent titre.
- DORS/97-12, art. 32
C.04.002 Le présent titre ne s’applique pas aux drogues sous forme posologique orale qui renferment des micro-organismes si elles sont recommandées uniquement pour reconstituer, normaliser ou stabiliser la flore intestinale.
- DORS/97-12, art. 33
C.04.003 La date de sortie d’une drogue doit être la date à laquelle le produit fini est retiré du frigorifique, mais ne doit en aucun cas dépasser
a) six mois après la date de fabrication, pour une drogue tenue constamment à une température ne dépassant pas 10 °C;
b) 12 mois après la date de fabrication, pour une drogue tenue constamment à une température ne dépassant pas 5 °C; ou
c) deux ans après la date de fabrication, pour une drogue tenue constamment à une température ne dépassant pas 0 °C.
C.04.004 à C.04.006 [Abrogés, DORS/97-12, art. 34]
C.04.007 [Abrogé, DORS/97-12, art. 67]
C.04.008 à C.04.012 [Abrogés, DORS/97-12, art. 36]
C.04.013 Le manufacturier et l’emballeur-étiqueteur doivent isoler toutes opérations faites avec des micro-organismes sporulés pathogènes et autres agents infectieux dont il est reconnu que la manipulation exige des précautions spéciales, et ils doivent prendre soin de l’outillage et exercer la surveillance nécessaire, de manière à exclure toute possibilité de contamination d’autres drogues.
- DORS/97-12, art. 63
C.04.014 Il est interdit d’utiliser tout procédé de laboratoire de nature diagnostique dans un établissement à moins qu’il ne soit complètement isolé des opérations visant à manufacturer, emballer-étiqueter ou analyser des drogues.
- DORS/97-12, art. 37
C.04.015 À la demande écrite du ministre, le manufacturier, l’emballeur-étiqueteur, l’analyste, le distributeur visé à l’alinéa C.01A.003b) et l’importateur d’une drogue doivent soumettre les protocoles des essais en même temps que les échantillons de tout lot de la drogue avant sa vente, et il est interdit de vendre tout lot dont le protocole ou un échantillon ne satisfait pas aux exigences du présent règlement.
- DORS/97-12, art. 37
- DORS/2018-69, art. 27
C.04.016 Tous les animaux qui servent à la préparation et à la conservation de certaines drogues doivent être :
a) sous la surveillance directe d’un personnel médical ou vétérinaire;
b) tenus en quarantaine par le manufacturier pendant au moins sept jours avant l’usage;
c) sains et exempts de maladie contagieuse.
- DORS/97-12, art. 38
C.04.017 Un manufacturier doit tenir des fiches des autopsies de tous les animaux qui meurent ou sont sacrifiés après avoir servi à la production d’une drogue.
- DORS/97-12, art. 61
C.04.018 Un manufacturier doit immédiatement isoler tout animal reconnu ou soupçonné d’être atteint de stomatite vésiculeuse, de fièvre aphteuse, d’encéphalomyélite, d’anémie infectieuse, de la morve, du charbon, du tétanos, ou de toute autre maladie contagieuse grave, et il doit en faire rapport au ministre.
- DORS/97-12, art. 61
C.04.019 Les dispositions de l’article C.01.004 ne s’appliquent pas à une drogue désignée dans le présent titre, mais tout emballage de ladite drogue doit porter
a) sur les étiquettes intérieure et extérieure,
(i) le nom propre de la drogue, immédiatement avant ou après la marque nominative, le cas échéant, en caractères d’une taille au moins égale à la moitié de celle des caractères de la marque nominative,
(ii) le nom du distributeur visé à l’alinéa C.01A.003b),
(iii) l’activité de la drogue, s’il y a lieu,
(iv) la dose recommandée de ladite drogue,
(v) le numéro du lot,
(vi) la date limite d’utilisation, sauf sur l’étiquette intérieure des récipients à dose unique, et
(vii) des directives appropriées d’emploi; et
b) sur l’étiquette extérieure
(i) l’adresse du distributeur visé à l’alinéa C.01A.003b),
(ii) [Abrogé, DORS/2013-179, art. 3]
(iii) le nom propre ou, à défaut, le nom usuel de tout antiseptique incorporé à la drogue, ainsi que la quantité de celui-ci,
(iv) une mention portant que la drogue doit être conservée à une température d’au moins 2 °C et d’au plus 10 °C, à moins qu’il n’ait été prouvé au ministre qu’une telle mention n’est pas nécessaire,
(v) une déclaration du contenu net, en poids, en mesure, ou en nombre,
(vi) dans le cas d’une drogue nouvelle pour usage exceptionnel à l’égard de laquelle un avis de conformité a été délivré en application de l’article C.08.004.01, la mention suivante, inscrite en majuscules et de façon lisible :
« SANTÉ CANADA A AUTORISÉ LA VENTE DE CETTE DROGUE NOUVELLE POUR USAGE EXCEPTIONNEL AUX FINS DE [indication de la fin] EN SE FONDANT SUR DES ESSAIS CLINIQUES RESTREINTS CHEZ L’ÊTRE HUMAIN.
HEALTH CANADA HAS AUTHORIZED THE SALE OF THIS EXTRAORDINARY USE NEW DRUG FOR [naming purpose] BASED ON LIMITED CLINICAL TESTING IN HUMANS. ».
- DORS/78-424, art. 7
- DORS/93-202, art. 21
- DORS/97-12, art. 39, 54 et 58
- DORS/2011-88, art. 6
- DORS/2013-179, art. 3
C.04.020 Sauf dans le cas des drogues ci-après, l’emballage d’une drogue qui est une drogue sur ordonnance doit porter le symbole « Pr » dans le quart supérieur gauche de l’espace principal des étiquettes intérieure et extérieure ou, dans le cas d’un récipient à dose unique, dans le quart supérieur gauche de l’étiquette extérieure :
a) la drogue vendue au titulaire d’une licence d’établissement;
b) la drogue vendue conformément à une ordonnance.
- DORS/80-543, art. 10
- DORS/97-12, art. 40
- DORS/2001-181, art. 4
- DORS/2013-122, art. 17
Vaccins bactériens, produits analogues aux vaccins bactériens
C.04.050 Sous réserve des dispositions du présent titre, un vaccin bactérien doit être une suspension stérile de cultures tuées de bactéries, avec ou sans addition d’autre médication, mais ne doit pas comprendre un vaccin autogène.
C.04.051 Est interdite la vente d’un vaccin bactérien, à moins que la culture ayant servi à sa préparation n’ait été soumise à des essais d’identité et de pureté selon une méthode acceptable, que lesdits essais n’aient confirmé l’authenticité et la pureté de la souche, et qu’une fiche de la culture n’ait été conservée, portant une déclaration de son origine, de ses propriétés et de ses caractéristiques.
C.04.052 Est interdit à tout manufacturier d’employer, dans la production d’un vaccin bactérien, un substrat (milieu de culture) contenant de la viande de cheval ou du sérum de cheval.
- DORS/97-12, art. 61
C.04.053 Le manufacturier d’un vaccin bactérien préparé à partir d’une bactérie qui ne croît pas facilement dans les milieux de culture ordinaires, doit lui faire subir l’essai de stérilité sur des milieux spéciaux favorables à la croissance de ladite bactérie, et ledit vaccin doit être stérile.
- DORS/97-12, art. 61
C.04.054 Sous réserve des articles C.04.083, C.04.084 et C.04.090, les étiquettes intérieure et extérieure de tout récipient à doses multiples et l’étiquette extérieure de tout récipient à dose unique d’un vaccin bactérien doivent porter une déclaration
a) du nombre de bactéries par millilitre, ou du poids de substance bactérienne desséchée par millilitre,
b) du nombre de bactéries par millilitre, ou du poids de substance desséchée par millilitre, de chaque espèce ou type immunogène, si le vaccin contient plusieurs espèces ou types immunogènes de bactéries,
c) de la nature et de la quantité exactes de toute substance, autre qu’un simple diluant, combinée à un tel vaccin, et
d) de la dose recommandée,
et l’étiquette intérieure des récipients à dose unique doit porter la déclaration que le récipient ne contient qu’une seule dose.
C.04.055 La date limite d’utilisation d’un vaccin bactérien ne doit pas dépasser 18 mois après la date de fabrication ou la date de sortie.
Vaccin antityphoïdique
C.04.060 Les cultures de Salmonella typhosa employées à la préparation de vaccin antityphoïdique doivent être lisses, mobiles, de la forme Vi et avoir la structure antigénique IX, XII, Vi; d.-.
C.04.061 Est interdite la vente de tout lot de vaccin antityphoïdique, à moins que ledit lot n’ait subi un titrage satisfaisant de son activité d’après une méthode acceptable.
Vaccin anticoquelucheux
C.04.065 Le manufacturier ne peut employer pour la fabrication du vaccin anticoquelucheux que des souches de Bordetella pertussis qui satisfont aux exigences d’un essai d’antigénicité effectué d’après une méthode acceptable.
- DORS/90-217, art. 1
- DORS/97-12, art. 61
C.04.066 Est interdite la vente de tout lot de vaccin anticoquelucheux, à moins que ledit lot n’ait subi un titrage satisfaisant de son activité d’après une méthode acceptable.
Vaccin B.C.G. (Bacille Calmette-Guérin)
C.04.070 Le vaccin B.C.G. doit être préparé à partir d’organismes B.C.G. vivants qui
a) ont été obtenus directement d’une source approuvée par le ministre;
b) sont reconnus non pathogènes par une méthode acceptable; et
c) ont des antécédents de succès dans la production du vaccin B.C.G.
- DORS/2018-69, art. 27
C.04.071 Est interdit à tout manufacturier d’employer à la fabrication de vaccin B.C.G. une personne qui
a) n’ait été et ne demeure exempte d’infection tuberculeuse sous toutes ses formes,
b) ne subisse tous les six mois un examen médical, lequel doit comprendre un examen aux rayons X de la poitrine, en vue de déceler la présence de tuberculose, ledit examen devant être fait par un praticien compétent qui doit signer un certificat établissant que ladite personne est exempte de tuberculose et devant être conservé dans les dossiers et être disponible en tout temps, et
c) n’habite avec une famille qui est, en tout temps, exempte de tuberculose active,
il est en outre interdit à un manufacturier d’employer une telle personne à tous autres travaux de laboratoire.
- DORS/97-12, art. 61
C.04.072 La préparation, la conservation et l’emballage-étiquetage du vaccin B.C.G. doivent être effectués sous la surveillance directe d’un bactériologiste d’expérience. De plus, ce bactériologiste doit :
a) avoir reçu une formation spécialisée d’au moins trois années en bactériologie et en immunologie;
b) s’être spécialisé dans le domaine de la bactériologie; et
c) posséder au moins un an d’expérience dans la fabrication du vaccin B.C.G.
- DORS/97-12, art. 41
C.04.073 Aucun manufacturier ne doit tolérer la présence, à quelque moment que ce soit, d’une culture qui n’est pas une culture de B.C.G. dans tout local où se fabrique du vaccin B.C.G.
- DORS/97-12, art. 61
C.04.074 Un emballeur-étiqueteur doit faire subir à chaque lot de vaccin B.C.G. une épreuve par une méthode acceptable, immédiatement après le remplissage du récipient définitif, en vue de déceler la présence de micro-organismes contaminants et le vaccin doit en être exempt.
- DORS/97-12, art. 65
C.04.075 Nonobstant l’article C.04.074, un vaccin B.C.G. liquide peut être mis en vente lorsqu’aucune croissance n’est apparue sur le milieu de culture d’épreuve après une incubation de 24 heures, mais s’il y a des signes de la présence de micro-organismes contaminants dans n’importe quel lot au cours de la période d’épreuve de 10 jours, l’emballeur-étiqueteur doit faire revenir immédiatement ledit lot.
- DORS/97-12, art. 65
C.04.076 Le manufacturier et l’emballeur-étiqueteur doivent déterminer le nombre d’organismes B.C.G. viables dans chaque lot de vaccin par une méthode acceptable et ils doivent en tenir registre.
- DORS/97-12, art. 63
C.04.077 Un manufacturier de vaccin B.C.G. doit conserver, à une température ne dépassant pas 5,0 °C et pendant au moins six mois,
a) la culture sur milieu glycériné de pomme de terre, qui a servi à faire les passages Sauton I et Sauton II, et
b) au moins six fioles du produit fini,
pour chaque lot dudit vaccin.
- DORS/97-12, art. 61
C.04.078 Le manufacturier et l’emballeur-étiqueteur de vaccin B.C.G. doivent conserver, sous une forme satisfaisante pour le ministre, des fiches cliniques continues de l’emploi du vaccin B.C.G. chez l’homme.
- DORS/97-12, art. 63
C.04.079 Un manufacturier de vaccin B.C.G. doit faire subir un examen pathologique à tous les animaux d’épreuve employés et signaler immédiatement au ministre tout indice de tuberculose active et évolutive chez lesdits animaux.
- DORS/97-12, art. 61
C.04.080 La date limite pour l’utilisation du vaccin B.C.G. ne doit pas dépasser
a) 10 jours après la récolte dans le cas du vaccin liquide;
b) 12 mois après la récolte dans le cas du vaccin desséché à froid (lyophilisation), conservé à 4 °C ou à une température plus élevée; ou
c) 20 mois après la récolte dans le cas du vaccin lyophilisé conservé à une température au-dessous de 4 °C.
C.04.081 Est interdite la vente de vaccin B.C.G. liquide qui n’est pas emballé dans des récipients scellés à la flamme.
C.04.082 Aucune étiquette intérieure n’est requise pour le vaccin B.C.G. liquide contenu dans des récipients à dose unique.
C.04.083 L’étiquette du vaccin B.C.G. liquide doit porter, plutôt que les déclarations prescrites aux alinéas C.04.054a) et b), une déclaration
a) du poids de bactéries par millilitre; et
b) de la voie d’administration du vaccin.
C.04.084 L’étiquette d’un vaccin B.C.G. desséché à froid (lyophilisation) doit porter, plutôt que les déclarations prescrites aux alinéas C.04.054a) et b), une déclaration
a) de la quantité de bactéries par ampoule ou par dose; et
b) de la voie d’administration du vaccin.
C.04.085 Les dispositions du sous-alinéa C.04.019b)(iv) ne s’appliquent pas au vaccin B.C.G. desséché à froid (lyophilisation).
Produits analogues aux vaccins bactériens
C.04.090 Un produit analogue à un vaccin bactérien doit être
a) un antigène bactérien autre qu’un vaccin bactérien, tel qu’un lysat, ou
b) un extrait préparé à partir d’une culture bactérienne,
et être conforme aux exigences du présent règlement relatif aux vaccins bactériens, sauf à celles des alinéas C.04.054a) et b).
C.04.091 La date limite d’utilisation d’un produit analogue à un vaccin bactérien ne doit pas dépasser 18 mois après la date de fabrication ou la date de sortie, mais dans le cas de la tuberculine desséchée et de la tuberculine contenant au moins 50 pour cent de glycérine, la date limite d’utilisation ne doit pas dépasser cinq ans après la date de fabrication ou la date de sortie, et dans le cas de toutes les autres tuberculines, elle ne doit pas dépasser 12 mois après la date de fabrication ou la date de sortie.
Virus vaccinaux et vaccins de rickettsies
C.04.100 Un virus vaccinal, un vaccin de rickettsies, doit être une suspension ou une préparation de virus ou de rickettsies vivants ou tués.
C.04.101 Il est interdit de vendre un virus ou un vaccin de rickettsies à moins que le manufacturier n’ait soumis à l’approbation du ministre les détails relatifs à la source des souches des virus ou des rickettsies utilisés, à leur mode de propagation, au procédé de préparation du vaccin et aux méthodes de détermination de la stérilité, de l’innocuité, de l’identité et de l’activité et autres analyses requises par le présent règlement.
- DORS/95-411, art. 2
- DORS/97-12, art. 42
C.04.102 À la demande écrite du ministre, le manufacturier et l’emballeur-étiqueteur doivent déposer pour chaque lot de virus vaccinal ou de vaccin de rickettsies prêt pour la vente des protocoles détaillés des essais de stérilité, de sécurité, d’identité, d’activité et de tout autre essai requis par le présent règlement.
- DORS/97-12, art. 63
- DORS/2018-69, art. 27
Vaccin antivariolique
C.04.110 Le vaccin antivariolique est conforme aux exigences suivantes :
a) il est un virus vaccinal;
b) il est le virus vivant de la vaccine ou ses dérivés tirés de l’une des sources suivantes :
(i) pustules produites sur la peau de veaux sains par inoculation du virus,
(ii) membranes d’embryons de poussins expressément infectées,
(iii) culture de tissu adéquate infectée par le virus ou ses dérivés;
c) il est de forme liquide ou desséchée.
- DORS/2006-2, art. 1
C.04.111 Le manufacturier et l’emballeur-étiqueteur ne peuvent manufacturer et emballer-étiqueter le vaccin antivariolique que dans une unité distincte qui est isolée de tous les autres travaux de laboratoire, et dans laquelle ou au voisinage de laquelle aucune matière étrangère n’est tolérée ni entreposée.
- DORS/97-12, art. 43
C.04.112 Le manufacturier doit interdire au personnel préposé au soin des animaux à vaccin tout accès aux écuries et aux enclos à chevaux et tout contact avec les chevaux pendant la propagation du vaccin antivariolique.
- DORS/97-12, art. 61
C.04.113 Le manufacturier et l’emballeur-étiqueteur ne doivent délivrer le vaccin antivariolique que dans des récipients de verre stériles et scellés dans des conditions aseptiques.
- DORS/97-12, art. 63
C.04.114 Le manufacturier et l’emballeur-étiqueteur doivent faire subir une épreuve au vaccin antivariolique en vue d’établir l’absence
a) de tout micro-organisme anaérobie sporifère;
b) de tout staphylocoque à réaction positive de la coagulase;
c) de tout streptocoque hémolytique; et
d) de tout autre micro-organisme pathogène contagieux.
- DORS/97-12, art. 63
C.04.115 Le vaccin antivariolique, mis à l’épreuve suivant des méthodes acceptables,
a) doit être exempt de tout micro-organisme étranger, s’il s’agit d’un vaccin dont l’administration se fait par injection au pistolet; et
b) ne doit pas contenir, par millilitre, plus de 500 bactéries non pathogènes viables, s’il s’agit d’un vaccin dont l’administration se fait suivant la méthode de pression multiple ou par scarification.
C.04.116 Il doit être démontré que le vaccin antivariolique exerce une action préventive au moins égale à celle d’un vaccin qui remplit les conditions suivantes :
a) son action préventive contre la transmission de la variole entre humains est reconnue;
b) son activité est égale ou supérieure à 108 unités infectantes par millilitre, lorsqu’elle est déterminée à l’aide de membranes chorio-allantoïdes d’embryons de poussins.
- DORS/2006-2, art. 2
C.04.117 Il est interdit de vendre du vaccin antivariolique, à moins que :
a) dans le cas du vaccin sous forme liquide, ce vaccin n’ait été conservé à une température inférieure à -10 °C;
b) dans le cas du vaccin desséché, il n’ait été conservé à une température inférieure à 10 °C; et
c) l’étiquette extérieure ne porte une déclaration disant que le vaccin doit être conservé à une température non supérieure à 5 °C.
- DORS/97-12, art. 44
C.04.118 Nonobstant les dispositions de l’article C.04.003, la date de sortie du vaccin antivariolique ne doit pas dépasser
a) neuf mois depuis la date de fabrication, dans le cas du vaccin sous forme liquide;
b) 24 mois depuis la date de fabrication, dans le cas du vaccin sous forme desséchée.
C.04.119 À moins qu’une preuve n’établisse la stabilité du vaccin à la satisfaction du ministre, la date limite d’utilisation du vaccin antivariolique ne peut dépasser :
a) dans le cas du vaccin sous forme liquide, trois mois après la date de sortie;
b) dans le cas du vaccin sous forme desséchée, douze mois après la date de sortie.
- DORS/2006-2, art. 3
C.04.120 Aucune étiquette intérieure n’est requise pour le vaccin antivariolique contenu dans des récipients à dose unique ou dispensé dans des tubes capillaires.
C.04.121 Est interdite la vente de vaccin antivariolique additionné d’un antibiotique quelconque.
Vaccin antipoliomyélitique
C.04.122 Le vaccin antipoliomyélitique doit être une suspension aqueuse de virus tués de poliomyélite, types I, II et III.
C.04.123 Le vaccin antipoliomyélitique doit être préparé dans un milieu de culture tissulaire acceptable, à partir de souches de virus de poliomyélite qui se sont révélées capables de produire du vaccin d’activité acceptable.
C.04.124 Le vaccin antipoliomyélitique dans sa forme définitive, doit contenir au plus 0,35 milligramme par millilitre d’azote total, et au plus une partie par million de sérum animal.
C.04.125 Est interdite la vente de vaccin antipoliomyélitique à moins qu’il n’ait subi une épreuve d’après une méthode acceptable pour ce qui est de l’activité et de l’innocuité et, lorsqu’il a été ainsi éprouvé, il doit être stable et posséder une activité acceptable.
C.04.126 L’étiquette extérieure doit porter une déclaration de la présence de tout antibiotique dans le vaccin.
C.04.127 La date limite d’utilisation du vaccin antipoliomyélitique ne doit pas dépasser 12 mois après la date de la dernière épreuve satisfaisante d’activité à moins que des preuves, jugées satisfaisantes par le ministre, ne soient présentées justifiant d’une période plus longue.
- DORS/85-715, art. 6
- DORS/2018-69, art. 27
Vaccin buccal, de poliovirus vivant
C.04.128 Le Vaccin buccal de poliovirus vivant et le Vaccin buccal de poliovirus (nom de la souche) vivant, doivent être préparés avec des virus poliomyélitiques vivants des types I, II et III, lesquels
a) ont été obtenus directement d’une source acceptable par le ministre;
b) démontrent une stabilité génétique établie par une méthode acceptable;
c) sont démontrés non pathogènes lorsqu’ils sont administrés par voie buccale chez les humains;
d) sont prouvés capables de proliférer dans le tube digestif humain, et de produire des anticorps neutralisants de leur type spécifique lorsqu’ils sont administrés par voie buccale; et
e) ont été employés avec succès pendant assez longtemps dans la production de vaccin buccal contre la poliomyélite à base de virus vivants.
- DORS/2018-69, art. 27
C.04.129 Le vaccin buccal de poliovirus vivant doit être manufacturé, emballé-étiqueté et analysé dans des locaux isolés des bâtiments où d’autres produits sont manufacturés, emballés-étiquetés ou analysés et des bâtiments où des épreuves de contrôle comprenant l’usage d’une lignée de cellules ou d’une souche virale n’entrant pas dans ces opérations doivent être effectuées.
- DORS/97-12, art. 45
C.04.130 Il est interdit à tout manufacturier de permettre l’introduction de toute culture bactérienne ou virale autre que celles qui servent à la fabrication du vaccin buccal de poliovirus vivant, dans n’importe quel lieu qui sert à la fabrication du vaccin buccal de poliovirus vivant.
- DORS/97-12, art. 61
C.04.131 Nonobstant les articles C.04.129 et C.04.130, un manufacturier peut fabriquer d’autres drogues dans un lieu qui sert, de temps à autre, à la fabrication du vaccin buccal de poliovirus vivant, lorsque ce lieu ne sert pas à la fabrication dudit vaccin, pourvu que
a) les lieux soient nettoyés et désinfectés par des méthodes acceptables au ministre, avant et après chaque fabrication de ce vaccin; et
b) le manufacturier ait reçu par écrit du ministre, la permission d’effectuer cette fabrication d’autres drogues.
- DORS/97-12, art. 61
- DORS/2018-69, art. 27
C.04.132 Le vaccin buccal de poliovirus doit être préparé uniquement
a) dans une culture de tissus,
b) dans un milieu, et
c) par des méthodes
jugés acceptables par le ministre.
- DORS/2018-69, art. 27
C.04.133 Est interdite à tout manufacturier la vente de vaccin buccal de poliovirus vivant, à moins que chaque lot n’ait été éprouvé pour la présence de micro-organismes étrangers et que le vaccin n’en soit exempt.
- DORS/97-12, art. 61
C.04.134 Un manufacturier de vaccin buccal de poliovirus vivant doit éprouver chaque lot de vaccin pour sa neurovirulence et ses traits génétiques marquants, par une méthode acceptable du ministre, et ce vaccin doit remplir les conditions exigées par le ministre.
- DORS/97-12, art. 61
- DORS/2018-69, art. 27
C.04.135 Il est interdit à un manufacturier d’employer qui que ce soit dans la fabrication du vaccin buccal de poliovirus vivant, à moins que
a) chaque personne en cause ne soit exempte de maladie infectieuse;
b) chaque personne en cause n’ait été vaccinée avec succès contre la poliomyélite par le vaccin buccal de poliovirus vivant; et
c) des tests périodiques ne prouvent qu’elle n’est pas « porteuse de germes » du virus de la poliomyélite.
- DORS/97-12, art. 61
C.04.136 Un manufacturier de vaccin buccal de poliovirus vivant doit interdire l’entrée dans un immeuble où se fabrique ledit vaccin à quiconque
a) n’a pas directement affaire au procédé de fabrication; ou
b) a travaillé durant la journée avec des animaux d’expérience ou des agents infectieux.
- DORS/97-12, art. 61
Bactériophage
C.04.137 Un bactériophage doit être une préparation de virus douée d’une action lytique spécifique contre un ou des micro-organismes actuellement ou virtuellement pathogènes.
C.04.138 La date limite d’utilisation d’un bactériophage ne doit pas dépasser 12 mois après la date de fabrication ou la date de délivrance.
Toxines, anatoxines
Réactifs de Schick
C.04.140 Les réactifs de Schick pour le diagnostic de la réceptivité à la diphtérie doivent être
a) la toxine diphtérique pour la réaction de Schick;
b) le contrôle pour le Schick; et
c) la toxine diphtérique pour la réaction de Schick avec contrôle.
C.04.141 La toxine diphtérique pour la réaction de Schick doit être de la toxine diphtérique diluée, stérile et stabilisée par une méthode acceptable.
C.04.142 Le contrôle pour le Schick doit être une dilution convenable
a) d’anatoxine diphtérique; ou
b) de toxine diphtérique stérile chauffée à la température de 95 °C, pendant cinq minutes.
C.04.143 Dans le cas de vieille toxine contenant un antiseptique, la dose d’épreuve pour l’homme de la réaction de Schick doit être déterminée par
a) injection intradermique, à des cobayes, en mélange avec diverses proportions d’antitoxine diphtérique; une dose d’épreuve mélangée avec 1/750 ou plus d’une unité d’antitoxine ne doit produire de réaction locale, mais, mélangée avec 1/1 250 ou moins d’une unité d’antitoxine, elle doit produire une réaction locale nette du type connu sous le nom de « réaction de Schick positive »; et par
b) injection intradermique, à des cobayes, sans mélange avec l’antitoxine; 1/50 d’une dose d’épreuve ne doit pas, mais 1/25 doit, produire une réaction locale nette du type connu sous le nom de « réaction de Schick positive ».
C.04.144 Dans le cas de toxine fraîche ne contenant aucun antiseptique, la dose d’épreuve pour l’homme de la réaction de Schick doit être déterminée par
a) injection intradermique, à des cobayes, en mélange avec diverses proportions d’antitoxine diphtérique; une dose d’épreuve mélangée avec 1/750 ou plus d’une unité d’antitoxine ne doit pas produire de réaction locale, mais, mélangée avec 1/1 500 ou moins d’une unité d’antitoxine, elle doit produire une réaction locale nette du type connu sous le nom de « réaction de Schick positive »; et par
b) injection intradermique, à des cobayes, sans mélange avec l’antitoxine; 1/100 d’une dose d’épreuve ne doit pas, mais 1/50 doit, produire une réaction locale nette du type connu sous le nom de « réaction de Schick positive ».
C.04.145 La dose d’épreuve pour l’homme du contrôle pour le Schick, injectée par voie intradermique à des cobayes, doit donner une réaction de Schick négative.
C.04.146 Est interdite la vente de toxine diphtérique pour la réaction de Schick, à moins que les étiquettes intérieure et extérieure ne portent toutes deux la déclaration du nombre de doses humaines d’épreuve que contient l’emballage, ainsi que le nom de tout stabilisateur présent.
C.04.147 La date limite d’utilisation des réactifs de Schick pour le diagnostic de la réceptivité à la diphtérie ne doit pas dépasser 12 mois après la date de fabrication ou la date de sortie.
Anatoxine diphtérique
C.04.160 L’anatoxine diphtérique liquide doit être de la toxine diphtérique stérile, formulée et détoxifiée, et contenir au plus 0,02 pour cent de formaldéhyde libre.
C.04.161 L’anatoxine diphtérique précipitée par l’alun doit être préparée à partir d’anatoxine diphtérique et contenir au plus 15 milligrammes d’alun par dose humaine.
C.04.162 L’alun employé à la précipitation de l’anatoxine diphtérique précipitée par l’alun doit contenir au moins 99,5 pour cent d’alun potassique pur, Al K(SO4)2, 12H2O.
C.04.163 Dans la production de la toxine diphtérique, il est interdit au manufacturier d’employer des milieux de culture qui contiennent des protéines de cheval ou de la peptone de Witte, ou qui n’ont pas été débarrassés autant que possible de tous autres ingrédients allergéniques.
- DORS/97-12, art. 61
C.04.164 La toxine diphtérique qui sert à préparer l’anatoxine doit avoir une toxicité exprimée par une dose léthale (L+) d’au plus 0,20 millilitre ou par une dose léthale minimum (D.L.M.) d’au plus 0,0025 millilitre.
C.04.165 Avant le remplissage des récipients définitifs, le manufacturier doit soumettre le contenu de chaque récipient-vrac d’anatoxine diphtérique à une épreuve de toxicité d’après une méthode acceptable et ce contenu ne doit pas être toxique.
- DORS/97-12, art. 61
C.04.166 Est interdite la vente de tout lot d’anatoxine diphtérique, à moins que ledit lot n’ait subi un essai satisfaisant d’antigénicité d’après une méthode acceptable.
C.04.167 Un manufacturier doit introduire aseptiquement l’anatoxine diphtérique dans des récipients en verre limpide et, lorsqu’il n’y a pas addition d’un antiseptique, les récipients doivent être scellés à la flamme.
- DORS/97-12, art. 61
C.04.168 Est interdite la vente d’anatoxine diphtérique qui contient du phénol.
C.04.169 Est interdite la vente d’anatoxine diphtérique, à moins que les étiquettes intérieure et extérieure ne portent toutes deux la déclaration de la dose immunisante.
C.04.170 La date limite d’utilisation de l’anatoxine diphtérique ne doit pas dépasser deux ans après la date de fabrication ou la date de sortie.
Anatoxine tétanique
C.04.180 L’anatoxine tétanique liquide doit être de la toxine tétanique stérile, formulée et détoxifiée, et contenir au plus 0,02 pour cent de formaldéhyde libre.
C.04.181 L’anatoxine tétanique précipitée par l’alun doit être préparée à partir de l’anatoxine tétanique et contenir au plus 15 milligrammes d’alun par dose humaine.
C.04.182 L’alun employé à la préparation de l’anatoxine tétanique précipitée par l’alun doit contenir au moins 99,5 pour cent d’alun potassique pur, Al K(SO4)2, 12H2O.
C.04.183 Dans la production de la toxine tétanique, il est interdit au manufacturier d’employer des milieux de culture qui contiennent des protéines de cheval ou de la peptone de Witte, ou qui n’ont pas été débarrassés autant que possible de tous autres ingrédients allergéniques.
- DORS/97-12, art. 61
C.04.184 La toxine tétanique qui sert à préparer l’anatoxine tétanique doit avoir une toxicité exprimée par une dose léthale minimum (D.L.M.) d’au plus 0,0001 millilitre pour le cobaye.
C.04.185 Avant le remplissage des récipients définitifs, l’emballeur-étiqueteur doit soumettre le contenu de chaque récipient-vrac à une épreuve de toxicité d’après une méthode acceptable et ce contenu ne doit pas être toxique.
- DORS/97-12, art. 65
C.04.186 Est interdite la vente de tout lot d’anatoxine tétanique, à moins que ledit lot n’ait subi un essai satisfaisant d’antigénicité d’après une méthode acceptable.
C.04.187 Est interdite la vente d’anatoxine tétanique, à moins que les étiquettes intérieure et extérieure ne portent toutes deux la déclaration de la dose immunisante.
C.04.188 Un manufacturier doit introduire aseptiquement l’anatoxine tétanique dans des récipients en verre limpide et, lorsqu’il n’y a pas addition d’un antiseptique, les récipients doivent être scellés à la flamme.
- DORS/97-12, art. 61
C.04.189 Est interdite la vente d’anatoxine tétanique qui contient du phénol.
C.04.190 La date limite d’utilisation de l’anatoxine tétanique ne doit pas dépasser deux ans après la date de fabrication ou la date de sortie.
Antitoxines, antisérums
C.04.210 Une antitoxine ou un antisérum doit être le sérum, ou une fraction du sérum, séparé du sang d’animaux immunisés artificiellement contre les sous-produits ou les fractions antigéniques des cultures spécifiques de micro-organismes ou contre des venins spécifiques.
C.04.211 L’activité d’une antitoxine ou d’un antisérum doit être déterminée par une méthode acceptable et, lorsqu’il y a lieu, l’unité d’activité doit être l’unité internationale.
C.04.212 L’antitoxine diphtérique liquide doit posséder une activité d’au moins 500 unités internationales par millilitre.
C.04.213 L’antitoxine tétanique liquide doit posséder une activité d’au moins 400 unités internationales par millilitre.
C.04.214 Une antitoxine ou un antisérum liquide doit contenir au plus 20 pour cent de solides.
C.04.215 Une antitoxine desséchée doit être préparée à partir d’une antitoxine liquide et son activité, après reconstitution au volume original, ne doit pas être inférieure à celle qui est prescrite pour l’antitoxine liquide.
C.04.216 Une antitoxine desséchée, un antisérum desséché, doit contenir au plus un pour cent d’humidité, à l’épreuve par une méthode acceptable.
C.04.217 Chaque lot d’antitoxine ou d’antisérum doit subir l’épreuve de pyrogénéité par une méthode acceptable et il doit être exempt de pyrogènes; et, après remplissage des récipients définitifs, il doit subir l’épreuve d’identité et correspondre à son nom.
C.04.218 Est interdite la vente d’une antitoxine ou d’un antisérum, à moins que les étiquettes intérieure et extérieure ne portent toutes deux la déclaration de l’espèce d’animal utilisée, si elle est autre que le cheval, et du contenu net en millilitres ou du nombre d’unités du récipient.
C.04.219 En ce qui concerne les antitoxines, la date limite d’utilisation ne doit pas dépasser,
a) dans le cas d’antitoxines liquides soumises à des normes d’activité : cinq ans après la date de fabrication;
b) dans le cas d’antitoxines desséchées soumises à des normes d’activité : cinq ans après la date de fabrication;
c) dans le cas d’antitoxines liquides pour lesquelles il n’y a pas de normes d’activité : 12 mois après la date de fabrication; et
d) dans le cas d’antitoxines desséchées pour lesquelles il n’y a pas de normes d’activité : cinq ans après la date de fabrication.
C.04.220 En ce qui concerne les antisérums, la date limite d’utilisation ne doit pas dépasser,
a) dans le cas d’antisérums liquides soumis à des normes d’activité : trois ans après la date de fabrication;
b) dans le cas d’antisérums desséchés soumis à des normes d’activité : cinq ans après la date de fabrication;
c) dans le cas d’antisérums liquides pour lesquels il n’y a pas de normes d’activité : 12 mois après la date de fabrication; et
d) dans le cas d’antisérums desséchés pour lesquels il n’y a pas de normes d’activité : cinq ans après la date de fabrication.
Préparations de provenance humaine
C.04.230 Les préparations de provenance humaine doivent être du plasma sanguin ou du sérum sanguin mis en commun, ou des fractions de l’un ou de l’autre, séparés selon une méthode satisfaisante aux yeux du ministre.
C.04.231 Un manufacturier ne doit obtenir de sérum ou de plasma humains que de personnes certifiées en bonne santé par un praticien compétent.
- DORS/97-12, art. 61
C.04.232 Un manufacturier ne doit employer comme donneur de sang, de placenta ou de cordon, aucune personne ayant des antécédents de maladies transmissibles par la transfusion du sang, y compris la syphilis, l’hépatite infectieuse, ou le paludisme.
- DORS/97-12, art. 61
C.04.233 Le prélèvement du sang d’un donneur doit s’effectuer sous la surveillance d’un praticien compétent et dans une salle de saignée convenable sous la direction du manufacturier.
- DORS/97-12, art. 61
C.04.234 Un manufacturier ne doit se procurer les placentas et les cordons employés à la fabrication de préparations de provenance humaine que de femmes accouchées dans des hôpitaux publics; les donneuses desdits placentas et cordons doivent avoir été exemptes des toxémies de la grossesse et les placentas et les cordons ne doivent présenter aucun indice macroscopique de quelque état pathologique que ce soit.
- DORS/97-12, art. 61
C.04.235 (1) Sous réserve des paragraphes (2) et (3), le sérum humain desséché, le plasma humain desséché, ou les fractions desséchées de l’un ou de l’autre, doivent contenir au plus un pour cent d’humidité à l’épreuve par une méthode acceptable.
(2) L’immunoglobuline humaine Rho(D) desséchée doit contenir au plus trois pour cent d’humidité, à l’épreuve par une méthode acceptable.
(3) Le facteur antihémophilique (humain) desséché doit contenir au plus deux pour cent d’humidité à l’épreuve par une méthode acceptable.
- DORS/81-334, art. 3
C.04.236 Un manufacturier doit fournir avec les préparations de provenance humaine, livrées sous forme liquide ou reconstituées à partir de la substance desséchée, des instructions ou des moyens pour l’élimination des particules d’une grosseur telle qu’elles pourraient être dangereuses pour le receveur.
- DORS/97-12, art. 61
C.04.237 Un manufacturier de préparations de provenance humaine doit conserver des fiches complètes de tous les donneurs, y compris le certificat médical prescrit à l’article C.04.231.
- DORS/97-12, art. 61
C.04.238 Le manufacturier, l’emballeur-étiqueteur ou le distributeur visé à l’alinéa C.01A.003b) peut délivrer du sérum ou du plasma humains, ou des fractions de l’un ou de l’autre, pour usage prophylactique ou thérapeutique, sous les formes suivantes :
a) immun-sérum humain, qui doit être du sérum préparé à partir du sang d’individus rétablis de la maladie que le sérum est destiné à prévenir ou à traiter, ou d’individus spécifiquement immunisés contre cette même maladie;
b) immuno-globulines humaines ou autres fractions d’immun-sérum humain, qui doivent être préparées à partir d’immun-sérum ou d’immun-plasma humains;
c) sérum humain normal ou plasma humain normal, ou fractions de l’un ou de l’autre, qui doivent être préparés à partir du sang d’individus normaux; et
d) produits desséchés préparés à partir de n’importe quelle des préparations ci-dessus.
- DORS/97-12, art. 46
C.04.239 Est interdite la vente de toute préparation de provenance humaine, à moins que les étiquettes intérieure et extérieure ne portent toutes deux l’indication précise que la préparation est de provenance humaine.
C.04.240 La date limite d’utilisation des préparations de provenance humaine, délivrées sous la forme liquide ou la forme desséchée, ne doit pas dépasser cinq ans après la date de remplissage du récipient immédiat.
C.04.241 La date de fabrication des préparations de provenance humaine doit être la date de la saignée du donneur.
C.04.300 et C.04.301 [Abrogés, DORS/81-335, art. 3]
C.04.400 [Abrogé, DORS/2013-179, art. 4]
C.04.401 [Abrogé, DORS/2013-179, art. 4]
C.04.402 [Abrogé, DORS/2013-179, art. 4]
C.04.403 [Abrogé, DORS/2013-179, art. 4]
C.04.404 [Abrogé, DORS/2013-179, art. 4]
C.04.405 [Abrogé, DORS/2013-179, art. 4]
C.04.406 [Abrogé, DORS/2013-179, art. 4]
C.04.407 [Abrogé, DORS/2013-179, art. 4]
C.04.408 [Abrogé, DORS/2013-179, art. 4]
C.04.409 [Abrogé, DORS/2013-179, art. 4]
C.04.410 [Abrogé, DORS/2013-179, art. 4]
C.04.411 [Abrogé, DORS/2013-179, art. 4]
C.04.412 [Abrogé, DORS/2013-179, art. 4]
C.04.413 [Abrogé, DORS/2013-179, art. 4]
C.04.414 [Abrogé, DORS/2013-179, art. 4]
C.04.415 [Abrogé, DORS/2013-179, art. 4]
C.04.416 [Abrogé, DORS/2013-179, art. 4]
C.04.417 [Abrogé, DORS/2013-179, art. 4]
C.04.418 [Abrogé, DORS/2013-179, art. 4]
C.04.419 [Abrogé, DORS/2013-179, art. 4]
C.04.420 [Abrogé, DORS/2013-179, art. 4]
C.04.421 [Abrogé, DORS/2013-179, art. 4]
C.04.422 [Abrogé, DORS/2013-179, art. 4]
C.04.423 [Abrogé, DORS/2013-179, art. 4]
C.04.424 [Abrogé, DORS/2006-353, art. 1]
C.04.425 [Abrogé, DORS/2006-353, art. 1]
C.04.426 [Abrogé, DORS/2006-353, art. 1]
C.04.427 [Abrogé, DORS/97-12, art. 50]
C.04.428 [Abrogé, DORS/2006-353, art. 1]
Préparations insuliniques
- DORS/82-769, art. 5
C.04.550 (1) Insuline désigne le principe actif du pancréas, qui influe sur le métabolisme des hydrates de carbone dans l’organisme animal et qui est efficace dans le traitement du diabète sucré.
(2) L’étalon canadien d’insuline doit être l’étalon international d’insuline.
(3) Les préparations insuliniques décrites dans le présent règlement doivent renfermer de l’insuline à laquelle ne peuvent être ajoutés que les ingrédients prescrits dans le présent règlement.
(4) L’activité d’une préparation insulinique doit être exprimée en unités par centimètre cube et chaque unité par centimètre cube doit donner une unité internationale d’insuline par centimètre cube.
- DORS/82-769, art. 4
C.04.551 Il est interdit de vendre ou de fournir une préparation insulinique à moins de l’avoir continuellement emmagasinée à une température comprise entre 35 °F et 50 °F (2 °C et 10 °C).
- DORS/82-769, art. 4
C.04.552 Les cristaux d’insuline-zinc employés dans une préparation insulinique doivent renfermer, d’après une méthode acceptable,
a) au moins 21 unités internationales d’insuline par milligramme; et
b) sur la matière desséchée, au moins 0,30 pour cent et au plus 0,90 pour cent de zinc.
- DORS/82-769, art. 4
Injection insulinique ou insuline
C.04.553 Les préparations insuliniques appelées « Injection insulinique » ou « Insuline » doivent être une solution limpide, incolore ou presque incolore, stérile, exempte de turbidité et de matières insolubles, préparée avec de l’insuline ou des cristaux d’insuline-zinc, doivent avoir un pH d’au moins 2,5 et d’au plus 3,5, ou d’au moins 7,0 et d’au plus 7,8 et doivent renfermer,
a) en poids par volume,
(i) au moins 0,1 pour cent et au plus 0,25 pour cent de phénol ou de crésol, et
(ii) au moins 1,4 pour cent et au plus 1,8 pour cent de glycérine; et
b) d’après une méthode acceptable, par 1 000 unités internationales d’insuline,
(i) au plus 7,0 milligrammes d’azote dans le cas de l’injection insulinique préparée avec des cristaux d’insuline-zinc et au plus 8,5 milligrammes d’azote dans le cas de l’injection insulinique autre que celle qui est faite avec des cristaux d’insuline-zinc,
(ii) au moins 0,10 milligramme et au plus 0,40 milligramme de zinc dans le cas de l’injection insulinique préparée avec des cristaux d’insuline-zinc et au plus 0,40 milligramme de zinc dans le cas de l’injection insulinique autre que celle faite avec des cristaux d’insuline-zinc, et
(iii) dans le cas de l’injection insulinique autre que celle qui est faite avec cristaux d’insuline-zinc, au plus 1,0 milligramme de cendres.
- DORS/82-769, art. 4
- DORS/85-715, art. 7
C.04.554 Il est interdit de vendre de l’injection insulinique à moins
a) qu’elle ne soit offerte dans une fiole d’une capacité approximative de 10 centimètres cubes, laquelle doit présenter un excédent de volume permettant d’en retirer 10 centimètres cubes;
b) que l’étiquette de la fiole n’indique que chaque centimètre cube a une activité égale à
(i) 40 unités internationales d’insuline,
(ii) 80 unités internationales d’insuline, ou
(iii) 100 unités internationales d’insuline; et
c) que chaque centimètre cube de ladite injection n’ait une activité réelle d’au moins 95 pour cent et n’excédant pas 105 pour cent de l’activité indiquée sur l’étiquette et déterminée par une méthode acceptable.
- DORS/82-769, art. 4
C.04.555 (1) Le manufacturier ne doit pas vendre d’injection insulinique à moins qu’il
a) n’ait procuré au ministre, en conformité du paragraphe (2), une présentation relative à ladite préparation, sous une forme et dans une teneur qui soient à la satisfaction du ministre;
b) n’ait fourni au ministre les renseignements supplémentaires que celui-ci pourrait lui avoir demandés; et
c) n’ait reçu du ministre un avis portant que les renseignements contenus dans la présentation sont conformes aux exigences du présent article.
(2) Une présentation soumise en exécution du paragraphe (1) doit contenir au moins,
a) à l’égard de chaque maître-lot d’insuline ou de cristaux d’insuline-zinc, ayant servi à la fabrication de l’injection insulinique,
(i) les protocoles du titrage de l’activité exprimée en unités internationales par centimètre cube, dans le cas de l’insuline, et en unités internationales par milligramme, dans le cas des cristaux d’insuline-zinc,
(ii) un rapport de la teneur en humidité, exprimée en pourcentage et déterminée par dessiccation à poids constant à 100 °C, dans le cas des cristaux d’insuline-zinc,
(iii) un rapport de la teneur en cendres, dans le cas de l’insuline, et
(iv) des rapports de dosage de la teneur en azote en milligrammes et de la teneur en zinc en milligrammes par 1 000 unités internationales d’insuline;
b) à l’égard du premier lot fini d’injection insulinique préparé avec chaque maître-lot d’insuline ou de cristaux d’insuline-zinc, un rapport sur la quantité de chaque composant entrant dans ladite injection; et,
c) à l’égard du premier remplissage du premier lot fini d’injection insulinique préparé avec chaque maître-lot d’insuline ou de cristaux d’insuline-zinc,
(i) un rapport du dosage de la teneur en azote, en milligrammes par 1 000 unités internationales d’insuline,
(ii) un rapport du dosage de la teneur en zinc, en milligrammes par 1 000 unités internationales d’insuline,
(iii) un rapport sur la détermination du pH.
(iv) [Abrogé, DORS/95-203, art. 2]
- DORS/82-769, art. 4
- DORS/95-203, art. 2
- DORS/97-12, art. 61
- DORS/2018-69, art. 27, 31(A) et 32(F)
C.04.556 La date limite d’utilisation imprimée sur les étiquettes intérieure et extérieure de chaque emballage d’injection insulinique ne doit pas dépasser deux ans après la date de retrait du lieu d’entreposage du manufacturier en vue de la distribution.
- DORS/82-769, art. 4
- DORS/97-12, art. 61
Suspension d’insuline-zinc d’absorption rapide
C.04.557 La préparation insulinique appelée « Suspension d’insuline-zinc d’absorption rapide » doit être une suspension stérile, dans un milieu aqueux tamponné, d’insuline modifiée de telle façon par addition de zinc que le précipité en suspension soit une substance amorphe, doit avoir un pH d’au moins 7,0 et d’au plus 7,8 et doit renfermer,
a) en poids par volume,
(i) au moins 0,15 pour cent et au plus 0,17 pour cent d’acétate de sodium (NaC2H3O2,3H2O),
(ii) au moins 0,65 pour cent et au plus 0,75 pour cent de chlorure de sodium, et
(iii) au moins 0,09 pour cent et au plus 0,11 pour cent de p-hydroxybenzoate de méthyle; et
b) d’après une méthode acceptable, par 1 000 unités internationales d’insuline,
(i) au plus 7,0 milligrammes d’azote, et
(ii) au moins 1,2 milligrammes et au plus 2,5 milligrammes de zinc, dont au moins 20 pour cent et au plus 65 pour cent doivent être dans le liquide surnageant.
- DORS/80-545, art. 1
- DORS/82-769, art. 4
- DORS/85-715, art. 8
C.04.558 L’insuline servant à la préparation de la suspension d’insuline-zinc d’absorption rapide doit provenir d’un ou de plusieurs maîtres-lots et doit être en quantité suffisante pour fournir soit 40, soit 80, soit 100 unités internationales d’insuline par centimètre cube de suspension d’insuline-zinc d’absorption rapide, quand le précipité est répandu uniformément dans la suspension.
- DORS/82-769, art. 4
C.04.559 Le liquide surnageant obtenu de la suspension d’insuline-zinc d’absorption rapide doit renfermer au plus 1,0 unité internationale d’insuline par centimètre cube, quand l’activité de la préparation insulinique est de 40 unités par centimètre cube, et au plus 1,5 unités internationales d’insuline par centimètre cube, quand l’activité de ladite préparation est de 80 ou 100 unités par centimètre cube, d’après une méthode acceptable.
- DORS/82-769, art. 4
C.04.560 Il est interdit de vendre une suspension d’insuline-zinc d’absorption rapide à moins
a) qu’elle ne soit offerte dans une fiole d’une capacité approximative de 10 centimètres cubes, laquelle doit présenter un excédent de volume permettant d’en retirer 10 centimètres cubes; et
b) que chaque centimètre cube de ladite suspension ne fournisse, quand le précipité est répandu uniformément dans la suspension,
(i) 40 unités internationales d’insuline, ou
(ii) 80 unités internationales d’insuline, ou
(iii) 100 unités internationales d’insuline.
- DORS/82-769, art. 4
C.04.561 (1) Le manufacturier ne doit pas vendre une suspension d’insuline-zinc d’absorption rapide à moins qu’il
a) n’ait procuré au ministre, en conformité du paragraphe (2), une présentation relative à ladite préparation, sous une forme et dans une teneur qui soient à la satisfaction du ministre;
b) n’ait fourni au ministre les renseignements supplémentaires que celui-ci pourrait lui avoir demandés; et
c) n’ait reçu du ministre un avis portant que les renseignements contenus dans la présentation sont conformes aux exigences du présent article.
(2) Une présentation soumise en exécution du paragraphe (1) doit contenir au moins,
a) à l’égard de chaque maître-lot d’insuline ou de cristaux d’insuline-zinc, ayant servi à la fabrication de la suspension d’insuline-zinc d’absorption rapide,
(i) les protocoles du titrage de l’activité exprimée en unités internationales par centimètre cube, dans le cas de l’insuline, et en unités internationales par milligramme, dans le cas des cristaux d’insuline-zinc,
(ii) un rapport de la teneur en humidité, exprimée en pourcentage et déterminée par dessiccation à poids constant à 100 °C, dans le cas des cristaux d’insuline-zinc, et
(iii) des rapports du dosage de la teneur en azote en milligrammes et de la teneur en zinc en milligrammes par 1 000 unités internationales d’insuline;
b) à l’égard du premier lot fini de suspension d’insuline-zinc d’absorption rapide préparé avec chaque maître-lot d’insuline ou de cristaux d’insuline-zinc,
(i) un rapport sur la quantité de chaque composant entrant dans la préparation,
(ii) un rapport du dosage de la teneur en azote par 1 000 unités internationales d’insuline,
(iii) un rapport du dosage de la teneur en zinc par 1 000 unités internationales d’insuline,
(iv) un rapport de la teneur en insuline en unités internationales par centimètre cube du liquide surnageant après élimination du précipité en suspension,
(v) un rapport du dosage de la teneur en zinc du liquide surnageant, après élimination du précipité en suspension,
(vi) un rapport sur la détermination du pH, et
(vii) un rapport sur l’apparence au microscope du précipité en suspension; et,
c) à l’égard du premier remplissage du premier lot fini de suspension d’insuline-zinc d’absorption rapide préparé avec chaque maître-lot d’insuline ou de cristaux d’insuline-zinc,
(i) un rapport sur la détermination du pH,
(ii) un rapport sur l’examen du précipité au microscope,
(iii) un rapport sur son identification faite d’après une méthode acceptable.
(iv) [Abrogé, DORS/95-203, art. 3]
- DORS/82-769, art. 4
- DORS/95-203, art. 3
- DORS/97-12, art. 61
- DORS/2018-69, art. 27, 31(A) et 32(F)
C.04.562 La date limite d’utilisation imprimée sur les étiquettes intérieure et extérieure de chaque emballage de suspension d’insuline-zinc d’absorption rapide ne doit pas dépasser deux ans après la date du remplissage du contenant immédiat.
- DORS/82-769, art. 4
Suspension d’insuline-zinc d’absorption moyenne
C.04.563 La préparation insulinique appelée « Suspension d’insuline-zinc d’absorption moyenne » doit être une suspension stérile, dans un milieu aqueux tamponné, d’insuline modifiée de telle façon par addition de zinc que le précipité en suspension soit un mélange de cristaux et de substance amorphe dans une proportion approximative de sept parties de cristaux pour trois parties de substance amorphe, doit avoir un pH d’au moins 7,0 et d’au plus 7,8 et doit renfermer,
a) en poids par volume,
(i) au moins 0,15 pour cent et au plus 0,17 pour cent d’acétate de sodium (NaC2H3O2,3H2O),
(ii) au moins 0,65 pour cent et au plus 0,75 pour cent de chlorure de sodium, et,
(iii) au moins 0,09 pour cent et au plus 0,11 pour cent de p-hydroxybenzoate de méthyle; et,
b) d’après une méthode acceptable, par 1 000 unités internationales d’insuline,
(i) au plus 7,0 milligrammes d’azote dont au moins 63 pour cent et au plus 73 pour cent doivent être dans le composant cristallin, et
(ii) au moins 1,2 milligrammes et au plus 2,5 milligrammes de zinc, dont au moins 20 pour cent et au plus 65 pour cent doivent être dans le liquide surnageant.
- DORS/80-545, art. 2
- DORS/82-769, art. 4
- DORS/85-715, art. 9
- DORS/88-323, art. 7
C.04.564 L’insuline servant à la préparation de la suspension d’insuline-zinc d’absorption moyenne doit provenir d’un ou de plusieurs maîtres-lots et doit être en quantité suffisante pour fournir soit 40, soit 80, soit 100 unités internationales d’insuline par centimètre cube de la préparation, quand le précipité est répandu uniformément dans la suspension.
- DORS/82-769, art. 4
C.04.565 Le liquide limpide surnageant obtenu de la suspension d’insuline-zinc d’absorption moyenne doit renfermer au plus 1,0 unité internationale d’insuline par centimètre cube, quand l’activité de la préparation insulinique est de 40 unités par centimètre cube, et au plus 1,5 unités internationales d’insuline par centimètre cube, quand l’activité de ladite préparation est de 80 ou 100 unités par centimètre cube, d’après une méthode acceptable.
- DORS/82-769, art. 4
C.04.566 Il est interdit de vendre une suspension d’insuline-zinc d’absorption moyenne à moins
a) qu’elle ne soit offerte dans une fiole d’une capacité approximative de 10 centimètres cubes, laquelle doit présenter un excédent de volume permettant d’en retirer 10 centimètres cubes; et
b) que chaque centimètre cube de ladite suspension ne fournisse, quand le précipité est répandu uniformément dans la suspension,
(i) 40 unités internationales d’insuline,
(ii) 80 unités internationales d’insuline, ou
(iii) 100 unités internationales d’insuline.
- DORS/82-769, art. 4
C.04.567 (1) Le manufacturier ne doit pas vendre une suspension d’insuline-zinc d’absorption moyenne à moins qu’il
a) n’ait procuré au ministre, en conformité du paragraphe (2), une présentation relative à ladite préparation, sous une forme et dans une teneur qui soient à la satisfaction du ministre;
b) n’ait fourni au ministre les renseignements supplémentaires que celui-ci pourrait lui avoir demandés; et
c) n’ait reçu du ministre un avis portant que les renseignements contenus dans la présentation sont conformes aux exigences du présent article.
(2) Une présentation soumise en exécution du paragraphe (1) doit contenir au moins,
a) à l’égard de chaque maître-lot d’insuline ou de cristaux d’insuline-zinc ayant servi à la fabrication d’une suspension insuline-zinc d’absorption moyenne,
(i) les protocoles du titrage de l’activité exprimée en unités internationales par centimètre cube, dans le cas de l’insuline, et en unités internationales par milligramme, dans le cas des cristaux d’insuline-zinc,
(ii) un rapport de la teneur en humidité, exprimée en pourcentage et déterminée par dessiccation à poids constant à 100 °C, dans le cas des cristaux d’insuline-zinc, et
(iii) des rapports du dosage de la teneur en azote en milligrammes et de la teneur en zinc en milligrammes par 1 000 unités internationales d’insuline;
b) à l’égard du premier lot fini de suspension d’insuline-zinc d’absorption moyenne préparée avec chaque maître-lot d’insuline ou de cristaux d’insuline-zinc,
(i) un rapport sur la quantité de chaque composant entrant dans la préparation,
(ii) un rapport du dosage de la teneur en azote exprimée en milligrammes par centimètre cube ou par 1 000 unités internationales d’insuline,
(iii) un rapport du dosage de la teneur en zinc exprimée en milligrammes par centimètre cube ou par 1 000 unités internationales d’insuline,
(iv) un rapport de la teneur en insuline du liquide surnageant après élimination du précipité en suspension, exprimée en unités internationales par centimètre cube,
(v) un rapport sur la détermination de la proportion d’azote dans le composant cristallin du précipité en suspension,
(vi) un rapport du dosage de la teneur en zinc du liquide surnageant après élimination du précipité en suspension,
(vii) un rapport sur la détermination du pH, et
(viii) un rapport sur l’apparence au microscope du précipité en suspension; et,
c) à l’égard du premier remplissage du premier lot fini de suspension d’insuline-zinc d’absorption moyenne préparé avec chaque maître-lot d’insuline ou de cristaux d’insuline-zinc,
(i) un rapport sur la détermination du pH,
(ii) un rapport sur l’examen du précipité au microscope,
(iii) un rapport sur son identification faite d’après une méthode acceptable.
(iv) [Abrogé, DORS/95-203, art. 4]
- DORS/82-769, art. 4
- DORS/95-203, art. 4
- DORS/97-12, art. 61
- DORS/2018-69, art. 27, 31(A) et 32(F)
C.04.568 La date limite d’utilisation imprimée sur les étiquettes intérieure et extérieure de la suspension d’insuline-zinc d’absorption moyenne ne doit pas dépasser deux ans après la date du remplissage du contenant immédiat.
- DORS/82-769, art. 4
Suspension d’insuline-zinc d’absorption prolongée
C.04.569 La préparation insulinique appelée « Suspension d’insuline-zinc d’absorption prolongée » doit être une suspension stérile, dans un milieu aqueux tamponné, d’insuline modifiée de telle façon par addition de zinc que le précipité en suspension consiste en cristaux et ne contienne au plus qu’une quantité infime de substance amorphe, doit avoir un pH d’au moins 7,0 et d’au plus 7,8 et doit renfermer,
a) en poids par volume,
(i) au moins 0,15 pour cent et au plus 0,17 pour cent d’acétate de sodium (NaC2H3O2,3H2O),
(ii) au moins 0,65 pour cent et au plus 0,75 pour cent de chlorure de sodium, et
(iii) au moins 0,09 pour cent et au plus 0,11 pour cent de p-hydroxybenzoate de méthyle; et,
b) d’après une méthode acceptable, pour 1 000 unités internationales d’insuline,
(i) au plus 7,0 milligrammes d’azote dont au moins 90 pour cent doivent être dans le composant cristallin, et
(ii) au moins 1,2 milligrammes et au plus 2,5 milligrammes de zinc, dont au moins 20 pour cent et au plus 65 pour cent doivent être dans le liquide surnageant.
- DORS/80-545, art. 3
- DORS/82-769, art. 4
- DORS/85-715, art. 10
C.04.570 L’insuline servant à la préparation de la suspension d’insuline-zinc d’absorption prolongée doit provenir d’un ou de plusieurs maîtres-lots et doit être en quantité suffisante pour fournir soit 40, soit 80, soit 100 unités internationales d’insuline par centimètre cube de la préparation, quand le précipité est répandu uniformément dans la suspension.
- DORS/82-769, art. 4
C.04.571 Le liquide limpide surnageant obtenu de la suspension d’insuline-zinc d’absorption prolongée doit renfermer au plus 1,0 unité internationale d’insuline par centimètre cube, quand l’activité de la préparation insulinique est de 40 unités par centimètre cube et au plus 1,5 unités internationales d’insuline par centimètre cube, quand l’activité de ladite préparation est de 80 ou 100 unités par centimètre cube, d’après une méthode acceptable.
- DORS/82-769, art. 4
C.04.572 Il est interdit de vendre une suspension d’insuline-zinc d’absorption prolongée à moins
a) qu’elle ne soit offerte dans une fiole d’une capacité approximative de 10 centimètres cubes, laquelle doit présenter un excédent de volume permettant d’en retirer 10 centimètres cubes; et
b) que chaque centimètre cube de ladite suspension ne fournisse, quand le précipité est répandu uniformément dans la suspension,
(i) 40 unités internationales d’insuline,
(ii) 80 unités internationales d’insuline, ou
(iii) 100 unités internationales d’insuline.
- DORS/82-769, art. 4
C.04.573 (1) Le manufacturier ne doit pas vendre une suspension d’insuline-zinc d’absorption prolongée à moins qu’il
a) n’ait procuré au ministre, en conformité du paragraphe (2), une présentation relative à ladite préparation, sous une forme et dans une teneur qui soient à la satisfaction du ministre;
b) n’ait fourni au ministre les renseignements supplémentaires que celui-ci pourrait lui avoir demandés; et
c) n’ait reçu du ministre un avis portant que les renseignements contenus dans la présentation sont conformes aux exigences du présent article.
(2) Une présentation soumise en exécution du paragraphe (1) doit contenir au moins,
a) à l’égard de chaque maître-lot d’insuline ou de cristaux d’insuline-zinc ayant servi à la fabrication de la suspension d’insuline-zinc d’absorption prolongée,
(i) les protocoles du titrage de l’activité exprimée en unités internationales par centimètre cube, dans le cas de l’insuline, et en unités internationales par milligramme, dans le cas des cristaux d’insuline-zinc,
(ii) un rapport de la teneur en humidité, exprimée en pourcentage et déterminée par dessiccation à poids constant à 100 °C, dans le cas des cristaux d’insuline-zinc, et
(iii) des rapports du dosage de la teneur en azote en milligrammes et de la teneur en zinc en milligrammes par 1 000 unités internationales d’insuline;
b) à l’égard du premier lot fini de suspension d’insuline-zinc d’absorption prolongée préparé avec chaque maître-lot d’insuline ou de cristaux d’insuline-zinc,
(i) un rapport sur la quantité de chaque composant entrant dans la préparation,
(ii) un rapport du dosage de la teneur en azote exprimée en milligrammes par centimètre cube ou par 1 000 unités internationales d’insuline,
(iii) un rapport du dosage de la teneur en zinc exprimée en milligrammes par centimètre cube ou par 1 000 unités internationales d’insuline,
(iv) un rapport de la teneur en insuline du liquide surnageant après élimination du précipité en suspension, exprimé en unités internationales par centimètre cube,
(v) un rapport sur la détermination de la proportion de l’azote dans le composant cristallin du précipité en suspension,
(vi) un rapport du dosage de la teneur en zinc du liquide surnageant après élimination du précipité en suspension,
(vii) un rapport sur la détermination du pH, et
(viii) un rapport sur l’apparence au microscope du précipité en suspension; et,
c) à l’égard du premier remplissage du premier lot fini de suspension d’insuline-zinc d’absorption prolongée préparée avec chaque maître-lot d’insuline ou de cristaux d’insuline-zinc,
(i) un rapport sur la détermination du pH,
(ii) un rapport sur l’examen du précipité au microscope,
(iii) un rapport sur son identification faite d’après une méthode acceptable.
(iv) [Abrogé, DORS/95-203, art. 5]
- DORS/82-769, art. 4
- DORS/95-203, art. 5
- DORS/97-12, art. 61
- DORS/2018-69, art. 27, 31(A) et 32(F)
C.04.574 La date limite d’utilisation imprimée sur les étiquettes intérieure et extérieure de chaque emballage de suspension d’insuline-zinc d’absorption prolongée, ne doit pas dépasser deux ans après la date du remplissage du contenant immédiat.
- DORS/82-769, art. 4
Insuline-globine avec zinc
C.04.575 La préparation insulinique appelée insuline-globine avec zinc doit être une solution stérile d’insuline modifiée par addition de globine préparée avec du sang de boeuf, sous forme de chlorhydrate de globine, et de zinc; cette préparation doit être un liquide limpide, jaunâtre ou presque incolore, exempt de matière insoluble et suffisamment exempt de turbidité, avoir un pH d’au moins 3,4 et d’au plus 3,8 et doit renfermer,
a) en poids par volume, au moins 1,3 pour cent et au plus 1,7 pour cent de glycérine, et,
(i) soit au moins 0,15 pour cent et au plus 0,20 pour cent de crésol,
(ii) soit au moins 0,20 pour cent et au plus 0,26 pour cent de phénol; et,
b) d’après une méthode acceptable, pour 1 000 unités internationales d’insuline,
(i) au plus 15,0 milligrammes d’azote total,
(ii) au moins 36,0 milligrammes et au plus 40,0 milligrammes de globine, calculée à 6,0 fois la teneur en azote de globine, et
(iii) au moins 2,5 milligrammes et au plus 3,5 milligrammes de zinc.
- DORS/82-769, art. 4
C.04.576 Le chlorhydrate de globine servant à la préparation de l’insuline-globine avec zinc doit renfermer au moins 16,0 pour cent et au plus 17,5 pour cent d’azote, calculée sur la matière desséchée, exempte de cendres et d’acide chlorhydrique, et ne doit pas avoir une teneur en cendres de plus de 0,3 pour cent, d’après une méthode acceptable.
- DORS/82-769, art. 4
C.04.577 L’insuline servant à la préparation de l’insuline-globine avec zinc doit provenir d’un ou de plusieurs maîtres-lots et doit être en quantité suffisante pour fournir soit 40, soit 80 unités internationales d’insuline par centimètre cube d’insuline-globine avec zinc.
- DORS/82-769, art. 4
C.04.578 (1) L’étalon canadien pour l’insuline-globine avec zinc doit être l’étalon adopté de temps à autre par le ministre pour ladite préparation.
(2) À la demande du titulaire de licence d’établissement, le ministre doit lui procurer un échantillon de l’étalon canadien et les directives nécessaires pour faire des essais comparatifs.
(3) L’essai de la réaction biologique de l’insuline-globine avec zinc doit être fait suivant une méthode acceptable et cette réaction biologique doit être comparable à la réaction biologique de l’échantillon et l’étalon canadien procuré par le ministre.
- DORS/82-769, art. 4
- DORS/97-12, art. 64
- DORS/2018-69, art. 31(A) et 32(F)
C.04.579 Il est interdit de vendre de l’insuline-globine avec zinc à moins
a) qu’elle ne soit offerte dans une fiole d’une capacité approximative de 10 centimètres cubes, laquelle doit présenter un excédent de volume permettant d’en retirer 10 centimètres cubes; et
b) que chaque centimètre cube de ladite insuline-globine ne fournisse
(i) 40 unités internationales d’insuline, ou
(ii) 80 unités internationales d’insuline.
- DORS/82-769, art. 4
C.04.580 (1) Le manufacturier ne doit pas vendre de l’insuline-globine avec zinc à moins qu’il
a) n’ait procuré au ministre, en conformité du paragraphe (2), une présentation relative à ladite préparation, sous une forme et dans une teneur qui soient à la satisfaction du ministre;
b) n’ait fourni au ministre les renseignements supplémentaires que celui-ci pourrait lui avoir demandés; et
c) n’ait reçu du ministre un avis portant que les renseignements contenus dans la présentation sont conformes aux exigences du présent article.
(2) Une présentation soumise en exécution du paragraphe (1) doit contenir au moins,
a) à l’égard de chaque maître-lot d’insuline ou de cristaux d’insuline-zinc ayant servi à la fabrication de l’insuline-globine avec zinc,
(i) les protocoles du titrage de l’activité exprimée en unités internationales par centimètre cube, dans le cas de l’insuline, et en unités internationales par milligramme, dans le cas des cristaux d’insuline-zinc,
(ii) un rapport de la teneur en humidité, exprimée en pourcentage et déterminée par dessiccation à poids constant à 100 °C, dans le cas des cristaux d’insuline-zinc, et
(iii) des rapports du dosage de la teneur en azote en milligrammes et de la teneur en zinc en milligrammes par 1 000 unités internationales d’insuline;
b) à l’égard du maître-lot de chlorhydrate de globine ayant servi à la préparation de l’insuline-globine avec zinc, des rapports de dosage de
(i) la teneur en azote exprimée en pourcentage et calculée sur la matière desséchée et exempte de cendres et d’acide chlorhydrique,
(ii) la teneur en chlorure exprimée en pourcentage et calculée comme chlorhydrate, et
(iii) la teneur en cendres, exprimée en pourcentage;
c) à l’égard des composants ayant servi à la préparation du mélange d’essai de l’insuline-globine avec zinc, un rapport sur
(i) la quantité d’insuline, en grammes ou en unités internationales,
(ii) la quantité de zinc, en grammes ou en milligrammes, par 1 000 unités internationales d’insuline,
(iii) la quantité de chlorhydrate de globine, en grammes ou en milligrammes, par 1 000 unités internationales d’insuline, et
(iv) le volume de la préparation, en centimètres cubes ou en litres;
d) à l’égard du mélange d’essai de l’insuline-globine avec zinc,
(i) un rapport du dosage de la teneur en azote exprimée en milligrammes par centimètre cube ou par 1 000 unités internationales d’insuline,
(ii) un rapport du dosage de la teneur en zinc exprimée en milligrammes par centimètre cube ou par 1 000 unités internationales d’insuline,
(iii) les protocoles de la réaction biologique montrant le retardement de l’effet insulinique, et
(iv) un rapport sur la détermination du pH;
e) à l’égard du premier lot fini d’insuline-globine avec zinc préparée avec chaque mélange d’essai de l’insuline-globine avec zinc, un rapport sur la quantité de chaque composant entrant dans la préparation; et,
f) à l’égard du premier remplissage du premier lot fini d’insuline-globine avec zinc préparée avec chaque mélange d’essai de l’insuline-globine avec zinc,
(i) un rapport du dosage de la teneur en azote exprimée en milligrammes par centimètre cube ou par 1 000 unités internationales d’insuline,
(ii) un rapport du dosage de la teneur en zinc exprimée en milligrammes par centimètre cube ou par 1 000 unités internationales d’insuline,
(iii) un rapport sur la détermination du pH.
(iv) [Abrogé, DORS/95-203, art. 6]
- DORS/82-769, art. 4: DORS/95-203, art. 6
- DORS/97-12, art. 61
- DORS/2018-69, art. 27, 31(A) et 32(F)
C.04.581 La date limite d’utilisation imprimée sur les étiquettes intérieure et extérieure de chaque emballage d’insuline-globine avec zinc ne doit pas dépasser deux ans après la date du remplissage du contenant immédiat.
- DORS/82-769, art. 4
Insuline NPH ou insuline isophane
C.04.582 La préparation insulinique appelée « Insuline NPH ou insuline isophane » doit être une préparation stérile de cristaux en forme de bâtonnets renfermant de l’insuline, de la protamine et du zinc en suspension dans un milieu aqueux tamponné, doit avoir un pH d’au moins 7,0 et d’au plus 7,8 et doit renfermer,
a) en poids par volume, au moins 0,15 pour cent et au plus 0,25 pour cent de phosphate disodique anhydre et,
(i) soit au moins 1,4 pour cent et au plus 1,8 pour cent de glycérine, au moins 0,15 pour cent et au plus 0,17 pour cent de métacrésol et au moins 0,06 pour cent et au plus 0,07 pour cent de phénol,
(ii) soit au moins 0,40 pour cent et au plus 0,45 pour cent de chlorure de sodium, au moins 0,7 pour cent et au plus 0,9 pour cent de glycérine et au moins 0,18 pour cent et au plus 0,22 pour cent de métacrésol; et,
b) d’après une méthode acceptable, par 1 000 unités internationales d’insuline,
(i) au plus 8,5 milligrammes d’azote,
(ii) au moins 3,0 milligrammes et au plus 6,0 milligrammes de protamine, sous réserve que le rapport de la protamine à l’insuline ne doit pas être inférieur au rapport isophane et qu’il ne doit pas dépasser le rapport isophane de plus de 10 pour cent, et,
(iii) au moins 0,10 milligramme et au plus 0,40 milligramme de zinc, et
(iv) aucune activité protéasique importante pour la stabilité de l’insuline NPH.
- DORS/82-769, art. 4
- DORS/85-715, art. 11
C.04.583 La protamine servant à la préparation de l’insuline NPH doit provenir du sperme ou des testicules arrivés à maturité de poissons appartenant à la famille Salmonidae, genre Oncorhynchus Suckley ou Salmo Linné.
- DORS/82-769, art. 4
C.04.584 Rapport isophane signifie le nombre minimum de milligrammes de protamine requis pour précipiter 100 unités internationales d’insuline et doit être déterminé par une méthode acceptable.
- DORS/82-769, art. 4
C.04.585 L’insuline servant à la préparation de l’insuline NPH doit provenir d’un ou de plusieurs maîtres-lots et doit être en quantité suffisante pour fournir soit 40, soit 80, soit 100 unités internationales d’insuline par centimètre cube de la préparation, quand le précipité est répandu uniformément dans la suspension.
- DORS/82-769, art. 4
C.04.586 Le liquide limpide surnageant obtenu de l’insuline NPH doit renfermer au plus 0,4 unité internationale d’insuline par centimètre cube, quand l’activité de la préparation insulinique est de 40 unités par centimètre cube, au plus 0,6 unité internationale d’insuline par centimètre cube, quand l’activité de ladite préparation est de 80 unités par centimètre cube, et au plus 0,7 unité internationale d’insuline par centimètre cube, quand l’activité de ladite préparation est de 100 unités par centimètre cube, d’après une méthode acceptable.
- DORS/82-769, art. 4
C.04.587 Il est interdit de vendre de l’insuline NPH à moins
a) qu’elle ne soit offerte dans une fiole d’une capacité approximative de 10 centimètres cubes, laquelle doit présenter un excédent de volume permettant d’en retirer 10 centimètres cubes; et
b) que chaque centimètre cube de ladite insuline ne fournisse
(i) 40 unités internationales d’insuline,
(ii) 80 unités internationales d’insuline, ou
(iii) 100 unités internationales d’insuline.
- DORS/82-769, art. 4
C.04.588 (1) Le manufacturier ne doit pas vendre de l’insuline NPH à moins qu’il
a) n’ait procuré au ministre, en conformité du paragraphe (2), une présentation relative à ladite préparation, sous une forme et dans une teneur qui soient à la satisfaction du ministre;
b) n’ait fourni au ministre les renseignements supplémentaires que celui-ci pourrait lui avoir demandés; et
c) n’ait reçu du ministre un avis portant que les renseignements contenus dans la présentation sont conformes aux exigences du présent article.
(2) Une présentation soumise en exécution du paragraphe (1) doit contenir au moins,
a) à l’égard de chaque maître-lot de cristaux d’insuline-zinc ayant servi à la fabrication de l’insuline NPH,
(i) les protocoles du titrage de l’activité exprimée en unités internationales par milligramme,
(ii) un rapport de la teneur en humidité, exprimée en pourcentage et déterminée par dessiccation à poids constant à 100 °C, et
(iii) des rapports du dosage de la teneur en azote en milligrammes et de la teneur en zinc en milligrammes par 1 000 unités internationales d’insuline;
b) à l’égard du maître-lot de protamine, une déclaration du rapport isophane pour l’insuline ayant servi à la préparation de l’insuline NPH;
c) à l’égard du mélange d’essai d’insuline NPH,
(i) un rapport du dosage de la teneur en azote exprimée en milligrammes par centimètre cube ou par 1 000 unités internationales d’insuline,
(ii) un rapport du dosage de la teneur en zinc exprimée en milligrammes par centimètre cube ou par 1 000 unités internationales d’insuline,
(iii) un rapport de la teneur en insuline exprimée en unités internationales par centimètre cube du liquide surnageant après élimination du précipité en suspension,
(iv) un rapport sur la détermination du pH, et
(v) un rapport sur l’examen du précipité au microscope;
d) à l’égard du premier lot fini d’insuline NPH préparée avec chaque mélange d’essai d’insuline NPH, un rapport sur la quantité de chaque composant entrant dans la préparation; et,
e) à l’égard du premier remplissage du premier lot fini d’insuline NPH préparée avec chaque mélange d’essai d’insuline NPH,
(i) un rapport du dosage de la teneur en azote exprimée en milligrammes par centimètre cube ou par 1 000 unités internationales d’insuline,
(ii) un rapport du dosage de la teneur en zinc exprimée en milligrammes par centimètre cube ou par 1 000 unités internationales d’insuline,
(iii) un rapport sur la détermination du pH,
(iv) un rapport sur l’examen du précipité au microscope,
(v) un rapport sur l’identification faite d’après une méthode acceptable.
(vi) [Abrogé, DORS/95-203, art. 7]
- DORS/82-769, art. 4
- DORS/95-203, art. 7
- DORS/97-12, art. 61
- DORS/2018-69, art. 27, 31(A) et 32(F)
C.04.589 La date limite d’utilisation imprimée sur les étiquettes intérieure et extérieure de l’insuline NPH ne doit pas dépasser deux ans après la date du remplissage du contenant immédiat.
- DORS/82-769, art. 4
Insuline-zinc-protamine
C.04.590 La préparation insulinique appelée Insuline-zinc-protamine doit être une suspension blanche et stérile répandue dans un milieu aqueux tamponné et renfermant de l’insuline modifiée par addition de protamine et de zinc, doit avoir un pH d’au moins 7,1 et d’au plus 7,4 et doit renfermer,
a) en poids par volume,
(i) au moins 0,15 pour cent et au plus 0,25 pour cent de phosphate disodique anhydre,
(ii) au moins 1,4 pour cent et au plus 1,8 pour cent de glycérine, et,
(iii) soit au moins 0,18 pour cent et au plus 0,22 pour cent de crésol, soit au moins 0,22 pour cent et au plus 0,28 pour cent de phénol; et,
b) d’après une méthode acceptable, par 1 000 unités internationales d’insuline,
(i) au plus 12,5 milligrammes d’azote total,
(ii) au moins 10,0 milligrammes et au plus 15,0 milligrammes de protamine, et
(iii) au moins 1,7 milligramme et au plus 2,5 milligrammes de zinc.
- DORS/82-769, art. 4
C.04.591 La protamine servant à la préparation de l’insuline-zinc-protamine doit provenir du sperme ou des testicules arrivés à maturité de poissons appartenant à la famille Salmonidae, genre Oncorhynchus Suckley, ou Salmo Linné.
- DORS/82-769, art. 4
C.04.592 L’insuline servant à la préparation de l’insuline-zinc-protamine doit provenir d’un ou de plusieurs maîtres-lots et doit être en quantité suffisante pour fournir soit 40, soit 80, soit 100 unités internationales d’insuline par centimètre cube de la préparation, quand le précipité est répandu uniformément dans la suspension.
- DORS/82-769, art. 4
C.04.593 (1) L’étalon canadien pour l’insuline-zinc-protamine doit être l’étalon adopté de temps à autre par le ministre pour ladite préparation.
(2) À la demande du titulaire de licence d’établissement, le ministre doit lui procurer un échantillon de l’étalon canadien et les directives nécessaires pour faire des essais comparatifs.
(3) L’essai de la réaction biologique de l’insuline-zinc-protamine doit être faite suivant une méthode acceptable et cette réaction biologique doit être comparable à la réaction biologique de l’étalon canadien procuré par le ministre.
- DORS/82-769, art. 4
- DORS/97-12, art. 64
- DORS/2018-69, art. 31(A) et 32(F)
C.04.594 Il est interdit de vendre de l’insuline-zinc-protamine à moins
a) qu’elle ne soit offerte dans une fiole d’une capacité approximative de 10 centimètres cubes, laquelle doit présenter un excédent de volume permettant d’en retirer 10 centimètres cubes; et
b) que chaque centimètre cube de ladite insuline ne fournisse
(i) 40 unités internationales d’insuline,
(ii) 80 unités internationales d’insuline, ou
(iii) 100 unités internationales d’insuline.
- DORS/82-769, art. 4
C.04.595 (1) Le manufacturier ne doit pas vendre de l’insuline-zinc-protamine à moins qu’il
a) n’ait procuré au ministre, en conformité du paragraphe (2), une présentation relative à ladite préparation, sous une forme et dans une teneur qui soient à la satisfaction du ministre;
b) n’ait fourni au ministre les renseignements supplémentaires que celui-ci pourrait lui avoir demandés; et
c) n’ait reçu du ministre un avis portant que les renseignements contenus dans la présentation sont conformes aux exigences du présent article.
(2) Une présentation soumise en exécution du paragraphe (1) doit contenir au moins,
a) à l’égard de chaque maître-lot d’insuline ou de cristaux d’insuline-zinc ayant servi à la fabrication de l’insuline-zinc-protamine,
(i) les protocoles du titrage de l’activité exprimée en unités internationales par centimètre cube, dans le cas de l’insuline, et en unités internationales par milligramme, dans le cas des cristaux d’insuline-zinc,
(ii) un rapport de la teneur en humidité, exprimée en pourcentage et déterminée par dessiccation à poids constant à 100 °C, et dans le cas des cristaux d’insuline-zinc, et
(iii) des rapports de dosage de la teneur en azote en milligrammes et de la teneur en zinc en milligrammes par 1 000 unités internationales d’insuline;
b) à l’égard de composants ayant servi à la préparation du mélange d’essai de l’insuline-zinc-protamine, un rapport sur
(i) la quantité d’insuline, en grammes ou en unités internationales,
(ii) la quantité de zinc, en grammes ou en milligrammes par 1 000 unités internationales d’insuline,
(iii) la quantité de protamine, en grammes ou en milligrammes par 1 000 unités internationales d’insuline, et
(iv) le volume de la préparation, en centimètres cubes ou en litres;
c) à l’égard du mélange d’essai de l’insuline-zinc-protamine,
(i) un rapport du dosage de la teneur en azote exprimée en milligrammes par centimètre cube ou par 1 000 unités internationales d’insuline,
(ii) un rapport du dosage de la teneur en zinc exprimée en milligrammes par centimètre cube ou par 1 000 unités internationales d’insuline,
(iii) les protocoles de la réaction biologique montrant le retardement de l’effet insulinique, et
(iv) un rapport sur la détermination du pH;
d) à l’égard du premier lot fini d’insuline-zinc-protamine préparée avec chaque mélange d’essai d’insuline-zinc-protamine, un rapport sur la quantité de chaque composant entrant dans la préparation; et,
e) à l’égard du premier remplissage du premier lot fini d’insuline-zinc-protamine préparée avec chaque mélange d’essai de l’insuline-zinc-protamine,
(i) un rapport du dosage de la teneur en azote exprimée en milligrammes par centimètre cube ou par 1 000 unités internationales,
(ii) un rapport du dosage de la teneur en zinc exprimée en milligrammes par centimètre cube ou par 1 000 unités internationales,
(iii) un rapport sur la détermination du pH.
(iv) [Abrogé, DORS/95-203, art. 8]
- DORS/82-769, art. 4
- DORS/95-203, art. 8
- DORS/97-12, art. 61
- DORS/2018-69, art. 27, 31(A) et 32(F)
C.04.596 La date limite d’utilisation imprimée sur les étiquettes intérieure et extérieure de chaque emballage d’insuline-zinc-protamine ne doit pas dépasser deux ans après la date du remplissage du contenant immédiat.
- DORS/82-769, art. 4
Insuline sulfurisée
C.04.597 La préparation insulinique appelée insuline sulfurisée doit être une préparation isotonique limpide ou légèrement trouble, incolore ou presque incolore, stérile, faite avec des cristaux d’insuline-zinc chimiquement modifiés par l’action de l’acide sulfurique, doit avoir un pH d’au moins 6,0 et d’au plus 7,0 et doit renfermer,
a) en poids par volume,
(i) au moins 0,6 pour cent et au plus 1,0 pour cent de chlorure de sodium, et
(ii) au moins 0,2 pour cent et au plus 0,3 pour cent de phénol; et,
b) d’après une méthode acceptable,
(i) au plus 200 milligrammes de protéine par 1 000 unités internationales d’insuline, et
(ii) au moins 5,5 et au plus 6,5 groupements sulfurés par molécule d’insuline.
- DORS/82-769, art. 4
C.04.598 Rapport de neutralisation signifie la quantité de sérum antiglobine de boeuf requise pour neutraliser une unité d’insuline sulfurisée divisée par la quantité requise pour neutraliser une unité d’insuline de boeuf et doit être déterminé par une méthode acceptable.
- DORS/82-769, art. 4
C.04.599 Le rapport de neutralisation de l’insuline sulfurisée doit être au moins de 4 à 1.
- DORS/82-769, art. 4
C.04.600 Il est interdit de vendre de l’insuline sulfurisée à moins
a) qu’elle ne soit offerte dans une fiole d’une capacité approximative de 10 centimètres cubes, laquelle doit présenter un excédent de volume permettant d’en retirer 10 centimètres cubes; et
b) que chaque centimètre cube de ladite insuline ne fournisse 100 unités internationales d’insuline, d’après une méthode acceptable.
- DORS/82-769, art. 4
C.04.601 (1) Le manufacturier ne doit pas vendre de l’insuline sulfurisée à moins qu’il
a) n’ait procuré au ministre, en conformité du paragraphe (2), une présentation relative à ladite préparation, sous une forme et dans une teneur qui soient à la satisfaction du ministre;
b) n’ait fourni au ministre les renseignements supplémentaires que celui-ci pourrait lui avoir demandés; et
c) n’ait reçu du ministre un avis portant que les renseignements contenus dans la présentation sont conformes aux exigences du présent article.
(2) Une présentation soumise en exécution du paragraphe (1) doit contenir au moins,
a) à l’égard de chaque maître-lot de cristaux d’insuline-zinc ayant servi à la fabrication de l’insuline sulfurisée,
(i) les protocoles du titrage de l’activité exprimée en unités internationales par milligramme,
(ii) un rapport de la teneur en humidité, exprimée en pourcentage et déterminée par dessiccation à poids constant à 100 °C, et
(iii) des rapports du dosage de la teneur en azote en milligrammes et de la teneur en zinc en milligrammes par 1 000 unités internationales d’insuline; et,
b) à l’égard de chaque lot d’insuline sulfurisée préparée avec chaque maître-lot de cristaux d’insuline-zinc,
(i) un rapport sur la quantité de chaque composant,
(ii) un rapport sur la teneur en protéines exprimée en milligrammes par 1 000 unités internationales d’insuline,
(iii) un rapport sur la détermination du rapport de neutralisation,
(iv) un rapport sur la détermination du nombre de groupements sulfurés par molécule d’insuline,
(v) les protocoles du titrage de l’activité exprimée en unités internationales par centimètre cube,
(vi) un rapport sur la détermination du pH.
(vii) [Abrogé, DORS/95-203, art. 9]
- DORS/82-769, art. 4
- DORS/95-203, art. 9
- DORS/97-12, art. 61
- DORS/2018-69, art. 27, 31(A) et 32(F)
C.04.602 La date limite d’utilisation imprimée sur les étiquettes intérieure et extérieure de chaque emballage d’insuline-sulfurisée ne doit pas dépasser deux ans après la date du remplissage du contenant immédiat.
- DORS/80-545, art. 4
- DORS/82-769, art. 4
Étiquetage des préparations insuliniques
- DORS/82-769, art. 8
C.04.650 L’emballeur-étiqueteur d’injection insulinique ne peut mettre sur l’étiquette de cette préparation insulinique « Insuline faite avec des cristaux d’insuline-zinc » que si elle a été préparée avec des cristaux d’insuline-zinc.
- DORS/82-769, art. 7
- DORS/97-12, art. 65
C.04.651 L’emballeur-étiqueteur d’une préparation insulinique doit faire imprimer les renseignements requis par le présent règlement à la fois sur les étiquettes intérieure et extérieure de chaque emballage de cette préparation insulinique, de la façon indiquée au tableau du présent article.
TABLEAU
| Poste no | Colonne I | Colonne II | Colonne III |
|---|---|---|---|
| Préparation insulinique | Activité de la préparation | Nécessités d’impression pour l’étiquette | |
| 1 | Injection insulinique non étiquetée de la façon indiquée au poste 2 | a) 40 unités par cc | a) caractères noirs sur fond jaune |
| b) 80 unités par cc | b) caractères noirs sur fond vert | ||
| c) 100 unités par cc | c) caractères noirs sur fond blanc | ||
| 2 | Injection insulinique dont l’étiquette porte : « Insuline faite avec des cristaux d’insuline... zinc » | a) 40 unités par cc | a) caractères rouges sur fond gris |
| b) 80 unités par cc | b) caractères verts sur fond gris | ||
| c) 100 unités par cc | c) caractères noirs sur fond blanc | ||
| 3 | Suspension d’insuline-zinc d’absorption rapide, suspension d’insuline-zinc d’absorption moyenne et suspension d’insuline-zinc d’absorption prolongée | a) 40 unités par cc | a) caractères rouges sur fond lavande ainsi qu’une marque ou un symbole distinctifs |
| b) 80 unités par cc | b) caractères verts sur fond lavande ainsi qu’une marque ou un symbole distinctifs | ||
| c) 100 unités par cc | c) caractères noirs sur fond blanc | ||
| 4 | Insuline-globine avec zinc | a) 40 unités par cc | a) caractères rouges sur fond brun, sauf que l’expression « 40 unités par centimètre cube » peut être imprimée en caractères blancs sur fond rouge |
| b) 80 unités par cc | b) caractères verts sur fond brun, sauf que l’expression « 80 unités par centimètre cube » peut être imprimée en caractères blancs sur fond vert | ||
| 5 | Insuline NPH | a) 40 unités par cc | a) caractères rouges sur fond bleu |
| b) 80 unités par cc | b) caractères verts sur fond bleu | ||
| c) 100 unités par cc | c) caractères noirs sur fond blanc | ||
| 6 | Insuline-zinc-protamine | a) 40 unités par cc | a) caractères rouges sur fond blanc |
| b) 80 unités par cc | b) caractères verts sur fond blanc | ||
| c) 100 unités par cc | c) caractères noirs sur fond blanc | ||
| 7 | Insuline sulfurisée | 100 unités par cc | caractères noirs sur fond blanc ainsi que l’avertissement « Mise en garde... Non destiné à l’usage courant... Voir le feuillet de l’emballage » |
- DORS/82-769, art. 7
- DORS/97-12, art. 65
C.04.652 L’emballeur-étiqueteur d’une préparation insulinique doit faire imprimer sur l’étiquette extérieure de chaque emballage de ladite préparation des directives demandant de garder celle-ci au réfrigérateur à une température comprise entre 35 ° et 50 °F (2 ° et 10 °C) et d’éviter de l’exposer à être congelée.
- DORS/82-769, art. 7
- DORS/97-12, art. 65
C.04.653 L’emballeur-étiqueteur d’une préparation insulinique qui consiste en un précipité en suspension dans un milieu aqueux tamponné doit faire imprimer sur l’étiquette intérieure de chaque emballage de ladite préparation l’avertissement « Agiter avec soin ».
- DORS/82-769, art. 7
- DORS/97-12, art. 65
C.04.654 L’emballeur-étiqueteur d’une préparation insulinique peut, au lieu de faire imprimer les directives appropriées d’emploi sur les étiquettes intérieure et extérieure de ladite préparation, comme l’exige le sous-alinéa C.04.019a)(vii), les faire imprimer dans un prospectus explicatif rédigé en conformité avec l’article C.04.655, auquel cas, il doit
a) inclure un exemplaire du prospectus dans l’emballage contenant la préparation; et
b) mentionner sur l’étiquette extérieure de l’emballage qu’une telle circulaire y est incluse.
- DORS/82-769, art. 7 et 9
- DORS/97-12, art. 65
C.04.655 Le prospectus explicatif visé à l’article C.04.654 doit contenir au moins les renseignements suivants :
a) un avertissement disant que
(i) le traitement du diabète sucré exige la surveillance et l’examen du médecin,
(ii) que les préparations insuliniques doivent être employées uniquement de la façon prescrite par le médecin à chaque malade, à la lumière des quantités de sucre trouvées dans le sang et l’urine, et
(iii) que les directives du médecin au sujet du régime alimentaire, de la posologie, du repos et de l’exercice doivent être suivies minutieusement;
b) une description de la méthode à suivre pour retirer la préparation insulinique de la fiole, y compris le mode de stérilisation de la seringue et de l’aiguille, du bouchon de la fiole et du point d’injection;
c) un avertissement expliquant que les injections doivent être sous-cutanées, et non pas intraveineuses ni intramusculaires, et une mise en garde contre des injections successives au même endroit;
d) un avertissement disant que les doses sont spécifiées en termes d’unités d’activité par centimètre cube et que le volume de chaque dose dépend de l’activité en unités par centimètre cube déclarée sur l’étiquette de la préparation insulinique et que, pour ces raisons, il importe que le malade comprenne bien la graduation des seringues;
e) une brève explication de l’hypoglycémie ainsi que des mesures d’urgence que peuvent prendre les malades et ceux qui les soignent en cas de réactions hypoglycémiques;
f) un avertissement sur l’apparition possible de réactions indésirables par suite de maladie ou d’infection, de l’omission d’un repas et d’un manque de la préparation insulinique;
g) un avertissement de n’employer aucune autre sorte de préparation insulinique que celle qui a été prescrite par le médecin;
h) un avertissement de ne pas commencer à se servir d’un emballage après la date limite d’utilisation imprimée sur l’emballage;
i) un avertissement recommandant d’employer le contenu d’une façon aussi continue que possible et de jeter toute fiole entamée qui n’a pas servi depuis plusieurs semaines;
j) un avertissement signalant l’importance de consulter régulièrement un médecin et de suivre fidèlement ses directives;
k) dans le cas de préparations insuliniques consistant en une solution limpide, incolore ou presque incolore, exempte de turbidité et matière insoluble, un avertissement disant que, si le contenu d’une fiole devient brouillé ou trouble, il faut cesser d’utiliser cette fiole;
l) dans le cas de préparations insuliniques consistant en un précipité en suspension dans un milieu aqueux tamponné, un avertissement expliquant qu’il est nécessaire d’agiter la fiole avec soin avant d’en retirer une dose et signalant que, si le contenu prend une apparence grumeleuse ou granulée ou s’il s’est formé un dépôt de particules sur la paroi du contenant, il faut cesser d’utiliser cette fiole;
m) des directives demandant de garder la préparation insulinique au réfrigérateur à une température comprise entre 35 ° et 50 °F (2 ° et 10 °C) et de ne pas l’exposer à être congelée; et,
n) dans le cas de l’insuline sulfurisée, un avertissement expliquant que cette préparation insulinique n’est pas destinée à l’usage courant mais est une insuline chimiquement modifiée qui peut être plus efficace que les préparations insuliniques usuelles chez certains diabétiques résistant ou allergiques à l’insuline.
- DORS/82-769, art. 7 et 10
C.04.656 (1) Nonobstant l’article C.04.554, un titulaire de licence d’établissement peut vendre de l’injection insulinique faite avec des cristaux d’insuline-zinc et offerte dans des fioles d’une capacité approximative de 20 centimètres cubes, dont chacune
a) contient un excédent de volume permettant d’en retirer 20 centimètres cubes, et
b) fournit 500 unités internationales d’insuline par centimètre cube,
si
c) nonobstant l’article C.04.651, les étiquettes intérieure et extérieure sont toutes deux imprimées en caractères noirs sur fond blanc et portent en surcharge d’étroites bandes diagonales brunes et blanches, en nombre d’au moins cinq et d’au plus 20 au pouce;
d) les étiquettes intérieure et extérieure portent toutes deux la mention « Avertissement — Activité élevée — Ne pas employer aux fins ordinaires »; et
e) chaque emballage contient un prospectus explicatif conforme aux exigences de l’article C.04.655 et portant de plus :
(i) au début du prospectus, l’avertissement :
« Mise en garde — Cette préparation insulinique contient 500 unités internationales d’insuline par centimètre cube. Mettre un soin extrême à mesurer les doses, car une dose excessive donnée par inadvertance peut provoquer un état de choc irréversible. L’employer autrement que sous la surveillance constante d’un médecin peut avoir de graves conséquences. À moins que cette préparation ne soit spécifiquement prescrite, les malades ne devraient jamais l’employer à la place de quelque autre préparation insulinique. »,
(ii) un avertissement de ne pas administrer par voie intraveineuse de l’insuline faite avec des cristaux d’insuline-zinc à 500 unités internationales par centimètre cube, et
(iii) un exposé des renseignements nécessaires au médecin pour l’administration sûre et efficace de ladite drogue dans le traitement par choc insulinique et dans le traitement des diabétiques offrant une grande résistance à l’insuline (besoin quotidien de plus de 200 unités internationales d’insuline).
(2) [Abrogé, DORS/95-203, art. 10]
- DORS/82-769, art. 7 et 11
- DORS/95-203, art. 10
- DORS/97-12, art. 64
Extraits hypophysaires (lobe antérieur)
- DORS/82-769, art. 14
C.04.675 L’extrait hypophysaire (lobe antérieur) doit comprendre tous les produits naturels préparés à partir du lobe antérieur de la glande hypophysaire d’animaux, et possédant des propriétés physiologiques associées aux hormones du lobe antérieur de la glande hypophysaire, et leurs noms propres doivent être
a) Hormone adrénocorticotrope, Corticotrophine,
b) Hormone thyrotrope, Thyrotrophine,
c) Hormone pituitaire de la croissance, Somatotrophine,
d) Hormone lactogène, Prolactine,
e) Hormone gonadotrope, Gonadotrophine, suivi de qualificatifs pour indiquer l’activité gonadotrope que possède l’extrait,
et, s’il s’agit d’extrait hypophysaire (lobe antérieur) non purifié,
f) Extrait hypophysaire (lobe antérieur) suivi de qualificatifs qui indiquent les propriétés physiologiques attribuées audit extrait.
- DORS/82-769, art. 13
C.04.676 Les étalons de l’extrait hypophysaire (lobe antérieur) doivent être
a) l’étalon international;
b) dans le cas où il n’y a pas d’étalon international, l’étalon canadien qui doit être établi et conservé par le ministre, lequel peut, sur demande, en fournir des portions pour fins d’essais comparatifs; et
c) dans le cas où il n’y a pas d’étalon international ni d’étalon canadien, un étalon provisoire qui doit consister en une quantité appropriée du produit, soumise par le distributeur visé à l’alinéa C.01A.003b) au ministre, en vue du contrôle de l’uniformité du produit.
- DORS/82-769, art. 13
- DORS/97-12, art. 58
- DORS/2018-69, art. 27
C.04.677 Les étiquettes intérieure et extérieure de l’extrait hypophysaire (lobe antérieur) doivent toutes deux porter une déclaration de l’activité en fonction de l’étalon d’extrait hypophysaire (lobe antérieur) prévu à l’article C.04.676, déterminée par une méthode acceptable; toutefois, lorsqu’il n’y a pas d’étalon pour un extrait hypophysaire de lobe antérieur, le distributeur visé à l’alinéa C.01A.003b) doit adjoindre à tout emballage d’extrait hypophysaire de lobe antérieur une déclaration acceptable de l’unité d’activité et de la méthode de dosage employées.
- DORS/82-769, art. 13
- DORS/97-12, art. 58
- DORS/97-543, art. 6
C.04.678 Il est interdit à tout titulaire de licence d’établissement de vendre des hormones corticotrophiques pour injection sous-cutanée ou intramusculaire, à moins que la préparation n’ait été mise à l’épreuve par une méthode acceptable comportant une injection sous-cutanée et, si la préparation est recommandée pour usage intraveineux, à moins que l’étiquette n’indique la dose précise pour cet usage.
- DORS/82-769, art. 13
- DORS/97-12, art. 64
C.04.679 Est interdite la vente, comme telle, d’hormone adrénocorticotrope, d’hormone thyrotrope, d’hormone pituitaire de la croissance, d’hormone lactogène, ou d’hormone gonadotrope, qui ne sont pas suffisamment exemptes d’extrait hypophysaire (lobe antérieur) autre que celui d’après lequel l’hormone a été nommée.
- DORS/82-769, art. 13
C.04.680 L’étiquette extérieure d’un mélange de deux ou plusieurs des hormones adrénocorticotrope, thyrotrope, pituitaire de la croissance, lactogène ou gonadotrope, ou d’un mélange de l’une ou plusieurs de ces hormones avec de l’extrait hypophysaire (lobe antérieur), doit porter une mention du nom propre et de la quantité de chaque composant du mélange.
- DORS/82-769, art. 13
- DORS/93-202, art. 22
C.04.681 L’étiquette extérieure d’un extrait hypophysaire (lobe antérieur) ou d’un mélange d’extraits hypophysaires (lobe antérieur) doit porter une déclaration
a) donnant le nom de l’espèce d’animal dont proviennent les glandes ayant servi à la préparation de l’extrait hypophysaire (lobe antérieur);
b) avertissant que le produit doit être conservé à la température du réfrigérateur; et
c) sauf dans le cas des hormones gonadotropes, de n’employer ce produit que sur l’avis ou l’ordonnance d’un médecin.
- DORS/82-769, art. 13
C.04.682 Les étiquettes intérieure et extérieure d’une hormone adrénocorticotrope doivent toutes deux porter une déclaration de la voie d’administration, en plus d’être conformes aux dispositions des alinéas C.04.681a) et b).
- DORS/82-769, art. 13 et 15
C.04.683 La date limite d’utilisation d’un extrait hypophysaire (lobe antérieur) ou d’un mélange d’extraits hypophysaires (lobe antérieur) ne doit pas dépasser deux ans après la date d’épreuve satisfaisante de son activité.
- DORS/82-769, art. 13
TITRE 5Drogues destinées aux essais cliniques sur des sujets humains
Définitions
C.05.001 Les définitions qui suivent s’appliquent au présent titre.
- bonnes pratiques cliniques
bonnes pratiques cliniques Pratiques cliniques généralement reconnues visant à assurer la protection des droits, la sûreté et le bien-être des sujets d’essai clinique et d’autres personnes ainsi que les bonnes pratiques cliniques visées à l’article C.05.010. (good clinical practices)
- brochure du chercheur
brochure du chercheur Document dans lequel figurent les données précliniques et cliniques d’une drogue visées à l’alinéa C.05.005e). (investigator’s brochure)
- chercheur qualifié
chercheur qualifié La personne qui est responsable auprès du promoteur de la conduite de l’essai clinique à un lieu d’essai clinique, qui est habilitée à dispenser des soins de santé en vertu des lois de la province où ce lieu d’essai clinique est situé et qui est :
a) dans le cas d’un essai clinique portant sur une drogue destinée à être utilisée exclusivement en médecine dentaire, un médecin ou un dentiste, membre en règle d’une association médicale ou dentaire professionnelle;
b) dans tout autre cas, un médecin, membre en règle d’une association médicale professionnelle. (qualified investigator)
- comité d’éthique de la recherche
comité d’éthique de la recherche Organisme, qui n’est pas lié au promoteur, ayant les caractéristiques suivantes :
a) son principal mandat est d’approuver la tenue de projets de recherche biomédicale sur des sujets humains et d’en contrôler périodiquement le déroulement afin d’assurer la protection des droits des sujets, ainsi que leur sûreté et leur bien-être;
b) il est composé d’au moins cinq membres, la majorité de ses membres sont des citoyens canadiens ou des résidents permanents au sens de la Loi sur l’immigration et la protection des réfugiés et il compte parmi ses membres des hommes et des femmes, dont au moins :
(i) deux membres possèdent de l’expertise et de l’expérience principalement dans un domaine scientifique ainsi qu’une vaste expérience des méthodes et champs de recherche à approuver, l’un d’entre eux provenant d’une discipline des soins médicaux ou, dans le cas d’un essai clinique portant sur une drogue destinée à être utilisée exclusivement en médecine dentaire, d’une discipline des soins médicaux ou dentaires,
(ii) un membre possède des connaissances de l’éthique,
(iii) un membre possède des connaissances de la législation canadienne applicable à la recherche biomédicale à approuver,
(iv) un membre possède de l’expertise et de l’expérience principalement dans un domaine non scientifique,
(v) un membre, qui n’est pas lié au promoteur ni au lieu d’essai clinique proposé, est un individu de la collectivité ou un représentant d’un organisme intéressé aux champs de recherche à approuver. (research ethics board)
- drogue
drogue Drogue pour usage humain destinée à faire l’objet d’un essai clinique. (drug)
- essai clinique
essai clinique Recherche sur des sujets humains dont l’objet est soit de découvrir ou de vérifier les effets cliniques, pharmacologiques ou pharmacodynamiques d’une drogue pour usage humain, soit de déceler les incidents thérapeutiques liés à cette drogue, soit d’en étudier l’absorption, la distribution, le métabolisme et l’élimination ou soit d’en établir l’innocuité ou l’efficacité. (clinical trial)
- importer
importer Importer une drogue au Canada pour la vendre dans le cadre d’un essai clinique. (import)
- incident thérapeutique
incident thérapeutique Événement indésirable affectant la santé d’un sujet d’essai clinique à qui une drogue a été administrée — qui peut ou non être causé par l’administration de la drogue, — y compris toute réaction indésirable à une drogue. (adverse event)
- promoteur
promoteur Personne physique ou morale, établissement ou organisme qui mène un essai clinique. (sponsor)
- protocole
protocole Document qui expose les objectifs, le plan de travail, la méthodologie, les considérations statistiques et l’organisation d’un essai clinique. (protocol)
- réaction indésirable à une drogue
réaction indésirable à une drogue Réaction nocive et non intentionnelle à une drogue qui est provoquée par l’administration de toute dose de celle-ci. (adverse drug reaction)
- réaction indésirable grave à une drogue
réaction indésirable grave à une drogue Réaction indésirable à une drogue qui nécessite ou prolonge l’hospitalisation, entraîne une malformation congénitale ou une invalidité ou incapacité persistante ou importante, met la vie en danger ou entraîne la mort. (serious adverse drug reaction)
- réaction indésirable grave et imprévue à une drogue
réaction indésirable grave et imprévue à une drogue Réaction indésirable grave à une drogue dont la nature, la sévérité ou la fréquence ne sont pas mentionnées dans les renseignements sur les risques qui figurent dans la brochure du chercheur ou sur l’étiquette de la drogue. (serious unexpected adverse drug reaction)
- DORS/2001-203, art. 4
- 2001, ch. 27, art. 273
- DORS/2012-16, art. 1(F)
- DORS/2013-56, art. 1(F)
Champ d’application
C.05.002 (1) Sous réserve du paragraphe (2), le présent titre s’applique à la vente et à l’importation d’une drogue destinée à un essai clinique sur des sujets humains.
(2) À l’exception de l’alinéa C.05.003a), des paragraphes C.05.006(2) et (3), des alinéas C.05.010a) à i), de l’article C.05.011, des paragraphes C.05.012(1) et (2), des alinéas C.05.012(3)a) à d) et f) à h), du paragraphe C.05.012(4) et des articles C.05.013, C.05.016 et C.05.017, le présent titre ne s’applique ni à la vente ni à l’importation d’une drogue destinée à un essai clinique autorisées en vertu du paragraphe C.05.006(2).
- DORS/2001-203, art. 4
Interdiction
C.05.003 Malgré les articles C.01.014, C.08.002, C.08.002.02 et C.08.003, il est interdit à quiconque de vendre ou d’importer une drogue destinée à un essai clinique à moins que les conditions ci-après ne soient réunies :
a) il y est autorisé sous le régime du présent titre;
b) il se conforme au présent titre et aux articles C.01.015, C.01.036, C.01.037 à C.01.040, C.01.040.2, C.01.064 à C.01.067, C.01.070, C.01.131, C.01.133 à C.01.136 et C.01.435;
c) si la drogue doit être importée, il a un représentant au Canada qui est responsable de la vente de la drogue.
- DORS/2001-203, art. 4
- DORS/2011-88, art. 7
Disposition générale
C.05.004 Malgré le présent règlement, le promoteur peut présenter une demande conformément au présent titre pour la vente ou l’importation d’une drogue destinée à un essai clinique qui contient une substance dont la vente est interdite par le présent règlement, s’il établit, sur la foi d’informations scientifiques, que l’inclusion de cette substance dans la drogue peut avoir un effet thérapeutique bénéfique pour tout être humain.
- DORS/2001-203, art. 4
Demande d’autorisation
C.05.005 La demande d’autorisation pour la vente ou l’importation d’une drogue destinée à un essai clinique sous le régime du présent titre est présentée au ministre par le promoteur, est signée et datée par le directeur médical ou scientifique du promoteur au Canada et par le premier dirigeant du promoteur et contient les renseignements et documents suivants :
a) un exemplaire du protocole de l’essai clinique;
b) un exemplaire de la déclaration, qui figurera dans chaque formule de consentement éclairé, exposant les risques ainsi que les bénéfices prévus pour la santé des sujets d’essai clinique résultant de leur participation à l’essai clinique;
c) une attestation relative à l’essai clinique, signée et datée par le directeur médical ou scientifique du promoteur au Canada et par le premier dirigeant du promoteur, contenant :
(i) le titre du protocole et le numéro de l’essai clinique,
(ii) la marque nominative, le nom chimique ou le code de la drogue,
(iii) les catégories thérapeutique et pharmacologique de la drogue,
(iv) les ingrédients médicinaux de la drogue,
(v) les ingrédients non médicinaux de la drogue,
(vi) la forme posologique de la drogue,
(vii) le nom, l’adresse, le numéro de téléphone et, le cas échéant, le numéro de télécopieur et l’adresse électronique du promoteur,
(viii) si la drogue doit être importée, le nom, l’adresse, le numéro de téléphone et, le cas échéant, le numéro de télécopieur et l’adresse électronique du représentant du promoteur au Canada qui est responsable de la vente de la drogue,
(ix) pour chaque lieu d’essai clinique, le nom, l’adresse, le numéro de téléphone et, le cas échéant, le numéro de télécopieur et l’adresse électronique du chercheur qualifié, si ces renseignements sont connus au moment de la présentation de la demande,
(x) pour chaque lieu d’essai clinique, le nom, l’adresse, le numéro de téléphone et, le cas échéant, le numéro de télécopieur et l’adresse électronique du comité d’éthique de la recherche qui a approuvé le protocole visé à l’alinéa a) et une formule de consentement éclairé contenant la déclaration visée à l’alinéa b), si ces renseignements sont connus au moment de la présentation de la demande,
(xi) une déclaration précisant :
(A) que l’essai clinique sera mené conformément aux bonnes pratiques cliniques et au présent règlement,
(B) que les renseignements contenus dans la demande d’autorisation ou auxquels celle-ci renvoie sont exacts, complets et ne sont ni faux ni trompeurs;
d) si un comité d’éthique de la recherche a refusé auparavant d’approuver le protocole de l’essai clinique visé à l’alinéa a), le nom, l’adresse, le numéro de téléphone et, le cas échéant, le numéro de télécopieur et l’adresse électronique de ce comité, ainsi que la date et les motifs du refus, si ces renseignements sont connus au moment de la présentation de la demande;
e) la brochure du chercheur qui contient les renseignements suivants :
(i) les propriétés physiques, chimiques et pharmaceutiques de la drogue,
(ii) les aspects pharmacologiques de la drogue, y compris ses métabolites observés chez les espèces animales testées,
(iii) le comportement pharmacocinétique de la drogue et le métabolisme de celle-ci, y compris la façon dont elle est transformée biologiquement chez les espèces animales testées,
(iv) le cas échéant, les effets toxicologiques de la drogue observés chez les espèces animales testées lors d’études à dose unique, d’études à dose répétée ou d’études spéciales,
(v) le cas échéant, les résultats des études de carcinogénicité chez les espèces animales testées à l’égard de la drogue,
(vi) le cas échéant, les résultats des études cliniques sur le comportement pharmacocinétique de la drogue,
(vii) le cas échéant, lorsque des essais cliniques ont déjà été menés sur des sujets humains, les renseignements suivants obtenus lors de ces essais : l’innocuité de la drogue, son comportement pharmacodynamique, son efficacité et ses doses-réponses,
(viii) si la drogue est un produit pharmaceutique radioactif au sens de l’article C.03.201, les renseignements sur le mode de préparation du produit ainsi que sur la dosimétrie des rayonnements pour le produit préparé et les conditions d’emmagasinage une fois préparé;
f) si la drogue contient un excipient d’origine humaine, y compris toute utilisation dans un placebo :
(i) la mention, le cas échéant, que l’excipient a fait l’objet d’une identification numérique en vertu du paragraphe C.01.014.2(1) ou, s’agissant d’une drogue nouvelle, d’un avis de conformité en vertu du paragraphe C.08.004(1),
(ii) dans tout autre cas, les renseignements justifiant l’identité, la pureté, l’activité, la stabilité et l’innocuité de l’excipient;
g) s’il s’agit d’une drogue à l’égard de laquelle aucune identification numérique n’a été attribuée en vertu du paragraphe C.01.014.2(1) ou s’il s’agit d’une drogue nouvelle à l’égard de laquelle aucun avis de conformité n’a été délivré en application des articles C.08.004 ou C.08.004.01, les renseignements sur la chimie et la fabrication de la drogue, y compris le lieu de fabrication;
h) la date projetée du début de l’essai clinique à chaque lieu d’essai clinique, si ce renseignement est connu au moment de la présentation de la demande.
- DORS/2001-203, art. 4
- DORS/2011-88, art. 8
- DORS/2012-16, art. 2(F)
Autorisation
C.05.006 (1) Sous réserve du paragraphe (3), le promoteur peut vendre ou importer une drogue destinée à un essai clinique, autre qu’une drogue visée au paragraphe (2), si les conditions suivantes sont réunies :
a) il a présenté au ministre une demande conformément à l’article C.05.005;
b) le ministre ne lui a pas envoyé, dans les trente jours suivant la date de réception de la demande, un avis lui indiquant qu’il ne peut vendre ou importer la drogue pour l’un des motifs suivants :
(i) les renseignements et documents à l’égard de la demande, selon le cas :
(A) n’ont pas été fournis conformément au présent règlement,
(B) ne sont pas suffisants pour permettre au ministre d’évaluer l’innocuité et les risques de la drogue ou la sûreté et les risques de l’essai clinique,
(ii) le ministre a des motifs raisonnables de croire, d’après l’examen de la demande ou des renseignements fournis en vertu de l’article C.05.009, ou d’après l’évaluation de tout autre renseignement, que l’une des conditions suivantes existe :
(A) l’utilisation de la drogue destinée à l’essai clinique met en danger la santé d’un sujet d’essai clinique ou celle d’une autre personne,
(B) l’essai clinique va à l’encontre de l’intérêt d’un sujet d’essai clinique,
(C) les objectifs de l’essai clinique ne seront pas atteints;
c) pour chaque lieu d’essai clinique, le promoteur a obtenu l’approbation du comité d’éthique de la recherche à l’égard du protocole visé à l’alinéa C.05.005a) et à l’égard d’une formule de consentement éclairé contenant la déclaration visée à l’alinéa C.05.005b);
d) avant la vente ou l’importation de la drogue à un lieu d’essai clinique, le promoteur a fourni au ministre les renseignements visés aux sous-alinéas C.05.005c)(ix) et (x) et aux alinéas C.05.005d) et h) qui n’ont pas été fournis à l’égard de ce lieu au moment de la présentation de la demande.
(2) Sous réserve du paragraphe (3), le promoteur peut vendre ou importer une drogue destinée à un essai clinique lorsque :
a) s’agissant d’une drogue nouvelle à l’égard de laquelle un avis de conformité a été délivré en vertu du paragraphe C.08.004(1), l’essai clinique porte sur les fins ou le mode d’emploi pour lesquels l’avis de conformité a été délivré;
b) s’agissant d’une drogue, autre qu’une drogue nouvelle, à l’égard de laquelle une identification numérique a été attribuée en vertu du paragraphe C.01.014.2(1), l’essai clinique porte sur l’usage ou les fins pour lesquels l’identification numérique a été attribuée.
(3) Le promoteur ne peut vendre ou importer la drogue destinée à un essai clinique :
a) durant la période de la suspension ordonnée en vertu des articles C.05.016 ou C.05.017;
b) après l’annulation ordonnée en vertu des articles C.05.016 ou C.05.017.
- DORS/2001-203, art. 4
- DORS/2012-16, art. 3(F)
Notification
C.05.007 Lorsque la vente ou l’importation d’une drogue est autorisée sous le régime du présent titre, le promoteur peut apporter un ou plusieurs des changements suivants s’il en avise le ministre par écrit dans les quinze jours suivant la date du changement :
a) tout changement apporté aux renseignements sur la chimie et la fabrication de la drogue qui n’a aucune incidence sur la qualité ou l’innocuité de celle-ci, autre qu’un changement pour lequel une modification est exigée par l’article C.05.008;
b) tout changement apporté au protocole qui ne modifie pas le risque pour la santé d’un sujet d’essai clinique, autre qu’un changement pour lequel une modification est exigée par l’article C.05.008.
- DORS/2001-203, art. 4
- DORS/2012-16, art. 4(F)
Modification
C.05.008 (1) Sous réserve des paragraphes (4) et (5), lorsque la vente ou l’importation d’une drogue est autorisée sous le régime du présent titre et que le promoteur envisage d’apporter l’une des modifications visées au paragraphe (2), il peut vendre ou importer la drogue destinée à un essai clinique selon l’autorisation modifiée, si les conditions suivantes sont réunies :
a) il a présenté au ministre une demande de modification conformément au paragraphe (3);
b) le ministre ne lui a pas envoyé, dans les trente jours suivant la date de réception de la demande de modification, un avis lui indiquant qu’il ne peut vendre ou importer la drogue conformément à la modification pour l’un des motifs suivants :
(i) les renseignements et documents à l’égard de la demande de modification, selon le cas :
(A) n’ont pas été fournis conformément au présent règlement,
(B) ne sont pas suffisants pour permettre au ministre d’évaluer l’innocuité et les risques de la drogue ou la sûreté et les risques de l’essai clinique,
(ii) le ministre a des motifs raisonnables de croire, d’après l’examen de la demande de modification ou des renseignements fournis en vertu de l’article C.05.009, ou d’après l’évaluation de tout autre renseignement, que l’une des conditions suivantes existe :
(A) l’utilisation de la drogue destinée à l’essai clinique met en danger la santé d’un sujet d’essai clinique ou celle d’une autre personne,
(B) l’essai clinique va à l’encontre de l’intérêt d’un sujet d’essai clinique,
(C) les objectifs de l’essai clinique ne seront pas atteints;
c) avant la vente ou l’importation de la drogue, le promoteur a fourni au ministre les renseignements et documents suivants :
(i) pour chaque lieu d’essai clinique, le nom, l’adresse, le numéro de téléphone et, le cas échéant, le numéro de télécopieur et l’adresse électronique du comité d’éthique de la recherche qui a approuvé tout protocole modifié présenté conformément à l’alinéa (3)a) ou toute déclaration modifiée présentée conformément à l’alinéa (3)c),
(ii) si un comité d’éthique de la recherche a refusé auparavant d’approuver toute modification au protocole, le nom, l’adresse, le numéro de téléphone et, le cas échéant, le numéro de télécopieur et l’adresse électronique de ce comité, ainsi que la date et les motifs du refus;
d) avant la vente ou l’importation de la drogue, le promoteur tient des registres sur les renseignements suivants :
(i) les renseignements visés à l’alinéa C.05.005h),
(ii) les renseignements visés au sous-alinéa C.05.005c)(ix), s’ils ont changé depuis leur présentation;
e) avant la vente ou l’importation de la drogue conformément à l’autorisation modifiée, le promoteur cesse de vendre ou d’importer la drogue conformément à l’autorisation existante;
f) le promoteur mène l’essai clinique en conformité avec l’autorisation modifiée.
(2) Pour l’application du paragraphe (1), les modifications visées sont les suivantes :
a) une modification du protocole qui a une incidence sur la sélection, le suivi ou le renvoi d’un sujet d’essai clinique;
b) une modification du protocole qui a une incidence sur l’évaluation de l’efficacité clinique de la drogue;
c) une modification du protocole qui modifie le risque pour la santé d’un sujet d’essai clinique;
d) une modification du protocole qui a une incidence sur l’évaluation de l’innocuité de la drogue;
e) une modification du protocole qui prolonge la durée de l’essai clinique;
f) une modification des renseignements sur la chimie et la fabrication de la drogue qui peut avoir une incidence sur l’innocuité ou la qualité de celle-ci.
(3) La demande de modification visée au paragraphe (1) doit contenir, en plus d’un renvoi à la demande présentée en vertu de l’article C.05.005, les documents et renseignements suivants :
a) s’il s’agit d’une modification visée à l’un des alinéas (2)a) à e), un exemplaire du protocole modifié sur lequel les modifications sont indiquées, un exemplaire du protocole présenté conformément à l’alinéa C.05.005a) et les justifications des modifications;
b) s’il s’agit d’une modification visée à l’alinéa (2)e), un exemplaire de la brochure du chercheur modifiée ou un supplément à celle-ci indiquant les nouveaux renseignements, y compris les études toxicologiques à l’appui et les données sur la sûreté de l’essai clinique;
(c) s’il s’agit d’une modification visée à l’un des alinéas (2)a) à f), et qu’en raison de cette modification il est nécessaire de modifier la déclaration visée à l’alinéa C.05.005b), un exemplaire de la déclaration modifiée sur laquelle la modification est indiquée;
d) s’il s’agit d’une modification visée à l’alinéa (2)f), une copie des renseignements modifiés sur la chimie et la fabrication de la drogue indiquant les modifications ainsi que les justifications de celles-ci.
(4) Si l’une des modifications visées au paragraphe (2) est requise sur-le-champ parce que l’utilisation de la drogue destinée à un essai clinique ou l’essai clinique met en danger la santé d’un sujet d’essai clinique ou celle d’une autre personne, le promoteur peut immédiatement apporter cette modification; il doit alors fournir au ministre les renseignements exigés au paragraphe (3) dans les quinze jours suivant la date de la modification.
(5) Le promoteur ne peut vendre ou importer la drogue destinée à un essai clinique :
a) durant la période de la suspension ordonnée en vertu des articles C.05.016 ou C.05.017;
b) après l’annulation ordonnée en vertu des articles C.05.016 ou C.05.017.
- DORS/2001-203, art. 4
- DORS/2012-16, art. 5
Renseignements complémentaires et échantillons
C.05.009 Lorsque les renseignements et documents contenus dans la demande visée à l’article C.05.005 ou dans la demande de modification visée à l’article C.05.008 ne sont pas suffisants pour permettre au ministre de déterminer si l’un des motifs visés aux alinéas C.05.006(1)b) ou C.05.008(1)b) existe, le ministre peut exiger que le promoteur lui fournisse, dans les deux jours suivant la réception de la demande du ministre, les renseignements complémentaires concernant la drogue ou l’essai clinique ou les échantillons de la drogue qui lui sont nécessaires pour faire cette détermination.
- DORS/2001-203, art. 4
- DORS/2012-16, art. 6(F)
Obligations du promoteur
Bonnes pratiques cliniques
C.05.010 Le promoteur doit veiller à ce que tout essai clinique soit mené conformément aux bonnes pratiques cliniques et, en particulier, veiller à ce que :
a) l’essai clinique soit fondé sur le plan scientifique et clairement décrit dans un protocole;
b) l’essai clinique soit mené et la drogue utilisée en conformité avec le protocole de l’essai clinique et le présent titre;
c) des systèmes et des procédures visant à assurer la qualité de tous les aspects de l’essai clinique soient mis en oeuvre;
d) pour chaque lieu d’essai clinique, l’approbation d’un comité d’éthique de la recherche soit obtenue avant le début de l’essai clinique à ce lieu;
e) à chaque lieu d’essai clinique, il y ait au plus un chercheur qualifié;
f) à chaque lieu d’essai clinique, les soins de santé et les décisions médicales dans le cadre de l’essai clinique relèvent du chercheur qualifié de ce lieu;
g) chaque individu collaborant à la conduite de l’essai clinique soit qualifié, par ses études, sa formation et son expérience, pour accomplir les tâches qui lui sont confiées;
h) le consentement éclairé — donné conformément aux règles de droit régissant les consentements — soit obtenu par écrit de chaque personne avant qu’elle participe à l’essai clinique mais seulement après qu’elle a été informée de ce qui suit :
(i) des risques et bénéfices prévus pour sa santé résultant de sa participation à l’essai clinique,
(ii) de tout autre aspect de l’essai clinique nécessaire à la prise de sa décision de participer à l’essai clinique;
i) les exigences relatives aux renseignements et registres prévues à l’article C.05.012 soient respectées;
j) la drogue soit fabriquée, manutentionnée et emmagasinée conformément aux bonnes pratiques de fabrication visées aux titres 2 à 4, à l’exception des articles C.02.019, C.02.025 et C.02.026.
- DORS/2001-203, art. 4
- DORS/2012-16, art. 7(F)
Étiquetage
C.05.011 Malgré les autres dispositions du présent règlement relatives à l’étiquetage, le promoteur doit veiller à ce que la drogue porte une étiquette sur laquelle figurent, dans les deux langues officielles, les renseignements suivants :
a) une mention indiquant que la drogue est de nature expérimentale et ne doit être utilisée que par un chercheur qualifié;
b) le nom, le numéro ou la marque d’identification de la drogue;
c) la date limite d’utilisation de la drogue;
d) les conditions d’emmagasinage recommandées de la drogue;
e) le numéro de lot de la drogue;
f) les nom et adresse du promoteur;
g) le code ou l’identification du protocole;
h) si la drogue est un produit pharmaceutique radioactif au sens de l’article C.03.201, les renseignements exigés par le sous-alinéa C.03.202(1)b)(vi).
- DORS/2001-203, art. 4
- DORS/2012-16, art. 8(F)
Registres
C.05.012 (1) Le promoteur doit consigner dans des registres, traiter et conserver les renseignements relatifs à un essai clinique de façon à permettre la présentation de rapports complets et exacts sur ceux-ci ainsi que leur interprétation et leur vérification.
(2) Le promoteur doit tenir des registres complets et précis afin de démontrer que l’essai clinique est mené conformément aux bonnes pratiques cliniques et au présent règlement.
(3) Le promoteur doit tenir des registres complets et précis sur l’utilisation d’une drogue dans un essai clinique, y compris les renseignements et documents suivants :
a) un exemplaire de toutes les versions de la brochure du chercheur concernant la drogue;
b) un registre sur toutes les modifications apportées à la brochure du chercheur et les motifs de celles-ci, ainsi que les documents les justifiant;
c) un registre sur tous les incidents thérapeutiques liés à la drogue, survenus au Canada ou à l’étranger, ainsi que les indications de la drogue et sa forme posologique au moment où l’incident thérapeutique est survenu;
d) un registre sur l’inscription des sujets d’essai clinique dans lequel sont consignés les renseignements permettant d’identifier et de contacter ceux-ci si la vente de la drogue peut présenter un risque pour leur santé ou celle d’autres personnes;
e) un registre sur l’expédition, la réception, l’aliénation, le retour et la destruction de la drogue;
f) pour chaque lieu d’essai clinique, un engagement signé et daté par le chercheur qualifié, avant son entrée en fonction dans le cadre de l’essai clinique, portant :
(i) qu’il conduira l’essai clinique d’une manière conforme aux bonnes pratiques cliniques,
(ii) qu’en cas de cessation de l’essai clinique par le promoteur en totalité ou à un lieu d’essai clinique, il informera immédiatement les sujets d’essai clinique et le comité d’éthique de la recherche de la cessation et des motifs de celle-ci et les avisera par écrit des risques possibles pour la santé des sujets d’essai clinique ou celle d’autres personnes, le cas échéant;
g) pour chaque lieu d’essai clinique, un exemplaire de la formule de consentement éclairé et du protocole, ainsi que les modifications qui y ont été apportées, que le comité d’éthique de la recherche pour ce lieu a approuvés;
h) pour chaque lieu d’essai clinique, une attestation signée et datée par le comité d’éthique de la recherche pour ce lieu portant qu’il a examiné et approuvé le protocole et la formule de consentement éclairé et qu’il exerce ses activités d’une manière conforme aux bonnes pratiques cliniques.
(4) Le promoteur doit tenir les registres visés au présent titre durant quinze ans.
- DORS/2001-203, art. 4
- DORS/2022-18, art. 55
Présentation de renseignements et d’échantillons
C.05.013 (1) Le ministre doit exiger que le promoteur lui fournisse, dans les deux jours suivant la réception de la demande, des renseignements concernant la drogue ou l’essai clinique ou des échantillons de la drogue, s’il a des motifs raisonnables de croire que l’une des situations suivantes existe :
a) l’utilisation de la drogue destinée à l’essai clinique met en danger la santé d’un sujet d’essai clinique ou celle d’une autre personne;
b) l’essai clinique va à l’encontre de l’intérêt d’un sujet d’essai clinique;
c) les objectifs de l’essai clinique ne seront pas atteints;
d) un chercheur qualifié ne respecte pas l’engagement visé à l’alinéa C.05.012(3)f);
e) les renseignements fournis concernant la drogue ou l’essai clinique sont faux ou trompeurs.
(2) Le ministre peut exiger que le promoteur lui fournisse tout registre ou renseignement visé à l’article C.05.012 ou des échantillons de la drogue, dans les sept jours suivant la réception de la demande du ministre, afin d’évaluer l’innocuité de la drogue ou la santé d’un sujet d’essai clinique ou celle d’une autre personne.
- DORS/2001-203, art. 4
- DORS/2012-16, art. 9(F)
Rapport sur les réactions indésirables graves et imprévues à la drogue
C.05.014 (1) Le promoteur doit, au cours d’un essai clinique, informer le ministre de toute réaction indésirable grave et imprévue à la drogue, survenue au Canada ou à l’étranger, selon le cas :
a) dans les quinze jours suivant le moment où il en a eu connaissance, lorsque cette réaction n’entraîne pas la mort ni ne met en danger la vie;
b) dans les sept jours suivant le moment où il en a eu connaissance, lorsque cette réaction entraîne la mort ou met en danger la vie.
(2) Dans les huit jours suivant la communication de l’information au ministre conformément à l’alinéa (1)b), le promoteur lui remet un rapport exhaustif à ce sujet, y compris une analyse de l’importance et des répercussions des constatations.
(3) Les articles C.01.016 à C.01.020 ne s’appliquent pas aux drogues destinées à un essai clinique.
- DORS/2001-203, art. 4
- DORS/2017-18, art. 16
Cessation d’un essai clinique
C.05.015 (1) En cas de cessation de l’essai clinique par le promoteur en totalité ou à un lieu d’essai clinique, celui-ci doit :
a) en aviser le ministre dans les quinze jours suivant la date de cessation;
b) faire connaître au ministre les motifs de la cessation et les répercussions sur ses autres essais cliniques qui sont prévus ou en cours au Canada relativement à la drogue;
c) informer tous les chercheurs qualifiés, le plus tôt possible, de la cessation et des motifs de cette mesure et les aviser par écrit des risques possibles pour la santé des sujets d’essai clinique ou celle d’autres personnes, le cas échéant;
d) à tout lieu d’essai clinique en cause, cesser la vente ou l’importation de la drogue à partir de la date de cessation et prendre des mesures raisonnables pour assurer la récupération de toute quantité inutilisée de la drogue vendue.
(2) En cas de cessation de l’essai clinique par le promoteur en totalité ou à un lieu d’essai clinique, celui-ci peut recommencer à vendre ou à importer la drogue destinée à un essai clinique en totalité ou à un lieu d’essai clinique, s’il fournit au ministre les renseignements visés aux sous-alinéas C.05.005c)(ix) et (x) et aux alinéas C.05.005d) et h) à l’égard de chaque lieu d’essai clinique où la vente ou l’importation recommencera.
- DORS/2001-203, art. 4
Suspension et annulation
C.05.016 (1) Sous réserve du paragraphe (2), le ministre doit suspendre l’autorisation de vendre ou d’importer une drogue destinée à un essai clinique, en totalité ou à l’égard d’un lieu d’essai clinique, s’il a des motifs raisonnables de croire que l’une des situations suivantes existe :
a) le promoteur a contrevenu au présent règlement ou à toute disposition de la Loi relative à la drogue;
b) les renseignements fournis à l’égard de la drogue ou de l’essai clinique sont faux ou trompeurs;
c) le promoteur ne s’est pas conformé aux bonnes pratiques cliniques;
d) le promoteur a omis :
(i) soit de fournir les renseignements ou les échantillons de la drogue tel qu’exigés en vertu des articles C.05.009 et C.05.013,
(ii) soit d’informer le ministre ou de lui remettre un rapport conformément à l’article C.05.014.
(2) Sous réserve de l’article C.05.017, le ministre ne peut suspendre l’autorisation visée au paragraphe (1) que si les conditions suivantes sont réunies :
a) il a envoyé au promoteur un avis écrit de son intention de suspendre l’autorisation, indiquant si l’autorisation est suspendue en totalité ou à l’égard d’un lieu d’essai clinique, ainsi que les motifs de la suspension projetée;
b) le promoteur n’a pas, dans les trente jours suivant la réception de l’avis visé à l’alinéa a), fourni au ministre les renseignements ou documents démontrant que l’autorisation ne devrait pas être suspendue pour l’un des motifs suivants :
(i) la situation donnant lieu à la suspension projetée n’a pas existé,
(ii) la situation donnant lieu à la suspension projetée a été corrigée;
c) le ministre a donné au promoteur la possibilité de se faire entendre conformément à l’alinéa b).
(3) Le ministre suspend l’autorisation en envoyant au promoteur un avis écrit de la suspension de l’autorisation indiquant si l’autorisation est suspendue en totalité ou à l’égard d’un lieu d’essai clinique, la date de prise d’effet de la suspension ainsi que les motifs de celle-ci.
(4) Si le ministre a suspendu une autorisation au titre du paragraphe (1), il doit :
a) soit rétablir l’autorisation en totalité ou à l’égard d’un lieu d’essai clinique, selon le cas, si dans les trente jours suivant la date de prise d’effet de la suspension, le promoteur lui a fourni les renseignements ou documents démontrant que la situation ayant donné lieu à la suspension a été corrigée;
b) soit annuler l’autorisation en totalité ou à l’égard d’un lieu d’essai clinique, selon le cas, si dans les trente jours suivant la date de prise d’effet de la suspension, le promoteur ne lui a pas fourni les renseignements ou documents visés à l’alinéa a).
- DORS/2001-203, art. 4
- DORS/2012-16, art. 10
C.05.017 (1) Le ministre doit suspendre l’autorisation de vendre ou d’importer une drogue destinée à un essai clinique, en totalité ou à l’égard d’un lieu d’essai clinique, avant d’avoir donné au promoteur la possibilité de se faire entendre, s’il a des motifs raisonnables de croire que cela est nécessaire pour prévenir un préjudice à l’égard de la santé d’un sujet d’essai clinique ou celle d’une autre personne.
(2) Le ministre suspend l’autorisation en envoyant au promoteur un avis écrit de la suspension de l’autorisation indiquant si l’autorisation est suspendue en totalité ou à l’égard d’un lieu d’essai clinique, la date de prise d’effet de la suspension ainsi que les motifs de celle-ci.
(3) Si le ministre a suspendu une autorisation au titre du paragraphe (1), il doit :
a) soit rétablir l’autorisation en totalité ou à l’égard d’un lieu d’essai clinique, selon le cas, si dans les soixante jours suivant la date de prise d’effet de la suspension, le promoteur lui a fourni les renseignements ou documents démontrant que la situation ayant donné lieu à la suspension n’a pas existé ou a été corrigée;
b) soit annuler l’autorisation en totalité ou à l’égard d’un lieu d’essai clinique, selon le cas, si dans les soixante jours suivant la date de prise d’effet de la suspension, le promoteur ne lui a pas fourni les renseignements ou documents visés à l’alinéa a).
- DORS/2001-203, art. 4
- DORS/2012-16, art. 11
TITRE 6
Normes canadiennes des drogues
- Oestrogènes conjugués
- Oestrogènes conjugués pour injection
- Oestrogènes conjugués (comprimés d’)
- Digitoxine
- Digitoxine (comprimés de)
- Digoxine
- Digoxine (élixir de)
- Digoxine (injection de)
- Digoxine (comprimés de)
- Oestrogènes estérifiés
- Oestrogènes estérifiés (comprimés d’)
- Gélatine
- Thyroïde
- DORS/80-544, art. 11
Dispositions générales
C.06.001 Dans le présent titre,
a) la solubilité et la densité doivent être déterminées à 25 °C;
b) les essais d’identité, la détermination quantitative de l’arsenic, du plomb, du cuivre, du zinc, du fluor et de l’anhydride sulfureux, et les essais limites doivent être faits par des méthodes acceptables; et
c) la détermination des constantes physiques et chimiques doit être faite par des méthodes acceptables.
Oestrogènes conjugués
C.06.002 [N]. Les oestrogènes conjugués doivent être la drogue décrite dans la Pharmacopeia of the United States of America, XVIII (1970), sauf que
a) la solution A diluée, les solutions A et B, ainsi que le réactif de l’équiline qui y sont décrits sont préparés selon la méthode officielle DO-29, Oestrogènes conjugués, du 15 octobre 1981; et que
b) l’épreuve d’identité qui y est décrite est effectuée selon la méthode officielle DO-29, Oestrogènes conjugués, du 15 octobre 1981.
- DORS/82-429, art. 5
Oestrogènes conjugués pour injection
C.06.003 [N]. Les oestrogènes conjugués pour injection doivent être la drogue décrite dans la Pharmacopeia of the United States of America, XVIII (1970), sauf que
a) la solution A diluée, les solutions A et B, ainsi que le réactif de l’équiline qui y sont décrits sont préparés selon la méthode officielle DO-29, Oestrogènes conjugués, du 15 octobre 1981; et que
b) l’épreuve d’identité qui y est décrite est effectuée selon la méthode officielle DO-29, Oestrogènes conjugués, du 15 octobre 1981.
- DORS/82-429, art. 6
Comprimés d’oestrogènes conjugués
C.06.004 [N]. Les comprimés d’oestrogènes conjugués doivent être la drogue décrite dans la Pharmacopeia of the United States of America, XVIII (1970), sauf que
a) la solution A diluée, les solutions A et B, ainsi que le réactif de l’équiline qui y sont décrits sont préparés selon la méthode officielle DO-29, Oestrogènes conjugués, du 15 octobre 1981; et que
b) l’épreuve d’identité qui y est décrite est effectuée selon la méthode officielle DO-29, Oestrogènes conjugués, du 15 octobre 1981.
- DORS/82-429, art. 7
C.06.100 et C.06.101 [Abrogés, DORS/80-544, art. 12]
Digitoxine
C.06.120 [N]. La digitoxine doit être la drogue digitoxin décrite dans la Pharmacopeia of the United States of America.
Comprimés de digitoxine
C.06.121 [N]. Les comprimés de digitoxine doivent être la drogue digitoxin tablets décrite dans la Pharmacopeia of the United States of America.
Digoxine
C.06.130 [N]. La digoxine doit être la drogue digoxin décrite dans la Pharmacopeia of the United States of America.
Élixir de digoxine
C.06.131 [N]. L’élixir de digoxine doit être la drogue digoxin elixir décrite dans la Pharmacopeia of the United States of America.
Injection de digoxine
C.06.132 [N]. L’injection de digoxine doit être la drogue digoxin injection décrite dans la Pharmacopeia of the United States of America.
Comprimés de digoxine
C.06.133 [N]. Les comprimés de digoxine doivent être la drogue digoxin tablets décrite dans la Pharmacopeia of the United States of America.
C.06.140 à C.06.142 [Abrogés, DORS/80-544, art. 12]
C.06.150 à C.06.153 [Abrogés, DORS/80-544, art. 12]
C.06.154 à C.06.156 [Abrogés, DORS/80-544, art. 12]
C.06.157 à C.06.160 [Abrogés, DORS/80-544, art. 12]
Oestrogènes estérifiés
C.06.161 [N]. Les oestrogènes estérifiés doivent être la drogue esterified estrogens décrite dans la Pharmacopeia of the United States of America.
Comprimés d’oestrogènes estérifiés
C.06.162 [N]. Les comprimés d’oestrogènes estérifiés doivent être la drogue esterified estrogens tablets décrite dans la Pharmacopeia of the United States of America.
Gélatine
C.06.170 La gélatine doit être la drogue gélatine décrite dans la Pharmacopeia of the United States ou la British Pharmacopeia.
C.06.180 à C.06.183 [Abrogés, DORS/80-544, art. 12]
C.06.230 à C.06.233 [Abrogés, DORS/80-544, art. 12]
C.06.240 à C.06.242 [Abrogés, DORS/80-544, art. 12]
Thyroïde
C.06.250 La thyroïde doit être le produit des glandes thyroïdes nettoyées, desséchées et pulvérisées d’animaux domestiques comestibles, contenir au moins 0,17 pour cent et au plus 0,23 pour cent d’iode, sans aucune addition d’iode sous forme organique ou minérale, et
a) posséder les caractères suivants :
description, —
(i) généraux, — la thyroïde se présente sous forme d’une poudre amorphe de couleur crème; elle a une légère odeur et une faible saveur de viande, et
(ii) microscopiques, — convenablement montée sur une lame et examinée au microscope, la thyroïde présente de nombreux fragments colloïdaux hyalius, lisses ou striés, de formes angulaires ou irrégulières, incolores ou jaune pâle dans l’eau, bruns dans la solution de Mallory, et roses dans la solution d’éosine; dans certains de ces fragments se trouvent des granules, des vacuoles minuscules, des corps cristalloïdes et des cellules; de nombreux fragments irréguliers d’épithélium folliculaire qui se colorent en brun par la solution de Mallory; les cellules individuelles sont plus ou moins polygonales, à angles arrondis ou irrégulièrement cubiques, et contenant souvent des noyaux bien marqués qui se colorent en bleu foncé tandis que le cytoplasme se colore en pourpre dans la solution d’hématoxyline de Delafield; des segments de capillaires chatoyants, minces, d’un profil ondulé serré; de nombreux segments minces de neuraxones; de nombreux agrégats de parcelles de substance intercellulaire et des fibres minces de tissu conjonctif, droites pour la plupart, qui se colorent en bleu ou en bleu verdâtre par un mélange de solution de Mallory et de solution d’acide phosphotungstique, les faisceaux de fibres paraissant souvent rougeâtres dans la solution de Mallory; quelques fragments chatoyants de vaisseaux sanguins dont les extrémités, vues dans un montage à l’eau, apparaissent crénelées ou dentées; et
b) satisfaire aux essais de pureté suivants :
(i) iode inorganique, — ajouter à un gramme de thyroïde 10 millilitres d’une solution aqueuse saturée de sulfate de zinc, agiter, laisser reposer cinq minutes, et passer dans un filtre de verre poreux; ajouter à cinq millilitres du filtrat 0,5 millilitre de colle d’amidon, plus quatre gouttes d’une solution aqueuse de 10 grammes par 100 millilitres de nitrite de sodium et quatre gouttes d’acide sulfurique dilué, et agiter à chaque addition : il ne doit pas se produire de couleur bleue, et
(ii) humidité, — la thyroïde perd au plus six pour cent d’humidité, à la dessiccation.
C.06.251 La thyroïde doit être
a) dosée par la méthode officielle DO-26, Thyroïde, du 15 octobre 1981; et
b) conservée au frais dans des récipients hermétiquement bouchés.
- DORS/82-429, art. 8
C.06.252 [Abrogé, DORS/80-544, art. 12]
C.06.260 à C.06.264 [Abrogés, DORS/80-544, art. 12]
C.06.270 à C.06.280 [Abrogés, DORS/80-544, art. 12]
TITRE 7Vente de drogues aux fins de mise en oeuvre de la décision du Conseil général
Définitions
C.07.001 Les définitions qui suivent s’appliquent au présent titre.
- commissaire aux brevets
commissaire aux brevets Le commissaire aux brevets nommé en vertu du paragraphe 4(1) de la Loi sur les brevets. (Commissioner of Patents)
- décision du Conseil général
décision du Conseil général S’entend au sens du paragraphe 30(6) de la Loi. (General Council Decision)
- DORS/2005-141, art. 1
Champ d’application
C.07.002 Le présent titre s’applique à la vente de drogues aux fins de mise en oeuvre de la décision du Conseil général.
- DORS/2005-141, art. 1
Demande d’autorisation
C.07.003 La demande d’autorisation pour la vente d’une drogue sous le régime du présent titre est présentée au ministre par le fabricant et comporte les renseignements et documents suivants :
a) une déclaration du fabricant portant qu’il a l’intention de présenter une demande au commissaire aux brevets aux termes de l’article 21.04 de la Loi sur les brevets;
b) dans le cas d’une drogue nouvelle, le numéro et la date de dépôt de la présentation de drogue nouvelle ou de la présentation abrégée de drogue nouvelle déposées respectivement aux termes des articles C.08.002 et C.08.002.1, ainsi que de tout supplément à l’une ou l’autre présentation déposé aux termes de l’article C.08.003;
c) dans le cas d’une drogue autre qu’une drogue nouvelle :
(i) soit le numéro et la date de dépôt de la demande d’identification numérique présentée à l’égard de la drogue aux termes de l’article C.01.014.1,
(ii) soit l’identification numérique attribuée à la drogue, le cas échéant, aux termes de l’article C.01.014.2;
d) dans le cas où la drogue se présente sous une forme posologique solide, la méthode suivie pour marquer la drogue conformément à l’alinéa C.07.008a) ainsi qu’une preuve établissant que cette méthode n’a aucune incidence sur son innocuité ou son efficacité;
e) dans le cas où la drogue se présente sous une forme posologique non solide, la méthode suivie pour marquer le récipient immédiat conformément à l’alinéa C.07.008a);
f) un échantillon de l’étiquette de la drogue, laquelle doit comporter les renseignements prévus à l’alinéa C.07.008c).
- DORS/2005-141, art. 1
Autorisation
C.07.004 Le ministre avise le fabricant et le commissaire aux brevets, pour l’application de l’alinéa 21.04(3)b) de la Loi sur les brevets, que la drogue en cause satisfait aux exigences de la Loi et du présent règlement si les conditions suivantes sont réunies :
a) le fabricant a présenté au ministre une demande conforme à l’article C.07.003 et il a fourni à ce dernier un exemplaire de la demande qu’il a présentée au commissaire aux brevets aux termes de l’article 21.04 de la Loi sur les brevets;
b) dans le cas d’une drogue nouvelle, le ministre conclut que la présentation de drogue nouvelle, la présentation abrégée de drogue nouvelle ou tout supplément à l’une ou l’autre présentation est conforme aux articles C.08.002, C.08.002.1 ou C.08.003, selon le cas, et à l’article C.08.005.1;
c) dans le cas d’une drogue autre qu’une drogue nouvelle, une identification numérique a été attribuée à la drogue aux termes de l’article C.01.014.2;
d) le ministre est convaincu que le fabricant et la drogue satisfont aux exigences de la Loi et du présent règlement.
- DORS/2005-141, art. 1
C.07.005 Malgré les articles C.01.014, C.08.002 et C.08.003, le fabricant peut vendre une drogue sous le régime du présent titre si les conditions suivantes sont réunies :
a) le ministre a avisé le commissaire aux brevets, pour l’application de l’alinéa 21.04(3)b) de la Loi sur les brevets, que la drogue satisfait aux exigences de la Loi et du présent règlement;
b) le fabricant a reçu l’autorisation prévue à l’article 21.04 de la Loi sur les brevets.
- DORS/2005-141, art. 1
C.07.006 Les articles C.01.005 et C.01.014.1 à C.01.014.4 ne s’appliquent pas aux drogues nouvelles vendues sous le régime du présent titre.
- DORS/2005-141, art. 1
Avis au commissaire aux brevets
C.07.007 Le ministre avise le fabricant et le commissaire aux brevets, pour l’application de l’alinéa 21.13b) de la Loi sur les brevets, s’il est d’avis que la drogue dont la vente est autorisée sous le régime du présent titre ne satisfait plus aux exigences de la Loi et du présent règlement.
- DORS/2005-141, art. 1
Marquage et étiquetage
C.07.008 Il est interdit de vendre une drogue sous le régime du présent titre à moins que :
a) la drogue elle-même ne porte de façon permanente la marque « XCL », dans le cas où elle se présente sous une forme posologique solide, ou son récipient immédiat ne porte de façon permanente la marque « XCL », dans le cas où elle se présente sous une forme posologique non solide;
b) la drogue elle-même ne soit d’une couleur nettement différente de la couleur de la version de la drogue vendue au Canada, dans le cas où elle se présente sous une forme posologique solide;
c) l’étiquette de la drogue ne porte de façon permanente la marque « XCL », le numéro de suivi d’exportation attribué par le ministre aux termes de l’article C.07.009 et la mention « POUR EXPORTATION AUX TERMES DE LA DÉCISION DU CONSEIL GÉNÉRAL. VENTE INTERDITE AU CANADA. » ou « FOR EXPORT UNDER THE GENERAL COUNCIL DECISION. NOT FOR SALE IN CANADA. ».
- DORS/2005-141, art. 1
C.07.009 Le ministre attribue un numéro de suivi d’exportation à la drogue à l’égard de laquelle il a avisé le commissaire aux brevets en application de l’article C.07.004.
- DORS/2005-141, art. 1
Registre
C.07.010 Le fabricant est tenu, à l’égard de la drogue dont la vente est autorisée sous le régime du présent titre :
a) d’établir et de tenir, de façon à en permettre la vérification, un registre relatif aux renseignements visés au paragraphe C.08.007(1), et de le conserver durant une période minimale de sept ans à compter de la date de son établissement;
b) de fournir au ministre les résumés visés à l’article C.08.008.
- DORS/2005-141, art. 1
- DORS/2014-125, art. 1
Avis au ministre
C.07.011 Le fabricant est tenu d’aviser le ministre par écrit au moins quinze jours avant de commencer à fabriquer le premier lot de la drogue dont la vente est autorisée sous le régime du présent titre et au moins quinze jours avant l’exportation de tout lot subséquent de celle-ci.
- DORS/2005-141, art. 1
TITRE 8
Drogues nouvelles
C.08.001 Pour l’application de la Loi et du présent titre, drogue nouvelle s’entend d’une drogue, à l’exception d’un produit de santé animale :
a) qui est constituée d’une substance ou renferme une substance, sous forme d’ingrédient actif ou inerte, de véhicule, d’enrobage, d’excipient, de solvant ou de tout autre constituant, laquelle substance n’a pas été vendue comme drogue au Canada pendant assez longtemps et en quantité suffisante pour établir, au Canada, l’innocuité et l’efficacité de cette substance employée comme drogue;
b) qui entre dans une association de deux drogues ou plus, avec ou sans autre ingrédient, qui n’a pas été vendue dans cette association particulière, ou dans les proportions de ladite association pour ces drogues particulières, pendant assez longtemps et en quantité suffisante pour établir, au Canada, l’innocuité et l’efficacité de cette association ou de ces proportions employées comme drogue; ou
c) pour laquelle le fabricant prescrit, recommande, propose ou déclare un usage comme drogue ou un mode d’emploi comme drogue, y compris la posologie, la voie d’administration et la durée d’action, et qui n’a pas été vendue pour cet usage ou selon ce mode d’emploi au Canada pendant assez longtemps et en quantité suffisante pour établir, au Canada, l’innocuité et l’efficacité de cet usage ou de ce mode d’emploi pour cette drogue.
- DORS/95-172, art. 2
- DORS/2017-76, art. 10
C.08.001.1 Les définitions qui suivent s’appliquent au présent titre.
- drogue désignée contre la COVID-19
drogue désignée contre la COVID-19 Drogue nouvelle dont les fins et le mode d’emploi recommandés par le fabricant ont trait à la COVID-19. (designated COVID-19 drug)
- équivalent pharmaceutique
équivalent pharmaceutique S’entend d’une drogue nouvelle qui, par comparaison à une autre drogue, contient les mêmes quantités d’ingrédients médicinaux identiques, sous des formes posologiques comparables, mais pas nécessairement les mêmes ingrédients non médicinaux. (pharmaceutical equivalent)
- produit de référence canadien
produit de référence canadien Selon le cas :
a) une drogue à l’égard de laquelle un avis de conformité a été délivré en application des articles C.08.004 ou C.08.004.01 et qui est commercialisée au Canada par son innovateur;
b) une drogue jugée acceptable par le ministre et qui peut être utilisée pour la détermination de la bioéquivalence d’après les caractéristiques pharmaceutiques et, le cas échéant, les caractéristiques en matière de biodisponibilité, lorsqu’une drogue pour laquelle un avis de conformité a été délivré en application des articles C.08.004 ou C.08.004.01 ne peut être utilisée à cette fin parce qu’elle n’est plus commercialisée au Canada;
c) une drogue jugée acceptable par le ministre qui peut être utilisée pour la détermination de la bioéquivalence d’après les caractéristiques pharmaceutiques et, le cas échéant, les caractéristiques en matière de biodisponibilité, par comparaison à une drogue visée à l’alinéa a). (Canadian reference product)
- spécifications
spécifications S’entend de la description détaillée d’une drogue nouvelle et de ses ingrédients, notamment :
a) la liste des propriétés et des qualités des ingrédients qui ont trait à la fabrication et à l’emploi de la drogue nouvelle, y compris leur identité, leur activité et leur pureté;
b) la description détaillée des méthodes d’analyse et d’examen des ingrédients;
c) la liste des tolérances relatives aux propriétés et aux qualités des ingrédients. (specifications)
- DORS/95-411, art. 3
- DORS/2011-88, art. 9
- DORS/2021-45, art. 13
C.08.002 (1) Il est interdit de vendre ou d’annoncer une drogue nouvelle, à moins que les conditions suivantes ne soient réunies :
a) le fabricant de la drogue nouvelle a, relativement à celle-ci, déposé auprès du ministre une présentation de drogue nouvelle, une présentation de drogue nouvelle pour usage exceptionnel, une présentation abrégée de drogue nouvelle ou une présentation abrégée de drogue nouvelle pour usage exceptionnel que celui-ci juge acceptable;
b) le ministre a délivré au fabricant de la drogue nouvelle, en application des articles C.08.004 ou C.08.004.01, un avis de conformité relativement à la présentation;
c) l’avis de conformité relatif à la présentation n’a pas été suspendu en vertu de l’article C.08.006.
d) [Abrogé, DORS/2014-158, art. 10]
(2) La présentation de drogue nouvelle doit contenir suffisamment de renseignements et de matériel pour permettre au ministre d’évaluer l’innocuité et l’efficacité de la drogue nouvelle, notamment :
a) une description de la drogue nouvelle et une mention de son nom propre ou, à défaut, de son nom usuel;
b) une mention de la marque nominative de la drogue nouvelle ou du nom ou code d’identification projeté pour celle-ci;
c) la liste quantitative des ingrédients de la drogue nouvelle et les spécifications relatives à chaque ingrédient;
d) la description des installations et de l’équipement à utiliser pour la fabrication, la préparation et l’emballage de la drogue nouvelle;
e) des précisions sur la méthode de fabrication et les mécanismes de contrôle à appliquer pour la fabrication, la préparation et l’emballage de la drogue nouvelle;
f) le détail des épreuves qui doivent être effectuées pour contrôler l’activité, la pureté, la stabilité et l’innocuité de la drogue nouvelle;
g) les rapports détaillés des épreuves effectuées en vue d’établir l’innocuité de la drogue nouvelle, aux fins et selon le mode d’emploi recommandés;
h) des preuves substantielles de l’efficacité clinique de la drogue nouvelle aux fins et selon le mode d’emploi recommandés;
i) la déclaration des noms et titres professionnels de tous les chercheurs à qui la drogue nouvelle a été vendue;
j) dans le cas d’une drogue nouvelle pour usage vétérinaire, une esquisse de toute étiquette à utiliser relativement à la drogue nouvelle, y compris toute notice d’accompagnement et toute documentation supplémentaire sur l’emploi de la drogue nouvelle qui est fournie sur demande;
j.1) dans le cas d’une drogue nouvelle pour usage humain, des maquettes de toute étiquette à utiliser relativement à la drogue nouvelle — y compris toute notice d’accompagnement et toute documentation supplémentaire sur l’emploi de la drogue nouvelle qui est fournie sur demande — ainsi que des maquettes des emballages de la drogue nouvelle;
k) la déclaration de toutes les recommandations qui doivent être faites dans la réclame pour la drogue nouvelle, au sujet
(i) de la voie d’administration recommandée pour la drogue nouvelle,
(ii) de la posologie proposée pour la drogue nouvelle,
(iii) des propriétés attribuées à la drogue nouvelle,
(iv) des contre-indications et les effets secondaires de la drogue nouvelle;
l) la description de la forme posologique proposée pour la vente de la drogue nouvelle;
m) les éléments de preuve établissant que les lots d’essai de la drogue nouvelle ayant servi aux études menées dans le cadre de la présentation ont été fabriqués et contrôlés d’une manière représentative de la production destinée au commerce;
n) dans le cas d’une drogue nouvelle destinée à être administrée à des animaux producteurs de denrées alimentaires, le délai d’attente applicable;
o) dans le cas d’une drogue nouvelle pour usage humain autre qu’une drogue désignée contre la COVID-19, une appréciation de la question de savoir si la drogue nouvelle est susceptible d’être confondue avec une autre drogue à laquelle une identification numérique a été attribuée en raison de la ressemblance de la marque nominative dont l’utilisation est proposée pour cette drogue nouvelle avec la marque nominative, le nom usuel ou le nom propre de l’autre drogue.
(2.1) Le fabricant peut déposer, à l’égard d’une drogue désignée contre la COVID-19, une présentation de drogue nouvelle qui n’est pas conforme aux exigences prévues aux alinéas (2)g) et h) si la présentation contient à la fois :
a) une mention portant que la présentation contient des preuves visant à établir que l’exigence de l’alinéa b) est remplie;
b) des preuves suffisantes pour conclure que les avantages associés à la drogue désignée contre la COVID-19 l’emportent sur les risques associés à cette dernière en ce qui a trait aux fins et mode d’emploi recommandés, compte tenu des incertitudes à l’égard de ces avantages et de ces risques et du besoin en matière de santé publique relatif à la COVID-19.
(2.2) Le fabricant peut déposer, à l’égard d’une drogue désignée contre la COVID-19 pour usage humain, une présentation de drogue nouvelle qui n’est pas conforme aux exigences de l’alinéa (2)j.1) si la présentation contient une maquette de toute étiquette à utiliser relativement à la drogue désignée contre la COVID-19, y compris toute notice d’accompagnement et toute documentation supplémentaire sur l’emploi de la drogue désignée contre la COVID-19 qui est fournie sur demande.
(2.3) Si, au moment de déposer sa présentation de drogue nouvelle à l’égard d’une drogue désignée contre la COVID-19, le fabricant ne peut fournir au ministre les renseignements ou le matériel visés à l’un des alinéas (2)e) à k), m) et n) et à l’alinéa (2.1)b) ou au paragraphe (2.2) ou qu’il fournit ces renseignements ou ce matériel mais de façon incomplète, il fournit au ministre, au même moment, un plan précisant les modalités selon lesquelles il fournira au ministre les renseignements ou le matériel manquants.
(2.4) Les paragraphes (2.1) à (2.3) s’appliquent si, à la fois :
a) la présentation de drogue nouvelle contient une mention portant que la présentation est déposée à l’égard d’une drogue désignée contre la COVID-19;
b) les fins et le mode d’emploi mentionnés dans la présentation de drogue nouvelle à l’égard de la drogue désignée contre la COVID-19 ont trait uniquement à la COVID-19 et la présentation contient une mention à cet égard.
(2.5) Les paragraphes (2.1) à (2.3) ne s’appliquent pas lorsque le fabricant demande un avis de conformité à l’égard de la drogue désignée contre la COVID-19 sur la base d’une comparaison directe ou indirecte entre celle-ci et une autre drogue désignée contre la COVID-19.
(3) Le fabricant de la drogue nouvelle doit, à la demande du ministre, lui fournir, selon ce que celui-ci estime nécessaire pour évaluer l’innocuité et l’efficacité de la drogue dans le cadre de la présentation de drogue nouvelle, les renseignements et le matériel suivants :
a) les nom et adresse des fabricants de chaque ingrédient de la drogue nouvelle et les nom et adresse des fabricants de la drogue nouvelle sous sa forme posologique proposée pour la vente;
b) des échantillons des ingrédients de la drogue nouvelle;
c) des échantillons de la drogue nouvelle sous sa forme posologique proposée pour la vente;
d) tout renseignement ou matériel supplémentaire se rapportant à l’innocuité et à l’efficacité de la drogue nouvelle.
- DORS/85-143, art. 1
- DORS/93-202, art. 24
- DORS/95-411, art. 4
- DORS/2011-88, art. 10
- DORS/2014-158, art. 10
- DORS/2017-259, art. 22
- DORS/2018-69, art. 33(F)
- DORS/2018-84, art. 8(F)
- DORS/2021-45, art. 14
C.08.002.01 (1) Le fabricant d’une drogue nouvelle peut déposer à l’égard de celle-ci une présentation de drogue nouvelle pour usage exceptionnel si les conditions ci-après sont réunies :
a) la drogue nouvelle est destinée à être utilisée :
(i) en cas d’urgence, lorsqu’une personne a été exposée à une substance chimique, biologique, radiologique ou nucléaire et qu’il y a lieu d’agir pour traiter, atténuer ou prévenir une maladie, un désordre ou un état physique anormal graves — mettant notamment la vie en danger —, ou leurs symptômes, qui résultent — ou résulteraient vraisemblablement — d’une telle exposition,
(ii) en tant que mesure préventive chez toute personne qui pourrait être exposée à une substance chimique, biologique, radiologique ou nucléaire qui risque d’entraîner une incapacité permanente ou la mort;
b) il est impossible de remplir les exigences prévues aux alinéas C.08.002(2)g) et h) pour les raisons suivantes :
(i) l’exposition de volontaires humains à la substance visée à l’alinéa a) risque d’entraîner une incapacité permanente ou la mort,
(ii) les circonstances de l’exposition à la substance ne se produisent que de façon sporadique et à intervalles peu fréquents.
(2) Sous réserve des paragraphes (3) et (5), la présentation de drogue nouvelle pour usage exceptionnel doit contenir :
a) une attestation, signée et datée par le premier dirigeant au Canada du fabricant qui dépose la présentation et par son directeur médical ou scientifique, portant que les conditions prévues aux alinéas (1)a) et b) sont remplies, accompagnée de suffisamment de renseignements à l’appui pour permettre au ministre de conclure que ces conditions sont remplies;
b) suffisamment de renseignements et de matériel pour permettre au ministre d’évaluer l’innocuité et l’efficacité de cette drogue nouvelle, notamment :
(i) les renseignements et le matériel visés aux alinéas C.08.002(2)a) à f), i) à m) et o),
(ii) des renseignements concernant le processus pathophysiologique de la toxicité de la substance chimique, biologique, radiologique ou nucléaire et décrivant la capacité de la drogue nouvelle de traiter, d’atténuer ou de prévenir ce processus,
(iii) des rapports détaillés d’études in vitro effectuées relativement à la toxicité et à l’activité de la drogue nouvelle, aux fins recommandées,
(iv) des rapports détaillés d’études, effectuées sur une espèce animale dont les réactions devraient permettre de prédire celles chez l’être humain, établissant l’innocuité de la drogue nouvelle et fournissant des preuves substantielles de ses effets lorsqu’elle est utilisée aux fins et selon le mode d’emploi recommandés,
(v) des renseignements confirmant que le résultat d’études sur les animaux est clairement relié aux avantages recherchés chez l’être humain,
(vi) des renseignements indiquant une connaissance suffisante de la pharmacocinétique et de la pharmacodynamie de la drogue nouvelle chez l’animal et l’être humain pour en tirer des conclusions permettant de déterminer une dose thérapeutique chez l’être humain,
(vii) des renseignements concernant l’innocuité de la drogue nouvelle chez l’être humain, notamment des rapports détaillés de tout essai clinique établissant l’innocuité de la drogue nouvelle,
(viii) tout renseignement concernant l’efficacité de la drogue nouvelle chez l’être humain aux fins et selon le mode d’emploi recommandés,
(ix) un plan visant à surveiller et à établir l’innocuité et l’efficacité de la drogue nouvelle aux fins et selon le mode d’emploi recommandés, qui contient les procédures de collecte et d’analyse des données,
(x) tout rapport d’évaluation disponible concernant la drogue nouvelle, préparé par toute autorité réglementaire dans tout pays autre que le Canada.
(3) Il n’est pas nécessaire de fournir les rapports visés au sous-alinéa (2)b)(iii) ou les renseignements visés au sous-alinéa (2)b)(vi) si la présentation de drogue nouvelle pour usage exceptionnel contient une explication scientifique détaillée de la raison pour laquelle ils ne sont pas disponibles.
(4) Tout renseignement ou matériel nécessaire pour permettre au ministre d’évaluer l’innocuité et l’efficacité de la drogue nouvelle doit être ajouté, à la demande du ministre, à la présentation de drogue nouvelle pour usage exceptionnel, notamment :
a) les nom et adresse des fabricants de chaque ingrédient de la drogue nouvelle ainsi que ceux des fabricants de la drogue nouvelle sous la forme posologique proposée pour la vente;
b) des échantillons des ingrédients de la drogue nouvelle;
c) des échantillons de la drogue nouvelle sous la forme posologique proposée pour la vente;
d) tout renseignement qui n’a pas été fourni au titre du paragraphe (3).
(5) Si la présentation de drogue nouvelle pour usage exceptionnel vise une fin nouvelle d’une drogue nouvelle à l’égard de laquelle un avis de conformité a été délivré en application de l’article C.08.004, il n’est pas nécessaire de fournir les renseignements et le matériel visés au sous-alinéa (2)b)(i) à moins qu’ils ne diffèrent de ceux fournis à l’origine.
- DORS/2011-88, art. 11
- DORS/2014-158, art. 11
C.08.002.02 Malgré les articles C.08.002 et C.08.003, il est interdit au fabricant et à l’importateur de vendre une drogue nouvelle pour usage exceptionnel à l’égard de laquelle un avis de conformité a été délivré en application de l’article C.08.004.01, sauf :
a) au gouvernement du Canada ou à celui d’une province, à l’usage d’un de ses ministères ou organismes, sur réception d’une commande écrite signée par le ministre en cause ou le responsable de l’organisme, ou leur représentant dûment autorisé;
b) à une administration municipale ou un de ses organismes, sur réception d’une commande écrite signée par un cadre supérieur de l’administration ou de l’organisme, ou son représentant dûment autorisé.
- DORS/2011-88, art. 11
C.08.002.1 (1) Le fabricant d’une drogue nouvelle peut déposer à l’égard de celle-ci une présentation abrégée de drogue nouvelle ou une présentation abrégée de drogue nouvelle pour usage exceptionnel si, par comparaison à un produit de référence canadien :
a) la drogue nouvelle est un équivalent pharmaceutique du produit de référence canadien;
b) elle est bioéquivalente au produit de référence canadien d’après les caractéristiques pharmaceutiques et, si le ministre l’estime nécessaire, d’après les caractéristiques en matière de biodisponibilité;
c) la voie d’administration de la drogue nouvelle est identique à celle du produit de référence canadien;
d) les conditions thérapeutiques relatives à la drogue nouvelle figurent parmi celles qui s’appliquent au produit de référence canadien.
(2) La présentation abrégée de drogue nouvelle ou la présentation abrégée de drogue nouvelle pour usage exceptionnel doit contenir suffisamment de renseignements et de matériel pour permettre au ministre d’évaluer l’innocuité et l’efficacité de la drogue nouvelle, notamment :
a) les renseignements et le matériel visés :
(i) aux alinéas C.08.002(2)a) à f), j) à l) et o), dans le cas d’une présentation abrégée de drogue nouvelle,
(ii) aux alinéas C.08.002(2)a) à f), j) à l) et o) et aux sous-alinéas C.08.002.01(2)b)(ix) et (x), dans le cas d’une présentation abrégée de drogue nouvelle pour usage exceptionnel;
b) les renseignements permettant d’identifier le produit de référence canadien utilisé pour les études comparatives menées dans le cadre de la présentation;
c) les éléments de preuve, provenant des études comparatives menées dans le cadre de la présentation, établissant que la drogue nouvelle :
(i) d’une part, est un équivalent pharmaceutique du produit de référence canadien,
(ii) d’autre part, si le ministre l’estime nécessaire d’après les caractéristiques pharmaceutiques et, le cas échéant, d’après les caractéristiques en matière de biodisponibilité de celle-ci, est bioéquivalente au produit de référence canadien selon les résultats des études en matière de biodisponibilité, des études pharmacodynamiques ou des études cliniques;
d) les éléments de preuve établissant que les lots d’essai de la drogue nouvelle ayant servi aux études menées dans le cadre de la présentation ont été fabriqués et contrôlés d’une manière représentative de la production destinée au commerce;
e) dans le cas d’une drogue destinée à être administrée à des animaux producteurs de denrées alimentaires, les renseignements permettant de confirmer que le délai d’attente est identique à celui du produit de référence canadien.
(3) Le fabricant de la drogue nouvelle doit, à la demande du ministre, lui fournir, selon ce que celui-ci estime nécessaire pour évaluer l’innocuité et l’efficacité de la drogue dans le cadre de la présentation abrégée de drogue nouvelle ou de la présentation abrégée de drogue nouvelle pour usage exceptionnel, les renseignements et le matériel suivants :
a) les nom et adresse des fabricants de chaque ingrédient de la drogue nouvelle et les nom et adresse des fabricants de la drogue nouvelle sous sa forme posologique proposée pour la vente;
b) des échantillons des ingrédients de la drogue nouvelle;
c) des échantillons de la drogue nouvelle sous sa forme posologique proposée pour la vente;
d) tout renseignement ou matériel supplémentaire se rapportant à l’innocuité et à l’efficacité de la drogue nouvelle.
(4) Pour l’application du présent article, dans le cas d’une présentation abrégée de drogue nouvelle, la drogue nouvelle pour usage exceptionnel à l’égard de laquelle un avis de conformité a été délivré en application de l’article C.08.004.01 n’est pas un produit de référence canadien.
- DORS/95-411, art. 5
- DORS/2011-88, art. 12
- DORS/2014-158, art. 12
C.08.003 (1) Malgré l’article C.08.002, il est interdit de vendre une drogue nouvelle à l’égard de laquelle un avis de conformité a été délivré à son fabricant et n’a pas été suspendu en vertu de l’article C.08.006 lorsqu’un des éléments visés au paragraphe (2) diffère sensiblement des renseignements ou du matériel contenus dans la présentation de drogue nouvelle, la présentation de drogue nouvelle pour usage exceptionnel, la présentation abrégée de drogue nouvelle ou la présentation abrégée de drogue nouvelle pour usage exceptionnel, à moins que les conditions ci-après ne soient réunies :
a) le fabricant de la drogue nouvelle a déposé auprès du ministre un supplément à la présentation;
b) le ministre a délivré au fabricant un avis de conformité relativement au supplément;
c) l’avis de conformité relatif au supplément n’a pas été suspendu en vertu de l’article C.08.006.
d) [Abrogé, DORS/2014-158, art. 13]
(2) Pour l’application du paragraphe (1), les éléments ayant trait à la drogue nouvelle sont les suivants :
a) sa description;
b) sa marque nominative ou le nom ou code sous lequel il est proposé de l’identifier;
c) les spécifications de ses ingrédients;
d) les installations et l’équipement à utiliser pour sa fabrication, sa préparation et son emballage;
e) la méthode de fabrication et les mécanismes de contrôle à appliquer pour sa fabrication, sa préparation et son emballage;
f) les analyses effectuées pour contrôler son activité, sa pureté, sa stabilité et son innocuité;
g) les étiquettes à utiliser pour la drogue nouvelle;
g.1) dans le cas d’une drogue nouvelle pour usage humain, les emballages de celle-ci;
h) les observations faites relativement :
(i) à la voie d’administration recommandée pour la drogue nouvelle,
(ii) à sa posologie,
(iii) aux propriétés qui lui sont attribuées,
(iv) à ses contre-indications et à ses effets secondaires,
(v) au délai d’attente applicable à celle-ci;
i) sa forme posologique proposée pour la vente.
(3) Le supplément à toute présentation visée au paragraphe (1) contient, à l’égard des éléments qui diffèrent sensiblement de ce qui figure dans la présentation, suffisamment de renseignements et de matériel pour permettre au ministre d’évaluer l’innocuité et l’efficacité de la drogue nouvelle relativement à ces éléments.
(3.1) Le supplément à toute présentation visée au paragraphe (1) contient, selon le cas, ce qui suit :
a) si, en raison de l’élément visé au paragraphe (2) — autre que la marque nominative d’une drogue nouvelle pour usage humain — sur lequel porte le supplément, il est nécessaire de modifier les étiquettes de la drogue nouvelle :
(i) dans le cas d’une drogue nouvelle pour usage vétérinaire, une esquisse de toute étiquette à utiliser relativement à la drogue nouvelle, y compris toute notice d’accompagnement et toute documentation supplémentaire sur l’emploi de la drogue nouvelle qui est fournie sur demande,
(ii) dans le cas d’une drogue nouvelle pour usage humain, des maquettes de toute étiquette à utiliser relativement à la drogue nouvelle — y compris toute notice d’accompagnement et toute documentation supplémentaire sur l’emploi de la drogue nouvelle qui est fournie sur demande — ainsi que des maquettes des emballages de la drogue nouvelle;
b) si le supplément porte sur la marque nominative d’une drogue nouvelle pour usage humain :
(i) une appréciation de la question de savoir si la drogue nouvelle est susceptible d’être confondue avec une autre drogue à laquelle une identification numérique a été attribuée en raison de la ressemblance de la marque nominative dont l’utilisation est proposée pour cette drogue nouvelle avec la marque nominative, le nom usuel ou le nom propre de l’autre drogue,
(ii) des maquettes de toute étiquette à utiliser relativement à la drogue nouvelle — y compris toute notice d’accompagnement et toute documentation supplémentaire sur l’emploi de la drogue nouvelle qui est fournie sur demande — ainsi que des maquettes des emballages de la drogue nouvelle.
(4) S’il porte sur un élément visé au sous-alinéa (2)h)(iii), le supplément à une présentation de drogue nouvelle pour usage exceptionnel ou à une présentation abrégée de drogue nouvelle pour usage exceptionnel contient l’attestation et les renseignements à l’appui prévus à l’alinéa C.08.002.01(2)a).
- DORS/85-143, art. 2
- DORS/93-202, art. 25
- DORS/95-411, art. 6
- DORS/2011-88, art. 13
- DORS/2014-158, art. 13
- DORS/2017-259, art. 23
- DORS/2018-69, art. 33(F)
- DORS/2018-84, art. 9(F)
C.08.003.01 (1) Les définitions ci-après s’appliquent au présent article.
- présentation
présentation
a) toute présentation de drogue nouvelle déposée en application de l’article C.08.002;
b) toute présentation de drogue nouvelle pour usage exceptionnel déposée en application de l’article C.08.002.01;
c) toute présentation abrégée de drogue nouvelle déposée en application de l’article C.08.002.1;
d) toute présentation abrégée de drogue nouvelle pour usage exceptionnel déposée en application de l’article C.08.002.1. (submission)
- supplément
supplément Supplément à une présentation déposé en application de l’article C.08.003. (supplement)
(2) Malgré les articles C.08.002, C.08.002.01, C.08.002.1 et C.08.003 et sous réserve du paragraphe (3), le fabricant d’une drogue nouvelle ne peut déposer une présentation ou un supplément à l’égard de la drogue nouvelle sur la base d’une comparaison directe ou indirecte entre celle-ci et toute drogue nouvelle qui a fait l’objet d’une autorisation délivrée en vertu de l’arrêté d’urgence IVPD.
(3) Le paragraphe (2) n’empêche pas le fabricant d’une drogue nouvelle de déposer une présentation ou un supplément à l’égard de la drogue nouvelle sur la base d’une comparaison directe ou indirecte entre celle-ci et une autre drogue nouvelle qui a fait l’objet d’une autorisation délivrée en vertu de l’arrêté d’urgence IVPD si, à la fois :
a) un avis de conformité est délivré en vertu des articles C.08.004 ou C.08.004.01 relativement à une présentation ou à un supplément pour cette autre drogue nouvelle;
b) la comparaison concerne les éléments approuvés par l’avis de conformité.
C.08.003.1 Le ministre peut, dans le cadre de son examen d’une présentation de drogue nouvelle, d’une présentation de drogue nouvelle pour usage exceptionnel, d’une présentation abrégée de drogue nouvelle, d’une présentation abrégée de drogue nouvelle pour usage exceptionnel ou d’un supplément à l’une de ces présentations, examiner les renseignements ou le matériel que lui présente toute personne, en vertu du titre 5 ou des articles C.08.002, C.08.002.01, C.08.002.1, C.08.003, C.08.005 ou C.08.005.1, pour déterminer l’innocuité et l’efficacité de la drogue nouvelle visée par la présentation ou le supplément.
- DORS/95-411, art. 6
- DORS/2001-203, art. 5
- DORS/2011-88, art. 14
C.08.004 (1) Sous réserve de l’article C.08.004.1, après avoir terminé l’examen d’une présentation de drogue nouvelle, d’une présentation abrégée de drogue nouvelle ou d’un supplément à l’une de ces présentations, le ministre :
a) si la présentation ou le supplément est conforme aux articles C.08.002, C.08.002.1 ou C.08.003, selon le cas, et à l’article C.08.005.1, délivre un avis de conformité;
b) si la présentation ou le supplément n’est pas conforme aux articles C.08.002, C.08.002.1 ou C.08.003, selon le cas, ou à l’article C.08.005.1, délivre un avis à cet effet au fabricant.
(2) Le fabricant qui a déposé une présentation de drogue nouvelle, une présentation abrégée de drogue nouvelle ou un supplément à l’une de ces présentations non conformes aux articles C.08.002, C.08.002.1 ou C.08.003, selon le cas, ou à l’article C.08.005.1, peut modifier la présentation ou le supplément en déposant des renseignements ou du matériel supplémentaires dans les quatre-vingt-dix jours suivant la date à laquelle le ministre lui délivre un avis en application de l’alinéa C.08.004(1)b) ou dans tout délai plus long imparti par le ministre.
(3) Sous réserve de l’article C.08.004.1, après avoir terminé l’examen des renseignements et du matériel supplémentaires déposés relativement à une présentation de drogue nouvelle, à une présentation abrégée de drogue nouvelle ou à un supplément à l’une de ces présentations, le ministre :
a) si la présentation ou le supplément est conforme aux articles C.08.002, C.08.002.1 ou C.08.003, selon le cas, et à l’article C.08.005.1, délivre un avis de conformité;
b) si la présentation ou le supplément n’est pas conforme aux articles C.08.002, C.08.002.1 ou C.08.003, selon le cas, ou à l’article C.08.005.1, délivre un avis à cet effet au fabricant.
(4) L’avis de conformité délivré à l’égard d’une drogue nouvelle d’après les renseignements et le matériel contenus dans la présentation déposée conformément à l’article C.08.002.1 indique le nom du produit de référence canadien mentionné dans la présentation et constitue la déclaration d’équivalence de cette drogue.
- DORS/84-267, art. 1 à 3
- DORS/85-143, art. 3
- DORS/86-1009, art. 1
- DORS/86-1101, art. 1
- DORS/88-42, art. 1
- DORS/88-257, art. 1
- DORS/95-411, art. 6
- DORS/2019-62, art. 1
C.08.004.01 (1) Sous réserve de l’article C.08.004.1, après avoir terminé l’examen d’une présentation de drogue nouvelle pour usage exceptionnel, d’une présentation abrégée de drogue nouvelle pour usage exceptionnel ou d’un supplément à l’une de ces présentations, le ministre :
a) si la présentation ou le supplément est conforme aux articles C.08.002.01, C.08.002.1 ou C.08.003, selon le cas, et à l’article C.08.005.1, délivre un avis de conformité;
b) si la présentation ou le supplément n’est pas conforme aux articles C.08.002.01, C.08.002.1 ou C.08.003, selon le cas, ou à l’article C.08.005.1, délivre un avis à cet effet au fabricant.
(2) Le fabricant qui a déposé une présentation de drogue nouvelle pour usage exceptionnel, une présentation abrégée de drogue nouvelle pour usage exceptionnel ou un supplément à l’une de ces présentations non conformes aux articles C.08.002.01, C.08.002.1 ou C.08.003, selon le cas, ou à l’article C.08.005.1, peut modifier la présentation ou le supplément en déposant des renseignements ou du matériel supplémentaires dans les quatre-vingt-dix jours suivant la date à laquelle le ministre lui délivre un avis en application de l’alinéa C.08.004.01(1)b) ou dans tout délai plus long imparti par le ministre.
(3) Sous réserve de l’article C.08.004.1, après avoir terminé l’examen des renseignements et du matériel supplémentaires déposés relativement à une présentation de drogue nouvelle pour usage exceptionnel, à une présentation abrégée de drogue nouvelle pour usage exceptionnel ou à un supplément à l’une de ces présentations, le ministre :
a) si la présentation ou le supplément est conforme aux articles C.08.002.01, C.08.002.1 ou C.08.003, selon le cas, et à l’article C.08.005.1, délivre un avis de conformité;
b) si la présentation ou le supplément n’est pas conforme aux articles C.08.002.01, C.08.002.1 ou C.08.003, selon le cas, ou à l’article C.08.005.1, délivre un avis à cet effet au fabricant.
(4) L’avis de conformité délivré à l’égard d’une drogue nouvelle pour usage exceptionnel d’après les renseignements et le matériel contenus dans la présentation déposée aux termes de l’article C.08.002.1 indique le nom du produit de référence canadien mentionné dans la présentation et constitue la déclaration d’équivalence de cette drogue.
- DORS/2011-88, art. 15
- DORS/2019-62, art. 2
C.08.004.1 (1) Les définitions qui suivent s’appliquent au présent article.
- drogue innovante
drogue innovante S’entend de toute drogue qui contient un ingrédient médicinal non déjà approuvé dans une drogue par le ministre et qui ne constitue pas une variante d’un ingrédient médicinal déjà approuvé tel un changement de sel, d’ester, d’énantiomère, de solvate ou de polymorphe. (innovative drug)
- population pédiatrique
population pédiatrique S’entend de chacun des groupes suivants : les bébés prématurés nés avant la 37e semaine de gestation, les bébés menés à terme et âgés de 0 à 27 jours, tous les enfants âgés de 28 jours à deux ans, ceux âgés de deux ans et un jour à 11 ans et ceux âgés de 11 ans et un jour à 18 ans. (pediatric populations)
- présentation abrégée de drogue nouvelle
présentation abrégée de drogue nouvelle S’entend également d’une présentation abrégée de drogue nouvelle pour usage exceptionnel. (abbreviated new drug submission)
- présentation de drogue nouvelle
présentation de drogue nouvelle S’entend également d’une présentation de drogue nouvelle pour usage exceptionnel. (new drug submission)
(1.1) Pour l’application de la définition de drogue innovante au paragraphe (1), un ingrédient médicinal n’est pas considéré comme étant approuvé dans une drogue du fait que le ministre a délivré ou modifié, en vertu de l’arrêté d’urgence IVPD, une autorisation à l’égard d’une drogue contre la COVID-19 qui le contient.
(2) L’objet du présent article est de mettre en oeuvre les articles 20.48 et 20.49 de l’Accord entre le Canada, les États-Unis d’Amérique et les États-Unis du Mexique, au sens de Accord à l’article 2 de la Loi de mise en oeuvre de l’Accord Canada–États-Unis–Mexique, et le paragraphe 3 de l’article 39 de l’Accord sur les aspects des droits de propriété intellectuelle qui touchent au commerce figurant à l’annexe 1C de l’Accord instituant l’Organisation mondiale du commerce, au sens de Accord au paragraphe 2(1) de la Loi de mise en oeuvre de l’Accord sur l’Organisation mondiale du commerce.
(3) Lorsque le fabricant demande la délivrance d’un avis de conformité pour une drogue nouvelle sur la base d’une comparaison directe ou indirecte entre celle-ci et la drogue innovante :
a) le fabricant ne peut déposer pour cette drogue nouvelle de présentation de drogue nouvelle, de présentation abrégée de drogue nouvelle ou de supplément à l’une de ces présentations avant l’expiration d’un délai de six ans suivant la date à laquelle le premier avis de conformité a été délivré à l’innovateur pour la drogue innovante;
b) le ministre ne peut approuver une telle présentation ou un tel supplément et ne peut délivrer d’avis de conformité pour cette nouvelle drogue avant l’expiration d’un délai de huit ans suivant la date à laquelle le premier avis de conformité a été délivré à l’innovateur pour la drogue innovante.
(4) Le délai prévu à l’alinéa (3)b) est porté à huit ans et six mois si, à la fois :
a) l’innovateur fournit au ministre la description et les résultats des essais cliniques concernant l’utilisation de la drogue innovante dans les populations pédiatriques concernées dans sa première présentation de drogue nouvelle à l’égard de la drogue innovante ou dans tout supplément à une telle présentation déposé au cours des cinq années suivant la délivrance du premier avis de conformité à l’égard de cette drogue innovante;
b) le ministre conclut, avant l’expiration du délai de six ans qui suit la date à laquelle le premier avis de conformité a été délivré à l’innovateur pour la drogue innovante, que les essais cliniques ont été conçus et menés en vue d’élargir les connaissances sur l’utilisation de cette drogue dans les populations pédiatriques visées et que ces connaissances se traduiraient par des avantages pour la santé des membres de celles-ci.
(5) Le paragraphe (3) ne s’applique pas si la drogue innovante n’est pas commercialisée au Canada.
(6) L’alinéa (3)a) ne s’applique pas au fabricant dans le cas où l’innovateur consent à ce qu’il dépose une présentation de drogue nouvelle, une présentation abrégée de drogue nouvelle ou un supplément à l’une de ces présentations avant l’expiration du délai de six ans prévu à cet alinéa.
(7) L’alinéa (3)a) ne s’applique pas au fabricant s’il dépose une demande d’autorisation pour vendre cette drogue nouvelle aux termes de l’article C.07.003.
(8) L’alinéa (3)b) ne s’applique pas au fabricant dans le cas où l’innovateur consent à ce que lui soit délivré un avis de conformité avant l’expiration du délai de huit ans prévu à cet alinéa ou de huit ans et six mois prévu au paragraphe (4).
(9) Le ministre tient un registre des drogues innovantes, lequel contient les renseignements relatifs à l’application des paragraphes (3) et (4).
- DORS/95-411, art. 6
- DORS/2006-241, art. 1
- DORS/2011-88, art. 16
- DORS/2014-124, art. 1
- DORS/2020-74, art. 6
- DORS/2021-45, art. 16
C.08.005 (1) Sous réserve du paragraphe (1.1) et par dérogation aux articles C.08.002 et C.08.003, le fabricant d’une drogue nouvelle peut vendre celle-ci à un chercheur qualifié à la seule fin d’effectuer un essai clinique pour obtenir des preuves sur l’innocuité, la posologie et l’efficacité de la drogue nouvelle, si les conditions suivantes sont réunies :
a) le fabricant a, avant la vente, déposé auprès du ministre, conformément à l’article C.08.005.1, une présentation préclinique contenant des renseignements et du matériel se rapportant à ce qui suit :
(i) la marque nominative de la drogue nouvelle ou le nom ou code d’identification projeté pour celle-ci,
(ii) la structure chimique ou tout autre détail spécifique qui permet de déterminer la composition de la drogue nouvelle,
(iii) la provenance de la drogue nouvelle,
(iv) un protocole détaillé de l’essai clinique,
(v) les résultats des recherches effectuées pour motiver l’usage clinique de la drogue nouvelle,
(vi) les contre-indications et les précautions connues relativement à la drogue nouvelle, ainsi que le traitement recommandé en cas d’absorption de dose excessive,
(vii) tous les ingrédients de la drogue nouvelle, déclarés sous forme quantitative,
(viii) l’usine, les méthodes, l’outillage et les contrôles utilisés pour la fabrication, le conditionnement et l’empaquetage de la drogue nouvelle,
(ix) les essais effectués en vue de contrôler l’activité, la pureté et l’innocuité de la drogue nouvelle,
(x) les noms et les titres et compétences de tous les chercheurs auxquels la drogue doit être vendue, ainsi que les noms de tous les établissements où l’essai clinique doit avoir lieu;
b) dans les 60 jours suivant la date de réception de la présentation préclinique, le ministre n’a pas fait parvenir au fabricant, par courrier recommandé, un avis indiquant que la présentation de drogue nouvelle n’est pas satisfaisante;
c) toutes les étiquettes intérieures et extérieures utilisées relativement à la vente de la drogue nouvelle portent les mentions suivantes :
(i) « Drogue de recherche » ou « Investigational Drug »,
(ii) « Réservé uniquement à l’usage de chercheurs compétents » ou « To Be Used By Qualified Investigators Only »;
d) le fabricant, avant la vente, vérifie que tout chercheur compétent à qui il est censé vendre la drogue nouvelle :
(i) dispose des installations voulues pour l’essai clinique qu’il doit effectuer,
(ii) a reçu les renseignements et la documentation visés aux sous-alinéas a)(i) à (vi);
e) tout chercheur compétent à qui la drogue nouvelle doit être vendue a convenu par écrit avec le fabricant qu’il :
(i) n’utilisera pas la drogue nouvelle ou ne permettra pas son utilisation à d’autres fins que l’essai clinique,
(ii) ne permettra pas l’usage de la drogue nouvelle par une personne autre que lui-même, sauf sous sa direction,
(iii) signalera immédiatement au fabricant, ainsi qu’au ministre si celui-ci le lui demande, tout ce qui touche les réactions indésirables importantes qui auront été observées pendant l’essai clinique,
(iv) rendra compte au fabricant, sur demande de celui-ci, de toutes les quantités de drogue nouvelle qu’il aura reçues.
(1.1) Le présent article ne s’applique qu’aux drogues nouvelles pour usage vétérinaire.
(2) Nonobstant le paragraphe (1) ci-dessus, il est interdit à tout fabricant de vendre une drogue nouvelle à un chercheur compétent, à moins que, au sujet de toutes les ventes préalables de cette drogue nouvelle à n’importe quel chercheur compétent, le fabricant n’ait
a) tenu des registres exacts de la distribution de cette drogue nouvelle et des résultats des épreuves cliniques, et présenté lesdits registres à l’inspection, à la demande du ministre; et
b) rapporté immédiatement au ministre tous les renseignements obtenus par lui-même au sujet de réactions fâcheuses importantes.
(3) Le ministre peut aviser le fabricant d’une drogue nouvelle que la vente de cette drogue nouvelle aux chercheurs compétents est interdite si, de l’avis du ministre, cette mesure est dans l’intérêt de la santé publique.
(4) Nonobstant le paragraphe (1) ci-dessus, il est interdit à un fabricant de vendre une drogue nouvelle à un chercheur compétent si le ministre a avisé ce fabricant que la vente de ladite drogue est interdite.
(5) L’alinéa (1)c) ne s’applique pas aux produits pharmaceutiques radioactifs définis à l’article C.03.201, ni aux constituants ni aux trousses définis à l’article C.03.205.
- DORS/79-236, art. 5
- DORS/85-143, art. 4
- DORS/87-511, art. 1
- DORS/93-202, art. 26
- DORS/95-411, art. 7
- DORS/2001-203, art. 6
- DORS/2018-69, art. 27
C.08.005.1 (1) Le fabricant qui dépose une présentation de drogue nouvelle, une présentation de drogue nouvelle pour usage exceptionnel, une présentation abrégée de drogue nouvelle, une présentation abrégée de drogue nouvelle pour usage exceptionnel, un supplément à l’une de ces présentations ou une présentation pour l’essai clinique d’une drogue nouvelle pour usage vétérinaire doit, en plus des renseignements et du matériel exigés aux articles C.08.002, C.08.002.01, C.08.002.1, C.08.003 et C.08.005, y inclure :
a) [Abrogé, DORS/2018-84, art. 10]
b) un résumé de section pour chaque étude sur l’homme, sur l’animal et in vitro comprise dans la présentation ou le supplément;
c) une synthèse globale de chaque étude sur l’homme, sur l’animal et in vitro qui est comprise dans la présentation ou le supplément ou à laquelle il est fait renvoi;
d) une attestation concernant les renseignements et le matériel que contient la présentation ou le supplément, ainsi que les renseignements ou le matériel supplémentaires déposés, le cas échéant, aux fins de la modification de la présentation ou du supplément.
(2) Le résumé de section visé à l’alinéa (1)b) doit comprendre :
a) un résumé de chaque étude comprise dans la présentation ou le supplément;
b) un sommaire des renseignements ou du matériel supplémentaires déposés, le cas échéant, aux fins de la modification de la présentation ou du supplément;
c) lorsque le fabricant dispose des données brutes d’une étude :
(i) un sommaire de ces données,
(ii) les renvois aux parties pertinentes du résumé de section,
(iii) la description des conditions dans lesquelles se sont déroulées les expériences desquelles les données ont été obtenues,
(iv) les détails du mode de traitement des données,
(v) les résultats et les conclusions de l’étude.
(3) La synthèse globale visée à l’alinéa (1)c) doit comprendre un sommaire des méthodes utilisées, des résultats obtenus et des conclusions émises pour les études qui sont comprises dans la présentation ou le supplément ou auxquelles il est fait renvoi, et doit indiquer les renvois aux parties pertinentes des résumés de sections.
(4) L’attestation visée à l’alinéa (1)d) doit :
a) attester que les renseignements et le matériel compris dans la présentation ou le supplément et tout renseignement ou matériel supplémentaire déposé aux fins de la modification de la présentation ou du supplément sont exacts et complets, et que les résumés de sections et la synthèse globale représentent fidèlement les renseignements et le matériel qui sont compris dans la présentation ou le supplément ou auxquels il est fait renvoi;
b) être datée et signée à la fois par :
(i) le premier dirigeant au Canada du fabricant qui dépose la présentation ou le supplément,
(ii) le directeur médical ou scientifique du fabricant.
(5) [Abrogé, DORS/2018-84, art. 10]
(6) Le fabricant qui a déposé une présentation de drogue nouvelle, une présentation de drogue nouvelle pour usage exceptionnel, une présentation abrégée de drogue nouvelle, une présentation abrégée de drogue nouvelle pour usage exceptionnel, un supplément à l’une de ces présentations ou une présentation pour l’essai clinique d’une drogue nouvelle pour usage vétérinaire sans y inclure les fiches d’observations cliniques ou les données brutes y ayant trait doit conserver ces fiches ou ces données et les soumettre au ministre, s’il en fait la demande par écrit, dans les trente jours suivant la réception de celle-ci.
- DORS/85-143, art. 5
- DORS/92-543, art. 1
- DORS/94-689, art. 2(F)
- DORS/95-411, art. 8
- DORS/2001-203, art. 7
- DORS/2011-88, art. 17
- DORS/2018-84, art. 10
C.08.006 (1) Pour l’application du paragraphe (2), les éléments de preuve ou les nouveaux renseignements obtenus par le ministre comprennent les renseignements et le matériel que lui présente toute personne au titre du titre 5 ou des articles C.08.002, C.08.002.01, C.08.002.1, C.08.003, C.08.005 ou C.08.005.1.
(2) Le ministre peut suspendre, pour une période déterminée ou indéterminée, l’avis de conformité délivré à un fabricant à l’égard d’une présentation de drogue nouvelle, d’une présentation de drogue nouvelle pour usage exceptionnel, d’une présentation abrégée de drogue nouvelle, d’une présentation abrégée de drogue nouvelle pour usage exceptionnel ou d’un supplément à l’une de ces présentations, en envoyant au fabricant une notification indiquant que cette mesure est nécessaire, s’il estime :
a) que la drogue n’est pas sans danger aux fins spécifiées dans la présentation ou le supplément, en s’appuyant sur des éléments de preuve obtenus :
(i) soit d’essais cliniques ou autres expériences qui ne sont pas signalés dans la présentation ou le supplément ou qui ne lui étaient accessibles au moment de la délivrance de l’avis de conformité,
(ii) soit d’analyses par de nouvelles méthodes ou par des méthodes qui ne pouvaient vraisemblablement s’appliquer au moment de la délivrance de l’avis de conformité;
b) que, d’après de nouveaux renseignements obtenus après la délivrance de l’avis de conformité, il n’y a pas assez de preuves substantielles que la drogue aura l’effet qui lui est attribué, dans les conditions d’usage prescrites, recommandées ou proposées par le fabricant;
c) que la présentation ou le supplément renfermait une fausse déclaration touchant un fait substantiel;
d) que le fabricant n’a pas établi un système pour tenir les registres exigés, ou qu’il a manqué, à plusieurs reprises, ou délibérément, de tenir lesdits registres;
e) que, d’après des renseignements nouveaux obtenus après la délivrance de l’avis de conformité, les méthodes, l’outillage, l’usine ou les contrôles employés pour la fabrication, le conditionnement ou l’empaquetage de la drogue, ne suffisent pas à assurer ou à conserver l’identité, la force, la qualité ou la pureté de la drogue nouvelle;
f) que, d’après des renseignements nouveaux obtenus après la délivrance de l’avis de conformité, l’étiquette de la drogue est fausse, trompeuse ou incomplète sous quelque rapport que ce soit, et que le fabricant n’a pas rectifié ce défaut après que le ministre l’en a informé par écrit, en spécifiant l’aspect particulier de l’étiquette qui est faux, trompeur ou incomplet; ou
g) dans le cas d’une drogue nouvelle pour usage exceptionnel, que le fabricant n’a pas suivi le plan visé au sous-alinéa C.08.002.01(2)b)(ix).
(3) Le ministre peut suspendre, pour une période déterminée ou indéterminée, l’avis de conformité délivré à un fabricant à l’égard d’une présentation de drogue nouvelle, d’une présentation de drogue nouvelle pour usage exceptionnel, d’une présentation abrégée de drogue nouvelle, d’une présentation abrégée de drogue nouvelle pour usage exceptionnel ou d’un supplément à l’une de ces présentations en envoyant au fabricant une notification indiquant que cette mesure est nécessaire si, après qu’il a ordonné en vertu de l’article 21.31 de la Loi au titulaire d’une autorisation relative à un produit thérapeutique visée au sous-alinéa C.01.052(1)a)(iii) d’effectuer une évaluation de la drogue nouvelle en vue de fournir des preuves établissant que les bénéfices liés à la drogue l’emportent sur les risques de préjudice à la santé :
a) le titulaire ne se conforme pas à l’ordre;
b) le titulaire se conforme à l’ordre, mais le ministre conclut que les résultats de l’évaluation sont insuffisants pour établir que les bénéfices liés à la drogue l’emportent sur les risques de préjudice à la santé.
- DORS/95-411, art. 9
- DORS/2001-203, art. 8
- DORS/2011-88, art. 18
- DORS/2018-69, art. 27
- DORS/2018-84, art. 11
- DORS/2020-262, art. 5
C.08.007 (1) Lorsqu’un fabricant a reçu un avis de conformité à l’égard d’une présentation de drogue nouvelle, d’une présentation de drogue nouvelle pour usage exceptionnel, d’une présentation abrégée de drogue nouvelle, d’une présentation abrégée de drogue nouvelle pour usage exceptionnel ou d’un supplément à l’une de ces présentations, il doit établir et tenir, de façon à en permettre la vérification, des registres concernant ce qui suit :
a) les expériences animales et les épreuves cliniques, les études, recherches et tests, effectués par le fabricant ou qui lui sont rapportés par toute autre personne, au sujet de cette drogue nouvelle;
b) les rapports publiés dans la documentation scientifique, ou la bibliographie scientifique dont il dispose, au sujet de cette drogue nouvelle;
c) les expériences, recherches, études et tests, au sujet des propriétés physiques ou chimiques, ou de toute autre propriété de cette drogue nouvelle;
d) toute substitution d’une autre substance pour cette drogue nouvelle, et tout mélange d’une autre substance avec cette drogue nouvelle;
e) toute erreur dans l’étiquetage de cette drogue nouvelle, ou dans l’usage des étiquettes destinées à cette drogue nouvelle;
f) toute modification ou détérioration importante de nature physique ou chimique, tout changement au point de vue bactériologique, et toute autre modification ou détérioration, dans n’importe quel lot de cette drogue nouvelle;
g) toute occasion où un ou plusieurs lots distribués de cette drogue nouvelle n’étaient pas conformes aux spécifications établies dans la présentation ou le supplément;
h) tout cas inhabituel où la drogue nouvelle ne produit pas l’effet prévu.
i) [Abrogé, DORS/95-521, art. 3]
(1.1) Le fabricant conserve tout registre relatif aux renseignements visés au paragraphe (1) durant une période minimale de sept ans à compter de la date de son établissement;
(2) Le fabricant ou l’importateur qui vend une drogue nouvelle pour usage exceptionnel conformément à l’article C.08.002.02 doit conserver la commande écrite durant une période minimale de quinze ans à partir de l’exécution de la commande.
- DORS/95-411, art. 10
- DORS/95-521, art. 3
- DORS/2011-88, art. 19
- DORS/2014-125, art. 2
C.08.008 Il est interdit au fabricant de vendre une drogue nouvelle à moins que, à l’égard de ses ventes antérieures de cette drogue, il n’ait fourni au ministre :
a) le résumé d’un registre relatif à tout renseignement visé aux alinéas C.08.007(1)a) à c), sur réception d’une demande du ministre à cet effet;
b) le résumé d’un registre relatif à tout renseignement visé aux alinéas C.08.007(1)d) à f), dès son établissement par le fabricant;
c) le résumé d’un registre relatif à tout renseignement visé aux alinéas C.08.007(1)g) ou h), dans les quinze jours suivant la date de son établissement par le fabricant.
- DORS/95-411, art. 11
- DORS/95-521, art. 4
- DORS/2014-125, art. 3
- DORS/2018-84, art. 12
C.08.008.1 Lorsqu’un fabricant a reçu un avis de conformité à l’égard d’une présentation de drogue nouvelle pour usage exceptionnel, d’une présentation abrégée de drogue nouvelle pour usage exceptionnel ou d’un supplément à l’une de ces présentations, il doit :
a) suivre le plan visé au sous-alinéa C.08.002.01(2)b)(ix);
b) fournir au ministre, avant le 1er octobre de chaque année et lorsque celui-ci lui en fait la demande afin d’évaluer l’innocuité et l’efficacité de la drogue visée par l’avis de conformité, un rapport sur son utilisation, y compris une analyse critique des renseignements à jour disponibles concernant son innocuité et son efficacité.
- DORS/2011-88, art. 20
C.08.009 (1) Lorsque le ministre a décidé
a) de notifier le fabricant d’une drogue nouvelle pour usage vétérinaire que la vente de cette drogue aux chercheurs qualifiés est interdite, ou
b) de suspendre l’avis de conformité délivré en application des articles C.08.004 ou C.08.004.01,
le fabricant peut s’il n’est pas satisfait de cette décision, demander au ministre de lui fournir les raisons de ladite décision.
(2) Lorsque ledit fabricant a reçu les raisons de la décison du ministre par application du paragraphe (1), il peut demander au ministre de déférer cette décision à un Comité des drogues nouvelles et, sur ce, il doit fournir au ministre une déclaration des motifs de son insatisfaction, ainsi que tout renseignement et tout matériel à l’appui de ses motifs.
(3) Lorsque le ministre a été prié de déférer une décision à un Comité des drogues nouvelles par application du paragraphe (2), il doit nommer un membre au Comité des drogues nouvelles, le fabricant insatisfait doit nommer un membre au Comité des drogues nouvelles, et les deux membres ainsi nommés doivent, ensemble, nommer au Comité des drogues nouvelles, un troisième membre qui sera président du Comité, ou si ces deux membres ne peuvent le faire dans un délai raisonnable, le ministre doit nommer au Comité des drogues nouvelles, un troisième membre qui sera président du Comité.
(4) Aucune personne qui est employée à temps complet par le ministère, ou employée à temps complet par le fabricant non satisfait, ne sera nommée membre d’un Comité des drogues nouvelles.
(4.1) Chaque membre nommé à un Comité des drogues nouvelles est tenu de signer l’engagement de ne pas communiquer ni utiliser les renseignements, matériel, données, preuves et observations considérés en vertu du paragraphe (6).
(5) Le ministre doit payer des honoraires et des frais raisonnables au membre du Comité des drogues nouvelles nommé par le ministre, et le fabricant non satisfait doit payer des honoraires et des frais raisonnables au membre qu’il aura lui-même nommé au comité des drogues nouvelles, et le ministre et le fabricant insatisfait paieront, à parts égales, des honoraires et des frais raisonnables au président de ce comité.
(6) Le Comité des drogues nouvelles formé en application du paragraphe (3) doit peser les motifs de la décision du ministre, les motifs de l’insatisfaction du fabricant et tout renseignement ou matériel à l’appui de la décision du ministre ou de l’insatisfaction du fabricant et peut prendre en considération d’autres preuves, matériel, renseignements ou observations.
(7) Le Comité des drogues nouvelles formé par application du paragraphe (3), doit faire rapport au ministre de ses constatations et de ses recommandations.
(7.1) Les membres d’un Comité des drogues nouvelles ne peuvent divulguer ni utiliser les renseignements, matériel, données, preuves et observations considérés en vertu du paragraphe (6).
(8) Lorsque le ministre a reçu les constatations et recommandations du Comité des drogues nouvelles, il peut revenir sur la décision qui fait l’objet de ces constatations et recommandations.
- DORS/95-411, art. 12
- DORS/2001-203, art. 9
- DORS/2011-88, art. 21
Prépositionnement de drogues désignées contre la COVID-19
C.08.009.01 Les définitions suivantes s’appliquent aux articles C.08.009.03 à C.08.009.05.
- administrateur en chef de la santé publique
administrateur en chef de la santé publique s’entend de l’administrateur en chef de la santé publique nommé en vertu du paragraphe 6(1) de la Loi sur l’Agence de la santé publique du Canada. (Chief Public Health Officer)
- autorité réglementaire étrangère
autorité réglementaire étrangère Tout organisme gouvernemental ou toute autre entité, ailleurs qu’au Canada, qui est habilité à contrôler la fabrication, l’utilisation ou la vente de drogues dans le territoire relevant de sa compétence et qui peut prendre des mesures d’exécution pour veiller à ce que les drogues qui y sont commercialisées satisfassent aux exigences légales qui s’appliquent. (foreign regulatory authority)
C.08.009.02 Les articles C.08.009.03 à C.08.009.05 s’appliquent à l’égard de la drogue désignée contre la COVID-19 si les conditions suivantes sont réunies :
a) aucun avis de conformité n’a été délivré à son égard en vertu de l’article C.08.004 ou C.08.004.01;
b) Sa Majesté du chef du Canada a conclu un contrat en vue de son acquisition.
C.08.009.03 (1) Le titulaire d’une licence d’établissement peut importer une drogue désignée contre la COVID-19 si les conditions suivantes sont réunies :
a) l’administrateur en chef de la santé publique fournit au ministre :
(i) de l’information selon laquelle :
(A) ou bien la drogue désignée contre la COVID-19 fait l’objet d’une présentation de drogue nouvelle déposée en application de l’article C.08.002,
(B) ou bien une demande d’autorisation de vente a été présentée à une autorité réglementaire étrangère à l’égard de la drogue désignée contre la COVID-19,
(ii) le nom et la description de la drogue désignée contre la COVID-19,
(iii) les nom et coordonnées du fabricant de la drogue désignée contre la COVID-19,
(iv) de l’information quant à la quantité de la drogue désignée contre la COVID-19 à importer,
(v) les nom et coordonnées de tout titulaire de licence d’établissement envisagé pour l’importation de la drogue désignée contre la COVID-19,
(vi) l’adresse municipale du lieu où la drogue désignée contre la COVID-19 sera entreposée après l’importation;
b) le titulaire de licence fournit au ministre :
(i) les nom et coordonnées de chaque manufacturier, emballeur-étiqueteur et analyste de la drogue désignée contre la COVID-19 et l’adresse municipale de chaque bâtiment où celle-ci sera manufacturée, emballée-étiquetée ou analysée, avec indication, pour chaque bâtiment, de ce qui suit :
(A) les activités mentionnées au tableau I de l’article C.01A.008 qui s’appliquent à la drogue désignée contre la COVID-19,
(B) les catégories mentionnées au tableau II de cet article qui s’appliquent à la drogue désignée contre la COVID-19,
(C) pour chacune de ces catégories, la classe de forme posologique, le cas échéant, et une mention indiquant s’il s’agit d’une drogue stérile,
(ii) le certificat d’un inspecteur indiquant que les bâtiments, l’équipement et les méthodes et pratiques de chaque manufacturier, emballeur-étiqueteur et analyste satisfont aux exigences applicables des titres 2 à 4 ou, à défaut, toute autre preuve établissant qu’il est satisfait à ces exigences;
c) le titulaire de licence est l’un de ceux que l’administrateur en chef de la santé publique mentionne dans les renseignements fournis en aux termes du sous-alinéa a)(v).
(2) L’alinéa (1)b) ne s’applique pas au titulaire de licence d’établissement à l’égard de tout bâtiment visé au sous-alinéa (1)b)(i) si les conditions suivantes sont réunies :
a) le bâtiment figure sur la licence;
b) les renseignements visés aux divisions (1)b)(i)(A) à (C) que le titulaire a fournis à l’égard du bâtiment dans la demande de licence présentée conformément à l’article C.01A.005 ou dans toute demande de modification de la licence qu’il a présentée conformément à l’article C.01A.006, demeurent inchangés.
(3) Lorsque les conditions prévues au paragraphe (1) sont remplies, le ministre fait parvenir à l’administrateur en chef de la santé publique une lettre à cet égard.
C.08.009.04 Les articles A.01.040 et C.01.004.1, le paragraphe C.01A.004(1), l’article C.01A.006 et, à l’exception des dispositions ci-après, les titres 2 à 4 ne s’appliquent pas à l’égard de l’importation, en vertu de l’article C.08.009.03, d’une drogue désignée contre la COVID-19 par le titulaire d’une licence d’établissement :
a) les articles C.02.003.1, C.02.004 et C.02.006, en ce qui a trait à l’entreposage de la drogue désignée contre la COVID-19 par le titulaire de licence;
b) le paragraphe C.02.012(1);
c) les articles C.02.013 et C.02.014;
d) l’article C.02.015, en ce qui a trait à l’entreposage et au transport de la drogue désignée contre la COVID-19 par le titulaire de licence;
e) le paragraphe C.02.021(1), en ce qui a trait à l’entreposage de la drogue désignée contre la COVID-19 par le titulaire de licence;
f) le paragraphe C.02.022(1);
g) l’article C.02.023;
h) le paragraphe C.02.024(1);
i) l’article C.03.013;
j) l’article C.04.001.1, en ce qui a trait à l’entreposage de la drogue désignée contre la COVID-19 par le titulaire de licence.
C.08.009.05 Malgré toute disposition du présent règlement, le titulaire d’une licence d’établissement peut distribuer une drogue contre la COVID-19 qu’il a importée en vertu de l’article C.08.009.03 si les conditions suivantes sont réunies :
a) l’administrateur en chef de la santé publique fournit au ministre le nom de la drogue désignée contre la COVID-19 et l’adresse municipale du lieu où elle sera entreposée après la distribution;
b) la drogue désignée contre la COVID-19 est distribuée à une personne qui l’entreposera dans ce lieu.
Communication de renseignements relatifs à des essais cliniques
C.08.009.1 (1) Aux articles C.08.009.2 et C.08.009.3, renseignements relatifs à un essai clinique s’entend des renseignements relatifs à un essai clinique, au sens de l’article C.05.001, qui sont contenus dans une présentation de drogue nouvelle, une présentation de drogue nouvelle pour usage exceptionnel, une présentation abrégée de drogue nouvelle ou une présentation abrégée de drogue nouvelle pour usage exceptionnel déposées à l’égard d’une drogue nouvelle pour usage humain aux termes des articles C.08.002, C.08.002.01 ou C.08.002.1 ou dans un supplément à l’une de ces présentations déposé aux termes de l’article C.08.003.
(2) Il est entendu que la définition de renseignements relatifs à un essai clinique vise notamment les renseignements qui sont contenus dans une présentation ou un supplément visés dans cette définition et qui sont relatifs à un essai clinique sur des sujets humains relativement auquel une demande a été déposée en application du présent titre avant le 1er septembre 2001.
C.08.009.2 (1) Les renseignements relatifs à un essai clinique qui sont des renseignements commerciaux confidentiels cessent d’être des renseignements commerciaux confidentiels au moment où l’une des circonstances ci-après survient relativement à la présentation ou au supplément :
a) le ministre délivre un avis de conformité en application des articles C.08.004 ou C.08.004.01;
b) dans le cas où le ministre délivre un avis au fabricant, en application des alinéas C.08.004(1)b) ou C.08.004.01(1)b), et que le fabricant ne modifie pas la présentation ou le supplément en vertu des paragraphes C.08.004(2) ou C.08.004.01(2), celui des délais visés au paragraphe pertinent qui s’applique expire;
c) le ministre délivre un avis au fabricant, en application des alinéas C.08.004(3)b) ou C.08.004.01(3)b).
(2) Le paragraphe (1) ne s’applique pas aux renseignements relatifs à un essai clinique suivants :
a) ceux que le fabricant n’a pas utilisés dans la présentation ou le supplément pour étayer le mode d’emploi proposé de la nouvelle drogue ou les fins pour lesquelles celle-ci est recommandée;
b) ceux qui décrivent les tests, méthodes et essais utilisés exclusivement par le fabricant.
C.08.009.3 Le ministre peut communiquer les renseignements relatifs à un essai clinique qui se rapportent à l’entreprise d’une personne ou à ses activités et qui ont cessé d’être des renseignements commerciaux confidentiels, et ce sans obtenir son consentement et sans l’aviser.
Vente d’une drogue nouvelle pour soins d’urgence
- DORS/2020-212, art. 1(F)
C.08.010 (1) Le ministre peut, si les conditions ci-après sont réunies, délivrer au fabricant d’une drogue nouvelle une lettre d’autorisation permettant la vente à un praticien, pour usage humain ou vétérinaire, d’une quantité déterminée de cette drogue afin que le praticien puisse prodiguer des soins d’urgence à un animal ou à une personne qu’il traite à titre professionnel :
a) le praticien fournit au ministre les renseignements suivants :
(i) le nom de la drogue nouvelle et des précisions concernant l’urgence médicale pour laquelle la drogue est requise,
(ii) la quantité de la nouvelle drogue qui est requise,
(iii) sous réserve du paragraphe (2), les renseignements qu’il possède concernant l’usage, l’innocuité et l’efficacité de la drogue nouvelle,
(iv) le nom et l’adresse municipale de la personne à qui la drogue nouvelle doit être expédiée,
(v) tout autre renseignement que le ministre peut demander pour lui permettre de décider s’il convient de délivrer la lettre d’autorisation;
b) le praticien consent :
(i) à fournir au fabricant de la drogue nouvelle et au ministre un rapport sur les résultats obtenus à la suite de l’utilisation de la drogue pour traiter l’urgence médicale, notamment les renseignements concernant toute réaction indésirable à la drogue qu’il aura observée,
(ii) à rendre compte au ministre, sur demande, de toutes les quantités de la drogue nouvelle reçue;
c) dans le cas d’une drogue nouvelle pour usage humain, la personne visée au sous-alinéa a)(iv) est un praticien ou un pharmacien;
d) dans le cas d’une drogue nouvelle pour usage vétérinaire, la personne visée au sous-alinéa a)(iv) est un praticien, un pharmacien ou une personne autorisée à vendre un aliment médicamenté en vertu de l’article C.08.012.
(2) Le sous-alinéa (1)a)(iii) ne s’applique pas si les conditions suivantes sont réunies :
a) la vente de la drogue nouvelle a été autorisée à au moins une reprise en vertu du paragraphe (1) pour traiter la même urgence médicale;
b) l’Agence européenne des médicaments ou le Secrétariat américain aux produits alimentaires et pharmaceutiques aux États-Unis a autorisé la vente de la drogue nouvelle, sans conditions, pour le même usage et dans le territoire relevant de sa compétence;
c) le ministre n’a pas, en vertu des alinéas C.01.014.6(2)b) ou c) ou du paragraphe C.01.014.6(3), annulé l’identification numérique attribuée à la drogue nouvelle.
(3) [Abrogé, DORS/2021-271, art. 4]
(4) La lettre d’autorisation délivrée contient :
a) le nom du praticien auquel la drogue nouvelle peut être vendue;
b) le nom et l’adresse municipale de la personne à qui la drogue nouvelle peut être expédiée;
c) le nom de la drogue nouvelle et l’urgence médicale pour laquelle la drogue nouvelle peut être vendue;
d) la quantité de la drogue nouvelle qui peut être vendue au praticien pour traiter l’urgence médicale.
(5) Pour l’application du présent article, le praticien n’a pas à connaître l’identité de l’animal ou de la personne qu’il traite à titre professionnel au moment de la délivrance de la lettre d’autorisation.
- DORS/2013-172, art. 11
- DORS/2018-69, art. 31(A) et 32(F)
- DORS/2020-212, art. 2
- DORS/2021-271, art. 4
C.08.011 (1) Malgré l’article C.08.002, le fabricant peut vendre une drogue nouvelle conformément à une lettre d’autorisation délivrée en vertu du paragraphe C.08.010(1).
(2) En cas de vente faite en conformité avec le paragraphe (1) d’une drogue nouvelle pour usage vétérinaire qui contient un ingrédient actif pharmaceutique figurant dans la Liste A et qui n’a pas été importée en vertu de l’article C.08.011.2, un rapport annuel indiquant la quantité totale de la drogue ayant été vendue et, pour chacune des espèces animales auxquelles la drogue est destinée, une estimation de la quantité vendue de celle-ci, est présenté au ministre par le fabricant, dans le cas où la drogue nouvelle se trouvait au Canada au moment de la vente, ou dans le cas contraire, par le praticien.
(3) La vente d’une drogue nouvelle faite en conformité avec le paragraphe (1) est exemptée de l’application de la Loi et du présent règlement, à l’exception du présent article.
(4) Le rapport visé au paragraphe (2) porte sur toute année civile — à commencer par la première année civile complète pendant laquelle la drogue a été vendue pour la première fois — et est présenté au plus tard le 31 mars de l’année civile qui suit celle qui est visée par le rapport.
C.08.011.1 (1) Le ministre peut, si les conditions ci-après sont réunies, délivrer au fabricant d’une drogue nouvelle une lettre d’autorisation permettant au titulaire d’une licence d’établissement d’importer, pour usage humain ou vétérinaire, une quantité déterminée de cette drogue :
a) le fabricant fournit au ministre les renseignements suivants :
(i) le nom de la drogue nouvelle et des précisions concernant l’urgence médicale pour laquelle la drogue nouvelle sera importée,
(ii) la quantité de la drogue nouvelle qui sera importée,
(iii) le nom du titulaire d’une licence d’établissement qui l’importera,
(iv) l’adresse municipale du lieu où la drogue nouvelle sera entreposée au Canada,
(v) tout autre renseignement que le ministre peut demander pour lui permettre de décider s’il convient de délivrer la lettre d’autorisation;
b) la licence d’établissement du titulaire autorise l’importation d’une drogue nouvelle de même catégorie que celle à importer;
c) la quantité qui sera importée n’excède pas celle que le ministre juge vraisemblablement nécessaire pour traiter l’urgence médicale.
(2) [Abrogé, DORS/2021-271, art. 5]
(3) La lettre d’autorisation contient :
a) le nom de la drogue nouvelle et l’urgence médicale pour laquelle la lettre est délivrée;
b) la quantité de la drogue nouvelle qui peut être importée pour traiter l’urgence médicale;
c) le nom du titulaire d’une licence d’établissement qui est autorisé à importer la drogue nouvelle;
d) l’adresse municipale du lieu où la nouvelle drogue sera entreposée au Canada.
C.08.011.2 (1) Malgré le paragraphe C.01A.004(1), le titulaire d’une licence d’établissement peut importer une drogue nouvelle conformément à la lettre d’autorisation délivrée en vertu du paragraphe C.08.011.1(1).
(2) L’article C.01A.006 et, à l’exception des dispositions ci-après, les titres 2 à 4 ne s’appliquent pas à l’égard de l’importation de la drogue nouvelle visée par la lettre d’autorisation délivrée :
a) les articles C.02.003.1 et C.02.004, en ce qui a trait à l’entreposage de la drogue nouvelle par le titulaire d’une licence d’établissement;
b) l’article C.02.006, en ce qui a trait à l’entreposage de la drogue nouvelle par le titulaire d’une licence d’établissement;
c) le paragraphe C.02.012(1);
d) les articles C.02.013 et C.02.014;
e) l’article C.02.015, en ce qui a trait à l’entreposage et au transport de la drogue nouvelle par le titulaire d’une licence d’établissement;
f) le paragraphe C.02.021(1), en ce qui a trait à l’entreposage de la drogue nouvelle par le titulaire d’une licence d’établissement;
g) le paragraphe C.02.022(1);
h) l’article C.02.023;
i) le paragraphe C.02.024(1);
j) l’article C.03.013;
k) l’article C.04.001.1, en ce qui a trait à l’entreposage de la drogue nouvelle par le titulaire d’une licence d’établissement.
C.08.011.3 (1) Malgré l’article C.08.002, le titulaire d’une licence d’établissement qui importe une drogue nouvelle en vertu de l’article C.08.011.2 peut la distribuer conformément à une lettre d’autorisation délivrée en vertu du paragraphe C.08.010(1).
(2) Le titulaire d’une licence d’établissement qui distribue en conformité avec le paragraphe (1) au praticien une drogue nouvelle pour usage vétérinaire qui contient un ingrédient actif pharmaceutique figurant dans la Liste A présente au ministre un rapport annuel indiquant la quantité totale de la drogue nouvelle ayant été distribuée, et pour chacune des espèces animales auxquelles la drogue est destinée, une estimation de la quantité distribuée de celle-ci.
(3) La distribution d’une drogue nouvelle faite en conformité avec le paragraphe (1) est exemptée de l’application de la Loi et du présent règlement, à l’exception du présent article.
(4) Le rapport visé au paragraphe (2) porte sur toute année civile — à commencer par la première année civile complète pendant laquelle la drogue a été distribuée pour la première fois — et est présenté au plus tard le 31 mars de l’année civile qui suit celle qui est visée par le rapport.
Vente d’aliments médicamentés
C.08.012 (1) Nonobstant toute autre disposition du présent titre, il est permis de vendre, aux termes d’une ordonnance écrite d’un vétérinaire, un aliment médicamenté si
a) quant à la drogue ou aux drogues utilisées comme substances médicatrices dans l’aliment médicamenté :
(i) soit le ministre leur a attribué une identification numérique conformément à l’article C.01.014.2,
(ii) soit leur vente est permise aux termes des articles C.08.005, C.08.011 ou C.08.013;
b) l’aliment médicamenté est destiné au traitement d’animaux directement soumis aux soins du vétérinaire ayant signé l’ordonnance;
c) l’aliment médicamenté n’est prévu qu’à des fins thérapeutiques; et
d) l’ordonnance écrite renferme les renseignements suivants :
(i) le nom et l’adresse de la personne désignée dans l’ordonnance comme celle pour qui l’aliment médicamenté est préparé,
(ii) l’espèce, le type de production et l’âge ou le poids des animaux qui seront traités avec l’aliment médicamenté,
(iii) le genre et la quantité d’aliment médicamenté à préparer,
(iv) le nom propre ou, à défaut, le nom usuel de la drogue ou de chacune des drogues, selon le cas, à être utilisées comme substances médicamenteuses dans la préparation de l’aliment médicamenté, ainsi que la posologie de ces substances,
(v) toute instruction spéciale pour la préparation, et
(vi) les instructions d’étiquetage, y compris
(A) les instructions d’alimentation,
(B) une mise en garde concernant la période de retrait à observer après l’utilisation de l’aliment médicamenté, et
(C) le cas échéant, les précautions à prendre à l’égard de la santé de l’animal ou de la manipulation ou de l’entreposage de l’aliment médicamenté.
(2) Au présent article, aliment médicamenté s’entend au sens du Règlement de 2024 sur les aliments du bétail.
- DORS/80-741, art. 1
- DORS/92-130, art. 1
- DORS/93-202, art. 27
- DORS/2018-69, art. 27
- DORS/2024-132, art. 88
Études expérimentales
Conditions de vente
C.08.013 (1) Nonobstant toute autre disposition du présent titre, il est permis de vendre à un expert en études expérimentales, une quantité spécifiée par le ministre, de drogues nouvelles d’application vétérinaire destinées à l’exécution d’une étude expérimentale chez l’animal si,
a) l’expert en études expérimentales a reçu un certificat d’études expérimentales selon le paragraphe C.08.015(1) et si le certificat n’a pas été suspendu ou annulé selon l’article C.08.018; et
b) la drogue est étiquetée conformément au paragraphe C.08.016(1).
(2) Aux fins des articles C.08.013 à C.08.018,
- certificat d’études expérimentales
certificat d’études expérimentales désigne un certificat délivré selon le paragraphe C.08.015(1);
- expert en études expérimentales
expert en études expérimentales désigne la personne visée dans un certificat d’études expérimentales;
- étude expérimentale
étude expérimentale désigne un test limité effectué par un expert en études expérimentales sur des animaux auxquels on a administré une drogue nouvelle.
- DORS/81-333, art. 1
- DORS/2018-69, art. 27
Certificat d’études expérimentales
C.08.014 (1) Afin d’obtenir un certificat d’études expérimentales, un requérant doit présenter au ministre, par écrit, les renseignements et pièces suivants :
a) la marque nominative de la drogue nouvelle ou le nom ou code d’identification projeté pour celle-ci;
b) les objectifs et le protocole du projet d’étude expérimentale de la drogue nouvelle;
c) l’espèce, le nombre et le type de production des animaux auxquels la nouvelle drogue doit être administrée;
d) le nom et l’adresse du fabricant de la drogue nouvelle;
e) l’adresse de l’établissement où l’étude expérimentale doit être effectuée;
f) une description des installations devant servir à l’étude expérimentale;
g) le nom, l’adresse et les qualifications de l’expert en études expérimentales proposé;
h) la structure chimique, si elle est connue, et les caractéristiques pertinentes de la composition de la drogue nouvelle;
i) la quantité de drogue nouvelle que l’on se propose d’utiliser au cours de l’étude expérimentale;
j) les résultats de toutes les études toxicologiques ou pharmacologiques qui ont été conduites avec la drogue nouvelle;
k) l’engagement écrit mentionné au paragraphe (2); et
l) tous autres renseignements et pièces que le ministre exige.
(2) Lorsque des animaux de boucherie doivent servir d’une manière quelconque dans une étude expérimentale, le requérant mentionné au paragraphe (1) doit, afin d’obtenir un certificat d’études expérimentales, obtenir un engagement écrit du propriétaire desdits animaux, ou d’une personne autorisée par lui, de ne pas vendre ces animaux ou tout produit en dérivant, sans obtenir au préalable une autorisation de l’expert en études expérimentales.
(3) Le ministre peut demander au fabricant d’une drogue nouvelle qu’il lui fournisse des échantillons de ladite drogue, ou de l’un quelconque de ses ingrédients, sous une forme et d’une manière satisfaisantes, et tout autre renseignement que le ministre demande. Si le ministre ne reçoit pas les échantillons et les renseignements voulus, il peut refuser de délivrer le certificat d’études expérimentales demandé.
- DORS/81-333, art. 1
- DORS/93-202, art. 28
- DORS/2018-69, art. 27
C.08.015 (1) Lorsque, à la réception des renseignements et pièces fournis selon l’article C.08.014, le ministre a conclu que :
a) le requérant a les qualifications voulues pour les fins de l’étude expérimentale envisagée,
b) les installations destinées à servir à l’étude expérimentale envisagée sont appropriées, et
c) l’étude expérimentale peut être effectuée sans risque indu et prévisible pour l’homme ou l’animal,
le ministre doit délivrer le certificat d’études expérimentales pour la conduite de l’étude expérimentale envisagée et doit y préciser la quantité de la drogue nouvelle qui peut être vendue à l’expert en études expérimentales.
(2) Lorsque, à la réception des renseignements et pièces fournis aux termes de l’article C.08.014, le ministre conclut que les exigences des alinéas (1)a), b) et c) n’ont pas été satisfaites, il refuse de délivrer le certificat d’études expérimentales.
- DORS/81-333, art. 1
- DORS/2018-69, art. 25 et 27
- DORS/2022-197, art. 9
- DORS/2023-247, art. 6
Étiquetage
C.08.016 (1) L’étiquette d’une drogue nouvelle, vendue selon l’article C.08.013, doit porter :
a) la marque nominative de la drogue nouvelle ou le nom ou code d’identification projeté pour celle-ci;
b) une mise en garde indiquant que ladite drogue ne doit être utilisée que pour les études expérimentales effectuées sur les animaux;
c) le numéro de lot;
d) le nom et l’adresse du fabricant; et
e) le nom de la personne à qui la drogue à été fournie.
(2) Les articles C.01.004, C.01.005 et C.01.014 ne s’appliquent pas à une drogue qui est vendue selon l’article C.08.013 et étiquetée conformément au paragraphe (1).
- DORS/81-333, art. 1
- DORS/88-378, art. 2
- DORS/93-202, art. 29
Conditions applicables aux études expérimentales
C.08.017 Un expert en études expérimentales doit
a) utiliser la drogue nouvelle conformément au protocole de l’étude expérimentale;
b) signaler immédiatement au ministre toute réaction indésirable grave liée à l’utilisation de la drogue nouvelle;
c) communiquer rapidement au ministre, sur demande, les résultats de l’étude expérimentale;
d) retourner au fabricant, sur demande, toute quantité de la drogue nouvelle non utilisée dans l’étude expérimentale;
e) conserver tous les dossiers de l’étude expérimentale pendant au moins deux ans suivant la fin de l’étude, et, sur demande, les mettre à la disposition du ministre;
f) signaler rapidement au ministre tout cas où l’on a disposé, contrairement aux termes de l’engagement mentionné au paragraphe C.08.014(2), d’animaux servant d’une manière quelconque dans une étude expérimentale, ou de leurs produits; et
g) rendre compte au ministre, sur demande, de toutes les quantités de la drogue nouvelle qu’il aura reçues.
- DORS/81-333, art. 1
- DORS/2001-203, art. 10
- DORS/2018-69, art. 27
Suspension ou annulation du certificat d’études expérimentales
C.08.018 (1) Lorsque le ministre conclut qu’il est nécessaire de sauvegarder la santé de l’animal ou la santé publique ou d’assurer la sécurité publique, il peut suspendre un certificat d’études expérimentales pour une période définie ou indéfinie, ou encore l’annuler.
(2) Sans restreindre la portée générale du paragraphe (1), le ministre peut suspendre ou annuler un certificat d’études expérimentales si
a) les renseignements et pièces fournis selon l’article C.08.014 comportent une fausse déclaration ou une omission concernant les propriétés de la drogue nouvelle, qui sont connues du fabricant ou de l’expert en études expérimentales, ou qui auraient raisonnablement dû l’être;
b) l’étiquetage de la drogue nouvelle est, à n’importe quel moment, faux, mensonger, trompeur ou incomplet;
c) l’expert en études expérimentales n’a pas les qualifications voulues;
d) il existe des preuves que l’expert en études expérimentales n’a pas satisfait aux conditions mentionnées à l’article C.08.017; ou
e) une activité du fabricant, relative à la drogue nouvelle, a entraîné la condamnation dudit fabricant pour infraction à l’article C.08.002.
- DORS/81-333, art. 1
- DORS/2018-69, art. 26 et 27
TITRE 9
Médicaments vendus sans ordonnance
C.09.001 Le présent titre ne s’applique pas
a) à une drogue qui doit être vendue sur ordonnance aux termes du présent règlement ou du Règlement sur les stupéfiants; ni
b) à une drogue destinée exclusivement aux animaux.
- DORS/84-145, art. 4
Analgésiques
Dispositions générales
C.09.010 Après le 30 juin 1986, il est interdit à un fabricant ou à un importateur de vendre un produit analgésique renfermant une combinaison
a) d’un sel ou dérivé de l’acide salicylique et d’un autre sel ou dérivé de l’acide salicylique ou du salicylamide; ou
b) de l’acétaminophène et d’un sel ou dérivé de l’acide salicylique ou du salicylamide.
- DORS/84-145, art. 4
C.09.011 Après le 30 juin 1986, l’étiquette d’une drogue renfermant de l’acétaminophène, de l’acide salicylique ou l’un de ses sels ou dérivés et destinée à l’usage interne doit porter une mise en garde indiquant :
a) qu’un médecin doit être consulté si l’état pathologique sous-jacent persiste pendant plus de cinq jours; et
b) qu’il est dangereux de dépasser la dose maximum recommandée sans l’autorisation d’un médecin.
- DORS/84-145, art. 4
- DORS/86-589, art. 1
C.09.012 Après le 30 juin 1986, l’étiquette d’une drogue renfermant de l’acide salicylique ou l’un de ses sels ou dérivés et destinée à l’usage interne doit porter un avertissement indiquant qu’il ne faut pas utiliser la drogue pendant les trois derniers mois de la grossesse et au cours de l’allaitement sans avoir consulté un médecin.
- DORS/84-145, art. 4
Acétaminophène
C.09.020 (1) La dose normale d’acétaminophène est, pour les adultes, de 325 mg.
(2) La dose normale pour enfants d’acétaminophène est de 80 mg ou 160 mg en unités posologiques.
- DORS/84-145, art. 4
- DORS/90-587, art. 4
C.09.021 (1) Dans le présent titre, le terme produit d’acétaminophène désigne une drogue renfermant
a) de l’acétaminophène comme seul ingrédient médicinal; ou
b) de l’acétaminophène combiné avec de la caféine.
(2) Il est interdit à un fabricant ou à un importateur de vendre un produit d’acétaminophène qui n’est pas conforme aux exigences du présent titre.
(3) [Abrogé, DORS/90-587, art. 5]
- DORS/84-145, art. 4
- DORS/90-587, art. 5
C.09.022 (1) Sous réserve des paragraphes (2) à (4), un produit d’acétaminophène vendu sous forme de comprimé ou de capsule ou sous une autre forme posologique solide destinée à l’administration orale doit renfermer une seule dose normale, pour adultes, d’acétaminophène, dans chaque forme posologique individuelle.
(2) Un produit d’acétaminophène vendu sous forme de comprimé ou de capsule ou sous une autre forme posologique solide destinée à l’administration orale peut renfermer 500 mg d’acétaminophène dans chaque forme posologique individuelle, s’il porte une étiquette indiquant qu’il ne s’agit pas d’un produit à dose normale.
(3) Un produit d’acétaminophène vendu sous forme de comprimé ou de capsule ou sous une autre forme posologique solide destinée à l’administration orale peut renfermer 325 mg d’acétaminophène à libération immédiate et 325 mg d’acétaminophène à libération subséquente, s’il porte une étiquette indiquant qu’il ne s’agit pas d’un produit à dose normale.
(4) Un produit d’acétaminophène vendu sous forme de comprimé ou de capsule ou sous une autre forme posologique solide destinée à l’administration orale et qui est spécialement recommandé pour les enfants doit renfermer une dose normale, pour enfants, d’acétaminophène, dans chaque forme posologique individuelle.
(5) Un produit d’acétaminophène de forme liquide qui est destiné à être administré en gouttes et qui est spécialement recommandé pour les enfants doit renfermer une dose normale, pour enfants, d’acétaminophène, dans chaque millilitre.
(6) L’emballage d’un produit visé au paragraphe (5) doit être accompagné d’un instrument de mesure capable de contenir exactement 0,5 mL du produit.
(7) Un produit d’acétaminophène de forme liquide qui n’est pas destiné à être administré en gouttes et qui est spécialement recommandé pour les enfants doit renfermer une dose normale, pour enfants, d’acétaminophène, dans chaque cuillerée à thé.
(8) Un produit d’acétaminophène de forme liquide doit renfermer une dose normale, pour adultes, d’acétaminophène, dans chaque cuillerée à thé.
- DORS/84-145, art. 4
- DORS/85-966, art. 4
- DORS/86-954, art. 1
- DORS/99-441, art. 1
Salicylates
C.09.030 (1) La dose normale d’un salicylate est, pour les adultes,
a) de 325 mg, dans le cas de l’acide acétylsalicylique, du salicylate de sodium et du salicylate de magnésium; et
b) de 435 mg, dans le cas du salicylate de choline.
(2) La dose normale d’un salicylate est, pour les enfants,
a) de 80 mg, dans le cas de l’acide acétylsalicylique, du salicylate de sodium et du salicylate de magnésium; et
b) de 110 mg, dans le cas du salicylate de choline.
- DORS/84-145, art. 4
C.09.031 (1) Dans le présent titre, produit de salicylate désigne une drogue renfermant
a) un sel ou un dérivé de l’acide salicylique comme seul ingrédient médicinal;
b) un sel ou un dérivé de l’acide salicylique combiné avec de la caféine;
c) un sel ou un dérivé de l’acide salicylique combiné avec un ou plusieurs agents de tamponnage ou antiacides; ou
d) un sel ou un dérivé de l’acide salicylique combiné avec de la caféine et un ou plusieurs agents de tamponnage ou antiacides.
(2) Après le 30 juin 1986, il est interdit à un fabricant ou à un importateur de vendre un produit de salicylate qui n’est pas conforme aux exigences du présent titre.
(3) Jusqu’au 30 juin 1986, il est interdit à un fabricant ou à un importateur de vendre un produit de salicylate en doses autres que celles prévues dans le présent titre, à moins que ledit produit ne fût légalement disponible au Canada le 1er février 1984.
- DORS/84-145, art. 4
- DORS/85-966, art. 5(A)
C.09.032 (1) Sous réserve des paragraphes (2) et (3) et de l’article C.09.035, un produit de salicylate vendu sous forme de comprimé ou de capsule ou sous une autre forme posologique solide destinée à l’administration orale doit renfermer une seule dose normale pour adultes d’un salicylate, dans chaque forme posologique individuelle.
(2) Un produit de salicylate vendu sous forme de comprimé ou de capsule ou sous une autre forme posologique solide destinée à l’administration orale peut renfermer
a) 500 mg d’acide acétylsalicylique, de salicylate de sodium, ou de salicylate de magnésium, ou
b) 670 mg de salicylate de choline
dans chaque forme posologique individuelle, s’il porte une étiquette indiquant qu’il [ne] s’agit pas d’un produit à dose normale.
(3) Un produit de salicylate vendu sous forme de comprimé ou de capsule ou sous une autre forme posologique solide destinée à l’administration orale, peut renfermer dans chaque forme posologique individuelle
a) deux doses normales, pour adultes, d’un salicylate, s’il porte une étiquette indiquant que chaque forme posologique individuelle renferme deux doses normales pour adultes; ou
b) trois doses normales, pour adultes, d’un salicylate, s’il porte une étiquette indiquant que chaque forme posologique individuelle renferme trois doses normales pour adultes.
- DORS/84-145, art. 4
- DORS/85-966, art. 6
C.09.033 (1) Sous réserve du paragraphe (2), un produit de salicylate de forme liquide doit renfermer une dose normale, pour adultes, d’un salicylate, dans chaque cuillerée à thé.
(2) Un produit de salicylate de forme liquide peut renfermer dans chaque cuillerée à thé
a) deux doses normales, pour adultes, d’un salicylate, s’il porte une étiquette indiquant que chaque cuillerée à thé renferme deux doses normales pour adultes; ou
b) trois doses normales, pour adultes, d’un salicylate, s’il porte une étiquette indiquant que chaque cuillerée à thé renferme trois doses normales pour adultes.
- DORS/84-145, art. 4
C.09.034 Un produit de salicylate dit tamponné doit être capable de neutraliser au moins 1,9 milliéquivalents d’acide par dose normale, pour adultes, d’un salicylate.
- DORS/84-145, art. 4
C.09.035 Un produit de salicylate vendu sous forme de comprimé ou de capsule ou sous une autre forme posologique solide destinée à l’administration orale et qui est spécialement recommandé pour les enfants doit renfermer une seule dose normale, pour enfants, d’un salicylate, dans chaque forme posologique individuelle.
- DORS/84-145, art. 4
TITRE 10Accès à des drogues — circonstances exceptionnelles
C.10.001 (1) Les définitions qui suivent s’appliquent au présent article et à l’article C.10.002.
- autorité réglementaire étrangère
autorité réglementaire étrangère Tout organisme gouvernemental ou toute autre entité, ailleurs qu’au Canada, qui est habilité à contrôler la fabrication, l’utilisation ou la vente de drogues sur le territoire relevant de sa compétence. (foreign regulatory authority)
- responsable de la santé publique
responsable de la santé publique L’une ou l’autre des personnes suivantes :
a) l’administrateur en chef de la santé publique nommé en application du paragraphe 6(1) de la Loi sur l’Agence de la santé publique du Canada;
b) le médecin hygiéniste en chef d’une province ou toute personne exerçant une fonction équivalente;
c) le médecin général des Forces armées canadiennes;
d) le médecin en chef de la santé publique du ministère des Services aux Autochtones. (public health official)
(2) Malgré les articles A.01.040 et C.01.004.1, le titulaire d’une licence d’établissement autorisant l’importation d’une drogue peut, si les conditions ci-après sont réunies, importer une drogue à laquelle aucune identification numérique n’a été attribuée en application du paragraphe C.01.014.2(1) ou à l’égard de laquelle aucun avis de conformité n’a été délivré en application des articles C.08.004 ou C.08.004.01 :
a) un responsable de la santé publique a, au cours de la dernière année, avisé le ministre par écrit :
(i) de l’existence d’un besoin urgent en matière de santé publique pour un usage immédiat de la drogue dans le ressort du responsable,
(ii) de l’usage ou des fins auxquels la drogue est destinée;
b) la vente de la drogue est autorisée par une autorité réglementaire étrangère relevant des États-Unis, de la Suisse ou de l’Union européenne pour être utilisée pour le même usage ou aux mêmes fins que ceux visés au sous-alinéa a)(ii);
c) la drogue fait partie de la même catégorie que celle visée par la licence;
d) la drogue est importée directement du pays dans lequel sa vente a été autorisée par l’autorité réglementaire étrangère en cause;
e) les renseignements ci-après concernant la drogue figurent dans la Liste des drogues utilisées pour des besoins urgents en matière de santé publique, publiée par le gouvernement du Canada sur son site Web, avec ses modifications successives :
(i) la marque nominative,
(ii) les ingrédients médicinaux,
(iii) la forme posologique,
(iv) la concentration,
(v) la voie d’administration,
(vi) tout code ou numéro d’identification qui lui est attribué dans le pays où sa vente a été autorisée.
(3) Les articles C.01A.006 et C.01A.007 ne s’appliquent pas à l’égard de l’importation d’une drogue effectuée en vertu du paragraphe (2).
(4) Il est entendu que, malgré le paragraphe C.01A.004(1), le titulaire peut importer une drogue en vertu du paragraphe (2) sans avoir fait modifier sa licence au titre de l’article C.01A.006.
(5) Les titres 2 à 4, à l’exception des dispositions ci-après, ne s’appliquent pas à l’égard de l’importation d’une drogue effectuée en vertu du paragraphe (2) :
a) les articles C.02.003.1 et C.02.004 en ce qui a trait à l’entreposage de la drogue par le titulaire;
b) l’article C.02.006;
c) le paragraphe C.02.012(1);
d) les articles C.02.013 et C.02.014;
e) l’article C.02.015 en ce qui a trait à l’entreposage et au transport de la drogue par le titulaire;
f) le paragraphe C.02.021(1) en ce qui a trait à l’entreposage de la drogue par le titulaire;
g) le paragraphe C.02.022(1);
h) l’article C.02.023;
i) les paragraphes C.02.024(1) et C.02.025(1);
j) l’article C.03.013;
k) l’article C.04.001.1 en ce qui a trait à l’entreposage de la drogue par le titulaire.
- DORS/2017-133, art. 2
- DORS/2023-18, art. 2
C.10.002 (1) La vente d’une drogue qui est importée en vertu du paragraphe C.10.001(2) est exemptée de l’application des dispositions du présent règlement seulement si la drogue est vendue à une personne qui se trouve dans le ressort d’un responsable de la santé publique qui a avisé le ministre conformément à l’alinéa C.10.001(2)a), pour qu’elle soit utilisée à l’égard du même besoin urgent en matière de santé publique que celui pour lequel elle a été importée.
(2) Toute personne qui vend en gros une telle drogue doit détenir une licence d’établissement pour la vente en gros d’une drogue de même catégorie et, malgré le paragraphe (1), les dispositions ci-après s’appliquent à l’égard de cette vente en gros :
a) les articles C.02.003.1 et C.02.004 en ce qui a trait à l’entreposage de la drogue par le titulaire;
b) l’article C.02.006 en ce qui a trait à l’entreposage de la drogue par le titulaire;
c) le paragraphe C.02.012(1);
d) l’article C.02.013;
d.1) l’article C.02.014;
e) l’article C.02.015 en ce qui a trait à l’entreposage et au transport de la drogue par le titulaire;
e.1) le paragraphe C.02.021(1) en ce qui a trait à l’entreposage;
f) le paragraphe C.02.022(1);
f.1) [Abrogé, DORS/2023-247, art. 7]
g) l’article C.02.023;
h) le paragraphe C.02.024(1).
- DORS/2017-133, art. 2
- DORS/2022-197, art. 10
- DORS/2023-247, art. 7
C.10.003 Le titulaire qui importe une drogue en vertu du paragraphe C.10.001(2) en avise le ministre dans les quinze jours suivant l’importation en lui fournissant les renseignements suivants :
a) les nom, titre et coordonnées de la personne qui a importé la drogue;
b) la marque nominative de la drogue;
c) les ingrédients médicinaux de la drogue, sa concentration, sa forme posologique, la voie d’administration et tout code ou numéro d’identification qui lui a été attribué dans le pays où sa vente a été autorisée;
d) le nom du pays duquel la drogue a été importée;
e) la quantité totale de la drogue ayant été importée.
- DORS/2017-133, art. 2
- DORS/2023-18, art. 3
C.10.004 (1) Les définitions qui suivent s’appliquent au présent article et aux articles C.10.005 à C.10.011.
- autorité réglementaire étrangère
autorité réglementaire étrangère S’entend au sens du paragraphe C.10.001(1). (foreign regulatory authority)
- drogue
drogue S’entend de l’une des drogues pour usage humain ci-après :
a) les drogues inscrites aux annexes I, II, III, IV ou V de la Loi réglementant certaines drogues et autres substances;
b) les drogues sur ordonnance;
c) les drogues visées aux annexes C ou D de la Loi;
d) les drogues qui peuvent être vendues sans ordonnance, mais à administrer uniquement sous la surveillance d’un praticien. (drug)
- drogue désignée
drogue désignée Drogue figurant sur la Liste des drogues destinées aux importations et aux ventes exceptionnelles. (designated drug)
- Liste des drogues destinées aux importations et aux ventes exceptionnelles
Liste des drogues destinées aux importations et aux ventes exceptionnelles La Liste des drogues destinées aux importations et aux ventes exceptionnelles, avec ses modifications successives, publiée par le gouvernement du Canada sur son site Web. (List of Drugs for Exceptional Importation and Sale)
(2) Aux articles C.10.006 et C.10.009, bâtiment reconnu, certificat de lot, emballer-étiqueter, manufacturer et pays participant s’entendent au sens du paragraphe C.01A.001(1).
C.10.005 (1) Le ministre ne peut ajouter une drogue à la Liste des drogues destinées aux importations et aux ventes exceptionnelles que s’il a des motifs raisonnables de croire que les conditions ci-après sont réunies :
a) il y a pénurie ou risque de pénurie d’une autre drogue à l’égard de laquelle un avis de conformité a été délivré en application des articles C.08.004 ou C.08.004.01 ou à laquelle un numéro d’identification a été attribué en application du paragraphe C.01.014.2(1);
b) la drogue qu’il envisage d’ajouter à cette liste peut remplacer la drogue visée à l’alinéa a).
(2) Au paragraphe (1), pénurie s’entend au sens de l’article C.01.014.8.
C.10.006 (1) Le titulaire d’une licence d’établissement autorisant l’importation d’une drogue peut importer une drogue désignée si les conditions ci-après sont réunies :
a) il fournit au ministre, par voie électronique, en la forme précisée ou jugée acceptable par celui-ci et au plus tard le troisième jour ouvrable précédant la date de l’importation de la drogue désignée, un avis contenant les renseignements suivants :
(i) ses nom et coordonnées,
(ii) les nom et coordonnées de chaque manufacturier, emballeur-étiqueteur et analyste de la drogue désignée et l’adresse de chaque bâtiment où celle-ci est manufacturée, emballée-étiquetée ou analysée,
(iii) à l’égard de la drogue désignée :
(A) la marque nominative,
(B) les ingrédients médicinaux,
(C) la forme posologique,
(D) la concentration,
(E) la voie d’administration,
(F) tout code ou numéro d’identification qui lui est attribué dans le pays où sa vente est autorisée,
(G) une description détaillée de son mode d’emploi,
(iv) le point d’entrée prévu au Canada,
(v) la date d’arrivée prévue de la cargaison de la drogue désignée,
(vi) la quantité totale de la drogue désignée devant être importée à la date visée au sous-alinéa (v);
b) la vente de la drogue désignée est autorisée par une autorité réglementaire étrangère sur le territoire relevant de sa compétence;
c) la drogue désignée appartient à la même catégorie de drogues que celle pour laquelle la licence d’établissement a été délivrée;
d) les renseignements ci-après concernant la drogue désignée figurent sur la Liste des drogues destinées aux importations et aux ventes exceptionnelles :
(i) le nom du titulaire,
(ii) les renseignements visés aux divisions a)(iii)(A) à (F),
(iii) le nom de l’autorité réglementaire étrangère visée à l’alinéa b),
(iv) la date après laquelle elle ne peut plus être importée;
e) le numéro de lot de la drogue désignée figure sur la liste visée à l’alinéa d), le cas échéant;
f) la quantité totale de la drogue désignée que le titulaire importe n’excède pas la limite maximale figurant sur la liste visée à l’alinéa d) à l’égard de cette drogue, le cas échéant;
g) la drogue désignée est importée à la date visée au sous-alinéa d)(iv) ou avant cette date;
h) le titulaire a établi un plan qui prévoit les mesures envisagées pour se conformer aux exigences de l’article C.10.011.
(2) Au paragraphe (1), jour ouvrable désigne un jour autre que :
a) le samedi;
b) le dimanche ou un autre jour férié.
C.10.007 Les articles A.01.040, A.01.044 et C.01.004.1 ne s’appliquent pas à l’égard de l’importation d’une drogue désignée, en vertu de l’article C.10.006, par le titulaire d’une licence d’établissement.
C.10.008 (1) Sous réserve des articles C.10.009 et C.10.010, la vente d’une drogue désignée qui est importée en vertu de l’article C.10.006 est exemptée de l’application des dispositions suivantes :
a) les articles A.01.015, A.01.017 et A.01.051;
b) les dispositions de la partie C, à l’exception :
(i) des articles C.01.016, C.01.017, C.01.019 à C.01.020.1, C.01.040.3 à C.01.049.1 et C.01.051,
(ii) des dispositions des titres 1A et 2,
(iii) du présent article et des articles C.10.009 à C.10.011.
(2) Pour l’application de l’article C.01.016, il est entendu que le fabricant d’une drogue désignée n’est tenu de se conformer qu’aux exigences prévues aux articles C.01.017 et C.01.019 à l’égard de la drogue.
(3) Les paragraphes (1) et (2) cessent de s’appliquer à l’égard de la vente d’une drogue désignée à la date limite d’utilisation de celle-ci.
C.10.009 (1) L’article C.02.019 ne s’applique pas au titulaire d’une licence d’établissement à l’égard d’une drogue désignée qu’il importe en vertu de l’article C.10.006.
(2) Le titulaire fait l’analyse du produit fini sur un échantillon de la drogue désignée prélevé :
a) soit après la réception de chaque lot ou lot de fabrication de la drogue désignée dans ses locaux au Canada;
b) soit avant la réception de chaque lot ou lot de fabrication de la drogue désignée dans ses locaux au Canada, si les conditions ci-après sont réunies :
(i) il établit, à la satisfaction du ministre, que les lots ou les lots de fabrication de la drogue désignée qui lui ont été vendus par le vendeur du lot ou du lot de fabrication ont été fabriqués d’une façon constante selon les spécifications établies pour cette drogue et qu’ils y sont conformes de manière constante,
(ii) la drogue désignée n’a pas été transportée ou entreposée dans des conditions pouvant faire en sorte qu’elle ne soit plus conforme aux spécifications établies à son égard.
(3) Toute mention des spécifications au paragraphe (2) vaut mention des spécifications auxquelles la drogue désignée doit être conforme dans le territoire relevant de la compétence de l’autorité réglementaire étrangère visée à l’alinéa C.10.006(1)b).
(4) Chaque lot ou lot de fabrication d’une drogue désignée que le titulaire reçoit dans ses locaux au Canada doit, lorsque la période de vie utile de cette drogue est de plus de trente jours, faire l’objet d’une inspection visuelle par celui-ci pour confirmer l’identité du produit.
(5) Les paragraphes (2) et (4) ne s’appliquent pas au titulaire si la drogue désignée est manufacturée, emballée-étiquetée et analysée dans un bâtiment reconnu d’un pays participant et si les conditions ci-après sont réunies :
a) l’adresse du bâtiment est indiquée dans la licence d’établissement du titulaire;
b) le titulaire conserve une copie du certificat de lot qu’il reçoit pour chaque lot ou lot de fabrication de la drogue désignée pendant au moins un an après la date limite d’utilisation du lot ou du lot de fabrication.
(6) Au présent article, spécifications s’entend au sens de l’article C.02.002.
C.10.010 (1) Le titulaire d’une licence d’établissement qui importe une drogue désignée en vertu de l’article C.10.006 se conforme aux alinéas C.02.020(1)a), b) et d) à l’égard de cette drogue, mais n’a pas à conserver les dossiers visés à ces alinéas dans ses locaux au Canada.
(2) Le ministre peut demander au titulaire de lui fournir les dossiers visés aux alinéas C.02.020(1)a), b) et d) à l’égard de la drogue désignée.
(3) Le titulaire transmet les dossiers au ministre par voie électronique, en la forme précisée ou jugée acceptable par ce dernier et dans le délai que celui-ci fixe.
C.10.011 (1) Le titulaire d’une licence d’établissement ne peut vendre une drogue désignée qu’il a importée en vertu de l’article C.10.006 à moins de veiller à ce que les renseignements visés à la division C.10.006(1)a)(iii)(G) soient disponibles en français et en anglais de façon à permettre l’utilisation sécuritaire de la drogue.
(2) Le titulaire veille à ce que les renseignements soient disponibles conformément au paragraphe (1) au moins jusqu’à la fin de la journée à la date limite d’utilisation la plus tardive attribuée à la drogue désignée qu’il a importée.
TITRE 11Urgences en matière de santé touchant le public ou les Forces armées canadiennes — usage immédiat ou mise en réserve de drogues
C.11.001 (1) Les définitions qui suivent s’appliquent au présent titre.
- autorité réglementaire étrangère
autorité réglementaire étrangère S’entend au sens du paragraphe C.10.001(1). (foreign regulatory authority)
- responsable de la santé publique
responsable de la santé publique L’une des personnes suivantes :
a) l’administrateur en chef de la santé publique nommé en application du paragraphe 6(1) de la Loi sur l’Agence de la santé publique du Canada;
b) le médecin hygiéniste en chef d’une province ou toute personne exerçant une fonction équivalente;
c) le médecin hygiéniste d’une municipalité ou toute personne exerçant une fonction équivalente;
d) le médecin général des Forces armées canadiennes;
e) le médecin en chef de la santé publique du ministère des Services aux Autochtones. (public health official)
- responsable de la santé publique initial
responsable de la santé publique initial Le responsable de la santé publique nommé dans l’autorisation délivrée en vertu du paragraphe C.11.003(1). (initial public health official)
- responsable de la santé publique subséquent
responsable de la santé publique subséquent Se dit de tout responsable de la santé publique, autre que le responsable de la santé publique initial, qui obtient la quantité d’une drogue précisée dans l’autorisation délivrée en vertu du paragraphe C.11.003(1), ou une partie de cette quantité. (subsequent public health official)
(2) Le présent titre s’applique à toute drogue pour usage humain sous forme posologique à laquelle aucune identification numérique n’a été attribuée en application du paragraphe C.01.014.2(1) ou à l’égard de laquelle aucun avis de conformité n’a été délivré en application des articles C.08.004 ou C.08.004.01, y compris les drogues qui ont cessé d’être considérées comme des produits de santé naturels en vertu du paragraphe 103.15(2) du Règlement sur les produits de santé naturels.
C.11.002 (1) Pour parer à une urgence, à un événement ou à un incident réels, imminents ou éventuels en matière de santé publique ou touchant la santé des membres des Forces armées canadiennes, le responsable de la santé publique peut, sur demande au ministre, obtenir une autorisation permettant au fabricant d’une drogue de lui en vendre une quantité déterminée pour usage immédiat, mise en réserve ou les deux.
(2) La demande contient ce qui suit :
a) le nom du responsable de la santé publique et les coordonnées permettant de communiquer avec lui en tout temps;
b) le nom du fabricant et les coordonnées permettant de communiquer avec lui en tout temps;
c) une description de l’urgence, de l’événement ou de l’incident;
d) une mention indiquant si la drogue est requise pour usage immédiat, mise en réserve ou les deux;
e) une description de l’usage auquel la drogue est destinée pour parer à l’urgence, à l’événement ou à l’incident;
f) l’adresse municipale du lieu où la drogue sera expédiée par le fabricant;
g) à l’égard de la drogue, les précisions suivantes :
(i) sa marque nominative, le cas échéant, et soit son nom propre, son nom usuel ainsi que son nom chimique, soit son nom, code, numéro ou marque d’identification,
(ii) ses ingrédients médicinaux,
(iii) sa concentration,
(iv) sa forme posologique,
(v) la posologie recommandée pour l’usage précisé en application de l’alinéa e),
(vi) la voie d’administration recommandée,
(vii) les indications approuvées par toute autorité réglementaire étrangère, le cas échéant,
(viii) toute contre-indication,
(ix) le résumé de son profil d’innocuité,
(x) les conditions d’entreposage recommandées ;
h) une mention indiquant la quantité de drogue requise pour parer à l’urgence, à l’événement ou à l’incident;
i) une déclaration du responsable de la santé publique, avec renseignements et documents à l’appui, attestant les faits suivants :
(i) il existe une urgence, un événement ou un incident réels, imminents ou éventuels en matière de santé publique ou touchant la santé des membres des Forces armées canadiennes qui peut vraisemblablement causer chez l’humain une maladie, un désordre ou un état physique anormal grave ou mettant la vie en danger,
(ii) une mesure immédiate est requise — ou risque vraisemblablement de l’être, — pour diagnostiquer, traiter, atténuer ou prévenir la maladie, le désordre ou l’état physique anormal ou leurs symptômes,
(iii) les traitements conventionnels, le cas échéant, ont échoué, ne conviennent pas ou ne sont pas disponibles au Canada au moment où la demande est présentée,
(iv) les bénéfices connus et potentiels liés à l’usage précisé en application de l’alinéa e) l’emportent sur les risques connus et potentiels liés à cet usage;
j) tout renseignement ou document dont dispose le responsable de la santé publique concernant l’innocuité, l’efficacité et la qualité de la drogue au regard de l’usage précisé en application de l’alinéa e), notamment tout renseignement publié dans une revue médicale ou scientifique;
k) les renseignements ci-après, s’ils sont connus du responsable de la santé publique :
(i) le nom des autorités réglementaires étrangères ayant autorisé la vente de la drogue sur le territoire relevant de leur compétence pour le même usage que celui précisé en application de l’alinéa e),
(ii) le nom des autorités réglementaires étrangères ayant reçu une demande d’autorisation de vente de la drogue sur le territoire relevant de leur compétence pour le même usage que celui précisé en application de l’alinéa e), mais n’ayant pas encore rendu leur décision à l’égard de cette demande au moment de la présentation de la demande au titre du paragraphe (1) par le responsable de la santé publique,
(iii) le nom des autorités réglementaires étrangères ayant refusé, d’autoriser la vente de la drogue sur le territoire relevant de leur compétence, à l’égard de tout usage, ainsi que les motifs du refus.
(3) Le responsable de la santé publique fournit au ministre, au plus tard à la date précisée par ce dernier, tout document ou renseignement additionnel que ce dernier juge nécessaire pour l’examen de la demande.
C.11.003 (1) Le ministre peut, au terme de l’examen de la demande, délivrer au fabricant une autorisation permettant à celui-ci de vendre au responsable de la santé publique une quantité déterminée de la drogue pour les usages précisés dans la demande.
(2) Lors de l’examen de la demande, le ministre tient compte de l’existence d’un autre mécanisme pour parer à l’urgence, à l’événement ou à l’incident.
(3) L’autorisation contient les renseignements suivants :
a) la date de délivrance;
b) les nom et coordonnées du responsable de la santé publique;
c) les nom et coordonnées du fabricant;
d) une description de l’urgence, de l’événement ou de l’incident;
e) une mention indiquant si la drogue est requise pour usage immédiat, mise en réserve ou les deux;
f) une description de l’usage pour lequel la vente de la drogue est autorisée pour parer à l’urgence, à l’événement ou à l’incident;
g) l’adresse municipale du lieu où la drogue sera expédiée par le fabricant;
h) à l’égard de la drogue, les précisions suivantes :
(i) sa marque nominative, le cas échéant, et soit son nom propre, son nom usuel ainsi que son nom chimique, soit son nom, code, numéro ou marque d’identification,
(ii) ses ingrédients médicinaux,
(iii) sa concentration,
(iv) sa forme posologique,
(v) la posologie et la voie d’administration recommandées,
(vi) les conditions d’entreposage recommandées;
i) la quantité de drogue pouvant être vendue.
C.11.004 Le responsable de la santé publique initial avise le ministre, par écrit, de tout changement aux renseignements fournis en application de l’alinéa C.11.002(2)g), du sous-alinéa C.11.002(2)i)(iv), de l’alinéa C.11.002(2)j) ou du paragraphe C.11.002(3), dans les trente jours suivant le moment où il en a pris connaissance.
C.11.005 (1) Sous réserve de l’application du paragraphe C.11.008(2), le présent règlement ne s’applique pas à la drogue vendue conformément à une autorisation, à l’exception du présent titre, des articles A.01.010, A.01.014 et A.01.045, et des paragraphes C.01.001(1) et (1.1).
(2) Dans le cas d’une drogue mentionnée aux annexes C ou D de la Loi, la drogue vendue conformément à une autorisation est exemptée de l’application de l’article 12 de la Loi.
C.11.006 (1) Le responsable de la santé publique initial veille à ce que la drogue porte une étiquette ou soit accompagnée d’une documentation où figurent clairement les renseignements ci-après, en français et en anglais :
a) les nom et adresse municipale du fabricant de la drogue;
b) une mention indiquant que le ministre a autorisé la vente de la drogue pour parer à l’urgence, à l’événement ou à l’incident précisé dans l’autorisation;
c) une mention indiquant que la drogue ne peut servir qu’à l’usage précisé dans l’autorisation;
d) la marque nominative de la drogue, le cas échéant, et soit son nom propre, son nom usuel ainsi que son nom chimique, soit son nom, code, numéro ou marque d’identification;
e) les ingrédients médicinaux de la drogue;
f) la concentration de la drogue;
g) la forme posologique de la drogue;
h) la posologie et la voie d’administration recommandées de la drogue;
i) le numéro de lot de la drogue, s’il est connu;
j) toute mise en garde ou précaution relative à l’usage de la drogue, le cas échéant;
k) la date limite d’utilisation de la drogue ou, à défaut, la date de l’essai de stabilité ou la date à laquelle la drogue devrait faire l’objet d’un essai subséquent, selon ce qui est précisé par le fabricant;
l) les conditions d’entreposage recommandées de la drogue;
m) le contenu net du contenant de la drogue, exprimé en poids, en volume, en taille ou en nombre d’unités de la drogue qui s’y trouve.
(2) Tout responsable de la santé publique subséquent veille à ce que la drogue porte l’étiquette ou soit accompagnée de la documentation.
(3) S’il prend connaissance de tout changement aux renseignements visés aux alinéas (1)a), h), j), k) ou l), le responsable de la santé publique initial prend les mesures suivantes :
a) il veille à la mise à jour des renseignements figurant sur l’étiquette de la drogue ou dans la documentation qui l’accompagne;
b) il avise du changement, par écrit et sans délai, toute personne à qui il a vendu toute quantité de la drogue.
(4) Si la personne qui est avisée en application de l’alinéa (3)b) est un responsable de la santé publique subséquent, elle avise du changement, par écrit et sans délai, toute personne à qui elle a vendu toute quantité de la drogue.
(5) La personne avisée en application de l’alinéa (3)b) ou du paragraphe (4) veille à ce que les renseignements mis à jour accompagnent, par écrit, toute quantité de la drogue demeurant en sa possession.
C.11.007 (1) Outre les renseignements visés au paragraphe C.11.006(1), le responsable de la santé publique initial ou tout responsable de la santé publique subséquent, selon le cas, met à la disposition des personnes ci-après, par écrit, en français et en anglais, les renseignements suivants :
a) s’agissant des personnes à qui la drogue est administrée et de celles qui l’administrent, les bénéfices et les risques connus et potentiels liés à l’usage pour lequel la vente de la drogue est autorisée, la durée d’utilisation recommandée de la drogue, le cas échéant, et les indications faisant état de la marche à suivre en cas de réaction indésirable grave à une drogue;
b) s’agissant des personnes qui administrent la drogue, les renseignements visés aux alinéas C.11.002(2)a), b) et e) et aux sous-alinéas C.11.002(2)g)(v), (vii) et (viii), s’ils ne figurent pas sur l’étiquette de la drogue ou dans la documentation qui l’accompagne.
(2) S’il prend connaissance d’un changement aux renseignements visés au paragraphe (1), le responsable de la santé publique initial avise du changement, par écrit et sans délai, les intéressés.
C.11.008 (1) Si le responsable de la santé publique initial est une personne visée à l’alinéa d) de la définition de responsable de la santé publique au paragraphe C.11.001(1), il fournit au ministre un rapport écrit faisant état, relativement à la drogue, de toute réaction indésirable grave à une drogue au plus tard trente jours après la date à laquelle il en a pris connaissance, en y incluant les renseignements visés aux alinéas C.01.020.1(2)b) à l).
(2) Si le responsable de la santé publique initial est une personne visée à l’un des alinéas a) à c) ou e) de la définition de responsable de la santé publique au paragraphe C.11.001(1), le rapport n’est pas exigé et l’article C.01.020.1 s’applique relativement à la fourniture de renseignements portant sur toute réaction indésirable grave à une drogue.
C.11.009 (1) Le responsable de la santé publique initial surveille la réaction à la drogue lors de l’urgence, de l’événement ou de l’incident, y compris la surveillance de renseignements qu’il reçoit relativement aux réactions indésirables graves à une drogue, et prend des mesures raisonnables pour obtenir des renseignements qui portent sur cette réaction.
(2) Il fournit au ministre, sur demande, un rapport écrit concernant la surveillance de la réaction à la drogue lors de l’urgence, de l’événement ou de l’incident pendant la période précisée par celui-ci, et y inclus toute mesure corrective qui a été prise à la suite de cette surveillance.
C.11.010 (1) Le responsable de la santé publique initial conserve tout renseignement concernant la vente et l’usage de la drogue de manière à ce qu’il puisse fournir les renseignements, les avis et les rapports visés aux articles C.11.004 et C.11.008 et au paragraphe C.11.009(2).
(2) Le responsable de la santé publique initial et tout responsable de la santé publique subséquent conservent tout renseignement concernant la vente et l’usage de la drogue de manière à ce qu’ils puissent communiquer avec les personnes auxquelles elle a été administrée, dans le cas où son usage peut mettre en danger leur santé.
C.11.011 Le responsable de la santé publique initial ou tout responsable de la santé publique subséquent, selon le cas, conserve les renseignements, avis et rapports visés aux articles C.11.004 et C.11.008, au paragraphe C.11.009(2) et à l’article C.11.010, selon le cas, pendant une période de quinze ans suivant la fin de la période à laquelle ils se rapportent.
C.11.012 Au plus tard le 30 janvier suivant la première année civile complète pendant laquelle la drogue a été mise en réserve et au plus tard le 30 janvier de chaque année suivante, le responsable de la santé publique initial rend compte au ministre de la quantité de toute drogue mise en réserve qui demeure inutilisée et en sa possession à la fin de l’année civile précédente.
C.11.013 (1) Le ministre peut annuler l’autorisation s’il a des motifs raisonnables de croire que la drogue présente un risque grave ou imminent de préjudice à la santé humaine.
(2) Le cas échéant, le responsable de la santé publique initial avise, sans délai, toute personne à qui il a directement distribué toute quantité de la drogue de l’annulation.
(3) Le présent règlement s’applique à toute quantité inutilisée de la drogue dès la date de prise d’effet de l’annulation.
C.11.014 (1) Si les conditions ci-après sont réunies, le ministre peut délivrer une autorisation permettant au responsable de la santé publique initial qui est une personne visée aux alinéas a), d) ou e) de la définition de responsable de la santé publique au paragraphe C.11.001(1) de vendre à un praticien une quantité déterminée d’une drogue qui a été mise en réserve afin que celui-ci puisse prodiguer des soins d’urgence à une personne qu’il traite à titre professionnel :
a) le fabricant de la drogue a reçu du ministre une lettre d’autorisation permettant la vente d’une quantité déterminée de cette drogue au praticien afin qu’il puisse prodiguer des soins d’urgence à cette personne, conformément au paragraphe C.08.010(1);
b) l’usage de la drogue pour laquelle la lettre d’autorisation a été délivrée est le même que celui pour lequel l’autorisation a été délivrée à celui-ci en vertu du paragraphe C.11.003(1).
(2) Le présent titre, à l’exception du présent article, ne s’applique pas à la drogue vendue conformément à l’autorisation visée au paragraphe (1).
PARTIE DVitamines, minéraux et acides aminés
D.01.001 (1) Dans la présente partie,
- aliment supplémenté
aliment supplémenté S’entend au sens de l’article B.01.001; (supplemented food)
- apport nutritionnel recommandé pondéré
apport nutritionnel recommandé pondéré Quantité d’une vitamine ou d’un minéral nutritif indiquée au tableau II du titre 1 et au tableau II du titre 2; (weighted recommended nutrient intake)
- apport quotidien recommandé
apport quotidien recommandé[Abrogée, DORS/2016-305, art. 61]
- faire de la publicité
faire de la publicité signifie faire de la publicité auprès du grand public; (advertise)
- fortifiant pour lait humain
fortifiant pour lait humain S’entend au sens de l’article B.25.001; (human milk fortifier)
- ingrédient supplémentaire
ingrédient supplémentaire S’entend au sens de l’article B.01.001; (supplemental ingredient)
- marque nominative
marque nominative Dans le cas d’une drogue, le nom en français ou en anglais, avec ou sans le nom d’un fabricant, d’une personne morale, d’une société de personnes ou d’un particulier :
a) qui lui a été attribué par le fabricant;
b) sous lequel elle est vendue ou fait l’objet de publicité;
c) qui sert à l’identifier; (brand name)
- nom usuel
nom usuel Dans le cas d’un sel ou d’un dérivé d’une vitamine, le nom en français ou en anglais sous lequel il est :
a) généralement connu;
b) désigné dans des revues scientifiques ou techniques; (common name)
- produit préemballé
produit préemballé désigne un aliment contenu dans un emballage qui est celui dans lequel l’aliment est normalement vendu, utilisé ou acheté; (prepackaged product)
- ration quotidienne normale
ration quotidienne normale, lorsqu’il s’agit d’une substance alimentaire dont le nom figure à l’un des articles de l’annexe K à la colonne I, signifie la quantité de cette substance alimentaire précisée à la colonne II en regard de cet article; (reasonable daily intake)
- succédané de lait humain
succédané de lait humain S’entend au sens de l’article B.25.001; (human milk substitute)
- Tableau des quantités de référence
Tableau des quantités de référence S’entend au sens du paragraphe B.01.001(1); (Table of Reference Amounts)
- tableau des renseignements sur les aliments supplémentés
tableau des renseignements sur les aliments supplémentés S’entend au sens du paragraphe B.01.001(1); (supplemented food facts table)
- Tableau des valeurs quotidiennes
Tableau des valeurs quotidiennes S’entend au sens du paragraphe B.01.001(1); (Table of Daily Values)
- témoignage
témoignage, lorsqu’il s’agit d’un aliment ou d’une drogue présentée comme contenant une vitamine, un minéral nutritif ou un minéral, signifie n’importe quelle présentation orale, écrite ou en images, dramatisée ou non, quant à l’effet que produit, a produit ou peut produire l’addition, au régime alimentaire d’une personne, de cette vitamine, de ce minéral nutritif ou de ce minéral, selon le cas. (testimonial)
(2) Pour l’application de la présente partie, la portion indiquée d’un aliment est :
a) établie en fonction de l’aliment tel qu’il est vendu;
b) dans l’un ou l’autre des cas ci-après, la quantité nette de l’aliment dans l’emballage lorsque :
(i) cette quantité peut être raisonnablement consommée par une personne en une seule fois,
(ii) l’emballage contient moins de 200 % de la quantité de référence de l’aliment;
c) dans les autres cas, la quantité établie selon les critères énoncés à la colonne 3A du Tableau des quantités de référence pour cet aliment.
(3) La portion indiquée d’un aliment est exprimée de la façon suivante :
a) dans le cas d’un produit préemballé à portion individuelle auquel l’alinéa (2)b) s’applique, par emballage et selon les unités suivantes :
(i) en grammes, lorsque la quantité nette de l’aliment est mentionnée en poids ou en nombre sur l’étiquette,
(ii) en millilitres, lorsque la quantité nette de l’aliment est mentionnée en volume sur l’étiquette;
b) dans le cas d’un produit préemballé à portions multiples auquel l’alinéa (2)c) s’applique, selon les unités ci-après indiquées à la colonne 3B du Tableau des quantités de référence et de la manière dont elles y sont présentées :
(i) la mesure domestique applicable au produit,
(ii) la mesure métrique applicable au produit.
- DORS/88-559, art. 31
- DORS/93-202, art. 31
- DORS/96-259, art. 3
- DORS/2003-11, art. 27
- DORS/2016-305, art. 61
- DORS/2021-57, art. 17
- DORS/2022-169, art. 22
D.01.001.1 (1) La valeur quotidienne d’une vitamine ou d’un minéral nutritif figurant à la colonne 1 de la partie 2 du Tableau des valeurs quotidiennes est, à l’égard d’un aliment, la quantité de vitamine ou de minéral nutritif figurant :
a) à la colonne 2, dans le cas d’un aliment destiné exclusivement aux bébés âgés d’au moins six mois mais de moins d’un an;
b) à la colonne 3, dans le cas d’un aliment destiné aux bébés âgés d’au moins six mois mais de moins d’un an ou aux enfants âgés d’au moins un an mais de moins de quatre ans;
c) à la colonne 4, dans les autres cas.
(2) Le paragraphe (1) ne s’applique pas si l’aliment est :
a) soit un fortifiant pour lait humain;
b) soit un succédané de lait humain destiné exclusivement aux bébés âgés de moins de six mois.
- DORS/2016-305, art. 62
- DORS/2021-57, art. 18
D.01.001.2 Lorsqu’un symbole nutritionnel, au sens du paragraphe B.01.001(1), et une mention ou une allégation visée à l’un des articles D.01.004 à D.01.007 et D.02.002 à D.02.005 paraissent dans l’espace principal d’un produit préemballé, la mention ou l’allégation satisfait aux exigences suivantes :
a) la hauteur des lettres majuscules qui y paraissent ne dépasse pas le double de celle des lettres majuscules, sauf tout accent, paraissant dans le symbole nutritionnel, à l’exception des lettres des mots « Santé Canada » et « Health Canada »;
b) la hauteur de la hampe ascendante la plus élevée des lettres minuscules qui y paraissent ne dépasse pas le double de celle de la hampe ascendante la plus élevée des lettres minuscules paraissant dans le symbole nutritionnel, à l’exception des lettres des mots « Santé Canada » et « Health Canada ».
TITRE 1Vitamines dans les aliments
D.01.002 (1) Dans le présent titre, vitamine désigne l’une des vitamines suivantes :
a) vitamine A;
b) vitamine D;
c) vitamine E;
d) vitamine K;
e) vitamine C;
f) thiamine ou vitamine B1;
g) riboflavine ou vitamine B2;
h) niacine;
i) vitamine B6;
j) folacine ou folate;
k) vitamine B12;
l) acide pantothénique ou pantothénate;
m) biotine;
n) choline. (vitamin)
(2) Pour l’application du présent titre, il est interdit d’utiliser des désignations autres que celles prévues au paragraphe (1) pour la déclaration de la teneur en vitamines d’un aliment.
(3) Le présent titre ne s’applique qu’aux aliments présentés comme contenant une vitamine destinée à être utilisée dans l’alimentation humaine.
- DORS/88-559, art. 32
- DORS/2003-11, art. 28
- DORS/2016-305, art. 63
D.01.003 (1) Pour l’application du présent règlement, la teneur en vitamines d’un aliment, autre qu’une préparation pour régime liquide, un fortifiant pour lait humain, un succédané de lait humain ou un aliment présenté comme contenant un succédané de lait humain, doit être déterminée :
a) dans le cas de la vitamine A, en fonction de la teneur en rétinol et ses dérivés et en bêta-carotène, calculée en microgrammes d’équivalents d’activité de rétinol (ÉAR), et exprimée en microgrammes selon les équivalences suivantes :
(i) 1 ÉAR = 1 microgramme de rétinol,
(ii) 1 ÉAR = 12 microgrammes de bêta-carotène;
b) dans le cas de la vitamine D, en fonction de la teneur en cholécalciférol et en ergocalciférol, exprimée en microgrammes;
c) dans le cas de la vitamine E, en fonction de la teneur en d-alpha-tocophérol et en dl-alpha-tocophérol et leurs dérivés, exprimée en milligrammes selon les équivalences suivantes :
(i) 1 milligramme de d-alpha-tocophérol = 1 milligramme de vitamine E,
(ii) 1 milligramme de dl-alpha-tocophérol = 0,74 milligramme de vitamine E;
d) dans le cas de la vitamine K, en fonction de la teneur en phylloquinone et en ménaquinones, exprimée en microgrammes;
e) dans le cas de la vitamine C, en fonction de la teneur en acide L-ascorbique et en acide L-déhydroascorbique et leurs dérivés, calculée en milligrammes d’équivalents d’acide L-ascorbique et exprimée en milligrammes;
f) dans le cas de la thiamine ou vitamine B1 et ses dérivés, en fonction de la teneur en thiamine, exprimée en milligrammes;
g) dans le cas de la riboflavine ou vitamine B2 et ses dérivés, en fonction de la teneur en riboflavine, exprimée en milligrammes;
h) dans le cas de la niacine, en fonction de la teneur en niacine et ses dérivés, calculée en milligrammes d’acide nicotinique, plus la teneur en tryptophane, calculée en milligrammes et divisée par 60, le total en équivalent niacine (ÉN) étant exprimé en milligrammes;
i) dans le cas de la vitamine B6, en fonction de la teneur en pyridoxine, en pyridoxal et en pyridoxamine et leurs dérivés, calculée en milligrammes d’équivalents de pyridoxine et exprimée en milligrammes;
j) dans le cas de la folacine ou folate, en fonction de la teneur en acide folique (acide ptéroylmonoglutamique) et ses composés apparentés présentant l’activité biologique de l’acide folique, calculée en microgrammes d’équivalents de folate alimentaire (ÉFA) et exprimée en microgrammes selon les équivalences suivantes :
(i) 1 ÉFA = 1 μg de folate alimentaire,
(ii) 1 ÉFA = 0,6 μg d’acide folique provenant d’aliments auxquels de l’acide folique a été ajouté;
k) dans le cas de la vitamine B12, en fonction de la teneur en cyanocobalamine et ses composés apparentés présentant l’activité biologique de la cyanocobalamine, calculée en microgrammes d’équivalents de cyanocobalamine et exprimée en microgrammes;
l) dans le cas de l’acide pantothénique ou pantothénate, en fonction de la teneur en acide d-pantothénique, exprimée en milligrammes;
m) dans le cas de la biotine, en fonction de la teneur en biotine, exprimée en microgrammes;
n) dans le cas de la choline, en fonction de la teneur en choline, exprimée en milligrammes.
(2) Pour l’application de l’alinéa (1)h), la teneur en tryptophane peut être calculée comme étant équivalente à :
a) 1,1 pour cent des protéines, lorsque celles-ci proviennent d’un aliment contenant des protéines de plus d’une source ou d’une source autre que le lait, la viande, la volaille, le poisson ou les oeufs;
b) 1,3 pour cent des protéines, lorsque celles-ci proviennent du lait, de la viande, de la volaille ou du poisson;
c) 1,5 pour cent des protéines, lorsque celles-ci proviennent des oeufs.
- DORS/88-559, art. 32
- DORS/90-830, art. 7
- DORS/2016-305, art. 64
- DORS/2021-57, art. 19
- DORS/2022-197, art. 11
D.01.004 (1) Est interdite, sur l’étiquette ou dans l’annonce d’un aliment, autre qu’une préparation pour régime liquide, un fortifiant pour lait humain, un succédané de lait humain ou un aliment présenté comme contenant un succédané de lait humain, toute mention ou allégation relative à sa teneur en une vitamine, à moins que les conditions suivantes ne soient réunies :
a) il s’agit d’une vitamine figurant à la colonne 1 de la partie 2 du Tableau des valeurs quotidiennes;
b) le pourcentage de la valeur quotidienne pour cette vitamine, par portion indiquée, est de 5 % ou plus;
c) la teneur en cette vitamine est indiquée, sur l’étiquette ou dans l’annonce, en pourcentage de la valeur quotidienne, par portion indiquée.
(1.1) La condition visée à l’alinéa (1)c) n’a pas à être remplie si la mention ou l’allégation visée au paragraphe (1) est faite sur l’étiquette ou dans l’annonce d’un légume frais, d’un fruit frais ou d’un mélange quelconque de légumes frais ou de fruits frais sans ingrédient ajouté, d’une orange à laquelle un colorant alimentaire a été ajouté et d’un légume frais ou d’un fruit frais enrobé d’huile minérale, de paraffine, de vaseline ou de tout autre enduit protecteur.
(2) Si la mention ou l’allégation visée au paragraphe (1) est faite dans l’annonce d’un aliment qui n’est pas un produit préemballé ou dans l’annonce d’un produit préemballé faite par une personne autre que le fabricant du produit ou une personne agissant sous ses ordres, le pourcentage de la valeur quotidienne, par portion indiquée, répond aux critères suivants :
a) dans le cas d’une annonce autre qu’une annonce radiophonique ou télévisée :
(i) d’une part, il précède ou suit, sans qu’aucun texte imprimé ou écrit ni aucun signe graphique ne soit intercalé, la mention ou allégation ne paraissant qu’une seule fois ou, si la mention ou l’allégation est répétée, celle qui est la plus en évidence,
(ii) d’autre part, il figure en caractères d’une taille au moins égale et aussi bien en vue que ceux de la mention ou de l’allégation ne paraissant qu’une seule fois ou, si la mention ou l’allégation est répétée, que ceux de celle qui est la plus en évidence;
b) dans le cas d’une annonce radiophonique ou de la composante audio d’une annonce télévisée, il précède ou suit immédiatement la mention ou l’allégation;
c) dans le cas d’une annonce télévisée, il est communiqué :
(i) en mode audio, si la mention ou l’allégation fait partie uniquement de la composante audio de l’annonce ou, à la fois, des composantes audio et visuelle de celle-ci,
(ii) en mode audio ou en mode visuel, si la mention ou l’allégation fait partie uniquement de la composante visuelle de l’annonce.
(3) Le pourcentage de la valeur quotidienne, par portion indiquée, qui est communiqué en mode visuel dans une annonce télévisée conformément au sous-alinéa (2)c)(ii), à la fois :
a) paraît en même temps et pendant au moins la même durée que la mention ou l’allégation;
b) précède ou suit, sans qu’aucun texte imprimé ou écrit ni aucun signe graphique ne soit intercalé, la mention ou l’allégation ne paraissant qu’une seule fois ou, si la mention ou l’allégation est répétée, celle qui est la plus en évidence;
c) figure en caractères d’une taille qui est au moins égale et aussi bien en vue que ceux de la mention ou de l’allégation ne paraissant qu’une seule fois ou, si la mention ou l’allégation est répétée, que ceux de celle qui est la plus en évidence.
(4) L’alinéa (1)b) ne s’applique pas à l’indication de la teneur en une vitamine dans tout tableau de la valeur nutritive ou tout tableau des renseignements sur les aliments supplémentés.
(5) L’alinéa (1)c) ne s’applique pas à l’indication de la teneur en biotine exigée par le sous-alinéa B.24.202a)(vi).
- DORS/84-300, art. 57(A)
- DORS/88-559, art. 32
- DORS/90-830, art. 8
- DORS/96-259, art. 9
- DORS/2003-11, art. 29
- DORS/2016-305, art. 65 et 75(F)
- DORS/2021-57, art. 20
- DORS/2022-169, art. 23
D.01.005 [Abrogé, DORS/2003-11, art. 29]
D.01.006 Est interdite sur l’étiquette ou dans les annonces d’un aliment toute allégation concernant l’action ou les effets d’une vitamine que contient l’aliment, sauf celle indiquant que la vitamine :
a) contribue au maintien de la santé;
b) est généralement reconnue comme aidant à entretenir les fonctions de l’organisme nécessaires au maintien de la santé et à la croissance et au développement normaux.
- DORS/88-559, art. 32
D.01.007 (1) Si un constituant d’un ingrédient d’un produit préemballé mentionné au tableau du paragraphe B.01.009(1) est une vitamine, est interdite, sur l’étiquette ou dans l’annonce de ce produit préemballé, toute mention ou allégation selon laquelle la vitamine est un constituant de cet ingrédient, à moins que les conditions suivantes soient réunies :
a) malgré le paragraphe B.01.008.2(6), la vitamine est désignée par son nom usuel, lequel figure entre parenthèses immédiatement après l’ingrédient dont la vitamine est un constituant; cependant, dans le cas où, en application de l’alinéa B.01.010.1(8)a), une source d’allergène alimentaire ou de gluten doit figurer immédiatement après l’ingrédient, le nom usuel de la vitamine doit plutôt figurer immédiatement après cette source;
b) tous les constituants de l’ingrédient sont indiqués.
(2) L’alinéa (1)b) ne s’applique pas à la farine utilisée comme ingrédient dans la fabrication de tout produit préemballé visé au paragraphe (1).
- DORS/84-300, art. 59(A)
- DORS/88-559, art. 32
- DORS/2003-11, art. 30
- DORS/2011-28, art. 7
- DORS/2016-305, art. 66
D.01.008 (1) Les articles D.01.009, D.01.010 et D.01.011 ne s’appliquent pas aux fortifiants pour lait humain.
(2) Les articles D.01.009 et D.01.011 ne s’appliquent pas aux aliments supplémentés.
D.01.009 Sous réserve de l’article D.01.010, il est interdit de vendre un aliment auquel l’une des vitamines ci-après a été ajoutée, à moins qu’une ration quotidienne normale de cet aliment n’apporte à une personne qui la consomme la quantité ci-après de cette vitamine :
a) dans le cas de la vitamine A, au moins 1 600 unités internationales;
b) dans le cas de la thiamine, au moins 0,6 milligramme;
c) dans le cas de la riboflavine, au moins un milligramme;
d) dans le cas de la niacine ou de la niacinamide, au moins six milligrammes;
e) dans le cas de l’acide ascorbique, au moins 20 milligrammes; et
f) dans le cas de la vitamine D, au moins 300 unités internationales.
D.01.010 Lorsqu’un aliment auquel a été ajoutée l’une des vitamines ci-après est présenté comme étant destiné exclusivement à l’alimentation des enfants de moins de deux ans, il est interdit de vendre un tel aliment à moins qu’une ration quotidienne normale de cet aliment n’apporte à un enfant de moins de deux ans qui la consomme la quantité ci-après de cette vitamine :
a) dans le cas de la vitamine A, au moins 1 000 unités internationales;
b) dans le cas de la thiamine, au moins 0,4 milligramme;
c) dans le cas de la riboflavine, au moins 0,6 milligramme;
d) dans le cas de la niacine ou de la niacinamide, au moins quatre milligrammes;
e) dans le cas de la pyridoxine, au moins 0,6 milligramme;
f) dans le cas de l’acide ascorbique, au moins 20 milligrammes;
g) dans le cas de la vitamine D, au moins 300 unités internationales; et
h) dans le cas de la vitamine E, au moins cinq unités internationales.
D.01.011 Il est interdit de vendre un aliment auquel l’une des vitamines ci-après a été ajoutée si une ration quotidienne normale de cet aliment apporte à une personne qui la consomme la quantité ci-après de cette vitamine :
a) dans le cas de la vitamine A, plus de 2 500 unités internationales;
b) dans le cas de la thiamine, plus de deux milligrammes;
c) dans le cas de la riboflavine, plus de trois milligrammes;
d) dans le cas de la niacine ou de la niacinamide, plus de 20 milligrammes;
e) dans le cas de la pyridoxine, plus de 1,5 milligramme;
f) dans le cas de l’acide ascorbique, plus de 60 milligrammes;
g) dans le cas de la vitamine D, plus de 400 unités internationales; et
h) dans le cas de la vitamine E, plus de 15 unités internationales.
D.01.011.1 Les articles D.01.009, D.01.010 et D.01.011 ne s’appliquent pas en ce qui concerne la vitamine D contenue dans les aliments suivants :
a) l’aliment pour lequel le titre 8 de la partie B prévoit une norme, si celle-ci prévoit qu’il doit contenir de la vitamine D;
b) la margarine ou la margarine réduite en calories.
D.01.012 Il est interdit, dans la publicité faite au sujet d’un aliment présenté comme contenant une vitamine ou sur l’étiquette d’un tel aliment,
a) de donner quelque garantie que ce soit quant à l’effet que peut produire, qu’a produit ou que produira l’addition de la vitamine au régime d’une personne; ou
b) de mentionner, reproduire ou citer un témoignage quelconque.
D.01.013 [Abrogé, DORS/2003-11, art. 31]
TABLEAU I[Abrogé, DORS/2016-305, art. 67)
TABLEAU II
Apport nutritionnel recommandé pondéré
| Article | Colonne I | Colonne II | Colonne III |
|---|---|---|---|
| Vitamine | Unités | Quantité | |
| 1 | Biotine | microgrammes | 90 |
| 2 | Folacine | microgrammes | 195 |
| 3 | Niacine | équivalents de niacine | 16 |
| 4 | Acide pantothénique | milligrammes | 5,0 |
| 5 | Riboflavine | milligrammes | 1,2 |
| 6 | Thiamine | milligrammes | 1,0 |
| 7 | Vitamine A | équivalents de rétinol | 870 |
| 8 | Vitamine B6 | milligrammes | 1,0 |
| 9 | Vitamine B12 | microgrammes | 1,0 |
| 10 | Vitamine C | milligrammes | 34 |
| 11 | Vitamine D | microgrammes | 3,0 |
| 12 | Vitamine E | milligrammes | 7,0 |
- DORS/96-259, art. 5
TITRE 2Minéraux nutritifs dans les aliments
D.02.001 (1) Dans le présent titre, minéral nutritif désigne l’un des éléments chimiques suivants, soit seul, soit en combinaison avec un ou plusieurs autres éléments chimiques :
a) sodium;
b) potassium;
c) calcium;
d) phosphore;
e) magnésium;
f) fer;
g) zinc;
h) iode;
i) chlore;
j) cuivre;
k) fluor;
l) manganèse;
m) chrome;
n) sélénium;
o) cobalt;
p) molybdène;
q) étain;
r) vanadium;
s) silicium;
t) nickel. (mineral nutrient)
(2) Le présent titre ne s’applique qu’aux aliments présentés comme contenant un minéral nutritif destiné à être utilisé dans l’alimentation humaine.
- DORS/88-559, art. 34
- DORS/90-830, art. 9(F)
D.02.002 (1) Est interdite, sur l’étiquette ou dans l’annonce d’un aliment, autre que du sel de table ou d’usage domestique général contenant de l’iodure ajouté, de l’eau ou de la glace préemballées, une préparation pour régime liquide, un fortifiant pour lait humain, un succédané de lait humain ou un aliment présenté comme contenant un succédané de lait humain, toute mention ou allégation relative à sa teneur en un minéral nutritif, à moins que les conditions suivantes ne soient réunies :
a) il s’agit d’un minéral nutritif figurant à la colonne 1 de la partie 2 du Tableau des valeurs quotidiennes;
b) le pourcentage de la valeur quotidienne pour ce minéral nutritif, par portion indiquée, est de 5 % ou plus;
c) la teneur en ce minéral nutritif est indiquée, sur l’étiquette ou dans l’annonce, en pourcentage de la valeur quotidienne, par portion indiquée.
(1.1) La condition visée à l’alinéa (1)c) n’a pas à être remplie si la mention ou l’allégation visée au paragraphe (1) est faite sur l’étiquette ou dans l’annonce d’un légume frais, d’un fruit frais ou d’un mélange quelconque de légumes frais ou de fruits frais sans ingrédient ajouté, d’une orange à laquelle un colorant alimentaire a été ajouté et d’un légume frais ou d’un fruit frais enrobé d’huile minérale, de paraffine, de vaseline ou de tout autre enduit protecteur.
(2) Si la mention ou l’allégation visée au paragraphe (1) est faite dans l’annonce d’un aliment qui n’est pas un produit préemballé ou dans l’annonce d’un produit préemballé faite par une personne autre que le fabricant du produit ou une personne agissant sous ses ordres, le pourcentage de la valeur quotidienne, par portion indiquée, répond aux critères suivants :
a) dans le cas d’une annonce autre qu’une annonce radiophonique ou télévisée :
(i) d’une part, il précède ou suit, sans qu’aucun texte imprimé ou écrit ni aucun signe graphique ne soit intercalé, la mention ou allégation ne paraissant qu’une seule fois ou, si la mention ou l’allégation est répétée, celle qui est la plus en évidence,
(ii) d’autre part, il figure en caractères d’une taille au moins égale et aussi bien en vue que ceux de la mention ou de l’allégation ne paraissant qu’une seule fois ou, si la mention ou l’allégation est répétée, que ceux de celle qui est la plus en évidence;
b) dans le cas d’une annonce radiophonique ou de la composante audio d’une annonce télévisée, il précède ou suit immédiatement la mention ou l’allégation;
c) dans le cas d’une annonce télévisée, il est communiqué :
(i) en mode audio, si la mention ou l’allégation fait partie uniquement de la composante audio de l’annonce ou, à la fois, des composantes audio et visuelle de celle-ci,
(ii) en mode audio ou en mode visuel, si la mention ou l’allégation fait partie uniquement de la composante visuelle de l’annonce.
(3) Le pourcentage de la valeur quotidienne, par portion indiquée, qui est communiqué en mode visuel dans une annonce télévisée conformément au sous-alinéa (2)c)(ii), à la fois :
a) paraît en même temps et pendant au moins la même durée que la mention ou l’allégation;
b) précède ou suit, sans qu’aucun texte imprimé ou écrit ni aucun signe graphique ne soit intercalé, la mention ou allégation ne paraissant qu’une seule fois ou, si la mention ou l’allégation est répétée, celle qui est la plus en évidence;
c) figure en caractères d’une taille qui est au moins égale et aussi bien en vue que ceux de la mention ou de l’allégation ne paraissant qu’une seule fois ou, si la mention ou l’allégation est répétée, que ceux de celle qui est la plus en évidence.
(4) Le paragraphe (1) ne s’applique pas aux mentions et allégations relatives à la teneur en sodium ou en potassium.
(5) Les alinéas (1)a) et c) ne s’appliquent pas à l’indication de la teneur totale en ion fluorure exigée par les articles B.12.002 et B.12.008.
(6) L’alinéa (1)b) ne s’applique pas à l’indication de la teneur en un minéral nutritif dans tout tableau de la valeur nutritive ou tout tableau des renseignements sur les aliments supplémentés.
(7) L’alinéa (1)c) ne s’applique pas à l’indication de la teneur en chrome, en cuivre, en manganèse, en molybdène et en sélénium exigée par le sous-alinéa B.24.202a)(v).
- DORS/84-300, art. 60(A)
- DORS/88-559, art. 34
- DORS/90-830, art. 10
- DORS/96-259, art. 9
- DORS/2003-11, art. 34
- DORS/2016-305, art. 68 et 75(F)
- DORS/2021-57, art. 22
- DORS/2022-169, art. 25
D.02.003 [Abrogé, DORS/2003-11, art. 34]
D.02.004 Est interdite sur l’étiquette ou dans les annonces d’un aliment toute allégation concernant l’action ou les effets d’un minéral nutritif que contient l’aliment, sauf celle indiquant que le minéral nutritif :
a) contribue au maintien de la santé;
b) est généralement reconnu comme aidant à entretenir les fonctions de l’organisme nécessaires au maintien de la santé et à la croissance et au développement normaux.
- DORS/84-300, art. 61(A)
- DORS/88-559, art. 34
D.02.005 (1) Si un constituant d’un ingrédient de tout produit préemballé mentionné au tableau du paragraphe B.01.009(1) est un minéral nutritif, est interdite, sur l’étiquette ou dans l’annonce de ce produit préemballé, toute mention ou allégation à l’égard du minéral nutritif comme constituant de cet ingrédient, à moins que les conditions suivantes soient réunies :
a) malgré le paragraphe B.01.008.2(6), le minéral nutritif est désigné par son nom usuel lequel figure entre parenthèses immédiatement après l’ingrédient dont le minéral nutritif est un constituant; cependant, dans le cas où, en application de l’alinéa B.01.010.1(8)a), une source d’allergène alimentaire ou de gluten doit figurer immédiatement après l’ingrédient, le nom usuel du minéral nutritif doit plutôt figurer immédiatement après cette source;
b) tous les constituants de l’ingrédient sont indiqués.
(2) L’alinéa (1)b) ne s’applique pas à la farine utilisée comme ingrédient dans la fabrication d’un produit préemballé visé au paragraphe (1).
- DORS/88-559, art. 34
- DORS/2003-11, art. 35
- DORS/2011-28, art. 8
- DORS/2016-305, art. 69
D.02.006 [Abrogé, DORS/2003-11, art. 35]
D.02.007 [Abrogé, DORS/88-599, art. 34]
D.02.008 Il est interdit, dans la publicité faite au sujet d’un aliment présenté comme contenant un minéral nutritif ou sur l’étiquette d’un tel aliment,
a) de donner quelque garantie que ce soit quant à l’effet que peut produire, qu’a produit ou que produira l’addition de ce minéral nutritif au régime d’une personne; ou
b) de mentionner, reproduire ou citer un témoignage quelconque.
D.02.009 (1) Il est interdit de vendre un aliment auquel l’un des minéraux nutritifs ci-après a été ajouté à moins qu’une ration quotidienne normale de cet aliment n’apporte à une personne qui la consomme la quantité ci-après de ce minéral nutritif :
a) dans le cas du calcium, au moins 300 milligrammes;
b) dans le cas du phosphore, au moins 300 milligrammes;
c) dans le cas du fer, au moins quatre milligrammes; et
d) dans le cas de l’iode, au moins 0,10 milligramme.
(2) Le paragraphe (1) ne s’applique pas aux fortifiants pour lait humain et aux aliments supplémentés.
D.02.010 (1) Il est interdit de vendre de la poudre de fer élémentaire pour usage dans les aliments en tant que source du minéral nutritif fer, à moins,
a) sous réserve de l’alinéa b), que cette poudre ne soit conforme aux spécifications
(i) du carbonyle de fer,
(ii) du fer sous forme électrolytique, ou
(iii) du fer sous forme réduite
précisées dans le Food Chemicals Codex, troisième édition, 1981, publié par le National Academy of Sciences des États-Unis; et
b) dans le cas du fer sous forme réduite, que 100 pour cent, en poids, des particules de poudre ne parviennent à passer par un tamis de 100 mailles et qu’au moins 95 pour cent, en poids, des particules de poudre ne parviennent à passer par un tamis de 325 mailles.
(2) Il est interdit de vendre un aliment auquel a été ajoutée une poudre de fer élémentaire en tant que source du minéral nutritif fer, à moins que cette poudre ne soit conforme aux exigences des alinéas (1)a) et b).
- DORS/84-303, art. 1
D.02.011 Il est interdit à toute personne de vendre un aliment auquel a été ajouté du pyrophosphate de sodium et de fer en tant que source du minéral nutritif fer, à moins
a) que la biodisponibilité du fer dans l’aliment ne soit au moins égale à 50 pour cent de la biodisponibilité du sulfate ferreux, déterminée selon la méthode officielle FO-42, Détermination de la biodisponibilité du fer, 15 décembre 1982; et
b) que cette personne ne possède une preuve documentaire établissant que la biodisponibilité du fer dans l’aliment a été déterminée selon la méthode visée à l’alinéa a), et ne fournisse cette preuve au ministre s’il en fait la demande.
- DORS/84-303, art. 1
- DORS/2018-69, art. 27
TABLEAU I[Abrogé, DORS/2016-305, art. 70]
TABLEAU II
Apport nutritionnel recommandé pondéré
| Article | Colonne I | Colonne II | Colonne III |
|---|---|---|---|
| Minéral nutritif | Unités | Quantité | |
| 1 | Calcium | milligrammes | 780 |
| 2 | Iode | microgrammes | 155 |
| 3 | Fer | milligrammes | 10 |
| 4 | Phosphore | milligrammes | 885 |
| 5 | Magnésium | milligrammes | 210 |
| 6 | Zinc | milligrammes | 10 |
- DORS/96-259, art. 7
TITRE 3Addition de vitamines, de minéraux nutritifs ou d’acides aminés aux aliments
D.03.001 (1) Dans le présent titre, les expressions vitamine et minéral nutritif ont le même sens que dans les titres 1 et 2 respectivement.
(2) Le présent titre ne s’applique qu’aux aliments présentés comme contenant une vitamine, un minéral nutritif ou un acide aminé destiné à être utilisé dans l’alimentation humaine.
- DORS/88-559, art. 35
D.03.002 (1) Sous réserve de l’article D.03.003, il est interdit de vendre un aliment — autre qu’un aliment supplémenté — auquel une vitamine, un minéral nutritif ou un acide aminé a été ajouté, à moins que cet aliment ne figure à la colonne I du tableau du présent article et à moins que la vitamine, le minéral nutritif ou l’acide aminé, selon le cas, ne figure dans la colonne II dudit tableau en regard du nom de l’aliment.
(2) Sauf mention du contraire, le lait ou les produits ou dérivés du lait visés à la colonne I du tableau du présent article proviennent de la vache, genre Bos.
TABLEAU
Colonne I Colonne II Aliment Vitamine, minéral nutritif ou acide aminé 1 Céréales à déjeuner Thiamine, niacine vitamine B6, acide folique, acide pantothénique, magnésium, fer et zinc 2 Nectars de fruits, boissons aux légumes, bases et mélanges pour boissons aux légumes et mélanges de jus de légumes Vitamine C 2.1 Boissons à arôme de fruit qui répondent aux exigences de l’article B.11.150 Vitamines C, acide folique, thiamine, fer, potassium 2.2 Bases, concentrés et mélanges pour préparer les boissons à arôme de fruit qui répondent aux exigences de l’article B.11.151 Vitamine C, acide folique, thiamine, fer, potassium 3 Produits céréaliers pour bébés Thiamine, riboflavine, niacine ou niacinamide, calcium, phosphore, fer, iode 4 Margarine et autres succédanés similaires du beurre Vitamine A, vitamine D, alphatocophérol 5 Pâtes alimentaires Thiamine, riboflavine, niacine ou niacinamide, acide folique, acide pantothénique, vitamine B6, fer, magnésium 6 Fortifiants pour lait humain, préparations pour nourrissons et préparations pour régime liquide - Acides aminés — acide aspartique, acide glutamique, alanine, arginine, cystine, glycine, histidine, hydroxyproline, isoleucine, leucine, lysine, méthionine, phénylalanine, proline, sérine, taurine, thréonine, tryptophane, tyrosine, valine;
- Minéraux — calcium, chlorure, chrome, cuivre, iode, fer, magnésium, manganèse, molybdène, phosphore, potassium, sélénium, sodium, zinc;
- Vitamines — acide folique, acide d-pantothénique, alpha-tocophérol, biotine, choline, niacine, riboflavine, thiamine, vitamine A, vitamine B6, vitamine B12, vitamine C, vitamine D, vitamine K.
6.1 Aliments présentés comme étant conçus pour régimes à très faible teneur en énergie - Vitamines — acide d-pantothénique, acide folique, alpha-tocophérol, biotine, niacine, riboflavine, thiamine, vitamine A, vitamine B6, vitamine B12, vitamine C, vitamine D, vitamine K
- Minéraux — calcium, chlorure, chrome, cuivre, fer, iode, magnésium, manganèse, molybdène, phosphore, potassium, sélénium, sodium, zinc
7 Mélanges et bases aromatisés qu’il est recommandé d’ajouter au lait Vitamine A, thiamine, niacine ou niacinamide, vitamine C, fer 8 Simili-produits de viande, simili-produits de volaille, allongeurs de produits de viande et allongeurs de produits de volaille Thiamine, riboflavine, niacine, pyridoxine, acide d-pantothénique, acide folique, vitamine B12, fer, magnésium, potassium, zinc, cuivre, histidine, isoleucine, leucine, lysine, méthionine, phénylalanine, thréonine, tryptophane, valine. 9 Substituts de repas et suppléments nutritifs - Vitamines — acide folique, acide d-pantothénique, alpha-tocophérol, biotine, niacine, riboflavine, thiamine, vitamine A, vitamine B6, vitamine B12, vitamine C, vitamine D
- Minéraux — calcium, chlorure, chrome, cuivre, fer, iode, magnésium, manganèse, molybdène, phosphore, potassium, sélénium, sodium, zinc
9.1 Déjeuner tout prêt, déjeuner instantané et autres aliments semblables de remplacement quelle qu’en soit la description fer, niacine ou niacinamide, riboflavine, thiamine, vitamine A, vitamine C 10 Lait condensé, lait, poudre de lait, lait stérilisé, lait (indication de l’arôme) Vitamine D 11 Lait écrémé additionné de solides du lait, lait partiellement écrémé additionné de solides du lait, lait écrémé (indication de l’arôme), lait partiellement écrémé (indication de l’arôme), lait écrémé à (indication de l’arôme) additionné de solides de lait, lait partiellement écrémé à (indication de l’arôme) additionné de solides du lait, lait écrémé, lait partiellement écrémé, poudre de lait écrémé Vitamine A, vitamine D 12 Lait évaporé Vitamine C, vitamine D 13 Lait écrémé évaporé, lait écrémé concentré, lait partiellement écrémé évaporé, lait partiellement écrémé concentré Vitamine A, vitamine C, vitamine D 14 Jus de pomme, jus de pomme reconstitué, jus de raisin, jus de raisin reconstitué, jus d’ananas, jus d’ananas reconstitué, jus de pomme et de (nom du fruit) visé à l’article B.11.132, jus de fruit concentré sauf le jus d’orange concentré congelé Vitamine C 15 Farine, farine blanche, farine enrichie ou farine blanche enrichie Thiamine, riboflavine, niacine, vitamine B6, acide folique, acide d-pantothénique, calcium, fer, magnésium 16 [Abrogé, DORS/94-689, art. 2] 17 Sel de table, succédanés du sel de table Iode 18 Pommes de terre déshydratées Vitamine C 19 Produits imitant l’oeuf entier Vitamine A, thiamine, riboflavine, niacine ou niacinamide, vitamine B6, acide d-pantothénique, acide folique, vitamine B12, alphatocophérol, calcium, fer, zinc, potassium 20 [Abrogé, DORS/90-830, art. 11] 21 Lait de chèvre, lait de chèvre en poudre vitamine D 22 Lait de chèvre partiellement écrémé, lait de chèvre écrémé, lait de chèvre partiellement écrémé en poudre, lait de chèvre écrémé en poudre vitamines A et D 23 Lait de chèvre concentré vitamines C, D, acide folique 24 Lait de chèvre concentré partiellement écrémé, lait de chèvre concentré écrémé vitamines A, C, D, acide folique 25 Riz précuit, au sens du paragraphe B.13.010.1(1) Thiamine, niacine, vitamine B6, acide folique, acide pantothénique, fer 26 Eau minérale, eau de source, eau en contenants scellés, glace pré-emballée Fluor 27 Oeuf entier liquide, poudre d’oeuf entier, oeuf entier congelé, jaune d’oeuf liquide, poudre de jaune d’oeuf, jaune d’oeuf congelé, blanc d’oeuf liquide (albumen liquide), poudre de blanc d’oeuf (poudre d’albumen), blanc d’oeuf congelé (albumen congelé), mélange liquide d’oeufs entiers, mélange de poudre d’oeufs entiers, mélange congelé d’oeufs entiers, mélange liquide de jaunes d’oeufs, mélange de poudre de jaunes d’oeufs, mélange congelé de jaunes d’oeufs Vitamine A, vitamine D, vitamine E, thiamine, riboflavine, niacine, vitamine B6, folacine, vitamine B12, acide pantothénique, calcium, phosphore, magnésium, potassium, fer, zinc
- DORS/78-64, art. 8
- DORS/78-403, art. 29
- DORS/78-478, art. 3
- DORS/78-637, art. 11(A)
- DORS/78-698, art. 10
- DORS/79-6, art. 1
- DORS/81-60, art. 14
- DORS/83-858, art. 2
- DORS/84-300, art. 62
- DORS/85-623, art. 4
- DORS/86-320, art. 2
- DORS/87-640, art. 10
- DORS/88-559, art. 36
- DORS/89-145, art. 3
- DORS/89-198, art. 18
- DORS/90-830, art. 11
- DORS/94-35, art. 5
- DORS/94-689, art. 2
- DORS/95-474, art. 6
- DORS/96-259, art. 8
- DORS/2010-143, art. 39(A)
- DORS/2021-57, art. 24
- DORS/2022-169, art. 27
D.03.003 L’article D.03.002 ne s’applique pas à l’aliment — autre qu’un aliment supplémenté — qui répond aux exigences suivantes :
a) l’aliment est :
(i) soit un aliment sans gluten visé à l’alinéa B.24.003(1)g),
(ii) soit présenté comme étant destiné à un usage diététique spécial visé aux alinéas B.24.003(1)h) ou i);
b) il n’y a pas de normes applicables dans ce règlement pour l’aliment;
c) l’aliment n’est pas annoncé.
- DORS/78-64, art. 9
- DORS/84-334, art. 2
- DORS/90-830, art. 12
- DORS/95-444, art. 3
- DORS/2022-169, art. 28
TITRE 4[Abrogé, DORS/2003-196, art. 105]
TITRE 5Minéraux dans les drogues
D.05.001 à D.05.007 [Abrogés, DORS/2003-196, art. 106]
D.05.008 (1) Sous réserve du paragraphe (2), il est interdit de vendre une drogue contenant du fluor si la plus forte dose quotidienne recommandée sur l’étiquette résulte en l’ingestion par une personne de plus d’un milligramme d’ion fluor.
(2) Le paragraphe (1) ne s’applique pas à une drogue vendue sur ordonnance.
- DORS/81-196, art. 2
D.05.009 Lorsqu’une drogue contient du fluor, les étiquettes intérieure et extérieure de la drogue doivent porter une mise en garde précisant que, si la drogue est utilisée dans une région où l’eau potable naturelle a une teneur en fluor supérieure à 0,7 partie d’ion fluor par million de parties d’eau ou est fluorurée par des moyens artificiels, il peut s’ensuivre une tacheture de l’émail des dents chez l’usager de la drogue.
D.05.010 [Abrogé, DORS/2003-196, art. 107]
PARTIE EÉdulcorants au cyclamate
- DORS/2016-74, art. 11
E.01.001 (1) Dans la présente partie, édulcorant au cyclamate désigne l’acide cyclohexylsulfamique ou l’un de ses sels, ainsi qu’une substance en contenant, vendus comme édulcorants.
(2) La partie B ne s’applique pas aux édulcorants au cyclamate.
- DORS/78-422, art. 4
- DORS/2016-74, art. 12
Vente
E.01.002 Il est interdit de vendre un édulcorant au cyclamate qui n’est pas étiqueté comme l’exige la présente partie.
- DORS/78-422, art. 4
- DORS/2016-74, art. 13
Publicité
E.01.003 Dans la publicité destinée au grand public relativement aux édulcorants au cyclamate, seuls le nom, le prix et la quantité de l’édulcorant peuvent être annoncés.
- DORS/78-422, art. 4
- DORS/2016-74, art. 14
Étiquetage
E.01.004 Tout édulcorant au cyclamate porte, sur l’étiquette, une mise en garde précisant qu’il ne doit être utilisé que sur avis d’un médecin.
- DORS/78-422, art. 4
- DORS/2016-74, art. 15
E.01.005 Tout édulcorant au cyclamate porte sur l’étiquette :
a) sa valeur énergétique exprimée en calories par cuillerée à thé, comprimé, goutte ou autre, selon le mode d’emploi, et par 100 grammes ou 100 millilitres;
b) la liste de tous ses ingrédients et, le cas échéant, les quantités présentes d’acide cyclohexylsulfamique, de ses sels et de glucides.
- DORS/78-422, art. 4
- DORS/2016-74, art. 16
PARTIE GDrogues contrôlées
TITRE 1Dispositions générales
Définitions
Note marginale :Définitions
G.01.001 Les définitions qui suivent s’appliquent à la présente partie.
- autorité compétente
autorité compétente Organisme public d’un pays étranger qui est habilité, au titre des lois du pays, à consentir à l’importation ou à l’exportation de drogues contrôlées. (competent authority)
- composé
composé Vise notamment les préparations. (compound)
- destruction
destruction S’agissant d’une drogue contrôlée, le fait de l’altérer ou de la dénaturer au point d’en rendre la consommation impossible ou improbable. (destroy)
- Directive en matière de sécurité
Directive en matière de sécurité La Directive sur les exigences en matière de sécurité physique pour les substances désignées et les drogues contenant du cannabis, avec ses modifications successives, publiée par le gouvernement du Canada sur son site Web. (Security Directive)
- distributeur autorisé
distributeur autorisé Titulaire d’une licence délivrée au titre de l’article G.02.007. (licensed dealer)
- drogue contrôlée
drogue contrôlée S’entend de l’une des substances suivantes :
a) toute substance désignée qui est visée à l’annexe de la présente partie;
b) s’agissant d’une sage-femme, d’un infirmier praticien ou d’un podiatre, toute substance désignée qui est visée à l’annexe de la présente partie et que ce praticien peut, au titre des articles 3 et 4 du Règlement sur les nouvelles catégories de praticiens, prescrire ou avoir en sa possession ou relativement à laquelle il peut, au titre de ces articles, se livrer à toute autre opération. (controlled drug)
- emballage
emballage Vise notamment toute chose dans laquelle une drogue contrôlée est, en tout ou en partie, contenue, placée ou empaquetée. (package)
- étiquette
étiquette S’entend au sens de l’article 2 de la Loi sur les aliments et drogues. (label)
- hôpital
hôpital L’établissement, selon le cas :
a) qui peut, au titre d’une licence, d’une autorisation ou d’une désignation délivrée par une province sous le régime de ses lois, fournir des soins ou des traitements aux personnes ou aux animaux atteints d’une maladie ou d’une affection;
b) qui fournit des services de santé et qui soit appartient au gouvernement du Canada ou au gouvernement d’une province, soit est exploité par lui. (hospital)
- infirmier praticien
infirmier praticien S’entend au sens de l’article 1 du Règlement sur les nouvelles catégories de praticiens. (nurse practitioner)
- infraction désignée en matière criminelle
infraction désignée en matière criminelle S’entend des infractions suivantes :
a) infraction relative au financement du terrorisme visée aux articles 83.02 à 83.04 du Code criminel;
b) infraction de fraude visée à l’un des articles 380 à 382 du Code criminel;
c) infraction de recyclage des produits de la criminalité visée à l’article 462.31 du Code criminel;
d) infraction relative à une organisation criminelle visée à l’un des articles 467.11 à 467.13 du Code criminel;
e) tentative ou complot en vue de commettre une infraction visée aux alinéas a) à d), complicité après le fait à son égard ou fait de conseiller de la commettre. (designated criminal offence)
- Loi
Loi La Loi réglementant certaines drogues et autres substances. (Act)
- nécessaire d’essai
nécessaire d’essai Nécessaire qui a les caractéristiques suivantes :
a) il contient d’une part une drogue contrôlée et d’autre part un réactif ou une substance tampon;
b) il est utilisé dans un processus chimique ou analytique de dépistage ou de quantification d’une drogue contrôlée à des fins médicales, industrielles, éducatives, pour des travaux de laboratoire ou de recherche ou pour l’application ou l’exécution de la loi;
c) son contenu n’est pas destiné à être consommé par une personne ou un animal, ni à leur être administré, et il n’est pas susceptible de l’être. (test kit)
- obligation internationale
obligation internationale Toute obligation relative à une drogue contrôlée prévue par une convention, un traité ou un autre instrument multilatéral ou bilatéral que le Canada a ratifié ou auquel il adhère. (international obligation)
- ordonnance
ordonnance À l’égard d’une drogue contrôlée, l’autorisation d’un praticien d’en dispenser une quantité déterminée pour la personne qui y est nommée ou pour l’animal qui y est identifié. (prescription)
- pharmacien
pharmacien Personne qui est autorisée en vertu des lois d’une province à exercer la profession de pharmacien et qui l’y exerce. (pharmacist)
- podiatre
podiatre S’entend au sens de l’article 1 du Règlement sur les nouvelles catégories de praticiens. (podiatrist)
- préparation
préparation Drogue qui contient d’une part une drogue contrôlée et d’autre part un ingrédient actif de nature médicinale en dose thérapeutique reconnue qui n’est pas une drogue contrôlée. (preparation)
- publicité
publicité S’entend notamment de la présentation, par tout moyen, d’une drogue contrôlée en vue d’en promouvoir directement ou indirectement la disposition, notamment par vente. (advertisement)
- responsable principal
responsable principal L’individu désigné en application de l’article G.02.003. (senior person in charge)
- responsable qualifié
responsable qualifié L’individu désigné en application du paragraphe G.02.004(1). (qualified person in charge)
- sage-femme
sage-femme S’entend au sens de l’article 1 du Règlement sur les nouvelles catégories de praticiens. (midwife)
- DORS/78-220, art. 1
- DORS/85-550, art. 1
- DORS/86-91, art. 1
- DORS/90-261, art. 1(F)
- DORS/92-386, art. 1
- DORS/97-228, art. 7
- DORS/97-515, art. 2
- DORS/2003-135, art. 2
- DORS/2004-238, art. 1
- DORS/2012-230, art. 6
- DORS/2018-147, art. 29
- DORS/2019-171, art. 1
Application
Note marginale :Implants agricoles
G.01.002 (1) La Loi et la présente partie ne s’appliquent pas aux drogues contrôlées contenues dans des implants agricoles et mentionnées à la partie III de l’annexe de la présente partie. Le présent article n’a toutefois pas pour effet d’exempter ces drogues de l’application de la partie C.
Note marginale :Définition de implant agricole
(2) Dans le présent article, implant agricole s’entend d’un produit qui est présenté sous une forme permettant la libération prolongée d’un ingrédient actif dans un délai donné et qui est destiné à être inséré sous la peau d’un animal producteur de denrées alimentaires aux fins de l’accroissement du gain pondéral et de l’indice de consommation.
- DORS/97-515, art. 3
- DORS/99-125, art. 1
- DORS/2003-34, art. 1
- DORS/2003-413, art. 1
- DORS/2018-69, art. 67 et 68
- DORS/2019-171, art. 1
G.01.002.1 [Abrogé, DORS/2019-171, art. 1]
Note marginale :Membre d’un corps policier
G.01.003 Le membre d’un corps policier ou la personne agissant sous son autorité et sa supervision qui, à l’égard de l’une de ses activités, est soustrait à l’application du paragraphe 4(2) ou des articles 5, 6, ou 7 de la Loi en vertu du Règlement sur l’exécution policière de la Loi réglementant certaines drogues et autres substances est, à l’égard de cette activité, soustrait à l’application de la présente partie.
- DORS/80-543, art. 11
- DORS/2004-238, art. 2(F)
- DORS/2019-171, art. 1
Note marginale :Application des parties C et D
G.01.004 Sauf disposition contraire de la présente partie, il est interdit de vendre ou de fournir une drogue contrôlée ou une préparation qui n’est pas conforme à toutes les dispositions des parties C et D qui s’y appliquent.
- DORS/92-386, art. 2
- DORS/97-228, art. 8
- DORS/2019-171, art. 1
Possession
Note marginale :Personnes autorisées
G.01.005 (1) Toute personne est autorisée à avoir en sa possession une drogue contrôlée mentionnée à l’un des articles 1 à 3, 8 à 10, 12 à 14, 16 et 17 de la partie I de l’annexe de la présente partie si elle l’obtient soit en vertu du présent règlement, soit lors d’une activité se rapportant à l’application ou à l’exécution d’une loi ou d’un règlement, soit d’une personne bénéficiant d’une exemption accordée en vertu de l’article 56 de la Loi relativement à l’application du paragraphe 5(1) de la Loi à cette drogue, et si elle remplit l’une des conditions suivantes :
a) elle a besoin de la drogue contrôlée pour son entreprise ou sa profession et est :
(i) soit un distributeur autorisé,
(ii) soit un pharmacien,
(iii) soit un praticien inscrit et autorisé à exercer dans la province où il a la drogue en sa possession;
b) elle est un praticien inscrit et autorisé à exercer dans une province autre que la province où elle a la drogue contrôlée en sa possession seulement pour des urgences médicales;
c) elle est un employé d’un hôpital ou un praticien y exerçant;
d) elle obtient la drogue contrôlée pour son utilisation personnelle de l’une des façons suivantes :
(i) d’un praticien,
(ii) en vertu d’une ordonnance qui n’a pas été faite ou obtenue en contravention du présent règlement;
e) elle est un médecin qui a reçu la drogue contrôlée au titre des paragraphes G.06.003(1) ou (2) et qui l’a en sa possession pour la fournir ou la livrer à l’une des personnes visées au paragraphe G.06.003(3);
f) elle est un mandataire d’un médecin qui a reçu la drogue contrôlée au titre du paragraphe G.06.003(1) et qui l’a en sa possession pour la fournir ou la livrer à l’une des personnes visées au paragraphe G.06.003(2);
g) elle est employée à titre d’inspecteur, de membre de la Gendarmerie royale du Canada, d’agent de police, d’agent de la paix ou de membre du personnel technique ou scientifique du gouvernement du Canada, du gouvernement d’une province ou d’une université au Canada et elle a la drogue contrôlée en sa possession dans le cadre de ses fonctions;
h) elle n’est pas un médecin visé à l’alinéa e) ni un mandataire visé à l’alinéa f), elle bénéficie d’une exemption relative à la possession de la drogue contrôlée et accordée en vertu de l’article 56 de la Loi et elle en a la possession aux fins énoncées dans l’exemption;
i) elle est le ministre.
Note marginale :Mandataires
(2) Toute personne est autorisée à avoir une drogue contrôlée visée au paragraphe (1) en sa possession si elle agit comme mandataire d’une personne autorisée à en avoir la possession au titre de l’un des alinéas (1)a) à e), h) et i).
Note marginale :Mandataires — personne visée à l’alinéa (1)g)
(3) Toute personne est autorisée à avoir une drogue contrôlée visée au paragraphe (1) en sa possession si les conditions ci-après sont réunies :
a) elle agit comme mandataire d’une personne dont elle a des motifs raisonnables de croire que celle-ci est une personne visée à l’alinéa (1)g);
b) la possession de la drogue contrôlée a pour but d’aider la personne dont elle est mandataire dans l’application ou l’exécution d’une loi ou d’un règlement.
Nécessaires d’essai
Note marginale :Opérations autorisées
G.01.006 Toute personne peut vendre un nécessaire d’essai, en avoir un en sa possession ou effectuer toute autre opération relative à celui-ci si les conditions ci-après sont remplies :
a) un numéro d’enregistrement a été attribué au nécessaire d’essai au titre de l’article G.01.008 et n’a pas été annulé en application de l’article G.01.009;
b) le nécessaire d’essai porte, sur sa surface extérieure, les renseignements suivants :
(i) le nom du fabricant,
(ii) le nom commercial ou la marque de commerce,
(iii) le numéro d’enregistrement;
c) le nécessaire d’essai sera utilisé à des fins médicales, industrielles ou éducatives, pour des travaux de laboratoire ou de recherche ou pour l’application ou l’exécution de la loi.
Note marginale :Numéro d’enregistrement — demande
G.01.007 (1) Le fabricant d’un nécessaire d’essai peut obtenir un numéro d’enregistrement en présentant au ministre une demande qui contient les renseignements suivants :
a) une description détaillée de la conception et de la fabrication du nécessaire d’essai;
b) une description détaillée de la drogue contrôlée et, le cas échéant, des autres substances que contient le nécessaire d’essai, ainsi que la description qualitative et quantitative de chacun des composants;
c) une description de l’utilisation à laquelle est destiné le nécessaire d’essai.
Note marginale :Signature et attestation
(2) La demande satisfait aux exigences suivantes :
a) elle est signée et datée par la personne autorisée à cette fin par le demandeur;
b) elle comprend une attestation de celle-ci portant qu’à sa connaissance, tous les renseignements fournis à l’appui de la demande sont exacts et complets.
Note marginale :Renseignements et documents complémentaires
(3) Le demandeur fournit au ministre, au plus tard à la date précisée dans la demande écrite de celui-ci à cet effet, tout renseignement ou document que le ministre juge nécessaire pour compléter l’examen de la demande du numéro d’enregistrement.
Note marginale :Numéro d’enregistrement — attribution
G.01.008 Le ministre, au terme de l’examen de la demande de numéro d’enregistrement, attribue un numéro d’enregistrement précédé des lettres « TK » au nécessaire d’essai s’il établit que ce dernier satisfait à l’une des exigences ci-après et sera utilisé seulement à des fins médicales, industrielles ou éducatives, pour des travaux de laboratoire ou de recherche ou pour l’application ou l’exécution de la loi :
a) il contient une drogue contrôlée et un agent d’adultération ou un dénaturant, mélangés de telle manière et en quantités, proportions ou concentrations telles que la préparation ou le mélange ne présente pas un risque notable de toxicomanie;
b) il contient des quantités ou des concentrations d’une drogue contrôlée si infimes qu’il ne présente pas un risque notable de toxicomanie.
Note marginale :Numéro d’enregistrement — annulation
G.01.009 Le ministre annule le numéro d’enregistrement d’un nécessaire d’essai dans les cas suivants :
a) le fabricant retire le nécessaire d’essai du marché;
b) le ministre a des motifs raisonnables de croire que le nécessaire d’essai n’est pas utilisé à des fins médicales, industrielles ou éducatives, pour des travaux de laboratoire ou de recherche ou pour l’application ou l’exécution de la loi, ou qu’il est susceptible de ne pas l’être;
c) le ministre a des motifs raisonnables de croire que l’annulation est nécessaire pour protéger la sécurité ou la santé publiques, notamment pour prévenir le détournement d’une drogue contrôlée vers un marché ou un usage illicites.
G.01.010 [Abrogé, DORS/2019-171, art. 1]
TITRE 2Distributeurs autorisés
Opérations autorisées
Note marginale :Général
G.02.001 (1) Le distributeur autorisé peut produire, assembler, vendre, fournir, transporter, expédier, livrer, importer ou exporter une drogue contrôlée s’il se conforme à la présente partie ainsi qu’aux conditions de sa licence de distributeur autorisé et de tout permis délivré en vertu de la présente partie.
Note marginale :Présence d’un responsable qualifié
(2) Le distributeur autorisé ne peut effectuer à son installation une opération relative à une drogue contrôlée que si le responsable qualifié ou un responsable qualifié suppléant est présent à l’installation.
Note marginale :Permis — importation et exportation
(3) Le distributeur autorisé est tenu d’obtenir un permis pour importer ou exporter une drogue contrôlée.
Note marginale :Possession à des fins d’exportation
(4) Le distributeur autorisé peut avoir en sa possession une drogue contrôlée en vue de son exportation s’il l’a obtenue conformément à la présente partie.
- DORS/2004-238, art. 3
- DORS/2019-171, art. 1
G.02.001.1 [Abrogé, DORS/2019-171, art. 1]
G.02.001.2 [Abrogé, DORS/2019-171, art. 1]
Licences de distributeur autorisé
Exigences préalables
Note marginale :Personnes admissibles
G.02.002 Les personnes ci-après peuvent demander une licence de distributeur autorisé :
a) l’individu qui réside de façon habituelle au Canada;
b) la personne morale qui a son siège social au Canada ou qui y exploite une succursale;
c) le titulaire d’un poste qui est responsable des questions relatives aux drogues contrôlées pour le compte du gouvernement du Canada ou d’un gouvernement provincial, d’un service de police, d’un hôpital ou d’une université au Canada.
G.02.002.1 [Abrogé, DORS/2019-171, art. 1]
Note marginale :Responsable principal
G.02.003 La personne qui demande une licence de distributeur autorisé désigne un seul individu à titre de responsable principal, le demandeur pouvant se désigner lui-même s’il est un individu, qui est responsable de la gestion de l’ensemble des opérations relatives aux drogues contrôlées précisées dans la demande de licence.
- DORS/2004-238, art. 4
- DORS/2010-222, art. 2
- DORS/2012-230, art. 8
- DORS/2014-260, art. 1 et 16(F)
- DORS/2019-171, art. 1
G.02.003.1 [Abrogé, DORS/2019-171, art. 1]
G.02.003.2 [Abrogé, DORS/2019-171, art. 1]
G.02.003.3 [Abrogé, DORS/2019-171, art. 1]
G.02.003.4 [Abrogé, DORS/2019-171, art. 1]
G.02.003.5 [Abrogé, DORS/2019-171, art. 1]
G.02.003.6 [Abrogé, DORS/2019-171, art. 1]
G.02.003.7 [Abrogé, DORS/2019-171, art. 1]
G.02.003.8 [Abrogé, DORS/2019-171, art. 1]
G.02.003.9 [Abrogé, DORS/2019-171, art. 1]
G.02.003.91 [Abrogé, DORS/2019-171, art. 1]
Note marginale :Responsable qualifié
G.02.004 (1) La personne qui demande une licence de distributeur autorisé désigne un seul individu à titre de responsable qualifié, le demandeur pouvant se désigner lui-même s’il est un individu, qui est à la fois responsable de superviser les opérations relatives aux drogues contrôlées précisées dans la demande de licence et de veiller à la conformité de ces opérations avec la présente partie.
Note marginale :Responsable qualifié suppléant
(2) La personne qui demande une licence de distributeur autorisé peut désigner un individu à titre de responsable qualifié suppléant, le demandeur pouvant se désigner lui-même s’il est un individu, qui est autorisé à remplacer le responsable qualifié lorsque celui-ci est absent.
Note marginale :Qualifications
(3) Seul l’individu qui satisfait aux exigences ci-après peut être désigné à titre de responsable qualifié ou de responsable qualifié suppléant :
a) il travaille à l’installation précisée dans la licence de distributeur autorisé;
b) il est :
(i) soit une personne autorisée ou, le cas échéant, inscrite et autorisée, par une autorité provinciale attributive de licences en matière d’activités professionnelles ou par une association professionnelle au Canada, à exercer sa profession dans un domaine lié à ses fonctions, notamment celle de pharmacien, de praticien, de technicien en pharmacie ou de technicien de laboratoire,
(ii) soit titulaire d’un diplôme, d’un certificat ou d’une attestation décerné par un établissement d’enseignement postsecondaire au Canada dans un domaine qui est lié à ses fonctions, notamment la pharmacie, la médecine, la dentisterie, la médecine vétérinaire, la pharmacologie, la chimie, la biologie, la réglementation pharmaceutique, la sécurité ou la gestion des chaînes d’approvisionnement, les techniques en pharmacie ou les techniques de laboratoire,
(iii) soit titulaire d’un diplôme, d’un certificat ou d’une attestation décerné par un établissement d’enseignement étranger dans l’un des domaines visés au sous-alinéa (ii) et titulaire de l’une des attestations suivantes :
(A) une attestation d’équivalence, au sens du paragraphe 73(1) du Règlement sur l’immigration et la protection des réfugiés,
(B) une attestation d’équivalence délivrée par une institution ou une organisation chargée de faire de telles attestations et reconnue par une province;
c) il possède des connaissances et une expérience relatives à l’utilisation et à la manutention des drogues contrôlées précisées dans la licence de distributeur autorisé qui sont suffisantes pour lui permettre de bien exercer ses fonctions;
d) il possède une connaissance suffisante des dispositions de la Loi et de la présente partie s’appliquant aux opérations précisées dans la licence de distributeur autorisé pour lui permettre de bien exercer ses fonctions.
Note marginale :Exception
(4) La personne qui demande une licence de distributeur autorisé peut désigner à titre de responsable qualifié ou de responsable qualifié suppléant un individu qui ne satisfait à aucune des exigences prévues à l’alinéa (3)b) si les conditions ci-après sont réunies :
a) aucun autre individu travaillant à l’installation ne satisfait à l’une de ces exigences;
b) ces exigences ne sont pas nécessaires pour effectuer les opérations précisées dans la licence;
c) l’individu possède des connaissances suffisantes acquises par la combinaison de ses études, de sa formation ou de son expérience de travail pour lui permettre de bien exercer ses fonctions.
- DORS/2004-238, art. 4
- DORS/2019-171, art. 1
Note marginale :Inadmissibilité
G.02.005 Ne peut être désigné à titre de responsable principal, de responsable qualifié ou de responsable qualifié suppléant l’individu qui, dans les dix années précédant la date de présentation de la demande de licence de distributeur autorisé :
a) à l’égard d’une infraction désignée, d’une infraction désignée en matière criminelle ou d’une infraction désignée, au sens du paragraphe 2(1) de la Loi sur le cannabis :
(i) soit a été condamné en tant qu’adulte,
(ii) soit s’est vu imposer en tant qu’adolescent, au sens du paragraphe 2(1) de la Loi sur le système de justice pénale pour les adolescents, une peine applicable aux adultes, au sens de ce paragraphe;
b) à l’égard d’une infraction commise dans un pays étranger qui, si elle avait été commise au Canada, aurait constitué une infraction désignée, une infraction désignée en matière criminelle ou une infraction désignée, au sens du paragraphe 2(1) de la Loi sur le cannabis :
(i) soit a été condamné en tant qu’adulte,
(ii) soit s’est vu imposer, pour une infraction commise alors qu’il avait au moins quatorze ans et moins de dix-huit ans, une peine plus longue que la peine maximale prévue par la peine spécifique, au sens du paragraphe 2(1) de la Loi sur le système de justice pénale pour les adolescents pour une telle infraction.
Délivrance d’une licence
Note marginale :Demande
G.02.006 (1) La personne qui prévoit d’effectuer l’une des opérations visées à l’article G.02.001 doit obtenir une licence de distributeur autorisé pour chaque installation où elle prévoit d’effectuer celle-ci en présentant au ministre une demande qui contient les renseignements suivants :
a) les précisions ci-après à l’égard de la personne qui demande la licence :
(i) s’agissant d’un individu, son nom,
(ii) s’agissant d’une personne morale, sa dénomination sociale et toute autre dénomination enregistrée dans une province sous laquelle elle entend s’identifier ou effectuer les opérations précisées dans la licence,
(iii) s’agissant du titulaire d’un poste visé à l’alinéa G.02.002c), son nom et le titre de son poste;
b) l’adresse municipale, le numéro de téléphone et, le cas échéant, l’adresse électronique de l’installation de même que, si elle diffère de l’adresse municipale, son adresse postale;
c) les nom, numéro de téléphone et adresse électronique du responsable principal proposé ainsi que sa date de naissance;
d) à l’égard du responsable qualifié et de tout responsable qualifié suppléant proposés :
(i) leurs nom, numéro de téléphone et adresse électronique ainsi que leur date de naissance,
(ii) le titre de leur poste à l’installation,
(iii) les nom et titre du poste de leur supérieur immédiat à l’installation,
(iv) le cas échéant, la profession exercée qui est liée à leurs fonctions, le nom de la province les autorisant à l’exercer et le numéro de cette autorisation,
(v) leurs études, formation et expérience de travail liées à l’exercice de leurs fonctions;
e) les opérations proposées et les drogues contrôlées visées par chacune de celles-ci;
f) si la demande vise la fabrication ou l’assemblage d’un produit ou d’un composé contenant une drogue contrôlée, sauf si elle vise la fabrication ou l’assemblage d’un nécessaire d’essai, une liste qui contient les précisions ci-après pour chaque produit ou composé :
(i) la marque nominative du produit ou le nom du composé,
(ii) l’identification numérique qui a été attribuée au produit aux termes de l’article C.01.014.2, s’il y a lieu,
(iii) le nom de la drogue contrôlée qu’il contient,
(iv) la concentration de la drogue contrôlée qu’il contient dans chacune de ses unités, le nombre d’unités contenues dans son emballage et le nombre d’emballages,
(v) s’il est fabriqué ou assemblé sur mesure aux termes d’une commande spéciale pour un autre distributeur autorisé ou s’il l’est par un distributeur autorisé différent, les nom, adresse municipale et numéro de licence de celui-ci,
(vi) si le nom du demandeur figure sur l’étiquette du produit ou du composé, une copie de l’étiquette intérieure;
g) si la demande vise la production d’une drogue contrôlée, exception faite des produits ou composés contenant une drogue contrôlée, les précisions ci-après concernant cette drogue :
(i) son nom,
(ii) la quantité que le demandeur prévoit de produire en vertu de la licence et la période prévue pour la production,
(iii) si elle est produite sur mesure aux termes d’une commande spéciale pour un autre distributeur autorisé, les nom, adresse municipale et numéro de licence de celui-ci;
h) si la demande vise une opération qui n’est pas visée par les alinéas f) et g), le nom de la drogue contrôlée qui fera l’objet de l’opération et le but de cette dernière;
i) la description détaillée des mesures de sécurité mises en place à l’installation et établies conformément à la Directive en matière de sécurité;
j) la description détaillée de la méthode de consignation des renseignements que le demandeur prévoit d’utiliser en application de l’article G.02.071.
Note marginale :Documents
(2) La demande est accompagnée des documents suivants :
a) dans le cas où le demandeur est une personne morale :
(i) une copie de son certificat de constitution ou de tout autre acte constitutif,
(ii) une copie de tout document déposé auprès de la province où se trouve son installation et qui indique sa dénomination sociale et tout autre nom enregistré dans la province sous lequel elle entend s’identifier ou effectuer les opérations précisées dans la licence;
b) les déclarations individuelles signées et datées par le responsable principal, le responsable qualifié et tout responsable qualifié suppléant proposés attestant que le signataire n’est pas visé par l’article G.02.005;
c) à l’égard de chaque personne visée à l’alinéa b), un document délivré par un corps policier canadien précisant si, au cours des dix années précédant la présentation de la demande, elle a fait l’objet d’une condamnation visée au sous-alinéa G.02.005a)(i) ou s’est vu imposer une peine visée au sous-alinéa G.02.005a)(ii);
d) à l’égard de chaque personne visée à l’alinéa b) qui a résidé de façon habituelle dans un pays étranger au cours des dix années précédant la présentation de la demande, un document délivré par un corps policier de ce pays précisant si elle a fait l’objet d’une condamnation visée au sous-alinéa G.02.005b)(i) ou s’est vu imposer une peine visée au sous-alinéa G.02.005b)(ii) dans ce pays au cours de cette période;
e) une déclaration, signée et datée par le responsable principal, attestant que le responsable qualifié et tout responsable qualifié suppléant proposés ont les connaissances et l’expérience exigées aux alinéas G.02.004(3)c) et d);
f) dans le cas où le responsable qualifié ou tout responsable qualifié suppléant proposé ne satisfait pas à l’exigence visée au sous-alinéa G.02.004(3)b)(i) :
(i) une copie du diplôme, du certificat ou de l’attestation visé aux sous-alinéas G.02.004(3)b)(ii) ou (iii),
(ii) une description détaillée des études, de la formation et de l’expérience de travail visées à l’alinéa G.02.004(4)c), accompagnée de pièces justificatives telle une copie des relevés de notes ou de l’attestation faite par la personne qui a donné la formation.
Note marginale :Signature et attestation
(3) La demande satisfait aux exigences suivantes :
a) elle est signée et datée par le responsable principal proposé;
b) elle comprend une attestation de celui-ci portant sur les faits suivants :
(i) à sa connaissance, tous les renseignements et documents fournis à l’appui de la demande sont exacts et complets,
(ii) il est habilité à lier le demandeur.
Note marginale :Renseignements et documents complémentaires
(4) Le demandeur fournit au ministre, au plus tard à la date précisée dans la demande écrite de celui-ci à cet effet, tout renseignement ou document que le ministre juge nécessaire pour compléter l’examen de la demande de licence.
Note marginale :Délivrance
G.02.007 Le ministre, au terme de l’examen de la demande de licence et sous réserve de l’article G.02.009, délivre une licence de distributeur autorisé, avec ou sans conditions, qui contient les renseignements suivants :
a) le numéro de la licence;
b) le nom du distributeur, sa dénomination sociale ou le titre de son poste;
c) les opérations autorisées et le nom des drogues contrôlées visées par chacune de celles-ci;
d) l’adresse municipale de l’installation où le distributeur peut effectuer les opérations autorisées;
e) le niveau de sécurité applicable à l’installation, établi conformément à la Directive en matière de sécurité;
f) la date de prise d’effet de la licence;
g) la date d’expiration de la licence, qui ne peut être postérieure à la troisième année suivant sa date de prise d’effet;
h) toute condition que le ministre estime nécessaire, sur le fondement de motifs raisonnables, pour atteindre l’une des fins suivantes :
(i) le respect d’une obligation internationale,
(ii) la conformité aux exigences associées au niveau de sécurité visé à l’alinéa e),
(iii) la réduction d’un risque d’atteinte à la sécurité ou à la santé publiques, notamment le risque de détournement d’une drogue contrôlée vers un marché ou un usage illicites;
i) si le distributeur produit une drogue contrôlée, la quantité qu’il peut produire et la période de production autorisée.
Note marginale :Validité
G.02.008 La licence de distributeur autorisé est valide jusqu’à la date d’expiration qui y est indiquée ou, si elle est antérieure, jusqu’à la date de sa suspension ou de sa révocation au titre des articles G.02.027 ou G.02.028.
Note marginale :Refus
G.02.009 (1) Le ministre refuse de délivrer une licence de distributeur autorisé dans les cas suivants :
a) le demandeur ne peut pas demander une licence en vertu de l’article G.02.002;
b) le demandeur a contrevenu, dans les dix années précédant la présentation de la demande de licence :
(i) soit à une disposition de la Loi, de la Loi sur le cannabis ou de leurs règlements,
(ii) soit à une condition d’une licence ou d’un permis qui lui a été délivré en vertu d’un règlement pris en vertu de la Loi ou qui lui a été délivré en vertu de la Loi sur le cannabis ou de ses règlements;
c) dans les dix années précédant la présentation de la demande de licence, le responsable principal, le responsable qualifié ou tout responsable qualifié suppléant proposé a fait l’objet d’une condamnation visée aux sous-alinéas G.02.005a)(i) ou b)(i) ou s’est vu imposer une peine visée aux sous-alinéas G.02.005a)(ii) ou b)(ii);
d) l’une des opérations pour lesquelles la licence est demandée entraînerait la violation d’une obligation internationale;
e) le demandeur n’a pas mis en place à l’installation les mesures de sécurité prévues dans la Directive en matière de sécurité à l’égard d’une opération pour laquelle il demande la licence;
f) la méthode visée à l’alinéa G.02.006(1)j) ne permet pas la consignation des renseignements conformément à l’article G.02.071;
g) soit le demandeur ne s’est pas conformé aux exigences prévues au paragraphe G.02.006(4), soit il s’y est conformé, mais les renseignements ou documents fournis sont insuffisants pour terminer l’examen de la demande de licence;
h) le ministre a des motifs raisonnables de croire que le demandeur a fourni, dans sa demande de licence ou à l’appui de celle-ci, des renseignements faux ou trompeurs ou des documents faux ou falsifiés;
i) le ministre a des motifs raisonnables de croire, sur le fondement de renseignements reçus d’une autorité compétente ou de l’Organisation des Nations Unies, que le demandeur a participé au détournement d’une drogue contrôlée vers un marché ou un usage illicites ou qu’il a participé à des opérations qui ont entraîné la violation d’une obligation internationale;
j) le ministre a des motifs raisonnables de croire que la délivrance de la licence risquerait vraisemblablement de porter atteinte à la sécurité ou à la santé publiques, notamment en raison du risque de détournement d’une drogue contrôlée vers un marché ou un usage illicites.
Note marginale :Exceptions
(2) Le ministre ne peut, dans les cas visés aux alinéas (1)b) ou h), refuser de délivrer la licence si le demandeur remplit les conditions ci-après, sauf s’il a des motifs raisonnables de croire que le refus est nécessaire pour protéger la sécurité ou la santé publiques, notamment pour prévenir le détournement d’une drogue contrôlée vers un marché ou un usage illicites :
a) le demandeur n’a pas d’antécédents de contravention à la Loi, à la Loi sur le cannabis ou à leurs règlements;
b) il a soit pris les mesures correctives nécessaires pour veiller à respecter la Loi, la Loi sur le cannabis et leurs règlements, soit signé un engagement à cet effet.
Note marginale :Préavis
(3) Le ministre, avant de refuser de délivrer la licence, envoie au demandeur un préavis motivé l’informant qu’il peut présenter ses observations à cet égard.
Renouvellement de la licence
Note marginale :Demande
G.02.010 (1) Le distributeur autorisé présente au ministre, pour obtenir le renouvellement de sa licence de distributeur autorisé, une demande qui contient les renseignements et documents visés aux paragraphes G.02.006(1) et (2).
Note marginale :Signature et attestation
(2) La demande satisfait aux exigences suivantes :
a) elle est signée et datée par le responsable principal de l’installation précisée dans la demande;
b) elle comprend une attestation de celui-ci portant sur les faits suivants :
(i) à sa connaissance, tous les renseignements et documents fournis à l’appui de la demande sont exacts et complets,
(ii) il est habilité à lier le distributeur autorisé.
Note marginale :Renseignements et documents complémentaires
(3) Le distributeur autorisé fournit au ministre, au plus tard à la date précisée dans la demande écrite de celui-ci à cet effet, tout renseignement ou document que le ministre juge nécessaire pour compléter l’examen de la demande de renouvellement.
Note marginale :Renouvellement
G.02.011 (1) Le ministre, au terme de l’examen de la demande de renouvellement et sous réserve de l’article G.02.013, renouvelle la licence de distributeur autorisé, qui contient les renseignements visés à l’article G.02.007.
Note marginale :Conditions
(2) Le ministre peut, lorsqu’il renouvelle la licence du distributeur autorisé, ajouter toute condition à la licence, en modifier les conditions ou supprimer l’une de celles-ci s’il a des motifs raisonnables de le croire nécessaire pour atteindre l’une des fins suivantes :
a) le respect d’une obligation internationale;
b) la conformité aux exigences associées au niveau de sécurité précisé dans la licence ou à tout nouveau niveau qui s’impose à la suite du renouvellement;
c) la réduction d’un risque d’atteinte à la sécurité ou à la santé publiques, notamment le risque de détournement d’une drogue contrôlée vers un marché ou un usage illicites.
- DORS/2004-238, art. 5
- DORS/2010-222, art. 7
- DORS/2019-171, art. 1
G.02.011.1 [Abrogé, DORS/2019-171, art. 1]
G.02.011.2 [Abrogé, DORS/2019-171, art. 1]
Note marginale :Validité
G.02.012 La licence de distributeur autorisé renouvelée est valide jusqu’à la date d’expiration qui y est indiquée ou, si elle est antérieure, jusqu’à la date de sa suspension ou de sa révocation au titre des articles G.02.027 ou G.02.028.
- DORS/2004-238, art. 5
- DORS/2019-171, art. 1
Note marginale :Refus
G.02.013 (1) Le ministre refuse de renouveler la licence de distributeur autorisé dans les cas suivants :
a) le distributeur autorisé ne peut plus demander une licence en vertu de l’article G.02.002;
b) le distributeur autorisé a contrevenu, dans les dix années précédant la présentation de la demande de renouvellement :
(i) soit à une disposition de la Loi, de la Loi sur le cannabis ou de leurs règlements,
(ii) soit à une condition d’une licence ou d’un permis qui lui a été délivré en vertu d’un règlement pris en vertu de la Loi ou qui lui a été délivré en vertu de la Loi sur le cannabis ou de ses règlements;
c) dans les dix années précédant la présentation de la demande de renouvellement, le responsable principal, le responsable qualifié ou tout responsable qualifié suppléant proposé a fait l’objet d’une condamnation visée aux sous-alinéas G.02.005a)(i) ou b)(i) ou s’est vu imposer une peine visée aux sous-alinéas G.02.005a)(ii) ou b)(ii);
d) l’une des opérations pour lesquelles le renouvellement est demandé entraînerait la violation d’une obligation internationale;
e) le distributeur autorisé n’a pas mis en place à l’installation les mesures de sécurité prévues dans la Directive en matière de sécurité à l’égard d’une opération pour laquelle il demande le renouvellement;
f) la méthode visée à l’alinéa G.02.006(1)j) ne permet pas la consignation des renseignements conformément à l’article G.02.071;
g) soit le distributeur autorisé ne s’est pas conformé aux exigences prévues au paragraphe G.02.010(3), soit il s’y est conformé, mais les renseignements ou documents fournis sont insuffisants pour terminer l’examen de la demande de renouvellement;
h) le ministre a des motifs raisonnables de croire que le distributeur autorisé a fourni, dans sa demande de renouvellement ou à l’appui de celle-ci, des renseignements faux ou trompeurs ou des documents faux ou falsifiés;
i) le ministre a des motifs raisonnables de croire, sur le fondement de renseignements reçus d’une autorité compétente ou de l’Organisation des Nations Unies, que le distributeur autorisé a participé au détournement d’une drogue contrôlée vers un marché ou un usage illicites ou qu’il a participé à des opérations qui ont entraîné la violation d’une obligation internationale;
j) le ministre a des motifs raisonnables de croire que le renouvellement de la licence risquerait vraisemblablement de porter atteinte à la sécurité ou à la santé publiques, notamment en raison du risque de détournement d’une drogue contrôlée vers un marché ou un usage illicites.
Note marginale :Exceptions
(2) Le ministre ne peut, dans les cas visés aux alinéas (1)b) ou h), refuser de renouveler la licence si le distributeur autorisé remplit les conditions ci-après, sauf s’il a des motifs raisonnables de croire que le refus est nécessaire pour protéger la sécurité ou la santé publiques, notamment pour prévenir le détournement d’une drogue contrôlée vers un marché ou un usage illicites :
a) le distributeur autorisé n’a pas d’antécédents de contravention à la Loi, à la Loi sur le cannabis ou à leurs règlements;
b) il a soit pris les mesures correctives nécessaires pour veiller à respecter la Loi, la Loi sur le cannabis et leurs règlements, soit signé un engagement à cet effet.
Note marginale :Préavis
(3) Le ministre, avant de refuser de renouveler la licence, envoie au distributeur autorisé un préavis motivé l’informant qu’il peut présenter ses observations à cet égard.
Modification de la licence
Note marginale :Demande
G.02.014 (1) Le distributeur autorisé présente au ministre, avant d’apporter un changement ayant une incidence sur tout renseignement visé à l’article G.02.007 figurant sur sa licence de distributeur autorisé, une demande de modification de sa licence qui contient la description du changement prévu ainsi que les renseignements et documents pertinents visés à l’article G.02.006.
Note marginale :Signature et attestation
(2) La demande satisfait aux exigences suivantes :
a) elle est signée et datée par le responsable principal de l’installation précisée dans la demande;
b) elle comprend une attestation de celui-ci portant sur les faits suivants :
(i) à sa connaissance, tous les renseignements et documents fournis à l’appui de la demande sont exacts et complets,
(ii) il est habilité à lier le distributeur autorisé.
Note marginale :Renseignements et documents complémentaires
(3) Le distributeur autorisé fournit au ministre, au plus tard à la date précisée dans la demande écrite de celui-ci à cet effet, tout renseignement ou document que le ministre juge nécessaire pour compléter l’examen de la demande de modification.
- DORS/78-427, art. 1
- DORS/97-228, art. 10
- DORS/2004-238, art. 6
- DORS/2010-222, art. 8(A)
- DORS/2019-171, art. 1
Note marginale :Modification
G.02.015 (1) Le ministre, au terme de l’examen de la demande de modification et sous réserve de l’article G.02.017, modifie la licence de distributeur autorisé.
Note marginale :Conditions
(2) Le ministre peut, lorsqu’il modifie la licence du distributeur autorisé, ajouter toute condition à la licence, en modifier les conditions ou supprimer l’une de celles-ci s’il a des motifs raisonnables de le croire nécessaire pour atteindre l’une des fins suivantes :
a) le respect d’une obligation internationale;
b) la conformité aux exigences associées au niveau de sécurité précisé dans la licence ou à tout nouveau niveau qui s’impose à la suite de la modification;
c) la réduction d’un risque d’atteinte à la sécurité ou à la santé publiques, notamment le risque de détournement d’une drogue contrôlée vers un marché ou un usage illicites.
- DORS/78-427, art. 2
- DORS/2004-238, art. 7
- DORS/2010-222, art. 9
- DORS/2019-171, art. 1
Note marginale :Validité
G.02.016 La licence de distributeur autorisé modifiée est valide jusqu’à la date d’expiration qui y est indiquée ou, si elle est antérieure, jusqu’à la date de sa suspension ou de sa révocation au titre des articles G.02.027 ou G.02.028.
Note marginale :Refus
G.02.017 (1) Le ministre refuse de modifier la licence de distributeur autorisé dans les cas suivants :
a) l’une des opérations pour lesquelles la modification est demandée entraînerait la violation d’une obligation internationale;
b) le distributeur autorisé n’a pas mis en place à l’installation les mesures de sécurité prévues dans la Directive en matière de sécurité à l’égard d’une opération pour laquelle il demande la modification;
c) la méthode visée à l’alinéa G.02.006(1)j) ne permet pas la consignation des renseignements conformément à l’article G.02.071;
d) soit le distributeur autorisé ne s’est pas conformé aux exigences prévues au paragraphe G.02.014(3), soit il s’y est conformé, mais les renseignements ou documents fournis sont insuffisants pour terminer l’examen de la demande de modification;
e) le ministre a des motifs raisonnables de croire que le distributeur autorisé a fourni, dans sa demande de modification ou à l’appui de celle-ci, des renseignements faux ou trompeurs ou des documents faux ou falsifiés;
f) le ministre a des motifs raisonnables de croire que la modification de la licence risquerait vraisemblablement de porter atteinte à la sécurité ou à la santé publiques, notamment en raison du risque de détournement d’une drogue contrôlée vers un marché ou un usage illicites.
Note marginale :Exceptions
(2) Le ministre ne peut, dans le cas visé à l’alinéa (1)e), refuser de modifier la licence si le distributeur autorisé remplit les conditions ci-après, sauf s’il a des motifs raisonnables de croire que le refus est nécessaire pour protéger la sécurité ou la santé publiques, notamment pour prévenir le détournement d’une drogue contrôlée vers un marché ou un usage illicites :
a) le distributeur autorisé n’a pas d’antécédents de contravention à la Loi, à la Loi sur le cannabis ou à leurs règlements;
b) il a soit pris les mesures correctives nécessaires pour veiller à respecter la Loi, la Loi sur le cannabis et leurs règlements, soit signé un engagement à cet effet.
Note marginale :Préavis
(3) Le ministre, avant de refuser de modifier la licence, envoie au distributeur autorisé un préavis motivé l’informant qu’il peut présenter ses observations à cet égard.
Changements exigeant une approbation préalable du ministre
Note marginale :Demande
G.02.018 (1) Le distributeur autorisé doit obtenir l’approbation du ministre, en lui présentant une demande écrite, avant de procéder à l’un des changements suivants :
a) toute modification ayant une incidence sur les mesures de sécurité mises en place à l’installation précisée dans sa licence;
b) le remplacement du responsable principal;
c) le remplacement du responsable qualifié;
d) le remplacement ou l’adjonction de tout responsable qualifié suppléant.
Note marginale :Renseignements et documents
(2) Le distributeur autorisé fournit au ministre, pour tout changement visé au paragraphe (1), ce qui suit :
a) les précisions concernant la modification ayant une incidence sur les mesures de sécurité mises en place à l’installation précisée dans sa licence;
b) s’agissant du responsable principal :
(i) les renseignements visés à l’alinéa G.02.006(1)c),
(ii) la déclaration visée à l’alinéa G.02.006(2)b) et les documents visés aux alinéas G.02.006(2)c) et d);
c) s’agissant du responsable qualifié ou d’un responsable qualifié suppléant :
(i) les renseignements visés à l’alinéa G.02.006(1)d),
(ii) les déclarations visées aux alinéas G.02.006(2)b) et e) ainsi que les documents visés aux alinéas G.02.006(2)c), d) et f).
Note marginale :Renseignements et documents complémentaires
(3) Le distributeur autorisé fournit au ministre, au plus tard à la date précisée dans la demande écrite de celui-ci à cet effet, tout renseignement ou document que le ministre juge nécessaire pour compléter l’examen de la demande d’approbation.
- DORS/2004-238, art. 8
- DORS/2010-222, art. 10
- DORS/2019-171, art. 1
Note marginale :Approbation
G.02.019 (1) Le ministre, au terme de l’examen de la demande d’approbation et sous réserve de l’article G.02.020, approuve le changement.
Note marginale :Conditions
(2) Le ministre peut, lorsqu’il approuve le changement, ajouter toute condition à la licence de distributeur autorisé, en modifier les conditions ou supprimer l’une de celles-ci s’il a des motifs raisonnables de le croire nécessaire pour atteindre l’une des fins suivantes :
a) le respect d’une obligation internationale;
b) la conformité aux exigences associées au niveau de sécurité précisé dans la licence;
c) la réduction d’un risque d’atteinte à la sécurité ou à la santé publiques, notamment le risque de détournement d’une drogue contrôlée vers un marché ou un usage illicites.
- DORS/88-482, art. 2(F)
- DORS/2019-171, art. 1
Note marginale :Refus
G.02.020 (1) Le ministre refuse d’approuver le changement dans les cas suivants :
a) dans les dix années précédant la présentation de la demande d’approbation de changement, le responsable principal, le responsable qualifié ou tout responsable qualifié suppléant proposé a fait l’objet d’une condamnation visée aux sous-alinéas G.02.005a)(i) ou b)(i) ou s’est vu imposer une peine visée aux sous-alinéas G.02.005a)(ii) ou b)(ii);
b) soit le distributeur autorisé ne s’est pas conformé aux exigences prévues au paragraphe G.02.018(3), soit il s’y est conformé, mais les renseignements ou documents fournis sont insuffisants pour terminer l’examen de la demande d’approbation de changement;
c) le ministre a des motifs raisonnables de croire que le distributeur autorisé a fourni, dans sa demande d’approbation de changement ou à l’appui de celle-ci, des renseignements faux ou trompeurs ou des documents faux ou falsifiés;
d) le ministre a des motifs raisonnables de croire que le changement risquerait vraisemblablement de porter atteinte à la sécurité ou à la santé publiques, notamment en raison du risque de détournement d’une drogue contrôlée vers un marché ou un usage illicites.
Note marginale :Exceptions
(2) Le ministre ne peut, dans le cas visé à l’alinéa (1)c), refuser d’approuver le changement si le distributeur autorisé a pris les mesures correctives nécessaires pour veiller à respecter la Loi, la Loi sur le cannabis et leurs règlements ou a signé un engagement à cet effet, sauf s’il a des motifs raisonnables de croire que le refus est nécessaire pour protéger la sécurité ou la santé publiques, notamment pour prévenir le détournement d’une drogue contrôlée vers un marché ou un usage illicites.
Note marginale :Préavis
(3) Le ministre, avant de refuser d’approuver le changement, envoie au distributeur autorisé un préavis motivé l’informant qu’il peut présenter ses observations à cet égard.
Changements exigeant un avis au ministre
Note marginale :Avis préalable
G.02.021 (1) Le distributeur autorisé avise le ministre par écrit avant de faire l’un des changements suivants :
a) la fabrication ou l’assemblage d’un produit ou d’un composé qui ne figure pas sur la plus récente version de la liste visée à l’alinéa G.02.006(1)f) qui a été présentée au ministre;
b) la modification d’un produit ou d’un composé qui figure sur cette liste, si la modification a une incidence sur les renseignements déjà fournis à son égard.
Note marginale :Renseignements et liste
(2) L’avis contient les précisions visées à l’alinéa G.02.006(1)f) qui sont nécessaires pour mettre à jour la liste et est accompagné de la version révisée de celle-ci.
Note marginale :Avis — cinq jours
G.02.022 Le distributeur autorisé avise le ministre par écrit du fait que le responsable qualifié ou tout responsable qualifié suppléant cesse d’exercer cette fonction dans les cinq jours suivant la cessation.
Note marginale :Avis — dix jours
G.02.023 (1) Le distributeur autorisé avise le ministre par écrit de l’un des changements ci-après dans les dix jours suivant celui-ci :
a) le responsable principal visé par sa licence cesse d’exercer cette fonction;
b) le distributeur autorisé cesse de fabriquer ou d’assembler un produit ou un composé qui figure sur la plus récente version de la liste visée à l’alinéa G.02.006(1)f) qui a été présentée au ministre.
Note marginale :Renseignements et liste
(2) L’avis prévu à l’alinéa (1)b) contient les précisions visées à l’alinéa G.02.006(1)f) qui font l’objet du changement et est accompagné de la version révisée de la liste.
Note marginale :Avis — cessation des opérations
G.02.024 (1) Le distributeur autorisé qui entend cesser les opérations à son installation avant l’expiration de sa licence ou à l’expiration de celle-ci en avise le ministre par écrit au moins trente jours avant la cessation.
Note marginale :Contenu de l’avis
(2) L’avis est signé et daté par le responsable principal et contient les renseignements suivants :
a) la date prévue de la cessation des opérations à l’installation;
b) la description de la façon dont le distributeur autorisé disposera de la totalité des drogues contrôlées restant à l’installation à cette date, notamment les précisions suivantes :
(i) dans le cas où elles seront en tout ou en partie vendues ou fournies à un autre distributeur autorisé qui effectuera des opérations à la même installation, le nom de celui-ci,
(ii) dans le cas où elles seront en tout ou en partie vendues ou fournies à un autre distributeur autorisé qui n’effectuera pas d’opérations à la même installation, le nom de celui-ci et l’adresse municipale de son installation,
(iii) dans le cas où elles seront en tout ou en partie détruites, la date de la destruction et l’adresse municipale du lieu de la destruction;
c) l’adresse municipale du lieu où les documents du distributeur autorisé seront conservés après la cessation des opérations;
d) les nom, adresse municipale, numéro de téléphone et, le cas échéant, l’adresse électronique de la personne que le ministre pourra contacter après la cessation des opérations pour obtenir plus amples renseignements.
Note marginale :Mise à jour
(3) Une fois que les opérations ont cessé, le distributeur autorisé présente au ministre une mise à jour détaillée, signée et datée par le responsable principal, des renseignements visés au paragraphe (2), s’ils diffèrent de ceux indiqués sur l’avis.
- DORS/78-220, art. 3
- DORS/85-550, art. 2
- DORS/99-125, art. 2
- DORS/2004-238, art. 9
- DORS/2010-222, art. 11
- DORS/2012-230, art. 9
- DORS/2019-171, art. 1
G.02.024.1 [Abrogé, DORS/2019-171, art. 1]
G.02.024.2 [Abrogé, DORS/2019-171, art. 1]
Changement des conditions de la licence
Note marginale :Ajout ou modification de conditions
G.02.025 (1) Le ministre peut, à un moment autre que celui de la délivrance, du renouvellement ou de la modification de la licence du distributeur autorisé, ajouter toute condition à la licence ou en modifier les conditions s’il a des motifs raisonnables de le croire nécessaire pour atteindre l’une des fins suivantes :
a) le respect d’une obligation internationale;
b) la conformité aux exigences associées au niveau de sécurité précisé dans la licence;
c) la réduction d’un risque d’atteinte à la sécurité ou à la santé publiques, notamment le risque de détournement d’une drogue contrôlée vers un marché ou un usage illicites.
Note marginale :Préavis
(2) Le ministre, avant d’ajouter une condition à la licence ou d’en modifier les conditions, envoie au distributeur autorisé un préavis motivé l’informant qu’il peut présenter ses observations à cet égard.
Note marginale :Urgence
(3) Malgré le paragraphe (2), le ministre peut ajouter toute condition à la licence ou en modifier les conditions sans préavis s’il a des motifs raisonnables de le croire nécessaire pour protéger la sécurité ou la santé publiques, notamment pour prévenir le détournement d’une drogue contrôlée vers un marché ou un usage illicites.
Note marginale :Urgence — avis
(4) L’ajout ou la modification d’une condition en vertu du paragraphe (3) prend effet dès que le ministre envoie au distributeur autorisé un avis à cet égard qui contient les précisions suivantes :
a) les motifs de l’ajout ou de la modification;
b) le fait que le distributeur autorisé a la possibilité de présenter ses observations à cet égard;
c) les mesures correctives à prendre et le délai accordé à cette fin, s’il y a lieu.
- DORS/78-220, art. 4
- DORS/78-427, art. 4
- DORS/85-550, art. 3
- DORS/88-482, art. 3(F)
- DORS/90-261, art. 2(F)
- DORS/97-228, art. 11
- DORS/2004-238, art. 11
- DORS/2010-222, art. 12
- DORS/2012-230, art. 10
- DORS/2014-260, art. 6(A) et 14(F)
- DORS/2019-171, art. 1
Note marginale :Suppression d’une condition
G.02.026 (1) Le ministre peut supprimer toute condition qu’il ne juge plus nécessaire de la licence de distributeur autorisé.
Note marginale :Avis
(2) La suppression prend effet dès que le ministre envoie un avis de suppression au distributeur autorisé.
- DORS/2004-238, art. 12
- DORS/2010-222, art. 13(F)
- DORS/2014-260, art. 7
- DORS/2019-171, art. 1
Suspension et révocation de la licence
Note marginale :Suspension
G.02.027 (1) Le ministre suspend sans préavis la licence d’un distributeur autorisé s’il a des motifs raisonnables de le croire nécessaire pour protéger la sécurité ou la santé publiques, notamment pour prévenir le détournement d’une drogue contrôlée vers un marché ou un usage illicites.
Note marginale :Avis
(2) La suspension prend effet dès que le ministre envoie au distributeur autorisé un avis de suspension qui contient les précisions suivantes :
a) les motifs de la suspension;
b) le fait que le distributeur autorisé a la possibilité de présenter ses observations à cet égard;
c) les mesures correctives à prendre et le délai accordé à cette fin, s’il y a lieu.
Note marginale :Rétablissement de la licence
(3) Le ministre rétablit la licence s’il a des motifs raisonnables de croire que la suspension n’est plus nécessaire.
Note marginale :Révocation
G.02.028 (1) Le ministre, sous réserve du paragraphe (2), révoque la licence de distributeur autorisé dans les cas suivants :
a) le distributeur autorisé ne peut plus demander une licence en vertu de l’article G.02.002;
b) le distributeur autorisé lui en fait la demande ou l’informe de la perte, du vol ou de toute utilisation non autorisée de la licence, que celle-ci soit réelle ou potentielle;
c) le distributeur autorisé cesse ses opérations à son installation avant l’expiration de sa licence;
d) le distributeur autorisé ne prend pas les mesures correctives précisées dans un engagement ou un avis;
e) le distributeur autorisé a contrevenu :
(i) soit à une disposition de la Loi, de la Loi sur le cannabis ou de leurs règlements,
(ii) soit à une condition d’une licence ou d’un permis qui lui a été délivré en vertu d’un règlement pris en vertu de la Loi ou qui lui a été délivré en vertu de la Loi sur le cannabis ou de ses règlements;
f) dans les dix années précédant la révocation, le responsable principal, le responsable qualifié ou tout responsable qualifié suppléant a fait l’objet d’une condamnation visée aux sous-alinéas G.02.005a)(i) ou b)(i) ou s’est vu imposer une peine visée aux sous-alinéas G.02.005a)(ii) ou b)(ii);
g) le ministre a des motifs raisonnables de croire que le distributeur autorisé a fourni, dans toute demande relative à la licence ou à l’appui de celle-ci, des renseignements faux ou trompeurs ou des documents faux ou falsifiés;
h) le ministre a des motifs raisonnables de croire, sur le fondement de renseignements reçus d’une autorité compétente ou de l’Organisation des Nations Unies, que le distributeur autorisé a participé au détournement d’une drogue contrôlée vers un marché ou un usage illicites.
Note marginale :Exceptions
(2) Le ministre ne peut, dans les cas visés aux alinéas (1)e) ou g), révoquer la licence si le distributeur autorisé remplit les conditions ci-après, sauf s’il a des motifs raisonnables de croire que la révocation est nécessaire pour protéger la sécurité ou la santé publiques, notamment pour prévenir le détournement d’une drogue contrôlée vers un marché ou un usage illicites :
a) le distributeur autorisé n’a pas d’antécédents de contravention à la Loi, à la Loi sur le cannabis ou à leurs règlements;
b) il a soit pris les mesures correctives nécessaires pour veiller à respecter la Loi, la Loi sur le cannabis et leurs règlements, soit signé un engagement à cet effet.
Note marginale :Préavis
(3) Le ministre, avant de révoquer la licence, envoie au distributeur autorisé un préavis motivé l’informant qu’il peut présenter ses observations à cet égard.
Note marginale :Retour de la licence
G.02.029 Le distributeur autorisé retourne au ministre l’original de la licence dans les quinze jours suivant la date de prise d’effet de la révocation.
Permis d’importation
Note marginale :Demande
G.02.030 (1) Le distributeur autorisé présente au ministre, pour chaque importation prévue de drogues contrôlées, une demande de permis d’importation qui contient les renseignements suivants :
a) ses nom, adresse municipale et numéro de licence de distributeur autorisé;
b) les précisions ci-après concernant la drogue contrôlée qu’il prévoit d’importer :
(i) son nom, tel qu’il figure sur la licence de distributeur autorisé,
(ii) s’agissant d’un sel, son nom,
(iii) sa quantité,
(iv) s’agissant d’une matière première, son degré de pureté et son contenu anhydre;
c) si la drogue contrôlée est contenue dans un produit qu’il prévoit d’importer, les précisions ci-après concernant ce produit :
(i) sa marque nominative,
(ii) l’identification numérique qui lui a été attribuée aux termes de l’article C.01.014.2, s’il y a lieu,
(iii) la concentration de la drogue contrôlée qu’il contient dans chacune de ses unités, le nombre d’unités contenues dans son emballage et le nombre d’emballages;
d) les nom et adresse municipale, dans le pays d’exportation, de l’exportateur duquel il obtient la drogue contrôlée;
e) le nom du bureau de douane où est prévue l’importation;
f) les modes de transport prévus et chaque pays de transit ou de transbordement prévu.
Note marginale :Signature et attestation
(2) La demande satisfait aux exigences suivantes :
a) elle est signée et datée par le responsable qualifié ou un responsable qualifié suppléant;
b) elle comprend une attestation de celui-ci portant qu’à sa connaissance, tous les renseignements fournis à l’appui de la demande sont exacts et complets.
Note marginale :Renseignements et documents complémentaires
(3) Le distributeur autorisé fournit au ministre, au plus tard à la date précisée dans la demande écrite de celui-ci à cet effet, tout renseignement ou document que le ministre juge nécessaire pour compléter l’examen de la demande de permis d’importation.
Note marginale :Délivrance
G.02.031 Le ministre, au terme de l’examen de la demande de permis d’importation et sous réserve de l’article G.02.034, délivre au distributeur autorisé un permis d’importation qui contient les renseignements suivants :
a) le numéro du permis;
b) les renseignements visés au paragraphe G.02.030(1);
c) la date de prise d’effet du permis;
d) la date d’expiration du permis, qui correspond à celle des dates ci-après qui est antérieure aux autres :
(i) la date précisée par le ministre, qui ne peut être postérieure au cent quatre-vingtième jour suivant sa date de prise d’effet,
(ii) la date d’expiration de la licence du distributeur autorisé;
e) toute condition que le ministre estime nécessaire, sur le fondement de motifs raisonnables, pour atteindre l’une des fins suivantes :
(i) le respect d’une obligation internationale,
(ii) la réduction d’un risque d’atteinte à la sécurité ou à la santé publiques, notamment le risque de détournement d’une drogue contrôlée vers un marché ou un usage illicites.
Note marginale :Validité
G.02.032 Le permis d’importation est valide jusqu’à celle des dates ci-après qui est antérieure aux autres :
a) la date d’expiration qui y est indiquée;
b) la date de sa suspension ou de sa révocation au titre des articles G.02.037 ou G.02.038;
c) la date de suspension ou de révocation, au titre des articles G.02.027 ou G.02.028, de la licence du distributeur autorisé;
d) la date de suspension ou de révocation du permis d’exportation délivré par l’autorité compétente du pays d’exportation à l’égard de la drogue contrôlée à importer.
Note marginale :Retour du permis
G.02.033 Le distributeur autorisé dont le permis d’importation expire retourne l’original de celui-ci au ministre dans les quinze jours suivant la date d’expiration.
Note marginale :Refus
G.02.034 (1) Le ministre refuse de délivrer un permis d’importation dans les cas suivants :
a) la licence du distributeur autorisé ne l’autorise pas à importer la drogue contrôlée visée ou elle expirera avant la date d’importation;
b) le ministre a des motifs raisonnables de croire que l’importation entraînerait la violation d’une obligation internationale;
c) le distributeur autorisé n’a pas mis en place à l’installation les mesures de sécurité prévues dans la Directive en matière de sécurité à l’égard de l’importation;
d) soit le distributeur autorisé ne s’est pas conformé aux exigences prévues au paragraphe G.02.030(3), soit il s’y est conformé, mais les renseignements ou documents fournis sont insuffisants pour terminer l’examen de la demande de permis;
e) le ministre a des motifs raisonnables de croire que le distributeur autorisé a fourni, dans sa demande de permis ou à l’appui de celle-ci, des renseignements faux ou trompeurs ou des documents faux ou falsifiés;
f) le distributeur autorisé a été avisé que la demande de renouvellement de sa licence de distributeur autorisé ou la demande de modification de celle-ci sera refusée;
g) le ministre a des motifs raisonnables de croire que l’importation contreviendrait aux règles de droit du pays d’exportation, de tout pays de transit ou de tout pays de transbordement;
h) le ministre a des motifs raisonnables de croire que la délivrance du permis risquerait vraisemblablement de porter atteinte à la sécurité ou à la santé publiques, notamment en raison du risque de détournement d’une drogue contrôlée vers un marché ou un usage illicites.
Note marginale :Préavis
(2) Le ministre, avant de refuser de délivrer le permis d’importation, envoie au distributeur autorisé un préavis motivé l’informant qu’il peut présenter ses observations à cet égard.
Note marginale :Production d’une copie du permis
G.02.035 Le titulaire du permis d’importation en produit une copie au bureau de douane lors de l’importation.
Note marginale :Déclaration
G.02.036 Le titulaire du permis d’importation fournit au ministre, dans les quinze jours suivant la date du dédouanement de la drogue contrôlée visée par le permis conformément à la Loi sur les douanes, une déclaration comprenant les renseignements suivants :
a) son nom ainsi que les numéros de sa licence de distributeur autorisé et de son permis d’importation relatifs à la drogue contrôlée;
b) les précisions ci-après concernant la drogue contrôlée :
(i) son nom, tel qu’il figure sur la licence de distributeur autorisé,
(ii) s’agissant d’un sel, son nom,
(iii) sa quantité;
c) si la drogue contrôlée est contenue dans un produit qu’il a importé, les précisions ci-après concernant ce produit :
(i) sa marque nominative,
(ii) l’identification numérique qui lui a été attribuée aux termes de l’article C.01.014.2, s’il y a lieu,
(iii) la concentration de la drogue contrôlée qu’il contient dans chacune de ses unités, le nombre d’unités par emballage et le nombre d’emballages;
d) le nom du bureau de douane où a eu lieu le dédouanement et la date de celui-ci.
Note marginale :Suspension
G.02.037 (1) Le ministre suspend sans préavis le permis d’importation dans les cas suivants :
a) la licence du distributeur autorisé est suspendue;
b) il a des motifs raisonnables de le croire nécessaire pour protéger la sécurité ou la santé publiques, notamment pour prévenir le détournement d’une drogue contrôlée vers un marché ou un usage illicites;
c) l’importation contreviendrait aux règles de droit du pays d’exportation, de tout pays de transit ou de tout pays de transbordement.
Note marginale :Avis
(2) La suspension prend effet dès que le ministre envoie au distributeur autorisé un avis de suspension qui contient les précisions suivantes :
a) les motifs de la suspension;
b) le fait que le distributeur autorisé a la possibilité de présenter ses observations à cet égard;
c) les mesures correctives à prendre et le délai accordé à cette fin, s’il y a lieu.
Note marginale :Rétablissement du permis
(3) Le ministre rétablit le permis d’importation s’il a des motifs raisonnables de croire que la suspension n’est plus nécessaire.
Note marginale :Révocation
G.02.038 (1) Le ministre, sous réserve du paragraphe (2), révoque le permis d’importation dans les cas suivants :
a) le distributeur autorisé lui en fait la demande ou l’informe de la perte, du vol ou de toute utilisation non autorisée du permis, que celle-ci soit réelle ou potentielle;
b) le distributeur autorisé ne prend pas les mesures correctives précisées par le ministre en vertu de l’alinéa G.02.037(2)c) dans le délai imparti;
c) le distributeur autorisé a contrevenu à une condition de son permis;
d) le ministre a des motifs raisonnables de croire que le distributeur autorisé a fourni, dans sa demande de permis ou à l’appui de celle-ci, des renseignements faux ou trompeurs ou des documents faux ou falsifiés;
e) le ministre a des motifs raisonnables de croire, sur le fondement de renseignements reçus d’une autorité compétente ou de l’Organisation des Nations Unies, que le distributeur autorisé a participé au détournement d’une drogue contrôlée vers un marché ou un usage illicites;
f) la licence du distributeur autorisé a été révoquée.
Note marginale :Exceptions
(2) Le ministre ne peut, dans les cas visés aux alinéas (1)d) ou G.02.028(1)e) ou g), révoquer le permis d’importation si le distributeur autorisé remplit les conditions ci-après, sauf s’il a des motifs raisonnables de croire que la révocation est nécessaire pour protéger la sécurité ou la santé publiques, notamment pour prévenir le détournement d’une drogue contrôlée vers un marché ou un usage illicites :
a) le distributeur autorisé n’a pas d’antécédents de contravention à la Loi, à la Loi sur le cannabis ou à leurs règlements;
b) il a soit pris les mesures correctives nécessaires pour veiller à respecter la Loi, la Loi sur le cannabis et leurs règlements, soit signé un engagement à cet effet.
Note marginale :Préavis
(3) Le ministre, avant de révoquer le permis d’importation, envoie au distributeur autorisé un préavis motivé l’informant qu’il peut présenter ses observations à cet égard.
Note marginale :Retour du permis
G.02.039 Le distributeur autorisé retourne au ministre l’original du permis d’importation dans les quinze jours suivant la date de prise d’effet de la révocation.
Permis d’exportation
Note marginale :Demande
G.02.040 (1) Le distributeur autorisé présente au ministre, pour chaque exportation prévue de drogues contrôlées, une demande de permis d’exportation qui contient les renseignements et documents suivants :
a) ses nom, adresse municipale et numéro de licence de distributeur autorisé;
b) les précisions ci-après concernant la drogue contrôlée qu’il prévoit d’exporter :
(i) son nom, tel qu’il figure sur la licence de distributeur autorisé,
(ii) s’agissant d’un sel, son nom,
(iii) sa quantité,
(iv) s’agissant d’une matière première, son degré de pureté et son contenu anhydre;
c) si la drogue contrôlée est contenue dans un produit qu’il prévoit d’exporter, les précisions ci-après concernant ce produit :
(i) sa marque nominative,
(ii) l’identification numérique qui lui a été attribuée aux termes de l’article C.01.014.2, s’il y a lieu,
(iii) la concentration de la drogue contrôlée qu’il contient dans chacune de ses unités, le nombre d’unités par emballage et le nombre d’emballages;
d) les nom et adresse municipale, dans le pays de destination finale, de l’importateur;
e) le nom du bureau de douane où est prévue l’exportation;
f) les modes de transport prévus et chaque pays de transit ou de transbordement prévu;
g) une copie du permis d’importation délivré par l’autorité compétente du pays de destination finale précisant le nom de l’importateur et l’adresse municipale de son installation située dans ce pays.
Note marginale :Signature et attestation
(2) La demande satisfait aux exigences suivantes :
a) elle est signée et datée par le responsable qualifié ou un responsable qualifié suppléant;
b) elle comprend une attestation de celui-ci portant sur les faits suivants :
(i) à sa connaissance, l’exportation prévue ne contrevient à aucune règle de droit du pays de destination finale, de tout pays de transit ou de tout pays de transbordement,
(ii) à sa connaissance, tous les renseignements et documents fournis à l’appui de la demande sont exacts et complets.
Note marginale :Renseignements et documents complémentaires
(3) Le distributeur autorisé fournit au ministre, au plus tard à la date précisée dans la demande écrite de celui-ci à cet effet, tout renseignement ou document que le ministre juge nécessaire pour compléter l’examen de la demande de permis d’exportation.
Note marginale :Délivrance
G.02.041 Le ministre, au terme de l’examen de la demande de permis d’exportation et sous réserve de l’article G.02.044, délivre au distributeur autorisé un permis d’exportation qui contient les renseignements suivants :
a) le numéro du permis;
b) les renseignements visés aux alinéas G.02.040(1)a) à f);
c) la date de prise d’effet du permis;
d) la date d’expiration du permis, qui correspond à celle des dates ci-après qui est antérieure aux autres :
(i) la date précisée par le ministre, qui ne peut être postérieure au cent quatre-vingtième jour suivant sa date de prise d’effet,
(ii) la date d’expiration de la licence du distributeur autorisé,
(iii) la date d’expiration du permis d’importation délivré par l’autorité compétente du pays de destination finale;
e) toute condition que le ministre estime nécessaire, sur le fondement de motifs raisonnables, pour atteindre l’une des fins suivantes :
(i) le respect d’une obligation internationale,
(ii) la réduction d’un risque d’atteinte à la sécurité ou à la santé publiques, notamment le risque de détournement d’une drogue contrôlée vers un marché ou un usage illicites.
Note marginale :Validité
G.02.042 Le permis d’exportation est valide jusqu’à celle des dates ci-après qui est antérieure aux autres :
a) la date d’expiration qui y est indiquée;
b) la date de sa suspension ou de sa révocation au titre des articles G.02.047 ou G.02.048;
c) la date de suspension ou de révocation, au titre des articles G.02.027 ou G.02.028, de la licence du distributeur autorisé;
d) la date d’expiration, de suspension ou de révocation du permis d’importation délivré par l’autorité compétente du pays de destination finale à l’égard de la drogue contrôlée à exporter.
Note marginale :Retour du permis
G.02.043 Le distributeur autorisé dont le permis d’exportation expire retourne l’original de celui-ci au ministre dans les quinze jours suivant la date d’expiration.
Note marginale :Refus
G.02.044 (1) Le ministre refuse de délivrer un permis d’exportation dans les cas suivants :
a) la licence du distributeur autorisé ne l’autorise pas à exporter la drogue contrôlée visée ou elle expirera avant la date d’exportation;
b) le ministre a des motifs raisonnables de croire que l’exportation entraînerait la violation d’une obligation internationale;
c) soit le distributeur autorisé ne s’est pas conformé aux exigences prévues au paragraphe G.02.040(3), soit il s’y est conformé, mais les renseignements ou documents fournis sont insuffisants pour terminer l’examen de la demande de permis;
d) le ministre a des motifs raisonnables de croire que le distributeur autorisé a fourni, dans sa demande de permis ou à l’appui de celle-ci, des renseignements faux ou trompeurs ou des documents faux ou falsifiés;
e) le distributeur autorisé a été avisé que la demande de renouvellement de sa licence de distributeur autorisé ou la demande de modification de celle-ci sera refusée;
f) le ministre a des motifs raisonnables de croire que l’exportation ne serait pas conforme au permis d’importation délivré par l’autorité compétente du pays de destination finale;
g) le ministre a des motifs raisonnables de croire que l’exportation contreviendrait aux règles de droit du pays de destination finale, de tout pays de transit ou de tout pays de transbordement;
h) le ministre a des motifs raisonnables de croire que la délivrance du permis risquerait vraisemblablement de porter atteinte à la sécurité ou à la santé publiques, notamment en raison du risque de détournement d’une drogue contrôlée vers un marché ou un usage illicites.
Note marginale :Préavis
(2) Le ministre, avant de refuser de délivrer le permis d’exportation, envoie au distributeur autorisé un préavis motivé l’informant qu’il peut présenter ses observations à cet égard.
Note marginale :Production d’une copie du permis
G.02.045 Le titulaire du permis d’exportation en produit une copie au bureau de douane lors de l’exportation.
Note marginale :Déclaration
G.02.046 Le titulaire du permis d’exportation fournit au ministre, dans les quinze jours suivant la date d’exportation de la drogue contrôlée visée par le permis, une déclaration comprenant les renseignements suivants :
a) son nom ainsi que les numéros de sa licence de distributeur autorisé et du permis d’exportation relatifs à la drogue contrôlée;
b) les précisions ci-après concernant la drogue contrôlée :
(i) son nom, tel qu’il figure sur la licence de distributeur autorisé,
(ii) s’agissant d’un sel, son nom,
(iii) sa quantité;
c) si la drogue contrôlée est contenue dans un produit qu’il a exporté, les précisions ci-après concernant ce produit :
(i) sa marque nominative,
(ii) l’identification numérique qui lui a été attribuée aux termes de l’article C.01.014.2, s’il y a lieu,
(iii) la concentration de la drogue contrôlée qu’il contient dans chacune de ses unités, le nombre d’unités par emballage et le nombre d’emballages;
d) le nom du bureau de douane où a eu lieu l’exportation et la date de celle-ci.
Note marginale :Suspension
G.02.047 (1) Le ministre suspend sans préavis le permis d’exportation dans les cas suivants :
a) la licence du distributeur autorisé est suspendue;
b) il a des motifs raisonnables de le croire nécessaire pour protéger la sécurité ou la santé publiques, notamment pour prévenir le détournement d’une drogue contrôlée vers un marché ou un usage illicites;
c) l’exportation contreviendrait aux règles de droit du pays de destination finale, de tout pays de transit ou de tout pays de transbordement.
Note marginale :Avis
(2) La suspension prend effet dès que le ministre envoie au distributeur autorisé un avis de suspension qui contient les précisions suivantes :
a) les motifs de la suspension;
b) le fait que le distributeur autorisé a la possibilité de présenter ses observations à cet égard;
c) les mesures correctives à prendre et le délai accordé à cette fin, s’il y a lieu.
Note marginale :Rétablissement du permis
(3) Le ministre rétablit le permis d’exportation s’il a des motifs raisonnables de croire que la suspension n’est plus nécessaire.
Note marginale :Révocation
G.02.048 (1) Le ministre, sous réserve du paragraphe (2), révoque le permis d’exportation dans les cas suivants :
a) le distributeur autorisé lui en fait la demande ou l’informe de la perte, du vol ou de toute utilisation non autorisée du permis, que celle-ci soit réelle ou potentielle;
b) le distributeur autorisé ne prend pas les mesures correctives précisées par le ministre en vertu de l’alinéa G.02.047(2)c) dans le délai imparti;
c) le distributeur autorisé a contrevenu à une condition de son permis;
d) le ministre a des motifs raisonnables de croire que le distributeur autorisé a fourni, dans sa demande de permis ou à l’appui de celle-ci, des renseignements faux ou trompeurs ou des documents faux ou falsifiés;
e) le ministre a des motifs raisonnables de croire, sur le fondement de renseignements reçus d’une autorité compétente ou de l’Organisation des Nations Unies, que le distributeur autorisé a participé au détournement d’une drogue contrôlée vers un marché ou un usage illicites;
f) la licence du distributeur autorisé a été révoquée.
Note marginale :Exceptions
(2) Le ministre ne peut, dans les cas visés aux alinéas (1)d) ou G.02.028(1)e) ou g), révoquer le permis d’exportation si le distributeur autorisé remplit les conditions ci-après, sauf s’il a des motifs raisonnables de croire que la révocation est nécessaire pour protéger la sécurité ou la santé publiques, notamment pour prévenir le détournement d’une drogue contrôlée vers un marché ou un usage illicites :
a) le distributeur autorisé n’a pas d’antécédents de contravention à la Loi, à la Loi sur le cannabis ou à leurs règlements;
b) il a soit pris les mesures correctives nécessaires pour veiller à respecter la Loi, la Loi sur le cannabis et leurs règlements, soit signé un engagement à cet effet.
Note marginale :Préavis
(3) Le ministre, avant de révoquer le permis d’exportation, envoie au distributeur autorisé un préavis motivé l’informant qu’il peut présenter ses observations à cet égard.
Note marginale :Retour du permis
G.02.049 Le distributeur autorisé retourne au ministre l’original du permis d’exportation dans les quinze jours suivant la date de prise d’effet de la révocation.
Identification
Note marginale :Nom
G.02.050 Le distributeur autorisé veille à ce que son nom, tel qu’il apparaît sur sa licence, figure sur tout ce qu’il utilise pour s’identifier lors de ses opérations à l’égard des drogues contrôlées, notamment les étiquettes, les bons de commande, les documents d’expédition, les factures et les publicités.
Vente de drogues contrôlées
Note marginale :Vente à un autre distributeur autorisé
G.02.051 Le distributeur autorisé peut vendre ou fournir une drogue contrôlée à un autre distributeur autorisé.
Note marginale :Vente à un pharmacien
G.02.052 (1) Le distributeur autorisé peut, sous réserve du paragraphe (2), vendre ou fournir une drogue contrôlée à un pharmacien.
Note marginale :Exception — pharmacien nommé dans un avis
(2) Le distributeur autorisé ne peut vendre ou fournir à un pharmacien nommé dans un avis donné conformément à l’article G.03.017.2 les drogues contrôlées visées par l’avis, sauf s’il reçoit l’avis de rétractation visé à l’article G.03.017.3.
Note marginale :Vente à un praticien
G.02.053 (1) Le distributeur autorisé peut, sous réserve du paragraphe (2), vendre ou fournir une drogue contrôlée à un praticien.
Note marginale :Exceptions — praticien nommé dans un avis
(2) Le distributeur autorisé ne peut vendre ou fournir à un praticien nommé dans un avis donné conformément à l’article G.04.004.2 les drogues contrôlées visées par l’avis, sauf s’il reçoit l’avis de rétractation visé à l’article G.04.004.3.
Note marginale :Fourniture à un employé d’un hôpital
G.02.054 Le distributeur autorisé peut fournir une drogue contrôlée à l’employé d’un hôpital.
Note marginale :Vente à une personne exemptée
G.02.055 Le distributeur autorisé peut vendre ou fournir une drogue contrôlée à une personne qui bénéficie d’une exemption relative à la possession de cette drogue et accordée en vertu de l’article 56 de la Loi.
Note marginale :Vente au ministre
G.02.056 Le distributeur autorisé peut vendre ou fournir une drogue contrôlée au ministre.
Note marginale :Commande écrite
G.02.057 Le distributeur autorisé peut vendre ou fournir une drogue contrôlée en vertu des articles G.02.051 à G.02.055 si les conditions ci-après sont remplies :
a) il reçoit une commande écrite qui précise le nom et la quantité de la drogue contrôlée commandée et qui est signée et datée conformément à ce qui suit :
(i) si la drogue contrôlée doit être fournie à un employé d’un hôpital ou à un praticien exerçant dans un hôpital, par le pharmacien responsable de la pharmacie de l’hôpital ou par un praticien autorisé à signer la commande par le responsable de l’hôpital,
(ii) dans tout autre cas, par la personne à qui est vendue ou fournie la drogue contrôlée;
b) il vérifie la signature s’il ne la reconnaît pas.
Note marginale :Commande verbale
G.02.058 (1) Le distributeur autorisé peut vendre ou fournir une drogue contrôlée mentionnée aux parties II ou III de l’annexe de la présente partie si les conditions ci-après sont remplies :
a) il reçoit une commande verbale qui précise le nom et la quantité de la drogue contrôlée commandée;
b) si la drogue contrôlée doit être fournie à un employé d’un hôpital ou à un praticien exerçant dans un hôpital, la commande a été faite par le pharmacien responsable de la pharmacie de l’hôpital ou par un praticien autorisé à faire la commande par le responsable de l’hôpital.
Note marginale :Reçu
(2) Le distributeur autorisé qui reçoit une commande verbale d’un pharmacien ou d’un praticien doit obtenir, dans les cinq jours ouvrables suivant l’exécution de la commande, un reçu qu’il conserve et qui satisfait aux exigences suivantes :
a) il est signé par le pharmacien ou le praticien qui a reçu la drogue contrôlée;
b) il précise la date de la réception de la drogue contrôlée par celui-ci;
c) il précise le nom ainsi que la quantité de la drogue contrôlée.
Note marginale :Interdiction de vente ultérieure sans reçu
(3) Le distributeur autorisé qui n’obtient pas le reçu dans les cinq jours ouvrables ne peut, à la réception d’une autre commande verbale du pharmacien ou du praticien, lui vendre ou fournir une autre drogue contrôlée jusqu’à ce qu’il obtienne ce reçu.
Note marginale :Ventes multiples prévues
G.02.059 (1) Le distributeur autorisé peut vendre ou fournir une drogue contrôlée plus d’une fois à l’égard de la même commande si la commande précise les renseignements suivants :
a) le nombre de ventes ou de fournitures, celui-ci ne dépassant pas quatre;
b) la quantité précise pour chaque vente ou fourniture;
c) les intervalles entre chacune d’elles.
Note marginale :Ventes multiples — quantité disponible insuffisante
(2) Le distributeur autorisé qui, lorsqu’il reçoit la commande, ne dispose pas temporairement de toute la quantité de la drogue contrôlée demandée peut vendre ou fournir la quantité de la drogue dont il dispose alors et livrer le reste par la suite.
Emballage et transport
Note marginale :Emballage — vente et fourniture
G.02.060 (1) Le distributeur autorisé qui vend ou fournit une drogue contrôlée l’emballe solidement dans un contenant immédiat qui est scellé de telle manière qu’il est impossible de l’ouvrir sans briser le sceau.
Note marginale :Emballage — transport et exportation
(2) Le distributeur autorisé qui transporte ou exporte une drogue contrôlée veille à ce que son emballage soit scellé de telle manière qu’il est impossible de l’ouvrir sans briser le sceau.
Note marginale :Exception
(3) Le paragraphe (1) ne s’applique pas au nécessaire d’essai qui contient une drogue contrôlée et auquel un numéro d’enregistrement a été attribué.
Note marginale :Transport
G.02.061 (1) Le distributeur autorisé qui prend livraison d’une drogue contrôlée qu’il a importée ou qui fait la livraison d’une drogue contrôlée satisfait aux exigences suivantes :
a) il prend les mesures nécessaires pour veiller à la sécurité de la drogue contrôlée durant son transport;
b) il utilise un moyen de transport qui permet, sous réserve du paragraphe (2), de consigner fidèlement toute manutention de la drogue contrôlée ainsi que la signature de toute personne ayant effectué cette manutention pendant la durée du transport, jusqu’à sa livraison au destinataire;
c) s’agissant d’une drogue contrôlée importée, il la transporte, après son dédouanement en vertu de la Loi sur les douanes, directement à l’installation précisée dans sa licence;
d) s’agissant d’une drogue contrôlée qui doit être exportée, il la transporte directement de l’installation précisée dans sa licence au bureau de douane d’où la drogue sera exportée.
Note marginale :Exception
(2) Le distributeur autorisé peut faire transporter une préparation par un voiturier public.
Pertes, vols et transactions douteuses
Note marginale :Mesures de protection
G.02.062 Le distributeur autorisé prend toute mesure nécessaire pour veiller à la sécurité des drogues contrôlées, des licences et des permis qui sont en sa possession.
Note marginale :Pertes et vols — licences et permis
G.02.063 Le distributeur autorisé qui prend connaissance de la perte ou du vol de sa licence ou de son permis fournit un rapport écrit au ministre dans les soixante-douze heures suivantes.
Note marginale :Pertes inexplicables et vols — drogues contrôlées
G.02.064 Le distributeur autorisé qui prend connaissance d’une perte de drogues contrôlées ne pouvant pas s’expliquer dans le cadre des pratiques d’opération normalement acceptées ou d’un vol de drogues contrôlées se conforme aux exigences suivantes :
a) il fournit un rapport écrit à un membre d’un corps policier dans les vingt-quatre heures suivantes;
b) il fournit un rapport écrit au ministre dans les soixante-douze heures suivantes et lui confirme que le rapport prévu à l’alinéa a) a été fourni.
Note marginale :Transactions douteuses
G.02.065 (1) Le distributeur autorisé qui prend connaissance d’une transaction effectuée au cours de ses opérations à l’égard de laquelle il a des motifs raisonnables de soupçonner qu’elle pourrait être liée au détournement d’une drogue contrôlée vers un marché ou un usage illicites fournit au ministre, au plus tard soixante-douze heures après en avoir pris connaissance, un rapport écrit contenant les renseignements suivants :
a) ses nom, adresse municipale et numéro de téléphone ainsi que, si le distributeur autorisé est une personne morale, le poste de l’individu ayant fait le rapport;
b) les nom et adresse municipale de l’autre partie à la transaction;
c) les détails de la transaction, notamment ses date et heure, son type, le nom de la drogue contrôlée, la quantité en cause et, s’agissant d’un produit ou d’un composé, la quantité de toute drogue contrôlée qu’il contient;
d) exception faite d’un nécessaire d’essai, l’identification numérique qui a été attribuée au produit contenant la drogue contrôlée aux termes de l’article C.01.014.2, s’il y a lieu;
e) une description détaillée des motifs de ses soupçons.
Note marginale :Bonne foi
(2) Le distributeur autorisé ne peut faire l’objet d’une poursuite civile pour avoir fourni ce rapport de bonne foi.
Note marginale :Non-divulgation
(3) Le distributeur autorisé ne peut, dans l’intention de nuire à une enquête criminelle en cours ou à venir, révéler qu’il a fourni le rapport ou en dévoiler les détails.
Note marginale :Protection partielle contre l’auto-incrimination
G.02.066 Ni le rapport fourni en application de l’un des articles G.02.063 à G.02.065 ni aucune preuve qui en provient ne peuvent être utilisés ou admis pour incriminer le distributeur autorisé dans le cadre de poursuites criminelles intentées contre lui, sauf s’il s’agit de poursuites intentées en vertu des articles 132, 136 ou 137 du Code criminel.
Destruction de drogues contrôlées
Note marginale :Destruction à l’installation
G.02.067 Le distributeur autorisé qui prévoit de détruire une drogue contrôlée à l’installation précisée dans sa licence veille à ce que les conditions ci-après soient remplies :
a) il obtient au préalable l’approbation du ministre;
b) la destruction est effectuée en présence de deux personnes parmi les suivantes, dont au moins une est visée au sous-alinéa (i) :
(i) le responsable principal, le responsable qualifié ou tout responsable qualifié suppléant,
(ii) une personne qui travaille pour le distributeur autorisé ou qui lui fournit des services et qui occupe un poste de niveau supérieur;
c) la destruction est effectuée selon une méthode conforme à la législation fédérale, provinciale et municipale sur la protection de l’environnement applicable au lieu de destruction;
d) dès la destruction terminée, la personne qui l’a effectuée et les deux personnes visées à l’alinéa b) qui étaient présentes font une déclaration commune signée et datée qui atteste que la drogue contrôlée a été complètement détruite, chaque signataire ajoutant à la déclaration son nom en lettres moulées.
Note marginale :Destruction ailleurs qu’à l’installation
G.02.068 Le distributeur autorisé qui prévoit de détruire une drogue contrôlée ailleurs qu’à l’installation précisée dans sa licence veille à ce que les conditions ci-après soient remplies :
a) il obtient au préalable l’approbation du ministre;
b) il prend les mesures nécessaires pour veiller à la sécurité de la drogue contrôlée durant son transport afin de prévenir le détournement de celle-ci vers un marché ou un usage illicites;
c) la destruction est effectuée par une personne travaillant pour une entreprise spécialisée dans la destruction de marchandises dangereuses et en présence d’une autre personne travaillant pour cette entreprise;
d) la destruction est effectuée selon une méthode conforme à la législation fédérale, provinciale et municipale sur la protection de l’environnement applicable au lieu de destruction;
e) dès la destruction terminée, la personne qui l’a effectuée fournit au distributeur autorisé une déclaration datée qui atteste que la drogue contrôlée a été complètement détruite et qui contient les renseignements suivants :
(i) l’adresse municipale du lieu où la destruction a été effectuée,
(ii) le nom et la quantité de la drogue contrôlée et, le cas échéant, la marque nominative et la quantité du produit qui en contenait ou le nom et la quantité du composé qui en contenait,
(iii) la méthode de destruction,
(iv) la date de la destruction,
(v) les nom en lettres moulées et signature de cette personne ainsi que de l’autre personne présente lors de la destruction.
Note marginale :Demande d’approbation préalable
G.02.069 (1) Le distributeur autorisé présente au ministre une demande qui contient les renseignements ci-après afin d’obtenir une approbation préalable à la destruction d’une drogue contrôlée :
a) ses nom, adresse municipale et numéro de licence de distributeur autorisé;
b) la date prévue de la destruction;
c) l’adresse municipale du lieu où la destruction sera effectuée;
d) une brève description de la méthode de destruction;
e) si la destruction doit être effectuée à l’installation précisée dans sa licence, le nom des personnes proposées pour l’application de l’alinéa G.02.067b) et des renseignements établissant que celles-ci remplissent les conditions visées à cet alinéa;
f) le nom de la drogue contrôlée et, le cas échéant, la marque nominative du produit qui en contient ou le nom du composé qui en contient;
g) la forme et la quantité soit de la drogue contrôlée, soit du produit ou du composé qui en contient et, le cas échéant, la concentration de la drogue contenue dans chaque unité, le nombre d’unités par emballage et le nombre d’emballages.
Note marginale :Signature et attestation
(2) La demande satisfait aux exigences suivantes :
a) elle est signée et datée par le responsable qualifié ou tout responsable qualifié suppléant;
b) elle comprend une attestation de celui-ci portant sur les faits suivants :
(i) la méthode de destruction prévue est conforme à la législation fédérale, provinciale et municipale sur la protection de l’environnement applicable au lieu de destruction,
(ii) à sa connaissance, tous les renseignements et documents fournis à l’appui de la demande sont exacts et complets.
Note marginale :Renseignements et documents complémentaires
(3) Le distributeur autorisé fournit au ministre, au plus tard à la date précisée dans la demande écrite de celui-ci à cet effet, tout renseignement ou document que le ministre juge nécessaire pour compléter l’examen de la demande d’approbation.
Note marginale :Approbation
G.02.070 Le ministre, au terme de l’examen de la demande d’approbation, approuve la destruction de la drogue contrôlée, sauf dans les cas suivants :
a) si la destruction doit être effectuée à l’installation précisée dans la licence du distributeur autorisé, les personnes proposées pour l’application de l’alinéa G.02.067b) ne remplissent pas les conditions visées à cet alinéa;
b) le ministre a des motifs raisonnables de croire que la drogue contrôlée ne serait pas détruite;
c) le ministre a des motifs raisonnables de croire que le distributeur autorisé a fourni, dans sa demande d’approbation ou à l’appui de celle-ci, des renseignements faux ou trompeurs ou des documents faux ou falsifiés;
d) la drogue contrôlée est, en tout ou en partie, nécessaire dans le cadre d’une enquête criminelle, administrative ou préliminaire, d’un procès ou d’une autre procédure engagée sous le régime d’une loi ou de ses règlements;
e) le ministre a des motifs raisonnables de croire que l’approbation risquerait vraisemblablement de porter atteinte à la sécurité ou à la santé publiques, notamment en raison du risque de détournement de la drogue contrôlée vers un marché ou un usage illicites.
Documents
Note marginale :Méthode de consignation
G.02.071 Le distributeur autorisé qui consigne des renseignements en application de la présente partie le fait selon une méthode qui en permet la vérification à tout moment.
Note marginale :Renseignements généraux
G.02.072 Le distributeur autorisé consigne les renseignements suivants :
a) le nom, la forme et la quantité de toute drogue contrôlée qu’il commande, le nom de la personne qui fait la commande pour son compte et la date de la commande;
b) le nom, la forme et la quantité de toute drogue contrôlée qu’il reçoit ainsi que les nom et adresse municipale de la personne qui la lui a vendue ou fournie et la date de réception;
c) s’agissant d’une drogue contrôlée qu’il vend ou fournit, les précisions ci-après la concernant :
(i) la marque nominative du produit ou le nom du composé contenant la drogue contrôlée et le nom de celle-ci,
(ii) l’identification numérique qui a été attribuée au produit aux termes de l’article C.01.014.2, s’il y a lieu,
(iii) la forme et la quantité de la drogue contrôlée et, le cas échéant, la concentration de la drogue contenue dans chaque unité, le nombre d’unités par emballage et le nombre d’emballages,
(iv) les nom et adresse municipale de la personne à laquelle il l’a vendue ou fournie,
(v) la date de la vente ou de la fourniture;
d) le nom, la forme et la quantité de toute drogue contrôlée qu’il fabrique ou assemble ainsi que sa date d’entreposage et, le cas échéant, la concentration de la drogue contenue dans chaque unité, le nombre d’unités par emballage et le nombre d’emballages;
e) d’une part, le nom et la quantité de toute drogue contrôlée qu’il utilise dans la fabrication ou l’assemblage d’un produit ou d’un composé et, d’autre part, la marque nominative et la quantité de ce produit ou le nom et la quantité de ce composé ainsi que la date d’entreposage;
f) le nom, la forme et la quantité de toute drogue contrôlée entreposée à la fin de chaque mois;
g) le nom, la forme et la quantité de toute drogue contrôlée qu’il livre, transporte ou expédie, les nom et adresse municipale du destinataire ainsi que la date de la livraison, du transport ou de l’expédition;
h) le nom, la forme et la quantité de toute drogue contrôlée qu’il importe, la date de l’importation, les nom et adresse municipale de l’exportateur ainsi que le nom du pays d’exportation et de tout pays de transit ou de transbordement;
i) le nom, la forme et la quantité de toute drogue contrôlée qu’il exporte, la date de l’exportation, les noms et adresse municipale de l’importateur ainsi que le nom du pays de destination finale et de tout pays de transit ou de transbordement.
Note marginale :Commandes verbales
G.02.073 Le distributeur autorisé qui reçoit une commande verbale pour une drogue contrôlée mentionnée aux parties II ou III de l’annexe de la présente partie et qui vend ou fournit cette drogue à un pharmacien, à un praticien ou à un employé d’un hôpital consigne immédiatement les renseignements suivants :
a) le nom de la personne qui a fait la commande;
b) la date à laquelle il a reçu la commande;
c) le nom de la personne qui consigne la commande.
Note marginale :Pertes explicables de drogues contrôlées
G.02.074 Le distributeur autorisé qui prend connaissance d’une perte de drogues contrôlées pouvant s’expliquer dans le cadre des pratiques d’opération normalement acceptées consigne les renseignements suivants :
a) le nom de chaque drogue contrôlée perdue et, le cas échéant, la marque nominative du produit ou le nom du composé qui en contenait;
b) la forme et la quantité de cette drogue contrôlée et, le cas échéant, la forme du produit ou du composé qui en contenait, la concentration de la drogue contrôlée contenue dans chaque unité, le nombre d’unités par emballage et le nombre d’emballages;
c) la date à laquelle il a pris connaissance de la perte;
d) l’explication de la perte.
Note marginale :Destruction
G.02.075 Le distributeur autorisé consigne les renseignements ci-après concernant toute drogue contrôlée qu’il a détruite à l’installation précisée dans sa licence :
a) l’adresse municipale du lieu où la destruction a été effectuée;
b) le nom, la forme et la quantité de la drogue contrôlée et, le cas échéant, la marque nominative et la quantité du produit qui en contenait ou le nom et la quantité du composé qui en contenait;
c) la méthode de destruction;
d) la date de la destruction.
Note marginale :Rapport annuel
G.02.076 (1) Le distributeur autorisé fournit au ministre, sous réserve des paragraphes (2) et (3), un rapport annuel contenant les renseignements ci-après dans les trois mois suivant la fin de chaque année civile :
a) le nom, la forme et la quantité totale de chaque drogue contrôlée qu’il a reçue, produite, vendue, fournie, importée, exportée ou détruite au cours de l’année civile ainsi que le nom et la quantité totale de chaque drogue contrôlée utilisée pour la fabrication ou l’assemblage d’un produit ou d’un composé;
b) le nom, la forme et la quantité de chaque drogue contrôlée selon l’inventaire physique établi à la fin de l’année civile à l’installation précisée dans la licence;
c) le nom, la forme et la quantité de chaque drogue contrôlée perdue ou volée lors des opérations effectuées au cours de l’année civile.
Note marginale :Non-renouvellement ou révocation dans les trois premiers mois
(2) Le distributeur autorisé dont la licence expire sans être renouvelée ou est révoquée dans les trois premiers mois d’une année civile fournit au ministre les rapports ci-après dans les délais suivants :
a) dans les trois mois suivant la fin de l’année civile précédente, le rapport annuel pour celle-ci;
b) dans les trois mois suivant l’expiration ou la révocation, un rapport pour la période de l’année civile courante durant laquelle la licence était valide contenant les renseignements visés au paragraphe (1), la quantité devant être évaluée selon l’inventaire physique établi à la date d’expiration ou de révocation.
Note marginale :Non-renouvellement ou révocation après le troisième mois
(3) Le distributeur autorisé dont la licence expire sans être renouvelée ou est révoquée après le troisième mois d’une année civile fournit au ministre, dans les trois mois suivant l’expiration ou la révocation, un rapport pour la période de l’année civile durant lesquels la licence était valide contenant les renseignements visés au paragraphe (1), la quantité devant être évaluée selon l’inventaire physique établi à la date d’expiration ou de révocation.
Note marginale :Période de conservation
G.02.077 Le distributeur autorisé et l’ancien titulaire d’une licence de distributeur autorisé conservent tout document comprenant les renseignements consignés en application de la présente partie, notamment chaque déclaration ainsi qu’une copie de chaque rapport, pendant une période de deux ans suivant la date de la dernière consignation et selon une méthode qui permet la vérification du document à tout moment.
Note marginale :Lieu
G.02.078 Les documents sont conservés aux lieux suivants :
a) s’agissant d’un distributeur autorisé, à l’installation précisée dans sa licence;
b) s’agissant d’un ancien distributeur autorisé, en un lieu au Canada.
Note marginale :Caractéristiques des documents
G.02.079 Les documents sont complets ainsi que facilement accessibles et les renseignements qui y figurent sont lisibles et indélébiles.
TITRE 3Pharmaciens
- DORS/2019-171, art. 2(F)
Consignation de drogues contrôlées reçues
- DORS/2019-171, art. 2
Note marginale :Renseignements généraux
G.03.001 (1) Sur réception d’une drogue contrôlée provenant d’un distributeur autorisé ou d’un autre pharmacien, le pharmacien consigne le nom et la quantité de la drogue contrôlée reçue, les nom et adresse de celui qui la lui a vendue ou fournie et la date de réception.
Note marginale :Dossier
(2) Les renseignements visés au paragraphe (1) doivent être conservés
a) de manière à en permettre la vérification; et
b) sous réserve du paragraphe (3), dans un cahier, un registre ou un autre dossier semblable réservé exclusivement aux drogues contrôlées.
Note marginale :Exception
(3) Les renseignements visés au paragraphe (1) peuvent, dans le cas d’une drogue contrôlée mentionnée aux parties II ou III de l’annexe de la présente partie, être conservés sous une forme autre que celle précisée à l’alinéa (2)b).
- DORS/78-427, art. 5
- DORS/85-550, art. 4
- DORS/86-91, art. 2(F)
- DORS/90-261, art. 3(F)
- DORS/97-228, art. 12
- DORS/2004-238, art. 13
- DORS/2010-222, art. 14(A)
Vente de drogues contrôlées
- DORS/2019-171, art. 3
Note marginale :Interdiction de vente sans ordonnance
G.03.002 Il est interdit à tout pharmacien, sous réserve des autres dispositions de la présente partie, de vendre ou de fournir une drogue contrôlée à qui que ce soit, à moins d’avoir reçu au préalable une ordonnance à cet effet et d’avoir pris à son égard les mesures suivantes :
a) si l’ordonnance est écrite, s’assurer qu’elle est signée et datée par le praticien dont elle émane et vérifier lui-même toute signature qu’il ne connaît pas;
b) si l’ordonnance est verbale, prendre les précautions raisonnables pour s’assurer que la personne la prescrivant est bien un praticien.
- DORS/2004-238, art. 14
Note marginale :Interdiction — pharmacien ou praticien nommé dans un avis
G.03.002.1 Sous réserve de l’article G.03.002.2 et nonobstant les articles G.03.002, G.03.003 et G.03.005, il est interdit à un pharmacien de
a) vendre ou fournir une drogue contrôlée, autre qu’une préparation, à un pharmacien nommé dans un avis communiqué par le ministre selon l’article G.03.017.2;
b) vendre ou fournir une préparation à un pharmacien nommé dans un avis communiqué par le ministre selon l’article G.03.017.2;
c) dispenser, vendre ou fournir une drogue contrôlée autre qu’une préparation, soit à un praticien, soit en vertu d’une ordonnance ou d’une commande faite par un praticien nommé dans un avis communiqué par le ministre en application de l’article G.04.004.2;
d) dispenser, vendre ou fournir une préparation soit à un praticien, soit en vertu d’une ordonnance ou d’une commande faite par un praticien nommé dans un avis communiqué par le ministre en application de l’article G.04.004.2.
- DORS/2003-135, art. 7 et 8
- DORS/2004-238, art. 15
- DORS/2019-171, art. 4(F)
Note marginale :Exception — avis de rétractation
G.03.002.2 L’article G.03.002.1 ne s’applique pas au pharmacien auquel le ministre a donné un avis de rétractation de l’avis :
a) selon l’article G.03.017.3, à l’égard de tout pharmacien nommé dans un avis donné par le ministre selon l’article G.03.017.2;
b) selon l’article G.04.004.3, à l’égard de tout praticien nommé dans un avis donné par le ministre selon l’article G.04.004.2.
- DORS/2003-135, art. 4
Note marginale :Vente à un praticien — commande
G.03.003 (1) Le pharmacien peut vendre ou fournir une drogue contrôlée à un praticien pour l’usage de sa pratique professionnelle dans l’une des circonstances suivantes :
a) sur réception d’une commande écrite, signée et datée par le praticien, pourvu qu’il vérifie la signature du praticien si elle lui est inconnue;
b) sur réception d’une commande verbale, précisant le nom et la quantité de la drogue, s’il prend les moyens raisonnables pour s’assurer que la personne qui fait la commande est un praticien.
(2) [Abrogé, DORS/2019-171, art. 5]
- DORS/85-550, art. 5
- DORS/2004-238, art. 16
- DORS/2012-230, art. 11
- DORS/2019-171, art. 5
Note marginale :Registre des ordonnances
G.03.004 Tout pharmacien doit, à l’égard des drogues contrôlées vendues ou fournies à un praticien en vertu de l’article G.03.003, tenir un registre spécial des ordonnances, où seront consignés la date de l’ordonnance, les nom et adresse du praticien et la nature et la quantité de la drogue contrôlée vendue ou fournie.
- DORS/2004-238, art. 17
Note marginale :Fourniture à un hôpital
G.03.005 Le pharmacien peut, à la réception d’une commande écrite datée et signée par le pharmacien responsable de la pharmacie d’un l’hôpital ou par un praticien autorisé à signer la commande par le responsable de l’hôpital, fournir une drogue contrôlée à l’employé d’un hôpital ou à un praticien exerçant dans l’hôpital si le pharmacien reconnaît la signature du pharmacien responsable ou du praticien ou, dans le cas contraire, qu’il l’a vérifiée.
- DORS/85-550, art. 6
- DORS/2004-238, art. 18(A)
- DORS/2019-171, art. 6
Note marginale :Renouvellement de l’ordonnance
G.03.006 Il est interdit à un pharmacien de remplir de nouveau une ordonnance pour une drogue contrôlée, à moins
a) que le praticien, au moment où il l’a prescrite, n’ait indiqué, par écrit dans le cas d’une drogue contrôlée mentionnée à la partie I de l’annexe de la présente partie, et par écrit ou verbalement dans le cas d’une drogue contrôlée mentionnée aux parties II ou III de cette annexe, que cette ordonnance est renouvelable pour un certain nombre de fois à des dates ou des intervalles précis;
b) que le pharmacien ne consigne au registre chaque renouvellement d’une ordonnance.
- DORS/78-427, art. 6
- DORS/97-228, art. 13
Dossiers
Note marginale :Commandes et ordonnances écrites
G.03.007 Le pharmacien qui, conformément à une commande ou à une ordonnance écrites, dispense une drogue contrôlée mentionnée à la partie I de l’annexe de la présente partie, autre qu’une préparation, consigne immédiatement les renseignements ci-après dans un cahier, un registre ou un autre dossier réservé à cette fin :
a) ses nom ou initiales;
b) les nom, initiales et adresse municipale du praticien qui a fait la commande ou l’ordonnance;
c) les nom et adresse municipale de la personne nommée dans la commande ou l’ordonnance;
d) le nom, la forme et la quantité de la drogue contrôlée;
e) la date à laquelle il dispense la drogue;
f) le numéro attribué à la commande ou l’ordonnance.
- DORS/78-427, art. 7
- DORS/81-359, art. 1(F)
- DORS/97-228, art. 14
- DORS/2004-238, art. 19
- DORS/2019-171, art. 7
Note marginale :Commandes et ordonnances verbales
G.03.008 Le pharmacien consigne les renseignements ci-après dans un document écrit avant de dispenser une drogue contrôlée conformément à une commande ou une ordonnance verbales :
a) ses nom ou initiales;
b) les nom, initiales et adresse municipale du praticien qui a fait la commande ou l’ordonnance;
c) les nom et adresse municipale de la personne nommée dans l’ordonnance;
d) le nom, la forme et la quantité de la drogue contrôlée;
e) le mode d’emploi indiqué dans la commande ou l’ordonnance;
f) la date à laquelle il dispense la drogue contrôlée;
g) le numéro attribué à la commande ou à l’ordonnance.
- DORS/85-550, art. 7
- DORS/2004-238, art. 20
- DORS/2019-171, art. 7
Note marginale :Classement par ordre chronologique et numérique
G.03.009 Le pharmacien tient un dossier spécial pour les ordonnances de drogues contrôlées dans lequel sont conservées, par ordre chronologique et numérique, chaque commande et ordonnance écrites relativement aux drogues contrôlées qu’il a dispensées ainsi que chaque document écrit comprenant les renseignements consignés relativement aux drogues contrôlées qu’il a dispensées conformément à une commande ou à une ordonnance verbales.
Note marginale :Période de conservation
G.03.010 Tout pharmacien doit conserver en sa possession durant au moins deux ans, tous les dossiers et registres dont la tenue est exigée par la présente partie.
Obligations générales du pharmacien
- DORS/2019-171, art. 8
Note marginale :Fourniture de renseignements et assistance à l’inspecteur
G.03.011 Tout pharmacien doit
a) fournir tout renseignement relatif aux transactions dudit pharmacien à l’égard de toute drogue contrôlée, dans la manière et au moment que peut fixer le ministre;
b) présenter à un inspecteur, sur demande, son registre spécial des ordonnances, ainsi que tout autre cahier, registre ou document qu’il est obligé de tenir;
c) permettre à l’inspecteur de prendre copie ou de noter des extraits de tous lesdits cahiers, registres, dossiers ou documents; et
d) permettre à l’inspecteur de vérifier tous les stocks de drogues contrôlées dans son établissement.
Note marginale :Pertes et vols — mesures de protection
G.03.012 Le pharmacien doit prendre toutes les mesures raisonnables qui sont nécessaires pour protéger contre la perte et le vol les drogues contrôlées qui se trouvent dans son établissement ou dont il a la garde.
- DORS/85-550, art. 8
Note marginale :Pertes et vols — avis
G.03.013 Tout pharmacien doit signaler au ministre toute perte ou tout vol d’une drogue contrôlée, 10 jours au plus après en avoir fait la découverte.
Retour, vente et transfert
- DORS/2019-171, art. 9
Note marginale :Commandes écrites
G.03.014 Le pharmacien peut, lorsqu’il reçoit une commande écrite pour une drogue contrôlée, signée et datée
a) par le distributeur autorisé qui lui a vendu ou fourni la drogue, lui retourner cette drogue;
b) par un autre pharmacien, lui vendre ou lui fournir la quantité de drogue demandée pour une urgence;
c) par le ministre, lui vendre ou lui fournir la quantité de drogue, précisée dans la commande, dont il a besoin dans l’exercice de ses fonctions;
d) par une personne qui bénéficie d’une exemption relative à cette drogue et accordée en vertu de l’article 56 de la Loi, lui vendre ou lui fournir la quantité précisée dans la commande.
- DORS/81-359, art. 2
- DORS/85-550, art. 9
- DORS/99-125, art. 3
- DORS/2004-238, art. 21
- DORS/2014-260, art. 8(A)
- DORS/2018-69, art. 65
- DORS/2019-171, art. 10
Note marginale :Dossier
G.03.015 Le pharmacien, immédiatement après avoir reçu, vendu ou fourni une drogue contrôlée conformément aux alinéas G.03.014b) ou c) ou au paragraphe G.05.003(4), consigne les détails de la transaction dans un cahier, un registre ou tout autre dossier approprié.
- DORS/85-550, art. 10
- DORS/2004-238, art. 22
Note marginale :Avis au ministre
G.03.016 Un pharmacien doit, immédiatement après avoir retiré, transporté ou transféré une drogue contrôlée de son établissement d’affaires à tout autre établissement d’affaires exploité par lui-même, avertir le ministre en précisant les détails.
Renseignements fournis par le ministre aux autorités attributives de licences
Note marginale :Contraventions par le pharmacien
G.03.017 Le ministre fournit par écrit les renseignements factuels sur un pharmacien qui ont été obtenus sous le régime de la Loi ou de la présente partie à une autorité provinciale attributive de licences en matière d’activités professionnelles qui est responsable d’autoriser les personnes à exercer leur profession dans les cas suivants :
a) s’agissant de l’autorité d’une province où le pharmacien est ou était autorisé à exercer :
(i) soit l’autorité soumet au ministre une demande écrite qui précise les nom et adresse du pharmacien, la nature des renseignements demandés et une déclaration portant que les renseignements sont nécessaires pour l’aider à mener une enquête licite,
(ii) soit le ministre a des motifs raisonnables de croire à l’existence de l’un des faits ci-après concernant le pharmacien :
(A) il a contrevenu à une règle de conduite établie par l’autorité,
(B) il a été condamné pour une infraction désignée,
(C) il a contrevenu à la présente partie;
b) s’agissant de l’autorité d’une province où le pharmacien n’est pas autorisé à exercer, l’autorité soumet au ministre les documents suivants :
(i) une demande écrite qui précise les nom et adresse du pharmacien ainsi que la nature des renseignements demandés,
(ii) un document qui démontre :
(A) soit que le pharmacien a demandé à l’autorité l’autorisation d’exercer dans cette province,
(B) soit que l’autorité a des motifs raisonnables de croire que le pharmacien exerce dans cette province sans autorisation.
- DORS/86-881, art. 1
- DORS/97-228, art. 15
- DORS/2003-135, art. 5
- DORS/2010-222, art. 15
- DORS/2019-171, art. 11
Avis d’interdiction de vente
Note marginale :Demande du pharmacien
G.03.017.1 Tout pharmacien peut demander par écrit au ministre d’envoyer aux personnes et aux autorités visées au paragraphe G.03.017.2(3) un avis, émis conformément à l’article G.03.017.2, les informant que ne doivent pas lui être vendu ou fourni toute drogue contrôlée autre qu’une préparation, toute préparation, ou les deux.
- DORS/2003-135, art. 5
Note marginale :Avis par le ministre
G.03.017.2 (1) Le ministre envoie, dans les cas prévus au paragraphe (2), un avis aux destinataires visés au paragraphe (3) les informant que les pharmaciens qui exercent dans les pharmacies ayant reçu l’avis et les distributeurs autorisés ne peuvent pas vendre ou fournir de drogues contrôlées autres que des préparations ou de préparations au pharmacien nommé dans l’avis.
Note marginale :Cas exigeant l’avis
(2) Les cas exigeant l’avis sont les suivants :
a) le pharmacien nommé dans l’avis en fait la demande au ministre en vertu de l’article G.03.017.1;
b) il a contrevenu à une règle de conduite établie par l’autorité provinciale attributive de licences en matière d’activités professionnelles de la province où il exerce et l’autorité a demandé au ministre par écrit d’envoyer l’avis;
c) il a été condamné pour une infraction désignée ou pour une contravention au présent règlement.
Note marginale :Destinataires
(3) Les destinataires de l’avis sont les suivants :
a) tous les distributeurs autorisés;
b) les pharmacies de la province où le pharmacien nommé dans l’avis, d’une part, est autorisé en vertu des lois de celle-ci à exercer sa profession et, d’autre part, l’y exerce;
c) l’autorité provinciale attributive de licences en matière d’activités professionnelles de la province où le pharmacien nommé dans l’avis est autorisé à exercer;
d) les pharmacies d’une province adjacente qui pourraient exécuter une commande faite par le pharmacien nommé dans l’avis;
e) l’autorité provinciale attributive de licences en matière d’activités professionnelles d’une autre province qui en a fait la demande par écrit au ministre.
Note marginale :Autres cas
(4) Le ministre peut envoyer l’avis visé au paragraphe (1) au destinataire visé au paragraphe (3) s’il a pris les mesures prévues au paragraphe (5) et s’il a des motifs raisonnables de croire que le pharmacien nommé dans l’avis se trouve dans l’un des cas suivants :
a) il a contrevenu à une disposition de la Loi ou du présent règlement;
b) il s’est administré à plus d’une reprise une drogue contrôlée autre qu’une préparation obtenue d’une façon non conforme aux pratiques pharmaceutiques reconnues;
c) il s’est administré à plus d’une reprise une préparation obtenue d’une façon non conforme aux pratiques pharmaceutiques reconnues;
d) il a, à plus d’une reprise, fourni ou administré une drogue contrôlée autre qu’une préparation à son époux ou conjoint de fait, à son père, à sa mère ou à son enfant, y compris un enfant adopté de fait, d’une façon non conforme aux pratiques pharmaceutiques reconnues;
e) il a, à plus d’une reprise, il a fourni ou administré une préparation à son époux ou conjoint de fait, à son père, à sa mère ou à son enfant, y compris un enfant adopté de fait, d’une façon non conforme aux pratiques pharmaceutiques reconnues;
f) il est dans l’impossibilité de rendre compte de la quantité d’une drogue contrôlée dont il avait la responsabilité en application de la présente partie.
Note marginale :Mesures préalables
(5) Les mesures que le ministre doit prendre avant d’envoyer un avis sont les suivantes :
a) consulter l’autorité provinciale attributive de licences en matière d’activités professionnelles de la province où le pharmacien est autorisé à exercer;
b) donner au pharmacien l’occasion de présenter ses observations à cet égard;
c) prendre en considération les éléments suivants :
(i) les antécédents du pharmacien quant au respect de la Loi et de ses règlements,
(ii) la question de savoir si la conduite du pharmacien représente un risque d’atteinte à la santé ou à la sécurité publiques, notamment un risque de détournement de la drogue contrôlée vers un marché ou un usage illicites.
- DORS/2003-135, art. 5
- DORS/2010-222, art. 16 et 35(F)
- DORS/2019-171, art. 12
Note marginale :Avis de rétractation
G.03.017.3 Le ministre envoie à tous les destinataires d’un avis visé au paragraphe G.03.017.2(1) un avis de rétractation de l’avis d’interdiction si les exigences ci-après sont respectées, selon le cas :
a) dans le cas visé à l’alinéa G.03.017.2(2)a), les conditions prévues aux sous-alinéas b)(i) et (ii) sont remplies et il s’est écoulé un an depuis l’envoi de l’avis d’interdiction;
b) dans les cas visés aux alinéas G.03.017.2(2)b) et c) et (4)a) à f), le pharmacien nommé dans l’avis a satisfait aux exigences suivantes :
(i) il lui a demandé par écrit d’envoyer un avis de rétractation de l’avis,
(ii) il lui a fourni une lettre de l’autorité provinciale attributive de licences en matière d’activités professionnelles de la province où il est autorisé à exercer, dans laquelle l’autorité accepte la rétractation de l’avis d’interdiction.
- DORS/2003-135, art. 5
- DORS/2010-222, art. 17
- DORS/2019-171, art. 12
G.03.017.4 et G.03.017.5 [Abrogés, DORS/2003-135, art. 5]
TITRE 4Praticiens
Administration de drogues désignées et autres drogues contrôlées
Note marginale :Restriction
G.04.001 (1) Le praticien ne peut, sous réserve des paragraphes (2) et (3) ainsi que d’une exemption relative à l’administration de la drogue contrôlée que l’exemption précise et accordée en vertu de l’article 56 de la Loi, administrer une drogue contrôlée à une personne ou à un animal.
Note marginale :Conditions
(2) Le praticien peut administrer à une personne ou à un animal une drogue contrôlée, autre qu’une drogue désignée, si les conditions ci-après sont remplies :
a) le praticien traite la personne ou l’animal à titre professionnel;
b) la drogue contrôlée est nécessaire pour traiter l’état de la personne ou de l’animal.
Note marginale :Fins visées
(3) Le médecin, le dentiste, le vétérinaire ou l’infirmier praticien peut administrer une drogue désignée à une personne ou à un animal qu’il traite à titre professionnel si la drogue est destinée au traitement de l’un des états suivants :
a) s’agissant d’une personne :
(i) la narcolepsie,
(ii) les troubles hypercinétiques chez l’enfant,
(iii) l’épilepsie,
(iv) le syndrome parkinsonien,
(v) l’hypotension liée à l’anesthésie;
b) s’agissant d’un animal, la dépression des centres cardiaques et respiratoires.
Note marginale :Définitions
(4) Les définitions qui suivent s’appliquent au présent article.
- administrer
administrer Est assimilé au fait d’administrer une drogue celui de la prescrire, de la vendre ou de la fournir. (administer)
- drogue désignée
drogue désignée S’entend des drogues contrôlées suivantes :
a) amphétamine et ses sels;
b) benzphétamine et ses sels;
c) méthamphétamine et ses sels;
d) phenmétrazine et ses sels;
e) phendimétrazine et ses sels. (designated drug)
- DORS/99-125, art. 4
- DORS/2004-238, art. 23
- DORS/2012-230, art. 12
- DORS/2019-171, art. 13
Documents
Note marginale :Registre des drogues contrôlées vendues et fournies
G.04.002 (1) Tout praticien qui vend ou fournit à une personne une drogue contrôlée qu’elle s’administrera à elle-même ou qu’elle administrera à un animal, qu’il la facture ou non, consigne le nom et la quantité de la drogue contrôlée vendue ou fournie, les nom et adresse de la personne à laquelle elle l’a été et la date de la transaction, s’il s’agit d’une quantité :
a) supérieure à trois fois la dose quotidienne maximale recommandée par le fabricant ou l’assembleur de cette drogue contrôlée;
b) supérieure à trois fois la dose thérapeutique quotidienne maximale généralement admise pour cette drogue contrôlée, si le fabricant ou l’assembleur n’a pas spécifié de dose quotidienne maximale.
Note marginale :Accessibilité au registre
(2) Tout praticien qui est requis, par le présent article, de tenir un registre doit garder le registre en un endroit et le tenir sous une forme et d’une manière qui permettent à un inspecteur de l’examiner et d’y trouver des renseignements avec facilité.
- DORS/88-482, art. 4(F)
- DORS/2004-238, art. 24
- DORS/2019-171, art. 14
Obligations générales du praticien
- DORS/2019-171, art. 15
Note marginale :Exigences
G.04.002A Tout praticien doit
a) fournir au ministre, sur demande, tout renseignement concernant
(i) l’usage que ce praticien fait des drogues contrôlées qu’il reçoit — y compris les cas où il les administre, les vend ou les fournit à une personne,
(ii) les ordonnances de drogues contrôlées que délivre ce praticien,
selon que peut l’exiger le ministre;
b) présenter à un inspecteur, sur demande, tout registre que ce praticien est requis de tenir en vertu du présent règlement;
c) permettre à un inspecteur de prendre copie de ces registres ou de noter des extraits desdits registres;
d) permettre à un inspecteur de vérifier tous les stocks de drogues contrôlées dans les locaux de ce praticien;
e) conserver en sa possession durant au moins deux ans tout registre qu’il est requis de tenir en vertu du présent règlement;
f) prendre les mesures appropriées pour protéger les drogues contrôlées qu’il a en sa possession contre la perte ou le vol; et
g) signaler au ministre tout vol ou perte d’une drogue contrôlée au plus tard 10 jours après avoir constaté un tel vol ou une telle perte.
- DORS/2004-238, art. 25
G.04.003 [Abrogé, DORS/2010-222, art. 18]
Renseignements fournis par le ministre aux autorités attributives de licences
Note marginale :Contraventions par le praticien
G.04.004 Le ministre fournit par écrit les renseignements factuels sur un praticien qui ont été obtenus sous le régime de la Loi ou de la présente partie à une autorité provinciale attributive de licences en matière d’activités professionnelles qui est responsable d’inscrire les personnes et de les autoriser à exercer leur profession dans les cas suivants :
a) s’agissant de l’autorité d’une province où le praticien est ou était inscrit et autorisé à exercer :
(i) soit l’autorité soumet au ministre une demande écrite qui précise les nom et adresse du praticien, la nature des renseignements demandés et une déclaration portant que les renseignements sont nécessaires pour l’aider à mener une enquête licite,
(ii) soit le ministre a des motifs raisonnables de croire à l’existence de l’un des faits ci-après concernant le praticien :
(A) il a contrevenu à une règle de conduite établie par l’autorité,
(B) il a été condamné pour une infraction désignée,
(C) il a contrevenu à la présente partie;
b) s’agissant de l’autorité d’une province où le praticien n’est pas inscrit ni autorisé à exercer, l’autorité soumet au ministre les documents suivants :
(i) une demande écrite qui précise les nom et adresse du praticien ainsi que la nature des renseignements demandés,
(ii) un document qui démontre :
(A) soit que le praticien a demandé à cette autorité l’autorisation d’exercer dans cette province,
(B) soit que cette autorité a des motifs raisonnables de croire que le praticien exerce dans cette province sans autorisation.
- DORS/86-881, art. 2
- DORS/97-228, art. 17
- DORS/2003-135, art. 6
- DORS/2010-222, art. 19
- DORS/2019-171, art. 16
Avis d’interdiction de vente
Note marginale :Demande du praticien
G.04.004.1 Tout praticien peut demander par écrit au ministre d’envoyer aux pharmacies et aux distributeurs autorisés un avis, émis conformément à l’article G.04.004.2, les informant de tout ou partie des exigences suivantes :
a) aucune drogue contrôlée, autre qu’une préparation, ne doit lui être vendue ou fournie par un destinataire de cet avis;
b) aucune préparation ne doit lui être vendue ou fournie par un destinataire de cet avis;
c) aucune de ses ordonnances ou commandes de drogue contrôlée, autre qu’une préparation, ne doit être remplie par des pharmaciens exerçant dans les pharmacies ayant reçu l’avis;
d) aucune de ses ordonnances ou commandes de préparation ne doit être remplie par des pharmaciens exerçant dans les pharmacies ayant reçu l’avis.
- DORS/2003-135, art. 6
Note marginale :Avis par le ministre
G.04.004.2 (1) Le ministre envoie, dans les cas prévus au paragraphe (2), l’un des avis ci-après aux destinataires visés au paragraphe (3) :
a) soit que les pharmaciens qui exercent dans les pharmacies ayant reçu l’avis et les distributeurs autorisés ne peuvent pas vendre ou fournir de drogues contrôlées autres que des préparations ou de préparations au praticien nommé dans l’avis;
b) soit que les pharmaciens qui exercent dans les pharmacies ayant reçu l’avis ne peuvent pas exécuter les commandes ou les ordonnances de drogues contrôlées autres que des préparations ou de préparations faites par le praticien nommé dans l’avis;
c) soit que les interdictions prévues aux alinéas a) et b) s’appliquent concurremment relativement au praticien nommé dans l’avis.
Note marginale :Cas exigeant l’avis
(2) Les cas exigeant l’avis sont les suivants :
a) le praticien nommé dans l’avis en fait la demande au ministre en vertu de l’article G.04.004.1;
b) il a contrevenu à une règle de conduite établie par l’autorité provinciale attributive de licences en matière d’activités professionnelles de la province où il exerce et l’autorité a demandé au ministre par écrit d’envoyer l’avis;
c) il a été condamné pour une infraction désignée ou pour une contravention à la présente partie.
Note marginale :Destinataires
(3) Les destinataires de l’avis sont les suivants :
a) tous les distributeurs autorisés;
b) les pharmacies de la province où le praticien nommé dans l’avis, d’une part, est inscrit et autorisé en vertu des lois de celle-ci à exercer sa profession et, d’autre part, l’y exerce;
c) l’autorité provinciale attributive de licences en matière d’activités professionnelles de la province où le praticien nommé dans l’avis est inscrit et autorisé à exercer;
d) les pharmacies d’une province adjacente qui pourraient exécuter une commande ou une ordonnance faites par le praticien nommé dans l’avis;
e) l’autorité provinciale attributive de licences en matière d’activités professionnelles d’une autre province qui en a fait la demande par écrit au ministre.
Note marginale :Autres cas
(4) Le ministre peut envoyer l’avis visé au paragraphe (1) au destinataire visé au paragraphe (3) s’il a pris les mesures prévues au paragraphe (5) et s’il a des motifs raisonnables de croire que le praticien nommé dans l’avis se trouve dans l’un des cas suivants :
a) il a contrevenu à une disposition de la Loi ou du présent règlement;
b) il s’est administré à plus d’une reprise une drogue contrôlée, autre qu’une préparation, obtenue sur commande ou ordonnance faites par lui ou, à défaut de commande ou d’ordonnance, d’une façon non conforme aux pratiques professionnelles reconnues;
c) il s’est administré à plus d’une reprise une préparation obtenue sur commande ou ordonnance faites par lui ou, à défaut de commande ou d’ordonnance, d’une façon non conforme aux pratiques professionnelles reconnues;
d) il a, à plus d’une reprise, fait une ordonnance pour une drogue contrôlée autre qu’une préparation, l’a fournie ou l’a administrée à son époux ou conjoint de fait, à son père, à sa mère ou à son enfant, y compris un enfant adopté de fait, d’une façon non conforme aux pratiques professionnelles reconnues;
e) il a, à plus d’une reprise, fait une ordonnance pour une préparation, l’a fournie ou l’a administrée à son époux ou conjoint de fait, à son père, à sa mère ou à son enfant, y compris un enfant adopté de fait, d’une façon non conforme aux pratiques professionnelles reconnues;
f) il est dans l’impossibilité de rendre compte de la quantité d’une drogue contrôlée dont avait la responsabilité en application de la présente partie.
Note marginale :Mesures préalables
(5) Les mesures que le ministre doit prendre avant d’envoyer un avis sont les suivantes :
a) consulter l’autorité provinciale attributive de licences en matière d’activités professionnelles de la province où le praticien est inscrit et autorisé à exercer;
b) donner au praticien l’occasion de présenter ses observations à cet égard;
c) prendre en considération les éléments suivants :
(i) les antécédents du praticien quant au respect de la Loi et de ses règlements,
(ii) la question de savoir si la conduite du praticien représente un risque d’atteinte à la santé ou à la sécurité publiques, notamment un risque de détournement de la drogue contrôlée vers un marché ou un usage illicites.
- DORS/2003-135, art. 6
- DORS/2010-222, art. 20 et 35(F)
- DORS/2019-171, art. 17
Note marginale :Avis de rétractation
G.04.004.3 Le ministre envoie à tous les destinataires d’un avis visé au paragraphe G.04.004.2(1) un avis de rétractation de l’avis d’interdiction si les exigences ci-après sont respectées, selon le cas :
a) dans le cas visé à l’alinéa G.04.004.2(2)a), les conditions prévues aux sous-alinéas b)(i) et (ii) sont remplies et il s’est écoulé un an depuis l’envoi de l’avis d’interdiction;
b) dans les cas visés aux alinéas G.04.004.2(2)b) et c) et (4)a) à f), le praticien nommé dans l’avis satisfait aux exigences suivantes :
(i) il lui a demandé par écrit d’envoyer un avis de rétractation de l’avis,
(ii) il lui a fourni une lettre de l’autorité provinciale attributive de licences en matière d’activités professionnelles de la province où il est inscrit et autorisé à exercer, dans laquelle l’autorité accepte la rétractation de l’avis d’interdiction.
- DORS/88-482, art. 5(F)
- DORS/2003-135, art. 6
- DORS/2010-222, art. 21
- DORS/2019-171, art. 17
G.04.004.4 et G.04.004.5 [Abrogés, DORS/2003-135, art. 6]
TITRE 5Hôpitaux
Note marginale :Registre des drogues contrôlées
G.05.001 (1) Le responsable d’un hôpital doit tenir ou faire tenir un registre indiquant les renseignements suivants :
a) le nom et la quantité de toute drogue contrôlée reçue, au nom de l’hôpital, par un employé de cet hôpital ou un praticien exerçant dans cet hôpital;
b) le nom et l’adresse du fournisseur, ainsi que la date de réception;
c) le nom et la quantité de toute drogue contrôlée employée dans la fabrication ou l’assemblage d’un produit ou d’un composé qui contient cette drogue, le nom et la quantité du produit ou du composé fabriqué ou assemblé et la date à laquelle ce produit ou ce composé a été stocké;
c.1) le nom et la quantité de toute drogue contrôlée produite et la date à laquelle elle a été stockée;
d) le nom du malade pour lequel cette drogue a été dispensée;
e) le nom du praticien qui la commande ou la prescrit; et
f) la date à laquelle une drogue contrôlée est commandée ou prescrite, ainsi que la forme et la quantité concernées.
Note marginale :Tenue du registre
(2) Sous réserve des paragraphes (3) et (4), le registre visé au paragraphe (1) doit :
a) être tenu de façon à en permettre la vérification;
b) se présenter sous forme de cahier, de livre ou d’un autre document semblable réservé aux drogues contrôlées;
c) être conservé pendant au moins deux ans.
Note marginale :Exception — préparations
(3) Dans le cas d’une préparation, un registre autre que celui décrit à l’alinéa (2)b) peut être utilisé pour l’inscription des renseignements visés aux alinéas (1)d) à f).
Note marginale :Exception — parties II ou III de l’annexe
(4) Les renseignements visés au paragraphe (1) peuvent, dans le cas d’une drogue contrôlée mentionnée aux parties II ou III de l’annexe de la présente partie, être conservés sous une forme autre que celle précisée à l’alinéa (2)b).
- DORS/78-427, art. 8
- DORS/85-550, art. 11
- DORS/88-482, art. 6
- DORS/97-228, art. 18
- DORS/2004-238, art. 27
- DORS/2019-171, art. 18(F)
Note marginale :Fourniture de renseignements et assistance à l’inspecteur
G.05.002 Le responsable d’un hôpital doit
a) fournir tout renseignement relatif à l’emploi des drogues contrôlées dans ledit hôpital, dans la forme et au moment que peut fixer le ministre;
b) présenter à un inspecteur tous les cahiers, dossiers, registres ou documents que le présent règlement exige de tenir;
c) permettre à un inspecteur de prendre copie ou de noter des extraits desdits cahiers, registres ou documents; et
d) permettre à un inspecteur de vérifier tous les stocks de drogues contrôlées dans ledit hôpital.
Note marginale :Administration, vente et fourniture de drogues contrôlées
G.05.003 (1) Il est interdit au responsable d’un hôpital de permettre qu’une drogue contrôlée soit administrée, vendue ou fournie si ce n’est en conformité avec le présent article.
Note marginale :Commandes écrites ou ordonnances
(2) Le responsable d’un hôpital peut permettre qu’une drogue contrôlée soit administrée à la personne ou à l’animal qui reçoit un traitement comme patient hospitalisé ou externe de cet hôpital, ou soit vendue ou fournie à cette personne ou au responsable de l’animal, sur réception d’une ordonnance ou d’une commande écrite, signée et datée par un praticien.
Note marginale :Urgence — autre hôpital
(3) Sous réserve du paragraphe (6), le responsable d’un hôpital peut permettre qu’une drogue contrôlée soit fournie pour une urgence à un employé d’un autre hôpital ou à un praticien exerçant dans un autre hôpital, sur réception d’une commande écrite, signée et datée par le pharmacien de l’autre hôpital ou par le praticien autorisé par le responsable de l’autre hôpital à signer une telle commande.
Note marginale :Urgence — pharmacien
(4) Sous réserve du paragraphe (6), le responsable d’un hôpital peut permettre qu’une drogue contrôlée soit vendue ou fournie à un pharmacien pour une urgence, sur réception d’une commande écrite, signée et datée par ce pharmacien.
Note marginale :Recherche
(5) Le responsable d’un hôpital peut permettre qu’une drogue contrôlée soit fournie, à des fins de recherches, à un employé d’un laboratoire de recherche de cet hôpital.
Note marginale :Signature
(6) Il est interdit au responsable d’un hôpital de permettre que la drogue contrôlée soit vendue ou fournie en vertu des paragraphes (3) ou (4) à moins que la personne qui vend ou fournit la drogue contrôlée vérifie la signature, lorsqu’elle ne la reconnaît pas, du pharmacien de l’autre hôpital ou du praticien autorisé à signer une commande par le responsable de l’autre hôpital.
- DORS/85-550, art. 12
- DORS/88-482, art. 7
- DORS/2004-238, art. 28
- DORS/2010-222, art. 22(F)
- DORS/2019-171, art. 19(F)
- DORS/2019-171, art. 25(F)
Note marginale :Pertes et vols
G.05.004 Le responsable d’un hôpital doit prendre toutes les mesures nécessaires pour empêcher, dans son établissement, la perte ou le vol de drogues contrôlées et doit signaler au ministre toute perte ou tout vol dans les 10 jours en suivant la découverte.
- DORS/78-427, art. 9
TITRE 6Dispositions générales
Note marginale :Étiquetage — drogue dispensée conformément à une ordonnance
G.06.001 L’article C.01.004 ne s’applique pas à la drogue contrôlée dispensée par un pharmacien conformément à une ordonnance, mais les renseignements ci-après doivent figurer sur l’étiquette de l’emballage de la drogue contrôlée :
a) les nom et adresse municipale de la pharmacie ou du pharmacien;
b) la date et le numéro de l’ordonnance;
c) le nom de la personne pour laquelle la drogue contrôlée est dispensée;
d) le nom du praticien;
e) le mode d’emploi;
f) tout autre renseignement devant figurer, conformément à l’ordonnance, sur l’étiquette.
- DORS/99-125, art. 5
- DORS/2004-238, art. 29
- DORS/2018-69, art. 67 et 69
- DORS/2019-171, art. 20
Note marginale :Étiquetage — nécessaire d’essai
G.06.002 L’article C.01.004 ne s’applique pas au nécessaire d’essai qui contient une drogue contrôlée et auquel un numéro d’enregistrement a été attribué.
- DORS/85-550, art. 13
- DORS/88-482, art. 8(F)
- DORS/99-125, art. 6
- DORS/2019-171, art. 20
G.06.002.1 [Abrogé, DORS/2019-171, art. 20]
G.06.002.2 [Abrogé, DORS/2019-171, art. 20]
G.06.002.3 [Abrogé, DORS/2019-171, art. 20]
G.06.002.4 [Abrogé, DORS/2019-171, art. 20]
Note marginale :Identification ou analyse de drogues contrôlées
G.06.003 (1) Toute personne peut, malgré toute disposition de la présente partie, fournir ou livrer une drogue contrôlée à des fins d’identification ou d’analyse aux personnes suivantes :
a) le médecin;
b) le mandataire d’un médecin, si le mandataire bénéficie d’une exemption relative à la possession de cette drogue à ces fins et accordée en vertu de l’article 56 de la Loi.
Note marginale :Mandataire d’un médecin
(2) Le mandataire d’un médecin qui reçoit la drogue contrôlée la fournit ou la livre immédiatement à l’une des personnes suivantes :
a) le médecin;
b) le ministre.
Note marginale :Médecin
(3) Le médecin qui reçoit la drogue contrôlée la fournit ou la livre immédiatement à l’une des personnes suivantes :
a) la personne qui bénéficie d’une exemption relative à la possession de cette drogue à ces fins et accordée en vertu de l’article 56 de la Loi si la drogue lui est fournie ou livrée à des fins d’identification ou d’analyse;
b) le ministre.
Note marginale :Publicité
G.06.004 Il est interdit, à l’égard d’une drogue contrôlée :
a) d’en faire la publicité auprès du grand public;
b) d’en faire la publicité par écrit, sauf si le symbole ci-après figure de façon bien visible, par sa couleur et sa taille, sur le quart supérieur gauche de la première page de la publicité :

Note marginale :Conservation des documents — cas spécifiques
G.06.005 La personne qui bénéficie d’une exemption relative à la possession ou à l’administration d’une drogue contrôlée et accordée en vertu de l’article 56 de la Loi ainsi le médecin qui a reçu une drogue contrôlée en vertu des paragraphes G.06.003(1) ou (2) et le mandataire d’un médecin qui a reçu une drogue contrôlée en vertu du paragraphe G.06.003(1) doivent satisfaire aux exigences suivantes :
a) ils consignent dans un registre les renseignements ci-après et les conservent pendant une période de deux ans suivant la date de leur consignation :
(i) le nom et la quantité de toute drogue contrôlée achetée ou reçue ainsi que la date d’acquisition ou la date de la réception,
(ii) les nom et adresse de la personne de qui ils ont acheté et de qui ils ont reçu la drogue contrôlée,
(iii) les précisions concernant l’utilisation de la drogue contrôlée;
b) ils fournissent au ministre tout renseignement que celui-ci exige à l’égard de la drogue contrôlée;
c) ils donnent accès aux registres dont la tenue est requise par la présente partie.
Note marginale :Renseignements fournis par le ministre à un organisme régissant la profession d’infirmier
G.06.006 (1) Le ministre peut fournir à un organisme régissant la profession d’infirmier tout renseignement concernant un de ses membres qui a été obtenu sous le régime de la présente partie, de la Loi ou de la Loi sur les aliments et drogues.
Note marginale :Non-application
(2) Le paragraphe (1) ne s’applique pas aux infirmiers praticiens.
Note marginale :Définitions
(3) Les définitions qui suivent s’appliquent au présent article.
- membre
membre Personne autorisée par un organisme régissant la profession d’infirmier à exercer la profession d’infirmier. (member)
- organisme régissant la profession d’infirmier
organisme régissant la profession d’infirmier Autorité provinciale attributive de licences en matière d’activités professionnelles qui, en vertu des lois d’une province, autorise des personnes à exercer la profession d’infirmier. (nursing statutory body)
Note marginale :Préavis de la demande d’ordonnance de restitution
G.06.007 (1) Pour l’application du paragraphe 24(1) de la Loi, le préavis de la demande d’ordonnance de restitution qui est donné au procureur général est présenté par écrit et est mis à la poste sous pli recommandé au moins quinze jours avant la date à laquelle la demande sera présentée au juge de paix.
Note marginale :Contenu du préavis
(2) Le préavis contient les renseignements suivants :
a) le nom du juge de paix à qui la demande sera présentée;
b) le lieu et l’heure de l’audition de la demande;
c) les précisions concernant la drogue contrôlée ou toute autre chose faisant l’objet de la demande;
d) les éléments de preuve que le demandeur prévoit de présenter pour établir qu’il a le droit de posséder la drogue contrôlée ou l’autre chose visée à l’alinéa c).
G.07.001 [Abrogé, DORS/2019-171, art. 20]
G.07.002 [Abrogé, DORS/2019-171, art. 20]
ANNEXE(articles G.01.001 et G.01.002, paragraphes G.01.005(1) et G.02.058(1), article G.02.073, paragraphe G.03.001(3), alinéa G.03.006a), article G.03.007 et paragraphe G.05.001(4))
PARTIE I
- 1Les amphétamines, leurs sels, dérivés, isomères et analogues, ainsi que les sels de leurs dérivés, isomères et analogues, sauf ceux mentionnés à l’article 1 de la partie I de l’annexe de la partie J. Sont compris :
- (1)amphétamine (α-méthylbenzèneéthanamine)
- (2)méthamphétamine (N,α-diméthylbenzèneéthanamine)
- (3)benzphétamine (N-benzyl N,α-diméthylbenzèneéthanamine)
- 2Méthylphénidate (méthyl 2-phényl-2-(pipéridin-2-yl)acétate), ses sels, dérivés, isomères et analogues, ainsi que les sels de ses dérivés, isomères et analogues, notamment :
- (1)Éthylphénidate (éthyl 2-phényl-2-(pipéridin-2-yl)acétate)
- (2)Isopropylphénidate (isopropyl 2-phényl-2-(pipéridin-2-yl)acétate)
- (3)Propylphénidate (propyl 2-phényl-2-(pipéridin-2-yl)acétate)
- (4)3,4-Dichlorométhylphénidate (méthyl 2-(3,4-dichlorophényl)-2-(pipéridin-2-yl)acétate)
- (5)4-Méthylméthylphénidate (méthyl 2-(4-méthylphényl)-2-(pipéridin-2-yl)acétate)
- (6)4-Fluorométhylphénidate (méthyl 2-(4-fluorophényl)-2-(pipéridin-2-yl)acétate)
- (7)Méthylnaphthidate (méthyl 2-(naphthalén-2-yl)-2-(pipéridin-2-yl)acétate)
- (8)Éthylnaphthidate (éthyl 2-(naphthalén-2-yl)-2-(pipéridin-2-yl)acétate)
- 3Méthaqualone (méthyl-2 (méthyl-2 phényl)-3(3H)-quinazolinone-4) et ses sels
- 4Phendimétrazine (d-diméthyl-3,4 phényl-2 morpholine) et ses sels
- 5Phenmétrazine (méthyl-3 phényl-2 morpholine) et ses sels
- 6Pentobarbital (acide éthyl-5 (méthyl-1 butyl)-5 barbiturique)
- 7Sécobarbital (acide allyl-5 (méthyl-1 butyl)-5 barbiturique)
- 8Acide hydroxy-4 butanoïque et ses sels
- 9Aminorex (phényl-5 dihydro-4,5 oxazol-1,3 amine-2), ses sels, dérivés, isomères et analogues, ainsi que les sels de ses dérivés, isomères et analogues, notamment :
- (1)Méthyl-4 aminorex (méthyl-4 phényl-5 dihydro-4,5 oxazol-1,3 amine-2)
- (2)Diméthyl-4,4’ aminorex (méthyl-4 (méthyl-4 phényl)-5 dihydro-4,5 oxazol-1,3 amine-2)
- 10Fénétylline (d,l-dihydro-3,7 diméthyl-1,3 [[(méthyl-1 phényl-2 éthyl)amino]-2 éthyl]-7 1H-purinedione-2,6) et ses sels
- 11Glutéthimide (éthyl-2 phényl-2 glutarimide)
- 12Léfétamine ((-)-N,N-diméthyl-α-phénylbenzèneéthanamine), ses sels, dérivés et isomères, ainsi que les sels de ses dérivés et isomères
- 13Mécloqualone (méthyl-2(chloro-2 phényl)-3 (3H)-quinazolinone-4) et ses sels
- 14Mésocarbe ((α-méthylphénéthyl)-3 N-(phénylcarbamoyl)sydnone imine) et ses sels
- 15Pémoline (amino-2 phényl-5 oxazolinone-4) et ses sels
- 16Zipéprol ((méthoxy-2 phényl-2 éthyl)-4 α-(méthoxyphénylméthyl)-1-pipérazineéthanol) et ses sels
- 17Amineptine [(dihydro-10,11 5H-dibenzo[a,d]cycloheptenyl-5)amino]-7 heptanoïque et ses sels
PARTIE II
- 1Barbituriques, ainsi que leurs sels et dérivés, sauf ceux mentionnés aux articles 6 et 7 de la partie I de la présente annexe ainsi que l’acide barbiturique ((1H,3H,5H)-pyrimidinetrione-2,4,6) et ses sels et l’acide 1,3-diméthylbarbiturique (1,3-diméthyl-2,4,6(1H,3H,5H)-pyrimidinetrione) et ses sels. Sont compris :
- (1)allobarbital (acide diallyl-5,5 barbiturique)
- (2)alphénal (acide allyl-5 phényl-5 barbiturique)
- (3)amobarbital (acide éthyl-5 (méthyl-3 butyl)-5 barbiturique)
- (4)aprobarbital (acide allyl-5 isopropyl-5 barbiturique)
- (5)barbital (acide diéthyl-5,5 barbiturique)
- (6)[Abrogé, DORS/2017-12, art. 1]
- (7)butabarbital (acide sec-butyl-5 éthyl-5 barbiturique)
- (8)butalbital (acide allyl-5 isobutyl-5 barbiturique)
- (9)butallylonal (acide (bromo-2 allyl)-5 sec-butyl-5 barbiturique)
- (10)butéthal (acide butyl-5 éthyl-5 barbiturique)
- (11)cyclobarbital (acide (cyclohexène-1 yl-1)-5 éthyl-5 barbiturique)
- (12)cyclopal (acide allyl-5 (cyclopentène-2 yl-1)-5 barbiturique)
- (13)heptabarbital (acide (cycloheptène-1 yl-1)-5 éthyl-5 barbiturique)
- (14)hexéthal (acide éthyl-5 hexyl-5 barbiturique)
- (15)hexobarbital (acide (cyclohexène-1 yl-1)-5 diméthyl-1,5 barbiturique)
- (16)méphobarbital (acide éthyl-5 méthyl-1 phényl-5 barbiturique)
- (17)méthabarbital (acide diéthyl-5,5 méthyl-1 barbiturique)
- (18)méthylphénobarbital (acide éthyl-5 méthyl-1 phényl-5 barbiturique)
- (19)propallylonal (acide (bromo-2 allyl)-5 isopropyl-5 barbiturique)
- (20)phénobarbital (acide éthyl-5 phényl-5 barbiturique)
- (21)probarbital (acide éthyl-5 isopropyl-5 barbiturique)
- (22)acide phénylméthylbarbiturique (acide méthyl-5 phényl-5 barbiturique)
- (23)sigmodal (acide (bromo-2 allyl)-5 (méthyl-1 butyl)-5 barbiturique)
- (24)talbutal (acide allyl-5 sec-butyl-5 barbiturique)
- (25)vinbarbital (acide éthyl-5 (méthyl-1 butényl-1)-5 barbiturique)
- (26)vinylbital (acide (méthyl-1 butyl)-5 vinyl-5 barbiturique)
- 2Thiobarbituriques, ainsi que leurs sels et dérivés, notamment :
- (1)thialbarbital (acide allyl-5 (cyclohexène-2 yl-1)-5 thio-2 barbiturique)
- (2)thiamylal (acide allyl-5 (méthyl-1 butyl)-5 thio-2 barbiturique)
- (3)acide thiobarbiturique (acide thio-2 barbiturique)
- (4)thiopental (acide éthyl-5 (méthyl-1 butyl)-5 thio-2 barbiturique)
- 3Chlorphentermine ((p-chlorophényl)-1 méthyl-2 amino-2 propane) et ses sels
- 4Diéthylpropion ((diéthylamino)-2 propiophenone) et ses sels
- 5Phentermine (α,α-diméthylbenzèneéthanamine) et ses sels
- 6Butorphanol (1-N-cyclobutylméthyl dihydroxy-3,14 morphinane) et ses sels
- 7Nalbuphine (N-cyclobutylméthyl époxy-4,5 morphinanetriol-3,6,14) et ses sels
- 8Pyrovalérone (méthyl-4′(pyrrolidinyl-1)-2 valérophénone) et ses sels
PARTIE III
- 1Stéroïdes anabolisants et leurs dérivés, notamment :
- (1)androisoxazole (hydroxy-17ß méthyl-17α androstano[3,2-c]isoxazole)
- (2)androstanolone (hydroxy-17ß 5α-androstanone-3)
- (3)androstènediol (androstène-5 diol-3ß,17ß)
- (4)bolandiol (estrène-4 diol-3ß,17ß)
- (5)bolastérone (hydroxy-17ß diméthyl-7α,17 androstène-4 one-3)
- (6)bolazine (hydroxy-17ß méthyl-2α 5α-androstanone-3 azine)
- (7)boldénone (hydroxy-17ß androstadiène-1,4 one-3)
- (8)bolénol (nor-19 17α-prégnène-5 ol-17)
- (9)calustérone (hydroxy-17ß diméthyl-7ß,17 androstène-4 one-3)
- (10)clostébol (chloro-4 hydroxy-17ß androstène-4 one-3)
- (11)drostanolone (hydroxy-17ß méthyl-2α 5α-androstanone-3)
- (12)énestébol (dihydroxy-4,17ß méthyl-17 androstadiène-1,4 one-3)
- (13)épitiostanol (épithio-2α,3α 5α-androstanol-17ß)
- (14)éthylestrénol (nor-19 17α-prégnène-4 ol-17)
- (15)hydroxy-4 nor-19 testostérone
- (16)fluoxymestérone (fluoro-9 dihydroxy-11ß,17ß méthyl-17 androstène-4 one-3)
- (17)formébolone (dihydroxy-11α,17ß méthyl-17 oxo-3 androstadiène-1,4 carboxaldéhyde-2)
- (18)furazabol (méthyl-17 5α-androstano[2,3-c]furazanol-17ß)
- (19)mébolazine (hydroxy-17ß diméthyl-2α,17 5α-androstanone-3 azine)
- (20)mésabolone ([(méthoxy-1 cyclohexyl) oxy]-17ß 5α-androstène-1 one-3)
- (21)mestérolone (hydroxy-17ß méthyl-1α 5α-androstanone-3)
- (22)métandiénone (hydroxy-17ß méthyl-17 androstadiène-1,4 one-3)
- (23)méténolone (hydroxy-17ß méthyl-1 5α-androstène-1 one-3)
- (24)méthandriol (méthyl-17α androstène-5 diol-3ß,17ß)
- (25)méthyltestostérone (hydroxy-17ß méthyl-17 androstène-4 one-3)
- (26)métribolone (hydroxy-17ß méthyl-17 estratriène-4,9,11 one-3)
- (27)mibolérone (hydroxy-17ß diméthyl-7α,17 estrène-4 one-3)
- (28)nandrolone (hydroxy-17ß estrène-4 one-3)
- (29)norbolétone (éthyl-13 hydroxy-17ß dinor-18,19 prégnène-4 one-3)
- (30)norclostébol (chloro-4 hydroxy-17ß estrène-4 one-3)
- (31)noréthandrolone (éthyl-17α hydroxy-17ß estrène-4 one-3)
- (32)oxabolone (dihydroxy-4,17ß estrène-4 one-3)
- (33)oxandrolone (hydroxy-17ß méthyl-17 oxa-2 5α-androstanone-3)
- (34)oxymestérone (dihydroxy-4,17ß méthyl-17 androstène-4 one-3)
- (35)oxymétholone (hydroxy-17ß (hydroxyméthylène)-2 méthyl-17 5α-androstanone-3)
- (36)prastérone (hydroxy-3ß androstène-5 one-17)
- (37)quinbolone ((cyclopentènyl-1 oxy-1)-17ß androstadiène-1,4 one-3)
- (38)stanozolol (hydroxy-17ß méthyl-17 5α-androstano[3,2-c]pyrazole)
- (39)stenbolone (hydroxy-17ß méthyl-2 5α-androstène-1 one-3)
- (40)testostérone (hydroxy-17ß androstène-4 one-3)
- (41)tibolone (hydroxy-17 méthyl-7α nor-19 17α-prégnène-5(10) yne-20 one-3)
- (42)tiomestérone (bis(acétylthio)-1α,7α hydroxy-17ß méthyl-17 androstène-4 one-3)
- (43)trenbolone (hydroxy-17ßestratriène-4,9,11 one-3)
- 2Zéranol (trihydroxy-7,14,16 méthyl-3 décahydro-3,4,5,6,- 7,8,9,10,11,12 1H-benzoxa-2 cyclotétradécinone-1)
- DORS/78-427, art. 10
- DORS/79-753, art. 1
- DORS/81-84, art. 1
- DORS/85-550, art. 14(F)
- DORS/86-678, art. 1
- DORS/89-381, art. 1
- DORS/92-386, art. 3
- DORS/97-228, art. 21
- DORS/99-425, art. 1
- DORS/2003-34, art. 2 et 3
- DORS/2003-413, art. 2
- DORS/2015-210, art. 1
- DORS/2016-106, art. 1
- DORS/2017-12, art. 1, 2(A)
- DORS/2017-43, art. 1
- DORS/2017-250, art. 1
- DORS/2019-171, art. 21
PARTIE JDrogues d’usage restreint
Définitions
Note marginale :Définitions
J.01.001 Les définitions qui suivent s’appliquent la présente partie.
- autorité compétente
autorité compétente Organisme public d’un pays étranger qui est habilité, au titre des lois du pays, à consentir à l’importation ou à l’exportation de drogues d’usage restreint. (competent authority)
- chercheur compétent
chercheur compétent Personne ci-après autorisée par le ministre, en vertu du paragraphe J.01.059(4), à utiliser et à posséder une drogue d’usage restreint :
a) celle qui est employée par un établissement ou qui y est associée;
b) celle qui fait des essais cliniques ou de la recherche en laboratoire à l’égard de cette drogue à un établissement. (qualified investigator)
- composé
composé Vise notamment les préparations. (compound)
- destruction
destruction S’agissant d’une drogue d’usage restreint, le fait de l’altérer ou de la dénaturer au point d’en rendre la consommation impossible ou improbable. (destroy)
- Directive en matière de sécurité
Directive en matière de sécurité La Directive sur les exigences en matière de sécurité physique pour les substances désignées et les drogues contenant du cannabis, avec ses modifications successives, publiée par le gouvernement du Canada sur son site Web. (Security Directive)
- distributeur autorisé
distributeur autorisé Titulaire d’une licence délivrée au titre de l’article J.01.015. (licensed dealer)
- drogue d’usage restreint
drogue d’usage restreint S’entend des substances désignées qui sont visées à l’annexe de la présente partie. (restricted drug)
- emballage
emballage Vise notamment toute chose dans laquelle une drogue d’usage restreint est, en tout ou en partie, contenue, placée ou empaquetée. (package)
- établissement
établissement Établissement qui fait de la recherche sur les drogues, y compris l’hôpital, l’université au Canada, le ministère ou l’organisme du gouvernement du Canada ou du gouvernement d’une province ou une partie quelconque de ceux-ci. (institution)
- étiquette
étiquette S’entend au sens de l’article 2 de la Loi sur les aliments et drogues. (label)
- hôpital
hôpital L’établissement, selon le cas :
a) qui peut, au titre d’une licence, d’une autorisation ou d’une désignation délivrée par une province sous le régime de ses lois, fournir des soins ou des traitements aux personnes ou aux animaux atteints d’une maladie ou d’une affection;
b) qui fournit des services de santé et qui soit appartient au gouvernement du Canada ou au gouvernement d’une province, soit est exploité par lui. (hospital)
- infraction désignée en matière criminelle
infraction désignée en matière criminelle S’entend des infractions suivantes :
a) infraction relative au financement du terrorisme visée à l’un des articles 83.02 à 83.04 du Code criminel;
b) infraction de fraude visée à l’un des articles 380 à 382 du Code criminel;
c) infraction de recyclage des produits de la criminalité visée à l’article 462.31 du Code criminel;
d) infraction relative à une organisation criminelle visée à l’un des articles 467.11 à 467.13 du Code criminel;
e) tentative ou complot en vue de commettre une infraction visée à l’un des alinéas a) à d), complicité après le fait à son égard ou fait de conseiller de la commettre. (designated criminal offence)
- Loi
Loi La Loi réglementant certaines drogues et autres substances. (Act)
- nécessaire d’essai
nécessaire d’essai Nécessaire qui a les caractéristiques suivantes :
a) il contient d’une part une drogue d’usage restreint et d’autre part un réactif ou une substance tampon;
b) il est utilisé dans un processus chimique ou analytique de dépistage ou de quantification d’une drogue d’usage restreint à des fins médicales, industrielles, éducatives, pour des travaux de laboratoire ou de recherche ou pour l’application ou l’exécution de la loi;
c) son contenu n’est pas destiné à être consommé par une personne ou un animal, ni à leur être administré, et il n’est pas susceptible de l’être. (test kit)
- nom propre
nom propre S’agissant d’une drogue d’usage restreint, l’un des noms français ou anglais suivants :
a) celui figurant à l’article C.01.002;
b) celui figurant en caractères gras dans le présent règlement et celui de toute forme autre que celle visée à la partie C sous laquelle la drogue est dispensée;
c) s’agissant d’une drogue non visée aux alinéas a) ou b), celui figurant dans l’une des publications mentionnées à l’annexe B de la Loi sur les aliments et drogues. (proper name)
- obligation internationale
obligation internationale Toute obligation relative à une drogue d’usage restreint prévue par une convention, un traité ou un autre instrument multilatéral ou bilatéral que le Canada a ratifié ou auquel il adhère. (international obligation)
- ordonnance
ordonnance[Abrogée, DORS/2021-271, art. 1]
- pharmacien
pharmacien[Abrogée, DORS/2021-271, art. 1]
- responsable principal
responsable principal L’individu désigné en application de l’article J.01.011. (senior person in charge)
- responsable qualifié
responsable qualifié L’individu désigné en application du paragraphe J.01.012(1). (qualified person in charge)
- DORS/97-228, art. 22
- DORS/2004-238, art. 31
- DORS/2013-172, art. 1
- DORS/2019-171, art. 22
- DORS/2021-271, art. 1
Dispositions générales
Note marginale :Inscription accélérée temporaire
J.01.002 (1) Le ministre peut, par arrêté, ajouter à la colonne 1 de la partie III de l’annexe de la présente partie tout ou partie d’un article qui figure à l’annexe V de la Loi pour la période prévue à la colonne 2 correspondant à la même période que celle inscrite à l’annexe V pour cet article.
Note marginale :Abrogation
(2) Le ministre peut, par arrêté, supprimer de la colonne 1 de la partie III de l’annexe de la présente partie tout ou partie d’un article qui y figure.
Note marginale :Abrogation à l’annexe V de la Loi
(3) Tout ou partie d’un article figurant à la partie III de l’annexe à la présente partie est réputé en être supprimé le jour où il n’est plus inscrit à l’annexe V de la Loi.
- DORS/97-228, art. 23
- DORS/99-125, art. 7
- DORS/2010-222, art. 23
- DORS/2015-210, art. 2
- DORS/2018-85, art. 1
- DORS/2019-171, art. 22
Note marginale :Non-application — membre d’un corps policier
J.01.003 Le membre d’un corps policier ou la personne agissant sous son autorité et sa supervision qui, à l’égard de l’une de ses activités, est soustrait à l’application du paragraphe 4(2) ou des articles 5, 6 ou 7 de la Loi, en vertu du Règlement sur l’exécution policière de la Loi réglementant certaines drogues et autres substances est, à l’égard de cette activité, soustrait à l’application de la présente partie.
- DORS/2004-238, art. 32
- DORS/2019-171, art. 22
J.01.003.1 [Abrogé, DORS/2019-171, art. 22]
J.01.003.2 [Abrogé, DORS/2019-171, art. 22]
Possession
Note marginale :Personnes autorisées
J.01.004 (1) Les personnes ci-après sont autorisées à avoir en leur possession une drogue d’usage restreint mentionnée à la partie I de l’annexe de la présente partie :
a) le distributeur autorisé;
b) le chercheur compétent qui l’a en sa possession dans le but de faire des essais cliniques ou de la recherche en laboratoire à un établissement;
c) l’inspecteur, le membre de la Gendarmerie royale du Canada, l’agent de police, l’agent de la paix ou le membre du personnel technique ou scientifique du gouvernement du Canada, du gouvernement d’une province ou d’une université au Canada qui la possède dans le cadre de ses fonctions;
d) la personne qui bénéficie d’une exemption relative à la possession de cette drogue et accordée en vertu de l’article 56 de la Loi;
e) le ministre.
Note marginale :Mandataires
(2) Toute personne est autorisée à avoir en sa possession une drogue d’usage restreint mentionnée à la partie I de l’annexe de la présente partie si elle agit comme mandataire d’une personne visée aux alinéas (1)a), b), d) ou e).
Note marginale :Mandataires — personne visée à l’alinéa (1)c)
(3) Toute personne est autorisée à avoir en sa possession une drogue d’usage restreint mentionnée à la partie I de l’annexe de la présente partie si les conditions ci-après sont réunies :
a) elle agit comme mandataire d’une personne dont elle a des motifs raisonnables de croire que celle-ci est visée à l’alinéa (1)c);
b) la possession de la drogue a pour but d’aider la personne dont elle est mandataire dans l’application ou l’exécution d’une loi ou d’un règlement.
J.01.004.1 [Abrogé, DORS/2019-171, art. 22]
Nécessaires d’essai
Note marginale :Opérations autorisées
J.01.005 Toute personne peut vendre un nécessaire d’essai, en avoir un en sa possession ou effectuer toute autre opération relative à celui-ci si les conditions ci-après sont remplies :
a) un numéro d’enregistrement a été attribué au nécessaire d’essai au titre de l’article J.01.007 et n’a pas été annulé en application de l’article J.01.008;
b) le nécessaire d’essai porte, sur sa surface extérieure, les renseignements suivants :
(i) le nom du fabricant,
(ii) le nom commercial ou la marque de commerce,
(iii) le numéro d’enregistrement;
c) le nécessaire d’essai sera utilisé à des fins médicales, industrielles ou éducatives, pour des travaux de laboratoire ou de recherche ou pour l’application ou l’exécution de la loi.
Note marginale :Numéro d’enregistrement — demande
J.01.006 (1) Le fabricant d’un nécessaire d’essai peut obtenir un numéro d’enregistrement en présentant au ministre une demande qui contient les renseignements suivants :
a) une description détaillée de la conception et de la fabrication du nécessaire d’essai;
b) une description détaillée de la drogue d’usage restreint et, le cas échéant, des autres substances que contient le nécessaire d’essai, ainsi que la description qualitative et quantitative de chacun des composants;
c) une description de l’utilisation à laquelle est destiné le nécessaire d’essai.
Note marginale :Signature et attestation
(2) La demande satisfait aux exigences suivantes :
a) elle est signée et datée par la personne autorisée à cette fin par le demandeur;
b) elle comprend une attestation de celle-ci portant qu’à sa connaissance, tous les renseignements fournis à l’appui de la demande sont exacts et complets.
Note marginale :Renseignements et documents complémentaires
(3) Le demandeur fournit au ministre, au plus tard à la date précisée dans la demande écrite de celui-ci à cet effet, tout renseignement ou document que le ministre juge nécessaire pour compléter l’examen de la demande du numéro d’enregistrement.
Note marginale :Numéro d’enregistrement — attribution
J.01.007 Le ministre, au terme de l’examen de la demande de numéro d’enregistrement, attribue un numéro d’enregistrement précédé des lettres « TK » au nécessaire d’essai s’il établit que ce dernier satisfait à l’une des exigences ci-après et sera utilisé seulement à des fins médicales, industrielles ou éducatives, pour des travaux de laboratoire ou de recherche ou pour l’application ou l’exécution de la loi :
a) il contient une drogue d’usage restreint et un agent d’adultération ou un dénaturant, mélangés de telle manière et en quantités, proportions ou concentrations telles que la préparation ou le mélange ne présente pas un risque notable de toxicomanie;
b) il contient des quantités ou des concentrations d’une drogue d’usage restreint si infimes qu’il ne présente pas un risque notable de toxicomanie.
- DORS/2004-238, art. 33
- DORS/2010-222, art. 25
- DORS/2014-260, art. 9 et 16(F)
- DORS/2019-171, art. 22
J.01.007.1 [Abrogé, DORS/2019-171, art. 22]
J.01.007.2 [Abrogé, DORS/2019-171, art. 22]
J.01.007.3 [Abrogé, DORS/2019-171, art. 22]
J.01.007.4 [Abrogé, DORS/2019-171, art. 22]
J.01.007.5 [Abrogé, DORS/2019-171, art. 22]
J.01.007.6 [Abrogé, DORS/2019-171, art. 22]
J.01.007.7 [Abrogé, DORS/2019-171, art. 22]
J.01.007.8 [Abrogé, DORS/2019-171, art. 22]
J.01.007.9 [Abrogé, DORS/2019-171, art. 22]
J.01.007.91 [Abrogé, DORS/2019-171, art. 22]
Note marginale :Numéro d’enregistrement — annulation
J.01.008 Le ministre annule le numéro d’enregistrement d’un nécessaire d’essai dans les cas suivants :
a) le fabricant retire le nécessaire d’essai du marché;
b) le ministre a des motifs raisonnables de croire que le nécessaire d’essai n’est pas utilisé à des fins médicales, industrielles ou éducatives, pour des travaux de laboratoire ou de recherche ou pour l’application ou l’exécution de la loi, ou qu’il est susceptible de ne pas l’être;
c) le ministre a des motifs raisonnables de croire que l’annulation est nécessaire pour protéger la sécurité ou la santé publiques, notamment pour prévenir le détournement d’une drogue d’usage restreint vers un marché ou un usage illicites.
Distributeurs autorisés
Opérations autorisées
Note marginale :Exigences générales
J.01.009 (1) Le distributeur autorisé peut produire, assembler, vendre, fournir, transporter, expédier, livrer, importer ou exporter une drogue d’usage restreint s’il se conforme à la présente partie ainsi qu’aux conditions de sa licence de distributeur autorisé et de tout permis délivré en vertu de la présente partie.
Note marginale :Présence d’un responsable qualifié
(2) Le distributeur autorisé ne peut effectuer à son installation une opération relative à une drogue d’usage restreint que si le responsable qualifié ou un responsable qualifié suppléant est présent à l’installation.
Note marginale :Permis — importation et exportation
(3) Le distributeur autorisé est tenu d’obtenir un permis pour importer ou exporter une drogue d’usage restreint.
Note marginale :Possession à des fins d’exportation
(4) Le distributeur autorisé peut avoir en sa possession une drogue d’usage restreint en vue de son exportation s’il l’a obtenue conformément à la présente partie.
Licences de distributeur autorisé
Exigences préalables
Note marginale :Personnes admissibles
J.01.010 Les personnes ci-après peuvent demander une licence de distributeur autorisé :
a) l’individu qui réside de façon habituelle au Canada;
b) la personne morale qui a son siège social au Canada ou qui y exploite une succursale;
c) le titulaire d’un poste qui est responsable des questions relatives aux drogues d’usage restreint pour le compte du gouvernement du Canada ou d’un gouvernement provincial, d’un service de police, d’un hôpital ou d’une université au Canada.
Note marginale :Responsable principal
J.01.011 La personne qui demande une licence de distributeur autorisé désigne un seul individu à titre de responsable principal, le demandeur pouvant se désigner lui-même s’il est un individu, qui est responsable de la gestion de l’ensemble des opérations relatives aux drogues d’usage restreint précisées dans la demande de licence.
- DORS/2004-238, art. 34
- DORS/2019-171, art. 22
Note marginale :Responsable qualifié
J.01.012 (1) La personne qui demande une licence de distributeur autorisé désigne un seul individu à titre de responsable qualifié, le demandeur pouvant se désigner lui-même s’il est un individu, qui est à la fois responsable de superviser les opérations relatives aux drogues d’usage restreint précisées dans la demande de licence et de veiller à la conformité de ces opérations avec la présente partie.
Note marginale :Responsable qualifié suppléant
(2) La personne qui demande une licence de distributeur autorisé peut désigner un individu à titre de responsable qualifié suppléant, le demandeur pouvant se désigner lui-même s’il est un individu, qui est autorisé à remplacer le responsable qualifié lorsque celui-ci est absent.
Note marginale :Qualifications
(3) Seul l’individu qui satisfait aux exigences ci-après peut être désigné à titre de responsable qualifié ou de responsable qualifié suppléant :
a) il travaille à l’installation précisée dans la licence de distributeur autorisé;
b) il est :
(i) soit une personne autorisée ou, le cas échéant, inscrite et autorisée, par une autorité provinciale attributive de licences en matière d’activités professionnelles ou par une association professionnelle au Canada, à exercer sa profession dans un domaine lié à ses fonctions, notamment celle de pharmacien, de praticien, de technicien en pharmacie ou de technicien de laboratoire,
(ii) soit titulaire d’un diplôme, d’un certificat ou d’une attestation décerné par un établissement d’enseignement postsecondaire au Canada dans un domaine qui est lié à ses fonctions, notamment la pharmacie, la médecine, la dentisterie, la médecine vétérinaire, la pharmacologie, la chimie, la biologie, la réglementation pharmaceutique, la sécurité ou la gestion des chaînes d’approvisionnement, les techniques en pharmacie ou les techniques de laboratoire,
(iii) soit titulaire d’un diplôme, d’un certificat ou d’une attestation décerné par un établissement d’enseignement étranger dans l’un des domaines visés au sous-alinéa (ii) et titulaire de l’une des attestations suivantes :
(A) une attestation d’équivalence, au sens du paragraphe 73(1) du Règlement sur l’immigration et la protection des réfugiés,
(B) une attestation d’équivalence délivrée par une institution ou une organisation chargée de faire des attestations d’équivalences et reconnue par une province;
c) il possède des connaissances et une expérience relatives à l’utilisation et à la manutention des drogues d’usage restreint précisées dans la licence de distributeur autorisé qui sont suffisantes pour lui permettre de bien exercer ses fonctions;
d) il possède une connaissance suffisante des dispositions de la Loi et de la présente partie s’appliquant aux opérations précisées dans la licence de distributeur autorisé pour lui permettre de bien exercer ses fonctions.
Note marginale :Exception
(4) La personne qui demande une licence de distributeur autorisé peut désigner à titre de responsable qualifié ou de responsable qualifié suppléant un individu qui ne satisfait à aucune des exigences prévues à l’alinéa (3)b) si les conditions ci-après sont réunies :
a) aucun autre individu travaillant à l’installation ne satisfait à l’une de ces exigences;
b) ces exigences ne sont pas nécessaires pour effectuer les opérations précisées dans par la licence;
c) l’individu possède des connaissances suffisantes acquises par la combinaison de ses études, de sa formation et de son expérience de travail pour lui permettre de bien exercer ses fonctions.
- DORS/2004-238, art. 34
- DORS/2010-222, art. 30
- DORS/2019-171, art. 22
J.01.012.1 [Abrogé, DORS/2019-171, art. 22]
J.01.012.2 [Abrogé, DORS/2019-171, art. 22]
Note marginale :Inadmissibilité
J.01.013 Ne peut être désigné à titre de responsable principal, de responsable qualifié ou de responsable qualifié suppléant l’individu qui, dans les dix années précédant la date de présentation de la demande de licence de distributeur autorisé :
a) à l’égard d’une infraction désignée, d’une infraction désignée en matière criminelle ou d’une infraction désignée au sens du paragraphe 2(1) de la Loi sur le cannabis :
(i) soit a été condamné en tant qu’adulte,
(ii) soit s’est vu imposer en tant qu’adolescent, au sens du paragraphe 2(1) de la Loi sur le système de justice pénale pour les adolescents, une peine applicable aux adultes, au sens de ce paragraphe;
b) à l’égard d’une infraction commise dans un pays étranger qui, si elle avait été commise au Canada, aurait constitué une infraction désignée, une infraction désignée en matière criminelle ou une infraction désignée au sens du paragraphe 2(1) de la Loi sur le cannabis :
(i) soit a été condamné en tant qu’adulte,
(ii) soit s’est vu imposer, pour une infraction commise alors qu’il avait au moins quatorze ans et moins de dix-huit ans, une peine plus longue que la peine maximale prévue par la peine spécifique, au sens du paragraphe 2(1) de la Loi sur le système de justice pénale pour les adolescents pour une telle infraction.
- DORS/2004-238, art. 34
- DORS/2019-171, art. 22
Délivrance d’une licence
Note marginale :Demande
J.01.014 (1) La personne qui prévoit d’effectuer l’une des opérations visées à l’article J.01.009 doit obtenir une licence de distributeur autorisé pour chaque installation où elle prévoit d’effectuer celle-ci en présentant au ministre une demande qui contient les renseignements suivants :
a) les précisions ci-après à l’égard de la personne qui demande la licence :
(i) s’agissant d’un individu, son nom,
(ii) s’agissant d’une personne morale, sa dénomination sociale et tout autre nom enregistré dans une province sous lequel elle entend s’identifier ou effectuer les opérations précisées dans la licence,
(iii) s’agissant du titulaire d’un poste visé à l’alinéa J.01.010c), son nom et le titre de son poste;
b) l’adresse municipale, le numéro de téléphone et, le cas échéant, l’adresse électronique de l’installation de même que, si elle diffère de l’adresse municipale, son adresse postale;
c) les nom, numéro de téléphone et adresse électronique du responsable principal proposé ainsi que sa date de naissance;
d) à l’égard du responsable qualifié et de tout responsable qualifié suppléant proposés :
(i) leurs nom, numéro de téléphone et adresse électronique ainsi que leur date de naissance,
(ii) le titre de leur poste à l’installation,
(iii) les nom et titre du poste de leur supérieur immédiat à l’installation,
(iv) le cas échéant, la profession exercée qui est liée à leurs fonctions, le nom de la province les autorisant à l’exercer et le numéro de cette autorisation,
(v) leurs études, formation et expérience de travail liées à l’exercice de leurs fonctions;
e) les opérations proposées et les drogues d’usage restreint visées par chacune de celles-ci;
f) si la demande vise la fabrication ou l’assemblage d’un produit ou d’un composé contenant une drogue d’usage restreint, sauf si elle vise la fabrication ou l’assemblage d’un nécessaire d’essai, une liste qui contient les précisions ci-après pour chaque produit ou composé :
(i) la marque nominative du produit ou le nom du composé,
(ii) le nom de la drogue d’usage restreint qu’il contient,
(iii) la concentration de la drogue d’usage restreint qu’il contient dans chacune de ses unités, le nombre d’unités par emballage et le nombre d’emballages,
(iv) s’il est fabriqué ou assemblé sur mesure aux termes d’une commande spéciale pour un autre distributeur autorisé ou s’il l’est par un distributeur autorisé différent, les nom, adresse municipale et numéro de licence de celui-ci,
(v) si le nom du demandeur figure sur l’étiquette du produit ou du composé, une copie de l’étiquette intérieure;
g) si la demande vise la production d’une drogue d’usage restreint, exception faite des produits ou composés contenant une drogue d’usage restreint, les précisions ci-après concernant cette drogue :
(i) son nom,
(ii) la quantité que le demandeur prévoit de produire en vertu de la licence et la période prévue pour la production,
(iii) si elle est produite sur mesure aux termes d’une commande spéciale pour un autre distributeur autorisé, les nom, adresse municipale et numéro de licence de celui-ci;
h) si la demande vise une opération qui n’est pas visée par les alinéas f) et g), le nom de la drogue d’usage restreint qui fera l’objet de l’opération et le but de cette dernière;
i) la description détaillée des mesures de sécurité mises en place à l’installation et établies conformément à la Directive en matière de sécurité;
j) la description détaillée de la méthode de consignation des renseignements que le demandeur prévoit d’utiliser en application de l’article J.01.075.
Note marginale :Documents
(2) La demande est accompagnée des documents suivants :
a) dans le cas où le demandeur est une personne morale :
(i) une copie de son certificat de constitution ou de tout autre acte constitutif,
(ii) une copie de tout document déposé auprès de la province où se trouve son installation et qui indique sa dénomination sociale et tout autre nom enregistré dans la province sous lequel elle entend s’identifier ou effectuer les opérations précisées dans la licence;
b) les déclarations individuelles signées et datées par le responsable principal, le responsable qualifié et tout responsable qualifié suppléant proposés attestant que le signataire n’est pas visé par l’article J.01.013;
c) à l’égard de chaque personne visée à l’alinéa b), un document délivré par un corps policier canadien précisant si, au cours des dix années précédant la présentation de la demande, elle a fait l’objet d’une condamnation visée au sous-alinéa J.01.013a)(i) ou s’est vu imposer une peine visée au sous-alinéa J.01.013a)(ii);
d) à l’égard de chaque personne visée à l’alinéa b) qui a résidé de façon habituelle dans un pays étranger au cours des dix années précédant la présentation de la demande, un document délivré par un corps policier de ce pays précisant si elle a fait l’objet d’une condamnation visée au sous-alinéa J.01.013b)(i) ou s’est vu imposer une peine visée au sous-alinéa J.01.013b)(ii) dans ce pays au cours de cette période;
e) une déclaration, signée et datée par le responsable principal, attestant que le responsable qualifié et tout responsable qualifié suppléant proposés ont les connaissances et l’expérience exigées aux alinéas J.01.012(3)c) et d);
f) dans le cas où le responsable qualifié ou tout responsable qualifié suppléant proposé ne satisfait pas à l’exigence visée au sous-alinéa J.01.012(3)b)(i) :
(i) une copie du diplôme, du certificat ou de l’attestation visé aux sous-alinéas J.01.012(3)b)(ii) ou (iii),
(ii) une description détaillée des études, de la formation et de l’expérience de travail visées à l’alinéa J.01.012(4)c), accompagnée de pièces justificatives telle une copie des relevés de notes ou de l’attestation faite par la personne qui a dispensé la formation.
Note marginale :Signature et attestation
(3) La demande satisfait aux exigences suivantes :
a) elle est signée et datée par le responsable principal proposé;
b) elle comprend une attestation de celui-ci portant sur les faits suivants :
(i) à sa connaissance, tous les renseignements et documents fournis à l’appui de la demande sont exacts et complets,
(ii) il est habilité à lier le demandeur.
Note marginale :Renseignements et documents complémentaires
(4) Le demandeur fournit au ministre, au plus tard à la date précisée dans la demande écrite de celui-ci à cet effet, tout renseignement ou document que le ministre juge nécessaire pour compléter l’examen de la demande de licence.
Note marginale :Délivrance
J.01.015 Le ministre, au terme de l’examen de la demande de licence et sous réserve de l’article J.01.017, délivre une licence de distributeur autorisé, avec ou sans conditions, qui contient les renseignements suivants :
a) le numéro de la licence;
b) le nom du distributeur, sa dénomination sociale ou le titre de son poste;
c) les opérations autorisées et le nom des drogues d’usage restreint visées par chacune de celles-ci;
d) l’adresse municipale de l’installation où le distributeur peut effectuer les opérations autorisées;
e) le niveau de sécurité applicable à l’installation, établi conformément à la Directive en matière de sécurité;
f) la date de prise d’effet de la licence;
g) la date d’expiration de la licence, qui ne peut être postérieure à la troisième année suivant sa date de prise d’effet;
h) toute condition que le ministre estime nécessaire, sur le fondement de motifs raisonnables, pour atteindre l’une des fins suivantes :
(i) le respect d’une obligation internationale,
(ii) la conformité aux exigences associées au niveau de sécurité visé à l’alinéa e),
(iii) la réduction d’un risque d’atteinte à la sécurité ou à la santé publiques, notamment le risque de détournement d’une drogue d’usage restreint vers un marché ou un usage illicites;
i) si le distributeur produit une drogue d’usage restreint, la quantité qu’il peut produire et la période de production autorisée.
Note marginale :Validité
J.01.016 La licence de distributeur autorisé est valide jusqu’à la date d’expiration qui y est indiquée ou, si elle est antérieure, jusqu’à la date de sa suspension ou de sa révocation au titre des articles J.01.035 ou J.01.036.
Note marginale :Refus
J.01.017 (1) Le ministre refuse de délivrer une licence de distributeur autorisé dans les cas suivants :
a) le demandeur ne peut pas demander une licence en vertu de l’article J.01.010;
b) le demandeur a contrevenu, dans les dix années précédant la présentation de la demande de licence :
(i) soit à une disposition de la Loi, de la Loi sur le cannabis ou de leurs règlements,
(ii) soit à une condition d’une licence ou d’un permis qui lui a été délivré en vertu d’un règlement pris en vertu de la Loi ou qui lui a été délivré en vertu de la Loi sur le cannabis ou de ses règlements;
c) dans les dix années précédant la présentation de la demande de licence, le responsable principal, le responsable qualifié ou tout responsable qualifié suppléant proposé a fait l’objet d’une condamnation visée aux sous-alinéas J.01.013a)(i) ou b)(i) ou s’est vu imposer une peine visée aux sous-alinéas J.01.013a)(ii) ou b)(ii);
d) l’une des opérations pour lesquelles la licence est demandée entraînerait la violation d’une obligation internationale;
e) le demandeur n’a pas mis en place à l’installation les mesures de sécurité prévues dans la Directive en matière de sécurité à l’égard d’une opération pour laquelle il demande la licence;
f) la méthode visée à l’alinéa J.01.014(1)j) ne permet pas la consignation des renseignements conformément à l’article J.01.075;
g) soit le demandeur ne s’est pas conformé aux exigences prévues au paragraphe J.01.014(4), soit il s’y est conformé, mais les renseignements ou documents fournis sont insuffisants pour terminer l’examen de la demande de licence;
h) le ministre a des motifs raisonnables de croire que le demandeur a fourni, dans sa demande de licence ou à l’appui de celle-ci, des renseignements faux ou trompeurs ou des documents faux ou falsifiés;
i) le ministre a des motifs raisonnables de croire, sur le fondement de renseignements reçus d’une autorité compétente ou de l’Organisation des Nations Unies, que le demandeur a participé au détournement d’une drogue d’usage restreint vers un marché ou un usage illicites ou qu’il a participé à des opérations qui ont entraîné la violation d’une obligation internationale;
j) le ministre a des motifs raisonnables de croire que la délivrance de la licence risquerait vraisemblablement de porter atteinte à la sécurité ou à la santé publiques, notamment en raison du risque de détournement d’une drogue d’usage restreint vers un marché ou un usage illicites.
Note marginale :Exceptions
(2) Le ministre ne peut, dans les cas visés aux alinéas (1)b) ou h), refuser de délivrer la licence si le demandeur remplit les conditions ci-après, sauf s’il a des motifs raisonnables de croire que le refus est nécessaire pour protéger la sécurité ou la santé publiques, notamment pour prévenir le détournement d’une drogue d’usage restreint vers un marché ou un usage illicites :
a) le demandeur n’a pas d’antécédents de contravention à la Loi, à la Loi sur le cannabis ou à leurs règlements;
b) il a soit pris les mesures correctives nécessaires pour veiller à respecter la Loi, la Loi sur le cannabis et leurs règlements, soit signé un engagement à cet effet.
Note marginale :Préavis
(3) Le ministre, avant de refuser de délivrer la licence, envoie au demandeur un préavis motivé l’informant qu’il peut présenter ses observations à cet égard.
Renouvellement de la licence
Note marginale :Demande
J.01.018 (1) Le distributeur autorisé présente au ministre, pour obtenir le renouvellement de sa licence de distributeur autorisé, une demande qui contient les renseignements et documents visés aux paragraphes J.01.014(1) et (2).
Note marginale :Signature et attestation
(2) La demande satisfait aux exigences suivantes :
a) elle est signée et datée par le responsable principal de l’installation précisée dans la demande;
b) elle comprend une attestation de celui-ci portant sur les faits suivants :
(i) à sa connaissance, tous les renseignements et documents fournis à l’appui de la demande sont exacts et complets,
(ii) il est habilité à lier le distributeur autorisé.
Note marginale :Renseignements et documents complémentaires
(3) Le distributeur autorisé fournit au ministre, au plus tard à la date précisée dans la demande écrite de celui-ci à cet effet, tout renseignement ou document que le ministre juge nécessaire pour compléter l’examen de la demande de renouvellement.
Note marginale :Renouvellement
J.01.019 (1) Le ministre, au terme de l’examen de la demande de renouvellement et sous réserve de l’article J.01.021, renouvelle la licence de distributeur autorisé, qui contient les renseignements visés à l’article J.01.015.
Note marginale :Conditions
(2) Le ministre peut, lorsqu’il renouvelle la licence du distributeur autorisé, ajouter toute condition à la licence, en modifier les conditions ou supprimer l’une de celles-ci s’il a des motifs raisonnables de le croire nécessaire pour atteindre l’une des fins suivantes :
a) le respect d’une obligation internationale;
b) la conformité aux exigences associées au niveau de sécurité précisé dans la licence ou à tout nouveau niveau qui s’impose à la suite du renouvellement;
c) la réduction d’un risque d’atteinte à la sécurité ou à la santé publiques, notamment le risque de détournement d’une drogue d’usage restreint vers un marché ou un usage illicites.
Note marginale :Validité
J.01.020 La licence de distributeur autorisé renouvelée est valide jusqu’à la date d’expiration qui y est indiquée ou, si elle est antérieure, jusqu’à la date de sa suspension ou de sa révocation au titre des articles J.01.035 ou J.01.036.
Note marginale :Refus
J.01.021 (1) Le ministre refuse de renouveler la licence de distributeur autorisé dans les cas suivants :
a) le distributeur autorisé ne peut plus demander une licence en vertu de l’article J.01.010;
b) le distributeur autorisé a contrevenu, dans les dix années précédant la présentation de la demande de renouvellement :
(i) soit à une disposition de la Loi, de la Loi sur le cannabis ou de leurs règlements,
(ii) soit à une condition d’une licence ou d’un permis qui lui a été délivré en vertu d’un règlement pris en vertu de la Loi ou qui lui a été délivré en vertu de la Loi sur le cannabis ou de ses règlements;
c) dans les dix années précédant la présentation de la demande de renouvellement, le responsable principal, le responsable qualifié ou tout responsable qualifié suppléant proposé a fait l’objet d’une condamnation visée aux sous-alinéas J.01.013a)(i), ou b)(i) ou s’est vu imposer une peine visée aux sous-alinéas J.01.013a)(ii) ou b)(ii);
d) l’une des opérations pour lesquelles le renouvellement est demandé entraînerait la violation d’une obligation internationale;
e) le distributeur autorisé n’a pas mis en place à l’installation les mesures de sécurité prévues dans la Directive en matière de sécurité à l’égard d’une opération pour laquelle il demande le renouvellement;
f) la méthode visée à l’alinéa J.01.014(1)j) ne permet pas la consignation des renseignements conformément à l’article J.01.075;
g) soit le distributeur autorisé ne s’est pas conformé aux exigences prévues au paragraphe J.01.018(3), soit il s’y est conformé, mais les renseignements ou documents fournis sont insuffisants pour terminer l’examen de la demande de renouvellement;
h) le ministre a des motifs raisonnables de croire que le distributeur autorisé a fourni, dans sa demande de renouvellement ou à l’appui de celle-ci, des renseignements faux ou trompeurs ou des documents faux ou falsifiés;
i) le ministre a des motifs raisonnables de croire, sur le fondement de renseignements reçus d’une autorité compétente ou de l’Organisation des Nations Unies, que le distributeur autorisé a participé au détournement d’une drogue d’usage restreint vers un marché ou un usage illicites ou qu’il a participé à des opérations qui ont entraîné la violation d’une obligation internationale;
j) le ministre a des motifs raisonnables de croire que le renouvellement de la licence risquerait vraisemblablement de porter atteinte à la sécurité ou à la santé publiques, notamment en raison du risque de détournement d’une drogue d’usage restreint vers un marché ou un usage illicites.
Note marginale :Exceptions
(2) Le ministre ne peut, dans les cas visés aux alinéas (1)b) ou h), refuser de renouveler la licence si le distributeur autorisé remplit les conditions ci-après, sauf s’il a des motifs raisonnables de croire que le refus est nécessaire pour protéger la sécurité ou la santé publiques, notamment pour prévenir le détournement d’une drogue d’usage restreint vers un marché ou un usage illicites :
a) le distributeur autorisé n’a pas d’antécédents de contravention à la Loi, à la Loi sur le cannabis ou à leurs règlements;
b) il a soit pris les mesures correctives nécessaires pour veiller à respecter la Loi, la Loi sur le cannabis et leurs règlements, soit signé un engagement à cet effet.
Note marginale :Préavis
(3) Le ministre, avant de refuser de renouveler la licence, envoie au distributeur autorisé un préavis motivé l’informant qu’il peut présenter ses observations à cet égard.
- DORS/85-550, art. 15
- DORS/2019-171, art. 22
Modification de la licence
Note marginale :Demande
J.01.022 (1) Le distributeur autorisé présente au ministre, avant d’apporter un changement ayant une incidence sur tout renseignement visé à l’article J.01.015 figurant sur sa licence de distributeur autorisé, une demande de modification de sa licence qui contient la description du changement prévu ainsi que les renseignements et documents pertinents visés à l’article J.01.014.
Note marginale :Signature et attestation
(2) La demande satisfait aux exigences suivantes :
a) elle est signée et datée par le responsable principal de l’installation précisée dans la demande;
b) elle comprend une attestation de celui-ci portant sur les faits suivants :
(i) à sa connaissance, tous les renseignements et documents fournis à l’appui de la demande sont exacts et complets,
(ii) il est habilité à lier le distributeur autorisé.
Note marginale :Renseignements et documents complémentaires
(3) Le distributeur autorisé fournit au ministre, au plus tard à la date précisée dans la demande écrite de celui-ci à cet effet, tout renseignement ou document que le ministre juge nécessaire pour compléter l’examen de la demande de modification.
Note marginale :Modification
J.01.023 (1) Le ministre, au terme de l’examen de la demande de modification et sous réserve de l’article J.01.025, modifie la licence de distributeur autorisé.
Note marginale :Conditions
(2) Le ministre peut, lorsqu’il modifie la licence du distributeur autorisé, ajouter toute condition à la licence, en modifier les conditions ou supprimer l’une de celles-ci s’il a des motifs raisonnables de le croire nécessaire pour atteindre l’une des fins suivantes :
a) le respect d’une obligation internationale;
b) la conformité aux exigences associées au niveau de sécurité précisé dans la licence ou à tout nouveau niveau qui s’impose à la suite de la modification;
c) la réduction d’un risque d’atteinte à la sécurité ou à la santé publiques, notamment le risque de détournement d’une drogue d’usage restreint vers un marché ou un usage illicites.
- DORS/2004-238, art. 35
- DORS/2010-222, art. 31(F)
- DORS/2019-171, art. 22
Note marginale :Validité
J.01.024 La licence de distributeur autorisé modifiée est valide jusqu’à la date d’expiration qui y est indiquée ou, si elle est antérieure, jusqu’à la date de sa suspension ou de sa révocation au titre des articles J.01.035 ou J.01.036.
Note marginale :Refus
J.01.025 (1) Le ministre refuse de modifier la licence de distributeur autorisé dans les cas suivants :
a) l’une des opérations pour lesquelles la modification est demandée entraînerait la violation d’une obligation internationale;
b) le distributeur autorisé n’a pas mis en place à l’installation les mesures de sécurité prévues dans la Directive en matière de sécurité à l’égard d’une opération pour laquelle il demande la modification;
c) la méthode visée à l’alinéa J.01.014(1)j) ne permet pas la consignation des renseignements conformément à l’article J.01.075;
d) soit le distributeur autorisé ne s’est pas conformé aux exigences prévues au paragraphe J.01.022(3), soit il s’y est conformé, mais les renseignements ou documents fournis sont insuffisants pour terminer l’examen de la demande de modification;
e) le ministre a des motifs raisonnables de croire que le distributeur autorisé a fourni, dans sa demande de modification ou à l’appui de celle-ci, des renseignements faux ou trompeurs ou des documents faux ou falsifiés;
f) le ministre a des motifs raisonnables de croire que la modification de la licence risquerait vraisemblablement de porter atteinte à la sécurité ou à la santé publiques, notamment en raison du risque de détournement d’une drogue d’usage restreint vers un marché ou un usage illicites.
Note marginale :Exception
(2) Le ministre ne peut, dans le cas visé à l’alinéa (1)e), refuser de modifier la licence si le distributeur autorisé remplit les conditions ci-après, sauf s’il a des motifs raisonnables de croire que le refus est nécessaire pour protéger la sécurité ou la santé publiques, notamment pour prévenir le détournement d’une drogue d’usage restreint vers un marché ou un usage illicites :
a) le distributeur autorisé n’a pas d’antécédents de contravention à la Loi, à la Loi sur le cannabis ou à leurs règlements;
b) il a soit pris les mesures correctives nécessaires pour veiller à respecter la Loi, la Loi sur le cannabis et leurs règlements, soit signé un engagement à cet effet.
Note marginale :Préavis
(3) Le ministre, avant de refuser de modifier la licence, envoie au distributeur autorisé un préavis motivé l’informant qu’il peut présenter ses observations à cet égard.
- DORS/2004-238, art. 36
- DORS/2010-222, art. 32
- DORS/2019-171, art. 22
Changements exigeant une approbation préalable du ministre
Note marginale :Demande
J.01.026 (1) Le distributeur autorisé doit obtenir l’approbation du ministre, en lui présentant une demande écrite, avant de procéder à l’un des changements suivants :
a) toute modification ayant une incidence sur les mesures de sécurité mises en place à l’installation précisée dans sa licence;
b) le remplacement du responsable principal;
c) le remplacement du responsable qualifié;
d) le remplacement ou l’adjonction de tout responsable qualifié suppléant.
Note marginale :Renseignements et documents
(2) Le distributeur autorisé fournit au ministre, pour tout changement visé au paragraphe (1), ce qui suit :
a) les précisions concernant la modification ayant une incidence sur les mesures de sécurité mises en place à l’installation précisée dans sa licence;
b) s’agissant du responsable principal :
(i) les renseignements visés à l’alinéa J.01.014(1)c),
(ii) la déclaration visée à l’alinéa J.01.014(2)b) et les documents visés aux alinéas J.01.014(2)c) et d);
c) s’agissant du responsable qualifié ou d’un responsable qualifié suppléant :
(i) les renseignements visés à l’alinéa J.01.014(1)d),
(ii) les déclarations visées aux alinéas J.01.014(2)b) et e) ainsi que les documents visés aux alinéas J.01.014(2)c), d) et f).
Note marginale :Renseignements et documents complémentaires
(3) Le distributeur autorisé fournit au ministre, au plus tard à la date précisée dans la demande écrite de celui-ci à cet effet, tout renseignement ou document que le ministre juge nécessaire pour compléter l’examen de la demande d’approbation de changement.
- DORS/2004-238, art. 37
- DORS/2019-171, art. 22
Note marginale :Approbation
J.01.027 (1) Le ministre, au terme de l’examen de la demande d’approbation de changement et sous réserve de l’article J.01.028, approuve le changement.
Note marginale :Conditions
(2) Le ministre peut, lorsqu’il approuve le changement, ajouter toute condition à la licence de distributeur autorisé, en modifier les conditions ou supprimer l’une de celles-ci s’il a des motifs raisonnables de le croire nécessaire pour atteindre l’une des fins suivantes :
a) le respect d’une obligation internationale;
b) la conformité aux exigences associées au niveau de sécurité précisé dans la licence;
c) la réduction d’un risque d’atteinte à la sécurité ou à la santé publiques, notamment le risque de détournement d’une drogue d’usage restreint vers un marché ou un usage illicites.
- DORS/2004-238, art. 38
- DORS/2010-222, art. 33
- DORS/2019-171, art. 22
Note marginale :Refus
J.01.028 (1) Le ministre refuse d’approuver le changement dans les cas suivants :
a) dans les dix années précédant la présentation de la demande d’approbation de changement, le responsable principal, le responsable qualifié ou tout responsable qualifié suppléant proposé a fait l’objet d’une condamnation visée aux sous-alinéas J.01.013a)(i) ou b)(i) ou s’est vu imposer une peine visée aux sous-alinéas J.01.013a)(ii) ou b)(ii);
b) soit le distributeur autorisé ne s’est pas conformé aux exigences prévues au paragraphe J.01.026(3), soit il s’y est conformé, mais les renseignements ou documents fournis sont insuffisants pour terminer l’examen de la demande d’approbation de changement;
c) le ministre a des motifs raisonnables de croire que le distributeur autorisé a fourni, dans sa demande d’approbation de changement ou à l’appui de celle-ci, des renseignements faux ou trompeurs ou des documents faux ou falsifiés;
d) le ministre a des motifs raisonnables de croire que le changement risquerait vraisemblablement de porter atteinte à la sécurité ou à la santé publiques, notamment en raison du risque de détournement d’une drogue d’usage restreint vers un marché ou un usage illicites.
Note marginale :Exception
(2) Le ministre ne peut, dans le cas visé à l’alinéa (1)c), refuser d’approuver le changement si le distributeur autorisé a pris les mesures correctives nécessaires pour veiller à respecter la Loi, la Loi sur le cannabis et leurs règlements ou a signé un engagement à cet effet, sauf s’il a des motifs raisonnables de croire que le refus est nécessaire pour protéger la sécurité ou la santé publiques, notamment pour prévenir le détournement d’une drogue d’usage restreint vers un marché ou un usage illicites.
Note marginale :Préavis
(3) Le ministre, avant de refuser d’approuver le changement, envoie au distributeur autorisé un préavis motivé l’informant qu’il peut présenter ses observations à cet égard.
- DORS/2015-210, art. 3
- DORS/2018-85, art. 2
- DORS/2019-171, art. 22
Changements exigeant un avis au ministre
Note marginale :Avis préalable
J.01.029 (1) Le distributeur autorisé avise le ministre par écrit de faire avant l’un des changements suivants :
a) la fabrication ou l’assemblage d’un produit ou d’un composé qui ne figure pas sur la plus récente version de la liste visée à l’alinéa J.01.014(1)f) qui a été présentée au ministre;
b) la modification d’un produit ou d’un composé qui figure sur cette liste, si la modification a une incidence sur les renseignements déjà fournis à son égard.
Note marginale :Renseignements et liste
(2) L’avis contient les précisions visées à l’alinéa J.01.014(1)f) qui sont nécessaires pour mettre à jour la liste et est accompagné de la version révisée de celle-ci.
Note marginale :Avis — cinq jours
J.01.030 Le distributeur autorisé avise le ministre par écrit du fait que le responsable qualifié ou tout responsable qualifié suppléant cesse d’exercer cette fonction dans les cinq jours suivant la cessation.
Note marginale :Avis — dix jours
J.01.031 (1) Le distributeur autorisé avise le ministre par écrit de l’un des changements ci-après dans les dix jours suivant celui-ci :
a) le responsable principal cesse d’exercer cette fonction;
b) le distributeur autorisé cesse de fabriquer ou d’assembler un produit ou un composé qui figure sur la plus récente version de la liste visée à l’alinéa J.01.014(1)f) qui a été présentée au ministre.
Note marginale :Renseignements et liste
(2) L’avis prévu à l’alinéa (1)b) contient les précisions visées à l’alinéa J.01.014(1)f) qui font l’objet du changement et est accompagné de la version révisée de la liste.
Note marginale :Avis — cessation des opérations
J.01.032 (1) Le distributeur autorisé qui entend cesser les opérations à son installation avant l’expiration de sa licence ou à l’expiration de celle-ci en avise le ministre par écrit au moins trente jours avant la cessation.
Note marginale :Contenu de l’avis
(2) L’avis est signé et daté par le responsable principal et contient les renseignements suivants :
a) la date prévue de la cessation des opérations à l’installation;
b) la description de la façon dont le distributeur autorisé disposera de la totalité des drogues d’usage restreint restant à l’installation à cette date, notamment les précisions suivantes :
(i) dans le cas où elles seront en tout ou en partie vendues ou fournies à un autre distributeur autorisé qui effectuera des opérations à la même installation, le nom de celui-ci,
(ii) dans le cas où elles seront en tout ou en partie vendues ou fournies à un autre distributeur autorisé qui n’effectuera pas d’opérations à la même installation, le nom de celui-ci et l’adresse municipale de son installation,
(iii) dans le cas où elles seront en tout ou en partie détruites, la date de la destruction et l’adresse municipale du lieu de la destruction;
c) l’adresse municipale du lieu où les documents du distributeur autorisé seront conservés après la cessation des opérations;
d) les nom, adresse municipale, numéro de téléphone et, le cas échéant, l’adresse électronique de la personne que le ministre pourra contacter après la cessation des opérations pour obtenir plus amples renseignements.
Note marginale :Mise à jour
(3) Une fois que les opérations ont cessé, le distributeur autorisé présente au ministre une mise à jour détaillée, signée et datée par le responsable principal, des renseignements visés au paragraphe (2), s’ils diffèrent de ceux indiqués sur l’avis.
- DORS/2004-238, art. 39
- DORS/2019-171, art. 22
J.01.032.1 [Abrogé, DORS/2019-171, art. 22]
Changement des conditions de la licence
Note marginale :Ajout ou modification de conditions
J.01.033 (1) Le ministre peut, à un moment autre que celui de la délivrance, du renouvellement ou de la modification de la licence du distributeur autorisé, ajouter toute condition à la licence ou en modifier les conditions s’il a des motifs raisonnables de le croire nécessaire pour atteindre l’une des fins suivantes :
a) le respect d’une obligation internationale;
b) la conformité aux exigences associées au niveau de sécurité précisé dans la licence;
c) la réduction d’un risque d’atteinte à la sécurité ou à la santé publiques, notamment le risque de détournement d’une drogue d’usage restreint vers un marché ou un usage illicites.
Note marginale :Préavis
(2) Le ministre, avant d’ajouter une condition à la licence ou d’en modifier les conditions, envoie au distributeur autorisé un préavis motivé l’informant qu’il peut présenter ses observations à cet égard.
Note marginale :Urgence
(3) Malgré le paragraphe (2), le ministre peut ajouter toute condition à la licence ou en modifier les conditions sans préavis s’il a des motifs raisonnables de le croire nécessaire pour protéger la sécurité ou la santé publiques, notamment pour prévenir le détournement d’une drogue d’usage restreint vers un marché ou un usage illicites.
Note marginale :Urgence — avis
(4) L’ajout ou la modification d’une condition en vertu du paragraphe (3) prend effet dès que le ministre envoie au distributeur autorisé un avis à cet égard qui contient les précisions suivantes :
a) les motifs de l’ajout ou de la modification;
b) le fait que le distributeur autorisé a la possibilité de présenter ses observations à cet égard;
c) les mesures correctives à prendre et le délai accordé à cette fin, s’il y a lieu.
- DORS/99-125, art. 8
- DORS/2004-238, art. 40
- DORS/2018-69, art. 67 et 69
- DORS/2019-171, art. 22
J.01.033.1 [Abrogé, DORS/2019-171, art. 22]
J.01.033.2 [Abrogé, DORS/2019-171, art. 22]
J.01.033.3 [Abrogé, DORS/2019-171, art. 22]
J.01.033.4 [Abrogé, DORS/2019-171, art. 22]
Note marginale :Suppression d’une condition
J.01.034 (1) Le ministre peut supprimer toute condition qu’il ne juge plus nécessaire de la licence de distributeur autorisé.
Note marginale :Avis
(2) La suppression prend effet dès que le ministre envoie un avis de suppression au distributeur autorisé.
Suspension et révocation de la licence
Note marginale :Suspension
J.01.035 (1) Le ministre suspend sans préavis la licence d’un distributeur autorisé s’il a des motifs raisonnables de le croire nécessaire pour protéger la sécurité ou la santé publiques, notamment pour prévenir le détournement d’une drogue d’usage restreint vers un marché ou un usage illicites.
Note marginale :Avis
(2) La suspension prend effet dès que le ministre envoie au distributeur autorisé un avis de suspension qui contient les précisions suivantes :
a) les motifs de la suspension;
b) le fait que le distributeur autorisé a la possibilité de présenter ses observations à cet égard;
c) les mesures correctives à prendre et le délai accordé à cette fin, s’il y a lieu.
Note marginale :Rétablissement de la licence
(3) Le ministre rétablit la licence s’il a des motifs raisonnables de croire que la suspension n’est plus nécessaire.
- DORS/97-228, art. 24
- DORS/2019-171, art. 22
Note marginale :Révocation
J.01.036 (1) Le ministre, sous réserve du paragraphe (2), révoque la licence de distributeur autorisé dans les cas suivants :
a) le distributeur autorisé ne peut plus demander une licence en vertu de l’article J.01.010;
b) le distributeur autorisé lui en fait la demande ou l’informe de la perte, du vol ou de toute utilisation non autorisée de la licence, que celle-ci soit réelle ou potentielle;
c) le distributeur autorisé cesse ses opérations à son installation avant l’expiration de sa licence;
d) le distributeur autorisé ne prend pas les mesures correctives précisées dans un engagement ou un avis;
e) le distributeur autorisé a contrevenu :
(i) soit à une disposition de la Loi, de la Loi sur le cannabis ou de leurs règlements,
(ii) soit à une condition d’une licence ou d’un permis qui lui a été délivré en vertu d’un règlement pris en vertu de la Loi ou qui lui a été délivré en vertu de la Loi sur le cannabis ou de ses règlements;
f) dans les dix années précédant la révocation, le responsable principal, le responsable qualifié ou tout responsable qualifié suppléant a fait l’objet d’une condamnation visée aux sous-alinéas J.01.013a)(i) ou b)(i) ou s’est vu imposer une peine visée aux sous-alinéas J.01.013a)(ii) ou b)(ii);
g) le ministre a des motifs raisonnables de croire que le distributeur autorisé a fourni, dans toute demande relative à la licence ou à l’appui de celle-ci, des renseignements faux ou trompeurs ou des documents faux ou falsifiés;
h) le ministre a des motifs raisonnables de croire, sur le fondement de renseignements reçus d’une autorité compétente ou de l’Organisation des Nations Unies, que le distributeur autorisé a participé au détournement d’une drogue d’usage restreint vers un marché ou un usage illicites.
Note marginale :Exceptions
(2) Le ministre ne peut, dans les cas visés aux alinéas (1)e) ou g), révoquer la licence si le distributeur autorisé remplit les conditions ci-après, sauf s’il a des motifs raisonnables de croire que la révocation est nécessaire pour protéger la sécurité ou la santé publiques, notamment pour prévenir le détournement d’une drogue d’usage restreint vers un marché ou un usage illicites :
a) le distributeur autorisé n’a pas d’antécédents de contravention à la Loi, à la Loi sur le cannabis ou à leurs règlements;
b) il a soit pris les mesures correctives nécessaires pour veiller à respecter la Loi, la Loi sur le cannabis et leurs règlements, soit signé un engagement à cet effet.
Note marginale :Préavis
(3) Le ministre, avant de révoquer la licence, envoie au distributeur autorisé un préavis motivé l’informant qu’il peut présenter ses observations à cet égard.
- DORS/97-228, art. 25
- DORS/2019-171, art. 22
Note marginale :Retour de la licence
J.01.037 Le distributeur autorisé retourne au ministre l’original de la licence dans les quinze jours suivant la date de prise d’effet de la révocation.
- DORS/2018-85, art. 3
- DORS/2019-171, art. 22
Permis d’importation
Note marginale :Demande
J.01.038 (1) Le distributeur autorisé présente au ministre, pour chaque importation prévue de drogues d’usage restreint, une demande de permis d’importation qui contient les renseignements suivants :
a) ses nom, adresse municipale et numéro de licence de distributeur autorisé;
b) les précisions ci-après concernant la drogue d’usage restreint qu’il prévoit d’importer :
(i) son nom, tel qu’il figure sur la licence de distributeur autorisé,
(ii) s’agissant d’un sel, son nom,
(iii) sa quantité,
(iv) s’agissant d’une matière première, son degré de pureté et son contenu anhydre;
c) si la drogue d’usage restreint est contenue dans un produit qu’il prévoit d’importer, les précisions ci-après concernant ce produit :
(i) sa marque nominative,
(ii) l’identification numérique qui lui a été attribuée aux termes de l’article C.01.014.2, s’il y a lieu,
(iii) la concentration de la drogue d’usage restreint qu’il contient dans chacune de ses unités, le nombre d’unités par emballage et le nombre d’emballages;
d) les nom et adresse municipale, dans le pays d’exportation, de l’exportateur duquel il obtient la drogue d’usage restreint;
e) le nom du bureau de douane où est prévue l’importation;
f) les modes de transport prévus et chaque pays de transit ou de transbordement prévu.
Note marginale :Signature et attestation
(2) La demande satisfait aux exigences suivantes :
a) elle est signée et datée par le responsable qualifié ou un responsable qualifié suppléant;
b) elle comprend une attestation de celui-ci portant qu’à sa connaissance tous les renseignements fournis à l’appui de la demande sont exacts et complets.
Note marginale :Renseignements et documents complémentaires
(3) Le distributeur autorisé fournit au ministre, au plus tard à la date précisée dans la demande écrite de celui-ci à cet effet, tout renseignement ou document que le ministre juge nécessaire pour compléter l’examen de la demande de permis d’importation.
Note marginale :Délivrance
J.01.039 Le ministre, au terme de l’examen de la demande de permis d’importation et sous réserve de l’article J.01.042, délivre au distributeur autorisé un permis d’importation qui contient les renseignements suivants :
a) le numéro du permis;
b) les renseignements visés au paragraphe J.01.038(1);
c) la date de prise d’effet du permis;
d) la date d’expiration du permis, qui correspond à celle des dates ci-après qui est antérieure aux autres :
(i) la date précisée par le ministre, qui ne peut être postérieure au cent quatre-vingtième jour suivant sa date de prise d’effet,
(ii) la date d’expiration de la licence du distributeur autorisé;
e) toute condition que le ministre estime nécessaire, sur le fondement de motifs raisonnables, pour atteindre l’une des fins suivantes :
(i) le respect d’une obligation internationale,
(ii) la réduction d’un risque d’atteinte à la sécurité ou à la santé publiques, notamment le risque de détournement d’une drogue d’usage restreint vers un marché ou un usage illicites.
Note marginale :Validité
J.01.040 Le permis d’importation est valide jusqu’à celle des dates ci-après qui est antérieure aux autres :
a) la date d’expiration qui y est indiquée;
b) la date de sa suspension ou de sa révocation, au titre des articles J.01.045 ou J.01.046;
c) la date de suspension ou de révocation, au titre des articles J.01.035 ou J.01.036, de la licence du distributeur autorisé;
d) la date de suspension ou de révocation du permis d’exportation délivré par l’autorité compétente du pays d’exportation à l’égard de la drogue d’usage restreint à importer.
Note marginale :Retour du permis
J.01.041 Le distributeur autorisé dont le permis d’importation expire retourne l’original de celui-ci au ministre dans les quinze jours suivant la date d’expiration.
Note marginale :Refus
J.01.042 (1) Le ministre refuse de délivrer un permis d’importation dans les cas suivants :
a) la licence du distributeur autorisé ne l’autorise pas à importer la drogue d’usage restreint visée ou elle expirera avant la date d’importation;
b) le ministre a des motifs raisonnables de croire que l’importation entraînerait la violation d’une obligation internationale;
c) le distributeur autorisé n’a pas mis en place à l’installation les mesures de sécurité prévues dans la Directive en matière de sécurité à l’égard de l’importation;
d) soit le distributeur autorisé ne s’est pas conformé aux exigences prévues au paragraphe J.01.038(3), soit il s’y est conformé, mais les renseignements ou documents fournis sont insuffisants pour terminer l’examen de la demande de permis;
e) le ministre a des motifs raisonnables de croire que le distributeur autorisé a fourni, dans sa demande de permis ou à l’appui de celle-ci, des renseignements faux ou trompeurs ou des documents faux ou falsifiés;
f) le distributeur autorisé a été avisé que la demande de renouvellement de sa licence de distributeur autorisé ou la demande de modification de celle-ci sera refusée;
g) le ministre a des motifs raisonnables de croire que l’importation contreviendrait aux règles de droit du pays d’exportation, de tout pays de transit ou de tout pays de transbordement;
h) le ministre a des motifs raisonnables de croire que la délivrance du permis risquerait vraisemblablement de porter atteinte à la sécurité ou à la santé publiques, notamment en raison du risque de détournement d’une drogue d’usage restreint vers un marché ou un usage illicites.
Note marginale :Préavis
(2) Le ministre, avant de refuser de délivrer le permis d’importation, envoie au distributeur autorisé un préavis motivé l’informant qu’il peut présenter ses observations à cet égard.
Note marginale :Production d’une copie du permis
J.01.043 Le titulaire du permis d’importation en produit une copie au bureau de douane lors de l’importation.
Note marginale :Déclaration
J.01.044 Le titulaire du permis d’importation fournit au ministre, dans les quinze jours suivant la date du dédouanement de la drogue d’usage restreint visée par le permis conformément à la Loi sur les douanes, une déclaration comprenant les renseignements suivants :
a) son nom ainsi que les numéros de sa licence de distributeur autorisé et de son permis d’importation relatifs à la drogue d’usage restreint;
b) les précisions ci-après concernant la drogue d’usage restreint :
(i) son nom, tel qu’il figure sur la licence de distributeur autorisé,
(ii) s’agissant d’un sel, son nom,
(iii) sa quantité;
c) si la drogue d’usage restreint est contenue dans un produit qu’il a importé, les précisions ci-après concernant ce produit :
(i) sa marque nominative,
(ii) l’identification numérique qui lui a été attribuée aux termes de l’article C.01.014.2, s’il y a lieu,
(iii) la concentration de la drogue d’usage restreint qu’il contient dans chacune de ses unités, le nombre d’unités par emballage et le nombre d’emballages;
d) le nom du bureau de douane où a eu lieu le dédouanement et la date de celui-ci.
Note marginale :Suspension
J.01.045 (1) Le ministre suspend sans préavis le permis d’importation dans les cas suivants :
a) la licence du distributeur autorisé est suspendue;
b) il a des motifs raisonnables de le croire nécessaire pour protéger la sécurité ou la santé publiques, notamment pour prévenir le détournement d’une drogue d’usage restreint vers un marché ou un usage illicites;
c) l’importation contreviendrait aux règles de droit du pays d’exportation, de tout pays de transit ou de tout pays de transbordement.
Note marginale :Avis
(2) La suspension prend effet dès que le ministre envoie au distributeur autorisé un avis de suspension qui contient les précisions suivantes :
a) les motifs de la suspension;
b) le fait que le distributeur autorisé a la possibilité de présenter ses observations à cet égard;
c) les mesures correctives à prendre et le délai accordé à cette fin, s’il y a lieu.
Note marginale :Rétablissement du permis
(3) Le ministre rétablit le permis d’importation s’il a des motifs raisonnables de croire que la suspension n’est plus nécessaire.
Note marginale :Révocation
J.01.046 (1) Le ministre, sous réserve du paragraphe (2), révoque le permis d’importation dans les cas suivants :
a) le distributeur autorisé lui en fait la demande ou l’informe de la perte, du vol ou de toute utilisation non autorisée du permis, que celle-ci soit réelle ou potentielle;
b) le distributeur autorisé ne prend pas les mesures correctives précisées par le ministre en vertu de l’alinéa J.01.045(2)c) dans le délai imparti;
c) le distributeur autorisé a contrevenu à une condition de son permis;
d) le ministre a des motifs raisonnables de croire que le distributeur autorisé a fourni, dans sa demande de permis ou à l’appui de celle-ci, des renseignements faux ou trompeurs ou des documents faux ou falsifiés;
e) le ministre a des motifs raisonnables de croire, sur le fondement de renseignements reçus d’une autorité compétente ou de l’Organisation des Nations Unies, que le distributeur autorisé a participé au détournement d’une drogue d’usage restreint vers un marché ou un usage illicites;
f) la licence du distributeur autorisé a été révoquée.
Note marginale :Exceptions
(2) Le ministre ne peut, dans les cas visés aux alinéas (1)d) ou J.01.036(1)e) ou g), révoquer le permis d’importation si le distributeur autorisé remplit les conditions ci-après, sauf s’il a des motifs raisonnables de croire que la révocation est nécessaire pour protéger la sécurité ou la santé publiques, notamment pour prévenir le détournement d’une drogue d’usage restreint vers un marché ou un usage illicites :
a) le distributeur autorisé n’a pas d’antécédents de contravention à la Loi, à la Loi sur le cannabis ou à leurs règlements;
b) il a soit pris les mesures correctives nécessaires pour veiller à respecter la Loi, la Loi sur le cannabis et leurs règlements, soit signé un engagement à cet effet.
Note marginale :Préavis
(3) Le ministre, avant de révoquer le permis d’importation, envoie au distributeur autorisé un préavis motivé l’informant qu’il peut présenter ses observations à cet égard.
Note marginale :Retour du permis
J.01.047 Le distributeur autorisé retourne au ministre l’original du permis d’importation dans les quinze jours suivant la date de prise d’effet de la révocation.
Permis d’exportation
Note marginale :Demande
J.01.048 (1) Le distributeur autorisé présente au ministre, pour chaque exportation prévue de drogues d’usage restreint, une demande de permis d’exportation qui contient les renseignements et documents suivants :
a) ses nom, adresse municipale et numéro de licence de distributeur autorisé;
b) les précisions ci-après concernant la drogue d’usage restreint qu’il prévoit d’exporter :
(i) son nom, tel qu’il figure sur la licence de distributeur autorisé,
(ii) s’agissant d’un sel, son nom,
(iii) sa quantité,
(iv) s’agissant d’une matière première, son degré de pureté et son contenu anhydre;
c) si la drogue d’usage restreint est contenue dans un produit qu’il prévoit d’exporter, les précisions ci-après concernant ce produit :
(i) sa marque nominative,
(ii) l’identification numérique qui lui a été attribuée aux termes de l’article C.01.014.2, s’il y a lieu,
(iii) la concentration de la drogue d’usage restreint qu’il contient dans chacune de ses unités, le nombre d’unités par emballage et le nombre d’emballages;
d) les nom et adresse municipale, dans le pays de destination finale, de l’importateur;
e) le nom du bureau de douane où est prévue l’exportation;
f) les modes de transport prévus et chaque pays de transit ou de transbordement prévu;
g) une copie du permis d’importation délivré par l’autorité compétente du pays de destination finale précisant le nom de l’importateur et l’adresse municipale de son installation située dans ce pays.
Note marginale :Signature et attestation
(2) La demande satisfait aux exigences suivantes :
a) elle est signée et datée par le responsable qualifié ou un responsable qualifié suppléant;
b) elle comprend une attestation de celui-ci portant sur les faits suivants :
(i) à sa connaissance, l’exportation prévue ne contrevient à aucune règle de droit du pays de destination finale, de tout pays de transit ou de tout pays de transbordement,
(ii) à sa connaissance, tous les renseignements et documents fournis à l’appui de la demande sont exacts et complets.
Note marginale :Renseignements et documents complémentaires
(3) Le distributeur autorisé fournit au ministre, au plus tard à la date précisée dans la demande écrite de celui-ci à cet effet, tout renseignement ou document que le ministre juge nécessaire pour compléter l’examen de la demande de permis d’exportation.
Note marginale :Délivrance
J.01.049 Le ministre, au terme de l’examen de la demande de permis d’exportation et sous réserve de l’article J.01.052, délivre au distributeur autorisé un permis d’exportation qui contient les renseignements suivants :
a) le numéro du permis;
b) les renseignements visés aux alinéas J.01.048(1)a) à f);
c) la date de prise d’effet du permis;
d) la date d’expiration du permis, qui correspond à celle des dates ci-après qui est antérieure aux autres :
(i) la date précisée par le ministre, qui ne peut être postérieure au cent quatre-vingtième jour suivant sa date de prise d’effet,
(ii) la date d’expiration de la licence du distributeur autorisé,
(iii) la date d’expiration du permis d’importation délivré par l’autorité compétente du pays de destination finale;
e) toute condition que le ministre estime nécessaire, sur le fondement de motifs raisonnables, pour atteindre l’une des fins suivantes :
(i) le respect d’une obligation internationale,
(ii) la réduction d’un risque d’atteinte à la sécurité ou à la santé publiques, notamment le risque de détournement d’une drogue d’usage restreint vers un marché ou un usage illicites.
Note marginale :Validité
J.01.050 Le permis d’exportation est valide jusqu’à celle des dates ci-après qui est antérieure aux autres :
a) la date d’expiration qui y est indiquée;
b) la date de sa suspension ou de sa révocation au titre des articles J.01.055 ou J.01.056;
c) la date de suspension ou de révocation, au titre des articles J.01.035 ou J.01.036, de la licence du distributeur autorisé;
d) la date d’expiration, de suspension ou de révocation du permis d’importation délivré par l’autorité compétente du pays de destination finale à l’égard de la drogue d’usage restreint à exporter.
Note marginale :Retour du permis
J.01.051 Le distributeur autorisé dont le permis d’exportation expire retourne l’original de celui-ci au ministre dans les quinze jours suivant la date d’expiration.
Note marginale :Refus
J.01.052 (1) Le ministre refuse de délivrer un permis d’exportation dans les cas suivants :
a) la licence du distributeur autorisé ne l’autorise pas à exporter la drogue d’usage restreint visée ou elle expirera avant la date d’exportation;
b) le ministre a des motifs raisonnables de croire que l’exportation entraînerait la violation d’une obligation internationale;
c) soit le distributeur autorisé ne s’est pas conformé aux exigences prévues au paragraphe J.01.048(3), soit il s’y est conformé, mais les renseignements ou documents fournis sont insuffisants pour terminer l’examen de la demande de permis;
d) le ministre a des motifs raisonnables de croire que le distributeur autorisé a fourni, dans sa demande de permis ou à l’appui de celle-ci, des renseignements faux ou trompeurs ou des documents faux ou falsifiés;
e) le distributeur autorisé a été avisé que la demande de renouvellement de sa licence de distributeur autorisé ou la demande de modification de celle-ci sera refusée;
f) le ministre a des motifs raisonnables de croire que l’exportation ne serait pas conforme au permis d’importation délivré par l’autorité compétente du pays de destination finale;
g) le ministre a des motifs raisonnables de croire que l’exportation contreviendrait aux règles de droit du pays de destination finale, de tout pays de transit ou de tout pays de transbordement;
h) le ministre a des motifs raisonnables de croire que la délivrance du permis risquerait vraisemblablement de porter atteinte à la sécurité ou à la santé publiques, notamment en raison du risque de détournement d’une drogue d’usage restreint vers un marché ou un usage illicites.
Note marginale :Préavis
(2) Le ministre, avant de refuser de délivrer le permis d’exportation, envoie au distributeur autorisé un préavis motivé l’informant qu’il peut présenter ses observations à cet égard.
Note marginale :Production d’une copie du permis
J.01.053 Le titulaire du permis d’exportation en produit une copie au bureau de douane lors de l’exportation.
Note marginale :Déclaration
J.01.054 Le titulaire du permis d’exportation fournit au ministre, dans les quinze jours suivant la date d’exportation de la drogue d’usage restreint visée par le permis, une déclaration comprenant les renseignements suivants :
a) son nom ainsi que les numéros de sa licence de distributeur autorisé et du permis d’exportation relatifs à la drogue d’usage restreint;
b) les précisions ci-après concernant la drogue d’usage restreint :
(i) son nom, tel qu’il figure sur la licence de distributeur autorisé,
(ii) s’agissant d’un sel, son nom,
(iii) sa quantité;
c) si la drogue d’usage restreint est contenue dans un produit qu’il a exporté, les précisions ci-après concernant ce produit :
(i) sa marque nominative,
(ii) l’identification numérique qui lui a été attribuée aux termes de l’article C.01.014.2, s’il y a lieu,
(iii) la concentration de la drogue d’usage restreint qu’il contient dans chacune de ses unités, le nombre d’unités par emballage et le nombre d’emballages;
d) le nom du bureau de douane où a eu lieu l’exportation et la date de celle-ci.
Note marginale :Suspension
J.01.055 (1) Le ministre suspend sans préavis le permis d’exportation dans les cas suivants :
a) la licence du distributeur autorisé est suspendue;
b) il a des motifs raisonnables de le croire nécessaire pour protéger la sécurité ou la santé publiques, notamment pour prévenir le détournement d’une drogue d’usage restreint vers un marché ou un usage illicites;
c) l’exportation contreviendrait aux règles de droit du pays de destination finale, de tout pays de transit ou de tout pays de transbordement.
Note marginale :Avis
(2) La suspension prend effet dès que le ministre envoie au distributeur autorisé un avis de suspension qui contient les précisions suivantes :
a) les motifs de la suspension;
b) le fait que le distributeur autorisé a la possibilité de présenter ses observations à cet égard;
c) les mesures correctives à prendre et le délai accordé à cette fin, s’il y a lieu.
Note marginale :Rétablissement du permis
(3) Le ministre rétablit le permis d’exportation s’il a des motifs raisonnables de croire que la suspension n’est plus nécessaire.
Note marginale :Révocation
J.01.056 (1) Le ministre, sous réserve du paragraphe (2), révoque le permis d’exportation dans les cas suivants :
a) le distributeur autorisé lui en fait la demande ou l’informe de la perte, du vol ou de toute utilisation non autorisée du permis, que celle-ci soit réelle ou potentielle;
b) le distributeur autorisé ne prend pas les mesures correctives précisées par le ministre en vertu de l’alinéa J.01.055(2)c) dans le délai imparti;
c) le distributeur autorisé a contrevenu à une condition de son permis;
d) le ministre a des motifs raisonnables de croire que le distributeur autorisé a fourni, dans sa demande de permis ou à l’appui de celle-ci, des renseignements faux ou trompeurs ou des documents faux ou falsifiés;
e) le ministre a des motifs raisonnables de croire, sur le fondement de renseignements reçus d’une autorité compétente ou de l’Organisation des Nations Unies, que le distributeur autorisé a participé au détournement d’une drogue d’usage restreint vers un marché ou un usage illicites;
f) la licence du distributeur autorisé a été révoquée.
Note marginale :Exceptions
(2) Le ministre ne peut, dans les cas visés aux alinéas (1)d) ou J.01.036(1)e) ou g), révoquer le permis d’exportation si le distributeur autorisé remplit les conditions ci-après, sauf s’il a des motifs raisonnables de croire que la révocation est nécessaire pour protéger la sécurité ou la santé publiques, notamment pour prévenir le détournement d’une drogue d’usage restreint vers un marché ou un usage illicites;
a) le distributeur autorisé n’a pas d’antécédents de contravention à la Loi, à la Loi sur le cannabis ou à leurs règlements;
b) il a soit pris les mesures correctives nécessaires pour veiller à respecter la Loi, la Loi sur le cannabis et leurs règlements, soit signé un engagement à cet effet.
Note marginale :Préavis
(3) Le ministre, avant de révoquer le permis d’exportation, envoie au distributeur autorisé un préavis motivé l’informant qu’il peut présenter ses observations à cet égard.
Note marginale :Retour du permis
J.01.057 Le distributeur autorisé retourne au ministre l’original du permis d’exportation dans les quinze jours suivant la date de prise d’effet de la révocation.
Identification
Note marginale :Nom
J.01.058 Le distributeur autorisé veille à ce que son nom, tel qu’il apparaît sur sa licence, figure sur tout ce qu’il utilise pour s’identifier lors de ses opérations à l’égard des drogues d’usage restreint, notamment les étiquettes, les bons de commande, les documents d’expédition, les factures et les publicités.
Vente de drogues d’usage restreint
Note marginale :Vente à un établissement
J.01.059 (1) Le distributeur autorisé peut, malgré l’article C.08.002 et sous réserve des paragraphes (3) et (4), vendre à un établissement une drogue d’usage restreint à l’une des fins ci-après si celui-ci présente au distributeur ou au ministre une demande à cet effet et que le ministre délivre une autorisation écrite avant la vente :
a) la tenue à l’établissement d’essais cliniques à l’égard de la drogue d’usage restreint par des chercheurs compétents dans le but d’en déterminer les dangers et l’efficacité;
b) la recherche en laboratoire à l’établissement par des chercheurs compétents.
Note marginale :Contenu de la demande
(2) La demande contient les renseignements suivants :
a) les nom et adresse municipale de l’établissement;
b) les noms et qualifications des chercheurs compétents;
c) le nom, la forme et la quantité de la drogue d’usage restreint ainsi que la concentration de la drogue contenue dans chaque unité;
d) les précisions concernant l’utilisation prévue de la drogue d’usage restreint;
e) les nom et adresse municipale du distributeur autorisé prévu pour l’achat de la drogue d’usage restreint.
Note marginale :Demande présentée au distributeur autorisé
(3) Le distributeur autorisé qui reçoit la demande de l’établissement en fournit une copie au ministre.
Note marginale :Autorisation par le ministre
(4) Le ministre, s’il reçoit la demande de l’établissement ou une copie de celle-ci du distributeur autorisé, peut, au terme de l’examen de la demande et sous réserve de toute condition qu’il estime nécessaire sur le fondement de motifs raisonnables, délivrer une autorisation écrite pour l’une des fins suivantes :
a) la vente à l’établissement par le distributeur autorisé de la drogue d’usage restreint demandée, en la forme, quantité et concentration dans chaque unité qu’il précise;
b) la possession de la drogue d’usage restreint par des chercheurs compétents pour leur permettre de faire à l’établissement soit des essais cliniques à l’égard de celle-ci dans le but d’en déterminer les dangers et l’efficacité, soit de la recherche en laboratoire.
Note marginale :Utilisation limitée
(5) L’établissement ne peut utiliser la drogue d’usage restreint que conformément à l’autorisation écrite.
Note marginale :Vente au ministre
J.01.060 Le distributeur autorisé peut vendre ou fournir une drogue d’usage restreint au ministre.
Note marginale :Fourniture à des fins d’identification ou d’analyse
J.01.061 (1) Toute personne peut, malgré toute disposition de la présente partie, fournir ou livrer une drogue d’usage restreint à des fins d’identification ou d’analyse aux personnes suivantes :
a) le médecin;
b) le mandataire d’un médecin, si le mandataire bénéficie d’une exemption relative à la possession de cette drogue à ces fins et accordée en vertu de l’article 56 de la Loi.
Note marginale :Mandataire d’un médecin
(2) Le mandataire d’un médecin qui reçoit la drogue d’usage restreint la fournit ou la livre immédiatement à l’une des personnes suivantes :
a) le médecin;
b) le ministre.
Note marginale :Médecin
(3) Le médecin qui reçoit la drogue d’usage restreint la fournit ou la livre immédiatement à l’une des personnes suivantes :
a) la personne qui bénéficie d’une exemption relative à la possession de cette drogue à ces fins et accordée en vertu de l’article 56 de la Loi si la drogue lui est fournie ou livrée à des fins d’identification ou d’analyse;
b) le ministre.
Emballage, étiquetage et transport
Note marginale :Emballage — vente et fourniture
J.01.062 (1) Le distributeur autorisé qui vend ou fournit une drogue d’usage restreint l’emballe solidement dans un contenant immédiat qui est scellé de telle manière qu’il est impossible de l’ouvrir sans briser le sceau.
Note marginale :Emballage — transport et exportation
(2) Le distributeur autorisé qui transporte ou exporte une drogue d’usage restreint veille à ce que son emballage soit scellé de telle manière qu’il est impossible de l’ouvrir sans briser le sceau.
Note marginale :Exception
(3) Le paragraphe (1) ne s’applique pas au nécessaire d’essai qui contient une drogue d’usage restreint et auquel un numéro d’enregistrement a été attribué.
Note marginale :Étiquetage
J.01.063 (1) Le distributeur autorisé qui vend ou fournit une drogue d’usage restreint veille à ce que l’emballage de la drogue d’usage restreint porte des étiquettes intérieure et extérieure sur lesquelles figurent les renseignements suivants :
a) le nom propre ou, à défaut, le nom de la drogue;
b) la quantité nette du contenu de l’emballage;
c) la concentration de la drogue d’usage restreint contenue dans chaque unité et le nombre d’unités par emballage, le cas échéant;
d) le numéro de lot de la drogue;
e) la mention « Drogue d’usage restreint »;
f) les nom et adresse municipale du fabricant ou de l’assembleur de la drogue.
Note marginale :Exception
(2) Le paragraphe (1) ne s’applique pas au nécessaire d’essai qui contient une drogue d’usage restreint et auquel un numéro d’enregistrement a été attribué.
Note marginale :Non-application
(3) Les exigences concernant l’étiquetage prévues à l’article C.01.004 ne s’appliquent pas aux drogues d’usage restreint.
Note marginale :Transport
J.01.064 Le distributeur autorisé qui prend livraison d’une drogue d’usage restreint qu’il a importée ou qui fait la livraison d’une drogue d’usage restreint satisfait aux exigences suivantes :
a) il prend les mesures nécessaires pour veiller à la sécurité de la drogue d’usage restreint durant son transport;
b) il utilise un moyen de transport qui permet de consigner fidèlement toute manutention de la drogue d’usage restreint ainsi que la signature de toute personne ayant effectué cette manutention pendant la durée du transport, jusqu’à sa livraison au destinataire;
c) s’agissant d’une drogue d’usage restreint importée, il la transporte, après son dédouanement en vertu de la Loi sur les douanes, directement à l’installation précisée dans sa licence;
d) s’agissant d’une drogue d’usage restreint qui doit être exportée, il la transporte directement de l’installation précisée dans sa licence au bureau de douane d’où la drogue sera exportée.
Pertes, vols et transactions douteuses
Note marginale :Mesures de protection — licences et permis
J.01.065 Le distributeur autorisé prend toute mesure nécessaire pour veiller à la sécurité des licences et des permis qui sont en sa possession.
Note marginale :Mesures de protection — drogues d’usage restreint
J.01.066 Les personnes ci-après prennent toute mesure nécessaire pour veiller à la sécurité des drogues d’usage restreint qui sont en leur possession :
a) le distributeur autorisé;
b) l’établissement;
c) le chercheur compétent qui les a en sa possession dans le but de faire des essais cliniques ou de la recherche en laboratoire à un établissement;
d) la personne qui bénéficie d’une exemption relative à la possession de ces drogues d’usage restreint et accordée en vertu de l’article 56 de la Loi.
Note marginale :Pertes et vols — licences et permis
J.01.067 Le distributeur autorisé qui prend connaissance de la perte ou du vol de sa licence ou de son permis fournit un rapport écrit au ministre dans les soixante-douze heures suivantes.
Note marginale :Pertes et vols — drogues d’usage restreint
J.01.068 (1) Toute personne visée à l’article J.01.066 qui prend connaissance de la perte ou du vol de drogues d’usage restreint se conforme, sous réserve du paragraphe (2), aux exigences suivantes :
a) elle fournit un rapport écrit à un membre d’un corps policier dans les vingt-quatre heures suivantes;
b) elle fournit un rapport écrit au ministre dans les soixante-douze heures suivantes et lui confirme que le rapport prévu à l’alinéa a) a été fourni.
Note marginale :Pertes explicables — distributeurs autorisés
(2) Le paragraphe (1) ne s’applique pas au distributeur autorisé qui prend connaissance d’une perte de drogues d’usage restreint pouvant s’expliquer dans le cadre des pratiques d’opération normalement acceptées.
Note marginale :Transactions douteuses
J.01.069 (1) Le distributeur autorisé qui prend connaissance d’une transaction effectuée au cours de ses opérations à l’égard de laquelle il a des motifs raisonnables de soupçonner qu’elle pourrait être liée au détournement d’une drogue d’usage restreint vers un marché ou un usage illicites fournit au ministre, au plus tard soixante-douze heures après en avoir pris connaissance, un rapport écrit contenant les renseignements suivants :
a) ses nom, adresse municipale et numéro de téléphone ainsi que, si le distributeur autorisé est une personne morale, le poste de l’individu ayant fait le rapport;
b) les nom et adresse municipale de l’autre partie à la transaction;
c) les détails de la transaction, notamment ses date et heure, son type, le nom de la drogue d’usage restreint, la quantité en cause et, s’agissant d’un produit ou d’un composé, la quantité de toute drogue d’usage restreint qu’il contient;
d) exception faite d’un nécessaire d’essai, l’identification numérique qui a été attribuée au produit contenant la drogue d’usage restreint aux termes de l’article C.01.014.2, s’il y a lieu;
e) une description détaillée des motifs de ses soupçons.
Note marginale :Bonne foi
(2) Le distributeur autorisé ne peut faire l’objet d’une poursuite civile pour avoir fourni ce rapport de bonne foi.
Note marginale :Non-divulgation
(3) Le distributeur autorisé ne peut, dans l’intention de nuire à une enquête criminelle en cours ou à venir, révéler qu’il a fourni le rapport ou en dévoiler les détails.
Note marginale :Protection partielle contre l’auto-incrimination
J.01.070 Ni le rapport fourni en application de l’un des articles J.01.067 à J.01.069 ni aucune preuve qui en provient ne peuvent être utilisés ou admis pour incriminer le distributeur autorisé dans le cadre de poursuites criminelles intentées contre lui, sauf s’il s’agit de poursuites intentées en vertu des articles 132, 136 ou 137 du Code criminel.
Destruction de drogues d’usage restreint
Note marginale :Destruction à l’installation
J.01.071 Le distributeur autorisé qui prévoit de détruire une drogue d’usage restreint à l’installation précisée dans sa licence veille à ce que les conditions ci-après soient remplies :
a) il obtient au préalable l’approbation du ministre;
b) la destruction est effectuée en présence de deux personnes parmi les suivantes, dont au moins une est visée au sous-alinéa (i) :
(i) le responsable principal, le responsable qualifié ou tout responsable qualifié suppléant,
(ii) une personne qui travaille pour le distributeur autorisé ou qui lui fournit des services et qui occupe un poste de niveau supérieur;
c) la destruction est effectuée selon une méthode conforme à la législation fédérale, provinciale et municipale sur la protection de l’environnement applicable au lieu de destruction;
d) dès la destruction terminée, la personne qui l’a effectuée et les deux personnes visées à l’alinéa b) qui étaient présentes font une déclaration commune signée et datée qui atteste que la drogue d’usage restreint a été complètement détruite, chaque signataire ajoutant à la déclaration son nom en lettres moulées.
Note marginale :Destruction ailleurs qu’à l’installation
J.01.072 Le distributeur autorisé qui prévoit de détruire une drogue d’usage restreint ailleurs qu’à l’installation précisée dans sa licence veille à ce que les conditions ci-après soient remplies :
a) il obtient au préalable l’approbation du ministre;
b) il prend les mesures nécessaires pour veiller à la sécurité de la drogue d’usage restreint durant son transport afin de prévenir le détournement de celle-ci vers un marché ou un usage illicites;
c) la destruction est effectuée par une personne travaillant pour une entreprise spécialisée dans la destruction de marchandises dangereuses et en présence d’une autre personne travaillant pour cette entreprise;
d) la destruction est effectuée selon une méthode conforme à la législation fédérale, provinciale et municipale sur la protection de l’environnement applicable au lieu de destruction;
e) dès la destruction terminée, la personne qui l’a effectuée fournit au distributeur autorisé une déclaration datée qui atteste que la drogue d’usage restreint a été complètement détruite et qui contient les renseignements suivants :
(i) l’adresse municipale du lieu où la destruction a été effectuée,
(ii) le nom et la quantité de la drogue d’usage restreint et, le cas échéant, la marque nominative et la quantité du produit qui en contenait ou le nom et la quantité du composé qui en contenait,
(iii) la méthode de destruction,
(iv) la date de la destruction,
(v) les nom en lettres moulées et signature de cette personne ainsi que de l’autre personne présente lors de la destruction.
Note marginale :Demande d’approbation préalable
J.01.073 (1) Le distributeur autorisé présente au ministre une demande qui contient les renseignements ci-après afin d’obtenir l’approbation préalable de la destruction d’une drogue d’usage restreint :
a) ses nom, adresse municipale et numéro de licence de distributeur autorisé;
b) la date prévue de la destruction;
c) l’adresse municipale du lieu où la destruction sera effectuée;
d) une brève description de la méthode de destruction;
e) si la destruction doit être effectuée à l’installation précisée dans sa licence, le nom des personnes proposées pour l’application de l’alinéa J.01.071b) et des renseignements établissant que celles-ci remplissent les conditions visées à cet alinéa;
f) le nom de la drogue d’usage restreint et, le cas échéant, la marque nominative du produit qui en contient ou le nom du composé qui en contient;
g) la forme et la quantité soit de la drogue d’usage restreint, soit du produit ou du composé qui en contient et, le cas échéant, la concentration de la drogue contenue dans chaque unité, le nombre d’unités par emballage et le nombre d’emballages.
Note marginale :Signature et attestation
(2) La demande satisfait aux exigences suivantes :
a) elle est signée et datée par le responsable qualifié ou un responsable qualifié suppléant;
b) elle comprend une attestation de celui-ci portant sur les faits suivants :
(i) la méthode de destruction prévue est conforme à la législation fédérale, provinciale et municipale sur la protection de l’environnement applicable au lieu de destruction,
(ii) à sa connaissance, tous les renseignements et documents fournis à l’appui de la demande sont exacts et complets.
Note marginale :Renseignements et documents complémentaires
(3) Le distributeur autorisé fournit au ministre, au plus tard à la date précisée dans la demande écrite de celui-ci à cet effet, tout renseignement ou document que le ministre juge nécessaire pour compléter l’examen de la demande d’approbation.
Note marginale :Approbation
J.01.074 Le ministre, au terme de l’examen de la demande d’approbation, approuve la destruction de la drogue d’usage restreint, sauf dans les cas suivants :
a) si la destruction doit être effectuée à l’installation précisée dans la licence du distributeur autorisé, les personnes proposées pour l’application de l’alinéa J.01.071b) ne remplissent pas les conditions visées à cet alinéa;
b) le ministre a des motifs raisonnables de croire que la drogue d’usage restreint ne serait pas détruite;
c) le ministre a des motifs raisonnables de croire que le distributeur autorisé a fourni, dans sa demande d’approbation ou à l’appui de celle-ci, des renseignements faux ou trompeurs ou des documents faux ou falsifiés;
d) la drogue d’usage restreint est, en tout ou en partie, nécessaire dans le cadre d’une enquête criminelle, administrative ou préliminaire, d’un procès ou d’une autre procédure engagée sous le régime d’une loi ou de ses règlements;
e) le ministre a des motifs raisonnables de croire que l’approbation risquerait vraisemblablement de porter atteinte à la sécurité ou à la santé publiques, notamment en raison du risque de détournement de la drogue d’usage restreint vers un marché ou un usage illicites.
Documents
Distributeurs autorisés
Note marginale :Méthode de consignation
J.01.075 Le distributeur autorisé qui consigne des renseignements en application de la présente partie le fait selon une méthode qui en permet la vérification à tout moment.
Note marginale :Renseignements généraux
J.01.076 Le distributeur autorisé consigne les renseignements suivants :
a) le nom, la forme et la quantité de toute drogue d’usage restreint qu’il commande, le nom de la personne qui fait la commande pour son compte et la date de la commande;
b) le nom, la forme et la quantité de toute drogue d’usage restreint qu’il reçoit ainsi que les nom et adresse municipale de la personne qui la lui a vendue ou fournie et la date de réception;
c) s’agissant d’une drogue d’usage restreint qu’il vend ou fournit, les précisions ci-après la concernant :
(i) la marque nominative du produit ou le nom du composé contenant la drogue d’usage restreint et le nom de celle-ci,
(ii) l’identification numérique qui a été attribuée au produit aux termes de l’article C.01.014.2, s’il y a lieu,
(iii) la forme et la quantité de la drogue d’usage restreint et, le cas échéant, la concentration de la drogue contenue dans chaque unité, le nombre d’unités par emballage et le nombre d’emballages,
(iv) les nom et adresse municipale de la personne à laquelle il l’a vendue ou fournie,
(v) la date de la vente ou de la fourniture;
d) le nom, la forme et la quantité de toute drogue d’usage restreint qu’il fabrique ou assemble ainsi que sa date d’entreposage et, le cas échéant, la concentration de la drogue contenue dans chaque unité, le nombre d’unités par emballage et le nombre d’emballages;
e) d’une part, le nom et la quantité de toute drogue d’usage restreint qu’il utilise dans la fabrication ou l’assemblage d’un produit ou d’un composé et, d’autre part, la marque nominative et la quantité de ce produit ou le nom et la quantité de ce composé ainsi que la date d’entreposage;
f) le nom, la forme et la quantité de toute drogue d’usage restreint entreposée à la fin de chaque mois;
g) le nom, la forme et la quantité de toute drogue d’usage restreint qu’il livre, transporte ou expédie, les nom et adresse municipale du destinataire ainsi que la date de la livraison, du transport ou de l’expédition;
h) le nom, la forme et la quantité de toute drogue d’usage restreint qu’il importe, la date de l’importation, les nom et adresse municipale de l’exportateur ainsi que le nom du pays d’exportation et de tout pays de transit ou de transbordement;
i) le nom, la forme et la quantité de toute drogue d’usage restreint qu’il exporte, la date de l’exportation, les noms et adresse municipale de l’importateur ainsi que le nom du pays de destination finale et de tout pays de transit ou de transbordement.
Note marginale :Pertes explicables de drogues d’usage restreint
J.01.077 Le distributeur autorisé qui prend connaissance d’une perte de drogues d’usage restreint pouvant s’expliquer dans le cadre des pratiques d’opération normalement acceptées consigne les renseignements suivants :
a) le nom de chaque drogue d’usage restreint perdue et, le cas échéant, la marque nominative du produit ou le nom du composé qui en contenait;
b) la forme et la quantité de cette drogue d’usage restreint et, le cas échéant, la forme du produit ou du composé qui en contenait, la concentration de la drogue d’usage restreint contenue dans chaque unité, le nombre d’unités par emballage et le nombre d’emballages;
c) la date à laquelle il a pris connaissance de la perte;
d) l’explication de la perte.
Note marginale :Destruction
J.01.078 Le distributeur autorisé consigne les renseignements ci-après concernant toute drogue d’usage restreint qu’il a détruite à l’installation précisée dans sa licence :
a) l’adresse municipale du lieu où la destruction a été effectuée;
b) le nom, la forme et la quantité de la drogue d’usage restreint et, le cas échéant, la marque nominative et la quantité du produit qui en contenait ou le nom et la quantité du composé qui en contenait;
c) la méthode de destruction;
d) la date de la destruction.
Note marginale :Rapport annuel
J.01.079 (1) Le distributeur autorisé fournit au ministre, sous réserve des paragraphes (2) et (3), un rapport annuel contenant les renseignements ci-après dans les trois mois suivant la fin de chaque année civile :
a) le nom, la forme et la quantité totale de chaque drogue d’usage restreint qu’il a reçue, produite, vendue, fournie, importée, exportée ou détruite au cours de l’année civile ainsi que le nom et la quantité totale de chaque drogue d’usage restreint utilisée pour la fabrication ou l’assemblage d’un produit ou d’un composé;
b) le nom, la forme et la quantité de chaque drogue d’usage restreint selon l’inventaire physique établi à la fin de l’année civile à l’installation précisée dans la licence;
c) le nom, la forme et la quantité de chaque drogue d’usage restreint perdue ou volée lors des opérations effectuées au cours de l’année civile.
Note marginale :Non-renouvellement ou révocation dans les trois premiers mois
(2) Le distributeur autorisé dont la licence expire sans être renouvelée ou est révoquée dans les trois premiers mois d’une année civile fournit au ministre les rapports ci-après dans les délais suivants :
a) dans les trois mois suivant la fin de l’année civile précédente, le rapport annuel pour celle-ci;
b) dans les trois mois suivant l’expiration ou la révocation, un rapport pour la période de l’année civile courante durant lesquels la licence était valide contenant les renseignements visés au paragraphe (1), la quantité devant être évaluée selon l’inventaire physique établi à la date d’expiration ou de révocation.
Note marginale :Non-renouvellement ou révocation après le troisième mois
(3) Le distributeur autorisé dont la licence expire sans être renouvelée ou est révoquée après le troisième mois d’une année civile fournit au ministre, dans les trois mois suivant l’expiration ou la révocation, un rapport pour la période de l’année civile durant lesquels la licence était valide contenant les renseignements visés au paragraphe (1), la quantité devant être évaluée selon l’inventaire physique établi à la date d’expiration ou de révocation.
Établissements
Note marginale :Méthode de consignation
J.01.080 L’établissement qui consigne des renseignements en application de la présente partie le fait selon une méthode qui en permet la vérification à tout moment.
Note marginale :Renseignements
J.01.081 L’établissement consigne les renseignements suivants :
a) le nom, la forme et la quantité de toute drogue d’usage restreint qu’il commande, le nom de la personne qui fait la commande pour son compte et la date de la commande;
b) le nom, la forme et la quantité de toute drogue d’usage restreint qu’il reçoit ainsi que les nom et adresse municipale du distributeur autorisé qui la lui a vendue ou fournie et la date de réception;
c) les précisions concernant l’utilisation de toute drogue d’usage restreint dans l’établissement;
d) les nom et qualifications des personnes utilisant toute drogue d’usage restreint dans l’établissement;
e) les données cliniques concernant l’utilisation de toute drogue d’usage restreint reçue par l’établissement.
Drogues reçues à des fins d’identification ou d’analyse
Note marginale :Méthode de consignation
J.01.082 La personne qui consigne des renseignements en application de l’article J.01.083 le fait selon une méthode qui en permet la vérification à tout moment.
Note marginale :Renseignements
J.01.083 La personne qui reçoit une drogue d’usage restreint conformément à l’article J.01.061 consigne les renseignements suivants :
a) le nom, la forme et la quantité de la drogue d’usage restreint ainsi que les nom et adresse municipale de la personne qui la lui a fournie et la date de réception;
b) les précisions concernant l’identification ou l’analyse de la drogue d’usage restreint;
c) le nom des personnes qui ont manipulé la drogue d’usage restreint lors du processus d’identification ou d’analyse de la drogue.
Conservation des documents
Note marginale :Période de conservation
J.01.084 Le distributeur autorisé, l’ancien titulaire d’une licence de distributeur autorisé, l’établissement et la personne visée à l’article J.01.083 conservent tout document comprenant les renseignements consignés en application de la présente partie, notamment chaque déclaration ainsi qu’une copie de chaque rapport, pendant une période de deux ans suivant la date de la dernière consignation et selon une méthode qui permet la vérification du document à tout moment.
Note marginale :Lieu
J.01.085 Les documents sont conservés aux lieux suivants :
a) s’agissant d’un distributeur, à l’installation précisée dans sa licence;
b) s’agissant d’un établissement, à l’établissement;
c) s’agissant d’une personne visée à l’article J.01.083, en un lieu au Canada;
d) s’agissant d’un ancien titulaire d’une licence de distributeur autorisé, en un lieu au Canada.
Note marginale :Caractéristiques des documents
J.01.086 Les documents sont complets ainsi que facilement accessibles et les renseignements qui y figurent sont lisibles et indélébiles.
Préavis de la demande d’ordonnance de restitution
Note marginale :Préavis écrit
J.01.087 (1) Pour l’application du paragraphe 24(1) de la Loi, le préavis de la demande d’ordonnance de restitution qui est donné au procureur général est présenté par écrit et est mis à la poste sous pli recommandé au moins quinze jours avant la date à laquelle la demande sera présentée au juge de paix.
Note marginale :Contenu du préavis
(2) Le préavis contient les renseignements suivants :
a) le nom du juge de paix à qui la demande sera présentée;
b) le lieu et l’heure de l’audition de la demande;
c) les précisions concernant la drogue d’usage restreint ou toute autre chose faisant l’objet de la demande;
d) les éléments de preuve que le demandeur prévoit de présenter pour établir qu’il a le droit de posséder la drogue d’usage restreint ou l’autre chose visée à l’alinéa c).
ANNEXE(articles J.01.001, J.01.002 et J.01.004)
PARTIE I
- 1Les amphétamines suivants, leurs sels, dérivés, isomères et analogues, ainsi que les sels de leurs dérivés, isomères et analogues :
- (1)N-éthylamphétamine (N-éthyl α-méthylbenzèneéthanamine)
- (2)méthyl-4 diméthoxy-2,5 amphétamine (STP) (diméthoxy-2,5 4,α-diméthylbenzèneéthanamine)
- (3)méthylènedioxy-3,4 amphétamine (MDA) (α-méthyl benzodioxole-1,3 éthanamine-5)
- (4)diméthoxy-2,5 amphétamine (diméthoxy-2,5α-méthylbenzèneéthanamine)
- (5)méthoxy-4 amphétamine (méthoxy-4 α-méthylbenzèneéthanamine)
- (6)triméthoxy-2,4,5 amphétamine (triméthoxy-2,4,5 α-méthylbenzèneéthanamine)
- (7)N-méthyl méthylènedioxy-3,4 amphétamine (N,α-diméthyl benzodioxole-1,3 éthanamine-5)
- (8)éthoxy-4 diméthoxy-2,5 amphétamine (éthoxy-4 diméthoxy-2,5 α-méthylbenzèneéthanamine)
- (9)méthoxy-5 méthylènedioxy-3,4 amphétamine (N,α-diméthyl benzodioxole-1,3 éthanamine-5)
- (10)N,N-diméthyl méthylènedioxy-3,4 amphétamine (N,N, α-triméthyl benzodioxole-1,3 éthanamine-5)
- (11)N-éthyl méthylènedioxy-3,4 amphétamine (N-éthyl α-méthyl benzodioxole-1,3 éthanamine-5)
- (12)éthyl-4 diméthoxy-2,5 amphétamine (DOET) (éthyl-4 diméthoxy-2,5α-méthylbenzèneéthanamine)
- (13)bromo-4 diméthoxy-2,5 amphétamine (bromo-4 diméthoxy-2,5 α-méthylbenzèneéthanamine)
- (14)chloro-4 diméthoxy-2,5 amphétamine (chloro-4 diméthoxy-2,5 α-méthylbenzèneéthanamine)
- (15)éthoxy-4 amphétamine (éthoxy-4 α-méthylbenzèneéthanamine)
- (16)N-propyl méthylènedioxy-3,4 amphétamine (α-méthyl N-propyl benzodioxole-1,3 éthanamine)
- (17)N-hydroxy méthylènedioxy-3,4 amphétamine (N-[α-méthyl (méthylènedioxy)-3,4 phénéthyl]hydroxylamine)
- (18)triméthoxy-3,4,5 amphétamine (triméthoxy-3,4,5 α-méthylbenzèneéthanamine)
- 2Diéthylamide de l’acide lysergique (LSD) (N,N-diéthyl-lysergamide) et ses sels
- 3N,N-Diéthyltryptamine (DET) ((diéthylamino-2 éthyl)-3 indole) et ses sels
- 4N,N-Diméthyltryptamine (DMT) ((diméthylamino-2 éthyl)-3 indole) et ses sels
- 5N-Méthyl pipéridyl-3 benzilate (LBJ) ([(hydroxy-diphénylacétyl)oxy]-3 méthyl-1 pipéridine) et ses sels
- 6Harmaline (dihydro-4,9 méthoxy-7 méthyl-1 3H-pyrido(3,4-ß) indole) et ses sels
- 7Harmalol (dihydro-4,9 hydroxy-7 méthyl-1 3H-pyrido(3,4-b) indole) et ses sels
- 8Psilocine ((diméthylamino-2 éthyl)-3 hydroxy-4 indole) et ses sels
- 9Psilocybine ((diméthylamino-2 éthyl)-3 phosphoryloxy-4 indole) et ses sels
- 10N-(Phényl-1 cyclohexyl) éthylamine (PCE) et ses sels
- 11[(Thiényl-2)-1 cyclohexyl]-1 pipéridine (TCP) et ses sels
- 12Phényl-1 N-propylcyclohexanamine et ses sels
- 13Mescaline (triméthoxy-3,4,5 benzèneéthanamine) et ses sels, sauf le peyote (lophophora)
- 14[Abrogé, DORS/2017-250, art. 2]
- 15Méthylamino-2 phényl-1 propanone-1 et ses sels
- 16[Cyclohexyl (phénylméthyl)-1] pipéridine-1 et ses sels
- 17[Cyclohexyl (méthyl-4 phényl)-1] pipéridine-1 et ses sels
- 18Étryptamine ((amino-2 butyl)-3 indole) et ses sels
- 19Rolicyclidine ((phényl-1 cyclohexyl)-1 pyrrolidine) et ses sels
- 20Benzylpipérazine [BZP], à savoir 1-benzylpipérazine et ses sels, isomères et sels d’isomères
- 21Trifluorométhylphénylpipérazine [TFMPP], à savoir 1-(3-trifluorométhylphényl)pipérazine et ses sels, isomères et sels d’isomères
- 22Méthylènedioxypyrovalérone (MDPV), ses sels, dérivés, isomères et analogues, ainsi que les sels de ses dérivés, isomères et analogues
- 23Cathinone (l-α-aminopropiophénone) et ses sels
- 24Les 2C-phénéthylamines, leurs sels, dérivés et isomères, ainsi que les sels de leurs dérivés et isomères, qui répondent à la description chimique suivante :
- toute substance ayant une structure 1-amino-2-phényléthane substituée en positions 2’ et 5’ ou 2’ et 6’ du cycle benzénique par un groupe alcoxy ou halogénoalcoxy, ou substituée à deux atomes de carbone adjacents du cycle benzénique de façon à entraîner la formation d’un groupe furane, dihydrofurane, pyrane, dihydropyrane ou méthylènedioxy — qu’il y ait ou non davantage de substitution sur le cycle benzénique dans quelque mesure que ce soit, qu’il y ait ou non substitution au groupe amino par un ou deux groupes méthyle, éthyle, propyle, isopropyle, hydroxyle, benzyle (ou benzyle substitué dans quelque mesure que ce soit) ou benzylène (ou benzylène substitué dans quelque mesure que ce soit) ou par une combinaison de ceux-ci, et qu’il y ait ou non substitution en position 2-éthyle (carbone bêta) par un groupe hydroxyle, oxo ou alcoxy —, les sels et dérivés de cette substance ainsi que les sels de ses dérivés, notamment :
- (1)4-bromo-2,5-diméthoxy-N-(2-méthoxybenzyle)phénéthylamine (25B-NBOMe)
- (2)4-chloro-2,5-diméthoxy-N-(2-méthoxybenzyle)phénéthylamine (25C-NBOMe)
- (3)4-iodo-2,5-diméthoxy-N-(2-méthoxybenzyle)phénéthylamine (25I-NBOMe)
- (4)4-bromo-2,5-diméthoxybenzèneéthanamine (2C-B)
- 25AH-7921 ((dichloro-3,4 benzamide méthyl)-1 cyclohexyl diméthylamine), ses sels et isomères, ainsi que les sels de ses isomères
- 26MT-45 (cyclohexyl-1(diphényl-1,2 éthyl)-4 pipérazine), ses sels, dérivés, isomères et analogues, ainsi que les sels de ses dérivés, isomères et analogues, notamment :
- (1)diphénidine (DEP) (1-(1,2-diphényléthyl)pipéridine)
- (2)méthoxphénidine (2-MeO-Diphénidine, MXP) (1- [1-(2-méthoxyphényl)-2-phényléthyl] pipéridine)
- (3)éphénidine (NEDPA, EPE) (N-éthyl-1,2-diphényléthylamine)
- (4)isophénidine (NPDPA) (N-isopropyl-1,2-diphényléthylamine)
- mais non compris :
- (5)léfétamine ((-)-N,N-diméthyl-α-phénylbenzèneéthanamine), ses sels, dérivés et isomères, ainsi que les sels de ses dérivés et isomères
- 27W-18 (4-chloro-N-[1- [2- (4-nitrophényl) éthyl] -2-pipéridinylidène] benzènesulfonamide), ses sels, dérivés, isomères et analogues, ainsi que les sels de ses dérivés, isomères et analogues
- 28U-47700 (3,4-dichloro-N-(2-(diméthylamino)cyclohexyl)-N-méthylbenzamide) et ses sels, isomères, dérivés et analogues, ainsi que les sels de ses isomères, dérivés et analogues, notamment :
- (1)Bromadoline (4-bromo-N-(2-(diméthylamino)cyclohexyl)benzamide)
- (2)U-47109 (3,4-dichloro-N-(2-(diméthylamino)cyclohexyl)benzamide)
- (3)U-48520 (4-chloro-N-(2-(diméthylamino)cyclohexyl)-N-méthylbenzamide)
- (4)U-50211 (N-(2-(diméthylamino)cyclohexyl)-4-hydroxy-N-méthylbenzamide)
- (5)U-77891 (3,4-dibromo-N-méthyl-N-(1-méthyl-1-azaspiro[4.5]déc-6-yl)benzamide)
PARTIE II
- 1Salvia divinorum (S. divinorum), ses préparations et dérivés, notamment :
- (1)Salvinorine A (ester méthylique de l’acide (2S,4aR,6aR,7R,9S,10aS,10bR)-9-(acétyloxy)-2-(3-furanyl)dodécahydro-6a,10b-diméthyl-4,10-dioxo-2Hnaphto[2,1-c]pyran-7-carboxylique)
- 2Catha edulis Forsk, ses préparations, dérivés, alcaloïdes et sels, notamment :
- (1)cathine (d-thréo-amino-2 hydroxy-1 phényl-1 propane)
- mais non compris :
- (2)cathinone (l-α-aminopropiophénone) et ses sels
| Article | Colonne 1 | Colonne 2 |
|---|---|---|
| Substance | Période | |
- DORS/97-228, art. 25
- DORS/2003-34, art. 4 et 5
- DORS/2012-65, art. 1
- DORS/2012-177, art. 1
- DORS/2013-172, art. 2
- DORS/2015-210, art. 4 à 6
- DORS/2016-72, art. 1
- DORS/2016-106, art. 2
- DORS/2016-239, art. 1
- DORS/2017-12, art. 3 et 4
- DORS/2017-250, art. 2
- DORS/2017-278, art. 1
- DORS/2018-69, art. 66
- DORS/2018-85, art. 4
- DORS/2019-171, art. 23
ANNEXE F
ANNEXE KRation quotidienne normale de diverses substances alimentaires
| Colonne I | Colonne II | ||
|---|---|---|---|
| Poste no | Nom et description | R.Q.N. | |
| 1 | Pâtes alimentaires, sèches  | 3,0 oz | 85 g |
| 2 | Bacon (de flanc), simili-produit de viande qui rappelle le bacon de flanc (cuit)  | 1,0 oz | 28 g |
| 3 | Base et mélanges aromatisés, pour boissons, pour ajouter au lait (prêts à servir)  | 16,0 oz liq | 454 ml |
| 4 | Pain, 5 tranches  | 5,3 oz | 150 g |
| 5 | Beurre  | 2,0 oz | 57 g |
| 6 | Lait de beurre  | 30,0 oz liq | 852 ml |
| 7 | Céréales, à déjeuner ou pour nourrissons  | 1,0 oz | 28 g |
| 8 | Céréales, soufflées  | 0,5 oz | 14 g |
| 9 | Fromage (autre que le fromage cottage)  | 2,0 oz | 57 g |
| 10 | Fromage cottage  | 3,5 oz | 100 g |
| 11 | Lait condensé  | 15,0 oz liq | 426 ml |
| 12 | Crème à fouetter  | 2,0 oz | 57 g |
| 13 | Oeuf, jaune d’oeuf substitué  | 3,5 oz | 100 g |
| 14 | Lait évaporé, lait écrémé évaporé, lait partiellement écrémé évaporé  | 30,0 oz liq | 852 ml |
| (reconstitué à son volume original) | |||
| 15 | Poisson, coquillages  | 3,5 oz | 100 g |
| 16 | Fruits secs  | 2,0 oz | 57 g |
| 17 | Fruits (sauf bananes, citrons, limes, melons d’eau)  | 3,5 oz | 100 g |
| 18 | Fruits, bananes  | 5,3 oz | 150 g |
| 19 | Fruits, citrons  | 1,8 oz | 50 g |
| 20 | Fruits, limes  | 1,8 oz | 50 g |
| 21 | Fruits, melons d’eau  | 7,0 oz | 200 g |
| 22 | Boissons aux fruits, nectars de fruits (prêts à servir)  | 4,0 oz liq | 114 ml |
| 23 | Bases, mélanges et concentrés pour boissons aux fruits (prêts à servir)  | 4,0 oz liq | 114 ml |
| 24 | Jus de fruit (sauf jus de citron et jus de lime)  | 4,0 oz liq | 114 ml |
| 25 | Jus de fruit, citron  | 1,0 oz liq | 28 ml |
| 26 | Jus de fruit, lime  | 1,0 oz liq | 28 ml |
| 27 | Crème glacée, lait glacé  | 3,5 oz | 100 g |
| 28 | Préparations pour nourrissons (prêtes à servir)  | Selon le mode d’emploi inscrit sur l’étiquette | |
| 29 | Déjeuner instantané, déjeuner prêt à servir  | Selon le mode d’emploi inscrit sur l’étiquette | |
| 30 | Margarine  | 2,0 oz | 57 g |
| 31 | Produits de viande  | 3,5 oz | 100 g |
| 32 | Allongeurs de produits de viande  | 3,5 oz | 100 g |
| 33 | Produits de viande avec allongeur  | 3,5 oz | 100 g |
| 34 | Lait entier  | 30,0 oz liq | 852 ml |
| 35 | Lait en poudre (reconstitué et prêt à servir)  | 30,0 oz liq | 852 ml |
| 36 | Lait (nom de l’arôme)  | 30,0 oz liq | 852 ml |
| 37 | Mélasse  | 1,5 oz | 43 g |
| 38 | Noix  | 1,0 oz | 28 g |
| 39 | Beurre d’arachide  | 1,0 oz | 28 g |
| 40 | Produits de volaille  | 3,5 oz | 100 g |
| 41 | Produits de volaille avec allongeur  | 3,5 oz | 100 g |
| 42 | Allongeurs de produits de volaille  | 3,5 oz | 100 g |
| 43 | Simili-produits de viande, sauf les simili-produits de viande qui rappellent le bacon de flanc  | 3,5 oz | 100 g |
| 44 | Simili-produits de volaille  | 3,5 oz | 100 g |
| 45 | Lait écrémé, lait partiellement écrémé  | 30,0 oz liq | 852 ml |
| 46 | Lait écrémé (nom de l’arôme), lait partiellement écrémé (nom de l’arôme)  | 30,0 oz liq | 852 ml |
| 47 | Lait écrémé en poudre, lait partiellement écrémé en poudre (reconstitués et prêts à servir)  | 30,0 oz liq | 852 ml |
| 48 | Lait écrémé additionné d’extrait sec du lait, lait partiellement écrémé additionné d’extrait sec du lait  | 30,0 oz liq | 852 ml |
| 49 | Lait écrémé additionné d’extrait sec du lait (nom de l’arôme), lait partiellement écrémé additionné d’extrait sec du lait (nom de l’arôme)  | 30,0 oz liq | 852 ml |
| 50 | Soupe (prête à servir)  | 7,0 oz liq | 200 ml |
| 51 | Lait stérilisé  | 30,0 oz liq | 852 ml |
| 52 | Jus de légumes  | 4,0 oz liq | 114 ml |
| 53 | Boissons aux légumes  | 4,0 oz liq | 114 ml |
| 54 | Concentrés, mélanges et bases pour boissons aux légumes (prêts à servir)  | 4,0 oz liq | 114 ml |
| 55 | Légumes (autres que fèves au four et pommes de terre cuites)  | 3,5 oz | 100 g |
| 56 | Légumes, fèves au four  | 8,5 oz | 250 g |
| 57 | Légumes, pommes de terre cuites  | 7,0 oz | 200 g |
| 58 | Levure  | 0,5 oz | 14 g |
| 59 | Yogourt, nature  | 5,0 oz | 150 g |
- DORS/78-64, art. 10
- DORS/84-300, art. 63(A)
APPENDICES I ET II[Abrogés, DORS/81-935, art. 2]
APPENDICE IIIFormules
Certificat d’exportation
| (En vertu de l’article 37 de la Loi sur les aliments et drogues) | ||
L’exportateur soussigné certifie par les présentes que (description de l’article) | ||
 | ||
emballé et étiqueté comme suit :  | ||
| et portant distinctement imprimé le mot « Exportation », | ||
| ||
| ||
| ||
Fait à  le le  20 . 20 . | ||
Canada : En ce qui a trait à un certificat d’exportation délivré en vertu de la Loi des aliments et drogues, En ce qui a trait à un certificat d’exportation délivré en vertu de la Loi des aliments et drogues, | ||
Province  | ||
| EN FOI DE QUOI : | Je, | |
de  de de  | ||
dans  de de  | ||
| déclare solennellement : | ||
| ||
ou | ||
que je suis  de de  | ||
 | ||
| l’« exportateur » délivrant le présent certificat et que je suis au courant des renseignements que j’y ai déclarés (si l’exportateur est une société commerciale, indiquer que le déclarant est l’agent de l’« exportateur »), | ||
| ||
| ||
| Et je fais la présente déclaration solennelle la croyant vraie et sachant qu’elle a la même valeur que si elle était faite sous serment et en vertu de la Loi sur la preuve au Canada. | ||
Déclaration faite en ma présence à | ||
le | ||
| ||
Commissaire à l’assermentation | ||
ANNEXE K.1(paragraphes B.01.350(1), B.01.351(1) et (5))
Symboles nutritionnels et modèles
Modèle horizontal unilingue
1(FH)  | 1(AH)  |
2(FH)  | 2(AH)  |
3(FH)  | 3(AH) 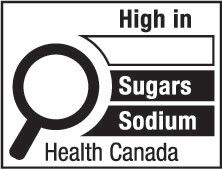 |
4(FH)  | 4(AH)  |
5(FH)  | 5(AH)  |
6(FH)  | 6(AH) 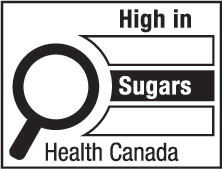 |
7(FH)  | 7(AH)  |
8(FH)  | 8(AH)  |
9(FH)  | 9(AH)  |
10(FH)  | 10(AH) 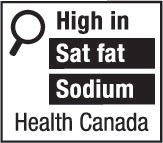 |
11(FH)  | 11(AH)  |
12(FH)  | 12(AH)  |
13(FH)  | 13(AH)  |
Modèle vertical unilingue
1(FV)  | 1(AV)  |
2(FV)  | 2(AV)  |
3(FV)  | 3(AV)  |
4(FV)  | 4(AV)  |
5(FV)  | 5(AV)  |
6(FV)  | 6(AV)  |
7(FV)  | 7(AV)  |
8(FV)  | 8(AV)  |
9(FV)  | 9(AV)  |
10(FV)  | 10(AV)  |
11(FV)  | 11(AV)  |
12(FV)  | 12(AV)  |
13(FV)  | 13(AV)  |
Modèle horizontal bilingue
1(HB)

2(HB)

3(HB)

4(HB)

5(HB)

6(HB)

7(HB)

8(HB)

9(HB)

10(HB)

11(HB)

12(HB)

13(HB)

Modèle vertical bilingue
1(VB)

2(VB)

3(VB)

4(VB)

5(VB)

6(VB)

7(VB)

8(VB)

9(VB)

10(VB)

11(VB)

12(VB)

13(VB)

ANNEXE K.2(paragraphes B.29.021(1), (2) et (8))
Modèles — identifiant des aliments supplémentés avec mise en garde
Modèle standard unilingue
FS  | AS  |
Modèle standard bilingue
SB

Modèle compact bilingue
CB

ANNEXE L
ANNEXE M
DISPOSITIONS CONNEXES
MODIFICATIONS NON EN VIGUEUR
— DORS/2024-110, art. 76
76 Le Règlement sur les aliments et droguesNote de bas de page 1 est modifié par adjonction, après l’article A.01.068, de ce qui suit :
Retour à la référence de la note de bas de page 1C.R.C., ch. 870
Non-application
A.01.069 Le présent règlement ne s’applique pas à une drogue visée aux alinéas b) ou c) de la définition de biocide au paragraphe 1(1) du Règlement sur les biocides.
— DORS/2024-110, art. 77
77 L’alinéa C.01.004.02(6)c) du même règlement est abrogé.
— DORS/2024-110, art. 78
78 Les alinéas C.01.014.1(2)c) et d) du même règlement sont remplacés par ce qui suit :
c) la voie d’administration recommandée;
— DORS/2024-110, art. 79
79 Le paragraphe C.01.040.2(5) du même règlement est abrogé.
— DORS/2024-110, art. 80
80 La définition de agent antimicrobien, au paragraphe C.01A.001(1) du même règlement, est abrogée.
— DORS/2024-110, art. 81
81 L’alinéa C.01A.002(1)e) du même règlement est abrogé.
— DORS/2024-110, art. 82
82 L’article C.02.002.1 du même règlement est abrogé.
— DORS/2024-136, art. 1
1 L’article C.01.051 du Règlement sur les aliments et droguesNote de bas de page 1 et l’intertitre le précédant sont remplacés par ce qui suit :
Retour à la référence de la note de bas de page 1C.R.C., ch. 870
Rapports sur les rappels
C.01.051 (1) Lorsque le fabricant qui vend une drogue sous forme posologique ou un ingrédient actif ou la personne qui importe et vend au Canada une telle drogue ou un tel ingrédient décide d’en faire le rappel sans que le ministre le lui ait ordonné, il fournit par écrit au ministre les renseignements ci-après dans les vingt-quatre heures après avoir pris la décision de faire le rappel :
a) le nom propre de la drogue ou, à défaut, son nom usuel;
b) une mention indiquant s’il s’agit d’une drogue sous forme posologique ou d’un ingrédient actif;
c) dans le cas d’une drogue sous forme posologique :
(i) la marque nominative,
(ii) l’identification numérique attribuée en application du paragraphe C.01.014.2(1),
(iii) la forme posologique,
(iv) la concentration,
(v) le nom des personnes au Canada à qui le fabricant ou l’importateur a vendu la drogue, autres que les consommateurs qui l’ont achetée au détail, ainsi que la quantité de la drogue qu’il a vendue à chacune d’elles,
(vi) une évaluation des effets que le rappel pourrait avoir sur la capacité du fabricant ou de l’importateur de répondre à la demande pour la drogue au Canada;
d) les numéros de lot de la drogue;
e) les dates de manufacture de la drogue;
f) les dates limites d’utilisation de la drogue;
g) la quantité de la drogue qui a été manufacturée au Canada;
h) la quantité de la drogue qui a été importée;
i) la quantité de la drogue que le fabricant ou l’importateur a vendue à des personnes au Canada et la période durant laquelle il la leur a vendue;
j) la quantité de la drogue que le fabricant ou l’importateur a exportée ainsi que la répartition, par pays, de cette quantité;
k) la quantité de la drogue se trouvant au Canada que le fabricant ou l’importateur a en sa possession ou dont il a charge;
l) une évaluation du risque de préjudice à la santé humaine que la drogue présente, notamment en raison de tout manque d’efficacité de celle-ci;
m) les nom et adresse municipale du fabricant, du manufacturier et de tout importateur de la drogue;
n) les nom et coordonnées de l’individu responsable du rappel;
o) les dates prévues du lancement et de la fin du rappel;
p) les motifs du rappel ainsi que la date à laquelle la situation à l’origine du rappel a été décelée et la façon dont elle l’a été.
(2) Le fabricant ou l’importateur fournit au ministre :
a) avant de lancer le rappel, une copie de tout communiqué qu’il entend utiliser relativement au lancement du rappel;
b) après avoir lancé le rappel, sur demande et dans le délai précisé par le ministre, une copie de tout communiqué additionnel qu’il utilise ou qu’il entend utiliser relativement au rappel.
(3) Le fabricant ou l’importateur fournit au ministre, par écrit, les renseignements ci-après dans les soixante-douze heures après avoir pris la décision de faire le rappel :
a) le plan d’action à suivre pour faire le rappel, notamment les modalités — de temps ou autres — selon lesquelles le ministre sera informé du déroulement du rappel;
b) la description des mesures projetées pour éviter que la situation à l’origine du rappel ne se reproduise.
(4) Le fabricant ou l’importateur fournit au ministre, par écrit, les renseignements ci-après dans les trente jours suivant la fin du rappel :
a) les résultats du rappel;
b) la description des mesures qui ont été prises ou qui le seront pour éviter que la situation à l’origine du rappel ne se reproduise.
(5) Au présent article et à l’article C.01.051.1, ingrédient actif et manufacturer s’entendent au sens du paragraphe C.01A.001(1).
C.01.051.1 (1) La personne à qui le ministre ordonne de faire le rappel en vertu de l’article 21.3 de la Loi d’une drogue sous forme posologique ou d’un ingrédient actif lui fournit les renseignements ci-après selon les modalités — de temps ou autres — qu’il précise :
a) la quantité de la drogue qu’elle a vendue au détail à des consommateurs au Canada;
b) dans le cas où elle a vendu la drogue à des personnes au Canada autres que les consommateurs visés à l’alinéa a) :
(i) le nom de ces personnes et la quantité qu’elle a vendue à chacune d’elles,
(ii) la période durant laquelle elle la leur a vendue;
c) la quantité de la drogue qu’elle a exportée du Canada ainsi que la répartition, par pays, de cette quantité;
d) la quantité de la drogue se trouvant au Canada qu’elle a en sa possession ou dont elle a la charge;
e) les nom, titre et coordonnées d’un individu à qui le ministre peut s’adresser pour obtenir des renseignements supplémentaires au sujet du rappel;
f) le plan d’action à suivre pour faire le rappel;
g) tout autre renseignement que le ministre a des motifs raisonnables de croire nécessaire pour atténuer le risque de préjudice à la santé humaine;
h) dans le cas où la personne est en mesure d’éviter que la situation à l’origine du rappel ne se reproduise, la description des mesures qu’elle entend prendre à cet effet.
(2) Elle avise sans délai le ministre de tout changement des renseignements visés à l’alinéa (1)e).
(3) Elle fournit au ministre :
a) avant de lancer le rappel, une copie de tout communiqué qu’elle entend utiliser relativement au lancement du rappel;
b) après avoir lancé le rappel, sur demande et dans le délai précisé par le ministre, une copie de tout communiqué additionnel qu’elle utilise ou qu’elle entend utiliser relativement au rappel.
(4) Elle notifie au ministre, par écrit, dans les vingt-quatre heures, le lancement du rappel ainsi que la fin de ce dernier.
(5) Elle fournit au ministre, par écrit, les renseignements ci-après dans les trente jours suivant la fin du rappel :
a) les résultats du rappel;
b) dans le cas où la personne est en mesure d’éviter que la situation à l’origine du rappel ne se reproduise, la description des mesures qu’elle a prises ou qu’elle prendra à cet effet.
— DORS/2024-136, art. 3
3 L’alinéa C.02.012(1)a) de la version française du même règlement est remplacé par ce qui suit :
a) un système de contrôle qui permet le rappel rapide et complet de tout lot ou tout lot de fabrication de la drogue se trouvant sur le marché;
— DORS/2024-136, art. 5
5 (1) Le paragraphe C.02.022(1) de la version française du même règlement est remplacé par ce qui suit :
C.02.022 (1) Le grossiste, le distributeur visé à l’article C.01A.003 et l’importateur d’une drogue sous forme posologique conservent les dossiers sur la vente de chaque lot ou lot de fabrication de la drogue pendant un an après sa date limite d’utilisation afin de pouvoir en faire le rappel, à moins que la licence d’établissement de l’intéressé ne prévoie une autre période.
(2) Le passage du paragraphe C.02.022(2) de la version française du même règlement précédant l’alinéa a) est remplacé par ce qui suit :
(2) Le distributeur d’un ingrédient actif visé à l’alinéa C.01A.003a) et le grossiste et l’importateur d’un ingrédient actif conservent les dossiers sur la vente de chaque lot ou lot de fabrication de l’ingrédient actif pendant celle des périodes ci-après qui s’applique afin de pouvoir en faire le rappel, à moins que l’intéressé ne détienne une licence d’établissement qui prévoit une autre période :
- Date de modification :